能源短缺和温室效应是当今人类面临的难题,新能源的开发和地球环境的保护是人类共同的目标.为达到节能减排的目的,下列能源中最
 yangjie16882022-10-04 11:39:541条回答
yangjie16882022-10-04 11:39:541条回答A.天然气
B.煤炭
C.氢气
D.汽油

已提交,审核后显示!提交回复
共1条回复
 zh642217 共回答了28个问题
zh642217 共回答了28个问题 |采纳率85.7%- 解题思路:煤、石油、天然气在燃烧过程中都会产生造成温室效应的二氧化碳和污染空气的一氧化碳、氮硫氧化物以及烟尘等,而氢气燃烧只生成水,对环境没有任何污染
氢气燃烧的产物只有水,水不污染环境.煤、石油、天然气在燃烧过程中会产生一氧化碳、二氧化硫、可吸入颗粒物等物质,这些物质能够污染环境.
故选C.点评:
本题考点: 氢气的用途和氢能的优缺点.
考点点评: 氢气作为能源有三大优点:原料来源广、燃烧热值高、生成物没有污染,因此是一种最理想的能源. - 1年前
相关推荐
- 能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)⇌CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H2
①上述反应符合“原子经济”原则的是______(填“Ⅰ”或“Ⅱ”);
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K).
由表中数据判断△H1______0(填“>”“=”或“<”);温度 250℃ 300℃ 350℃ K 2.041 0.270 0.012
③某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.2mol•L-1,则CO的转化率为______.
(2)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,通过反应Ⅰ进行甲醇合成,T4℃下此反应的平衡常数为160.此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小:v正______v逆 (填“>”、“<”或“=”).物质 H2 CO CH3OH 浓度/(mol•L-1) 0.2 0.1 0.4
②若加入CO、H2后,在T5℃反应10min达到平衡,c(H2)=0.4mol•L-1,则该时间内反应速率v(CH3OH)=______mol•(L•min)-1. zhuye1871年前1
zhuye1871年前1 -
 耘之妖 共回答了27个问题
耘之妖 共回答了27个问题 |采纳率81.5%解题思路:(Ⅰ)①“原子经济”是指在化学品合成过程中,所用的所有原材料尽可能多的转化到最终产物中;
②依据平衡常数随温度变化分析温度对平衡移动的影响,据此判断;
③利用三段式计算各自组分物质的量变化量、平衡时的物质的量,依据转化率概念计算CO的转化率;根据浓度计算出平衡常数,再判断温度;
(Ⅱ)①计算此时的浓度商Qc,与平衡常数比较,判断反应进行的方向,据此解答;
②依据图表数据计算起始量,结合三段式列式计算,根据甲氢气的浓度变化计算甲醇的浓度变化量,再根据v=[△c/△t]计算v(CH3OH);(Ⅰ)①“原子经济”是指在化学品合成过程中,所用的所有原材料尽可能多的转化到最终产物中,分析反应可知,反应Ⅰ符合“原子经济”,
故答案为:Ⅰ;
②由表数据可知,温度升高,平衡常数减小,说明平衡逆向进行,逆向是吸热反应,正向放热反应,即△H1<0,
故答案为:<;
③按反应Ⅰ充分反应达到平衡后,测得c(CO)=0.2mol/L,物质的量为0.4mol;
CO (g)+2H2 (g)⇌CH3OH (g)
起始量(mol) 2 6 0
变化量(mol) 1.6 3.2 1.6
平衡量(mol) 0.4 2.8 1.6
CO的转化率=[1.6mol/2mol]×100%=80%,
此故答案为:80%;
(Ⅱ)①由表中数据可知,10min时氢气的浓度为0.2mol/L、CO的浓度为0.1mol/L、甲醇的浓度为0.4mol/L,则此时的浓度商Qc=[0.4
0.22×0.1=100,小于平衡常数160,故反应向正反应方向进行,故V正>V逆,故答案为:>;
②依据图表计算起始量;
2H2(g)+CO(g)⇌CH3OH(g)
起始量(mol/L) 1 0.5 0
变化量(mol/L) 0.80.4 0.4
T4时(mol/L) 0.2 0.1 0.4
若加入CO、H2后,在T5℃反应10min达到平衡,c(H2)=0.4mol•L-1,由表中数据可知,l0min内氢气的浓度变化量为0.6mol/L,故甲醇的浓度变化量为0.3mol/L,故v(CH3OH)=
0.3mol/L/10min]=0.03mol/(L•min),
故答案为:0.03;点评:
本题考点: 反应热和焓变;反应速率的定量表示方法;化学平衡建立的过程.
考点点评: 本题考查了化学平衡的有关计算、化学平衡常数及应用等,难度不大,注意掌握平衡常数应用.1年前查看全部
- 英语翻译近年来,随着石油储量的日益减少,全世界正面临着能源短缺的危机,开发新的能源产品替代石油已迫在眉睫.生物柴油是一种
英语翻译
近年来,随着石油储量的日益减少,全世界正面临着能源短缺的危机,开发新的能源产品替代石油已迫在眉睫.生物柴油是一种重要的可再生液体燃料,对解决石油燃料的供给不足及其燃烧所带来的环境问题都有重要的意义.生物柴油作为内燃机代用燃料,以其优异的环保性和可再生性受到世界各国的重视,其市场前景非常广阔. 可能也许那么1年前3
可能也许那么1年前3 -
 天才猪猪 共回答了22个问题
天才猪猪 共回答了22个问题 |采纳率90.9%In recent years,with oil reserves dwindling day by day ,the world is facing energy shortage crisis.Therefore,the development of new alternative energy to replace oil is imminent.Biodiesel is an important renewable liquid fuel which can solve the problems caused by the inadequate supply of petroleum fuels and the environmental problems caused by the burning of them.Biodiesel ,as alternative fuel of the internal combustion engine,has received more and more world attention for being eco-friendly and renewable.It's future market prospects
are very bright.1年前查看全部
- (2013•汕尾二模)能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
 (2013•汕尾二模)能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(2013•汕尾二模)能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)⇌CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H2
①上述反应符合“原子经济”原则的是______(填“I”或“Ⅱ”).
②下表所列数据是反应I在不同温度下的化学平衡常数(K).
由表中数据判断△H1______0 (填“>”、“=”或“<”).温度 250℃ 300℃ 350℃ K 2.041 0.270 0.012
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为______,此时的温度为______(从上表中选择).
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:______
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.
①该电池正极的电极反应为______.
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为______. happydoor591年前1
happydoor591年前1 -
 SYLBEE 共回答了22个问题
SYLBEE 共回答了22个问题 |采纳率81.8%解题思路:(1)①原子经济性原则指的是原子利用率高的反应;②对于放热反应,温度越高则平衡常数越小;③根据化学方程式计算平衡转化率和化学平衡常数进而确定反应的温度;(2)根据盖斯定律来计算化学反应的焓变,书写热化学方程式;(3)极是氧气发生得电子的还原反应,总反应是燃料燃烧的反应.(1)①原子经济性原则指的是原子利用率高的反应,Ⅰ是化合反应,原子利用率高达100%,故答案为:Ⅰ;
②根据表中数据可以看出,温度越高则平衡常数越小,可以确定该反应是放热反应,故答案为:<;
③设一氧化碳的变化量为x,则
CO(g)+2H2(g)⇌CH3OH(g)
初始浓度(mol/L)1 3 0
变化浓度(mol/L)0.81.6 0.8
平衡浓度(mol/L)0.22.4 0.8
则CO的转化率=[0.8/1]×100%=80%,平衡常数K=
[CH3OH]
[CO][H2]2=[0.8
0.2×2.42=2.041,所以该反应的温度为250℃,
故答案为:80%;250℃;
(2)甲醇不完全燃烧生成一氧化碳和液态水的反应CH3OH(l)+O2(g)=CO(g)+2H2O(l)和反应①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol,②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol,③H2O(g)=H2O(l)
△H=-44.0kJ/mol之间的关系为:①×
1/2]-②×[1/2]+2×③=-442.8 kJ∕mol,
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ∕mol;
(3)①在燃料电池中,正极是氧气发生得电子的还原反应,即O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
②工作一段时间后,测得溶液的pH减小,说明氢氧根离子被消耗,在在燃料电池中,总反应是燃料燃烧的反应,
故答案为:2CH3OH+3O2+4OH-=2CO32-+6H2O.点评:
本题考点: 化学平衡常数的含义;用盖斯定律进行有关反应热的计算;化学电源新型电池;化学平衡的计算.
考点点评: 本题是一道涉及电化学、热化学、化学平衡知识的综合题目,考查角度广,难度大.1年前查看全部
- 能源是当今世界日益关注的热点之一。由于矿物能源的过度开发和消耗,导致全球性的能源短缺和环境污染。
能源是当今世界日益关注的热点之一。由于矿物能源的过度开发和消耗,导致全球性的能源短缺和环境污染。
(1)煤、石油、天然气等化石燃料日益枯竭,因此开发新能源显得尤为重要。请例举出两种已经开发的新能源________、_________。
(2)原煤中含有硫元素,原煤燃烧产生的二氧化硫进入大气后,与水反应生成亚硫酸(H 2 SO 3 ),亚硫酸又被空气中的氧气氧化成硫酸,形成酸雨。请写出亚硫酸转化为硫酸的化学方程式:_____________,该反应的基本类型为______(选填“化合”、“分解”、“置换”或“复分解”)反应。
(3)酸雨对人类生活环境危害极大,请举一例:___________________。工厂尾气中的二氧化硫可用氢氧化钙吸收消除,其化学反应原理类似于氢氧化钙与二氧化碳的反应,写出用氢氧化钙吸收SO 2 的化学方程式:_______________。
(4)我国首次使用二甲醚(化学式C 2 H 6 O)为燃料的城市客车问世,有效的解决公交车冒黑烟的问题。驱动汽车的是二甲醚燃烧产生的________能转化成的电能。二甲醚在空气中完全燃烧生成的两种产物在空气中都存在,请写出其中一种产物的化学式:__________。 把你宠坏20001年前1
把你宠坏20001年前1 -
 hao_990 共回答了17个问题
hao_990 共回答了17个问题 |采纳率94.1%(1)太阳能、氢能(或电能或风能或其它合理答案均可)
(2)2H 2 SO 3 +O 2 ==2H 2 SO 4 ;化合
(3)酸雨会使土壤酸化,破坏农作物和森林的生长(或其它合理答案均可);Ca(OH) 2 +SO 2 ==CaSO 3 +H 2 O
(4)化学能;H 2 O(或CO 2 )1年前查看全部
- 能源短缺是人类面临的重大问题.甲醇是一种可再生资源,具有广泛的开发和应用前景,因此甲醇被称为21世纪的新型材料.工业上用
能源短缺是人类面临的重大问题.甲醇是一种可再生资源,具有广泛的开发和应用前景,因此甲醇被称为21世纪的新型材料.工业上用CO生产甲醇,一定条件下发生反应;CO(g)+2H2(g)⇌CH3OH(g).图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图.请回答下列问题:
(1)在“图1”中,曲线______(填“a”或“b”)表示使用了催化剂;该反应属于______(填“吸热”或“放热”)反应.
(2)根据“图2”判断,下列说法不正确的是______
A.起始充入的CO为1mol
B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达到平衡状态
D.保持温度和密闭容器容积不变,再充入1mol CO和2mol H2,在再次达到平衡时
会增大n(CH3)OH n(CO)
(3)从反应开始到建立平衡,v(H2)=______;该温度下CO(g)+2H2(g)⇌CH3OH(g)的化学平衡常数为______,若保持其它条件不变,将反应体系升温,则该反应的化学平衡常数将______(填“增大”、“减小”或“不变”).
(4)请在“图3”中画出平衡时甲醇蒸气百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1>P2,).
(5)科学家常用______(填仪器名称)来直接测定某一反应的反应热,现测得:CH3OH(g)+[3/2]O2=CO2(g)+2H2O(g)△H=-192.9KJ/mol,又知H2O(l)=H2O(g)△=44KJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式CH3OH(l)+[3/2]O2(g)=CO2(g)+2H2O(l)△H=-280.9kJ/molCH3OH(l)+[3/2]O2(g)=CO2(g)+2H2O(l)△H=-280.9kJ/mol.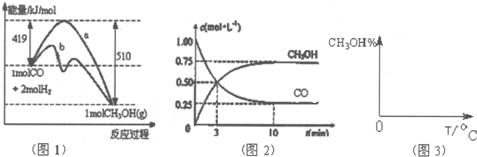
 再想一个1年前1
再想一个1年前1 -
 shaomai919 共回答了23个问题
shaomai919 共回答了23个问题 |采纳率91.3%解题思路:(1)根据活化能的大小判断;根据反应物与生成物的总能量判断;
(2)反应方程式为CO(g)+2H2(g)⇌CH3OH(g),根据方程式结合图象进行判断;
(3)计算出CO的反应速率,结合方程式可计算氢气的反应速率,计算出平衡时各物质的浓度,可计算出平衡常数;正反应放热,升高温度平衡常数减小;
(4)根据压强对平衡移动的影响判断;
(5)32g的CH3OH的物质的量为1mol,结合盖斯定律计算.(1)加入催化剂,可降低反应的活化能,由图象可知b活化能较低,应加入催化剂,反应物的总能量大于生成物的总能量,则反应为放热反应,故答案为:b;放热;
(2)A.CO的起始浓度为1moL/L,体积为2L,则起始充入的CO为2mol,故A错误;
B.增加CO浓度,CO的转化率减小,故B错误;
C.由于反应前后气体的体积不等,则容器中压强恒定时,反应已达到平衡状态,故C正确;
D.保持温度和密闭容器容积不变,再充入1mol CO和2mol H2,相当于在原来的基础上缩小体积,压强增大,平衡向正反应方向移动,则平衡时
n(CH3)OH
n(CO)会增大,故D正确.
故答案为:AB;
(3)从反应开始到建立平衡,v(CO)=[1mol/L−0.25mol/L/10min]=0.075moL/(L•min),
则v(H2)=2v(CO)=0.15moL/(L•min),
平衡时:c(CO)=0.25mol/L,c(CH3OH)=0.75mol/L,
则消耗n(CO)=0.75mol/L×2L=1.5mol,消耗的n(H2)=3mol,
平衡时c(H2)=[4mol−3mol/2L]=0.5mol/L,
k=[0.75
0.25×0.52=12,
正反应放热,升高温度平衡常数减小,
故答案为:0.15moL/(L•min);12;减小;
(4)增大压强,平衡向正反应方向移动,则甲醇的百分含量增大,温度升高,平衡向逆反应方向移动,甲醇的百分含量降低,则图象可为 ,
,
故答案为: ;
;
(5)科学家常用量热计来直接测定某一反应的反应热,
已知①CH3OH(g)+
3/2]O2=CO2(g)+2H2O(g)△H=-192.9KJ/mol,②H2O(l)=H2O(g)△=44KJ/mol,
利用盖斯定律将①-②×2可得CH3OH(g)+[3/2]O2(g)=CO2(g)+2H2O(l)
△H=(-192.9kJ/mol)-44KJ/mol×2=-280.9kJ/mol,
故答案为:量热计;CH3OH(g)+[3/2]O2(g)=CO2(g)+2H2O(l)△H=-280.9kJ/mol.点评:
本题考点: 化学平衡的计算;热化学方程式;化学平衡建立的过程;化学平衡的调控作用.
考点点评: 本题考查较为综合,涉及化学平衡的计算、化学平衡的移动以及影响因素、化学反应与能量变化等问题,题目难度中等,注意盖斯定律的运用以及化学平衡常数的意义.1年前查看全部
- 能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上合成甲醇的反应为:CO(g)+2
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上合成甲醇的反应为:CO(g)+2H2(g)⇌CH3OH(g);△H
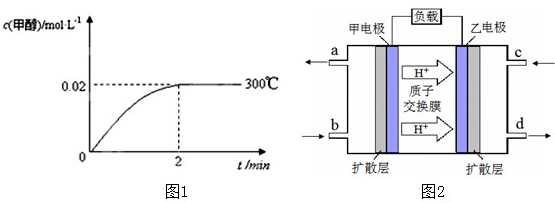
(1)已知,该反应在300℃,5MPa条件下能自发进行,则△H______0,△S______0 (填“<,>或=”).
(2)在300℃,5MPa条件下,将0.20mol的 CO与0.58mol H2的混合气体充入2L密闭容器发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图1所示.
①在0~2min内,以H2表示的平均反应速率为______mol•L-1•s-1.
②列式计算300℃时该反应的平衡常数K=______.
③300℃时,将0.50mol CO、1.00mol H2和1.00mol CH3OH充入容积为2L的密闭容器中,此时反应将______.
A.向正方向移动B.向逆方向移动C.处于平衡状态D.无法判断
④下列措施可增加甲醇产率的是______
A.压缩容器体积B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入0.20mol CO和0.58mol H2
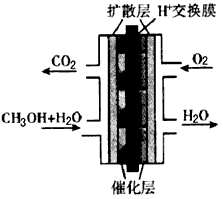
(3)甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:CH3OH(l)+[3/2]O2(g)═CO2(g)+2H2O(l).其工作原理示意图如图2:
在上图的横线上标出a、b、c、d四个出入口通入或排出的物质名称(或化学式)负极的电极反应式为______. kangleier1年前1
kangleier1年前1 -
 等黄昏看夕阳 共回答了23个问题
等黄昏看夕阳 共回答了23个问题 |采纳率78.3%解题思路:(1)当△H-T△S<0时,反应自发进行,结合方程式分析即可;
(2)①据图分析出△c和△t即可求出;
②利用三段式法解答;
③据该温度下的K和Qc比较,当K>Qc时平衡正向移动,K<Qc时平衡逆向移动;
④结合影响平衡移动的因素,使平衡正向移动即可;
(3)甲醇-空气燃料电池是甲醇和氧气反应的氧化还原反应,甲醇在反应中失去电子发生氧化反应在原电池中做负极,反应生成二氧化碳,氧气再正极上得到电子生成氢氧根离子,依据质子交换最终生成水;电极反应依据电池反应和正极电极反应计算得到.(1)该反应的反应物有3mol气体,生成物有1mol气体,所以△S<0,反应自发进行△H-T△S<0,故△H必须小于0,故答案为:<;<;
(2)①2min时,甲醇浓度变化0.02mol/L,则氢气浓度变化为0.04mol/L,v(H2)=[△c/△t]=[0.04mol/L/2min]=0.02mol/(L•min)-1
故答案为:0.02;
②CO(g)+2H2(g)⇌CH3OH(g)
加入的(mol/L) 0.10 0.29 0
反应的(mol/L) 0.02 0.04 0.02
平衡后(mol/L)0.08 0.25 0.02
K=
c(CH3OH)
c(CO)•c2(H2)=
0.02
0.08×0.252(mol/L)-2=4(mol/L)-2
故答案为:K=4(mol/L)-2;
③Qc=K=
c(CH3OH)
c(CO)•c2(H2)=
0.50
0.25×0.502=8>K=4,所以平衡逆向移动,选B,
故答案为:B;
④A、对于反应CO(g)+2H2(g)⇌CH3OH(g),反应物气体体积大于生成物,压缩容器体积时,压强增大,平衡正向移动,可增加甲醇产率,A正确;
B、分离出甲醇,平衡正向移动可增加甲醇产率,故B正确;
C、充入He,不影响各气体的分压,平衡不移动,不能增加甲醇产率,故C错误;
D、体积不变,再充入反应物气体,平衡正向移动,可增加甲醇产率,故D正确.
故选:ABD;
(3)①甲醇-空气燃料电池是甲醇和氧气反应的氧化还原反应,甲醇在反应中失去电子发生氧化反应在原电池中做负极,反应生成二氧化碳,氧气再正极上得到电子生成氢氧根离子,依据质子交换最终生成水;所以a放出CO2;b通入甲醇水溶液;c通入O2;d流出水;标注如图: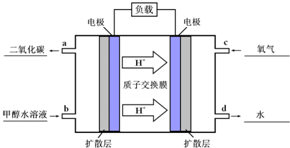 ,
,
电池反应为:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);
电池正极反应为:O2+4H++4e-=2H2O;
电池反应-正极反应×3得到负极电极反应为:CH3OH(l)+H2O(l)-6e-=CO2(g)+6H+;
故答案为: ;CH3OH(l)+H2O(l)-6e-=CO2(g)+6H+.
;CH3OH(l)+H2O(l)-6e-=CO2(g)+6H+.点评:
本题考点: 反应热和焓变;化学电源新型电池;化学平衡常数的含义;化学平衡的影响因素;化学平衡的调控作用.
考点点评: 本题考查了化学反应的反应热的计算、原电池的产物判断和电极判断,电极反应,盖斯定律的计算应用,理解概念是关键,原电池原理是常考重点,题目难度中等.1年前查看全部
- 已经投入使用,可以缓解东部地区能源短缺的重要工程项目是( )
已经投入使用,可以缓解东部地区能源短缺的重要工程项目是( )
A.西气东输
B.北煤南运
C.南水北调
D.青藏铁路 都市稗子1年前1
都市稗子1年前1 -
 ss00mm 共回答了18个问题
ss00mm 共回答了18个问题 |采纳率88.9%解题思路:西气东输工程是我国距离最长、口径最大的输气管道,西起塔里木盆地的轮南,东至上海.全线采用自动化控制,供气范围覆盖中原、华东、长江三角洲地区.西气东输对于调整我国能源结构、促进环境状况改善具有重大意义.能缓解我国东部地区能源紧缺,又能对东部环境有所改善的工程是西气东输.根据题意.
故选:A.点评:
本题考点: 跨世纪的四大工程.
考点点评: 该题考查西气东输工程的意义,理解解答即可.1年前查看全部
- 能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g)+2H 2 (g) CH 3 OH(g) ΔH1
CH 3 OH(g) ΔH1
反应II:CO 2 (g)+3H 2 (g) CH 3 OH(g) + H 2 O(g) ΔH2
CH 3 OH(g) + H 2 O(g) ΔH2
①下表所列数据是反应I在不同温度下的化学平衡常数(K)。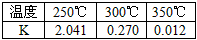
由表中数据判断ΔH1______0 (填“>”、“=”或“<”)。
②某温度下,将2 mol CO和6 mol H 2 充入2L的密闭容器中,5min后该反应达到平衡,测得c(CO)=0.2
mol/L,则用H 2 表示的该反应的反应速率为:________,此时的温度为________(从上表中选择)。
(2)已知在常温常压下:
① 2CH 3 OH(l) + 3O 2 (g) =2CO 2 (g) + 4H 2 O(g) ΔH =-1275.6 kJ/mol
② 2CO (g)+ O 2 (g) =2CO 2 (g) ΔH =-566.0 kJ/mol
③ H 2 O(g) =H 2 O(l) ΔH =-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:______________________
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。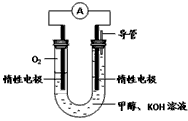
①该电池正极的电极反应为__________________。
②用该电池电解200mL饱和食盐水(溶质足量),一段时间后,阴极得标况下气体2.24L,电解后溶液的pH为________(溶液体积变化忽略不计),要使电解后溶液复原,所加物质为___________(填名称)。 wxf1171年前1
wxf1171年前1 -
 village1st 共回答了16个问题
village1st 共回答了16个问题 |采纳率87.5%(1)①<;②0.32mol·L -1 ·min -1 ;250℃
(2)CH 3 OH(l)+O 2 (g)=CO(g)+2H 2 O(l) ΔH=-442.8 kJ∕mol
(3)①O 2 + 2H 2 O + 4e - ==4OH - ;②14;氯化氢1年前查看全部
- 能源短缺和温室效应是当今人类面临的难题,新能源的开发和地球环境的保护是人类共同的目标。为达到节能减排的目的,下列能源中最
能源短缺和温室效应是当今人类面临的难题,新能源的开发和地球环境的保护是人类共同的目标。为达到节能减排的目的,下列能源中最理想的是
A.天然气 B.煤炭 C.氢气 D.汽油  口圭口牙1年前1
口圭口牙1年前1 -
 bdmklcl 共回答了24个问题
bdmklcl 共回答了24个问题 |采纳率87.5%C
考点:
专题:氧气、氢气的性质与用途.
分析:煤、石油、天然气在燃烧过程中都会产生造成温室效应的二氧化碳和污染空气的一氧化碳、氮硫氧化物以及烟尘等,而氢气燃烧只生成水,对环境没有任何污染
氢气燃烧的产物只有水,水不污染环境.煤、石油、天然气在燃烧过程中会产生一氧化碳、二氧化硫、可吸入颗粒物等物质,这些物质能够污染环境.
故选C.1年前查看全部
- 随着世界各国对环境保护、能源短缺及节能等问题的日益关注,可再生能源越来越被重视.风力发电作为一种清
随着世界各国对环境保护、能源短缺及节能等问题的日益关注,可再生能源越来越被重视.风力发电作为一种清
如何翻译成英文?急、、、、、 xiaopp00461年前1
xiaopp00461年前1 -
 Lancer11 共回答了19个问题
Lancer11 共回答了19个问题 |采纳率89.5%along with the world focus on issues such as protect environment、energy shortage and save energy ,the renewable resources is increasingly attention.1年前查看全部
- 能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
 能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)以甲醇、氧气为原料,KOH溶液作为电解质构成燃料电池总反应为:2CH3OH+3O2+4KOH=2K2CO3+6H2O,负极的电极反应式为______,随着反应的不断进行溶液的pH______(填“增大”“减小”或“不变”).
(2)如果以该燃料电池为电源,石墨作两极电解饱和食盐水,
阳极产物的检验方法:______,电解池总反应的离子方程式为2Cl-+2H2O
Cl2↑+H2↑+2OH-电解 .2Cl-+2H2O.
Cl2↑+H2↑+2OH-电解 . beside751年前1
beside751年前1 -
 kk1225 共回答了14个问题
kk1225 共回答了14个问题 |采纳率78.6%解题思路:(1)原电池中负极上燃料失电子,碱性条件下,CH3OH反应生成碳酸根离子;根据电极反应判断氢氧根离子浓度的变化;
(2)阳极上氯离子放电生成氯气,氯气可以用湿润的淀粉碘化钾试纸检验;根据阴阳两极的反应来书写总反应.(1)原电池放电时,甲醇失电子被氧化,应为电池负极反应,其电极反应式为:2CH3OH+3O2+4OH-=2CO32-+6H2O;已知电池总反应为:2CH3OH+3O2+4KOH=2K2CO3+6H2O,电池在放电过程中消耗氢氧根离子,所以溶液的pH减小;
故答案为:CH3OH+8OH--6e-=CO32-+6H2O;减小;
(2)阴极上氢离子放电生成氢气,阳极上氯离子放电生成氯气,氯气可以用湿润的淀粉碘化钾试纸检验,如果湿润的淀粉碘化钾试纸变蓝色,则证明有氯气生成,所以电池反应式为2Cl-+2H2O
电解
.
Cl2↑+H2↑+2OH-;
故答案为:将湿润的KI淀粉试纸放在气体出口,若观察到试纸变蓝,证明有Cl2产生;2Cl-+2H2O
电解
.
Cl2↑+H2↑+2OH-.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了燃料电池、电解原理的应用,侧重于考查学生书对电极方程式的书写的掌握情况,题目难度中等,注意电解质溶液的酸碱性对电极方程式的影响.1年前查看全部
- (2013•呼伦贝尔)既能缓解我国东部地区能源短缺问题,又能对东部环境有所改善的工程是( )
(2013•呼伦贝尔)既能缓解我国东部地区能源短缺问题,又能对东部环境有所改善的工程是( )
A.南水北调
B.青藏铁路
C.西气东输
D.北煤南运 D2361年前1
D2361年前1 -
 小爱1015 共回答了15个问题
小爱1015 共回答了15个问题 |采纳率80%解题思路:西气东输工程是我国距离最长、口径最大的输气管道,西起塔里木盆地的轮南,东至上海.全线采用自动化控制,供气范围覆盖中原、华东、长江三角洲地区.西气东输对于调整我国能源结构、促进环境状况改善具有重大意义.能缓解我国东部地区能源紧缺,又能对东部环境有所改善的工程是西气东输.
故选:C.点评:
本题考点: 跨世纪的四大工程.
考点点评: 本题考查西气东输工程的意义,理解解答即可.1年前查看全部
- (2011•临川区模拟)能源短缺是人类面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(2011•临川区模拟)能源短缺是人类面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H1
反应Ⅱ:CO(g)+2H2(g)⇌CH3OH(g)△H2
①上述反应符合“原子经济”原则的是______(填“Ⅰ”或“Ⅱ”),
②下表所列数据是反应Ⅱ在不同温度下的化学平衡常数(K)
I.由表中数据判断△H2______0(填“>”、“<”或“=”).
Ⅱ.若容器容积不变,下列措施可增加甲醇产率的是______(填序号).
A.升高温度B.将CH3OH(g)从体系中分离出来C.使用合适的催化剂
D.充入He,使体系总压强增大 E.按原比例再充入CO和H2
Ⅲ.
某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol•L-1,则CO的转化率为______,此时的温度为______(从上表中选择);温度 250℃ 300℃ 350℃ K 2.041 0.270 0.012 
(2)某实验小组依据甲醇燃烧的反应原理,设计如右图所示的原电池装置.
①该电池工作时,OH-向______极移动(填“正”或“负”),
②该电池正极的电极反应式为______. moralist1年前1
moralist1年前1 -
 含冰罕心95 共回答了16个问题
含冰罕心95 共回答了16个问题 |采纳率81.3%解题思路:(1)①“原子经济性”是指在化学品合成过程中,合成方法和工艺应被设计成能把反应过程中所用的所有原材料尽可能多的转化到最终产物中;
②Ⅰ、反应物总能量大于生成物总能量时,该反应为放热反应;
Ⅱ、措施可增加甲醇产率,即平衡正移,根据影响平衡的因素分析;
Ⅲ、根据一氧化碳的平衡浓度计算平衡时一氧化碳的物质的量,再根据转化率公式计算其转化率,根据平衡浓度计算K,再判断温度;
(2)①原电池工作是阴离子向负极移动;
②负极上燃料失电子发生氧化反应,正极上氧气得电子发生还原反应,据此写出电池反应式.(1)①根据原子经济知,Ⅱ没有副产物,符合原子经济理念,中有副产物,不符合原子经济理念,
故答案为:Ⅱ;
②Ⅰ、根据图象知,反应物总能量大于生成物总能量,所以该反应是放热反应,则△H1<0,
故答案为:<;
Ⅱ、A.升高温度,平衡逆移,甲醇产率降低,故错误;
B.将CH3OH(g)从体系中分离出来,平衡正移,甲醇产率增大,故正确;
C.使用合适的催化剂,平衡不移动,故错误;
D.充入He,使体系总压强增大,平衡不移动,故错误;
E.按原比例再充入CO和H2,增大了压强平衡正移,甲醇产率增大,故正确;
故答案为:BE;
Ⅲ、按反应II充分反应达到平衡后,测得c(CO)=0.2mol/L,物质的量为0.4mol;
CO (g)+2H2 (g)⇌CH3OH (g)
起始量(mol) 2 6 0
变化量(mol) x 2x x
平衡量(mol) 2-x 6-2xx
平衡时一氧化碳的物质的量:2-x=0.4mol,所以x=1.6mol
平衡时各物质的浓度:c(CO)=0.2mol/L×2L=0.4mol,c(H2)=[6−2×1.6/2]=1.4mol/L,c(CH3OH)=[1.6/2]=0.8mol/L;
一氧化碳的转化率=
(2−0.4)mol
2mol=80%,K=
0.8mol/L
0.2mol/L×(1.4mol/L)2=2.041,由表格可知温度为250℃;
故答案为:80%;250℃;
(2)①原电池工作是阴离子向负极移动,所以OH-向负极移动,
故答案为:负;
②正极上氧气得电子和水反应生成氢氧根离子,所以其电极反应式为O2+2H2O+4e-═4OH-,
故答案为:O2+2H2O+4e-═4OH-.点评:
本题考点: 化学能与热能的相互转化;化学电源新型电池;化学平衡的影响因素.
考点点评: 本题考查了原电池原理、化学平衡移动等知识点,注意燃料电池中正负极上发生的电极反应式,题目难度中等.1年前查看全部
- 20世纪以来,随着科学技术的迅速发展,人类创造了空前的物质财富.与此同时,能源的过度开发和消耗导致全球性的能源短缺和环境
20世纪以来,随着科学技术的迅速发展,人类创造了空前的物质财富.与此同时,能源的过度开发和消耗导致全球性的能源短缺和环境污染.从原料来源和对环境的影响考虑.下列能源中,最具开发前景的能源是( ) A.煤 B.石油 C.天然气 D.太阳能  消逝的霁飒1年前1
消逝的霁飒1年前1 -
 daniel_h 共回答了21个问题
daniel_h 共回答了21个问题 |采纳率85.7%A、煤是化石燃料,其来源是有限的,燃烧会释放出二氧化硫等有毒气体.故A错误;
B、石油是化石燃料,其来源是有限的,燃烧会释放出二氧化硫等有毒气体.故B错误;
C、天然气是化石燃料,其来源是有限的,燃烧会释放出二氧化碳温室气体.故C错误;
D、太阳能是新型能源,其来源是无限的,且不会对环境造成污染,是最有开发前景的能源.故D正确;
故选D.1年前查看全部
- 20世纪以来,随着科学技术的迅速发展,人类创造了空前的物质财富.与此同时,能源的过度开发和消耗导致全球性的能源短缺和环境
20世纪以来,随着科学技术的迅速发展,人类创造了空前的物质财富.与此同时,能源的过度开发和消耗导致全球性的能源短缺和环境污染.从原料来源和对环境的影响考虑,下列能源中,最具开发前景的能源是( )
A. 天然气
B. 石油
C. 太阳能
D. 煤 ahjianan1年前2
ahjianan1年前2 -
 程纸音 共回答了17个问题
程纸音 共回答了17个问题 |采纳率76.5%解题思路:从原料的来源和对空气的影响考虑,太阳能是新型能源,其来源是无限的,且不会对空气造成污染,是最有开发前景的能源.而煤、石油、天然气是化石燃料,其来源是有限的,燃烧会释放出二氧化硫等有毒气体.A、天然气是化石燃料,其来源是有限的,燃烧会释放出二氧化碳温室气体.故错误
B、石油是化石燃料,其来源是有限的,燃烧会释放出二氧化硫等有毒气体.故B错误;
C、太阳能是新型能源,其来源是无限的,且不会对空气造成污染,是最有开发前景的能源.故C正确;
D、煤是化石燃料,其来源是有限的,燃烧会释放出二氧化硫等有毒气体.故错误;
故选C.点评:
本题考点: 新能源.
考点点评: 本题考查资源的综合利用和新能源的开发.太阳能是新型能源,其来源是无限的,且不会对空气造成污染,是最有开发前景的能源.1年前查看全部
- 为了从根本上解决人类面临的能源短缺问题,一要节约能源,二要进一步开发、利用新能源.下列属于新能源的是( ) A.天然气
为了从根本上解决人类面临的能源短缺问题,一要节约能源,二要进一步开发、利用新能源.下列属于新能源的是( ) A.天然气 B.氢气 C.木材 D.煤  lily1980_lz1年前1
lily1980_lz1年前1 -
 vwauby 共回答了19个问题
vwauby 共回答了19个问题 |采纳率94.7%A、天然气属于化石燃料,不属于新能源.
B、氢气属于新能源.
C、木材属于传统能源,不属于新能源.
D、煤属于化石燃料,不属于新能源.
故选B.1年前查看全部
- 20世纪以来,随着科学技术的迅速发展,人类创造了空前的物质财富.与此同时,能源的过度开发和消耗导致全球性的能源短缺和环境
20世纪以来,随着科学技术的迅速发展,人类创造了空前的物质财富.与此同时,能源的过度开发和消耗导致全球性的能源短缺和环境污染.从原料来源和对环境的影响考虑,下列能源中,最具开发前景的能源是( ) A.煤 B.石油 C.太阳能 D.天然气  我轻舞肥羊1年前1
我轻舞肥羊1年前1 -
 金州海边 共回答了19个问题
金州海边 共回答了19个问题 |采纳率89.5%从原料来源和对环境的影响考虑,最具开发前景的能源是太阳能.
故选C.1年前查看全部
- 能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H 2 (g) CH 3 OH(g)ΔH1
CH 3 OH(g)ΔH1
反应II:CO 2 (g) + 3H 2 (g) CH 3 OH(g)+H 2 O(g)ΔH2
CH 3 OH(g)+H 2 O(g)ΔH2
①在以上制备甲醇的两个反应中:反应I优于反应II,原因为___________。
②下表所列数据是反应I在不同温度下的化学平衡常数(K)。
I、在一密闭容器中发生反应Ⅰ并达到平衡后,保持其他条件不变,对容器升温,此反应的化学反应平衡应__________移动(填“正向”、“逆向”、“不”) 。
II、某温度下,将1mol CO和4mol H 2 充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)= 0.1 mol/L,则CO的转化率为___________,此时的温度______________250℃(填“>”、“<”、“=”)
(2)已知在常温常压下:
① 2CH 3 OH(l) + 3O 2 (g) = 2CO 2 (g) + 4H 2 O(g)ΔH = -1275.6 kJ/mol
② 2CO (g)+ O 2 (g) = 2CO 2 (g)ΔH = -566.0 kJ/mol
③ H 2 O(g) = H 2 O(l)ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:__________________
(3)某同学依据甲醇燃烧的反应原理,设计如图所示的电池装置,工作一段时间后,测得溶液的pH将____________(填“升高”、“降低”、“不变”),该燃料电池负极反应的离子方程式为:___________________。
 累不llde1年前1
累不llde1年前1 -
 贝贝爱娜娜 共回答了17个问题
贝贝爱娜娜 共回答了17个问题 |采纳率88.2%(1)①反应I符合“原子经济性”的原则即原子利用率为100%
②I:逆向 ; II:80%;<
(2)CH 3 OH(l)+ O 2 (g) = CO(g) + 2H 2 O(l)ΔH=﹣442.8 kJ∕mol
(3)降低; CH 3 OH-6e - +8OH - =CO 3 2- +6H 2 O1年前查看全部
- (10分)能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。(注:“原子经济性”是指,在
(10分)能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。(注:“原子经济性”是指,在化学品合成过程中,合成方法和工艺应被设计
 成能把反应过程中所用的所有原材料尽可能多的转化到最终产物中)
成能把反应过程中所用的所有原材料尽可能多的转化到最终产物中)
(1)工业上一般采用下列两种反应合成甲醇
反应I: CO(g) + 2H 2 (g) CH 3 OH(g) Δ H 1
CH 3 OH(g) Δ H 1
反应II: CO 2 (g) + 3H 2 (g) CH 3 OH(g) + H 2 O(g) Δ H 2
CH 3 OH(g) + H 2 O(g) Δ H 2
上述反应符合“原子经济”原则的是: (填“I”或“Ⅱ”)。
(2)已知在常温常压下:
① 2CH 3 OH(l) + 3O 2 (g) = 2CO 2 (g) + 4H 2 O (g) Δ H =-1275.6 kJ·mol -1
(g) Δ H =-1275.6 kJ·mol -1
② 2CO (g)+ O 2 (g) = 2CO 2 (g) Δ H =-566.0 kJ·mol -1
③ H 2 O(g) = H 2 O(l)Δ H =-44.0 kJ·mol -1
请写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式
_ _________________________________________________
(3)甲醇—空气燃料电池,电解质溶液是:20%~30%的KOH溶液。请写出甲醇—空气燃料电池放电时正极的电极反应式。
。
(4)下图是一个电化学过程示意图。
①锌片上发生的电极反应式为 。
②假设使用甲醇—空气燃料电池作为本过程中的电源,铜片的质量变化96g,则燃料电池理论上需要 mol甲醇。
mol甲醇。 我是zz哦1年前1
我是zz哦1年前1 -
 久久不放 共回答了14个问题
久久不放 共回答了14个问题 |采纳率92.9%每空2分
(1) I
(2) CH 3 OH(l) + O 2 (g) = CO(g) + 2H 2 O(l)Δ H =-442.8kJ·mol -1
(3) O 2 +2H 2 O+4e - =4OH -
(4) Cu 2+ +2e - ="Cu " 0.5 mol
略1年前查看全部
- 能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
Ⅰ.已知在常温常压下:
①2ch3oh(l)+3o2(g)═2co2(g)+4h2o(g)△h═-1275.6kj•mol-1
②2co(g)+o2(g)═2co2(g)△h═-566.0kj•mol-1
③h2o(g)═h2o(l)△h═-44.0kj•mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:______
Ⅱ.工业上合成甲醇的反应为:co(g)+2h2(g)⇌ch3oh(g);△h
(1)该反应在300℃,5mpa条件下能自发进行,则△h______0,△s______0 (填“<,>或=”).
(2)在300℃,5mpa条件下,将0.20mol的 co与0.58mol h2的混合气体充入2l密闭容器发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图1所示.
①在0~2min内,以h2表示的平均反应速率为______mol•l-1•s-1.
②计算300℃时该反应的平衡常数k=______.
③300℃时,将0.50mol co、1.00mol h2和1.00mol ch3oh 充
入容积为2l的密闭容器中,此时反应将______.
a.向正方向移动b.向逆方向移动
c.处于平衡状态d.无法判断
④下列措施可增加甲醇产率的是______
a.压缩容器体积b.将ch3oh(g)从体系中分离
c.充入he,使体系总压强增大
d.再充入0.20mol co和0.58mol h2
(3)若其它条件不变,使反应在500℃下进行,在图2中作出甲醇的物质的量浓度随时间的变化的示意图.
Ⅲ.甲醇可以与水蒸气反应生成氢气,反应方程式如下:
ch3oh(g)+h2o(g)⇌co2(g)+3h2(g)△h>0.
(1)判断可逆反应达到平衡状态的依据是(填序号)______.
a.v正(ch3oh)=v正(co2)
b.混合气体的密度不变
c.混合气体的平均相对分子质量不变
d.ch3oh、h2o、co2、h2的浓度都不再发生变化
(2)图2中p是可***平行滑动的活塞,关闭k,在相同温度时,向a容器中充入1mol ch3oh(g)和2mol h2o(g),向b容器中充入1.2mol ch3oh(g)和2.4mol h2o(g),两容器分别发生上述反应.已知起始时容器a和b的体积均为a l.试回答:反应达到平衡时容器b的体积为1.5a l,容器b中ch3oh的转化率为______,a、b两容器中h2o(g)的体积百分含量的大小关系为b______a(填“>”“<”或“=”).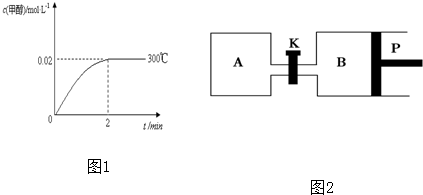
 hh常渴1年前1
hh常渴1年前1 -
 无敌大青年 共回答了17个问题
无敌大青年 共回答了17个问题 |采纳率94.1%解题思路:Ⅰ、依据热化学方程式和盖斯定律 计算所得热化学方程式;
Ⅱ、(1)当△H-T△S<0时,反应自发进行,结合方程式分析即可;
(2)①据图分析出△c和△t即可求出;
②利用三段式法解答;
③据该温度下的K和Qc比较,当K>Qc时平衡正向移动,K<Qc时平衡逆向移动;
④结合影响平衡移动的因素,使平衡正向移动即可;
(3)结合影响反应速率和影响平衡移动的因素解答.
Ⅲ、(1)化学平衡的标志是正逆反应速率相同,各组分浓度保持不变分析选项;
(2)依据恒温恒容、恒温恒压容器变化,结合反应平衡特征分析判断,压强变化和物质的量变化成正比.Ⅰ、(1)①H2O(g)=H2O(l)△H1=-44.0kJ/mol②2CO (g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol③2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H3=-1275.6kJ/mol;由盖斯定律可知③-②+4×①得到甲醇不完全燃烧...
点评:
本题考点: 热化学方程式;化学平衡的影响因素;化学平衡状态的判断;化学平衡的计算.
考点点评: 本题考查了化学平衡三段式计算,平衡标志的分析判断,恒温恒容容器,恒温恒压容器的分析判断是解题关键,气体压强之比和物质的量之比成正比例,题目难度较大.1年前查看全部
- 人类面临着能源短缺,机动车的燃料也随之产生危机.下列缓解机动车燃料危机的设想不合理的是( )
人类面临着能源短缺,机动车的燃料也随之产生危机.下列缓解机动车燃料危机的设想不合理的是( )
A.使用已醇汽油
B.改进发动机的燃烧方法,使汽油充分燃烧
C.从石油中提炼汽油
D.寻找新的催化剂使水变汽油 花蟑螂1年前1
花蟑螂1年前1 -
 kqlzmq 共回答了21个问题
kqlzmq 共回答了21个问题 |采纳率90.5%解题思路:此题是关于资源的综合利用和新能源的开发以及环境保护的一道综合类型的一道题型,对资源的利用和开发一定遵循环保、节能、可持续性的原则,同时还必须遵循客观事实的原则.选项A、B、C分别从石油的替代品乙醇、改进发动机的燃烧方法提高燃料的利用率、石油的冶炼来阐述的.选项D寻找新的催化剂使水变汽油,是没法实现的.因为汽油属于碳氢化合物,而水属于氢氧化合物,根据质量守恒定律,是无法实现水向汽油的转化的.
故选D.点评:
本题考点: 资源综合利用和新能源开发.
考点点评: 解答此类题型时,必须尊重客观事实的原则,遵循质量守恒定律的原则.对于本类型的题可以采用排除法进行选择.1年前查看全部
- 能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。(注:“原子经济性”是指,在化学品合成
能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。(注:“原子经济性”是指,在化学品合成过程中,合成方法和工艺应被设计成能把反应过程中所用的所有原材料尽可能多的转化到最终产物中)
(1)工业上一般采用下列两种反应合成甲醇
反应I: CO(g) + 2H 2 (g) CH 3 OH(g)ΔH1
CH 3 OH(g)ΔH1
反应II: CO 2 (g) + 3H 2 (g) CH 3 OH(g)+H 2 O(g)ΔH2
CH 3 OH(g)+H 2 O(g)ΔH2
上述反应符合“原子经济”原则的是________(填“I”或“Ⅱ”)。
(2)已知在常温常压下:
① 2CH 3 OH(l) + 3O 2 (g) = 2CO 2 (g) + 4H 2 O(g)ΔH = -1275.6 kJ·mol -1
② 2CO (g)+ O 2 (g) = 2CO 2 (g)ΔH = -566.0 kJ·mol -1
③ H 2 O(g) = H 2 O(l)ΔH = -44.0 kJ·mol -1
请写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式 ___________________
(3)甲醇--空气燃料电池,电解质溶液是:20%~30%的KOH溶液。请写出甲醇--空气燃料电池放电时正极的电极反应式。___________________。
(4)下图是一个电化学过程示意图。
① 锌片上发生的电极反应式为___________。
② 假设使用甲醇--空气燃料电池作为本过程中的电源,铜片的质量变化96g,则燃料电池理论上需要___________mol甲醇。
 山顶的贝壳1年前1
山顶的贝壳1年前1 -
 i99beijing 共回答了15个问题
i99beijing 共回答了15个问题 |采纳率93.3%(1)I
(2)CH 3 OH(l) + O 2 (g) = CO(g) + 2H 2 O(l)ΔH = -442.8kJ·mol -1
(3) O 2 +2H 2 O+4e - =4OH -
(4) ①Cu 2+ +2e - =Cu;②0.5 mol1年前查看全部
- 下列有关能源的认识错误的是( ) A.开发新能源可解决能源短缺问题 B.乙醇汽油的使用可以节省石油资源 C.化石燃料在
下列有关能源的认识错误的是( ) A.开发新能源可解决能源短缺问题 B.乙醇汽油的使用可以节省石油资源 C.化石燃料在地球上的蕴藏量是有限的 D.使用天然气不会对环境造成任何污染  wj4324251年前1
wj4324251年前1 -
 pxhy112 共回答了17个问题
pxhy112 共回答了17个问题 |采纳率94.1%A、开发新能源可解决能源短缺问题.故选项错误;
B、乙醇汽油的使用可以节省石油资源.故选项错误;
C、化石燃料在地球上的蕴藏量是有限的.故选项错误;
D、天然气燃烧时能生成大量的二氧化碳,二氧化碳是一种主要的温室气体,在空气中含量过高时会引起温室效应.故选项正确.
故选D.1年前查看全部
- 能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上合成甲醇的反应原理为:CO(g)+2H2(g)⇌CH3OH(g)△H,
下表所列数据是该反应在不同温度下的化学平衡常数(K).
①根据表中数据可判断△H______0 (填“>”、“=”或“<”).温度 250℃ 300℃ 350℃ K 2.041 0.270 0.012
②在300℃时,将2mol CO、3mol H2和2mol CH3OH充入容积为1L的密闭容器中,此时反应将______.
A.向正方向移动B.向逆方向移动C.处于平衡状态D.无法判断
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1451.6kJ•mol-1
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
写出该条件下甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:______.
(3)以甲醇、氧气为原料,KOH溶液作为电解质构成燃料电池总反应为:2CH3OH+3O2+4KOH=2K2CO3+6H2O,则负极的电极反应式为______,随着反应的不断进行溶液的pH______(填“增大”“减小”或“不变”).
(4)如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为______;如果电解一段时间后NaCl溶液的体积为1L,溶液的pH为12(25℃下测定),则理论上消耗氧气的体积为______mL(标况下). xidianzhy1年前1
xidianzhy1年前1 -
 玉溪玲 共回答了18个问题
玉溪玲 共回答了18个问题 |采纳率94.4%解题思路:(1)①、由表中数据可知,温度越高,平衡常数越小,说明升高温度平衡向逆反应移动;
②、计算此时的浓度商Qc,与平衡常数比较,判断反应进行的方向;
(2)根据盖斯定律①-②可得甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式;
(3)负极发生氧化反应,甲醇在负极放电,氧气在正极放电,正极电极反应式为O2+2H2O+4e-=4OH-,总反应式减去正极反应式可得负极反应式,由电池总反应式可知OH-参加反应,OH-浓度降低;
(4)电解饱和食盐水,氯离子在阳极发生氧化反应生成氯气.电解一段时间,溶液的pH=12,则溶液中c(OH-)=0.01mol/L,则n(OH-)=0.01mol/L×1L=0.01mol,据此计算生成的氯气的物质的量,根据电子转移守恒计算原电池消耗的氧气的物质的量,进而计算体积.(1)①、由表中数据可知,温度越高,平衡常数越小,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H<0,故答案为:<;
②、将2mol CO、3mol H2和2mol CH3OH充入容积为1L的密闭容器中,此时的浓度商Qc=[2
2×32=
1/9],小于0.27,故反应向正反应进行,故答案为:A;
(2)根据盖斯定律①-②可得 2CH3OH(l)+2O2(g)=2CO(g)+4H2O(l)△H=(-1451.6kJ•mol-1)-(-566.0kJ•mol-1)
=-885.6kJ•mol-1,即CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8 kJ•mol-1;
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8 kJ•mol-1;
(3)负极发生氧化反应,甲醇在负极放电,氧气在正极放电,正极电极反应式为3O2+6H2O+12e-=12OH-,电池总反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O,总反应式减去正极反应式可得2CH3OH+16OH--12e-=2CO32-+12H2O,故负极反应式为:CH3OH+8OH--6e-=CO32-+6H2O,由电池总反应式可知OH-参加反应,OH-浓度降低,酸性增强,溶液pH减小,
故答案为:CH3OH+8OH--6e-=CO32-+6H2O;减小;
(4)电解饱和食盐水,氯离子在阳极发生氧化反应生成氯气,电极反应式为:2Cl--2e-=Cl2↑,电解一段时间,溶液的pH=12,则溶液中c(OH-)=0.01mol/L,则n(OH-)=0.01mol/L×1L=0.01mol,根据反应2NaCl+2H2O=H2↑+Cl2↑+2NaOH可知,n(Cl2)=0.01mol×[1/2]=0.005mol,根据电子转移守恒有4n(O2)=2n(Cl2),所以n(O2)=[0.005mol×2/4]=0.0025mol,故原电池消耗氧气的体积为0.0025mol×22.4L/mol=0.056L=56mL,
故答案为:2Cl--2e-=Cl2↑;56.点评:
本题考点: 化学平衡的影响因素;热化学方程式;化学电源新型电池.
考点点评: 本题目综合性较大,涉及化学平衡常数、热化学方程式、原电池与电解池工作原理及计算等,难度中等,注意(3)中利用总反应式减去正极反应式书写负极电极反应式时,转移电子数目应相等.1年前查看全部
- 能源短缺是人类面临的难题之一.最理想的能源是什么?是氢气还是汽油还是酒精还是天然气?选一个
 4807041年前1
4807041年前1 -
 蚍蜉撼大书 共回答了18个问题
蚍蜉撼大书 共回答了18个问题 |采纳率88.9%我个人认为是氢气1年前查看全部
- 能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H 2 (g) CH 3 OH(g)ΔH1
CH 3 OH(g)ΔH1
反应II:CO 2 (g) + 3H 2 (g) CH 3 OH(g)+H 2 O(g)ΔH2
CH 3 OH(g)+H 2 O(g)ΔH2
①上述反应符合“原子经济”原则的是_______(填“I”或“Ⅱ”)。
②下表所列数据是反应I在不同温度下的化学平衡常数(K)。
由表中数据判断ΔH1______0 (填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H 2 充入2L的密闭容器中,充分反应,达到平衡后,测得
c(CO)=0.2 mol/L,则CO的转化率为______,此时的温度为_______(从上表中选择)。
(2)已知在常温常压下:
① 2CH 3 OH(l) + 3O 2 (g) = 2CO 2 (g) + 4H 2 O(g)ΔH = -1275.6 kJ/mol
② 2CO (g)+ O 2 (g) = 2CO 2 (g)ΔH = -566.0 kJ/mol
③ H 2 O(g) = H 2 O(l)ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:__________________
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。
①该电池正极的电极反应为_________________。
② 工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为______________。 rxj03181年前1
rxj03181年前1 -
 静24 共回答了30个问题
静24 共回答了30个问题 |采纳率90%(1)① I ;② <;③ 80%;250℃
(2)CH 3 OH(l)+ O 2 (g) = CO(g) + 2H 2 O(l)ΔH=﹣442.8 kJ∕mol
(3)①O 2 + 2H 2 O + 4e - =4OH - ;②2CH 3 OH + 3O 2 + 4OH - = 2CO 3 2- + 6H 2 O1年前查看全部
- 阅读下列材料:人类的生存和发展导致了能源短缺、环境污染、全球气候变化…,开发清洁、高效、安全和可持续的能源迫在眉睫.下面
阅读下列材料:
人类的生存和发展导致了能源短缺、环境污染、全球气候变化…,开发清洁、高效、安全和可持续的能源迫在眉睫.下面是二种新能源的介绍:
材料一:可贮能源--太阳能
太阳能是一种清洁、廉价的能源.太阳能可以储存,甲烷发生器即是其中一种,其原理是利用太阳能加热装有甲烷和水的化学反应器,使温度达到227℃以上,甲烷与水蒸气反应产生一氧化碳和氢气.这些新分子所含能量比甲烷多30%左右.然后将产生的合成气输入一条管道,送入另一个化学反应器里,在这里化学反应与前相反,将气体还原成甲烷和水蒸气,这一还原过程释放的热能可用于热加工、发电等,达到太阳能的重新利用.
材料二:绿色能源--乙醇汽油
乙醇汽油是一种由粮食及各种植物纤维加工成的燃料乙醇和普通汽油按一定比例混合而成的替代能源.按照我国的国家标准,乙醇汽油是用90%的普通汽油与10%的燃料乙醇调和而成.它可以缓解石油紧缺矛盾,可以减少有害气体一氧化碳的排放量,还将大幅度提升粮食精深加工能力和综合利用水平,达到“吃干榨净,变废为宝”的目的.
综合上述材料,回答下列问题:
(1)写出“材料一”中贮存太阳能或释放能量的化学方程式:______.
(2)写出“材料二”乙醇(c 2 h 5 oh)燃烧的化学方程式:______.
(3)乙醇汽油的燃烧可以减少有害气体的排放量.你认为合理的解释是______(填编号).
①汽油的分子结构发生了改变
②乙醇与汽油中的杂质发生反应
③乙醇提供了氧元素,使碳元素燃烧更加充分
④乙醇作催化剂
(4)谈谈你对“吃干榨尽,变废为宝”的理______.
(5)请你再例举一种新能源,并谈谈它的优点:______. cc52991年前1
cc52991年前1 -
 森林小狐狸 共回答了18个问题
森林小狐狸 共回答了18个问题 |采纳率94.4%(1)甲烷和水在太阳能的作用下能生成一氧化碳和氢气,反应的化学方程式为:CH 4 +H 2 O
太阳能
.
CO+3H 2 .
一氧化碳和氢气反应能生成甲烷和水,反应的化学方程式为:CO+3H 2 ═CH 4 +H 2 O.
(2)乙醇燃烧生产水和二氧化碳,反应的化学方程式为:C 2 H 5 OH+3O 2
点燃
.
2CO 2 +3H 2 O.
(3)乙醇提供了氧元素,使碳元素燃烧更加充分,所以乙醇汽油的燃烧可以减少有害气体的排放量.故填:③.
(4)“吃干榨尽,变废为宝”的含义为:稻米可用作粮食、酿酒,稻草可加工转化为燃料乙醇,都可以造福于人类.
(5)氢能是一种清洁的新能源,氢气燃烧时只生成水,不污染环境,热值高,原料丰富.故填:氢能.清洁、无污染,热值高,原料丰富.1年前查看全部
- 关于能源短缺的英语作文当今社会能源短缺,环境污染严重,
 t322r11年前1
t322r11年前1 -
 灏好走下去 共回答了15个问题
灏好走下去 共回答了15个问题 |采纳率93.3%Energy shortage is a very serious problem in the world.Many people worry that energy resources on the earth will be exhausted if we use them in an unchecked way.This,most people agree,will cause serious problems and even crisis and jeopardize the survival of mankind .
On the one hand,most people agree that the problem can be solved in one way or another.One is to conserve and save our energy.Energy refers not only to coal,oil,or natural gases but also to goods,land and water,etc.Most countries have realized the wastefulness in their using of energy.They are trying to conserve energy.For example,some countries have a daylight saving system to use less electricity for lighting.Some cities have enforced water savers at public such as restrooms and bars.Some have enforced serious penalties on overuse of electricity,water,and farming land.By these means,people hope the drain on energy resources could be slowed down.
However,conservation alone cannot solve the problem.Another way,perhaps the best I think,is to develop new energy resources.Obviously,no matter how hard we try to save energy resources and how abundant they are,we will use them up sooner or later.I think there are many energy resources that we can develop and utilize.We don't have to depend only on the current conventional energy resources.There are many other energy resources that we can develop such as nuclear power,waterpower and solar power.These resources,if developed,can completely replace the conventional energy and thus solve the problem of energy shortage.1年前查看全部
- 求一个两人的英语对话,甲乙双方热烈讨论之间的关系经济的发展和环境污染和能源短缺问题.
求一个两人的英语对话,甲乙双方热烈讨论之间的关系经济的发展和环境污染和能源短缺问题.
我们老师给的题目就是那么纠结,简单来说就是两人讨论经济发展、环境污染、能源短缺之间的关系 siss_shi1年前3
siss_shi1年前3 -
 幽岁月淡无痕 共回答了16个问题
幽岁月淡无痕 共回答了16个问题 |采纳率81.3%A:Well,no one could survive without water.But you see pollution has been making more and more water unable for drinking.
B:Yeah.Water pollution has for a long time been a major concern among the environmental issues.
A:But what are the sources of water pollution?
B:They could generally be divided into two categories:direct and indirect contaminant sources.
A:Well,direct ones are pollution directly from factories,refineries,waste treatment plants etc.,aren't they?
B:Yeah.They are emitted directly into urban water supplies.
A:But what about the indirect ones?
B:Indirect sources include contaminants that enter the water supply from soils or groundwater systems and from the atmosphere via rainwater.
A:I see.for the sake of us all,we should be an active participator in the prevention of it.
B:Sure.it's an issue asking for everyone's participation.1年前查看全部
- 能源是当今世界日益关注的热点之一.由于矿物能源的过度开发和消耗,导致全球性的能源短缺和环境污染.
能源是当今世界日益关注的热点之一.由于矿物能源的过度开发和消耗,导致全球性的能源短缺和环境污染.
(1)煤、石油、天然气等化石燃料日益枯竭,因此开发新能源显得尤为重要.请例举出两种已经开发的新能源______、______.
(2)原煤中含有硫元素,原煤燃烧产生的二氧化硫进入大气后,与水反应生成亚硫酸(H2SO3),亚硫酸又被空气中的氧气氧化成硫酸,形成酸雨.请写出亚硫酸转化为硫酸的化学方程式:______,该反应的基本类型为______(选填“化合”、“分解”、“置换”或“复分解”)反应.
(3)酸雨对人类生活环境危害极大,请举一例:______.
工厂尾气中的二氧化硫可用氢氧化钙吸收消除,其化学反应原理类似于氢氧化钙与二氧化碳的反应,写出用氢氧化钙吸收SO2的化学方程式:______.
(4)我国首次使用二甲醚(化学式C2H6O)为燃料的城市客车问世,有效的解决公交车冒黑烟的问题.驱动汽车的是二甲醚燃烧产生的______能转化成的电能.二甲醚在空气中完全燃烧生成的两种产物在空气中都存在,请写出其中一种产物的化学式:______. 简单E人1年前1
简单E人1年前1 -
 林有财 共回答了16个问题
林有财 共回答了16个问题 |采纳率100%解题思路:(1)新能源如:太阳能、氢能
(2)亚硫酸转化为硫酸的化学方程式:2H2SO3 +O2 ═2H2SO4、该反应类型为化合反应;
(3)酸雨对人类生活环境危害极大,如酸雨会使土壤酸化,破坏农作物和森林的生长、用氢氧化钙吸收SO2的化学方程式:Ca(OH)2+SO2═CaSO3+H2O
(4)驱动汽车的是二甲醚燃烧产生的化学能能转化成的电能.二甲醚在空气中完全燃烧生成的两种产物在空气中都存在,请写出其中一种产物的化学式:H2O.(1)例举出两种已经开发的新能源如:太阳能、氢能
(2)亚硫酸转化为硫酸的化学方程式:2H2SO3 +O2 ═2H2SO4、该反应类型为化合反应;
(3)酸雨对人类生活环境危害极大,如酸雨会使土壤酸化,破坏农作物和森林的生长、用氢氧化钙吸收SO2的化学方程式:Ca(OH)2+SO2═CaSO3+H2O
(4)我国首次使用二甲醚(化学式C2H6O)为燃料的城市客车问世,有效的解决公交车冒黑烟的问题.驱动汽车的是二甲醚燃烧产生的化学能能转化成的电能.二甲醚在空气中完全燃烧生成的两种产物在空气中都存在,请写出其中一种产物的化学式:H2O.
故答案为:(1)太阳能、氢能(2)2H2SO3 +O2 ═2H2SO4、化合(3)酸雨会使土壤酸化,破坏农作物和森林的生长、Ca(OH)2+SO2═CaSO3+H2O(4)化学能、H2O.点评:
本题考点: 常用燃料的使用与其对环境的影响;防治空气污染的措施;酸雨的产生、危害及防治;反应类型的判定;常见能源的种类、能源的分类.
考点点评: 本题考查新能源的开发.煤、石油、天然气等化石燃料日益枯竭,因此开发新能源显得尤为重要.1年前查看全部
- 为了解决能源短缺问题,,,,(三空)等化学燃料的同时,正在积极寻找解决能源短缺的有效途径,如开发 ,,,(三空)等新能源
为了解决能源短缺问题,,,,(三空)等化学燃料的同时,正在积极寻找解决能源短缺的有效途径,如开发 ,,,(三空)等新能源,研制和开发节能新产品等.诺贝尔是瑞典化学家,***是科学界的最高荣誉奖,它从一个侧面反映了世界科学的发展状况.化学无处不在,是人类进步的关键,希望同学们也能像诺贝尔一样,勇于探究.请你从衣,食,住,行,医或医药等方面,简要说出化学的用途.【示例】农:合理使用尿素等氮肥,提高了粮食的产量.衣:食:住:行:林:
医或医药: yjf9102021年前3
yjf9102021年前3 -
 树抱熊 共回答了21个问题
树抱熊 共回答了21个问题 |采纳率85.7%为了解决能源短缺问题,化学在利用 煤 ,石油 ,天然气 ,(三空)等化学燃料的同时,正在积极寻找解决能源短缺的有效途径,如开发 太阳能 ,风能 ,潮汐能 ,(三空)等新能源,研制和开发节能新产品等.诺贝尔是瑞典化学家,诺...1年前查看全部
- 为什么说能源短缺和环境恶化已经成为关系到人类社会能否持续发展的大问题?
 chyy111年前1
chyy111年前1 -
 0000020 共回答了14个问题
0000020 共回答了14个问题 |采纳率100%能源短缺会导致科技发展受到影响,很多日常家用电器不能使用,更重要的是医学设备可能也无法运行.现在的人们已经习惯了先进的科技,如果突然间所有的耗能物品不能使用,那么我们就寸步难行了,也许就只能钻木取火了.环境恶化就更不用说了,全球变暖,南极冰川融化,海平面上升,会淹没许多沿海地区.“从人类砍倒第一棵树时,文明便开始了.当人类砍到最后一棵树,文明即将结束.”植物是多么重要啊.可现在,酸雨和乱砍乱伐却严重毁坏了他们.这两个大问题,是人类持续发展路上的拦路虎.我们要节约资源,爱护环境,让天更蓝,水更清.1年前查看全部
- 能源短缺和环境恶化已经成为关系到人类社会能否持续发展的大问题。为缓解能源紧张压力、减少环境污染,汽车制造商纷纷推出小排量
能源短缺和环境恶化已经成为关系到人类社会能否持续发展的大问题。为缓解能源紧张压力、减少环境污染,汽车制造商纷纷推出小排量经济实用型轿车。某公司研制开发了某型号小汽车发动机的额定功率为24 kW,汽车连同驾乘人员总质量为m=2 t,在水平路面上行驶时受到的阻力是800 N,求:
(1)汽车在额定功率下匀速行驶的速度;
(2)汽车在额定功率下行驶,速度为20 m/s时的加速度。 momo_20001年前0
momo_20001年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2014•上海模拟)能源短缺是人类面临的重大问题之一.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上合成甲醇一
(2014•上海模拟)能源短缺是人类面临的重大问题之一.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上合成甲醇一般采用以下反应:CO(g)+2H2(g)⇌CH3OH(g)+Q
下表所列数据是上述反应在不同温度下的化学平衡常数(K)
(1)在一定条件下将2mol CO和6mol H2充入2L的密闭容器中发生反应,5分钟后测得c(H2)=1.5mol/L,则此段时间内的反应速率(用CH3OH表达)______mol/(L•min).温度 250℃ 300℃ 350℃ K 2.041 0.270 0.012
(2)由表中数据分析可知,Q______0(填“>”、“<”或“=”).其它条件不变的情况下,若压缩容器的体积,则平衡______移动(“向正反应方向”“向逆反应方向”或“不”),化学平衡常数K______(填“增大”、“减小”或“不变”).
(3)在体积一定的密闭容器中,能说明该反应已处于化学平衡状态的是______(填编号).
a.V正(CO)=1/2V正(H2) b.混合气体的密度保持不变
c.反应体系中的热效应不再变化d.c(CO):c(CH3OH)=1:1
(4)寻找到合适的催化剂是实现反应工业化的关键.该反应使用催化剂无法实现的目标是______(填编号).
a.提高单位时间内甲醇的产量b.增大混合气体中甲醇的体积分数
c.缩短达到平衡所需时间d.提高一氧化碳的转化率. xcy2081年前1
xcy2081年前1 -
 asl8010 共回答了17个问题
asl8010 共回答了17个问题 |采纳率88.2%解题思路:(1)依据化学反应的三段式列式计算;
(2)平衡常数随温度变化,温度升高K减小说明温度升高平衡左移,逆向是吸热反应,正向是放热反应;反应特征CO(g)+2H2(g)⇌CH3OH(g)反应前后是气体体积减小的反应,增大压强平衡正向进行;
(3)化学平衡的标志是正逆反应速率相同,各组分百分含量不变,依据反应特征逐项分析判断;
(4)催化剂降低活化能,改变化学反应的反应速率,不能改变化学平衡.(1)依据化学平衡三段式列式得到
CO(g)+2H2(g)⇌CH3OH(g)
起始量(mol) 260
变化量(mol)1.5 31.5
5分钟量(mol) 0.5 2L×1.5mol/L=3mol 1.5
用CH3OH表达的反应速率=
1.5mol
2L
5min=0.15mol/L•min,
故答案为:0.15;
(2)表中数据分析可知随温度升高,平衡常数K减小,说明温度升高,平衡逆向进行,所以正向是放热反应,Q>>0,反应前后气体体积减小,依据平衡移动原理,增大压强平衡向气体体积减小的分析进行,所以压缩体积是增大压强,平衡正向进行;平衡常数随温度变化,不随浓度、压强等因素变化,所以K不变,
故答案为:>;向正反应方向;不变;
(3)反应达到平衡的标志是正逆反应速率相同,各组分含量保持不变;
a.V正(CO)=1/2V正(H2),正反应速率之比等于化学方程式中 计量数之比,仅表示反应正向进行,不能说明反应达到平衡,故a错误;
b.混合气体的密度保持不变,混合气体在乙定容密闭容器中进行,质量守恒,体积不变,反应过程中混合气体的密度始终不变,故b错误;
c.反应体系中的热效应不再变化,反应达到平衡反应的热量变化一定,平衡发生移动,反应的热量发生改变,证明反应达到平衡,故C正确;
d.c(CO):c(CH3OH)=1:1浓度相同,和起始量,变化量等有关,与平衡无直接关系,不能做平衡的标志,故d错误;
故答案为:c;
(4)寻找到合适的催化剂是实现反应工业化的关键,催化剂降低反应活化能,增大反应速率,但不改变化学平衡,
a.提高单位时间内甲醇的产量,反应速率增大,单位时间内生成甲醇增大,故a不符合;
b.增大混合气体中甲醇的体积分数,催化剂不改变化学平衡,体积分数不变,故b符合;
c.缩短达到平衡所需时间,催化剂加快反应速率,缩短到达平衡的时间,故c不符合;
d.提高一氧化碳的转化率,催化剂不改变平衡,反应物的转化率不变,故d符合;
故答案为:bd.点评:
本题考点: 化学平衡常数的含义;化学平衡的影响因素;化学平衡状态的判断.
考点点评: 本题考查了化学平衡常数的概念应用,化学平衡影响因素的分析判断,平衡标志的选择,化学反应速率影响因素的分析应用,题目难度中等.1年前查看全部
- 能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上合成甲醇的反应原理为:CO(g)+2H2(g)⇌CH3OH(g)△H,
下表所列数据是该反应在不同温度下的化学平衡常数(K).
①根据表中数据可判断△H______0 (填“>”、“=”或“<”).温度 250℃ 300℃ 350℃ K 2.041 0.270 0.012
②在300℃时,将2mol CO、3mol H2和2mol CH3OH充入容积为1L的密闭容器中,此时反应将______.
A.向正方向移动B.向逆方向移动C.处于平衡状态D.无法判断
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1451.6kJ•mol-1
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
写出该条件下甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:______.
(3)以甲醇、氧气为原料,KOH溶液作为电解质构成燃料电池总反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O,则负极的电极反应式为______,随着反应的不断进行溶液的pH______(填“增大”“减小”或“不变”).
(4)如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为______一段时间后NaCl溶液的体积为1L,溶液的pH为12(25℃下测定),则理论上消耗氧气的体积为______mL(标况下). scottwjw1年前1
scottwjw1年前1 -
 azhangc 共回答了23个问题
azhangc 共回答了23个问题 |采纳率91.3%解题思路:(1)①由表中数据可知,温度越高,平衡常数越小,说明升高温度平衡向逆反应移动;
②计算此时的浓度商Qc,与平衡常数比较,判断反应进行的方向;
(2)根据盖斯定律①-②可得甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式;
(3)负极发生氧化反应,甲醇在负极放电,氧气在正极放电,正极电极反应式为O2+2H2O+4e-=4OH-,总反应式减去正极反应式可得负极反应式,由电池总反应式可知OH-参加反应,OH-浓度降低;
(4)电解饱和食盐水,氯离子在阳极发生氧化反应生成氯气.电解一段时间,溶液的pH=12,则溶液中c(OH-)=0.01mol/L,则n(OH-)=0.01mol/L×1L=0.01mol,据此计算生成的氯气的物质的量,根据电子转移守恒计算原电池消耗的氧气的物质的量,进而计算体积.(1)①由表中数据可知,温度越高,平衡常数越小,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H<0,故答案为:<;
②、将2mol CO、3mol H2和2mol CH3OH充入容积为1L的密闭容器中,此时的浓度商Qc=[2
2×32=
1/9],小于0.27,故反应向正反应进行,故答案为:A;
(2)根据盖斯定律①-②可得 2CH3OH(l)+2O2(g)=2CO(g)+4H2O(l)△H=(-1451.6kJ•mol-1)-(-566.0kJ•mol-1)
=-885.6kJ•mol-1,
即CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8 kJ•mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8 kJ•mol-1;
(3)负极发生氧化反应,甲醇在负极放电,氧气在正极放电,正极电极反应式为3O2+6H2O+12e-=12OH-,电池总反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O,总反应式减去正极反应式可得2CH3OH+16OH--12e-=2CO32-+12H2O,故负极反应式为:CH3OH+8OH--6e-=CO32-+6H2O,由电池总反应式可知OH-参加反应,OH-浓度降低,酸性增强,溶液pH减小,
故答案为:CH3OH+8OH--6e-=CO32-+6H2O;减小;
(4)电解饱和食盐水,氯离子在阳极发生氧化反应生成氯气,电极反应式为:2Cl--2e-=Cl2↑,电解一段时间,溶液的pH=12,则溶液中c(OH-)=0.01mol/L,则n(OH-)=0.01mol/L×1L=0.01mol,根据反应2NaCl+2H2O=H2↑+Cl2↑+2NaOH可知,n(Cl2)=0.01mol×[1/2]=0.005mol,根据电子转移守恒有4n(O2)=2n(Cl2),所以n(O2)=[0.005mol×2/4]=0.0025mol,故原电池消耗氧气的体积为0.0025mol×22.4L/mol=0.056L=56mL,故答案为:2Cl--2e-=Cl2↑;56.点评:
本题考点: 化学平衡常数的含义;用盖斯定律进行有关反应热的计算;原电池和电解池的工作原理;化学平衡的影响因素.
考点点评: 本题目综合性较大,涉及化学平衡常数、热化学方程式、原电池与电解池工作原理及计算等,难度中等,注意(3)中利用总反应式减去正极反应式书写负极电极反应式时,转移电子数目应相等.1年前查看全部
- 能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。直接甲醇燃料电池(DNFC)被认为是2
能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。直接甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H 2 (g) CH 3 OH(g) △H1
CH 3 OH(g) △H1
反应Ⅱ:CO 2 (g)+3H 2 (g) CH 3 OH(g)+H 2 O(g) △H2
CH 3 OH(g)+H 2 O(g) △H2
①上述反应符合“原子经济”原则的是____(填“I”或“Ⅱ”);
②用反应I生产燃料甲醇,该反应的化学平衡常数表达式为K=_________,下表所列数据是反应I在不同温度下的化学平衡常数(K)。
由表中数据判断△H1___0(填“>”“=”或“<”);
③某温度下,将2 mol CO和6 mol H 2 充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO) =0.2
mol/L,则CO的转化率为_____,此时的温度为____(从上表中选择)。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH 3 OH(g) +H 2 O(g) =CO 2 (g)+3H 2 (g) △H1 =+49. 0 kJ/mol
②CH 3 OH(g)+O 2 (g)=CO 2 (g)+2H 2 (g) △H2
已知H 2 (g)+O 2 (g)=H 2 O(g) △H=-241.8 kJ/mol
则反应②的△H2=____kJ/mol;
(3)下图是甲醇燃料电池的结构示意图。甲醇进入____极(填“正”或“负”),正极发生的电极反应为
___________________。
 一呀么yi1年前1
一呀么yi1年前1 -
 洪波涌起 共回答了18个问题
洪波涌起 共回答了18个问题 |采纳率100%1年前查看全部
- 能源短缺是人类社会面临的重大问题,利用化学反应可实现多种形式的能量相互转化。请回答以下问题:
能源短缺是人类社会面临的重大问题,利用化学反应可实现多种形式的能量相互转化。请回答以下问题:
(1)由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是旧键断裂和新键的形成过程。已知反应N 2 (g)+3H 2 (g) 2NH 3 (g) △H=-93 kJ·mol -1 。试根据表中所列键能数据,计算a 的数值为_______kJ/mol。
2NH 3 (g) △H=-93 kJ·mol -1 。试根据表中所列键能数据,计算a 的数值为_______kJ/mol。
(2)甲醇是一种可再生能源,具有广泛的开发和应用前景。已知在常压下有如下变化:化学键 H-H N-H N≡N 键能/kJ·mol -1 436 a 945
① 2CH 3 OH(l)+3O 2 (g)=2CO 2 (g)+4H 2 O(g) ΔH =a kJ/mol
② H 2 O(g)=H 2 O(l)ΔH =b kJ/mol
写出液态甲醇完全燃烧生成二氧化碳和液态水的热化学方程式: 。
(3)可利用甲醇燃烧反应设计一个燃料电池。如下图1,用Pt作电极材料,用氢氧化钾溶液作电解质溶液,在两个电极上分别充入甲醇和氧气。
①写出燃料电池正极的电极反应式 。②若利用该燃料电池提供电源,与图1右边烧杯相连,在铁件表面镀铜,则铁件应是 极(填”A”或”B”);当铁件的质量增重6.4g时,燃料电池中消耗氧气的标准状况下体积为 L。
(4)如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图2装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾(电解槽内的阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)。
①该电解槽的阳极反应式为 ,单位时间内通过阴离子交换膜的离子数与通过阳离子交换膜的离子数的比值为 。
②从出口D导出的溶液是 (填化学式)。 senwe1年前1
senwe1年前1 -
 adjwv 共回答了16个问题
adjwv 共回答了16个问题 |采纳率87.5%(14分)(1)391 (2分)
(2)2CH 3 OH(l)+3O 2 (g)=2CO 2 (g)+4H 2 O(l); ΔH =(a +4b)kJ/mol(3分)(ΔH算错扣1分)
(3)①O 2 +2H 2 O+4e - =4OH - (2分) ;②B;(1分) 1.12 (2分)
(4)① 4OH - -4e - =2H 2 O+O 2 ↑(或2H 2 O—4e - = O 2 ↑+4H + )(2分);1:2(1分);② KOH(1分);
1年前查看全部
- 能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
 能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)⇌CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H2
如图所示是反应I反应过程中的能量变化曲线.
(1)由图可知反应I为______反应(选填”吸热、放热”),反应热△H1=______.
(2)反应I在一定体积的密闭容器中进行,能判断其是否达到化学平衡状态的依据是______.
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(CH3OH)
D.c(CO)=c(CH3OH)
(3)图中曲线______表示使用催化剂时反应的能量变化.
(4)一定条件下,向体积为2L的密闭容器中充入2mol CO2和6mol H2,一段时间后达到平衡状态,测得CH3OH(g)的物质的量为1mol,则此条件下该反应的化学平衡常数数K值=[4/27][4/27](用分数表示),若开始时充入2mol CH3OH(g) 和2mol H2O(g)达到相同平衡时CH3OH的转化率为______,若平衡后在充入4mol的N2,则c(CO2)是______.
(5)从绿色化学的角度比较上述两种方法,符合原子经济的是______.(填“Ⅰ”或“Ⅱ”) zgh2zcq1年前1
zgh2zcq1年前1 -
 2GTOS 共回答了18个问题
2GTOS 共回答了18个问题 |采纳率83.3%解题思路:(1)根据反应物总能量和生成物总能量的关系判断反应热;根据反应热等于正反应的活化能减去逆反应的活化能;
(2)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,据此解答,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(3)根据催化剂能降低反应的活化能;
(4)先根据三段式计算出平衡时各物质的浓度,利用各物质平衡的浓度来计算化学平衡常数,利用转化率定义计算CH3OH的转化率;根据等效平衡的从正向建立和逆向建立,转化率之和100%;根据恒容条件下,充入与反应无关的气体,压强增大,平衡不移动,各物质的浓度不变;
(5)原子经济性反应是原材料分子中的原子全部转变成所需产物,不产生副产物,实现零排放;(1)由图象可以看出反应物总能量大于生成物的总能量,则该反应的正反应为放热反应;反应热=419kJ/mol-510kJ/mol=-91 kJ/mol;
故答案为:放热;-91 kJ/mol;
(2)A.随反应进行气体的物质的量增大,压强增大,容器中压强不变,说明到达平衡状态,故A正确;
b.反应达到平衡状态时,各物质的浓度不变,混合气体中c(CO)不变说明到达平衡状态,故B正确;
c.不同物质表示的速率之比等于化学计量数之比,说明到达平衡状态,而v正(H2)=v逆(CH3OH)不等于化学计量数之比,未达平衡状态,故C正确;
d.反应始终按CO与氢气物质的量之比为1:1进行,c(H2)=c(CO)不能说明到达平衡,故D错误;
故答案为;AB;
(3)催化剂能降低反应的活化能,所以图中曲线b表示使用催化剂时反应的能量变化,故选:b;
(4)CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
开始(mol/L)1 3 0 0
转化(mol/L)0.5 1.5 0.5 0.5
平衡(mol/L) 0.51.5 0.5 0.5
则化学平衡常数K=[ 0.5× 0.5
0.5×1.53 =
4/27];
平衡时CH3OH的转化率为[ 1.5/3]×100%=50%,若开始时充入2mol CH3OH(g) 和2mol H2O(g)达到相同平衡与原平衡等效且等同,c(CO2)=0.5mol/L,转化率之和100%,所以平衡时CH3OH的转化率50%;恒容条件下,充入与反应无关的气体,压强增大,平衡不移动,各物质的浓度不变,c(CO2)=0.5mol/L,
故答案为:[4/27];50%;0.5mol/L;
(5)由题干中原材料分子中的原子全部转变成所需产物,不产生副产物,实现零排放,可知生成物质能有一种,即属于化合反应,反应物为多种,生成物为一种,故选:I;点评:
本题考点: 反应热和焓变;化学平衡状态的判断;化学平衡的计算.
考点点评: 本题主要考查反应热的计算、化学平衡的计算、化学平衡的判断、平衡常数、等效平衡等,难度中等,注意基础知识的掌握,注意(4)中对等效平衡规律的掌握.1年前查看全部
- 石油是一种重要的能源.以下解决能源短缺问题的方法不当的是( ) A.用木柴做燃料 B.用氢能源代替汽油 C.开发风能
石油是一种重要的能源.以下解决能源短缺问题的方法不当的是( ) A.用木柴做燃料 B.用氢能源代替汽油 C.开发风能 D.开发地热  枝先生1年前1
枝先生1年前1 -
 ifyksc 共回答了24个问题
ifyksc 共回答了24个问题 |采纳率95.8%石油虽然是-种重要能源,但是毕竟石油是不可再生的能源,人类正面临着石油短缺、油价上涨的等等困惑.所以寻求新能源是当务之急.所以目前综合利用太阳能、风能、氢能、地热能等等新能源,不仅可以弥补能源 的危机,而且发展前景非常大.但是乱砍伐树木,不仅导致水土流失,而且破坏生态环境,温室效应加急等等,弊大于利,此法不妥.
故选A.1年前查看全部
- (2013•湖南模拟)能源短缺是人类面临的重大问题,甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上一般采用下列两
(2013•湖南模拟)能源短缺是人类面临的重大问题,甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上一般采用下列两种反应合成甲醇:
反应I:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H1
反应II:CO(g)+2H2(g)⇌CH3OH(g)△H2
(1)上述反应符合“原子经济”原则的是______(填“Ⅰ”或“Ⅱ”).
(2)图中甲图表示用反应Ⅱ生产燃料甲醇反应过程中能量的变化情况;乙图表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间的变化情况.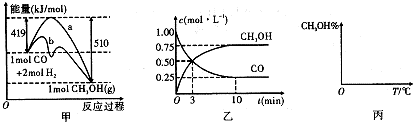
请回答下列问题.
①下列说法正确的是______(填字母序号).
a.在甲图中,曲线b表示使用了催化剂
b.起始充入的CO为2mol,从反应开始到达到平衡,v(H2)=0.075mol•L-1•min-1
c.增大CO的浓度,CO的转化率增大
d.容器中压强恒定时,说明反应已达平衡状态
e.保持温度和密闭容器的容积不变,再充入1mol CO和2mol H2,再次达到平衡时
的值会变小n(CH3OH) n(CO)
②该温度下CO(g)+2H2(g)⇌CH3OH(g)的化学平衡常数为______.若保持其他条件不变,将反应体系升温,则该反应的化学平衡常数______(填“增大”“减小”或“不变”).
③请在丙图所示坐标图中画出平衡时甲醇的百分含量(纵坐标)随温度(横坐标)的变化曲线,要求画出压强不同的两条曲线(在曲线上标出P1、P2且P1<P2).
(3)甲醇的一个重要作用是可以制燃料电池,常用KOH作电解质溶液,负极的电极反应式为:______.
(4)已知CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1.甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为______. ukpont391年前1
ukpont391年前1 -
 7pippo21 共回答了15个问题
7pippo21 共回答了15个问题 |采纳率93.3%解题思路:(1)“原子经济性”是指在化学品合成过程中,合成方法和工艺应被设计成能把反应过程中所用的所有原材料尽可能多的转化到最终产物中;
(2)①a、在甲图中,曲线b表示使用了催化剂,反应的活化能降低;
b、起始充入的CO为2mol,说明容器体积为2L,v(CO)=[1−0.25/10]mol•L-1•min-1,所以v(H2)=2v(CO)=0.15mol•L-1•min-1;
c、增加CO浓度,会促进氢气的转化,但本身的转化率降低;
d、该反应为反应前后压强不等的反应;
e、再充入1molCO和2molH2,体积不变,则压强增大,平衡正向移动,比值增大;
②根据三行式来求解;因温度升高,平衡逆向移动,反应物的浓度增大,生成物的浓度减少,平衡常数减小;
(3)负极发生氧化反应,在碱性介质中生成碳酸盐;
(4)根据CO和CH3OH的燃烧热先书写热方程式,再利用盖斯定律来分析甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式.(1)根据原子经济知,Ⅱ没有副产物,符合原子经济理念,中有副产物,不符合原子经济理念,故答案为:Ⅱ; (2)①a、在甲图中,曲线b表示使用了催化剂,反应的活化能降低,故选;b、起始充入的CO为2mol,说明容器体...
点评:
本题考点: 物质的量或浓度随时间的变化曲线;热化学方程式;化学电源新型电池;化学平衡常数的含义;化学平衡状态的判断.
考点点评: 本题考查化学平衡状态判断、化学平衡有关计算、影响化学平衡的因素、化学平衡图象等,难度中等.1年前查看全部
- 能源短缺是人类社会面临的重大问题,利用化学反应可实现多种形式的能量相互转化.请回答以下问题:
能源短缺是人类社会面临的重大问题,利用化学反应可实现多种形式的能量相互转化.请回答以下问题:
(1)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是旧键断裂和新键的形成过程.已知反应N2(g)+3H2(g)⇌2NH3(g)△H=-93kJ•mol-1.试根据表中所列键能数据,计算a 的数值为______kJ/mol.
(2)甲醇是一种可再生能源,具有广泛的开发和应用前景.已知在常压下有如下变化:化学键 H-H N-H N≡N 键能/kJ•mol-1 436 a 945
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=a kJ/mol
②H2O(g)=H2O(l)△H=b kJ/mol
写出液态甲醇完全燃烧生成二氧化碳和液态水的热化学方程式:______.
(3)可利用甲醇燃烧反应设计一个燃料电池.如下图1,用Pt作电极材料,用氢氧化钾溶液作电解质溶液,在两个电极上分别充入甲醇和氧气.
①写出燃料电池正极的电极反应式______.②若利用该燃料电池提供电源,与图1右边烧杯相连,在铁件表面镀铜,则铁件应是______极(填”A”或”B”);当铁件的质量增重6.4g时,燃料电池中消耗氧气的标准状况下体积为______L.
(4)如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图2装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾(电解槽内的阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过).
①该电解槽的阳极反应式为______,单位时间内通过阴离子交换膜的离子数与通过阳离子交换膜的离子数的比值为______.
②从出口D导出的溶液是______(填化学式). 舞朵朵1年前1
舞朵朵1年前1 -
 ee哦 共回答了16个问题
ee哦 共回答了16个问题 |采纳率93.8%解题思路:(1)依据化学反应的焓变=反应物键能总和-生成物键能总和计算;
(2)依据热化学方程式和盖斯定律计算所需热化学方程式;
(3)①甲醇燃料电池,甲醇在负极失电子发生氧化反应,碱性溶液中生成碳酸盐,正极是氧气得到电子发生还原反应生成氢氧根离子;
②依据电镀原理分析,待镀金属做阴极与电源负极相连,镀层金属做阳极与电源正极相连,含镀层金属离子的电解质溶液;依据电极反应和电子守恒计算得到;
(4)①电解硫酸钾溶液,电解池中阳极电极反应是溶液中氢氧根离子失电子生成氧气,阴离子交换膜和阳离子交换膜通过的离子根据电荷守恒分析计算;
②阴极附近溶液中氢离子得到电子生成氢气,附近水的电离平衡被破坏,氢氧根离子浓度增大,D处是氢氧化钾;(1)N2(g)+3H2(g)⇌2NH3(g)△H=-93kJ•mol-1,化学反应的焓变=反应物键能总和-生成物键能总和,所以得到-93KJ/mol=945KJ/mol+3×436KJ/mol-6×a,计算得到a=391KJ/mol;
故答案为:391;
(2)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=a kJ/mol
②H2O(g)=H2O(l)△H=b kJ/mol
①+②×4得到液态甲醇完全燃烧生成二氧化碳和液态水的热化学方程式:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=(a+4b) kJ/mol;
故答案为:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=(a+4b) kJ/mol;
(3)①用Pt作电极材料,用氢氧化钾溶液作电解质溶液,在两个电极上分别充入甲醇和氧气,甲醇在负极失电子在碱溶液中生成盐,氧气在正极得到电子生成氢氧根离子,正极的电极反应式为:O2+2H2O+4e-=4OH-;
故答案为:O2+2H2O+4e-=4OH-;
②利用该燃料电池提供电源,与图1右边烧杯相连,在铁件表面镀铜,则铁件做电解池的阴极,阴极与电源负极连接,装置图中与甲醇相连的B电极是阴极;当铁件的质量增重6.4g时,Cu2++2e-=Cu,电子转移0.2mol,燃料电池中消耗氧气的电极反应为:O2+2H2O+4e-=4OH-,依据电子守恒计算消耗氧气物质的量0.05mol,标准状况下体积=0.05mol×22.4L/mol=1.12L;
故答案为:B,1.12;
(4)①装置图分析,与电源正极相连的为阳极,溶液中氢氧根离子失电子生成氧气,电解槽的阳极反应式4OH--4e-=2H2O+O2↑,单位时间内通过阴离子交换膜的离子数与通过阳离子交换膜的离子数,电解硫酸钾溶液,阳极发生氧化反应,OH-被氧化生成O2,电极方程式为,SO42-通过阴离子交换膜向阳极移动,钾离子通过阳离子交换膜向阴极移动,由电荷守恒知钾离子数目大于硫酸根离子数目,通过的离子数之比1:2;
故答案为:4OH--4e-=2H2O+O2↑;1:2;
②阴极附近溶液中氢离子得到电子生成氢气,附近水的电离平衡被破坏,氢氧根离子浓度增大,D处是氢氧化钾;
故答案为:KOH;点评:
本题考点: 热化学方程式;化学电源新型电池;电解原理.
考点点评: 本题考查化学反应能量变化,热化学方程式娥盖斯定律的计算应用,原电池和电解池知识,为高考常见题型和高频考点,侧重于学生的分析能力和电化学知识的综合运用,注意把握电极的判断和电极方程式的书写,为解答该题的关键,结合两极转移电子相等计算,难度中等.1年前查看全部
- 以下解决能源短缺问题的方法不恰当的是( ) A.用木材作燃料 B.用液氢替代汽油 C.开发地热 D.开发风能
 LW-58121年前1
LW-58121年前1 -
 fool517 共回答了13个问题
fool517 共回答了13个问题 |采纳率69.2%A、用木材作燃料,会导致水土流失、破坏生态环境、加剧温室效应等,故方法不恰当.
B、C、D、利用太阳能、风能、氢能、地热能等新能源,可以减少大气污染,解决能源短缺危机.
故选A.1年前查看全部
- 下列说法中正确的是( )A.自然界的能量是守恒的,所以不存在能源短缺B.虽然能源的利用过程中有能量耗散,但自然界的能量
下列说法中正确的是( )
A.自然界的能量是守恒的,所以不存在能源短缺
B.虽然能源的利用过程中有能量耗散,但自然界的能量是守恒的
C.隐形飞机就是人眼看不见的飞机
D.电容器具有“通直流,隔交流”的作用 重走回头路1年前1
重走回头路1年前1 -
 uu小琪 共回答了21个问题
uu小琪 共回答了21个问题 |采纳率85.7%解题思路:能量既不能凭空产生也不能凭空消失,总是由一种能量转化为另一种能量,在转化的过程中能的总量保持不变.只有高品质的能量才能利用;在利用过程中能量会耗散,品质变低;隐形飞机是指雷达搜不到;电容器具有“通交流,隔直流”的作用.A、自然界的能量是守恒的,但能量的品质高了能利用,低了不能利用,故要节约能源,故A错误
B、能源在利用过程中有能量耗散,品质降低,但自然界的能量是守恒;故B正确;
C、隐形飞机是指雷达搜不到,故C错误;
D、电容器具有“通交流,隔直流”的作用,故D错误;
故选:B点评:
本题考点: 能量守恒定律;能源的开发和利用;电容.
考点点评: 考查了能量守恒即利用,能源具有较高的品质一但利用品质变低,不能再用,要节约能源,解释一些现象.1年前查看全部
- (2009•常德模拟)随着世界经济的快速发展,能源短缺问题日显突出,近期油价不断攀升,已对各国人民的日常生活造成了各种影
 (2009•常德模拟)随着世界经济的快速发展,能源短缺问题日显突出,近期油价不断攀升,已对各国人民的日常生活造成了各种影响.如图所示排长队等待加油的情景已经多次在世界各地发生,能源成为困扰世界经济发展的重大难题之一,下列有关能量转化的说法中正确的是( )
(2009•常德模拟)随着世界经济的快速发展,能源短缺问题日显突出,近期油价不断攀升,已对各国人民的日常生活造成了各种影响.如图所示排长队等待加油的情景已经多次在世界各地发生,能源成为困扰世界经济发展的重大难题之一,下列有关能量转化的说法中正确的是( )
A.不可能从单一热源吸收热量并把它全部用来做功,而不引起其它的变化
B.只要对内燃机不断改进,就可以把内燃机得到的全部内能转化为机械能
C.满足能量守恒定律的物理过程都能自发的进行
D.外界对物体做功,物体的内能必然增加 零点一度011年前1
零点一度011年前1 -
 modestman 共回答了22个问题
modestman 共回答了22个问题 |采纳率100%解题思路:先熟悉理解热力学第二定律的两种表述然后进行判断A、热力学第二定律有不同的表述:不可能把热从低温物体传到高温物体而不产生其他影响;不可能从单一热源取热使之完全转换为有用的功而不产生其他影响;不可逆热力学过程中熵的增量总是大于零.故A正确,B错误.
C、满足能量守恒定律不满足热力学第二定律的物理过程也不能自发进行,故C错误;
D、根据热力学第一定律,改变内能的方式有两种:做功和热传递,外界对物体做功,若物体同时向外放热,则物体的内能有可能减少,故D错误.
故选:A.点评:
本题考点: 能量守恒定律.
考点点评: 本题关键熟悉热力学第二定律的各种表述,能够明确热力学第二定律的本质.1年前查看全部
- 能源短缺是人类面临的重大问题之一.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上合成甲醇一般采用以下反应:CO(
能源短缺是人类面临的重大问题之一.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上合成甲醇一般采用以下反应:CO(g)+2H 2 (g)⇌CH 3 OH(g)+Q
下表所列数据是上述反应在不同温度下的化学平衡常数(K)
(1)在一定条件下将2molCO和6molH 2 充入2L的密闭容器中发生反应,5分钟后测得c(H 2 )=1.5mol/L,则此段时间内的反应速率(用CH 3 OH表达)______mol/(L•min).温度 250℃ 300℃ 350℃ K 2.041 0.270 0.012
(2)由表中数据分析可知,Q______0(填“>”、“<”或“=”).其它条件不变的情况下,若压缩容器的体积,则平衡______移动(“向正反应方向”“向逆反应方向”或“不”),化学平衡常数K______(填“增大”、“减小”或“不变”).
(3)在体积一定的密闭容器中,能说明该反应已处于化学平衡状态的是______(填编号).
a.V 正 (CO)=1/2V 正 (H 2 )b.混合气体的密度保持不变
c.反应体系中的热效应不再变化d.c(CO):c(CH 3 OH)=1:1
(4)寻找到合适的催化剂是实现反应工业化的关键.该反应使用催化剂无法实现的目标是______(填编号).
a.提高单位时间内甲醇的产量b.增大混合气体中甲醇的体积分数
c.缩短达到平衡所需时间d.提高一氧化碳的转化率. smile咿人1年前1
smile咿人1年前1 -
 他家maomao 共回答了23个问题
他家maomao 共回答了23个问题 |采纳率87%(1)依据化学平衡三段式列式得到
CO(g)+2H 2 (g)⇌CH 3 OH(g)
起始量(mol) 260
变化量(mol)1.5 31.5
5分钟量(mol) 0.5 2L×1.5mol/L=3mol 1.5
用CH 3 OH表达的反应速率=
1.5mol
2L
5min =0.15mol/L•min,
故答案为:0.15;
(2)表中数据分析可知随温度升高,平衡常数K减小,说明温度升高,平衡逆向进行,所以正向是放热反应,Q>>0,反应前后气体体积减小,依据平衡移动原理,增大压强平衡向气体体积减小的分析进行,所以压缩体积是增大压强,平衡正向进行;平衡常数琐碎温度变化,不随浓度、压强等因素变化,所以K不变,
故答案为:>;向正反应方向;不变;
(3)反应达到平衡的标志是正逆反应速率相同,各组分含量保持不变;
a.V 正 (CO)=1/2V 正 (H 2 ),正反应速率之比等于化学方程式中 计量数之比,仅表示反应正向进行,不能说明反应达到平衡,故a错误;
b.混合气体的密度保持不变,混合气体在乙定容密闭容器中进行,质量守恒,体积不变,反应过程中混合气体的密度始终不变,故b错误;
c.反应体系中的热效应不再变化,反应达到平衡反应的热量变化一定,平衡发生移动,反应的热量发生改变,证明反应达到平衡,故C正确;
d.c(CO):c(CH 3 OH)=1:1浓度相同,和起始量,变化量等有关,与平衡无直接关系,不能做平衡的标志,故d错误;
故答案为:c;
(4)寻找到合适的催化剂是实现反应工业化的关键,催化剂降低反应活化能,增大反应速率,但不改变化学平衡,
a.提高单位时间内甲醇的产量,反应速率增大,单位时间内生成甲醇增大,故a不符合;
b.增大混合气体中甲醇的体积分数,催化剂不改变化学平衡,体积分数不变,故b符合;
c.缩短达到平衡所需时间,催化剂加快反应速率,缩短到达平衡的时间,故c不符合;
d.提高一氧化碳的转化率,催化剂不改变平衡,反应物的转化率不变,故d符合;
故答案为:bd.1年前查看全部
- 能源短缺是人类社会面临的重大问题,而“原子经济”就是反应物的原子全部转化为期望的最终产物。甲醇是一种可再生能源,具有广泛
能源短缺是人类社会面临的重大问题,而“原子经济”就是反应物的原子全部转化为期望的最终产物。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H 2 (g) CH 3 OH(g) Δ H 1
CH 3 OH(g) Δ H 1
反应II: CO 2 (g) + 3H 2 (g) CH 3 OH(g) + H 2 O(g) Δ H 2
CH 3 OH(g) + H 2 O(g) Δ H 2
①上述反应符合“原子经济”原则的是 (填“I”或“Ⅱ”)。
②某温度下,将2 mol CO和6 mol H 2 充入2L的密闭容器中,充分反应,达到平衡后,测得 c (CO)= 0.2 mol/L,则H 2 的转化率为 。
(2)已知在常温常压下:
① 2CH 3 OH(l) + 3O 2 (g) = 2CO 2 (g) + 4H 2 O(g) Δ H =-1275.6 kJ/mol
② 2CO (g)+ O 2 (g) = 2CO 2 (g)Δ H =-566.0 kJ/mol
③ H 2 O(g) = H 2 O(l)Δ H =-44.0 kJ/mol
请计算1 mol甲醇不完全燃烧生成1 mol一氧化碳和液态水放出的热量为 255103211年前1
255103211年前1 -
 如花星星 共回答了18个问题
如花星星 共回答了18个问题 |采纳率83.3%(1)① I(2分)②53.3%(各2分)(2) 442.8 kJ(3分
(1)①反应I中反应物全部进入生成物,所以符合“原子经济”原则的是I。
② c (CO)= 0.2 mol/L,则消耗CO的浓度是1mol/L-0.2mol/L=0.8mol/L.消耗氢气是1.6mol/L,所以氢气转化率是
(2)①-②+③×4即得到2CH 3 OH(l) +2O 2 (g) = 2CO(g) + 4H 2 O(l),所以该反应的反应热是1275.6 kJ/mol+566 kJ/mol-44 kJ/mol×4=-885.6 kJ/mol。1 mol甲醇不完全燃烧生成1 mol一氧化碳和液态水放出的热量为442.8 kJ。1年前查看全部
- 在现在这个能源短缺的情况下,你认为我们应该采取 哪些措施来节约能源,请用英语回答
 tongrentang1年前1
tongrentang1年前1 -
 wangjun112610 共回答了26个问题
wangjun112610 共回答了26个问题 |采纳率80.8%First,we should save the current energy sources.For example,to take bus more instead of driving a car.Recycle the used materials like paper,bottles.
At the same time,we should encourage to explore new energy technology,for example,we can take advantage of limitless sources of sun,water or wind to produce electricity.1年前查看全部
- 20世纪以来,随着科学技术的迅速发展,人类创造了空前的物质财富.与此同时,能源的过度开发和消耗导致全球性的能源短缺和环境
20世纪以来,随着科学技术的迅速发展,人类创造了空前的物质财富.与此同时,能源的过度开发和消耗导致全球性的能源短缺和环境污染.从原料来源和对环境的影响考虑,下列能源中,最具开发前景的能源是( )
A. 天然气
B. 石油
C. 太阳能
D. 煤 吃饱喝足谁都不服1年前1
吃饱喝足谁都不服1年前1 -
 清宛 共回答了18个问题
清宛 共回答了18个问题 |采纳率88.9%解题思路:从原料的来源和对空气的影响考虑,太阳能是新型能源,其来源是无限的,且不会对空气造成污染,是最有开发前景的能源.而煤、石油、天然气是化石燃料,其来源是有限的,燃烧会释放出二氧化硫等有毒气体.A、天然气是化石燃料,其来源是有限的,燃烧会释放出二氧化碳温室气体.故错误
B、石油是化石燃料,其来源是有限的,燃烧会释放出二氧化硫等有毒气体.故B错误;
C、太阳能是新型能源,其来源是无限的,且不会对空气造成污染,是最有开发前景的能源.故C正确;
D、煤是化石燃料,其来源是有限的,燃烧会释放出二氧化硫等有毒气体.故错误;
故选C.点评:
本题考点: 新能源.
考点点评: 本题考查资源的综合利用和新能源的开发.太阳能是新型能源,其来源是无限的,且不会对空气造成污染,是最有开发前景的能源.1年前查看全部
- 限制长三角和珠三角经济发展的共同局限因素是水旱灾害还是能源短缺?
 OnlyKnight1年前1
OnlyKnight1年前1 -
 雨过天青软烟罗 共回答了29个问题
雨过天青软烟罗 共回答了29个问题 |采纳率86.2%能源短缺1年前查看全部
大家在问
- 1求过程,必采纳,用四年级的方法解答,要用分步算式题目是生产小组计划,每天生产40个零件30天完成任务,实际提前六天完成任
- 2How is the weather it is cold and ____(snow)
- 3比喻用一个好的去填补一个坏的并不能改变解决根本问题的成语,急求
- 4背古诗、古文背的特别慢怎么办?
- 5340克等于多少千克.5.2吨等于多少千克.米等于多少千米
- 6已知函数y=x平方+6x+11,把它的图像平移向量a,得到y=x平方的图像,求向量a.
- 7一个数的25%减少0.4后得3.6,求这个数.
- 8后鼻韵母有哪些,整体认读音节有哪些?
- 9-Excuse me.I want to buy some stamps.Where can I find a post
- 10已知a∈(0,2分之派),cos a=3分之√3,则cos(a+6分之派)等于
- 11英语天才来帮忙(初中)not..any more no more not..any longer no longer的区
- 12“忽如一夜春风来,千树万树梨花开”诗句在《呼风唤雨的世纪》课文中起什么作用?
- 13长方形面积公式,圆形面积公式,间距计算
- 14英语翻译亲爱的哥哥:圣诞快乐!生日快乐!你打算骗我到什么时候呢?我都已经有五个嫂子了,你还要骗我吗?李玲玲人挺好的,你要
- 15对于理想气体的绝热过程 有PV^r=常量,r=Cp/Cv

