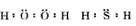热力学标准态是指总压强还是各气体分压强
 thjmhg2022-10-04 11:39:541条回答
thjmhg2022-10-04 11:39:541条回答(s)+B(g)+C(g)=D(g)
这个反应的热力学标准态是A表面的压强为100000Pa,B C D 的分压均为100000Pa 标态下定温定压下反应进度为1MOL时测出来的焓变是标准摩尔焓变
但我觉得这是不可能做到的
因为当每个气体分压都是100000Pa时,系统的总压是300000Pa 那么固体表面的压强就是300000pa 与热力学标准态中固体表面压强为100000Pa 相矛盾

已提交,审核后显示!提交回复
共1条回复
 alex911us 共回答了13个问题
alex911us 共回答了13个问题 |采纳率84.6%- “当每个气体分压都是100000Pa时,系统的总压是300000Pa”
这个说法是错误的,建议研究一下气体压强产生的原因和实质,这是不能叠加的
如果一个系统中每部分都是100kpa,那么总压强还是100kpa - 1年前
相关推荐
- 已知:在热力学标准态(298K,1.01*10的5次幂千帕)下,由稳定的单质发生反应生成1摩尔化合物的反应热称为该反应物
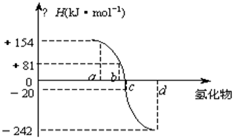
已知:在热力学标准态(298K,1.01*10的5次幂千帕)下,由稳定的单质发生反应生成1摩尔化合物的反应热称为该反应物的生成热(ΔH).图为氧族元素的氢化物a,b,c,d的生成热数据示意图.
(1)非金属元素氢化物的稳定性与氢化物的反应热ΔH的关系是( )
(2)硒化氢在热力学标准态下,发生分解反应的热化学方程式为( )
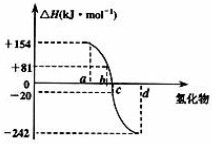
《图中为:横轴为氢化物,竖轴为ΔH/千焦每摩尔,a的对应的ΔH为+154.b对应的ΔH为+81.c对应的ΔH为-20.d对应的ΔH为-242
为什么?
我没看明白图
可不可以给个详解
 做发财梦1年前4
做发财梦1年前4 -
 xubo617609 共回答了14个问题
xubo617609 共回答了14个问题 |采纳率92.9%(1)氢化物稳定性越强,△H越小
(2)H2Se(g) === H2(g) + Se(s) △H=-81kJ・mol-11年前查看全部
- 已知:在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成
已知:在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H).图为氧族元素氢化物a、b、c、d的生成热数据示意图.
试回答下列问题:
(1)归纳:非金属元素氢化物的稳定性与氢化物的反应热△H的关系______.
(2)硒化氢在热力学标准态下,发生分解反应的热化学反应方程式:______. 俯冲1年前1
俯冲1年前1 -
 猪是老虎的LG 共回答了19个问题
猪是老虎的LG 共回答了19个问题 |采纳率94.7%解题思路:(1)根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定;而根据热力学,能量越低越稳定,以此进行判断.
(2)根据图象判断出abcd对应的各氢化物,根据焓变的大小书写热化学方程式.(1)非金属元素氢化物的稳定性与生成1mol氢化物时的△H的关系为:根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定;而根据热力学,能量越低越稳定.a、b、c、d依次为H2Te、H2Se、H2S、H2O,
故答案为:非金属元素氢化物越稳定,△H越小,反之亦然;
(2)由(2)可知,b为H2Se的生成热数据,则H2Se分解放热,且△H=-81kJ/mol,
所以H2Se发生分解反应的热化学反应方程式为H2Se(g)═Se(s)+H2(g)△H=-81 kJ•mol-1,
故答案为:H2Se(g)═Se(s)+H2(g)△H=-81 kJ•mol-1点评:
本题考点: 热化学方程式;反应热和焓变.
考点点评: 本题考查化学反应与能量变化,题目难度不大,本题注意从图象判断各种氢化物的种类为解答该题的关键.1年前查看全部
- 已知:在热力学标准态(298 K、1.01×10 5 Pa)下,由稳定的单质发生反应生成1 mol化合物的反应热叫该化合
已知:在热力学标准态(298 K、1.01×10 5 Pa)下,由稳定的单质发生反应生成1 mol化合物的反应热叫该化合物的生成热(ΔH)。下图为氧族元素氢化物a、b、c、d的生成热数据示意图。试完成下列问题:
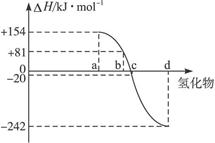
(1)写出氧族元素中含有18e - 的两种氢化物的电子式___________________________。
(2)请你归纳:非金属元素氢化物的稳定性与氢化物的反应热ΔH的关系__________。
(3)写出硒化氢在热力学标准态下,发生分解反应的热化学反应方程式:______。 潇月10201年前1
潇月10201年前1 -
 变化不变 共回答了15个问题
变化不变 共回答了15个问题 |采纳率86.7%(1)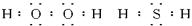
(2)非金属元素氢化物越稳定,ΔH越小,反之亦然
(3)H 2 Se(g)====Se(s)+H 2 (g);ΔH="-81" kJ·mol -1
本题以元素化合物为载体,结合所给信息考查反应热与物质稳定性的关系。
一般来说:物质本身具有的能量越低,物质越稳定。换言之,相同状况下,生成一定量的某物质放出的热量越多,物质越稳定。所以,ΔH越小,非金属元素氢化物越稳定。a、b、c、d对应的氢化物分别为:碲化氢、硒化氢、硫化氢和水。
本题新意之一在题干:以大学无机化学知识作为信息,考查学生阅读理解能力和自学能力,同时也是对心理素质的考验。与高等知识点结合出题将是一个新趋势。本题新意之二在解题思路:应用新信息解题是出题人的意图,但本题应用我们学过的非金属性强弱判断方法之一也可轻松解题。信息又似乎是一种干扰,充分考验考生对知识的掌握与灵活应用程度。题目不难,会不会做全在于是题目左右你还是你把握题目。1年前查看全部
- 已知:在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成
 已知:在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H).下图为氧族元素氢化物a、b、c、d的生成热数据示意图.试回答下列问题:
已知:在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H).下图为氧族元素氢化物a、b、c、d的生成热数据示意图.试回答下列问题:
(1)写出氧族元素中含有18e-的两种氢化物的电子式______.
(2)请你归纳:非金属元素氢化物的稳定性与氢化物的生成热△H的关系______
(3)写出硫化氢在热力学标准态下,发生分解反应的热化学反应方程式:______. mimiv1年前1
mimiv1年前1 -
 zhang0911chen 共回答了16个问题
zhang0911chen 共回答了16个问题 |采纳率87.5%解题思路:(1)氧族元素有O、S等元素,含有18e-的物质的有H2O2、H2S等物质;
(2)根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定;而根据热力学,能量越低越稳定,以此进行判断;
(3)根据图象判断出abcd对应的各氢化物,根据焓变的大小书写热化学方程式.(1)氧族元素有O、S等元素,含有18e-的物质的有H2O2、H2S等物质,电子式分别为:
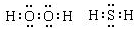 ,
,
故答案为: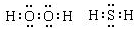 ;
;
(2)非金属元素氢化物的稳定性与生成1mol氢化物时的△H的关系为:根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定;而根据热力学,能量越低越稳定.a、b、c、d依次为H2Te、H2Se、H2S、H2O.
故答案为:非金属元素氢化物越稳定,△H越小,反之亦然;
(3)由(2)可知,c为硫化氢的生成热数据,则硫化氢分解吸热,且△H=+20kJ/mol,
所以H2S发生分解反应的热化学反应方程式为H2S(g)=S(s)+H2(g);△H=+20kJ/mol,
故答案为:H2S(g)=S(s)+H2(g);△H=+20kJ/mol.点评:
本题考点: 热化学方程式;电子式;化学反应中能量转化的原因.
考点点评: 本题考查化学反应与能量变化,题目难度不大,本题注意从图象判断各种氢化物的种类为解答该题的关键.1年前查看全部
- 已知:在热力学标准态(298K、1.01×10 5 Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的
已知:在热力学标准态(298K、1.01×10 5 Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H).下图为氧族元素氢化物a、b、c、d的生成热数据示意图.试回答下列问题:
(1)写出氧族元素中含有18e - 的两种氢化物的电子式______.
(2)请你归纳:非金属元素氢化物的稳定性与氢化物的生成热△H的关系______
(3)写出硫化氢在热力学标准态下,发生分解反应的热化学反应方程式:______.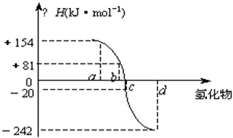
 红心儿1年前1
红心儿1年前1 -
 leejiasbs 共回答了20个问题
leejiasbs 共回答了20个问题 |采纳率95%(1)氧族元素有O、S等元素,含有18e - 的物质的有H 2 O 2 、H 2 S等物质,电子式分别为: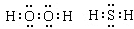
,
故答案为: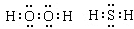
;
(2)非金属元素氢化物的稳定性与生成1mol氢化物时的△H的关系为:根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定;而根据热力学,能量越低越稳定.a、b、c、d依次为H 2 Te、H 2 Se、H 2 S、H 2 O.
故答案为:非金属元素氢化物越稳定,△H越小,反之亦然;
(3)由(2)可知,c为硫化氢的生成热数据,则硫化氢分解吸热,且△H=+20kJ/mol,
所以H 2 S发生分解反应的热化学反应方程式为H 2 S(g)=S(s)+H 2 (g);△H=+20kJ/mol,
故答案为:H 2 S(g)=S(s)+H 2 (g);△H=+20kJ/mol.1年前查看全部
- 1.(本小题5分)在热力学标准态,298K时电对Ag+/Ag(oA=0.80V)和电对Fe3+/Fe2+
1.(本小题5分)在热力学标准态,298K时电对Ag+/Ag(oA=0.80V)和电对Fe3+/Fe2+(oA=0.77V组成
1.(本小题5分)在热力学标准态,298K时电对Ag+/Ag(joA=0.80V)和电对Fe3+/Fe2+(joA=0.77V组成原电池,求:
该电池反应的标准平衡常数Ko298K;
当c(Ag+)=0.010 mol×L-1,c(Fe3+)=c(Fe2+)=0.10mol×L-1时电池的电动势. wt361241年前1
wt361241年前1 -
 juenianxuan 共回答了15个问题
juenianxuan 共回答了15个问题 |采纳率80%参考答案x09付出不一定有收获,努力了就值得了.1年前查看全部
- 已知:在热力学标准态(298 K、1.01×10 5 Pa)下,由稳定的单质发生反应生成1 mol化合物的反应热叫该化合
已知:在热力学标准态(298 K、1.01×10 5 Pa)下,由稳定的单质发生反应生成1 mol化合物的反应热叫该化合物的生成热(ΔH)。下图为氧族元素氢化物a、b、c、d的生成热数据示意图。试回答下列问题 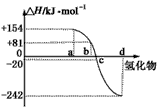
(1)归纳:非金属元素氢化物的稳定性与氢化物的反应热ΔH的关系____________。
(2)硒化氢在热力学标准态下,发生分解反应的热化学反应方程式:__________________________。 苇芒花1年前1
苇芒花1年前1 -
 此去经年13 共回答了17个问题
此去经年13 共回答了17个问题 |采纳率82.4%(1)非金属元素氢化物越稳定,ΔH越小,反之亦然
(2)H 2 Se(g)=Se(s)+H 2 (g) ΔH=-81 kJ·mol -11年前查看全部
- 已知:在热力学标准态(298K、1.01×105 Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生
已知:在热力学标准态(298K、1.01×105 Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H)。下图为氧族元素氢化物a、b、c、d的生成热数据示意图。试回答下列问题:
(1)写出氧族元素中含有18e - 的两种氢化物的电子式____。
(2)请你归纳:非金属元素氢化物的稳定性与氢化物的反应热△H的关系____。
(3)写出硒化氢在25℃、101kPa下,发生分解反应的热化学反应方程式:________。
 迷失的羔羊5201年前1
迷失的羔羊5201年前1 -
 烛之舞- 共回答了23个问题
烛之舞- 共回答了23个问题 |采纳率95.7%1年前查看全部
大家在问
- 1下列说法中不正确的是 A.分子式为C 4 H 10 O并能与金属钠反应放出氢气的有机化合物有5种 B.可以用酸性高锰酸钾
- 2用有“逸”字的词语来形容莲花!或者荷叶 莲蓬
- 3请问:They were worried.
- 4英语翻译还有一个问题,我的退休工资只有1423元,可是我有两处房产对外出租,年租金在24万,我也准备了产权证和土地证原件
- 5will you please句式的问题
- 6两条异面直线的公垂线问题任意两条异面直线的公垂线 与公垂线平行的不也和另两条直线垂直 这算不算另一条公垂线 或者反过来说
- 7在数学综合实践活动课上,老师只给各活动小组教学用直角三角板一个、皮尺一条(皮尺长度不够直接测河宽),测量如下图所示小河的
- 8设函数f(x)在[0,1]上连续且非负,而f(0)=f(1)=0,试证:对于(0,1)内的任意实数l,必存在一点小x.属
- 9有甲乙两筐苹果,甲筐比乙筐多18个,如果从乙筐取出12个放久甲筐,这时甲筐是乙筐的2倍.甲筐原有多少个苹果.
- 10英语选择题目的疑惑This dictionary isn't mine._______ can it be?A.who
- 11等体积的10%和30%的硫酸混合后,为什么质量分数小于20%?
- 123.29*199+3.29简便法
- 13多读书的好处 辩论会
- 14英语中asl是什么意思?要详细点
- 15一个等腰梯形的上底是8厘米,下底是6厘米,一条腰长7厘米,围成这个等腰梯形至少要______厘米长的铁丝.