水的离子积问题99°C时,水中c(H+)=1×10^-6mol/L,此时水的离子积是
 lookbacked2022-10-04 11:39:543条回答
lookbacked2022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 清风00171 共回答了18个问题
清风00171 共回答了18个问题 |采纳率100%- 水电离出的H+和OH-一样.所以是1×10^-12
- 1年前
 qsw520 共回答了45个问题
qsw520 共回答了45个问题 |采纳率- c(H+)=c(OH-)
Kw=1×10^-12 - 1年前
 qwfy831010 共回答了17个问题
qwfy831010 共回答了17个问题 |采纳率76.5%- Kw=1×10-12
- 1年前
相关推荐
- 酸性溶液中H和OH离子的浓度积为什么是1*10负14次方?(不要回答水电离出来的都是这么多,是总的离子积)
 听海78781年前1
听海78781年前1 -
 迦梨陀娑 共回答了14个问题
迦梨陀娑 共回答了14个问题 |采纳率100%水有电离平衡,即勒沙特列原理,当水中H+增多时,水的电离平衡向减弱这种效应的方向移动,即电离出离子的量变少.最终近似10^-141年前查看全部
- (1)某温度(t℃)时,水的离子积为Kw=1×10-13,在此温度下,某溶液中由水电离出来的H+浓度为1×10-10mo
(1)某温度(t℃)时,水的离子积为Kw=1×10-13,在此温度下,某溶液中由水电离出来的H+浓度为1×10-10mol/L,则该溶液的pH可能为______或______.
(2)若温度为25℃时,体积为Va、pH=a的H2SO4溶液与体积为Vb、pH=b的NaOH溶液混合,恰好中和.已知Va>Vb,且a=0.5b,则a的取值范围[14/3]<a<7[14/3]<a<7.
(3)若将此温度(t℃)下,pH=11的苛性钠溶液m L与pH=1的稀硫酸溶液nL混合(假设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比,并比较溶液中各离子的浓度大小.
①若所得混合液为中性,则m:n=______;此溶液中各种离子的浓度由大到小排列顺序是______.
②若所得混合液的pH=2,则m:n=______;此溶液中各种离子的浓度由大到小排列顺序是______. tommy43061年前1
tommy43061年前1 -
 一笑随风s 共回答了15个问题
一笑随风s 共回答了15个问题 |采纳率93.3%解题思路:(1)酸或碱抑制水电离,含有弱根离子的盐促进水电离;
(2)硫酸和氢氧化钠都是强电解质,二者恰好反应,则氢离子的物质的量等于氢氧根离子的物质的量;
(3)若将此温度(t℃)下,pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合,此时NaOH溶液中c(OH-)=0.01mol/L,稀硫酸溶液中c(H+)=0.1mol/L,根据反应后溶液的酸碱性判断反应的程度,以此计算.(1)水的离子积为Kw=1×10-13,则纯水中氢离子浓度=5×10-7mol/L,在此温度下,某溶液中由水电离出来的H+浓度为1×10-10mol/L<5×10-7mol/L,所以该溶质抑制水电离,为酸或碱,如果为酸,则溶液的pH=3,如果是碱,则溶液的pH=10,
故答案为:3或10;
(2)体积为Va、pH=a的H2SO4溶液与体积为Vb、pH=b的NaOH溶液混合,恰好中和,则硫酸中氢离子的物质的量=碱中氢氧根离子的物质的量,所以10-a×Va=10 b-14×Vb,a=0.5b,10-a×Va=10 2a-14×Vb,Va>Vb,
0<
Vb
Va<1,所以得[14/3]<a<7,
故答案为:[14/3]<a<7;
(3)若将此温度(t℃)下,pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合,此时NaOH溶液中c(OH-)=
10−13
10−11mol/L=0.01mol/L,稀硫酸溶液中c(H+)=0.1mol/L,则
①若所得混合液为中性,则有0.01m=0.1n,m:n=10:1,混合溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(Na+)>c(SO4 2- ),该溶液为盐溶液,硫酸根离子浓度大于氢离子浓度,所以离子浓度大小顺序是:c(Na+)>c(SO4 2-)>c(H+)=c(OH-),
故答案为:10:1; c(Na+)>c(SO4 2- )>c(H+)=c(OH-);
②若所得混合液的pH=2,则有[0.1n−0.01m/m+n]=0.01,m:n=9:2,溶液呈酸性,所以c(H+)>c(OH-),
溶液中氢离子浓度为0.01mol/L,硫酸根离子浓度为[0.05×2/2+9]mol/L=0.009mol/L,所以氢离子浓度大于硫酸根离子浓度,根据物料守恒知,c(SO4 2- )>(Na+),氢氧根离子浓度最小,所以离子浓度大小顺序是c(H+)>c(SO4 2- )>c(Na+)>c(OH-),
故答案为:9:2;c(H+)>c(SO4 2- )>c(Na+)>c(OH-).点评:
本题考点: 弱电解质在水溶液中的电离平衡;酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查酸碱混合的定性判断,题目难度中等,注意水的离子积常数的计算,把握相关计算公式的运用.1年前查看全部
- 化学反应原理__________已知AnBm的离子积为[c(Am+)]n[c(Bn-)]
化学反应原理__________已知AnBm的离子积为[c(Am+)]n[c(Bn-)]
已知AnBm的离子积为[c(Am+)]n[c(Bn-)]m,若某温度下Ca(OH)2的溶解度为0.74g,设饱和溶液的密度为1g·mL-1,其离子积约为______________. xiangligoo1年前1
xiangligoo1年前1 -
 偶要飘红5 共回答了15个问题
偶要飘红5 共回答了15个问题 |采纳率86.7%设溶液有1 L,则质量为1000 g,由于浓度为0.74/100.74=0.735%,所以溶质质量约为7.35 g,折合物质的量为0.1 mol.由于氢氧化钙是强电解质,完全电离,所以
[Ca2+]=0.1 mol/L,[OH-]=0.2 mol/L
离子积=[Ca2+]·[OH-]^2=0.1·0.2^2=4·10^-31年前查看全部
- 某温度下,水的离子积约为10-12,将Va L pH=2的硫酸溶液与Vb L p
某温度下,水的离子积约为10-12,将Va L pH=2的硫酸溶液与Vb L pH=11的NaOH溶液混合,若混合溶液的pH=10,体积是(Va+Vb) L,则Va:Vb为( )
A.2:11
B.2:9
C.11:2
D.9:2 shen351年前1
shen351年前1 -
 obnaij 共回答了15个问题
obnaij 共回答了15个问题 |采纳率100%解题思路:水的离子积常数Kw=10-12,即PH=6时,溶液呈中性,pH=2的硫酸溶液中氢离子浓度=10-2mol/L,pH=11的氢氧化钠溶液中氢氧根离子浓度=
mol/L=0.1mol/L,混合溶液的pH=10,溶液呈碱性,说明氢氧化钠过量,10−12 10−11
混合溶液中氢氧根离子浓度=
mol/L=0.01mol/L,根据混合溶液中氢氧根离子浓度=10−12 10−10
计算.n(OH−)−n(H+) V(酸)+V(碱) 水的离子积常数Kw=10-12,即PH=6时,溶液呈中性,pH=2的硫酸溶液中氢离子浓度═10-2mol/L,pH=11的氢氧化钠溶液中氢氧根离子浓度=
10−12
10−11mol/L=0.1mol/L,混合溶液的pH=10,溶液呈碱性,说明氢氧化钠过量,
混合溶液中氢氧根离子浓度=
10−12
10−10mol/L=0.01mol/L,混合溶液中氢氧根离子浓度=
n(OH−)−n(H+)
V(酸)+V(碱)=
0.1×Vb−0.01×Va
Va+Vb=0.01mol/L,则Va:Vb=9:2,故选D.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查了混合溶液PH的计算,难度不大,能灵活运用水的离子积常数是解本题的关键,注意该题中中性溶液的PH不等于7而是为6,很多学生往往定向思维而导致错误.1年前查看全部
- 已知AnBm的离子积=C(Am+)乘C(Bn-),式中C(Am+)的n次和C(Bn-)的m次表示离子的物质的量浓度
已知AnBm的离子积=C(Am+)乘C(Bn-),式中C(Am+)的n次和C(Bn-)的m次表示离子的物质的量浓度
在某温度下,Ca(oH)2 的溶解度为0.74克,其饱和溶液密度设为1g/ml,其离子积为多少? 少不识愁1年前1
少不识愁1年前1 -
 紫贝菜 共回答了15个问题
紫贝菜 共回答了15个问题 |采纳率86.7%100g水溶0.74g得100.74g溶液,体积为0.10074ml,n(Ca(oH)2)=0.74/74=0.01mol
C(Ca﹢)=0.01/0.10074mol/L C(oH-)=0.02/0.10074mol/L
然后,离子积我还是没想起是什么,不过你应该会了1年前查看全部
- D2O的离子积为1*10^-12,将pD=4的DCl的重水溶液稀释100倍,所得溶液pD=多少?
D2O的离子积为1*10^-12,将pD=4的DCl的重水溶液稀释100倍,所得溶液pD=多少?
答案说是c(D+)=10^-6+10^-6=2*10^-6,-lgc(D+)=5.7了,我就觉得这里有点怪!为什么是10^-6+10^-6?溶液稀释后由酸电离出来的D+为10^-6,重水本来又是10^-6,那加在一起不会抑制电离吗?就不应该是10^-6+10^-6了!请你说明这里.不懂的别乱吹、 佳佳爱轩轩1年前1
佳佳爱轩轩1年前1 -
 Jeffreyliu1982 共回答了16个问题
Jeffreyliu1982 共回答了16个问题 |采纳率87.5%DCl的电离不存在平衡关系1年前查看全部
- 水的离子积单位是什么水的离子积是 1.0X10^-15 (mol/L)^2 它的单位怎么是这样的啊?怎样得出来的 换了别
水的离子积单位是什么
水的离子积是 1.0X10^-15 (mol/L)^2
它的单位怎么是这样的啊?怎样得出来的 换了别的数值的离子积单位也是这样吗? 西北故人1年前2
西北故人1年前2 -
 freeflying 共回答了15个问题
freeflying 共回答了15个问题 |采纳率100%(mol/L.)*(mol/L.)=(mol/L)^2
水是一种弱电解质
可以发生极其微弱的电离,其电离方程式为:H2O+H2O≈H3O+ + OH-,简写为H2O≈H+ + OH-,是一个吸热过程.水的电离是水分子与水分子之间的相互作用而引起的,因此极难发生.实验测得,25℃时1L纯水中只有1×10^(-7)mol的水分子发生电离.由水分子电离出的H+和OH-数目在任何情况下总相等,25℃时,纯水中c(H+)=c(OH-)=1×10^(-7)mol/L.1年前查看全部
- 已知AnBm的离子积=[Am+]n[Bn-]m,式中的Am+]和[Bn-]表示离子的物质的量浓度.
已知AnBm的离子积=[Am+]n[Bn-]m,式中的Am+]和[Bn-]表示离子的物质的量浓度.
已知AnBm的离子积=[Am+]n[Bn-]m,式中的Am+]和[Bn-]表示离子的物质的量浓度.在某温度下,Ca(OH)2的溶解度为0.74g,其饱和溶液密度设为1g/ml,其离子积为0.004 怎么我老算错啊 ,求祥解 白墨云1年前2
白墨云1年前2 -
 啊胖 共回答了22个问题
啊胖 共回答了22个问题 |采纳率81.8%0.74g氢氧化钙的物质的量=0.74/74=0.01mol
溶液 的质量=100+0.74=100.74克
溶液的体积=100.74/1=100.74ml=0.1L
浓度=0.01/0.1=0.1mol/L
Ca(OH)2=Ca2+ + 2OH-
0.1-------0.1-----0.2
氢氧化钙的离子积=0.1*(0.2)^2=0.0041年前查看全部
- 某温度下,水的离子积约为10-12,将Va L pH=2的硫酸溶液与Vb L p
某温度下,水的离子积约为10-12,将Va L pH=2的硫酸溶液与Vb L pH=11的NaOH溶液混合,若混合溶液的pH=10,体积是(Va+Vb) L,则Va:Vb为( )
A. 2:11
B. 2:9
C. 11:2
D. 9:2 超级树獭1年前1
超级树獭1年前1 -
 冬日月潭 共回答了21个问题
冬日月潭 共回答了21个问题 |采纳率95.2%解题思路:水的离子积常数Kw=10-12,即PH=6时,溶液呈中性,pH=2的硫酸溶液中氢离子浓度=10-2mol/L,pH=11的氢氧化钠溶液中氢氧根离子浓度=
mol/L=0.1mol/L,混合溶液的pH=10,溶液呈碱性,说明氢氧化钠过量,10−12 10−11
混合溶液中氢氧根离子浓度=
mol/L=0.01mol/L,根据混合溶液中氢氧根离子浓度=10−12 10−10
计算.n(OH−)−n(H+) V(酸)+V(碱) 水的离子积常数Kw=10-12,即PH=6时,溶液呈中性,pH=2的硫酸溶液中氢离子浓度═10-2mol/L,pH=11的氢氧化钠溶液中氢氧根离子浓度=
10−12
10−11mol/L=0.1mol/L,混合溶液的pH=10,溶液呈碱性,说明氢氧化钠过量,
混合溶液中氢氧根离子浓度=
10−12
10−10mol/L=0.01mol/L,混合溶液中氢氧根离子浓度=
n(OH−)−n(H+)
V(酸)+V(碱)=
0.1×Vb−0.01×Va
Va+Vb=0.01mol/L,则Va:Vb=9:2,故选D.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查了混合溶液PH的计算,难度不大,能灵活运用水的离子积常数是解本题的关键,注意该题中中性溶液的PH不等于7而是为6,很多学生往往定向思维而导致错误.1年前查看全部
- 在100℃时水的离子积为1×10-12,若该温度下某溶液中H+浓度为1×10-7 mol•L-1,则该溶液(
在100℃时水的离子积为1×10-12,若该温度下某溶液中H+浓度为1×10-7 mol•L-1,则该溶液( )
A. 呈碱性
B. 呈酸性
C. 呈中性
D. c(OH-)=10c(H+) Aspkiller1年前1
Aspkiller1年前1 -
 dd女生 共回答了18个问题
dd女生 共回答了18个问题 |采纳率88.9%解题思路:根据溶液中氢离子浓度与氢氧根离子浓度的大小关系判断溶液酸碱性.某溶液中H+浓度为1×10-7mol•L-1,故c(OH-)=
1×10−12
1×10−7=1×10-5mol•L-1,故c(OH-)>c(H+),故溶液显碱性,
故选A.点评:
本题考点: 水的电离.
考点点评: 本题考查溶液酸碱性判断,难度不大.要注意根据溶液中c(OH-)、c(H+)相对大小判断溶液酸碱性,不能根据溶液pH大小判断溶液酸碱性.1年前查看全部
- 已知,在100度是,水的离子积为10^(-12),此时将pH=12的氢氧化钠溶液V1 L 与pH=1硫酸V2 L混合,若
已知,在100度是,水的离子积为10^(-12),此时将pH=12的氢氧化钠溶液V1 L 与pH=1硫酸V2 L混合,若所得混合溶液的pH=10,则V1:V2是多少?
 等待12341年前2
等待12341年前2 -
 栩栩 共回答了20个问题
栩栩 共回答了20个问题 |采纳率95%PH=1的H2SO4中H+浓度为10^(-1)=0.1 mol/L,PH=12 NaOH中H+浓度为10^(-12) mol/L,则其OH-浓度为10^(-12)/10^(-12)=1 mol/L,
要使pH=10,则混合后OH-浓度为10^(-2))=0.01 mol/L,
(V1*1-V2*0.1)/(V1+V2)=0.01
V1:V2=1:91年前查看全部
- 已知常温下BaSO4的溶解度为2.33×10-4g,类似于水的离子积,难溶盐AmBn也有离子积Ksp且Ksp=〔C(An
已知常温下BaSO4的溶解度为2.33×10-4g,类似于水的离子积,难溶盐AmBn也有离子积Ksp且Ksp=〔C(An+)〕m〔C(Bm-)〕n,则其Ksp为 ( )
A.2.33×10-4 B.1×10-5 C.1×10-10 D.1×10-12 yuluu1年前1
yuluu1年前1 -
 阴阳街老匹夫 共回答了24个问题
阴阳街老匹夫 共回答了24个问题 |采纳率83.3%答案选D
n(BaSO4)=2.33x10^(-4) / 233 mol =10^(-6) mol
[Ba2+]=[SO42-]=10^(-6) mol/L
所以ksp=10^(-6)x10(-6)=10^(-12)1年前查看全部
- 25℃时,重水(D2O)的离子积为1.6×10-15,也可用PH值一样的定义来规定其酸碱度:PD=-lg[D+],下列有
25℃时,重水(D2O)的离子积为1.6×10-15,也可用PH值一样的定义来规定其酸碱度:PD=-lg[D+],下列有关PD的叙述,正确的是( )
①中性D2O的PD=7
②在1LD2O中,溶解0.01molNaOD,其PD值为12
③1L0.01mol/L的DCl的重水溶液,PD=2
④在100mL 0.25mol/L DCl的重水溶液中,加入50mL 0.2mol/L NaOD的重水溶液,反应后溶液的PD=1.
A. ①②
B. ③④
C. ①③④
D. ①②③④ A无缘1年前1
A无缘1年前1 -
 那朵小花 共回答了16个问题
那朵小花 共回答了16个问题 |采纳率93.8%解题思路:①结合水的电离平衡和离子浓度,类推得到重水的电离和离子浓度,根据重氢离子浓度计算PD;
②根据NaOD的浓度结合重水的离子积常数确定该溶液的pD值;
③根据DCl的浓度结合重水的离子积常数确定该溶液的pD值;
④酸碱反应根据过量的离子浓度计算,结合溶液中的离子积常数计算PD.①25℃时,重水(D2O)的离子积为1.6×10-15,中性纯水中,C(D+)=C(HD-)=
1.6×10−15mol/L=4×10-8mol/L,PD=-lg[D+]=8-lg4>7,故错误;
②在1LD2O中,溶解0.01molNaOD,NaOD的物质的量浓度小于0.01mol/L,所以C(HD-)<0.01mol/L,C(D+)>1.6×10-13,则PD值>12,故错误;
③1L0.01mol/L的DCl的重水溶液,C(D+)>=0.01mol/L,PD=2,故正确;
④在100mL 0.25mol/L DCl的重水溶液中,n(DCl)=0.25mol/L×0.1L=0.025mol,50mL 0.2mol/L NaOD的重水溶液中,C(NaOD)=0.2mol/L×0.05L=0.01mol<n(DCl),则酸过量,混合溶液中C(DCl)=[0.25mol/L×0.1L−0.2mol/L×0.05L/0.15L]=0.1mol/L,则C(D+)>=0.1mol/L,PD=1,故正确;
故选B.点评:
本题考点: pH的简单计算.
考点点评: 本题考查了pH的简单计算,根据普通水的离子积常数然后利用知识迁移的方法进行分析解答本题即可,注意,只要是纯水,溶液中氢离子浓度始终等于氢氧根离子浓度.1年前查看全部
- 还有就是水升到100度时的离子积为10的负六次方,这与我的问题有联系吗,请回答
 贸阿没阿投你1年前1
贸阿没阿投你1年前1 -
 绝对黑色1984 共回答了17个问题
绝对黑色1984 共回答了17个问题 |采纳率88.2%水升到100度时的离子积应该为为10的负十二次方1年前查看全部
- 下表是不同温度下水的离子积数据: 温度 / ℃ 25 t1 t2 水的离子积常数 1×10^-14 α 1×10^-12
下表是不同温度下水的离子积数据: 温度 / ℃ 25 t1 t2 水的离子积常数 1×10^-14 α 1×10^-12
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 mol·L-1,取该溶液1 mL,加水稀释至10 mL,则稀释后溶液中c (Na+)∶c (OH-)=________ (3)t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=____________.此溶液中各种离子的浓度由大到小的排列顺序是____________________.要这两问的过程!明早7:00之前加30分,之后加10分 szjwgg1年前2
szjwgg1年前2 -
 老鼠爱蝙蝠 共回答了17个问题
老鼠爱蝙蝠 共回答了17个问题 |采纳率82.4%第一题 Na+和SO42-都不水解 因此稀释后c (Na+)∶c (OH-)=(1×10^-4)/(10^-7)=1000
稀释10倍 但OH-浓度仍未10-7 而Na浓度为2×5×10-4/10=1×10-4mol/L
第二题
因为温度变了,所以水的离子积变了由题可知NaOH溶液中Na+浓度等于OH-浓度等于0.1mol/L
硫酸溶液中SO4 2-:H+=1:2 c(H+)=0.1mol/L 可以知道反应时NaOH:H2SO4=2:1
但最后混合溶液Ph=2 也就是c(H+)=0.01mol/L 可以知道硫酸过量
假设2Mol NaOH和硫酸反应
则达到中和需要1MOL 硫酸 此时有3mol溶液 再加入C(H+)=0.1mol的硫酸溶液 假设加入了x mol
则有 0.1x/(x+3)=0.01
解得x=1/3
则V1:V2=2:(1+1/3)=3:2
继续按上面假设的2MOL NaOH说
此时溶液中有c(H+)=0.01mol/l c(OH-)=10^-10 c(Na+)=0.6mol/L c(SO4 2-)=0.4mol/L
所以 c(Na+)>c(SO4 2-)>c(H+)>c(OH-)1年前查看全部
- 某温度t时,水的离子积为Kw=1X10^-13,若此温度下pH=11的苛性钠溶液aL与pH=1的稀硫酸bL混合,设混合后
某温度t时,水的离子积为Kw=1X10^-13,若此温度下pH=11的苛性钠溶液aL与pH=1的稀硫酸bL混合,设混合后溶液体积的微小变化忽略不计:
1.若所得混合溶液为中性,此溶液中各种离子的浓度由大到小排列的顺序是______________.
2.若所得混合溶液的pH=2,此溶液中各种离子的浓度由大到小排列的顺序是______________.
请写出具体的过程,无限感激啊! 66036851年前1
66036851年前1 -
 缁柯_195455 共回答了18个问题
缁柯_195455 共回答了18个问题 |采纳率94.4%1 氢离子等于氢氧根,钠离子是硫酸根的两倍
C(NA+)=2C(SO4 2-)>C(H+)=C(OH-)
2 酸性,氢离子0.02mol/l,为计算方便我氢氧根就不记了,
C(NA+)=2C(SO4 2-)-C(H+)
可以根据反应后ph得出a:b=9:2
原钠离子浓度0.01mol/l,现在约0.0018mol/l
原硫酸根浓度0.05mol/l,现在约0.04mol/l
c(SO4 2-)>c(H+)>c(NA+)>c(OH-)1年前查看全部
- 一道关于离子积的化学题,要详细过程
一道关于离子积的化学题,要详细过程
19、水的电离平衡曲线如图所示.
(1)若以A点表示25℃时水的电离平衡的离子浓度,当温度升高到100℃时,水的电离平衡状态移动到B点,则此时水的离子积从________变化到_________.
(2)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,致使混合溶液的pH=7,则Ba(OH)2和盐酸的体积比为__________________.
http://www.***.cn/jazx/UploadFiles_2785/200712/20071212153155883.doc
第22题 都有人使用1年前1
都有人使用1年前1 -
 1478523690 共回答了15个问题
1478523690 共回答了15个问题 |采纳率93.3%水的电离平衡状
态移动到B点,则此时水的离子积
从__10^-14______变化到____10^-12_____.
因为A点是氢离子浓度,水电离时电离出的氢离子浓度与氢氧根离子浓度相等,故氢氧根离子浓度也是10^-7,B点时是10^-6mol/L
(1) 将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混
合,并保持100℃的恒温,致使混合溶液
的pH=7,则Ba(OH)2和盐酸的体积比为__________________.
PH=7时溶液显碱性,不是中性(PH=6才是中性)1年前查看全部
- 在某温度下,Ca(oH)2的溶解度为0.74g,其饱和溶液密度设为1g/mL,其离子积为多少
 orange43221年前1
orange43221年前1 -
 泪鱼kitty 共回答了19个问题
泪鱼kitty 共回答了19个问题 |采纳率84.2%4×10^-31年前查看全部
- 两种浓度不同体积不同的溶液混合后,溶液离子的浓度会变吗?然后算离子积.
 boycloud1年前1
boycloud1年前1 -
 米呆米呆 共回答了10个问题
米呆米呆 共回答了10个问题 |采纳率80%NACL溶液中,CL离子浓度为1mol/L,所以NACL溶液的CL离子为0.03L*1mol/L=0因为混合前后溶液体积不变,所以溶液体积为0.03L 0.04L=0.07L 故混合液1年前查看全部
- 常温下,1.0mol每L的醋酸溶液中,水的离子积是不是1x10的负14次方?
常温下,1.0mol每L的醋酸溶液中,水的离子积是不是1x10的负14次方?
如上..带说明 长河夕照1年前1
长河夕照1年前1 -
 crystal_orchid 共回答了20个问题
crystal_orchid 共回答了20个问题 |采纳率100%是的.
Kw值跟温度有关,在25℃,Kw=[H+ ][OH-]=1×10-7×1×10-7=1×10-14.
在常温下,[H +]和[OH-]的乘积都等于1×10-14.不管是在算或是碱性溶液中.它只随温度变化1年前查看全部
- 如何通过离子积判断完全沉淀离子积值的范围与溶解情况是什么?
 mbt20041年前1
mbt20041年前1 -
 yiluhun6 共回答了14个问题
yiluhun6 共回答了14个问题 |采纳率92.9%①当溶液中[M]m[A]n<Ksp时,是未饱和溶液,如果体系中有固体存在,将继续溶解,直至饱和为止;②当[M]m[A]n = Ksp时,是饱和溶液,达到动态平衡;③当[M]m[A] n>Ksp时,将会有MmAn沉淀析出,直至成为饱和溶液.以上三点称为溶度积规则,它是微溶电解质多相离子平衡移动规律的总结.根据溶度积规则可以控制离子浓度,使沉淀生成或溶解.1年前查看全部
- 【高二化学】关于离子积和溶解度某温度下氢氧化钙的溶解度为0.74克,其饱和溶液的密度设为1克每毫升,其离子积约为?
 依恋荏苒1年前1
依恋荏苒1年前1 -
 jax0126 共回答了14个问题
jax0126 共回答了14个问题 |采纳率85.7%是要求离子积常数吧
假设水为1000g,
则氢氧化钙饱和溶液为(1000+7.4)g*1g/mL=100.74mL=1.0074L(约等于1升)
氢氧化钙的质量为:7.4g
物质的量为:7.4g/74(g/mol)=0.1mol
Q氢氧化钙物质的量浓度为:0.1/1=0.1mol/L
钙离子物质的量浓度为:0.1摩尔每升,氢氧根离子的浓度为0.2摩尔每升
离子积常数Ksp=0.1*0.2*0.2=0.004
钙离子的浓度乘以氢氧根离子浓度的平方1年前查看全部
- 水溶液中的离子积问题90°时水的离子积常数为3.8X10^-13,此温度下将PH=3的盐酸和PH=11NAOH溶液等体积
水溶液中的离子积问题
90°时水的离子积常数为3.8X10^-13,此温度下将PH=3的盐酸和PH=11NAOH溶液等体积混合,混合溶液中氢离子浓度约为?2.05X10^-11 铜匠1年前2
铜匠1年前2 -
 menghaigz 共回答了21个问题
menghaigz 共回答了21个问题 |采纳率100%这个题目,只要你把握住PH的定义就可以了.
PH=11的盐酸,含有H+=10^-11mol/L,那么OH-含量就是0.038mol/L.混合后OH-浓度为:(0.038-0.001)/2 = 0.0185mol/L.再用离子积3.8*10^-13除以氢氧根的浓度0.0185,得数就是你的答案,约为2.054*10^-11mol/L.1年前查看全部
- 25℃时,往纯水中加入几滴硫酸:⑴水的电离度将 ,原因是 ;⑵H+浓度将 ;⑶水的离子积
25℃时,往纯水中加入几滴硫酸:⑴水的电离度将 ,原因是 ;⑵H+浓度将 ;⑶水的离子积
25℃时,往纯水中加入几滴硫酸:⑴水的电离度将 ,原因是 ;⑵H+浓度将 ;⑶水的离子积将 ,原因是 . 若水-雾1年前1
若水-雾1年前1 -
 statical 共回答了17个问题
statical 共回答了17个问题 |采纳率94.1%减小;硫酸电离产生的H+抑制了水的电离;
增加;
不变,Kw仅于温度有关.1年前查看全部
- 化学离子积,溶度积,电离常数用什么符号表示?
 zhenhaoqi1年前4
zhenhaoqi1年前4 -
 zjzangel 共回答了21个问题
zjzangel 共回答了21个问题 |采纳率85.7%化学离子积Kw,溶度积Ksp,电离常数K1年前查看全部
- 温度升高水的离子积增大说明水的电离是吸热反应.
 一梅大人1年前2
一梅大人1年前2 -
 蚊子0113 共回答了21个问题
蚊子0113 共回答了21个问题 |采纳率85.7%弱电解质电离都是吸热的,水也是弱电解质.所以这句话是对的1年前查看全部
- 水的离子积中C(H+)是只是有水电离出的H+的浓度还是溶液中所有的H+浓度比如加酸后水的离子积的C(H+)取
 hyl2031年前2
hyl2031年前2 -
 绿色杨柳枝 共回答了19个问题
绿色杨柳枝 共回答了19个问题 |采纳率94.7%所有的H+,但是水中所允许的离子积常数为1*10^-14,所以当水中存在酸的时候水中氢离子浓度增加,则氢氧根离子的浓度会降低,这个氢氧根离子来自于水自身的电离,同时水电离出的氢氧根离子与氢离子是对等的,所以水本身的电离程度会降低,水本身所电离出的氢离子和氢氧根离子浓度相同1年前查看全部
- 如何判断两种沉淀谁更难溶,是用离子积判断好还是溶解度判断,有时候由于平方会不好判断,
 sulphurous1年前1
sulphurous1年前1 -
 dongwei1 共回答了19个问题
dongwei1 共回答了19个问题 |采纳率100%同类型的看溶度积,不同类型比较溶解度1年前查看全部
- T摄氏度时,水的离子积为KW,该温度下将A摩尔每升一元酸HA与B摩尔每升一元碱等体积混合,要使混合液..
T摄氏度时,水的离子积为KW,该温度下将A摩尔每升一元酸HA与B摩尔每升一元碱等体积混合,要使混合液..
T摄氏度时,水的离子积为KW,该温度下将A摩尔每升一元酸HA与B摩尔每升一元碱等体积混合,要使混合液中性,必要条件是混合液中C{H+}= shenrenxin1年前1
shenrenxin1年前1 -
 pchyj 共回答了22个问题
pchyj 共回答了22个问题 |采纳率95.5%要使混合液中性,必要条件是混合液中C{H+}= √Kw
因为如果溶液中性的话,有c(H+) = c(OH-)
而在水溶液中,有:c(H+) * c(OH-) = Kw
所以c(H+) = c(OH-) = √Kw1年前查看全部
- 为什么在0.01molL盐酸溶液中水的离子积c(H+)=10^-12
 烟雨深锁1年前2
烟雨深锁1年前2 -
 yxzbq123 共回答了12个问题
yxzbq123 共回答了12个问题 |采纳率91.7%标准状况下
C(H+)*C(OH-)=10^-14,所以中性时C(H+)=C(OH-)=10^-7
当盐酸浓度为0.01mol/L时,溶液中的H+浓度为10^-2(水电离的H+浓度可以忽略),则OH-浓度为10^-14/10^-2=10^-12,因为电离出的H+浓度等于电离出的OH-浓度,所以
c(H+)=10^-121年前查看全部
- 水的离子积的一道问题在一定温度下,往水中加入少量NH4CL,则水的离子积将A:减小 B:增大 C:不变 D:改变
 东方心铭1年前4
东方心铭1年前4 -
 风儿宝宝 共回答了17个问题
风儿宝宝 共回答了17个问题 |采纳率82.4%不变,
在一定温度下,C(H)与C(OH)的乘积是一个常数,称为水的离子积常数,简称水的离子积1年前查看全部
- 温度为95时离子积为10负12次方,常温下PH=4的溶液在95时c(H+)和c(OH-)为多少
 BZ0071年前1
BZ0071年前1 -
 sasasaq 共回答了18个问题
sasasaq 共回答了18个问题 |采纳率88.9%H+浓度不变,是10的-4次幂 根据离子积OH-为10的-8次幂1年前查看全部
- 某温度t时,水的离子积为Kw=1X10^-13,若此温度下pH=11的苛性钠溶液aL与pH=1的稀硫酸bL混合,设混合后
某温度t时,水的离子积为Kw=1X10^-13,若此温度下pH=11的苛性钠溶液aL与pH=1的稀硫酸bL混合,设混合后溶液体积的微小变化忽略不计:
1.若所得混合溶液为中性,此溶液中各种离子的浓度由大到小排列的顺序是______________.
2.若所得混合溶液的pH=2,此溶液中各种离子的浓度由大到小排列的顺序是______________.
最好能详细一点!刚搜到了和这个一样的题,但步骤不全,算a和b
的比例是希望明示. 无影神风1年前2
无影神风1年前2 -
 chenliucai 共回答了18个问题
chenliucai 共回答了18个问题 |采纳率88.9%第一问.
pH=11的苛性钠溶液c(H+)=10^-11mol/L,离子积为Kw=1x10^-13,所以c(OH-)=0.01mol/L;
pH=1的稀硫酸c(H+)=0.1mol/L;
n(H+)=n(OH-);
0.1b=0.01a;
a=10b;
a:b=10:1;
反应后溶液就是硫酸钠溶液Na2SO4;溶液c(Na+)>c(SO42-)>c(H+)=c(OH-);
第二问.
由上问可推出.因为反应后为酸性溶液,所以,HCl的物质量一定大于NaOH,而H离子会与OH-反应从而浓度降低.
所以Cl大于Na大于H大于OH.1年前查看全部
- ph=10的K2CO3溶液水在常温下的离子积
 天秤坐女孩1年前1
天秤坐女孩1年前1 -
 许小包 共回答了16个问题
许小包 共回答了16个问题 |采纳率93.8%10^-14
常温永远-141年前查看全部
- 水的离子积 稀溶液中的离子积 就是他们到底的关系吧 搞不太清楚 别都用概念说…… 比如下面一道题
水的离子积 稀溶液中的离子积 就是他们到底的关系吧 搞不太清楚 别都用概念说…… 比如下面一道题
25摄氏度,某稀溶液中由水电离产生的C(h*)与c(oh-)的乘积是1*10负20次
我就不懂了不是水电离产生的都是10负14次嘛?、、 为钱dd20061年前3
为钱dd20061年前3 -
 麒麟山的ll林 共回答了15个问题
麒麟山的ll林 共回答了15个问题 |采纳率100%听我说,只有25℃时才有Kw=1.0×10 -14(纯水或稀溶液)
这里虽也是25℃,但要注意,这里的1.0×10 -20并不是Kw,因为这里的c(H+)和c(OH-)都只是水电离出来的.这不是中性溶液.分类讨论——
1.考虑水解.若是水解导致的pH变化,那么H+和OH-应全部由水电离产生.
(这时c(H+)不等于c(OH-),要特别注意.一楼不对)这不符合题意.舍去.
2.这是酸或碱的稀溶液,则H+和OH-并非全部有水电离产生,但由水电离产生的这部分满足
c(H+)=c(OH-)
所以c(H+)=c(OH-)=1.0×10 -10
所以pH=10,这是碱的稀溶液.
再补充一点:kw=c(H+)·c(OH-),这是指溶液中的总浓度,并非水电离产生的.1年前查看全部
- 某温度下水的离子积为1×10^-12,若使PH=1的H2SO4与PH=12 NaOH溶液混合后呈中性,这两者体积比为多少
某温度下水的离子积为1×10^-12,若使PH=1的H2SO4与PH=12 NaOH溶液混合后呈中性,这两者体积比为多少?假设H2SO4的体积为X,NaOH的体积为Y,那么硫酸中氢离子的浓度乘以X减去NaOH的氢离子浓度,在除以它们的体积等于10^-6 但是有一问题.假若这么算,1:10 但是当拿氢氧根离子算,即硫酸中氢氧根离子的浓度乘以X减去NaOH的氢氧根离子浓度,在除以它们的体积等于10^-6 ,这么算下来 得到的是10:1 那么这道题的正解是什么?不可能两个答案吧.
 sdaqwp1年前4
sdaqwp1年前4 -
 pb45006397 共回答了26个问题
pb45006397 共回答了26个问题 |采纳率84.6%你这种做法是错误的,题目考查的主要是水的离子积,PH=1的H2SO4中H+浓度为10^(-1) mol/L,PH=12 NaOH中H+浓度为10^(-12) mol/L,则其OH-浓度为10^(-12)/10^(-12)=1 mol/L,因为反应后溶液呈中性,故H+物质的量等于OH-(那10^-6是H2O电离出来的,与酸碱无关),易得体积比为10:11年前查看全部
- 常温下,水的离子积为Kw=1.0×10 -14 ,下列说法正确的是 [
常温下,水的离子积为Kw=1.0×10 -14 ,下列说法正确的是 [ ]A.在pH=11的溶液中,水电离出的c(OH - )等于10 -3 mol/L
B.将pH=1的硫酸和pH=13的氢氧化钠溶液体积比为9:1混合后,溶液的pH值为1.7(lg2=0.3)
C.将物质的量浓度和体积都相同的一元酸HA与一元碱BOH混合后,溶液呈中性,则反应后溶液中c(H + )=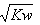
D.若中和之前强酸、强碱的pH之和等于14,则中和后溶液的pH大于7。 格林童话1年前1
格林童话1年前1 -
 lziv 共回答了16个问题
lziv 共回答了16个问题 |采纳率93.8%C1年前查看全部
- 关于水的离子积常温下水电离的H+和OH-浓度相同,水电离出H+浓度为10^-12mol/L时,其电离出的OH-浓度也是1
关于水的离子积
常温下水电离的H+和OH-浓度相同,水电离出H+浓度为10^-12mol/L时,其电离出的OH-浓度也是10^-12mol/L.不是说水的离子积只随温度变化吗?那么水电离出的氢氧根应该是10∧-2啊! 上dd红雨1年前1
上dd红雨1年前1 -
 giggle125428170 共回答了23个问题
giggle125428170 共回答了23个问题 |采纳率91.3%常温下,如果是纯水中.
水电离出H+和OH-是一定的,浓度均为10^-7.此时PH=7
你给出的浓度,已经不是常温下的了.虽然10^-12时PH=12
但是它还是中性.
有疑问的话欢迎提出,1年前查看全部
- 醋酸钠溶液升温,PH怎么变?直接从水解平衡角度考虑吗?可是升温后水的离子积也增大啊?
 c94536fd000e3c7b1年前1
c94536fd000e3c7b1年前1 -
 xinjian007 共回答了21个问题
xinjian007 共回答了21个问题 |采纳率85.7%盐类水解是吸热的,故升温有利水解平衡向右移动,水解程度增大,CO32- +H2O == HCO3-+OH- OH-增多,PH增大
水不考虑 因为水电离的H+和OH- 始终相等1年前查看全部
- 判断题:若某系统的溶液离子积等于溶度积,则该系统必然存在固相
判断题:若某系统的溶液离子积等于溶度积,则该系统必然存在固相
如题,谢谢 hkcindy1年前1
hkcindy1年前1 -
 tester2002 共回答了14个问题
tester2002 共回答了14个问题 |采纳率92.9%错,不一定1年前查看全部
- 几道很令我费解的化学题1、某温度下水的离子积为1×10^-12.将ph=4的H2SO4溶液与ph=9的NaOH混合,温度
几道很令我费解的化学题
1、某温度下水的离子积为1×10^-12.将ph=4的H2SO4溶液与ph=9的NaOH混合,温度不变,欲使混合后的溶液ph=7,求两种溶液的体积比
2、(一道选择题,我只把我不明白的选项写出来)常温下,下列各组数据的数值比为1:2的是 ph=7的氨水与硫酸铵的混合溶液中,c(铵根)与c(硫酸根)的比
3、Ksp小的难容物质,其溶解度一定小.(为什么错) 在碘化银和溴化银共存且均过饱和溶液中【典离子】比【溴离子】=Ksp(碘化银)比Ksp(溴化银)(为什么对)
4、25摄氏度,ph小于7的溶液一定是酸或强酸弱碱盐(为什么错)
大家回答的都非常棒,要是能平均分就好了…… lovekyralvin1年前6
lovekyralvin1年前6 -
 ldkxd 共回答了18个问题
ldkxd 共回答了18个问题 |采纳率100%1、水的离子积为10^-12.硫酸溶液PH=4,知C(H+)=10^-4mol/L
NaOH溶液PH=9,知C(H+)=10^-9mol/L,C(OH-)=k/c(H+)=10^-3mol/L
混合后溶液的PH=7,此时并不意味溶液为中性,此时C(OH-)=k/C(OH-)=10^-5mol/L.即NaOH过量,那么
[V(NaOH)*c(OH-)-V(H2SO4)*c(H+)]/[V(NaOH)+V(H2SO4)]=10^-5
V(H2SO4):V(NaOH)=9:1
2、
根据溶液中电荷守恒可知阳离子所带电荷和等于阴离子所带电荷和.
C(NH4+)+c(H+)=2C(SO42-)+c(OH-)
常温下,PH=7.意味着溶液呈中性.即c(H+)=c(OH-)
所以c(NH4+)=2C(SO42-)
c(NH4+):c(SO42-)=2:1
3、ksp只是反应物质电离的程度,并不反应其溶解性.如NH3的ksp很小,其溶解性却很强.
ksp(AgI)=C(Ag+)*C(I-)
ksp(AgBr)=c(Ag)*c(Br-)
在过饱和的溶液中,上面两种物质的电离都处于相对平衡状态.因为共处相同的溶液,c(Ag+)相等.所以ksp(AgI):ksp(AgBr)=c(I-):c(Br-)
4、还有可能是弱酸弱碱盐,只不过酸电离强于碱的电离,溶液呈酸性.
我打字速度太慢,实在费时,1年前查看全部
- 已知在100℃的温度下(本题涉及的溶液其温度均为100℃,水的离子积 K W =1.0×10 - 12 mol 2 ·L
已知在100℃的温度下(本题涉及的溶液其温度均为100℃,水的离子积 K W =1.0×10 - 12 mol 2 ·L - 2 。下列说法中正确的是
A.0.05 mol·L - 1 的H 2 SO 4 溶液,pH=1 B.0.001 mol·L - 1 的NaOH溶液,pH=11 C.0.005 mol·L - 1 的H 2 SO 4 溶液与0.01 mol·L - 1 的NaOH溶液等体积混合,混合溶液的pH为6,溶液显酸性 D.完全中和pH=3的H 2 SO 4 溶液50 mL,需要pH=11的NaOH溶液50 mL  ifshiba1年前1
ifshiba1年前1 -
 kittyy 共回答了16个问题
kittyy 共回答了16个问题 |采纳率100%A
A:c(H + )=0.1mol/L,pH=—lg c(H + )=1
B:c(OH — )=0.001mol/L,c(H + )=1.0×10 - 9 mol/L,pH=—lg c(H + )=9
C:两者恰好中和,混合溶液的pH=6,溶液呈中性。
D:酸提供的n(H + )=1.0×10 - 3 ×0.05,碱提供的n(OH — )=1.0×10 - 1 ×V,可得V="0.5" mL1年前查看全部
- 100℃时,纯水的离子积等于一乘十的负十二次方,则此时纯水的氢离子为多少?此时纯水是否仍为中性?
 爬上珠峰的蚯蚓1年前2
爬上珠峰的蚯蚓1年前2 -
 CH166 共回答了12个问题
CH166 共回答了12个问题 |采纳率91.7%纯水里只有氢正离子和氢氧根负离子,所以氢离子浓度=氢氧根离子浓度=离子积开根号=10^-6.
水还是中性,因为氢离子浓度=氢氧根离子浓度.
不要被温度欺骗了哟1年前查看全部
- 纯水 升温 氢离子浓度纯水升温后离子平衡右移 水的离子积增加氢离子浓度与氢氧根离子浓度都增加 哪个增加大?还是同等程度增
纯水 升温 氢离子浓度
纯水升温后离子平衡右移 水的离子积增加
氢离子浓度与氢氧根离子浓度都增加
哪个增加大?还是同等程度增加 毁s1年前1
毁s1年前1 -
 昨日狂鸦 共回答了18个问题
昨日狂鸦 共回答了18个问题 |采纳率88.9%纯水的电离是吸热反应,提高温度,反应向电离方向移动,氢离子浓度与氢氧根离子浓度同程度增加,因为反应比1:1.1年前查看全部
- 离子积单位问题离子积是常数,应该没有单位.可是量浓度的单位是mol/L,离子积的单位应该是mol/L的平方呀,怎么mol
离子积单位问题
离子积是常数,应该没有单位.可是量浓度的单位是mol/L,离子积的单位应该是mol/L的平方呀,怎么mol/L的平方这个单位变成没有单位了 saegregrew1年前4
saegregrew1年前4 -
 ynfgp 共回答了17个问题
ynfgp 共回答了17个问题 |采纳率82.4%每个浓度都要除以标准浓度1mol/L,所以最后是没单位的.1年前查看全部
- 水的浓度随温度变化吗?(在算水的离子积中)
 斑马_王子1年前3
斑马_王子1年前3 -
 灰飞烟灭1984 共回答了16个问题
灰飞烟灭1984 共回答了16个问题 |采纳率87.5%水的密度随温度变化1年前查看全部
- (1)某温度(t℃)时,水的离子积为Kw=1×10-13,则该温度 25℃(填“>”“=”或“<”),在此温度下,某溶
(1)某温度(t℃)时,水的离子积为Kw=1×10-13,则该温度 25℃(填“>”“=”或“<”),在此温度下,某溶液中由水电离出来的H+浓度为1×10-10mol/L,则该溶液的pH可能为 或 。
若温度为25℃时,体积为Va、pH=a的H2SO4溶液与体积为Vb、pH=b的NaOH溶液混合,恰好中和.已知Va>Vb,且a=0.5 b,则a的取值范围 。
(3)若将此温度(t℃)下,pH=11的苛性钠溶液m L与pH=1的稀硫酸溶液nL混合(假设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比,并比较溶液中各离子的浓度大小。
①若所得混合液为中性,则m∶n= ;此溶液中各种离子的浓度由大到小排列顺序是 。
②若所得混合液的pH=2,则m∶n= ;此溶液中各种离子的浓度由大到小排列顺序是 。 猪猪恋1年前0
猪猪恋1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 关于水的离子积:问.01mol/L的HCL溶液 ,水电离的H+浓度呢
关于水的离子积:问.01mol/L的HCL溶液 ,水电离的H+浓度呢
我想问的是:里面的水电离出的H+是等于OH- 这我知道
那么 HCL中的OH-为什么是用 ( 1x10的-14方 去除以 氯化氢中的H+) (不是应该是水的离子常数除以水的氢离子浓度么) fantao02241年前1
fantao02241年前1 -
 coldlg 共回答了17个问题
coldlg 共回答了17个问题 |采纳率94.1%不是这样的,水的离子积只要在温度一定的情况下是不会改变的.所以c(H+)xc(OH-)=1X10-14 .注意是溶液中的H+与OH-1年前查看全部
- 在离子平衡的题中水的离子积可以同时用于纯水中和电解质稀溶液中吗?
在离子平衡的题中水的离子积可以同时用于纯水中和电解质稀溶液中吗?
请看清楚再做答,
例:室温下由水电离的H+的浓度为10的负14mol/L的溶液中,按室温下的水的离子积算OH的浓度为1mol/L,为强碱溶液.而明显这个溶液可以是强酸溶液.这是怎么回事?那又该如何解释? 游弋的海1年前2
游弋的海1年前2 -
 tt大晒 共回答了24个问题
tt大晒 共回答了24个问题 |采纳率87.5%水的离子积常数原来是指纯水电离的所有H+与所有OH-浓度的积;但实验表明在水中加入少量溶质时,溶液中的H+与OH-(可能是水电离出的也可能是溶质电离出的)浓度的积不变,仍然等于该温度下纯水的离子积.所以,只要是稀溶液(理想溶液),应该是所有物质电离出的H+与OH-浓度乘积等于水的离子积.另外,水自身电离出的H+和OH-的量总是一样多的!
再看你的例子:室温下由水电离的H+的浓度为10的负14mol/L的溶液中,水电离出的OH-的浓度一定也是10的负14mol/L,这个只能说明水的电离受到抑制,不能确定这个溶液是强酸溶液还是强碱性溶液.1年前查看全部
大家在问
- 1用爱慕虚荣、凯歌、尊重、较量写一段话,40个字
- 2gei wo ge xin ying de xue xi tiao zhan xuan yan!~~~
- 3离散数学蕴涵式定义请教书上的定义说:当条件式是一个重言式时,则该重言式是一个蕴涵式,此处我不甚理解,因为重言式的定义是,
- 4Iridescent求翻译
- 5(2008•深圳模拟)如图,已知正方形ABCD的边长是4,E是AB的中点,延长BC到点F使CF=AE.
- 6如图所示,在粗糙水平面上固定一点电荷Q,在M点无初速度释放一带有恒定电量的小物块,小物块在Q的电场中运动到N点静止,则从
- 7饲养场的猪和羊的数量比是7:8,羊和牛的数量比是4:1,猪,羊和牛一共有85头,猪有多少头?
- 8英国和法国发生过哪些重大的战争?
- 9《青春中的落落野花》 题目的含义是什么
- 10早在1912年就建成了世界上第一座潮汐发电站是作用了哪种说明方法
- 11红、绿、蓝三种颜色组合等于什么色?
- 12饮酒》反映诗人陶渊明的生活志向,其中表现他悠游自在的隐居生活的名句是 ,
- 13求高中物理知识体系要包括详细内容的啊 高分~谢谢~~~~
- 14表面处理MFZn8-TK的含义有谁知道金属表面处理MFZN5-TK各英文代号说明 请详细介绍各英文字母代表的含义,谢谢!
- 15面对正在扫大街的清洁工,我会对她说:“ ”
