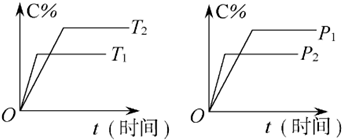
可逆反应mA(气)+nB(固)⇌rC(气)+qD(气)在反应过程中,其他条件不变,D的百分含量和T或P关系如图所示,下列
 十三包2022-10-04 11:39:541条回答
十三包2022-10-04 11:39:541条回答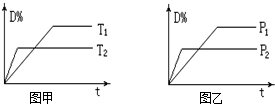 可逆反应mA(气)+nB(固)⇌rC(气)+qD(气)在反应过程中,其他条件不变,D的百分含量和T或P关系如图所示,下列叙述中正确的是( )
可逆反应mA(气)+nB(固)⇌rC(气)+qD(气)在反应过程中,其他条件不变,D的百分含量和T或P关系如图所示,下列叙述中正确的是( )A.温度降低,化学平衡向正反应方向移动
B.使用催化剂,D的物质的量分数增加
C.物质B的颗粒越小,反应越快,有利于平衡向正反应方向移动
D.化学方程式系数m<r+q

已提交,审核后显示!提交回复
共1条回复
 帽子11 共回答了16个问题
帽子11 共回答了16个问题 |采纳率100%- 解题思路:由图甲可知,温度T2为先到达平衡,则T2>T1,升高温度,D的体积分数减小,说明平衡向逆反应方向移动,则正反应为放热反应;
由图(2)可知,压强为P2先到达平衡,故P2>P1,增大压强,D的体积分数减小,说明平衡向逆反应方向移动,m<r+q,
注意反应中A为固体.由图甲可知,温度T2为先到达平衡,故T2>T1,升高温度,升高温度,D%减小,则平衡向逆反应移动,升高温度平衡向吸热反应移动,故正反应为放热反应;由图乙可知,压强为P2先到达平衡,故P2>P1,增大压强,D%减小,则平衡向逆向移动,增大压强平衡向体积减小的方向移动,故m<r+q.注意反应中B为固体;
A、已知正反应为放热反应,则温度降低,化学平衡向正反应方向移动,故A正确;
B、使用催化剂,缩短到达平衡时间,平衡不移动,D%的不变,故B错误;
C、B为固体,物质B的颗粒越小,反应越快,但是固体浓度为常数,所以平衡不移动,故C错误;
D、由右图可知,压强为P2先到达平衡,故P2>P1,增大压强,D%减小,则平衡向逆向移动,增大压强平衡向体积减小的方向移动,反应中B为固体,故m<r+q,故D正确.
故选:AD.点评:
本题考点: 产物的百分含量随浓度、时间的变化曲线.
考点点评: 本题考查化学平衡的移动、化学平衡影响因素、化学平衡图象等,难度中等,图象的解题方法是“先拐先平”,即曲线先折拐的首先达到平衡,以此判断温度或压强的高低,再依据外界条件对平衡的影响确定答案. - 1年前
相关推荐
- 可逆反应mA(固)+nB(气)⇌cC(气)+fD(气)反应过程中,当其它条件不变时,C的体积分数(C%)与温度(T)和压
可逆反应mA(固)+nB(气)⇌cC(气)+fD(气)反应过程中,当其它条件不变时,C的体积分数(C%)与温度(T)和压强(P)的关系如下图所示,下列叙述正确的是( )
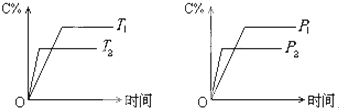
A.达到平衡后,若使用催化剂,C的体积分数增大
B.达到平衡后,若使温度升高,化学平衡向逆反应方向移动
C.化学方程式中n>c+f
D.达到化学平衡后,增加A的量有利于化学平衡向正反应方向移动 liujin31年前1
liujin31年前1 -
 经济种子 共回答了20个问题
经济种子 共回答了20个问题 |采纳率95%解题思路:可逆反应,当其他条件一定时,温度越高,反应速率越大,达到平衡所用的时间越短.由图象(1)可知T2>T1,温度越高,平衡时C的体积分数φ(C)越小,故此反应的正反应为放热反应;当其他条件一定时,压强越高,反应速率越大,达到平衡所用的时间越短.由图(2)可知p2>p1,压强越大,平衡时C的体积分数φ(C)越小,可知正反应为气体物质的量增大的反应,即n<c+f,据此结合外界条件对化学平衡的影响分析解答.可逆反应,当其他条件一定时,温度越高,反应速率越大,达到平衡所用的时间越短.由图象(1)可知T2>T1,温度越高,平衡时C的体积分数φ(C)越小,故此反应的正反应为放热反应;当其他条件一定时,压强越高,反应速率越大,达到平衡所用的时间越短.由图(2)可知p2>p1,压强越大,平衡时C的体积分数φ(C)越小,可知正反应为气体物质的量增大的反应,即n<c+f,
A、催化剂只改变化学反应速率,对平衡移动没有影响,C的体积分数不变,故A错误;
B、正反应为放热反应,升高温度平衡向吸热方向移动,即向逆反应移动,故B正确;
C、由上述分析可知,可逆反应mA(固)+nB(气)⇌cC(气)+fD(气)正反应为气体物质的量增大的反应,即n<c+f,故C错误;
D、达平衡后,增加A的量,因为A为固体,所以平衡不移动,故D错误;
故选B.点评:
本题考点: 化学平衡建立的过程;化学平衡的影响因素.
考点点评: 本题考查化学平衡图象问题,题目难度中等,本题注意根据图象判断外界条件对平衡的移动的影响是解答该题的关键.1年前查看全部
- 可逆反应mA(气)+nB⇌pC(气)+qD(其中A和C都是无色气体),当达到平衡时,下列叙述正确的是( )
可逆反应mA(气)+nB⇌pC(气)+qD(其中A和C都是无色气体),当达到平衡时,下列叙述正确的是( )
A.增大压强,平衡不移动,说明(m+n)一定等于(p+q)
B.升高温度,A的转化率减小,说明正反应是吸热反应
C.若增加B的量,平衡体系颜色加深,说明B必是气体物质
D.若B是气体,增加A的量,A、B转化率都一定增大 kk的豆子1年前1
kk的豆子1年前1 -
 sizhaolee 共回答了16个问题
sizhaolee 共回答了16个问题 |采纳率87.5%解题思路:升高温度、增大压强、增大反应物浓度、使用催化剂都会使正反应速率增大,结合平衡移动原理分析平衡移动的可能方向,据此解答.A、如D是非气体,则是说明m+n等于p,故A错误;
B、升高温度,A的转化率减小,说明平衡逆向移动,逆反应是吸热反应,故B错误;
C、若增加B的量,平衡正向移动,削弱B的浓度,但未抵消,平衡体系B的浓度变大,颜色加深,说明B必是气体,故C正确;
D、若B是气体,增大A的量,A的转化率减小,B的转化率增大,故D错误;
故选C.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查了影响化学平衡的因素,难度不大,易错选项是B,注意固体和纯液体改变用量对反应速率无影响,催化剂只影响反应速率不影响平衡的移动.1年前查看全部
- 可逆反应mA (g)+nB(s)⇌eC(g)+fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与
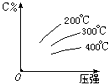 可逆反应mA (g)+nB(s)⇌eC(g)+fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )
可逆反应mA (g)+nB(s)⇌eC(g)+fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )
A.达平衡后,加入催化剂,加快反应速率,使C%增大
B.达平衡后,增加B的量有利于平衡向正反应方向移动
C.化学方程式中m+n<e+f
D.该可逆反应的正反应的△H<0 7702221年前1
7702221年前1 -
 策马入红尘 共回答了20个问题
策马入红尘 共回答了20个问题 |采纳率95%解题思路:根据图象可知,升高温度,C的百分含量减小,则升高温度平衡逆移,所以该反应的正反应是放热反应;增大压强,C的百分含量增大,则平衡向正反应方向移动,所以该反应是一个气体体积减小的可逆反应,固体量的增减不会引起化学平衡的移动.A.达到平衡后,加入催化剂加快反应速率,但是不改变平衡,C的含量不变,故A错误;
B.达平衡后,增加B的量不会引起平衡的移动,故B错误;
C.压强增大,C%含量增大,说明平衡正向进行,正反应是气体体积减小的反应,n>e+f,故C错误;
D.升高温度,C的含量减小,则该反应的正反应是放热反应,该反应的正反应是放热反应,故D正确;
故选D.点评:
本题考点: 体积百分含量随温度、压强变化曲线.
考点点评: 本题考查化学平衡的影响因素分析判断,图象分析方法,注意催化剂的作用,固体改变量平衡不动,题目难度中等.1年前查看全部
- 可逆反应mA(气)+nB(气)=pC(气)+qD(气),测得平均反应速率v(C)=2v(B),达到平衡后,若保持温度不变
可逆反应mA(气)+nB(气)=pC(气)+qD(气),测得平均反应速率v(C)=2v(B),达到平衡后,若保持温度不变,
给体系加压,平衡不移动,则m,n,p,q的数值正确关系为()
A.2,6,3,5 B.3,1,2,2 C.3,1,2,1 D.1,3,2,2
(化学平衡9) 三色烟1231年前3
三色烟1231年前3 -
 小鱼游圆 共回答了17个问题
小鱼游圆 共回答了17个问题 |采纳率94.1%这个题选B 首先看速率 速率之比是系数比 所以B和C的比是1比2 所以AD不对 而加压不移动是说两侧系数的和是一样的 所以C不对1年前查看全部
- 可逆反应mA(气)⇌nB(气)达到平衡时,下列叙述中正确的是( )
可逆反应mA(气)⇌nB(气)达到平衡时,下列叙述中正确的是( )
①V(正)=V(逆)≠0
②A的生成速成率等于A的分解速率
③A与B的物质的量不变
④A与B的生成速率之比为m:n.
A.①
B.①②
C.①③
D.①②③④ wangleiaht1年前1
wangleiaht1年前1 -
 qq英语132 共回答了15个问题
qq英语132 共回答了15个问题 |采纳率80%解题思路:根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.①化学平衡是动态平衡,当反应达到平衡状态时,正逆反应速率相等,但不为0,故①正确;
②的生成速成率等于A的分解速率,正逆反应速率相等,说明达平衡状态,故②正确;
③A与B的物质的量不变,也就是正逆反应速率相等,说明达平衡状态,故③正确;
④A与B的生成速率之比为m:n,正逆反应速率相等,说明达平衡状态,故④正确;
故选D.点评:
本题考点: 化学平衡状态的判断.
考点点评: 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.1年前查看全部
- 可逆反应mA(固)+nB(气) eC(气)+fD(气),反应过程中保持其他条件不变,C的体积分
可逆反应mA(固)+nB(气)
 eC(气)+fD(气),反应过程中保持其他条件不变,C的体积分
eC(气)+fD(气),反应过程中保持其他条件不变,C的体积分
数[j(C)]在温度(T)和压强(P)的条件下随时间(t)变化如下图所示,下列叙述正确的是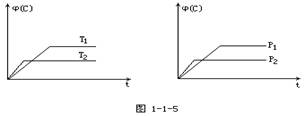
A.达到平衡后,若使用催化剂,C的体积分数将增大
B.达到平衡后,若温度升高,化学平衡向逆反应方向移动
C.化学方程式中n>e+f
D.达到平衡后,增加A的质量有利于化学平衡向正反应方向移动 yuanze19841年前1
yuanze19841年前1 -
 全角 共回答了21个问题
全角 共回答了21个问题 |采纳率85.7%B
1年前查看全部
- 可逆反应mA(固)+nB(气)⇌Pc (气)+qD(气)反应过程中其他条件不变时C的百分含量C%与温度(T)和
可逆反应mA(固)+nB(气)⇌Pc (气)+qD(气)反应过程中其他条件不变时C的百分含量C%与温度(T)和压强(p)的关系如图所示,下列叙述中正确的是( )
A.达到平衡后,使用催化剂,C%将增大
B.达到平衡后,若升高温度,化学平衡向逆反应方向移动
C.方程式中n>p+q
D.达到平衡后,增加A的量有利于化学平衡向正反应方向移动 小面包芭芘1年前1
小面包芭芘1年前1 -
 娉婷儿 共回答了19个问题
娉婷儿 共回答了19个问题 |采纳率94.7%解题思路:可逆反应,当其他条件一定时,温度越高,反应速率越大,达到平衡所用的时间越短.由图象(1)可知T1>T2,温度越高,平衡时C的体积分数φ(C)越小,故此反应的正反应为放热反应;当其他条件一定时,压强越高,反应速率越大,达到平衡所用的时间越短.由图(2)可知p2>p1,压强越大,平衡时C的体积分数φ(C)越小,可知正反应为气体物质的量增大的反应,即n<P+q,据此结合外界条件对化学平衡的影响分析解答.可逆反应,当其他条件一定时,温度越高,反应速率越大,达到平衡所用的时间越短.由图象(1)可知T1>T2,温度越高,平衡时C的体积分数φ(C)越小,故此反应的正反应为放热反应;
当其他条件一定时,压强越高,反应速率越大,达到平衡所用的时间越短.由图(2)可知p2>p1,压强越大,平衡时C的体积分数φ(C)越小,可知正反应为气体物质的量增大的反应,即n<P+q.
A、催化剂只改变化学反应速率,对平衡移动没有影响,C的质量分数不变,故A错误;
B、由上述分析可知,可逆反应mA(固)+nB(气)⇌Pc (气)+qD(气)正反应为放热反应,升高温度平衡向吸热方向移动,即向逆反应移动,故B正确;
C、由上述分析可知,可逆反应mA(固)+nB(气)⇌Pc (气)+qD(气)正反应为气体物质的量增大的反应,即n<P+q,故C错误;
D、A为固体,浓度为定值,达平衡后,增加A的量,平衡不移动,故D错误.
故选B.点评:
本题考点: 产物百分含量与压强的关系曲线.
考点点评: 本题考查化学平衡图象问题,题目难度中等,本题注意根据图象判断外界条件对平衡的移动的影响是解答该题的关键.1年前查看全部
大家在问
- 1关于x的方程mx2-3x=x2-mx 2是一元一次方程时m应满足什么条件?
- 2在罗马数字中0该怎么写?
- 3一道高中的题 只留下思路也可以在等差数列中 (a11)/(a10)<-1,前n项和Sn有最大值 ,那么使Sn有最大值的正
- 4一道英语选择题-When was _____ Jazz was born in the United States?-A
- 5请给我一写作文题目的比喻写法.例如自信——隐形的翅膀
- 6古文中“解”的意思1.庖丁为文惠君解牛2.少年大骇,急解令休止3.后经吾婉解4.师者,所以传道受业解惑也能答几个答几个
- 7一种长方体的喷雾药箱可装药液15升.从里面量这个药箱长3分米宽2分米药液深多少分米 如果每分钟可喷药液500
- 8(2004•镇江)如图中,正确使用测电笔的图是______;交流发电机的原理图是______.(填序号)
- 9根据句意和首字母提示完成单词 1. There is a big tree in front of my house,
- 10某些动物如响尾蛇,是用对光的感应来捕食的,这种光是( ) A.白光 B.紫外线 C.红外线 D.红光
- 11英语翻译나는 당신을 기Ꮕ
- 12这个篮子是所有篮子中最重的,让我来扛吧 英语翻译
- 13How long should a couple know each other before they get mar
- 14如图,在Rt△ABC中,∠C=90°,BC=acm,AC=bcm,a>b,且a,b是方程
- 15如图,在矩形ABCD中,AB=3,BC=5,过对角线交点O作OE⊥AC交AD于E,则AE的长是______.
