酸碱性物质到多少时,指示剂变色
 您字送你2022-10-04 11:39:541条回答
您字送你2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 五谷石 共回答了17个问题
五谷石 共回答了17个问题 |采纳率94.1%- PH值8.3 酚酞指示剂变色
- 1年前
相关推荐
- 酸性溶液具有酸的通性么?本人理解有问题:题上说检验溶液的酸碱性,可以用锌粒观察是否产生气泡,可以么?不是酸才可与活泼金属
酸性溶液具有酸的通性么?
本人理解有问题:
题上说检验溶液的酸碱性,可以用锌粒观察是否产生气泡,可以么?不是酸才可与活泼金属反应么?显酸性溶液一定具有酸的通性么?CUSO4溶液呢?显酸性可以与ZN反应么? syhaozi1年前2
syhaozi1年前2 -
 acc72 共回答了19个问题
acc72 共回答了19个问题 |采纳率94.7%太弱的就不好了,还是酸碱指示剂稳妥,硫酸铜的确酸性溶液,强酸弱碱盐么,但是明显但是和锌发生的是置换反应1年前查看全部
- 醋酸钙的酸碱性谁人知晓?它是弱酸强碱盐,但是我们老师说醋酸根离子电力大于水解所以呈碱性.那这两条理论怎么用啊
 woyao271年前1
woyao271年前1 -
 flory_413 共回答了17个问题
flory_413 共回答了17个问题 |采纳率82.4%你们老师似乎没有说到点子上.
酸碱性的本质是溶液中质子(氢离子)浓度的大小.在CaAc2的水溶液中,质子主要来源于水的电离.
水的电离特征有二:1、必产生等量的质子(或水和氢离子)和氢氧根粒子.2、质子和氢氧根离子浓度的乘积为定值(即水的离子积,标况下为1.0×10^(-14)).同时,所谓强酸与弱酸实质上是酸根离子与质子结合的紧密程度,弱酸根与氢离子结合紧密,不易电离,反过来说容易“捕获”氢离子,强酸根与氢离子结合松散,容易电离,反过来说不易“捕获”氢离子,强碱与弱碱是同样的道理,只是将氢离子换成氢氧根离子.
回到CaAc2水溶液:Ca(OH)2为中强碱,Ca2+不易捕获水中的OH-;而HAc为弱酸,Ac-容易捕获水中的H+,由于水电离的两个特征,可以得知在Ca2+和Ac-的影响下,溶液中的H+越来越少,而相应的OH-减少的量远远小于受离子积影响电离的量,固溶液中OH-浓度远大于H+浓度,溶液呈碱性.1年前查看全部
- 元素周期酸碱性,怎么变化
 1174675611年前1
1174675611年前1 -
 yjhsd 共回答了16个问题
yjhsd 共回答了16个问题 |采纳率87.5%周期表中,从上至下,同主族元素的元素金属性逐渐增强,等同于其于水反应的剧烈程度,所得溶液(最高价氧化物对应的水化物,Na---NaOH)的碱性也越强.从左至右,同周期元素,元素的非金属性逐渐增强,其得电子的能力越强,与氢气反应也越容易,等同于改元素的最高价氧化物对应的水化物(最高价含氧酸)的酸性也就越强.
纯手打,!1年前查看全部
- 如何判断酸碱性的强弱不用ph试纸判定
 pbx5201年前1
pbx5201年前1 -
 可爱的傻子 共回答了18个问题
可爱的傻子 共回答了18个问题 |采纳率100%要是量相同的强酸,看他们同量情况下氢离子的多少,氢离子多的那个酸性就强.如浓硫酸和浓硝酸.
要是量相同的弱酸,看他们同量情况下电离出来的氢离子的多少.氢离子多的那个就强.
如果是碱,那是同样的道理.只不过这个时候看的不是氢离子的多少了.而是看氢氧根含量的多少了.
记住这个口诀”碱看氢氧酸看氢,弱酸若碱看电离”1年前查看全部
- 为什么0.1mol/L磷酸钠和磷酸二氢钠酸碱性不同.
 冰ll妹1年前3
冰ll妹1年前3 -
 SMCC126 共回答了24个问题
SMCC126 共回答了24个问题 |采纳率87.5%磷酸钠在水中电离成 磷酸根和钠离子 一般接近中性 磷酸二氢钠在水中电离成 上述离子外 还会有H+离子存在 所以水溶液呈酸性1年前查看全部
- 溶液的酸碱度(酸碱性强弱的程度)常用pH来表示。江河湖泊水体的pH小于6.6或大于8.5时,就会使水生生物受到不良影响,
溶液的酸碱度(酸碱性强弱的程度)常用pH来表示。江河湖泊水体的pH小于6.6或大于8.5时,就会使水生生物受到不良影响,严重时造成鱼虾绝迹。流溪河是广州市人民的重要饮水源,某校研究小组的同学在“我与化学”的活动中,对流经从化几个城镇的流溪河段水质pH值进行了测试。
1.取样。从上游到下游分别选择8个重要河段取样,并按次序分别编为1~8号。
2.测试及数据记录。用酸度计分别测定各河段水样的PH值,并记录如下: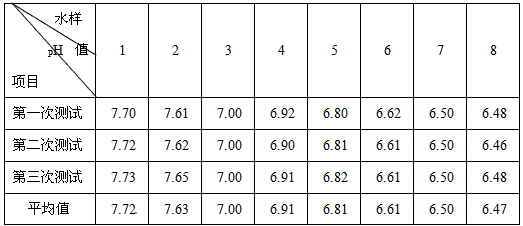
回答下列问题:
(1)根据测试数据,可知上游河水呈_______性,下游河水呈______性。从上游到下游,河水PH值的变化是:________。
(2)测试数据显示,第______河段的水质PH已对水生生物产生不良影响。经调查分析可知是由于流经该河段的镇上有几间电镀工厂,这些工厂使用的燃料主要是煤,煤中含有的硫在燃烧时会以二氧化硫的形式排放,二氧化硫大气中会发生反应2SO 2 +O 2 +2X==2H 2 SO 4 ,造成降酸雨。试推断X的化学式为_______。 gxy11161年前1
gxy11161年前1 -
 杨楚雄 共回答了20个问题
杨楚雄 共回答了20个问题 |采纳率90%⑴碱;酸;PH值逐渐减小(或由弱碱性逐渐变成酸性)
⑵7;H 2 O1年前查看全部
- 用离子方程式或电离方程式表示其显酸碱性的原因
用离子方程式或电离方程式表示其显酸碱性的原因
NaHSO4 NaHCO3 KAL(SO4)2 CuSO4 H2S Na2S NH4NO3
 桃花生1年前1
桃花生1年前1 -
 lkjnpoi 共回答了14个问题
lkjnpoi 共回答了14个问题 |采纳率85.7%NaHSO4===Na+ +H+ +SO42-
HCO3-+H2O===H2CO3+OH-
Al3++3H2O===Al(OH)3+3H+
CuSO4===Cu2++SO42-
H2S===H++HS-
S2-+H2O===HS-+OH-
NH4++H2O====NH3.H2O+H+1年前查看全部
- Zn(OH)2、Al(OH)3和CH3COONH4的水溶液的酸碱性大约分别是多少啊?
 alllove0011年前1
alllove0011年前1 -
 ada-huang 共回答了20个问题
ada-huang 共回答了20个问题 |采纳率95%锌离子完全沉淀的ph是8.04,也就是8.04时为氢氧化锌饱和溶液的ph
铝离子完全沉淀的ph为4.7,
CH3COONH4为缓冲溶液,ph值大约为7,基本认为是中性,因为醋酸根和铵根离子水解程度基本一致1年前查看全部
- 二氧化碳酸碱性是什么?将二氧化碳气体通入紫色石蕊试液中,会有什么变化?我指的是单纯的二氧化碳啊,没水的!有没有没水的石蕊
二氧化碳酸碱性是什么?
将二氧化碳气体通入紫色石蕊试液中,会有什么变化?
我指的是单纯的二氧化碳啊,没水的!
有没有没水的石蕊试液? 银魔像1年前3
银魔像1年前3 -
 诺亚与方舟 共回答了17个问题
诺亚与方舟 共回答了17个问题 |采纳率94.1%但是 紫色石蕊试液中有水啊
二氧化碳溶于溶液中产生碳酸
变红了就
那就不是试液啦
倒是有石蕊试纸 可是干燥的石蕊试纸放在二氧化碳中没有变化 只有湿润后才能看出来 说明二氧化碳其实算酸性氧化物1年前查看全部
- 填写下列溶液的酸碱性:Na2SO4()CuSO4()NaCL( )
 ifyue1年前1
ifyue1年前1 -
 lgx121 共回答了30个问题
lgx121 共回答了30个问题 |采纳率86.7%中性,酸性,碱性1年前查看全部
- 物质酸碱性的判别.哪些物质呈酸性,哪些物质呈碱性,哪些物质成中性?例如我们知道酸呈酸性,碱呈碱性.可是哪些盐呈酸性,哪些
物质酸碱性的判别.
哪些物质呈酸性,哪些物质呈碱性,哪些物质成中性?例如我们知道酸呈酸性,碱呈碱性.可是哪些盐呈酸性,哪些盐呈碱性,哪些气体呈酸性碱性呢?比较啰嗦,可是本人在化学方面比较低能,大恩不言谢.(^.^) tuotuohaohao1年前1
tuotuohaohao1年前1 -
 yueyueii 共回答了15个问题
yueyueii 共回答了15个问题 |采纳率100%你会区分那些是酸式根,碱式根吗?一般情况下有酸式根的成酸性,不过要分强弱的,碱性的也一样,酸式根比如,硫酸根,碳酸根,硝酸根之类的,碱性的主要是氢氧根,这样说你会明折吗?》1年前查看全部
- 怎样判断物质的熔点、沸点和酸碱性的大小?
 而已昂1年前3
而已昂1年前3 -
 judy8805 共回答了12个问题
judy8805 共回答了12个问题 |采纳率91.7%物质的熔点、沸点高低判断:1、首先看物质的晶体类型:一般规律是原子晶体>离子晶体>分子晶体 2、同类晶体分别按照晶体中构成粒子间的作用力大小来判断:原子晶体--看共价键的强弱,共价键越强,熔点越高.而共价键的强弱可以通过原子半径来比较---原子半径越小,共价键越强.例如金刚石>金刚砂(碳化硅)>晶体硅.离子晶体---看离子键(或晶格能)的强弱,离子键越强,熔点越高.而离子键的强弱可以通过离子半径和离子所带电荷数来比较----离子半径越大,离子所带电荷数越多,离子键越强.例如:MgO>NaCl>KCl.分子晶体---看分子间作用力,分子间作用力越大,熔点沸点越高.分子作用力的大小比较规律:组成和结构相似的物质,相对分子质量越大,分子间作用力越大.例如:CF4>CCl4>CBr4>CI4.当分子中存在氢键时,分子键作用力增大,熔点沸点升高.例如:H2O>H2Se>H2S.
物质的酸碱性判断:1、最高价含氧酸的酸性---看成酸元素的非金属性,非金属性越强,酸性越强.例如:HClO4>H2SO4>H3PO4.2、同一元素的不同价态含氧酸的酸性----看成酸元素的价态,价态越高,酸性越强.例如:HClO4>HClO3>HClO2>HClO.2、最高价金属氢氧化物的碱性---看金属元素的金属性强弱,金属性越强,碱性越强.例如:NaOH>Mg(OH)2>Al(OH)31年前查看全部
- 如何运用酸碱质子理论验证一个物质的酸碱性
 helen08291年前1
helen08291年前1 -
 dexuan 共回答了17个问题
dexuan 共回答了17个问题 |采纳率88.2%凡是可以释放质子(氢离子,H+)的分子或离子为酸(布朗斯特酸),凡是能接受氢离子的分子或离子则为碱(布朗斯特碱).所以HCO-3也是两性物质,可以释放出H+ 和CO3-,也可以接受H+变为H2CO31年前查看全部
- 为什么水电离的离子很少,却可以影响化学物品的酸碱性?
为什么水电离的离子很少,却可以影响化学物品的酸碱性?
水可以电离出氢离子和氢氧根离子,都为0.0000007
这么少,却可以影响化学物质的酸碱性
例如:碳酸钠 在水溶液里就成碱性呢?
我知道是因为碳酸和氢离子反应了
所以我想问的是,那么少的离子怎么就可以让他成碱性.
他自己的性质抵不过 那么点?
算了 ,我现在就是在学这个 主要是觉得那么少的离子可以影响其他化学物质的性质,觉得很了不起 并不是不懂这个盐的水解
不过还是要谢谢 当落叶忘记飞舞1年前1
当落叶忘记飞舞1年前1 -
 loverossi 共回答了23个问题
loverossi 共回答了23个问题 |采纳率87%不是因为碳酸和氢离子反应了,是H+和CO32-生成了H2CO3,促进了水的电离,而H2CO3是弱电解质,NaOH是电解质,溶液就成碱性.
要是你还不解,你可以去看看选修本的高2化学书,1年前查看全部
- 如何测定溶液的酸碱性
 没开花就结果1年前4
没开花就结果1年前4 -
 斯远 共回答了17个问题
斯远 共回答了17个问题 |采纳率88.2%测定PH值,
较为粗糙的方法,是指示剂法,PH试纸显色变化,根据标准色卡对比颜色,只能估计大概值.
PH计,电化学原理,测定的PH值精确度很高.1年前查看全部
- 溶液的酸碱性用什么测定能用ph试纸吗
 弱水3千1年前4
弱水3千1年前4 -
 波兰琥珀CC 共回答了18个问题
波兰琥珀CC 共回答了18个问题 |采纳率88.9%可以.在常温下7是中性,<7是酸性,>7是碱性.
如果要求很精确的话,可以使用pH计(一种电子仪器)来测量.
满意请采纳,谢谢~
欢迎追问,在线回答1年前查看全部
- 关于物质的酸碱性碳酸钾溶液竟然是碱性的!难道不是某酸某都是酸性的吗?请问该怎么区别?
 melodyyan1年前7
melodyyan1年前7 -
 sicyang 共回答了21个问题
sicyang 共回答了21个问题 |采纳率100%有一种简单的记法
如果一个盐是弱酸强碱盐 就是醋酸,碳酸等弱酸的酸根配上强碱的阳离子比如钠离子,钾离子
那么就显碱性
反之,如果是强酸弱碱盐比如硫酸铵,氯化铵,就显酸性
口诀就是谁强显谁性,同强显中性(比如醋酸铵,氯化钠)
这个涉及水解的知识 具体的可以再问我1年前查看全部
- 氯化镁,氯化钙,的水溶液酸碱性?金属阳离子的氢氧化物不是都强碱吗?怎么还有酸碱性?如何判断水溶液的酸碱性?
 wx811395181年前1
wx811395181年前1 -
 mg109 共回答了15个问题
mg109 共回答了15个问题 |采纳率93.3%氯化镁强酸弱碱盐所以显碱性,氯化钙是强酸强碱盐所以显中性;只有K Ca Na Ba四种强碱其他都是弱碱
从ph判断 常温下 ph<7酸性.PH=7中性.pH>7碱性从浓度判断 氢离子浓度大于氢氧根浓度.酸性氢离子等于氢氧根.中性氢离子小于氢氧根 碱性1年前查看全部
- (2011•南京)电解水实验可以确定水的组成.甲、乙、丙三位同学对电解水后液体的酸碱性进行探究.
(2011•南京)电解水实验可以确定水的组成.甲、乙、丙三位同学对电解水后液体的酸碱性进行探究.

【提出问题】电解水后的液体一定呈中性吗?
【查阅资料】
图Ⅰ所示装置可用于电解水实验;硫酸钠可增强水的导电性,硫酸钠溶液呈中性.
【实验与讨论】
三位同学分别向U形管中加入含有酚酞的硫酸钠溶液,接通直流电,观察现象,电解一段时间后,断开电源.
(1)实验中发现试管①电极附近的溶液迅速变红,管②电极附近的溶液仍为无色,乙同学用pH试纸测定管②电极附近的溶液,pH小于7.说明试管①电极附近的溶液呈______性,管②附近的溶液呈______(选填“酸”、“碱”或“中”)性.
(2)甲同学将实验后U形管中的溶液按图Ⅱ所示倒入烧杯中,发现红色立刻消失.乙同学、丙同学将试验后U形管中的溶液按图Ⅲ所示分别倒入烧杯中,发现红色不完全消失.经讨论与分析,乙、丙同学的试验中溶液的红色不消失,原因可能是酸______.
(3)甲、乙、丙同学分别用蒸馏水洗涤U形管、碳棒等,再将洗涤液倒入自己实验的烧杯中,观察现象:
甲同学的溶液仍为无色.
乙同学的溶液中红色仍不消失.
丙同学的溶液中红色______.
(4)甲、乙、丙同学分析了实验现象,为确证溶液的酸碱性,又进行下列实验:
甲同学用______来测定溶液,原因是______.
乙同学向溶液中滴加______,使溶液中红色刚好褪去.因为造成(3)中溶液的红色仍不消失的原因是______.
【解释与结论】
用硫酸钠增强水的导电性时,电解后溶液混合均匀,呈中性.
【交流与反思】
甲同学取55g质量分数为2%的硫酸钠溶液进行电解,消耗了5g水后,则电解后硫酸钠溶液的质量分数为______.
甲同学的老师上课时用NaOH增强水的导电性,电解后溶液的碱性______.
乙同学的老师上课时用H2SO4增强水的导电性,电解后溶液的酸性______. jiuweitoupiao1年前1
jiuweitoupiao1年前1 -
 江北的雪松 共回答了17个问题
江北的雪松 共回答了17个问题 |采纳率88.2%解题思路:本题是溶液酸碱性的测定,利用酸碱指示剂或者pH试纸都可以测定出来,解题的关键是判断溶液里面的成分.根据实验的结果对溶液的酸碱性做出判断,进而分析即可.
【实验与探讨】(1)酚酞溶液遇碱变红,pH值小于7溶液显酸性.
故答案为:碱;酸
(2)红色不消失说明还有碱性溶液.
故答案为:不足(或酸液残留在管壁上等)
(3)丙同学的溶液中酸与碱恰好完全反应了.
故答案为:恰好褪去(或立即消失)
(4)因为酚酞溶液与酸不反应没有现象,所以无色就有2种情况,而用pH试纸就可以很简单的判断此时的溶液到底呈什么性.
故答案为:pH试纸;实验中滴加酚酞的溶液变为无色,可能呈中性,也可能因酸过量而呈酸性,故用pH试纸来确认.稀硫酸(或酸);乙同学用pH试纸测定管②电极附近溶液时消耗了少量酸.
【交流与反思】甲同学消耗了5克水,溶液还剩50克,而溶质没有变还是55×2%=1.1g.所以电解后的溶液中溶质的质量分数为[1.1g/50g]×100%=2.2%.为提高水的导电性,加入酸时,由于溶液中减少的是水,即酸的浓度在增大,所以酸性在增强,pH值在减小.而加入的是碱时,由于也是水在减少,即碱的浓度在增大,所以碱性增强,pH在增大.
故答案为:2.2%;增强;增强点评:
本题考点: 溶液的酸碱性测定;实验探究物质的性质或变化规律;酸碱指示剂及其性质.
考点点评: 本题是有一定难度的,一是题干太长,容易使人出现审题疲劳,二是如何选择判断酸碱性的方法.1年前查看全部
- 如何设计实验检验亚硫酸溶液的酸碱性?
如何设计实验检验亚硫酸溶液的酸碱性?
要有化学反应的,不要用酸碱指示剂! zhrj20071年前1
zhrj20071年前1 -
 sh66128467do 共回答了20个问题
sh66128467do 共回答了20个问题 |采纳率95%利用和碳酸钠
H2SO3+Na2CO3=====Na2SO3+H2O+CO2
可以证明有酸性1年前查看全部
- 如何用实验证明最高价氧化物对应的水化物的酸碱性
 hua_jeey1年前1
hua_jeey1年前1 -
 叶夜星1 共回答了24个问题
叶夜星1 共回答了24个问题 |采纳率100%用专业仪器测量水溶液的PH1年前查看全部
- 可燃性的物质:助燃性的物质:还原性的物质:氧化性的物质:酸碱性的物质:以上这些物质请大家帮忙想几个
 zl6281年前2
zl6281年前2 -
 xiaobao20 共回答了25个问题
xiaobao20 共回答了25个问题 |采纳率92%可燃性的物质:
H2、CO、C、CH4、S
助燃性的物质:
O2
还原性的物质:
Fe、Na、Al、Mg...金属活动顺序表的金属
C、H2、CO
氧化性的物质:
O2、CL2、浓硫酸,硝酸,Fe3+、H2O2
酸碱性的物质:
酸性:常见的酸有HCl,H2SO4、CH3COOH、HNO3、H2CO3、H3PO4、H2SO3.
还有某些强酸弱碱盐FeCL3、CuSO4...
碱性:常见的碱有NaOH、Ca(OH)2、Ba(OH)2、KOH、NH3·H2O
还有强碱弱酸盐:Na2CO3、NaHCO3、CaHCO3.1年前查看全部
- 溶液酸碱性与离子共存的关系不要太复杂了
 栾栾兮_1年前3
栾栾兮_1年前3 -
 平凡人物 共回答了14个问题
平凡人物 共回答了14个问题 |采纳率78.6%有碱性就没有:Mg ,NH4,Ag(注意,过多会形成银铵溶液)
有H+离子就是不能有弱酸根在里面,如果有硝酸根,硫酸根的话,就要注意有什么有什么容易被氧化的物质,如果有,离子也不能共存
这些大概就是我的高三经验了.如果题目不是太变态,就可以应付了1年前查看全部
- 一道水的电离和溶液酸碱性的化学题
一道水的电离和溶液酸碱性的化学题
25摄氏度时,水的电离达到平衡,焓变大于0,下列叙述正确的是
(1)向水中加希氨水,平衡逆向移动,C(OH-)降低.
(2)向水中加少量固体硫酸氢钠,c(H+)增大,Kw不变.
(3)向水中加少量固体CH3COONa,平衡逆向移动,c(H+)降低
(4)将水加热,Kw增大,pH不变... 杜鹃azalea1年前1
杜鹃azalea1年前1 -
 kelkelg 共回答了14个问题
kelkelg 共回答了14个问题 |采纳率85.7%(2)向水中加少量固体硫酸氢钠,c(H+)增大,Kw不变.
1)向水中加希氨水,平衡逆向移动,C(OH-)增大.
(3)向水中加少量固体CH3COONa,平衡正向移动,c(H+)降低
(4)将水加热,Kw增大,pH变小...1年前查看全部
- (2011•青岛)不同物质的溶液酸碱性不同.根据下表中所列物质pH的情况判断,下列说法中正确的是
(2011•青岛)不同物质的溶液酸碱性不同.根据下表中所列物质pH的情况判断,下列说法中正确的是
( )物质 盐酸 硫酸镁溶液 氯化钠溶液 蒸馏水 碳酸钾溶液 氢氧化钙溶液 pH 小于7 小于7 等于7 等于7 大于7 大于7
A.pH小于7的一定是酸溶液
B.pH大于7的一定是碱溶液
C.pH等于7的一定是水
D.盐的溶液可能显酸性、碱性或中性 runbayue1年前1
runbayue1年前1 -
 终年汲引绝 共回答了16个问题
终年汲引绝 共回答了16个问题 |采纳率93.8%解题思路:当溶液的pH等于7时,呈中性.当溶液的pH大于7时,呈碱性.当溶液的pH小于7时,呈酸性.A、pH小于7的不一定是酸溶液,例如硫酸镁属于盐,水溶液的pH小于7.错误;
B、pH大于7的不一定是碱溶液,例如碳酸钠属于盐,水溶液的pH大于7.错误;
C、氯化钠属于盐,水溶液的pH等于7.错误;
D、盐的溶液可能显酸性、碱性或中性.正确.
故选D.点评:
本题考点: 溶液的酸碱性与pH值的关系.
考点点评: 解答本题要掌握溶液的酸碱性和溶液pH大小之间的关系,然后再根据具体物质的水溶液的酸碱性进行分析、判断,从而得出正确的结论.1年前查看全部
- 磷酸氢二钠和磷酸二氢钠的酸碱性
 立_青1年前2
立_青1年前2 -
 hh710 共回答了15个问题
hh710 共回答了15个问题 |采纳率80%NaH2PO4是酸性
Na2HPO4是碱性1年前查看全部
- 酸碱性是物理性质还是化学性质?
 lmyd1年前1
lmyd1年前1 -
 liuhaibo2 共回答了12个问题
liuhaibo2 共回答了12个问题 |采纳率66.7%显然是化学物质,酸是溶液H ̄离子含量多于OH ̄,碱性反之,并不是含氢离子就显酸性,是氢离子浓度多于氢氧根才显酸性1年前查看全部
- (2003•武汉)某学习小组的同学,欲在不使用酸碱指示剂或试纸等测酸碱性的条件下,通过添加试剂的方法将含有硝酸的硝酸钙溶
(2003•武汉)某学习小组的同学,欲在不使用酸碱指示剂或试纸等测酸碱性的条件下,通过添加试剂的方法将含有硝酸的硝酸钙溶液变为中性.甲同学提出选用石灰石粉末,乙同学提出选用澄清的石灰水.比较甲、乙两同学所选试剂,你认为______同学的选择不可行;理由是该试剂虽能除去原混合液中的______,但______.
 有朋不亦乐乎1年前1
有朋不亦乐乎1年前1 -
 香山红叶22 共回答了26个问题
香山红叶22 共回答了26个问题 |采纳率96.2%解题思路:可以根据物质的性质方面进行分析、判断,从而得出正确的结论.例如,用石灰水中和硝酸时,因为两者反应时无明显现象,无法判断是否恰好完全反应.石灰石不溶于水,和硝酸充分反应后不再溶解.石灰水和硝酸是否恰好完全反应不容易判断.
故填:乙;H+(或HN03或硝酸);在不用指示剂的情况下,难控制溶液的酸碱性.点评:
本题考点: 物质除杂或净化的探究;化学性质与物理性质的差别及应用;反应现象和本质的联系.
考点点评: 解答本题的关键是要掌握物质的物理性质和化学性质,只有这样才能对问题做出正确的判断.1年前查看全部
- 高中阶段常见酸碱的酸碱性强弱的排列顺序 要全的
 有泪就流吧1年前1
有泪就流吧1年前1 -
 zhengzzzzz 共回答了20个问题
zhengzzzzz 共回答了20个问题 |采纳率85%中学常见弱酸强弱记诵口诀(从前到后酸性逐渐变弱,只考虑第一级电离的比较)
亚硫磷酸氢氟酸,亚硝甲酸冰醋酸,碳酸氢硫氢氰酸.
即H2SO3>H3PO4>HF>HNO2>HCOOH>CH3COOH>H2CO3>H2S>HCN
其他常见酸如HClO4,H2SO4,HNO3,HI,HBr都是强酸,强酸在水里视作酸性等同(水的拉平效应,使得强酸一级电离完全)
碱性:Fe(OH)2>Fe(OH)3>Cu(OH)2
强碱之间不用排了,都差不多1年前查看全部
- (1)有机物一定不显酸碱性吗?(2)Na2SO4的水溶液呈什么性?(3)催化剂反应前后什么变了?(4)BaCl2与浓H2
(1)有机物一定不显酸碱性吗?
(2)Na2SO4的水溶液呈什么性?
(3)催化剂反应前后什么变了?
(4)BaCl2与浓H2SO4混合,有什么现象? 跑丢的牛牛1年前5
跑丢的牛牛1年前5 -
 快乐学 共回答了14个问题
快乐学 共回答了14个问题 |采纳率92.9%(1)不一定,羧酸类(如乙酸)为酸性
酚类(如苯酚)也呈弱酸性
(2)显中性,为强酸强碱盐,没有离子水解
(3)一般什么都不变.如果变的话,那只有颗粒大小变化了.
(4)有白色沉淀(BaSO4),并伴随着白烟,是氯化氢气体1年前查看全部
- 为了更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG═lgc(H+)/c(OH-).已知常温下某无色溶液的A
为了更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG═lgc(H+)/c(OH-).已知常温下某无色溶液的AG═12,则此溶液中大量共存的离子组是( )
A.Na+、AlO2-、K+、NO3-
B.MnO4-、K+、SO42-、Na+
C.Mg2+、SO42-、HCO3-、Na+
D.NH4+、NO3-、Al3+、Cl- wang34211年前1
wang34211年前1 -
 小小一水寇 共回答了13个问题
小小一水寇 共回答了13个问题 |采纳率92.3%解题思路:AG═12,AG═lgc(H+)/c(OH-),c(H+)>c(OH-),溶液显酸性,离子之间不能结合生成水、气体、沉淀,则离子大量共存,并结合离子的颜色来解答.AG═12,AG═lgc(H+)/c(OH-),c(H+)>c(OH-),溶液显酸性,
A.因H+、AlO2-结合生成沉淀,不能大量共存,故A错误;
B.该组离子之间不反应,能共存,但MnO4-为紫色,与无色溶液不符,故B错误;
C.因HCO3-、H+结合生成水和气体,则不能大量共存,故C错误;
D.该组离子之间不反应,能共存,且离子均为无色,故D正确;
故选D.点评:
本题考点: 离子共存问题.
考点点评: 本题考查离子的共存,把握习题中的信息为解答本题的关键,注重学生知识的迁移应用能力和离子之间反应的考查,注意常见离子的颜色,题目难度不大.1年前查看全部
- 由水电离产生的C(H+)=1×10-14mol/L的溶液,为什么不能确定溶液的酸碱性?
由水电离产生的C(H+)=1×10-14mol/L的溶液,为什么不能确定溶液的酸碱性?
另外,为什么由水电离产生的H+浓度大于10^-7mol/L,则该溶液一定呈酸性? 梦白茱莉1年前1
梦白茱莉1年前1 -
 amorv 共回答了16个问题
amorv 共回答了16个问题 |采纳率87.5%溶液中的H+和OH—可能来自多种物质的电离,一种是水的电离,另一种是溶质的电离.为了区分我们用了两个词:水电离的H+、溶液中的H+,当溶液中的溶质不电离出H+时,溶液中的
C(H+)等于水电离出的C(H+),当溶液中的溶质能够电离出H+时,溶液中的C(H+)等于水电离出的C(H+)加上溶质电离出的C(H+),由于溶质(酸)电离出的C(H+)远远大于水电离出的C(H+),所以溶液中的C(H+)近似等于溶质电离出的C(H+).如本题的问题“由水电离产生的C(H+)=1×10-14mol/L的溶液”,如果该溶液为酸的溶液,酸对水的电离起抑制作用,水电离出的C(H+)等于水电离出的C(OH—)可知,由水电离出的C(OH—)=1×10-14mol/L,则溶液中C(H+)=1mol/L;如该溶液为碱的溶液,溶液中的C(H+)等于水电离出的C(H+),所以溶液中的C(OH—)=1mol/L.也就是说当溶液中由水电离产生的C(H+)=1×10-14mol/L的溶液时,不能确定溶液的酸碱性.酸、碱对水的电离起抑制作用,所以溶液中由水电离出的
C(H+)、C(OH—) 都小于1×10-7mol/L,当溶质为可水解的盐时,水的电离受到促进,而当由水电离产生的H+浓度大于10^-7mol/L时,该盐一定是结合水电离出的OH—,故溶液呈酸性.1年前查看全部
- 气体酸碱性气体能不能有酸碱性?我的意思不是说H2CO3,H2SO3之类的我的意思是说如:CO2显酸性(这句话对不对)或者
气体酸碱性
气体能不能有酸碱性?我的意思不是说H2CO3,H2SO3之类的我的意思是说如:CO2显酸性(这句话对不对)或者CO2属于酸. ystree1年前2
ystree1年前2 -
 yiluodeyishi 共回答了21个问题
yiluodeyishi 共回答了21个问题 |采纳率90.5%不能,气体的水溶液具有酸碱性,而不能说气体具有酸碱性,我们老师强调过.1年前查看全部
- 三价铬在不同酸碱性介质中还原性及还原产物
三价铬在不同酸碱性介质中还原性及还原产物
酸性,中性和碱性 Stifensini1年前1
Stifensini1年前1 -
 人在中山 共回答了17个问题
人在中山 共回答了17个问题 |采纳率94.1%在酸性溶液中,三价铬的还原性很弱.在碱性溶液中,有较强的还原性,还原产物为CrO4 2-1年前查看全部
- 实验室用强酸碱性气体排风时,排风管道上有静压箱,排风管道用不锈钢材质好,还是玻璃钢材质?
实验室用强酸碱性气体排风时,排风管道上有静压箱,排风管道用不锈钢材质好,还是玻璃钢材质?
实验室用强酸碱性气体排风时,排风管道上有静压箱,排风管道用不锈钢材质好,还是玻璃钢材质好,静压箱有不锈钢静压箱吗?
玻璃钢风管用有机玻璃钢风管还是无机玻璃管风管好?大边长1000mm,厚度为多少,还有什么技术要求没有 nn头等舱1年前3
nn头等舱1年前3 -
 飞鸟与鱼lxj 共回答了29个问题
飞鸟与鱼lxj 共回答了29个问题 |采纳率86.2%玻璃钢材质好,玻璃钢能够耐受大多数酸碱的腐蚀,但不锈钢不行!静压箱有不锈钢静压箱!1年前查看全部
- 帮忙总结铬,锰,铁,钴,镍的氢氧化物的酸碱性和氧化还原性
帮忙总结铬,锰,铁,钴,镍的氢氧化物的酸碱性和氧化还原性
请另外对它们的氧化还原能力大小作比较 hhnb20081年前2
hhnb20081年前2 -
 writeone 共回答了13个问题
writeone 共回答了13个问题 |采纳率92.3%氢氧化铬 两性
氢氧化锰 碱性
氢氧化铁具有两性,但其碱性强于酸性
氢氧化钴 碱性
氢氧化镍 碱性
全部都是既有氧化性有有还原性.1年前查看全部
- 关于酸碱性的强弱比对问题从元素周期表中我们可以发现Cl的非金属性强于S的所以对应的氧化水化物高氯酸酸性强于硫酸.但从离子
关于酸碱性的强弱比对问题
从元素周期表中我们可以发现Cl的非金属性强于S的所以对应的氧化水化物高氯酸酸性强于硫酸.
但从离子浓度上来讲硫酸对应的是两份氢,而高氯酸只对应一分
而且都是完全电离难道不矛盾么 1文冠木1年前1
1文冠木1年前1 -
 sunhaoai 共回答了14个问题
sunhaoai 共回答了14个问题 |采纳率85.7%这牵扯到大学知识----“拉平效应”,也称校平效应(leveling effect)”.通过溶剂的作用,使不同强度的酸或碱显示同等强度的效应.根据酸碱质子理论,一种物质在某种溶液中表现出的酸或碱的强度,不仅与酸碱的本质有关,也与溶剂的性质的有关.如HClO4在水中是一种强酸,趋近于完全离解,但在冰醋酸中却不能完全离解.高氯酸和硫酸是强酸在水中都能完全电离,没法区分强弱,得选择其他合适的溶剂才能区分开.
你可以百度“拉平效应”来看看,以获得更多相关知识.1年前查看全部
- 铬锰铁钴镍的氢氧化物的酸碱性和氧化还原性是怎样
 Gingko_Z1年前1
Gingko_Z1年前1 -
 qianliyan 共回答了19个问题
qianliyan 共回答了19个问题 |采纳率84.2%三价钴镍的氢氧化物有较强氧化性,用盐酸溶有氯气产生,二价锰的氢氧化物还原性强,易被氧化为三价,三价铬的氢氧化物较稳定.铬锰的氢氧化物为两性,铁钴镍的氢氧化物两性偏碱1年前查看全部
- 人们用______来表示溶液酸碱性的强弱程度,用______可以测定溶液的酸碱度.溶液的酸碱性:pH=7,溶液呈____
人们用______来表示溶液酸碱性的强弱程度,用______可以测定溶液的酸碱度.溶液的酸碱性:pH=7,溶液呈______性,pH<7,溶液呈______性,pH>7,溶液呈______性.溶液的pH与酸碱性强弱的关系:pH越大,______,pH越小,______.
 echo61871年前1
echo61871年前1 -
 bairai1 共回答了11个问题
bairai1 共回答了11个问题 |采纳率90.9%解题思路:可以根据溶液的酸碱性与溶液的pH大小关系方面碱性综合分析,从而得出正确的结论.通常用pH来表示溶液的酸碱性强弱程度.故填:pH
通常用pH试纸测定溶液的酸碱度.故填:pH试纸.
当溶液的pH等于7时,呈中性.当溶液的pH大于7时,呈碱性.当溶液的pH小于7时,呈酸性.故填:中;酸;碱;
溶液的pH越大,碱性越强.pH越小,酸性越强.故填:碱性越强;酸性越强.点评:
本题考点: 溶液的酸碱性与pH值的关系.
考点点评: 本题主要考查了溶液的酸碱性与溶液pH的关系及其如何测定溶液酸碱度等方面的内容.1年前查看全部
- 怎么用化学式分辨溶液的酸碱性,初中范围内.强酸强碱,弱酸弱碱是什么?怎么用?顺便举下例子.
 起个名真的很难1年前3
起个名真的很难1年前3 -
 野狮尾 共回答了16个问题
野狮尾 共回答了16个问题 |采纳率93.8%强、弱酸 是酸性的(即是含H+的) 比如Hcl、H2CO3
强、弱碱 是碱性的(即是含OH-的) 比如NaOH、Ca(OH)2
强酸是指完全可电离的酸 Hcl盐酸,H2SO4硫酸
弱酸是指不完全电离的酸 H2CO3碳酸
强碱是指完全可电离的碱 NaOH
弱碱是指不完全电离的碱 Ca(OH)2
初中范围的就是以上几个而已1年前查看全部
- 向氢氧化钠和酚酞溶液的混合液中滴加稀盐酸,红色褪去后,为了检验所得溶液的酸碱性,将所得溶液分成四等份,进行如下实验,其中
向氢氧化钠和酚酞溶液的混合液中滴加稀盐酸,红色褪去后,为了检验所得溶液的酸碱性,将所得溶液分成四等份,进行如下实验,其中实验结论正确的是( )
选项 实验操作和现象 实验结论 A 向所得溶液中加入紫色石蕊,又变红色 该溶液显酸性 B 向所得溶液中再加入少量氢氧化钠溶液,不变色 该溶液显中性 C 向所得溶液中加入碳酸钠粉末,有气泡 该溶液显碱性 D 向所得溶液中加入少量锌粒,有气泡 该溶液显中性
A. A
B. B
C. C
D. D 心爱新灵1年前1
心爱新灵1年前1 -
 carol1022 共回答了21个问题
carol1022 共回答了21个问题 |采纳率90.5%解题思路:氢氧化钠溶液中滴加酚酞后溶液呈红色,滴加盐酸,红色褪去,溶液可能是中性或酸性,根据酸性溶液的性质分析解答.A、氢氧化钠溶液中滴加酚酞后溶液呈红色,滴加盐酸,红色褪去,溶液可能是中性或酸性,滴加紫色石蕊试液变红色,说明呈酸性,故A正确;
B、氢氧化钠溶液中滴加酚酞后溶液呈红色,滴加盐酸,红色褪去,溶液可能是中性或酸性,滴加少量氢氧化钠溶液不变色,说明盐酸过量,溶液呈酸性,将加入的氢氧化钠中和,故B错误;
C、氢氧化钠溶液中滴加酚酞后溶液呈红色,滴加盐酸,红色褪去,溶液可能是中性或酸性,滴加碳酸钠溶液有气泡,说明溶液呈酸性,故C错误;
D、氢氧化钠溶液中滴加酚酞后溶液呈红色,滴加盐酸,红色褪去,溶液可能是中性或酸性,加入锌粒有气泡,说明溶液呈酸性,故D错误;
故选A.点评:
本题考点: 溶液的酸碱性测定;酸碱指示剂及其性质.
考点点评: 酸性溶液能使紫色石蕊试液变红,能与碳酸盐反应生成二氧化碳,能与氢前金属反应生成氢气.1年前查看全部
- 稀硫酸,氢氧化钠溶液,稀盐酸,氢氧化钙溶液的酸碱性?
 老汉今年80岁1年前2
老汉今年80岁1年前2 -
 creamsky1126 共回答了21个问题
creamsky1126 共回答了21个问题 |采纳率90.5%按顺序 酸.碱.酸.碱1年前查看全部
- 为更好地表示溶液酸碱性,科学家提出了酸度AG的概念,AG=lgc(H+)/c(OH-).
为更好地表示溶液酸碱性,科学家提出了酸度AG的概念,AG=lgc(H+)/c(OH-).
常温下0.01mol/L的HCL AG=? 宁瑟1年前2
宁瑟1年前2 -
 lpy9000 共回答了17个问题
lpy9000 共回答了17个问题 |采纳率94.1%101年前查看全部
- c(H+)/c(OH-)=10^12,怎么化简判定酸碱性
 2830387751年前4
2830387751年前4 -
 binbin33 共回答了35个问题
binbin33 共回答了35个问题 |采纳率74.3%明显H+浓度远远大于OH-的浓度,所以溶液酸性1年前查看全部
- 一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示.下列判断正确的是( )
一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示.下列判断正确的是( )

A. 在0-50 min之间,pH=2和PH=7时R的降解百分率不相等
B. 在20-25 min之间,pH=10 时R的平均降解速率为0.04 mol•L-1•min-1
C. 溶液酸性越强,R 的降解速率越小
D. R的起始浓度和溶液的PH均影响R的降解速率 落51片叶子1年前0
落51片叶子1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 属于化学性的是~导电性延展性酸碱性挥发性
 mycox1年前1
mycox1年前1 -
 sfaagaga 共回答了19个问题
sfaagaga 共回答了19个问题 |采纳率89.5%酸碱性1年前查看全部
- 1、为了更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念
1、为了更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念
AG=lg.已知某无色溶液的AG=12,则在此溶液中能大量共存的离子组是( )
A.Na+、AlO2-、K+、NO3-
B.MnO4-、K+、SO42-、Na+
C.NH4+、NO3-、Al3+、Cl-
D.Mg2+、SO42-、HCO3-、Na+
已知选择C,能说下思路吗? pic161年前1
pic161年前1 -
 5412300 共回答了13个问题
5412300 共回答了13个问题 |采纳率92.3%首先明白酸度=lgc(h+)/(oh-)
题中AG=12,故c(h+)/c(oh-)=10^12
溶液呈酸性.
好,我们看题:
A:ALO2-就是四羟基和氯酸跟,他会跟算反应,先生成氢氧化铝沉淀,如果氢离子还多,就继续溶解.故A错.
B:题目要求无色溶液,而MnO4-显紫色,所以不行.
D:氢离子与碳酸氢跟离子反应生成水和二氧化碳,也不行.
C:没问题~1年前查看全部
- 简答题,回答下列问题简答:1,有什么方法抑制酶的活性2,单体化合物的结构研究步骤程序3,比较酸碱性(黄酮类酸性)用化学方
简答题,回答下列问题
简答:1,有什么方法抑制酶的活性
2,单体化合物的结构研究步骤程序
3,比较酸碱性(黄酮类酸性)
用化学方法鉴别
1,黄酮不同类型的比较
2,强心苷甲型乙型,小檗碱
某挥发油中含有生物碱A,醇类B,醛类C,醚萜类D,设计提取方案 古庭毅华1年前1
古庭毅华1年前1 -
 其实我是上帝 共回答了16个问题
其实我是上帝 共回答了16个问题 |采纳率93.8%一、酶的抑制剂有两种,竞争性和非竞争性
若产物是该种酶的抑制剂,则抑制酶活性
若产物影响反映的pH也会影响酶活性
若反应使温度发生变化,也会影响
注:反应速率变慢不一定是酶活性降低,如底物浓度影响反应速率而不一定影响酶活性
二、1首先要检验纯度2确定化合物的类型结构3确定熔点
三、黄酮类酸性和什么比较?1年前查看全部
大家在问
- 1麻烦各位帮忙把下面的时态改为进行时,小弟感激不尽~!
- 2寻找父母的爱手抄报内容
- 3灵魂 作文
- 43分之2和5分之3哪个大
- 5钻木取火经历了哪些能量传递转化环节
- 61+2-3-4+5+6-7-8+9+10-11-12+...+2009+2010-2011-2012+2013=?七年级
- 7The nearest hospital is about 6 Kilometers___here. Afay away
- 8乘法交律和乘法结合律还有乘法分配律的公式,一定采纳。
- 9wash room the and afternoon the clothes clean I inting 连词成句
- 10已知a+b+2的绝对值与(ab-1)平方互为相反数.
- 11《蠢狼》填空有一只狼,住在狼窝里.这狼窝从来不打扫,不整修,又脏又破烂,眼看就要倒塌了!有一天,大象偶然路过这破狼窝,不
- 12自然数的大小平方按从大小排成1 4 9 16 25 36 49...问:第200个位置的数字是几?
- 13感谢老师的序言怎么写?是给作文集写序言.文笔要优美,充满真情实感.
- 14小杰与小丽分别从相距27千米的A、B两地同时出发相向而行,3小时后相遇,相遇后两人按原来的速度继续前进
- 15根毛适于吸水的特点是不是细胞壁厚呢?
