求碳族元素电势图.图或链接。
 春风亦要解风情2022-10-04 11:39:541条回答
春风亦要解风情2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 hyheqing 共回答了17个问题
hyheqing 共回答了17个问题 |采纳率94.1%- 卤族,氮族,氧族,碳族物质转化图即知识框架+化学方程式 给你方程式,你可以自己画画! 卤族元素 Cl2+Cu=CuCl2 3Cl2+2Fe=2FeCl3 Cl2+2Na= 2NaCl
- 1年前
相关推荐
- 根据碳族元素的相似性与递变性、一般性与特殊性的知识,判断下列说法正确的是( ) A.
根据碳族元素的相似性与递变性、一般性与特殊性的知识,判断下列说法正确的是( )
A.CO 2 、PbO 2 都是强氧化剂 B.CO 2 和PbO 2 都是弱氧化剂,CO和PbO都是还原剂 C.Sn(OH) 4 可与NaOH反应,但不与盐酸反应 D.Ge单质的熔点介于Si、Pb之间,是半导体材料  lb5hbv1年前1
lb5hbv1年前1 -
 jam68 共回答了14个问题
jam68 共回答了14个问题 |采纳率100%D
碳族元素中,C、Si、Ge、Sn的+4价化合物稳定,而Pb的+2价化合物稳定,+4价不稳定的元素表现强氧化性,+2价不稳定的元素则表现强还原性,故A、B都错。Sn是典型金属,所以其最高价氧化物对应的水化物Sn(OH) 4 和HCl易反应,碳族元素单质的熔沸点由上而下逐渐降低,故D正确。1年前查看全部
- A、B分别为碳族元素的两种单质,它们在一定条件下可以发生如下图所示的转化(反应过程中消耗或生成的水均已略去).
 A、B分别为碳族元素的两种单质,它们在一定条件下可以发生如下图所示的转化(反应过程中消耗或生成的水均已略去).
A、B分别为碳族元素的两种单质,它们在一定条件下可以发生如下图所示的转化(反应过程中消耗或生成的水均已略去).
(1)请写出一个含有A、B两种单质的置换反应:SiO2+2C
Si+2CO↑高温 .SiO2+2C.
Si+2CO↑高温 .
(2)由H制D的反应是某种工业的主要反应之一,请写出此反应的化学方程式:SiO2+Na2CO3
Na2SiO3+CO2↑高温 .SiO2+Na2CO3.
Na2SiO3+CO2↑高温 .
(3)反应⑤的离子方程式为______. 菲茜的乖乖1年前1
菲茜的乖乖1年前1 -
 腰花111 共回答了15个问题
腰花111 共回答了15个问题 |采纳率86.7%解题思路:本题属于推断题,根据题目给出的流程图和信息:A、B分别为碳族元素的两种单质,含有A、B两种单质的置换反应是:二氧化硅和碳在高温的条件下反应生成硅和一氧化碳,配平即可.A、B分别为碳族元素的两种单质,A能够和浓氢氧化钠反应,B能够和热的浓硫酸反应,因此A是硅,B是碳,碳和热的浓硫酸反应生成二氧化碳、二氧化硫和水,二氧化硫能够和溴水反应,因此F是二氧化硫,E是二氧化碳,D是硅酸钠,C是氢气;因此
(1)含有A、B两种单质的置换反应是:二氧化硅和碳在高温的条件下反应生成硅和一氧化碳,配平即可,故答案为:SiO2+2C
高温
.
Si+2CO↑;
(2)由H制D的反应是某种工业的主要反应之一,因此可以使二氧化硅和碳酸钠反应产生硅酸钠和二氧化碳,故答案为:SiO2+Na2CO3
高温
.
Na2SiO3+CO2↑
(3)反应⑤是二氧化硫和溴水反应生成硫酸和氢溴酸,故答案为:SO2+Br2+2H2O=4H++SO42-+2Br-.点评:
本题考点: 物质的鉴别、推断;书写化学方程式、文字表达式、电离方程式.
考点点评: 本考点属于物质的推断题,是通过对实验方法和过程的探究,在比较鉴别的基础上,得出了正确的实验结论;解答此题的关键是熟练掌握碳族元素的性质.1年前查看全部
- 一道关于碳族元素的化学题~物质A是一种高熔点的化合物,不溶于硫酸、硝酸等强酸,A与纯碱熔融生成化合物B,同时放出气体C,
一道关于碳族元素的化学题~
物质A是一种高熔点的化合物,不溶于硫酸、硝酸等强酸,A与纯碱熔融生成化合物B,同时放出气体C,把气体C通入B的溶液中则得化合物D,D在空气里干燥变成化合物E,加热E又的A
求ABCDE的化学式
以及一系列方程式 霉啊霉1年前1
霉啊霉1年前1 -
 sam315818 共回答了22个问题
sam315818 共回答了22个问题 |采纳率86.4%A:SiO2
B:Na2SiO3
C;CO2
D:H4SiO4(原硅酸)
E:H2SiO3
1)SiO2+Na2CO3熔融=(高温)Na2SiO3+CO2上升气号
2)CO2+Na2SiO3+H2O=Na2CO3+H4SiO4沉淀
3)H4SiO4=H2SiO3+H2O
4)H2SiO3=(加热)SiO2+H2O1年前查看全部
- (2010•山东)碳族元素包括C、Si、Ge、Sn、Pb.
(2010•山东)碳族元素包括C、Si、Ge、Sn、Pb.
(1)碳纳米管由单层或多层石墨层卷曲而成,其结构类似于石墨晶体,每个碳原子通过______杂化与周围碳原子成键,多层碳纳米管的层与层之间靠______结合在一起.
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为______.
(3)用价层电子对互斥理论推断SnBr2分子中Sn-Br键的键角______120°(填“>”“<”或“=”)
(4)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心.该化合物化学式为______,每个Ba2+与______个O2-配位. 小雨轻飞1年前1
小雨轻飞1年前1 -
 shend961130 共回答了17个问题
shend961130 共回答了17个问题 |采纳率88.2%解题思路:(1)石墨是层状结构的,每层每个C原子与周围的三个碳原子成σ键,键角为120°(这些都是实验数据得出的),根据价层电子对互斥理论分析;
(2)根据吸电子能力强的原子电负性大分析;
(3)首先判断价层电子对数目和有无孤电子对,进而判断分子的空间构型;
(4)利用均摊法计算该化合物的化学式.(1)石墨每个碳原子用SP2杂化轨道与邻近的三个碳原子以共价键结合,形成无限的六边形平面网状结构,每个碳原子还有一个与碳环平面垂直的未参与杂化的2P轨道,并含有一个未成对电子,这些平面网状结构再以范德华力结合形成层状结构.因碳纳米管结构与石墨类似.
故答案为:SP2 ;范德华力;
(2)根据共用电子对偏向电负性大的原子,已知CH4中共用电子对偏向C,SiH4中共用电子对偏向H,故有C>H>Si,
故答案为:C>H>Si;
(3)SnBr2分子中,Sn原子的价层电子对数目是
(4+2)
2=3,配位原子数为2,故Sn含有孤对电子,SnBr2空间构型为V型,键角小于120°,故答案为:<;
(4)根据均摊法可知,每个晶胞含有Pb4+:8×[1/8]8=1个,Ba2+:1个,O2-:12×[1/4]=3个,故化学式为PbBaO3,Ba2+ 处于晶胞中心,只有一个,O2-处于晶胞棱边中心,共有12个,故每个Ba2+与12个O2-配位.
故答案为:PbBaO3;12.点评:
本题考点: 碳族元素简介;元素电离能、电负性的含义及应用;键能、键长、键角及其应用;配合物的成键情况.
考点点评: 此知识点为选修内容,本题综合考查了原子杂化方式、电负性、价层电子对互斥理论、晶胞结构等知识,知识点全面,突出主干知识,题目难度中等,学生在学习过程中重点在于能利用模型解决问题,侧重于方法.1年前查看全部
- 碳族元素包括___、___、___、___、___、,位于元素周期表的第___族,其中非金属性最强的是___,金属性最强
碳族元素包括___、___、___、___、___、,位于元素周期表的第___族,其中非金属性最强的是___,金属性最强的是___.告诉答案即可
 yiqingwen1231年前9
yiqingwen1231年前9 -
 冷月颦儿泪 共回答了17个问题
冷月颦儿泪 共回答了17个问题 |采纳率88.2%位于元素周期表中ⅣA族,包括碳C、硅Si、锗Ge、锡Sn、铅Pb五种元素.碳、硅是非金属,锡、铅是金属,锗是半金属.非金属性最强的是碳,金属性最强的是铅1年前查看全部
- 碳族元素显+2价是否由于结构原因?原因是什么?
 PHI19801年前1
PHI19801年前1 -
 cuixinqing 共回答了16个问题
cuixinqing 共回答了16个问题 |采纳率87.5%碳原子外层有四个电子:两个p轨道电子,两个s轨道电子.
由于两个p轨道电子的能量比较接近,两个s轨道电子的能量也比较接近,而p轨道电子和s轨道电子的能量有一定的差别,所以一般情况下,碳先失去两个p轨道电子,呈+2价;然后又失去两个s轨道电子,呈+4价,而极少形成+3价1年前查看全部
- 根据碳族元素性质的相似性与递变性,判断下列说法正确的是( ) A.CO 2 是分子晶体,SiO 2 也是分子晶体 B.
根据碳族元素性质的相似性与递变性,判断下列说法正确的是( ) A.CO 2 是分子晶体,SiO 2 也是分子晶体 B.CO 2 具有氧化性,PbO 2 也具有氧化性 C.在常温下CCl 4 是液体,SiF 4 也是液体 D.金刚石和SiO 2 都是正四面体结构,12 g金刚石晶体中含2 mol共价键,6O g SiO 2 晶体中含2 mol共价键  深夜的ll1年前1
深夜的ll1年前1 -
 yiyun3 共回答了17个问题
yiyun3 共回答了17个问题 |采纳率94.1%A.SiO 2 是原子晶体,故A错误;
B.CO 2 、PbO 2 的化合价是+4价,化合价能降低,故B正确;
C.常温下,SiF 4 是气体,故C错误;
D.SiO 2 晶体中Si原子以四条单键的形式与氧原子连接在一起,6O g SiO 2 晶体中含4 mol共价键,故D错误.
故选B.1年前查看全部
- 下列叙述正确的是:A碳族元素中只有硅单质有半导体性能 B碳族元素单质的熔点,由碳到铅逐渐升高
下列叙述正确的是:A碳族元素中只有硅单质有半导体性能 B碳族元素单质的熔点,由碳到铅逐渐升高
C锗不存在气态氢化物
D碳族元素的最高价氧化物对应的水化物中碳酸的酸性最强 ejtg7l1年前2
ejtg7l1年前2 -
 thexboy 共回答了17个问题
thexboy 共回答了17个问题 |采纳率94.1%A Ge 也有半导体性能 ,A错
B 错 ,是降低的,C和Si的熔点比Pb高的多
C 存在 GeH4 沸点(101.325kPa):-88.℃
D 对 比如 H2CO3 >H2SiO3
选 D1年前查看全部
- 将氧族元素,氮族元素,卤素,碳族元素的性质归纳一下
将氧族元素,氮族元素,卤素,碳族元素的性质归纳一下
不用太仔细 hy8381年前1
hy8381年前1 -
 漂泊咴念 共回答了21个问题
漂泊咴念 共回答了21个问题 |采纳率85.7%这四族的性质是相似的,以O族为例:
1.非金属性:从上到下,非金属性越来越弱,
2.金属性:越来越强.
3.原子半径:由于电子层不同,所以电子层多的原子半径越大.即从上到下依次半径增大.
反正根据元素周期律来归纳了,建议先精通元素周期律.1年前查看全部
- 一道高一碳族元素基础选择题常温下,不跟单质硅起反应的物质是( )(A)氢氟酸 (B)氟气 (C)浓硝酸 (D)苛性钠溶液
一道高一碳族元素基础选择题
常温下,不跟单质硅起反应的物质是( )
(A)氢氟酸 (B)氟气 (C)浓硝酸 (D)苛性钠溶液
请把原因与化学方程式打在上面, xuhui9111年前4
xuhui9111年前4 -
 Tree20 共回答了24个问题
Tree20 共回答了24个问题 |采纳率95.8%选C
Si+4HF=SiF4+2H2
Si+2F2=SiF4
Si+2NaOH+H2O=Na2SiO3+2H21年前查看全部
- 一道有关碳族元素的推断题有一种白色固体混合物,可能含有SnCl2,SnCl4*5H2O,PbCl2,PbSO4等化合物,
一道有关碳族元素的推断题
有一种白色固体混合物,可能含有SnCl2,SnCl4*5H2O,PbCl2,PbSO4等化合物,从下列实验现象判断哪几种物质是确实存在的,并用反应式表示反应现象.
(1)加水生成悬浊液A和不容固体B;
2.在悬浊液A中加入少量盐酸则澄清,滴加碘,淀粉溶液可以褪色.
3.固体B易溶于稀盐酸,通H2S得黑色沉淀,沉淀与H2O2反应转变为白色.
从最后一条明显看出是PbS,与H2O2反应.
固体B猜测是氧化铅,因为它是碱性氧化物,可溶于酸.
由第二条看出A中有能氧化碘单质的离子,离子氧化性上看,猜测是Sn4+,应该有SnCl4;;但是无法推断PbO是如何得到的?铅离子(二价)水解得到?另外A的悬浊液加盐酸澄清,但是如果假定是Sn4+,水解产物锡酸H2Sn3好像不溶于盐酸吧?这样推断又矛盾了.. dhfut1年前3
dhfut1年前3 -
 jxddxj 共回答了18个问题
jxddxj 共回答了18个问题 |采纳率83.3%你的推理基本正确,只是有2个误区
1.B是氯化铅,它是微溶于水的,也可认为不溶.
2.A是SnCl4*5H2O,水解产物是H2SnO3,不溶于水,但能溶于盐酸,所有的酸,包括锡酸都能溶于强酸(HCl).由于水解产物的另一物质就是HCl,含量低,所以呈悬浊液.
SnCl4+3H2O=H2SnO3+4HCl(这是一个可逆反应,实际是不会反应,本题不应写出)
答案:1.不用写了.
2.2SnCl4+I2+3H2O=SnCl2+SnIO3+6HCl
3.PbCl2+H2S=PbS↓+2HCl
PbS+H2O2=PbO2+H2S↑1年前查看全部
- 碳族元素中的最高氧化物通式为(),对应的水化物通式为()或()或();气态氢化物可表示为()?
碳族元素中的最高氧化物通式为(),对应的水化物通式为()或()或();气态氢化物可表示为()?
水化物是碳酸吗? finx9871年前1
finx9871年前1 -
 emma223 共回答了22个问题
emma223 共回答了22个问题 |采纳率86.4%RO2, H2RO3 ,H4SIO4 RH41年前查看全部
- 碳族元素一氧化物,二氧化物是否与水反应(除了CO2以外)
 xiaozhu123451年前2
xiaozhu123451年前2 -
 jijtsve 共回答了17个问题
jijtsve 共回答了17个问题 |采纳率94.1%催化下:CO+H2O←→CO2+H21年前查看全部
- 碳、硅、锗、锡、铅(碳族元素)中有哪些是半导体?
 abcyee1年前4
abcyee1年前4 -
 舍命走oo 共回答了21个问题
舍命走oo 共回答了21个问题 |采纳率95.2%其中硅锗为半导体元素可跟据对角线原则在周期表查出(碳较特殊构成不同则或表现优异的绝缘性或优良的导电性1年前查看全部
- 碳族元素等质量的CO2和SiO2分别很足量的NaOH完全反应,消耗NaOH物质的量之比为( )A、15:22 B、15:
碳族元素
等质量的CO2和SiO2分别很足量的NaOH完全反应,消耗NaOH物质的量之比为( )
A、15:22 B、15:11 C、11:15 D、11:7
为什么? 草莓821年前1
草莓821年前1 -
 korla31g 共回答了21个问题
korla31g 共回答了21个问题 |采纳率81%NaOH是足量的
CO2+2NaOH=Na2CO3+H2O
1 2
44
SiO2+2NaOH=Na2SiO3+H2O
1 2
60
设质量为1
1/44 *2 :1/60 *2=15/111年前查看全部
- 下列关于碳族元素的说法正确的是( )
下列关于碳族元素的说法正确的是( )
A.单质都是无色晶体
B.单质中硅单质熔点最高
C.碳族元素形成的化合物种类最多
D.在化合物中最稳定的化合价都是+4价 hyroni1年前1
hyroni1年前1 -
 wolf256 共回答了13个问题
wolf256 共回答了13个问题 |采纳率61.5%解题思路:A.木炭是黑色固体;
B.金刚石的熔点最高;
C.碳族元素形成的化合物种类最多,有机物中含有碳元素;
D.在化合物中最稳定的化合价是不一定是+4价.A.在碳族元素所形成的单质中,只有金刚石为无色晶体,故A错误;
B.在碳族元素形成的单质中,金刚石、晶体硅为原子晶体,金刚石的熔点比晶体硅高,故B错误;
C.碳族元素位于周期表中部,易形成共价化合物特别是碳元素是构成种类繁多的有机物的最重要元素,故C正确;
D.Pb的稳定价态为+2,故D错误;
故选C.点评:
本题考点: 碳族元素简介.
考点点评: 本题考查了碳族元素的性质,本族单质的熔点与卤族元素单质熔点递变趋势不同,卤族单质熔点从F2→I2依次升高,碳族元素单质由C→Pb熔点呈降低趋势,根据其结构确定性质,题目难度不大.1年前查看全部
- 几个有关碳族元素的问题1.为什么在Na2S中通入足量SO2一定会出现沉淀,而在iBaCl2中通入则不一定会出现沉淀?2.
几个有关碳族元素的问题
1.为什么在Na2S中通入足量SO2一定会出现沉淀,而在iBaCl2中通入则不一定会出现沉淀?
2.为什么往氯化钙饱和溶液中通入过量的二氧化碳始终不出现浑浊?
3.在用H2SO4和Na2CO3制取二氧化碳时,为什么是把Na2CO3溶液滴加到H2SO4中而不是把H2SO4滴加到Na2CO3溶液中呢?
那为什么往碳酸钠饱和溶液通入过量二氧化碳会出现浑浊呢?浑浊是什么? xc3231年前1
xc3231年前1 -
 飞歌127 共回答了13个问题
飞歌127 共回答了13个问题 |采纳率92.3%1.因为Na2S中有还原性很强的硫离子,而二氧化硫有一定的氧化性,可以把硫离子氧化成硫单质,而二氧化硫别还原成硫单质,但在氯化钡溶液中通入二氧化硫的话,会生成强酸,盐酸,而二氧化硫通入水生成弱酸亚硫酸,违反了强酸制弱酸的规律
2.和上面氯化钡原理一样,碳酸制盐酸是不可能的
3.避免反应过于剧烈
因为生成的碳酸氢钠比碳酸钠在水中的溶解度小,析出了碳酸氢钠晶体,看起来就有浑浊了1年前查看全部
- 在元素周期表中~哪一列是碳族元素
在元素周期表中~哪一列是碳族元素
哪一列是氧族元素~元素周期表的含义~ 6866881年前8
6866881年前8 -
 xuhailin2004 共回答了17个问题
xuhailin2004 共回答了17个问题 |采纳率76.5%第14列IVA族是碳族元素
第16列VIA族是氧族元素1年前查看全部
- 下列叙述中,完全正确的是 [ ] A.同一周期的氧族元素比碳族元素的非金
下列叙述中,完全正确的是 [ ]A.同一周期的氧族元素比碳族元素的非金属性弱
B.正常雨水的PH值约为5.6,酸雨的PH<5.6;CO、Cl 2 、SO 2 都能污染大气
C.在化学反应中SO 2 +2H 2 S==S↓+2H 2 O,表现了SO 2 的还原性
D.碳族元素都是非金属元素,其非金属性随核电荷数的增加而减弱 wwwpengtao31年前1
wwwpengtao31年前1 -
 匪兵51号 共回答了19个问题
匪兵51号 共回答了19个问题 |采纳率94.7%B1年前查看全部
- (2014•静安区一模)碳族元素是形成化合物种类最多的元素.
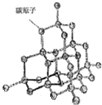 (2014•静安区一模)碳族元素是形成化合物种类最多的元素.
(2014•静安区一模)碳族元素是形成化合物种类最多的元素.
(1)碳原子2个2p电子的运动状态不相同的方面是______;C5HxN分子中C、N原于最外层都达到8电子稳定结构,则x的值可能为______ (选填序号).
a.10b.11c.13d.15
(2)如图是金刚石晶体的结构示意图.则关于金刚石的描述正确的是______(选填序号).
a.C-C键键角都为109°28’b.最小的环由6个C原子构成
c.可溶于非极性溶剂d.1mol金刚石含有4mol C-C键
(3)以下比较错误的是______(选填序号).
a.稳定性SiH4>CH4 b.沸点SiH4>CH4
c.熔点SiC>Si d.键能C=C>C-C
(4)NaBH4是广泛使用的有机反应还原剂,其中H为-1价,SiO2为其制备原料之一.
①配平以下制备NaBH4的化学方程式:
□Na2B4O7+□Na+□SiO2+□H2→□NaBH4+□Na2SiO3
②反应中被还原的元素为______.
(5)碳酸钙是石灰石、方解石等的主要成分,可以形成“喀斯特”地貌、钟乳和石笋,有关反应的化学方程式为CaCO3+CO2+H2O=Ca(HCO3)2、Ca(HCO3)2
CaCO3↓+CO2↑+H2O△ .CaCO3+CO2+H2O=Ca(HCO3)2、Ca(HCO3)2.
CaCO3↓+CO2↑+H2O△ .
(6)若物质组成相似,可相互推算组成元素的相对原子质量.某学习小组模拟求算锗的相对原子质量,测得了锗酸钠中Na和Ge的质量分数、硅酸钠中Na和Si的质量分数,他们还需查阅的数据是______(选填序号).
a.氧元素的相对原子质量b.硅元素的相对原子质量c.钠元素的相对原子质量. denisefang1年前1
denisefang1年前1 -
 DwWS 共回答了16个问题
DwWS 共回答了16个问题 |采纳率87.5%解题思路:(1)同一能级的不同轨道中,其运动状态与轨道有关;碳原子要达到8电子稳定结构应该形成4个共价键,氮原子要形成8电子稳定状态应该形成3个共价键;
(2)a.金刚石中每个碳原子和其它4个碳原子形成正四面体结构;
b.最小的环由6个C原子构成;
c.根据相似相溶原理判断;
d.一个碳原子形成4个C-C间,据此计算1mol金刚石含有C-C键的物质的量;
(3)a.同一主族元素,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其氢化物越稳定;
b.同一主族元素氢化物的沸点与其相对分子质量成正比;
c.同一类型的晶体中,晶体的熔点与其键长成反比;
d.在碳碳键中,碳碳双键的键能小于碳碳单键键能的二倍;
(4)根据氧化还原反应中得失电子数相等配平方程式;在反应中,得电子化合价降低的元素为还原;
(5)碳酸钙能和二氧化碳、水反应生成可溶性的碳酸氢钙,碳酸氢钙不稳定,在加热条件下,碳酸氢钙易分解生成碳酸钙;
(6)根据质量分数公式进行判断.(1)碳原子的两个2p电子位于两个不同的轨道上,其自旋方向相同,所以碳原子2个2p电子的运动状态不相同的方面是轨道(或电子云的伸展方向);
假设碳原子连接氮原子,氮原子在边上为氨基,氨基含有2个氢原子,剩余的碳原子和氢原子形成烷基或烯烃基,如果形成的是烷基,则x=2+2×5+1=13,如果形成的是烯烃基,x=2+2×5-1=11,碳和氢原子还可以形成炔烃基,氢原子个数更少,故选bc,
故答案为:轨道(或电子云的伸展方向);bc;
(2)a.金刚石中每个碳原子和其它4个碳原子形成正四面体结构,所以其键角为109°28′,故正确;
b.根据图片知,最小的环由6个C原子构成,故正确;
c.二氧化硅属于原子晶体,非极性溶剂都属于分子晶体,根据相似相溶原理知,二氧化硅不易溶于非极性溶剂,故错误;
d.一个碳原子形成4个C-C间,则1mol金刚石含有2molC-C键,故错误;
故选ab;
(3)a.同一主族元素,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其氢化物越稳定,碳元素的非金属性大于硅元素,所以氢化物的稳定性SiH4<CH4,故错误;
b.同一主族元素氢化物的沸点与其相对分子质量成正比,硅烷的相对分子质量大于甲烷,所以沸点SiH4>CH4,故正确;
c.碳化硅和硅都属于原子晶体,硅原子半径大于碳原子,所以碳化硅的键长小于硅硅键,则碳化硅的熔点高于硅,故正确;
d.在碳碳键中,碳碳双键的键能小于碳碳单键键能的二倍,所以键能C=C>C-C,故正确;
故选a;
(4)①该方程式知,H元素的化合价由0价变为-1价,钠元素的化合价由0价变为+1价,1mol钠变为钠离子,失去1mol电子,1mol氢气得到2mol电子变为H-,再结合原子守恒配平方程式得,Na2B4O7+16Na+7SiO2+8H2=4NaBH4+7Na2SiO3,故答案为:16;7;8;4;7;
②该方程式中,得电子化合价降低的元素是0价的H元素,所以O价的H元素被还原,故答案为:0价的H;
(5)碳酸钙能和二氧化碳、水反应生成可溶性的碳酸氢钙,碳酸氢钙不稳定,在加热条件下,碳酸氢钙易分解生成碳酸钙,反应方程式为:CaCO3+CO2+H2O=Ca( HCO3)2、Ca(HCO3)2
△
.
CaCO3↓+CO2↑+H2O,故答案为:CaCO3+CO2+H2O=Ca( HCO3)2、Ca(HCO3)2
△
.
CaCO3↓+CO2↑+H2O;
(6)根据题意知,锗酸钠和硅酸钠属于结构相似的物质,根据硅酸钠中硅的质量分数即可知道锗酸钠中锗的质量分数,测得了锗酸钠中Na和Ge的质量分数、硅酸钠中Na和Si的质量分数,只要知道硅的相对原子质量即可得出锗的相对原子质量,故选b.点评:
本题考点: 氧化还原反应;元素周期律的作用;原子核外电子排布.
考点点评: 本题考查较综合,涉及方程式的配平、晶体结构、分子的构成等知识点,根据氧化还原反应中得失电子相等配平方程式,以金刚石为例熟记原子晶体结构,难点是(1)题氢原子个数的计算,根据碳原子、氮原子形成共价键的个数采用知识迁移的方法解答,难度中等.1年前查看全部
- ABCDE都是含碳族元素C和D在高温条件下反应生成B E和KOH溶液反应生成A和水 B和O2反应生成C,固体E受热生成A
ABCDE都是含碳族元素
C和D在高温条件下反应生成B E和KOH溶液反应生成A和水 B和O2反应生成C,固体E受热生成A C和水 则A BC D E 分别是? 紫慕云1年前1
紫慕云1年前1 -
 Gulf007 共回答了10个问题
Gulf007 共回答了10个问题 |采纳率90%从 E受热生成A C和水 E和KOH溶液反应生成A和水 可以推出E是KHCO3 那A就是K2CO3(碳酸钾) C就是CO2 那B就是CO D就是C 推断这样的题目要敢大胆的去试 因为这样的答案是我们常见的1年前查看全部
- 一道高一碳族元素推断选择题某气体能使紫色石蕊试液变红,能使酸性高锰酸钾溶液褪色,若通入溴水,可使溶液变浑浊.该气体是(
一道高一碳族元素推断选择题
某气体能使紫色石蕊试液变红,能使酸性高锰酸钾溶液褪色,若通入溴水,可使溶液变浑浊.该气体是( )
A.CO2 B.Cl2 C.H2S D.SO2 FlyingBT1年前7
FlyingBT1年前7 -
 yoursPsyche 共回答了13个问题
yoursPsyche 共回答了13个问题 |采纳率69.2%选B
四个溶水全显酸性(碳酸、盐酸和次氯酸、氢硫酸、亚硫酸),AC不能使高褪色,BD可以(BD有漂白性),D通溴水生成硫酸和氢溴酸,二者都溶于水,B通溴水,还原出溴单质(其实说浑浊也勉强,颜色是浑浊的,并不是沉淀).1年前查看全部
- 高一化学 碳族元素、将炭和8g O2在密闭容器中使之发生反应,反应后,冷却到原来的温度,压强为起始时的1.5倍,则反应的
高一化学 碳族元素、
将炭和8g O2在密闭容器中使之发生反应,反应后,冷却到原来的温度,压强为起始时的1.5倍,则反应的结果是
A.生成CO、CO2体积相等
B.生成CO、CO2的物质的量之比为1:2
C.生成CO、CO2的物质的量之比为1:3
D.消耗炭4.2g
我算出来是CO:CO2=2:1
反过来了= =
炭是4.5g没有问题。。。。
这是怎么回事? sinisa1年前5
sinisa1年前5 -
 cad1119 共回答了21个问题
cad1119 共回答了21个问题 |采纳率90.5%可以这样考虑.
若只生成二氧化碳则压强不变,若只生成一氧化碳则压强变为原来2倍,而现在只有1.5倍,所以产物中既有一氧化碳又有二氧化碳,分别设为xy.氧元素有0.5,所以x+2y=0.5;再根据压强改变:x+y=0.25*1.5=0.375.解得一氧化碳0.25二氧化碳0.125.怎么2:1了.1年前查看全部
- 碳族元素的题目如何区别碳酸钠 硝酸钠 氯化钠 和 硅酸钠 这4种溶液,请些出有关反应的方程式
 霓裳梦惊影1年前3
霓裳梦惊影1年前3 -
 cjh96810 共回答了25个问题
cjh96810 共回答了25个问题 |采纳率92%1.分别加入HCl溶液
Na2CO3+2HCl=2NaCl+H2O+CO2↑放出气体
Na2SiO3+2HCl=H2SiO3↓+2NaCl产生白色沉淀
2.没有分出的两个溶液
加入AgNO3溶液,产生白色AgCl沉淀的是NaCl
没有反应的是NaNO31年前查看全部
- 碳族元素与其他元素化合时易行成什么键?原因.
 kdwn1年前1
kdwn1年前1 -
 我爱老K 共回答了20个问题
我爱老K 共回答了20个问题 |采纳率90%共价键,原因:碳族元素的电子排布相似,有4个价电子.碳、硅是非金属,锗是金属元素,但金属性较弱,锡和铅是更为典型的金属元素,uuq系人工合成.化合价主要有+4和+2,所以易形成共价键.1年前查看全部
- 碳族元素最高价氧化物水化物均显酸性,说出理由.
 7021814691年前1
7021814691年前1 -
 紫露竹心 共回答了19个问题
紫露竹心 共回答了19个问题 |采纳率100%碳族元素最高价氧化物水化物均显酸性 .对,但说法不够规范,应该是碳族元素最高价氧化物水化物均以显酸性为主.并且随着原子序数的增加酸性减弱.
理由:Si不能在溶液中以简单的离子状态存在,而以酸根的形式存在,说明它最高氧化态是酸性氧化物
Ge..Sn:必须在有强酸的存在下才能一简单离子存在与溶液中,一但溶液酸性降低就形成它们的最高态水和物(我们称原Ge酸或原Sn酸),说明的它们的最高氧化态还是一呈酸性为主.
Pb:我们可以很容易的得到铅酸盐,而很难得到四价铅的溶液,另外四价铅在溶液PH很底时就可以沉淀说明它也是以酸性为主.
因此碳族元素最高价氧化物水化物均显酸性 .对1年前查看全部
- 碳族元素的单质中,谁的熔点最高?密度最大?
 cnrobinxu1年前1
cnrobinxu1年前1 -
 蓝风2007 共回答了19个问题
蓝风2007 共回答了19个问题 |采纳率94.7%碳族元素中,碳和硅各自组成的晶体,都属于原子晶体,而碳碳键的键能大于任何一种由硅组成的晶体之间的键能.所以碳组成的单质的熔点最高.
铅的密度最大.1年前查看全部
- 一道高一化学碳族元素推断题有A、B、C、D、E五种无色溶液Ba(OH)2、AgNO3、MgCl2、NH4HCO3和HCl
一道高一化学碳族元素推断题
有A、B、C、D、E五种无色溶液Ba(OH)2、AgNO3、MgCl2、NH4HCO3和HCl进行如下实验:
①A滴入C后有白色沉淀生成;
②A滴入B后有气泡产生;
③C滴入D后有白色沉淀生成;
④B滴入E后有气泡产生,并有白色沉淀生成;
⑤D滴入E后有白色沉淀生成.
(1)从实验结果判断A、B、C的化学式.
(2)写出右方反应的的离子方程式:A+B,B+E,D+E goddonkey1年前5
goddonkey1年前5 -
 悠然人生 共回答了19个问题
悠然人生 共回答了19个问题 |采纳率89.5%因为A滴入B后有气泡产生,B滴入E后有气泡产生,并有白色沉淀生成,根据已知的几种物质可以知道气体肯定是二氧化成,并且产生二氧化碳的只有是NH4HCO3,所以B是NH4HCO3
A滴入B后有气泡产生,所以A是HCl
B滴入E后有气泡产生,并有白色沉淀生成,所以E是Ba(OH)2
所以C是AgNO3,D是MgCl2.
① A是HCl B是NH4HCO3 C是AgNO3
② A+B :HCl+NH4HCO3==NH4Cl+H2O+CO2
B+E :Ba(OH)2+NH4HCO3==BaCO3+H2O+NH3.H2O
D+E :Ba(OH)2+MgCl2==Mg(OH)2+BaCl21年前查看全部
- 关于碳族元素1,C3O2与水反应的方程式?2,为什么四氯化硅易水解而四氯化碳难水解?
 liebhaber1年前1
liebhaber1年前1 -
 qingsky 共回答了20个问题
qingsky 共回答了20个问题 |采纳率85%1,C3O2+H2O=HOOC-CH2-COOH,即得到丙二酸
工业上有这个反应
2,C在第二周期,最外层有4个轨道,1个s,3个p,在CCl4中,4个轨道上都放了电子对,很稳定了.
Si是第三周期,虽然与C很象,3s2,3p2,但其实还存在3d轨道,只是没有电子放,但有这样的空轨道,就有可能接受其它的电子,如接受H2O提供的电子,因此可以水解.
本质,是C的配位数只能是4,且在CCl4中都用上了,而Si的配位数可以更大,如H2[SiF6]中,Si就和6个F结合,配位数达到了6.
第二个问题,不知道你能否理解,决定于你们的结构化学学到什么难度.1年前查看全部
- 碳族元素都有导电性对吗?
 susheng8281年前1
susheng8281年前1 -
 Jimmy07 共回答了21个问题
Jimmy07 共回答了21个问题 |采纳率81%怎么说呢 碳有很多种同素异形体 金刚石、足球烯等等 其中只有石墨是导电的 硅是半导体 锗锡铅都是金属肯定导电1年前查看全部
大家在问
- 1You'll be able to make a living doing something you love 中为什
- 2老师,您好……请问,对自己狠一点,用英文怎么说?想要外国用的,地道的翻译,
- 3英语翻译The master's degree in intercultural studies in communic
- 4“花是美好的,但它终究要凋谢,所以我不喜欢它”用英语怎么说
- 5这些花很漂亮 用英语怎么说
- 6你比花更漂亮 英语怎么说RT
- 7写出下列词语的近、反义词.近义词:安然无恙( ) 蓬勃( ) 一如既往( ) 反义词:气势雄伟( ) 激情(
- 8一根圆柱形木材长20dm,分成四个相等的圆柱体.表面积增加了18.84平方分米.原来圆柱形木材的表面积是多少?
- 9三角形 正方形 五边形 哪个是凸图形
- 10我们为我们的祖国感到骄傲 用英语怎么说
- 11英语翻译初是初二(下)第五单元课文中的一句话,哪位老师可帮我直译一下,并分析一下它的意义构成和句子结构.打错了,原文是:
- 12《三峡》余秋雨 赏析\x0b历时在这儿终结,山川在这儿避退,诗人在这儿萎谢.
- 131+1等于几 哥德巴赫猜想 简单说一下
- 14哪个洲最小英文翻译
- 15高数书上那些等价无穷小的式子怎么来的?
