亚磷酸溶液与碘水的反应方程式
 四川oo聚地2022-10-04 11:39:541条回答
四川oo聚地2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 chu00000033 共回答了24个问题
chu00000033 共回答了24个问题 |采纳率87.5%- H3PO3 + I2 +H2O = H3PO4 + 2HI
你不能配平估计是因为没加水.很多反应无法配平的时候就要考虑是不是没加水. - 1年前
相关推荐
- 磷的含氧酸酸性比较.正磷酸、聚磷酸、焦磷酸、偏磷酸酸性比较?我不是说磷酸,亚磷酸.我是说正磷酸,聚磷酸,偏磷酸和焦磷酸酸
磷的含氧酸酸性比较.
正磷酸、聚磷酸、焦磷酸、偏磷酸酸性比较?
我不是说磷酸,亚磷酸.我是说正磷酸,聚磷酸,偏磷酸和焦磷酸酸性比较. 素素_zhao1年前1
素素_zhao1年前1 -
 痴痴宝宝 共回答了14个问题
痴痴宝宝 共回答了14个问题 |采纳率92.9%PO4(aC1)(2)H(aq)一H(g)(3)H(g)一H(g)(4)H(s)+H2PO4(g)一}bPO#(g)(5)H2PO4一(g)一H2P04(g)(6)H2PO4一(aq)一H2PO#一(g)因此,△也可以由以下热力学循环得出【4H2FO4"(aq)+H(aq)———_兰一(aq)rrl~PO4(g)([Hg)根据盖斯定律,总反应的热效应等于各分步反应热效应的代数和.AH~=△H.h(tO4)一D(0一H)一I(H)一E(H2P04)一△H(H)一AH.h(PO一)式中AH.h(H3PO#)——H3PO4分子的水合焙,I(H)——氢元素的第一电离势,△h(H)、AH%(H2PO4一)——H’,P04一离子的水合焙.D(0一H)——HPO4分子中0一H键的离解能.E(PO4)——H2e04基团的电子亲台势.表1磷的舍氧酸根的质子亲台能IkJ·toolI1)从表l中数据可以看出,随着Po分子中磷元素氧化数的增大,其对应的酸根H2PO2一,H'P一,H2e04一的质子亲台能呈负值增大的趋势,说明三种酸根离子夺取H的趋势依次增强.故其共轭酸的酸性是递减的.为了方便起见,将OH一离子的质子亲合能作为确定酸根质子亲合能的相对标准,把它定为l0,然后求出其它酸根的相对质子亲合能值J,并且通过比较得出:在水溶液中,酸根的相对质子亲合能越小,其共轭酸的酸性越强,酸根的相对质子亲合能越大,其共轭酸的酸性越弱.由表中数据可以看出:PO2一,P03一,P04一的相对质子亲台能是由小到大(下转第312页)312四川师范学院学报(自然科学版)1999正2讶泽生,苏志先,米志平等.20世纪生物成就的特点及21世纪发展的趋势四川师范学院学报(自然科学版),1998,19(4):357—361.3米志平,苏志先,汤泽生等.高师生物学教育专业主干课程设置体系的沿革与启示.uu)JI师范学院学报(自然科学版),1998,19(4):426—420(上接第297页)表1不同情况的计算结果题中,分别表示平衡气液两相组成.由表1知:当气液平衡关系为y=AX时,应用本文程序算得结果与对数平均推动力法算得的结果吻合.5结束语利用计算机程序,能方便地用来确定气液平衡关系.即:y=舯r/(1+)或y=AX时的气相总传质单元数.并能直观而清楚地绘出表示传质单元数的曲边梯形图,它使繁杂的手工图解积分过程变得相当简单.本文程序通过计算获得过某已知点的某已知曲线的切线切点的坐标比在手工绘出的图形中用肉眼估读出切点的坐标值更准确,由此而获得的最小液气比更合理.本文程序虽是针对指定的气液平衡关系编写,但在计算最小液气比时采用普适性的方法.因此本文程序用于其它形式的气液平衡关系时,只须对与其有关韵语句进行修改即可.参考文献1天津大学化工原理教研宣编.化工原理(下册).天津}天津科学技术出版社,198'72张巨洪编.BASIC语盲程序库.北京:清华大学出版社,19843余文琳,赵贵琏,董爱明编.化工原理解题分析,南京r江苏科学技术出版社,1988(上接第300页)的.因此磷的含氧酸酸性强弱顺序应该是H3Po2>P>H3PO4参考文献1赵继周.高等无机化学,北京:北京师范大学出版社,1987.2宋景濂,戚冠发,林洪宾中级无机化学,沈阳:辽宁大学出版社,1991.3刘少炽,钱博,张进胜.酸根的质子亲台能与无机酸的强度,化学教育,1981.64杨德壬.无机化学中的一些热力学问题,上海:上海科学技术出版社,1986.5林平娣.无机化学热力学1年前查看全部
- 亚磷酸盐 氧化剂亚磷酸盐的常见氧化剂有哪些?
 管所长的单车1年前1
管所长的单车1年前1 -
 野_aa 共回答了20个问题
野_aa 共回答了20个问题 |采纳率75%常见的氧化剂是在化学反应中易得电子被还原的物质.
(1)典型的非金属单质如F2、O2、Cl2、Br2、I2、S等(其氧化性强弱与非金属活动性基本一致).
(2)含有变价元素的高价化合物,如KMnO4 KClO3 H2SO4 HNO3 MnO2 等.
(3)金属阳离子如:Fe3+、Cu2+、(H+)(在金属与酸、盐溶液的置换反应,如反应Fe+CuSO4=FeSO4+Cu中,实质上是Cu2+离子氧化Fe原子,Cu2+作氧化剂,Fe是还原剂)
常见的还原剂是在化学反应中易失电子被氧化的物质.
(1)典型的金属单质如:K、Ca、 Na、Mg等(其还原性强弱与金属活动性基本一致)
(2)某些非金属单质及其化合物如:H2、C、CO.
(3)有变价元素的最低价态化合物如:H2S、HI、HBr、HC
(4)非金属阴离子如:S2-、I-、Br-、Cl-1年前查看全部
- 亚磷酸在核磁共振氢谱中有两种化学环境的的的氢.推断:亚磷酸是二元酸
亚磷酸在核磁共振氢谱中有两种化学环境的的的氢.推断:亚磷酸是二元酸
判断正误,并说明理由!几元酸和核磁共振氢谱有关系吗? 正宗五叶神1年前1
正宗五叶神1年前1 -
 iamzhengzhou 共回答了16个问题
iamzhengzhou 共回答了16个问题 |采纳率93.8%1年前查看全部
- 我上午提问亚磷酸加热反应化学式写错,应是4H3PO3→3H3PO4+PH3 ,
我上午提问亚磷酸加热反应化学式写错,应是4H3PO3→3H3PO4+PH3 ,
100克亚磷酸(H3PO3)加热260度,反应生成磷化氢及磷酸等,反应式是:4H3PO3→3H3PO4+PH3 请问?反应生成磷化氢(PH3)多少? 我最心疼hh1年前1
我最心疼hh1年前1 -
 lg972 共回答了16个问题
lg972 共回答了16个问题 |采纳率87.5%4H3PO3=3H3PO4+PH3
亚磷酸分子量:82.00 ,磷化氢分子量为34,可以算得磷化氢的质量100/
(82*4)*34=10.37g
若是算体积,则亚磷酸的摩尔数为1.22mol,所以磷化氢的摩尔数为0.30Mol.再通过气体摩尔体积算就可以了1年前查看全部
- H3PO3分子的结构式要求从这信息推测(详解):亚磷酸(H3PO3)与NaOH溶液反应的物质的量之比及对应的产物如下图:
H3PO3分子的结构式
要求从这信息推测(详解):亚磷酸(H3PO3)与NaOH溶液反应的物质的量之比及对应的产物如下图:
nH3PO3 :nNaOH
1 :1
1 :2
1 :3
产物
NaH2PO3
Na2HPO3
Na3PO3
试写出H3PO3分子的结构式: bianshihu1年前0
bianshihu1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 除去三氯化磷中的亚磷酸
 夜舞婆娑1年前1
夜舞婆娑1年前1 -
 凄然北望 共回答了15个问题
凄然北望 共回答了15个问题 |采纳率93.3%三氯化磷沸点76度,亚磷酸沸点200度(分解),利用沸点的差异,在80度进行真空分馏,控制好馏份.1年前查看全部
- 亚磷酸与硝酸银反应亚磷酸溶液中加入硝酸银,有黑色沉淀银和一氧化氮气体生成,写出这一反应的化学方程式
 ee天山南北1年前1
ee天山南北1年前1 -
 恬倩 共回答了22个问题
恬倩 共回答了22个问题 |采纳率100%楼上真是令人无语,亚磷酸化学式都写不对
一方面硝酸根氧化亚磷酸,另一方面,Ag+氧化亚磷酸
2H3PO3+AgNO3=2H3PO4+Ag+NO1年前查看全部
- 亚磷酸具有强还原性,可使碘水褪色,该放映的方程式
 summervie1年前1
summervie1年前1 -
 风满楼82 共回答了17个问题
风满楼82 共回答了17个问题 |采纳率94.1%H3PO3+I2+H2O=(可逆等号) H3PO4+HI
因为亚磷酸(H3PO3)可以被碘水氧化
成为磷酸(H3PO4)加碘化氢(HI)1年前查看全部
- 亚磷酸具有强还原性,可使碘水褪色.该反应化学方程式是什么
 蝶舞双飞1年前2
蝶舞双飞1年前2 -
 cnzsb75 共回答了19个问题
cnzsb75 共回答了19个问题 |采纳率94.7%亚磷酸与碘反应的方程式
H3PO3 + I2 +H2O = H3PO4 + 2HI
不懂追问1年前查看全部
- 亚磷酸与纯碱反应生成什么?最好能给出反应方程式.有据可考
 yy文学21年前1
yy文学21年前1 -
 _控_ 共回答了15个问题
_控_ 共回答了15个问题 |采纳率93.3%亚磷酸是二元酸电离常数K1=5E-2 K2=2.5E-7碳酸电离常数是K1=4.5E-7 K2=4.7E-11,K1=5E-2 大于 K1=4.5E-7 K2=4.7E-11但K2=2.5E-7小于K1=4.5E-7 方程式的书写会与反应物的比例有关Na2CO3...1年前查看全部
- 下列离子方程式正确的是( )A.亚磷酸是一种二元酸,在其中加入过量的烧碱溶液:H3PO3+3OH-=PO33-+3H2
下列离子方程式正确的是( )
A.亚磷酸是一种二元酸,在其中加入过量的烧碱溶液:H3PO3+3OH-=PO33-+3H2O
B.氯化银可被NaCN溶液所溶解:AgCl+2CN-=[Ag(CN)2]-+C1-
C.偏铝酸钠溶液中通入过量的二氧化碳气体:2AlO2-+CO2+2H2O=2Al(OH)3↓+CO32-
D.三氯化铁溶液中通入硫化氢气体:2Fe3++H2S=Fe2++S↓+2H+ cjxfjx1年前1
cjxfjx1年前1 -
 zhangrui914 共回答了19个问题
zhangrui914 共回答了19个问题 |采纳率84.2%解题思路:A.亚磷酸是一种二元酸,1mol该酸消耗2molNaOH;
B.生成配位化合物;
C.反应生成氢氧化铝和碳酸氢钠;
D.电荷不守恒.A.亚磷酸是一种二元酸,在其中加入过量的烧碱溶液的离子反应为H3PO3+2OH-=HPO32-+2H2O,故A错误;
B.氯化银可被NaCN溶液所溶解的离子反应为AgCl+2CN-=[Ag(CN)2]-+C1-,故B正确;
C.偏铝酸钠溶液中通入过量的二氧化碳气体的离子反应为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故C错误;
D.三氯化铁溶液中通入硫化氢气体的离子反应为2Fe3++H2S=2Fe2++S↓+2H+,故D正确;
故选BD.点评:
本题考点: 离子方程式的书写.
考点点评: 本题考查离子反应的书写,明确发生的化学反应是解答本题的关键,注意与量有关的离子反应及氧化还原反应是解答的难点,选项B、D均为易错点,题目难度不大.1年前查看全部
- 为什么羟基氢在含氧酸中易电离为什么只有羟基氢电离出氢离子显酸性而非羟基氢不可以呢 麻烦讲解下 象亚磷酸 H3PO3 (下
为什么羟基氢在含氧酸中易电离
为什么只有羟基氢电离出氢离子显酸性而非羟基氢不可以呢
麻烦讲解下
象亚磷酸 H3PO3 (下角标不会打。) 有一个非羟基氢 为什么 那个氢不 电离生成氢离子啊 不听天由命的人1年前1
不听天由命的人1年前1 -
 毛毛maomaomao 共回答了27个问题
毛毛maomaomao 共回答了27个问题 |采纳率77.8%由于羟基氢是和氧原子相连,氧和氢之间的共用电子对强烈的偏向于氧,偏离于氢,氢原子容易变成氢离子,而发生电离.1年前查看全部
- 亚磷酸具有还原性,(H3PO3),可使碘水褪色,该反应过程的化学方程式为?
亚磷酸具有还原性,(H3PO3),可使碘水褪色,该反应过程的化学方程式为?
怎样看出反应物会有水的? sunykjd1年前2
sunykjd1年前2 -
 端木芸露 共回答了15个问题
端木芸露 共回答了15个问题 |采纳率86.7%I2 + H3PO3 + H2O = 2 HI + H3PO4
因为H3PO3、H3PO4的化学计量数必定相等(磷守恒)
如果这样,O必定不相等.即左边O不够,所以一定有水1年前查看全部
- 我上午提问亚磷酸加热反应化学式写错,应是4H3PO3→3H3PO4+PH3 ,对不起大家!
我上午提问亚磷酸加热反应化学式写错,应是4H3PO3→3H3PO4+PH3 ,对不起大家!
100克亚磷酸(H3PO3)加热260度,反应生成磷化氢及磷酸等,反应式是:4H3PO3→3H3PO4+PH3 请问?反应生成磷化氢(PH3)多少?
请朋友们帮忙指教,万分感谢,谢谢! hh-91年前2
hh-91年前2 -
 阿伟a 共回答了19个问题
阿伟a 共回答了19个问题 |采纳率84.2%4H3PO3→3H3PO4+PH3
328 34
100 x
328/100=34/x
x=675/41
=10.366g1年前查看全部
- 亚磷酸二烷基酯
 再为三儿1年前1
再为三儿1年前1 -
 三生石的眼泪 共回答了24个问题
三生石的眼泪 共回答了24个问题 |采纳率83.3%性质:常见的有下述3种.R=CH3,简写DMT.熔点57~60℃(分解),沸点163℃(3.061kPa),密度1.238g/cm3,旋光度[α]22+21°(c=2.5,水),溶于水、醇、醚及氯仿.R=C2H5,简写DET,无色固体,沸点280℃,折射率1.4460,密度1.204g/cm3...1年前查看全部
- 亚磷酸(H3PO3)与足量的NaOH溶液反应生成Na2HPO3.
亚磷酸(H3PO3)与足量的NaOH溶液反应生成Na2HPO3.
(1)亚磷酸是______元酸.
(2)PCl3水解可制取亚磷酸,反应的方程式是______.
(3)在H3PO3溶液中存在电离平衡:H3PO3⇌H++H2PO3-.
①某温度下,0.10mol•L-1的H3PO3溶液pH=1.6,即溶液中c(H+)=2.5×10-2mol•L-1.求该温度下,上述电离平衡的平衡常数K=______(只考虑H3PO3的第一步电离,结果保留两位有效数字).
②根据H3PO3的性质可推测Na2HPO3稀溶液的pH______7 (填“>”、“=”或“<”).
(4)亚磷酸具有强还原性,可将Cu2+还原为金属单质,亚磷酸与硫酸铜溶液反应的方程式为______.
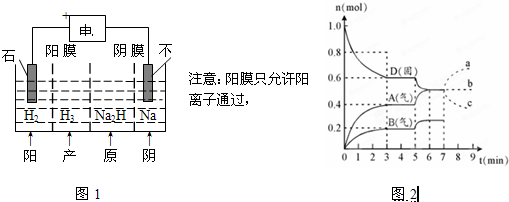
(5)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如图1:
①阴极的电极反应为______.
②产品室中反应的离子方程式为______.
(6)在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图2,据图回答下列问题:
①该化学反应的方程式是______.
②第5min时,若保持容器体积2.0L不变,改变条件,平衡移动如图2,测得第4min时的反应温度(T4)与第6min时的反应温度(T6)大小的关系为T4<T6,则该反应的平衡常数K4______(填“<”、“=”或“>”)K6.
③若在第7min时增加D的物质的量,A的物质的量变化正确的是______(用图中a、b、c编号回答). jzt1201年前1
jzt1201年前1 -
 vgasm 共回答了15个问题
vgasm 共回答了15个问题 |采纳率93.3%解题思路:(1)亚磷酸(H3PO3)与足量的NaOH溶液反应生成Na2HPO3,说明亚磷酸是二元酸;
(2)PCl3水解生成亚磷酸和盐酸;
(3)①电离平衡常数K=
;c(H+)c(H2PO3−) c(H3PO3)
②根据H3PO3的酸性强弱确定Na2HPO3溶液的酸碱性;
(4)亚磷酸和Cu2+发生氧化还原反应,亚磷酸作还原剂被氧化生成磷酸,铜离子被还原生成铜,据此写出反应方程式;
(5)①阴极上得电子发生还原反应;
②产品室中HPO32-和氢离子结合 生成亚磷酸;
(6)①根据各物质的增减判断反应物、生成物,根据同一反应、同一时间段内,各物质的浓度变化量之比等于其计量数之比判断;
②根据温度升高,D的物质的量减少,A、B的物质的量增大,平衡正向移动,而温度升高,平衡向吸热的方向移动;根据平衡常数只有与温度有关;
③增加固体的物质的量,浓度不变,平衡不移动.(1)亚磷酸(H3PO3)与足量的NaOH溶液反应生成Na2HPO3,说明亚磷酸是二元酸,故答案为:二;
(2)PCl3水解可制取亚磷酸和盐酸,水解方程式为:PCl3+3H2O⇌H3PO3+3HCl,故答案为:PCl3+3H2O⇌H3PO3+3HCl;
(3)①H3PO3 ═H++H2PO3-
起始浓度 0.10 0 0
反应浓度 2.5×10-2 2.5×10-2 2.5×10-2
平衡浓度0.10-2.5×10-2 2.5×10-2 2.5×10-2
电离平衡常数K=
c(H+)c(H2PO3−)
c(H3PO3)=
2.5×10−2×2.5×10−2
0.10−2.5×10−2mol/L=8.3×10-3mol/L,故答案为8.3×10-3mol/L;
②H3PO3是弱酸,Na2HPO3是强碱弱酸盐,所以其水溶液呈碱性,即pH>7,故答案为:>;
(4)亚磷酸和Cu2+发生氧化还原反应,亚磷酸作还原剂被氧化生成磷酸,铜离子被还原生成铜,据此写出反应方程式为:H3PO3+CuSO4+H2O=Cu+H3PO4+H2SO4;
故答案为:H3PO3+CuSO4+H2O=Cu+H3PO4+H2SO4;
(5)①阴极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
②产品室中HPO32-和氢离子结合生成亚磷酸,反应离子方程式为:HPO32-+2H+=H3PO3,故答案为:HPO32-+2H+=H3PO3;
(6)①根据图象知,随着反应的进行,D的物质的量减少,A、B的物质的量增加,所以D是反应物,A、B是生成物;同一反应、同一时间段内,各物质的浓度变化量之比等于其计量数之比,0-3min时,△D=0.4mol,
△A=0.4mol,△B=0.2mol,△D:△A:△B=0.4mol:0.4mol:0.2mol=4:4:2,方程式为:2D(s)⇌2A(g)+B(g),
故答案为:2D(s)⇌2A(g)+B(g);
②温度升高,D的物质的量减少,A、B的物质的量增大,平衡正向移动,而温度升高,平衡向吸热的方向移动,说明正反应为吸热反应,第4min时的反应温度(T4)与第6min时的反应温度(T6)大小的关系为T4<T6,平衡常数只有与温度有关,温度升高,平衡正向移动,平衡常数增大,K4<K6;
故答案为:<;
③D为固体,增加D的物质的量,浓度不变,平衡不移动,故选:b.点评:
本题考点: 化学平衡常数的含义;物质的量或浓度随时间的变化曲线;电解原理.
考点点评: 本题考查了化学反应速率、平衡移动、平衡常数等概念,难度不大,涉及水解反应、氧化还原反应、电极反应式的书写等知识点,电极反应式的书写、有关平衡常数的计算是高考热点,应重点掌握.1年前查看全部
- 亚磷酸结构式?如题.最好能给我电子式也可以.不要忽悠我,我化学还可以.我只要一针见血就够了,不用复制一大堆东西过来,
 酒醉菠萝1年前3
酒醉菠萝1年前3 -
 抗水洗 共回答了7个问题
抗水洗 共回答了7个问题 |采纳率85.7%http://cn.chemnet.com/tech/upload/446d719b88306.gif1年前查看全部
- 帮我一把1.已知亚磷酸(H2PO3)的pKa1=1.30,pKa2=6.70.计算:(1) 0.05 mol· L-1
帮我一把
1.已知亚磷酸(H2PO3)的pKa1=1.30,pKa2=6.70.计算:
(1) 0.05 mol· L-1 溶液的H2PO3 溶液的pH;
(2) 配制pH=6.20 的缓冲溶液100ml,应取0.05 mol· L-1 H2PO3 溶液和0.1mol· L-1 NaOH
溶液各多少毫升.
2.今有HAc-NaAc 缓冲系配成的总浓度为0.200mol· L-1、pH=4.50 的缓冲溶液500ml,
欲将此溶液的pH 调整到4.90,需加固体NaOH 多少克?pH 为4.90 的缓冲溶液的缓冲容量
是多少?[已知HAc pKa=4.76,M(NaOH)= 40g ·mol-1]
3.浓度皆为0.1mol·L-1 的溶液:H3BO3 溶液(pKa1=9.14),NaH2PO4 溶液(pKa2=7.21),氨水
溶液(pKb=4.75) ,NaOH 溶液和HCl 溶液.
(1) 欲配制 pH 为9.25 的缓冲溶液,选哪两种溶液最好?
(2) 配 300ml 缓冲溶液,所取两种溶液的体积各为多少?
(3) 配制出的缓冲溶液的缓冲容量β? bdtb1201年前1
bdtb1201年前1 -
 nononhm 共回答了16个问题
nononhm 共回答了16个问题 |采纳率100%找找,等1年前查看全部
- 除去亚磷酸在酰卤生成后如何除去产物亚磷酸的啊?CH3COOH+PCL3---CH3COCL+H3PO3
 kuramalex1年前1
kuramalex1年前1 -
 swj1986617 共回答了17个问题
swj1986617 共回答了17个问题 |采纳率94.1%乙酰氯挥发,亚磷酸不挥发,蒸馏即可.也可以使用无水的有机溶剂萃取(亚磷酸不溶).1年前查看全部
- (2013•青岛二模)已知:Cu(OH)2是二元弱碱;亚磷酸(H3PO3)是二元弱酸,与NaOH溶液反应,生成Na2HP
 (2013•青岛二模)已知:Cu(OH)2是二元弱碱;亚磷酸(H3PO3)是二元弱酸,与NaOH溶液反应,生成Na2HPO3.
(2013•青岛二模)已知:Cu(OH)2是二元弱碱;亚磷酸(H3PO3)是二元弱酸,与NaOH溶液反应,生成Na2HPO3.
(1)在铜盐溶液中Cu2+发生水解反应的离子方程式为______,该反应的平衡常数为______;(已知:25℃时,Ksp[Cu(OH)2]=2.0×10-20mol3•L-3)
(2)根据H3PO3的性质可推测Na2HPO3稀溶液的pH______7(填“>”“<”或“=”).常温下,向10mL0.01mol•L-1H3PO3溶液中滴加10ml 0.02mol•L-1NaOH溶液后,溶液中各种离子浓度由大到小的顺序是______;
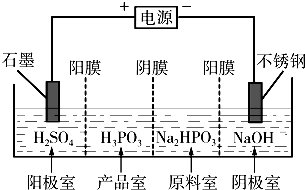
(3)电解Na2HPO3溶液可得到亚磷酸,装置如图(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过)
①阳极的电极反应式为______.
②产品室中反应的离子方程式为______. qq宾1年前1
qq宾1年前1 -
 fangxm007 共回答了16个问题
fangxm007 共回答了16个问题 |采纳率93.8%解题思路:(1)铜离子水解生成氢氧化铜和氢离子,依据沉淀溶度积常数和溶液中离子积常数计算;
(2)根据H3PO3的酸性强弱确定Na2HPO3溶液的酸碱性;氢氧化钠滴入到磷酸反应按照1:2反应依据反应产物判断离子浓度大小;
(3)阳极上是氢氧根离子失电子发生氧化反应;
②产品室中HPO32-和氢离子结合 生成亚磷酸.(1)铜离子水解离子反应为Cu2++2H2O⇌Cu(OH)2+2H+,Ksp=c(Cu2+)×c2(OH-)=2.0×10-20mol3•L-3,则K=
c2(H+)
c(Cu2+)=
c2(H+)×c2(OH−)
c(Cu2+)×c2(OH−)=
Kw2
Ksp=
(10−14)2
2.0×10−20=5×10-9,
故答案为:Cu2++2H2O⇌Cu(OH)2+2H+;5×10-9;
(2)H3PO3是弱酸,Na2HPO3是强碱弱酸盐,所以其水溶液呈碱性,即pH>7,向10mL0.01mol•L-1H3PO3溶液中滴加10ml 0.02mol•L-1NaOH溶液后,反应生成Na2HPO3,溶液水解显碱性,溶液中离子浓度大小为:c(Na+)>c(HPO32-)>c(OH-)>c(H2PO3-)>c(H+),故答案为:>;c(Na+)>c(HPO32-)>c(OH-)>c(H2PO3-)>c(H+);
(3))①阳极上氢氧根离子失电子发生氧化反应,电极反应式为4OH--4e-=2H2O+O2↑,故答案为:4OH--4e-=2H2O+O2↑;
②产品室中HPO32-和氢离子结合生成亚磷酸,反应离子方程式为:HPO32-+2H+=H3PO3,故答案为:HPO32-+2H+=H3PO3.点评:
本题考点: 盐类水解的应用;化学电源新型电池;离子浓度大小的比较.
考点点评: 本题涉及水解反应、氧化还原反应、离子浓度大小比较,电极反应式的书写等知识点,电极反应式的书写、有关平衡常数的计算是高考热点,应重点掌握.1年前查看全部
- 怎样用Pauling规则解释磷酸,亚磷酸,次磷酸酸性强弱顺序
怎样用Pauling规则解释磷酸,亚磷酸,次磷酸酸性强弱顺序
如何解释亚磷酸(H3PO3)、次磷酸(H3PO2)的酸性比磷酸( H3PO4)强.
 顶帖顶了一火车1年前1
顶帖顶了一火车1年前1 -
 evacz 共回答了15个问题
evacz 共回答了15个问题 |采纳率80%貌似pauling总结过X(OH)n型和XOn(OH)m型的酸性,主要可能是OH的d-p给电子作用1年前查看全部
- 含有6.02×10^23个O原子的H2SO4与含有3.01×10^23个O原子的H3PO3(亚磷酸)相比较,其物质的量之
含有6.02×10^23个O原子的H2SO4与含有3.01×10^23个O原子的H3PO3(亚磷酸)相比较,其物质的量之比为多少
 罗裙1年前1
罗裙1年前1 -
 Snakeee 共回答了25个问题
Snakeee 共回答了25个问题 |采纳率92%也就是1molO和0.5molO
1molH2SO4里有4MOL氧,所以1mol氧对应0.25molH2SO4
同理,得0.5molO对应1/6molH3PO3
所以,摩尔比是0.25/(1/6)=3/21年前查看全部
- (2013•济宁二模)亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3⇌H++H2PO3-.亚磷酸与
 (2013•济宁二模)亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3⇌H++H2PO3-.亚磷酸与足量NaOH溶液反应,生和Na2HPO3.
(2013•济宁二模)亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3⇌H++H2PO3-.亚磷酸与足量NaOH溶液反应,生和Na2HPO3.
(1)①写出亚磷酸与少量NaOH溶液反应的离子方程式______.
②某温度下,0.1000mol•L-1的H3PO3溶液pH的读数为1.6,即此时溶液中c (H+)=2.5×10-2mol•L-1,除OH-之外其他离子的浓度由小到大的顺序是______,该温度下H3PO3电离平衡的平衡常数K=______.(H3PO3第二步电离忽略不计,结果保留两位有效数字)
③向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中c(Na+)______ c(H2PO3-)+2c(HPO32-)(填“>”、“<”或“=”).
(2)亚磷酸具有强还原性,可使碘水褪色,该反应的化学方程式______.
(3)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如图:说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过
①阴极的电极反应式为______.
②产品室中反应的离子方程式为______. 李盛楠1年前1
李盛楠1年前1 -
 zzyzlo2004 共回答了17个问题
zzyzlo2004 共回答了17个问题 |采纳率94.1%解题思路:(1)①亚磷酸和少量氢氧化钠反应生成NaH2PO3、H2O;
②根据亚磷酸的浓度和pH知,亚磷酸是二元弱酸,在水溶液里分步电离,且电离程度逐渐减小,据此确定离子浓度大小;
K=
;c(H+).C(H2PO3−) C(H3PO3)
③根据电荷守恒分析;
(2)碘具有强氧化性,亚磷酸具有强还原性,所以碘和亚磷酸发生氧化还原反应生成氢碘酸和磷酸;
(3)①阴极上得电子发生还原反应;
②产品室中HPO32-和氢离子结合 生成亚磷酸.(1)①亚磷酸是二元酸,亚磷酸和少量氢氧化钠反应生成NaH2PO3、H2O,所以该反应方程式为:H3PO3+OH-=H2PO3-+H2O,故答案为:H3PO3+OH-=H2PO3-+H2O;
②0.1000mol•L-1的H3PO3溶液pH的读数为1.6,氢离子浓度小于亚磷酸浓度,所以亚磷酸是二元弱酸,在水中分步电离,且第一步电离程度大于第二步,两步电离中都有氢离子生成,所以氢离子浓度最大,离子浓度大小顺序是c(HPO32-)<c(H2PO3-)<c(H+),
H3PO3 ⇌H++H2PO3-
起始时各物质浓度(mol•L-1)0.1000
反应的各物质的浓度(mol•L-1)2.5×10-2 2.5×10-22.5×10-2
平衡时各物质的浓度(mol•L-1)0.10-2.5×10-2 2.5×10-22.5×10-2K=
c(H+)•c(H2PO3−)
c(H3PO3)=
2.5×10−2×2.5×10−2
0.10−2.5×10−2=8.3×1
0−3 mol•L-1
故答案为:c(HPO32-)<c(H2PO3-)<c(H+),8.3×10-3mol/L;
③溶液呈中性,则C(H+)=C(OH-),溶液呈电中性,则c(Na+)+C(H+)=C(OH-)+c(H2PO3-)+2c(HPO32-),因为C(H+)=C(OH-),所以c(Na+)=c(H2PO3-)+2c(HPO32-),故答案为:=;
(2)碘具有强氧化性,亚磷酸具有强还原性,所以亚磷酸和碘能发生氧化还原反应生成氢碘酸和磷酸,反应方程式为:
H3PO3+I2+H2O=2HI+H3PO4,故答案为:H3PO3+I2+H2O=2HI+H3PO4;
(3)①阴极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
②产品室中HPO32-和氢离子结合生成亚磷酸,反应离子方程式为:HPO32-+2H+=H3PO3,故答案为:HPO32-+2H+=H3PO3.点评:
本题考点: 弱电解质在水溶液中的电离平衡;电解原理.
考点点评: 本题考查弱电解质的电离,知识点较综合,电极反应式的书写、有关平衡常数的计算是高考热点,应重点掌握.1年前查看全部
- 亚磷酸与乙醇反应生成什么?
 无发生存啊1年前3
无发生存啊1年前3 -
 果果6 共回答了18个问题
果果6 共回答了18个问题 |采纳率88.9%把亚磷酸写成有机的结构式,根据酸脱羟基醇脱氢,可以写出,名字应该是叫亚磷酸乙酯1年前查看全部
- 怎么判断一种酸是几元酸啊,为什么亚磷酸(H3PO3)二元酸?
 香氏雪海1年前8
香氏雪海1年前8 -
 sh7301 共回答了12个问题
sh7301 共回答了12个问题 |采纳率91.7%判断酸是几元酸,不能只看他的化学式
主要看一个这种分子进入水中会电离几个氢离子
如果你在高中阶段,一般的都是有几个H就是几元酸,有几个特殊的,老师会强调,这个硬记住就行
至于有机,主要看官能团 ,主要是酚,羧基.有几个就是几元1年前查看全部
- 亚磷酸根为什么主要是负二价,为什么不是负三价
 Eniya1年前2
Eniya1年前2 -
 cherryphone 共回答了24个问题
cherryphone 共回答了24个问题 |采纳率91.7%磷酸化学式:H3PO4
亚磷酸化学式:H2PO3.所以,亚磷酸根离子为-2,磷的化合价为+4,一种物质化合价为0,可以推断各个元素的化合价.如果化合价是-3,则是磷酸根离子.1年前查看全部
- 亚磷酸中的磷是几价的
 gaohongc1年前3
gaohongc1年前3 -
 h-g-g 共回答了15个问题
h-g-g 共回答了15个问题 |采纳率93.3%亚磷酸 H3PO3
氢H +1价
磷P +3价
氧O -2价
代数和=3+3-2×3=0
有疑问请百度HI我..1年前查看全部
- 亚磷酸具有强还原性,可以使碘水褪色.该化学方程式是?
 love森1年前2
love森1年前2 -
 我为祖kk守大桥 共回答了22个问题
我为祖kk守大桥 共回答了22个问题 |采纳率90.9%H3PO3+I2+H2O==H3PO4+2HI1年前查看全部
- 亚磷酸与过量氢氧化钠溶液反应的化学方程式
 智泰1年前1
智泰1年前1 -
 julykaka 共回答了16个问题
julykaka 共回答了16个问题 |采纳率93.8%H3PO3+3NaOH=Na3PO3+3H2O1年前查看全部
- 亚磷酸分子结构式为五键,其磷化合价 为何 是 +3价而不是+5价呢?
 天天做梦又发呆1年前6
天天做梦又发呆1年前6 -
 mayhhh 共回答了26个问题
mayhhh 共回答了26个问题 |采纳率88.5%H3PO3结构简式为磷氧双键,磷再连两个羟基一个氢,由PCl3水解制的1年前查看全部
- 磷酸盐和三磷酸盐是不是一样的?“磷酸盐”我在百度搜是指:正磷酸H3PO4、焦磷酸H4P2O7、亚磷酸H3PO3、次磷酸H
磷酸盐和三磷酸盐是不是一样的?
“磷酸盐”我在百度搜是指:正磷酸H3PO4、焦磷酸H4P2O7、亚磷酸H3PO3、次磷酸H3PO2的盐类的总称.
"三磷酸盐"没搜到. 长眠的兔子1年前1
长眠的兔子1年前1 -
 打过媳妇离过婚 共回答了29个问题
打过媳妇离过婚 共回答了29个问题 |采纳率86.2%三聚磷酸钠(STPP)俗称三聚,在磷化工里面也叫“五钠”,分子式:Na5P3O10
六偏磷酸钠(SHMP)俗称六偏,分子式:(NaPO3)61年前查看全部
大家在问
- 1帮忙找点初二电压 电阻的题
- 2英语介词分析.521.London has the highest score for the quality of i
- 31.Look at that young man.He is a( ){著名的}singer in the USA.
- 4现有乌龟和仙鹤共12只,共有42只脚,乌龟和仙鹤各有多少只?(分别用算术方法和解方程方法解题)
- 5请问28*11111+99999*8怎样简便计算?
- 6某行团到达某一住处,如果安排3人住一间,则有10人无床位;如果安排4人住一间,则空2张床,列方程解
- 7122888.94万元改写成以亿为单位的近似数是多少!..
- 8某商店以40元的价格进了一批服装,若按50元一件出售时,一周可售出100件,若将每件出售价提高1元,那么其每周的销售量就
- 9客车和货车同时从相距609千米的甲乙两地相对开出,经过7小时两车相遇.已知客车每小时行42千米,货车每小时行多少千米?
- 10物体从光滑斜面下滑,斜面对小球做功么
- 11一个物体沿斜面下滑了一段距离,重力对物体做功100J,物体克服阻力做功30J.则下列说法正确的是
- 12横眉冷对千夫子,俯首甘为孺子牛快十万火急
- 13小人国奇遇记是出自哪本书?这个故事是出自哪部书?请写出书名和作者?这是宝一中的冲刺题,各位有兴趣可以看一看!
- 14横眉冷对千夫子下一句是什么
- 15填反义词()悲()喜

