(2013•攀枝花三模)在一定条件下,将4.0mol PCl3(g)和2.0mol Cl2(g)充入体积不变的2L密闭容
 zyt8306202022-10-04 11:39:541条回答
zyt8306202022-10-04 11:39:541条回答A.反应5min内,v(PCl3)=0.06 mol/(L•min)
B.达平衡时,反应放出的热量为1677.6kJ
C.平衡后,移走2.0mol PCl3和1.0mol Cl2,在相同条件下再达平衡时,c(PCl5)<0.2mol/L
D.若保持温度不变,将2.0mol PCl3(g)和1.0mol Cl2(g)充入体积不变的2L密闭容器中发生反应,当容器中Cl2为0.8mol时,可逆反应达到平衡状态

已提交,审核后显示!提交回复
共1条回复
 zhenggang365 共回答了15个问题
zhenggang365 共回答了15个问题 |采纳率73.3%- 解题思路:A、依据三氯化磷浓度变化计算反应速率V=[△c/△t]计算得到;
B、依据热化学方程式计算反应放热分析判断;
C、达平衡后移走2.0mol PC13和1.0mol C12,重新到达的平衡,可以等效为开始加入2.0mol PC13和1.0mol C12到达的平衡,与原平衡相比压强减小,平衡向逆反应移动,反应物的转化率减小,故平衡时PC15的物质的量小于原平衡的[1/2]倍;
D、依据C分析判断,平衡状态时氯气 即达平衡时PC15的物质的量小于0.8mol×[1/2]=0.4mol,反应逆向进行,氯气物质的量大于0.8mol;A、反应5min内,v(PCl3)=[2.0mol/L−1.6mol/L/5min]=0.08 mol/(L•min),故A错误;
B、PCl3(g)+Cl2(g)⇌PCl5(g)△H=-419.4kJ/mol,5min末达到平衡,且c(PCl3)=1.6mol/L.反应PCl3物质的量4.0mol-1.6mol/L×2L=0.8mol,依据热化学方程式计算反应放热419.4KJ/mol×0.8mol=335.52KJ,故B错误;
C、达平衡后移走2.0mol PC13和1.0mol C12,重新到达的平衡,可以等效为开始加入2.0mol PC13和1.0molC12到达的平衡,与原平衡相比压强减小,平衡向逆反应移动,反应物的转化率减小,故达新平衡时PC15的物质的量小于原平衡的[1/2]倍,即达平衡时PC15的物质的量小于0.8mol×[1/2]=0.4mol,c(PCl5)<0.2mol/L,故C正确;
D、依据C分析判断,将2.0mol PCl3(g)和1.0mol Cl2(g)充入体积不变的2L密闭容器中发生反应,即达平衡时PC15的物质的量小于0.8mol×[1/2]=0.4mol,平衡状态时氯气物质的量大于0.8mol,故D错误;
故选C.点评:
本题考点: 化学平衡的计算;化学平衡建立的过程.
考点点评: 本题考查了化学平衡影响因素,化学平衡计算应用,改变条件的分析方法,掌握基础是关键,题目难度较大. - 1年前
相关推荐
- (2011•攀枝花三模)为了测量电源电动势和内电阻,某同学设计了如图所示的电路,并用下列实验器材
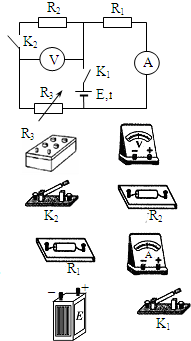 (2011•攀枝花三模)为了测量电源电动势和内电阻,某同学设计了如图所示的电路,并用下列实验器材
(2011•攀枝花三模)为了测量电源电动势和内电阻,某同学设计了如图所示的电路,并用下列实验器材
A.干电池(待测)
B.定值电阻R1、R2(阻值末知)
C.电阻箱R3.
D.电流表A(内阻很小)
E.电压表V(内阻很大)
F.开关K1、K2
G.导线若干
①请用笔画线,将答题卡上的实物图连接好.
②实验步骤为:闭合开关K1、K2,调节滑动变阻器R3,当R3=2.4Ω时,电流表0.8A,电压表读数为2V;保持滑动变阻器R3的阻值不变,断开开关K2,两电表的读数分别变为0.9A和3.6V.则该电池的电动势为______V,内阻为______Ω.
③本实验的系统误差来源于______. 赫181年前1
赫181年前1 -
 Smile4790 共回答了24个问题
Smile4790 共回答了24个问题 |采纳率87.5%解题思路:闭合开关K1、断开K2时,电压表测的外电压,有E=U1+I1r,且R1=4Ω;闭合开关K1、K2,根据电流表的读数以及R1的阻值可求出外电压,电压表测的是R2两端间的电压,再根据电压表的读数,求出R3两端的电压,以及通过R3的电流,从而求出总电流I2,有E=U2+I2r,联立两方程组,解出电动势和内阻.①如图

②闭合开关K1、断开K2时,电压表测的外电压,有E=3.6+0.9r,且R1=4Ω,闭合开关K1、K2,根据电流表的读数为0.8A,则外电压为3.2V,电压表的读数为2V,所以R3两端的电压为1.2V,则通过R3的电流为0.5A,总电流为1.3A,有E=3.2+1.3r.
联立两方程组得,E=4.5V,r=1Ω.
③实验时,电压表由于存在内阻,起分流作用,而造成系统误差.
故答案为:①如图 ②4.5V,1Ω ③电压表内阻点评:
本题考点: 测定电源的电动势和内阻.
考点点评: 解决本题的关键掌握测量电源电动势和内阻的原理,以及会分析误差形成的原因.1年前查看全部
- (2014•攀枝花三模)如图所示ABC为等腰三棱镜的横截面一束复色光从O点沿垂直于AC边方向射入三棱镜经三棱镜后分
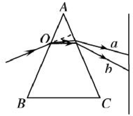 (2014•攀枝花三模)如图所示ABC为等腰三棱镜的横截面一束复色光从O点沿垂直于AC边方向射入三棱镜经三棱镜后分为 a、b两束单色光则下列说法正确的是( )
(2014•攀枝花三模)如图所示ABC为等腰三棱镜的横截面一束复色光从O点沿垂直于AC边方向射入三棱镜经三棱镜后分为 a、b两束单色光则下列说法正确的是( )
A.a光在棱镜中传播的时间小于b光在棱镜中传播的时间
B.若b光是黄光则a光可能是蓝光
C.将a、b光分别射入同一小孔b光衍射现象更明显
D.a光的频率大于b光的频率 渭水之1年前1
渭水之1年前1 -
 coobor 共回答了19个问题
coobor 共回答了19个问题 |采纳率100%解题思路:根据两种色光的偏折角的大小,分析三棱镜对它们折射率的大小,确定频率和波长的大小.由v=[c/n]分析光在光纤中传播速度关系,比较光在棱镜中传播时间的长短;蓝光的频率比黄光大;波长越长,衍射现象越明显.A、由图看出,b光通过三棱镜折射后偏折角较大,a光的偏折角较小,说明三棱镜对b光的折射率较大,a光的折射率较小,由v=[c/n]分析可知,a光在棱镜中传播速度大,通过的路程短,所以a光在棱镜中传播的时间小于b光在棱镜中传播的时间,故A正确.
B、黄光的折射率比蓝光的折射率小,所以若b光是黄光,则a光不可能是蓝光.故B错误.
C、a光的折射率小,频率小,波长长,波动性强,则将a、b光分别射入同一小孔a光衍射现象更明显,故C错误.
D、a光的折射率小,则a光的频率大于b光的频率小,故D错误.
故选:A点评:
本题考点: 光的折射定律;光的衍射.
考点点评: 本题是一种光色散现象,可以根据折射定律分析三棱镜对不同色光折射率的关系.光的衍射现象、干涉现象、光电效应、波动性与光的波长、频率的关系是考试的热点,在理解的基础上记牢.1年前查看全部
- (2011•攀枝花三模)如图所示,传送带AB长L=5m,与水平方向的夹角为30°.质量为M=1kg的小木块随传送带一起以
 (2011•攀枝花三模)如图所示,传送带ab长l=5m,与水平方向的夹角为30°.质量为m=1kg的小木块随传送带一起以v1=4m/s的速度向下匀速运动(传送带的传送速度恒定),小木块与传送带间刚好不打滑.当小木块运动至最下端a点时,一颗质量为m=0.02kg的子弹,沿平行于传送带方向,以v0=600m/s的速度正对小木块射入并穿出,穿出速度u=100m/s,以后每隔1s就***射向小木块.设子弹射穿小木块的时间极短,且每次穿过小木块时所受阻力相同(g取10m/s2),小木块与传送带间滑动摩擦力等于最大静摩擦力.求:
(2011•攀枝花三模)如图所示,传送带ab长l=5m,与水平方向的夹角为30°.质量为m=1kg的小木块随传送带一起以v1=4m/s的速度向下匀速运动(传送带的传送速度恒定),小木块与传送带间刚好不打滑.当小木块运动至最下端a点时,一颗质量为m=0.02kg的子弹,沿平行于传送带方向,以v0=600m/s的速度正对小木块射入并穿出,穿出速度u=100m/s,以后每隔1s就***射向小木块.设子弹射穿小木块的时间极短,且每次穿过小木块时所受阻力相同(g取10m/s2),小木块与传送带间滑动摩擦力等于最大静摩擦力.求:
(1)在第一颗子弹穿出小木块时,小木块的速度是多大?
(2)小木块被多少颗子弹打穿后能够从传送带b端飞出?飞出速度为多大?
(3)小木块从a点运动到b点过程中,小木块与传送带间的摩擦力做功产生的热量为多少? 品味生活08981年前1
品味生活08981年前1 -
 有意思克斯 共回答了14个问题
有意思克斯 共回答了14个问题 |采纳率71.4%解题思路:(1)子弹射穿木块过程,子弹与木块系统动量守恒,由动量守恒定律可以求出木块的速度;
(2)子弹第一次射穿木块后,求出木块速度,受力分析后求出加速度,木块这一秒内先减速上升,后加速下降,求出1s后物体的位置和速度,接着分析第二颗子弹射穿的过程,由于1s末的速度刚好等于传送带的速度,故接下来的运动过程是前面的重复,结合题中轨道的长度,就可以解出要求的量;
(3)由于摩擦力大小不变,根据公式Q=f△s,求出木块与皮带间的相对路程,即可以求出热量.(1)第一颗子弹射穿小木块过程中,木块与子弹系统动量守恒mv0-Mv1=mu+Mv2
代入数据解得:v2=6m/s 方向沿传送带向上
即在第一颗子弹穿出小木块时,小木块的速度是6m/s,方向沿传送带向上.
(2)由于小木块与传送带刚好不打滑,则有
Mgsin30°=μMgcos30°
小木块沿传送带向上作匀减速运动(向下做匀加速运动)的加速度为
a=
μMgcos300+Mgsin300
M=2gsin300=10m/s2
小木块速度减小为零所用时间
t1=
v2
a=
6
10=0.6s<1s
所以小木块在被第二颗子弹击中前先沿传送带向上做减速运动,当速度为零时,移动距离为
x1=
v22
2a=
62
2×10=1.8m
在第二颗子弹射中木块前,小木块再沿传送带向下做加速运动,时间t2=t-t1=1-0.6=0.4s
速度增大为v3=at2=4m/s(恰与传送带同速)
沿传送带向下移动的位移为 x2=
1
2a
t22=0.8m
所以两颗子弹射中木块的时间间隔内,小木块总位移x0=x1-x2=1m方向沿传送带向上
子弹数为N=
L−x1
x0+1=
5−1.8
1+1=4.2=5个
最后一颗子弹穿出小木块后小木块在传送带上前进的距离x3=L-(N-1)x0=1m
设小木块离开传送带的速度为v4,由匀变速运动规律得:v42-v22=-2ax3
代入数据解得 v4=4m/s
即小木块被5颗子弹打穿后能够从传送带B端飞出,飞出速度为4m/s.
(3)最后一颗子弹穿出小木块后小木块在传送带上运动的时间为t3,则有:v4=v2-at3
小木块与传送带间的摩擦力做功产生的热量Q=Wf=[(N-1)(v1t+x0)+x3+v1t3]μMgcos30°
联立以上各式并代入数据得:Q=109J
即小木块从A点运动到B点过程中,小木块与传送带间的摩擦力做功产生的热量为109J.点评:
本题考点: 动量守恒定律;匀变速直线运动的速度与位移的关系;滑动摩擦力;牛顿第二定律;功能关系.
考点点评: 本题中子弹射穿木块是常见的物理模型,关键在于皮带同时向下匀速运动,要分析清楚物体的受力和运动情况,由于过程较多,要善于在运动过程中发现不变的规律,如本题中物理过程有循环!1年前查看全部
- (2011•攀枝花三模)金属铍的逸出功为3.90eV.已知一群氢原子处于量子数n=4的激发态,其能级如右图所示.若用这些
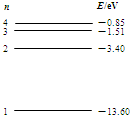 (2011•攀枝花三模)金属铍的逸出功为3.90eV.已知一群氢原子处于量子数n=4的激发态,其能级如右图所示.若用这些氢原子辐射的光照射金属铍,能够使金属铍发生光电效应的有几种不同频率的光( )
(2011•攀枝花三模)金属铍的逸出功为3.90eV.已知一群氢原子处于量子数n=4的激发态,其能级如右图所示.若用这些氢原子辐射的光照射金属铍,能够使金属铍发生光电效应的有几种不同频率的光( )
A.一种
B.二种
C.三种
D.四种 dilys01121年前1
dilys01121年前1 -
 xingqier22 共回答了27个问题
xingqier22 共回答了27个问题 |采纳率85.2%解题思路:处于n=4能级的氢原子能够发出6种不同频率的光,利用能级差算出这几种光的能量,大于金属铍的逸出功能则能发生光电效应.处于n=4能级的氢原子能够发出6种光子的能量分别为:
△E1=E2-E1=-3.4-(-13.6)=10.2eV;大于逸出功,能发生光电效应;
△E2=E3-E1=-1.51-(-13.6)=12.09eV;大于逸出功,能发生光电效应;
△E3=E4-E1=-0.85-(-13.6)=12.75eV;大于逸出功,能发生光电效应;
△E1=E4-E2=-0.85-(-3.4)=2.55eV;小于逸出功,不能发生光电效应;
△E1=E4-E3=-0.85-(-1.51)=0.66eV;小于逸出功,不能发生光电效应;
△E1=E3-E2=-1.51-(-3.4)=1.89eV;小于逸出功,不能发生光电效应;
因此有3中不同频率的光能使其发生光电效应,故选项ABD错误,C正确.
故选C.点评:
本题考点: 氢原子的能级公式和跃迁.
考点点评: 本题将光电效应和氢原子能级跃迁联系起来,有一定综合性,对于理解基本规律起着很好作用.1年前查看全部
- (2013•攀枝花三模)25℃时,下列溶液的pH或微粒的物质的量浓度关系正确的是( )
(2013•攀枝花三模)25℃时,下列溶液的pH或微粒的物质的量浓度关系正确的是( )
A.将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后,混合液pH大于7,则反应后的混合液:2c(OH-)+c(A-)=2c(H+)+c(HA)
B.pH均为9的三种溶液:CH3COOH、Na2CO3、NaOH,其物质的量浓度的大小顺序是NaOH 溶液>CH3COOH溶液>Na2CO3溶液
C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:c(R2-)+c(HR-)=c(Na+)
D.0.2mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合:c(H+)=c(OH-)+c(HCO3-)+2c(H2CO3) dearestpiggy1年前1
dearestpiggy1年前1 -
 吃葡萄的鱼 共回答了19个问题
吃葡萄的鱼 共回答了19个问题 |采纳率89.5%解题思路:A.二者混合后溶液中的溶质是等物质的量浓度的HA和NaA,溶液呈碱性,说明酸根离子水解程度大于HA电离程度,溶液中存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断;
B.pH相等的CH3COOH、Na2CO3、NaOH,强碱的物质的量浓度最小,酸根离子水解程度越大,则盐的浓度越小;
C.混合液的pH等于7,则c(H+)=c(OH-),再根据电荷守恒判断;
D.混合溶液中存在等物质的量浓度的 NaHCO3和 Na2CO3,溶液中存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断.A.二者混合后溶液中的溶质是等物质的量浓度的HA和NaA,溶液呈碱性,说明酸根离子水解程度大于HA电离程度,溶液中存在电荷守恒和物料守恒,根据电荷守恒得c(OH-)+c(A-)=c(H+)+c(Na+),根据物料守恒得2c(Na+)=c(A-)+c(HA),所以得2c(OH-)+c(A-)=2c(H+)+c(HA),故A正确;
B.pH相等的CH3COOH、Na2CO3、NaOH,强碱的物质的量浓度最小,酸根离子水解程度越大,则盐的浓度越小,水解程度:CO32->CH3COO-,所以浓度大小顺序是:CH3COOH溶液>Na2CO3溶液>NaOH 溶液,故B错误;
C.混合液的pH等于7,则c(H+)=c(OH-),根据电荷守恒得2c(R2-)+c(HR-)=c(Na+),故C错误;
D.混合溶液中存在等物质的量浓度的 NaHCO3和 Na2CO3,溶液中存在电荷守恒和物料守恒,物料守恒式为2c(Na+)=3c(HCO3-)+3c(H2CO3)+3c(CO32-),根据电荷守恒得c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),所以得c(HCO3-)+3c(H2CO3)+2c(H+)=2c(OH-)+c(CO32-),故D错误;
故选A.点评:
本题考点: 离子浓度大小的比较.
考点点评: 本题考查了离子浓度大小比较,根据溶液中的溶质及其性质再结合守恒思想分析解答,注意B中酸的强弱与酸根离子水解程度关系,注意D中通过电荷守恒和物料守恒得到的式子,这些都是易错点.1年前查看全部
- (2014•攀枝花三模)如图所示,光滑导轨MN和PQ固定在同一竖直面(纸面)内两导轨间距为L两端分别接有阻值均为R的
 (2014•攀枝花三模)如图所示,光滑导轨MN和PQ固定在同一竖直面(纸面)内两导轨间距为L两端分别接有阻值均为R的定值电阻R1和R2.两导轨间有一边长为[L/2]的正方形区域abcd该区域内有方向垂直纸面向里的匀强磁场磁感应强度为B.一质量为m的金属杆与导轨接触良好,从ab处无初速释放向下运动过程中始终保持水平杆离开磁场前已做匀速运动,不计金属杆及导轨的电阻重力加速度为g.求:
(2014•攀枝花三模)如图所示,光滑导轨MN和PQ固定在同一竖直面(纸面)内两导轨间距为L两端分别接有阻值均为R的定值电阻R1和R2.两导轨间有一边长为[L/2]的正方形区域abcd该区域内有方向垂直纸面向里的匀强磁场磁感应强度为B.一质量为m的金属杆与导轨接触良好,从ab处无初速释放向下运动过程中始终保持水平杆离开磁场前已做匀速运动,不计金属杆及导轨的电阻重力加速度为g.求:
(1)金属杆离开磁场的瞬间流过R1的电流大小和方向
(2)金属杆穿过整个磁场过程中R2上产生的电热. qazWSX9876541年前0
qazWSX9876541年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2011•攀枝花三模)一简谐横波沿x轴正方向传播,若在x=0.2m处质点的振动图象如图甲所示,则该波在t=0.4s时刻
 (2011•攀枝花三模)一简谐横波沿x轴正方向传播,若在x=0.2m处质点的振动图象如图甲所示,则该波在t=0.4s时刻的波形曲线为图乙中的( )
(2011•攀枝花三模)一简谐横波沿x轴正方向传播,若在x=0.2m处质点的振动图象如图甲所示,则该波在t=0.4s时刻的波形曲线为图乙中的( )
A.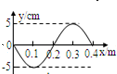
B.
C.
D.
 maiyashi1年前1
maiyashi1年前1 -
 地下hh123 共回答了13个问题
地下hh123 共回答了13个问题 |采纳率84.6%解题思路:由振动图象上t=0.4s读出x=0.2m处质点的位置和速度方向,来确定波动图象.由振动图象:t=0.4s时刻x=0.2m处质点在平衡位置向y轴正方向运动.
A、由此波动图象可知,波沿x轴正方向传播,x=0.2m处质点在平衡位置向y轴负方向运动.与振动图象反映的该点振动情况相反.故A错误.
B、由此波动图象可知,x=0.2m处质点在波谷,与振动图象反映的该点的振动情况不一致.故B错误.
C、由此波动图象可知,x=0.2m处质点在平衡位置向y轴正方向运动,与振动图象反映的该点的振动情况一致.故C正确.
D、由此波动图象可知,x=0.2m处质点在波峰,与振动图象反映的该点的振动情况不一致.故D错误.
故选C点评:
本题考点: 横波的图象;简谐运动的振动图象.
考点点评: 本题考查识别、理解振动图象和波动图象的能力和把握两种图象联系的能力.1年前查看全部
- (2013•攀枝花三模)无色溶液X由Na+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中
(2013•攀枝花三模)无色溶液X由Na+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的若干种离子组成,取溶液进行如图连续实验:下列判断正确的是( )

A.气体A能使湿润的红色石蕊试纸变蓝,气体B能使湿润的蓝色石蕊试纸变红
B.白色沉淀甲是混合物,白色沉淀乙是纯净物
C.Ag+、Ba2+、Al3+、MnO4-、SO42-一定都不存在于溶液中
D.Na+、AlO2-、CO32-一定存在于溶液中 温暖的小孩1年前1
温暖的小孩1年前1 -
 wyk_69 共回答了15个问题
wyk_69 共回答了15个问题 |采纳率100%解题思路:溶液呈无色,则不含MnO4-,加入过量盐酸只产生气体,则一定含有CO32-,不含Ag+;反应后溶液呈酸性,加入过量碳酸氢铵溶液,生成气体和白色沉淀,则发生反应应为:Al3++3HCO3-═Al(OH)3↓+3CO2↑,则原溶液中含有AlO2-,则一定不含Ag+、Ba2+、Al3+,因这些离子与AlO2-发生相互促进的水解而不能大量共存,根据溶液电中性原则,一定含有Na+;最后加入过量氢氧化钡溶液,因之前加入的碳酸氢铵过量,则生成的白色沉淀可能为BaCO3,不能确定是否含有SO42-,据此对各选项进行解答.无色溶液中不含MnO4-,加入过量盐酸只产生气体,则一定含有CO32-,不含Ag+;
反应后溶液呈酸性,加入过量碳酸氢铵溶液,生成气体和白色沉淀,则发生反应应为:Al3++3HCO3-═Al(OH)3↓+3CO2↑,则原溶液中含有AlO2-,根据离子共存一定不含Ag+、Ba2+、Al3+,因这些离子与AlO2-发生相互促进的水解而不能大量共存;
根据溶液电中性原则,一定含有Na+,最后加入过量氢氧化钡溶液,因之前加入的碳酸氢铵过量,则生成的白色沉淀可能为BaCO3,无法确定是否存在SO42-,
A.根据分析可知,气体A为CO2,能够使蓝色石蕊试纸品红;气体B为氨气,氨气能够使红色石蕊试纸变蓝,故A错误;
B.白色沉淀甲为氢氧化铝,属于纯净物;白色沉淀乙一定含有碳酸钡,可能含有硫酸钡,所以沉淀乙可能为混合物,故B错误;
C.根据以上分析可知,溶液中一定不存在的离子为:Ag+、Ba2+、Al3+、MnO4-,无法确定是否含有硫酸根离子,故C错误;
D.由分析可知,X溶液中一定存在的离子是CO32-,AlO2-,Na+,故D正确;
故选D.点评:
本题考点: 常见阳离子的检验;常见阴离子的检验.
考点点评: 本题考查常见离子的检验及离子组成分的确定,题目难度中等,注意常见离子的检验方法,把握有关离子的性质为解答关键,试题有利于培养学生的分析、理解能力.1年前查看全部
- (2010•攀枝花三模)若函数f(x)=5x+3x的反函数记为f-1(x),则f-1(4)=( )
(2010•攀枝花三模)若函数f(x)=
的反函数记为f-1(x),则f-1(4)=( )5x+3 x
A.3
B.[1/3]
C.-3
D.−1 3  可爱小猫1年前1
可爱小猫1年前1 -
 样子5566 共回答了17个问题
样子5566 共回答了17个问题 |采纳率82.4%令f(x)=4,即:
5x+3
x=4,
解得:x=-3,
∴f-1(4)=-3.
故选C.1年前查看全部
- (2010•攀枝花三模)不等式x−1x>0成立的充分不必要条件是( )
(2010•攀枝花三模)不等式x−
>0成立的充分不必要条件是( )1 x
A. x>1
B. x<-1或0<x<1
C. x>-1
D. -1<x<0或x>1 hm962521年前1
hm962521年前1 -
 浪者118 共回答了13个问题
浪者118 共回答了13个问题 |采纳率100%解题思路:先求出不等式的解集,然后根据“谁大谁必要,谁小谁充分”的原则进行逐一进行判定.不等式x−
1
x>0,解得x>1或x<0
x>1⇒x>1或x<0,符合题意,故正确;
x<-1或0<x<1⇒x>1或x<0是假命题,故不正确;
x>-1⇒x>1或x<0是假命题,故不正确;
-1<x<0或x>1⇒x>1或x<0是假命题,故不正确;
故选:A点评:
本题考点: 必要条件、充分条件与充要条件的判断;其他不等式的解法.
考点点评: 判断命题p与命题q所表示的范围,再根据“谁大谁必要,谁小谁充分”的原则,判断命题p与命题q的关系,属于基础题.1年前查看全部
- (2010•攀枝花三模)不等式x−1x>0成立的充分不必要条件是( )
(2010•攀枝花三模)不等式x−
>0成立的充分不必要条件是( )1 x
A.x>1
B.x<-1或0<x<1
C.x>-1
D.-1<x<0或x>1 cbitpl1年前1
cbitpl1年前1 -
 林迩冰 共回答了21个问题
林迩冰 共回答了21个问题 |采纳率76.2%解题思路:先求出不等式的解集,然后根据“谁大谁必要,谁小谁充分”的原则进行逐一进行判定.不等式x−
1
x>0,解得x>1或x<0
x>1⇒x>1或x<0,符合题意,故正确;
x<-1或0<x<1⇒x>1或x<0是假命题,故不正确;
x>-1⇒x>1或x<0是假命题,故不正确;
-1<x<0或x>1⇒x>1或x<0是假命题,故不正确;
故选:A点评:
本题考点: 必要条件、充分条件与充要条件的判断;其他不等式的解法.
考点点评: 判断命题p与命题q所表示的范围,再根据“谁大谁必要,谁小谁充分”的原则,判断命题p与命题q的关系,属于基础题.1年前查看全部
- (2011•攀枝花三模)用如图所示的装置可以测定棱镜的折射率,其中ABC表示待测直角棱镜的横截面,棱镜的两个锐角α和β都
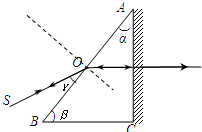
 (2011•攀枝花三模)用如图所示的装置可以测定棱镜的折射率,其中ABC表示待测直角棱镜的横截面,棱镜的两个锐角α和β都是已知的,紧贴直角边AC的是一块平面镜,将一束光线SO入射到棱镜的AB面上,适当调整SO的入射方向,使从AB面出射的光线与入射光线SO恰好重合,在这种情况下,仅需要测出SO与AB间的夹角γ就可以算出该棱镜的折射率,则计算折射率的表达式为( )
(2011•攀枝花三模)用如图所示的装置可以测定棱镜的折射率,其中ABC表示待测直角棱镜的横截面,棱镜的两个锐角α和β都是已知的,紧贴直角边AC的是一块平面镜,将一束光线SO入射到棱镜的AB面上,适当调整SO的入射方向,使从AB面出射的光线与入射光线SO恰好重合,在这种情况下,仅需要测出SO与AB间的夹角γ就可以算出该棱镜的折射率,则计算折射率的表达式为( )
A.[sinγ/sinα]
B.[cosγ/sinα]
C.[cosγ/sinβ]
D.[cosγ/cosα] lmsgood1年前1
lmsgood1年前1 -
 kai99 共回答了15个问题
kai99 共回答了15个问题 |采纳率100%1年前查看全部
- (2011•攀枝花三模)一条形磁铁用细线竖直悬挂,穿过水平金属圆环,如图所示,圆环轴线与条形磁铁中心轴线重合,现使圆环从
 (2011•攀枝花三模)一条形磁铁用细线竖直悬挂,穿过水平金属圆环,如图所示,圆环轴线与条形磁铁中心轴线重合,现使圆环从磁铁上方静止释放,圆环从开始运动到落到磁铁下方的过程中,圆环与条形磁铁( )
(2011•攀枝花三模)一条形磁铁用细线竖直悬挂,穿过水平金属圆环,如图所示,圆环轴线与条形磁铁中心轴线重合,现使圆环从磁铁上方静止释放,圆环从开始运动到落到磁铁下方的过程中,圆环与条形磁铁( )
A.始终相互吸引
B.始终相互排斥
C.先相互吸引,后相互排斥
D.先相互排斥,后相互吸引 梅间居士1年前1
梅间居士1年前1 -
 zz爱我 共回答了16个问题
zz爱我 共回答了16个问题 |采纳率81.3%解题思路:根据楞次定律进行判定:圆环从静止开始向下运动时,穿过圆环的磁通量先增大后减小,故圆环和磁铁先排斥后吸引.深刻理解楞次定律的含义:磁铁和线圈之间的所有作用效果均是阻碍线圈磁通量的变化.在本题中圆环从静止开始向下运动到落到磁铁下方的过程中,穿过圆环的磁通量先增加再减小,根据楞次定律可知磁铁对线圈的反应是:先是排斥其向下运动,阻碍其磁通量增大,后是吸收线圈,阻碍其磁通量的减小.故ABC错误,D正确.
故选D.点评:
本题考点: 楞次定律.
考点点评: 要深刻理解楞次定律“阻碍”的含义.如“阻碍”引起的线圈面积、速度、受力等是如何变化的.1年前查看全部
- (2013•攀枝花三模)尿素(CO(NH2)2,其中氮元素为-3价)在工业中有着非常重要的地位.
(2013•攀枝花三模)尿素(co(nh2)2,其中氮元素为-3价)在工业中有着非常重要的地位.

(1)工业上在183℃、14mpa条件下,当17g液氨与足量co2完全反应生成co(nh2)2(l)和h2o(l)时,放出51.9kj/mol的热量,写出反应的热化学方程式2nh3(l)+co2(g)
co(nh2)2(l)+h2o(l)△h=-103.8kj/mol183℃ .14mpa 2nh3(l)+co2(g),
co(nh2)2(l)+h2o(l)△h=-103.8kj/mol183℃ .14mpa
按n(nh3):n(co2)=4:1充入时,co2的转化率随时间的变化关系如图1所示.
①a点的逆反应速率v速(co2)______b点的正反应速率为v正(co2)(填“大于”、“小于”或“等于”)
②nh3的平衡转化率为______.
(2)h2是未来重要的能源它的制取与储存是必须解决的两大问题.电解尿素[co(nh2)2]的碱性溶液制氢的装置示意图如图2(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).电解时,阳极的电极反应式为______.mg2cu是一种储氢合金.350℃时,mg2cu与h2反应生成mgcu2和仅含一种金属元素的氢化物(其中氢的质量分数为7.7%),写出反应的化学方程式2mg2cu+3h2
mgcu2+3mgh2350℃ .2mg2cu+3h2.
mgcu2+3mgh2350℃ .
(3)在工业上常用尿素还原法制溴化钾:50~60℃的碳酸钾溶液中***素,溶解后再加入液溴,生成溴化钾和对环境无污染的常见气体,请写出发生反应的化学方程式3k2co3+co(nh2)2+3br2
6kbr+4co2↑+n2↑+2h2o50−60℃ .3k2co3+co(nh2)2+3br2.
6kbr+4co2↑+n2↑+2h2o50−60℃ . 高淳螃蟹1年前1
高淳螃蟹1年前1 -
 never_peace 共回答了18个问题
never_peace 共回答了18个问题 |采纳率100%解题思路:(1)17g液氨的物质的量是1mol,1mol液氨完全反应放出51.9kJ热量,则2mol液氨完全反应放出103.8kJ 热量,据此书写热化学反应方程式;
①物质的浓度的越大其反应速率越大;
②根据二氧化碳的量计算参加反应的氨气的量,再结合转化率公式计算;
(2)阳极上尿素失电子和氢氧根离子反应生成碳酸根离子、氮气和水;
令金属氢化物为RHx,金属R的相对分子质量为a,则[x/a+x]=0.077,即923x=77a,X为金属的化合价,讨论可得x=2,a=24,故该金属氢化物为MgH2;
(3)根据元素守恒结合物质性质知,生成的气体应该是二氧化碳、氮气,同时还生成水,根据反应物、生成物及反应条件书写方程式.(1)17g液氨的物质的量是1mol,1mol液氨完全反应放出51.9kJ热量,则2mol液氨完全反应放出103.8kJ 热量,所以其热化学反应方程式为2NH3(l)+CO2(g)
183℃
.
14MPa CO(NH2)2(l)+H2O(l)△H=-103.8kJ/mol,故答案为:2NH3(l)+CO2(g)
183℃
.
14MPa CO(NH2)2(l)+H2O(l)△H=-103.8kJ/mol;
①物质浓度越大,反应速率越大,A点生成物浓度小于B点生成物浓度,所以A点逆反应速率小于B点逆反应速率,B点正逆反应速率相等,所以A点逆反应速率小于B点正反应速率,故答案为:小于;
②假设充入氨气、二氧化碳的物质的量分别是4mol、1mol,达到平衡时,反应的n(CO2)=1mol×0.6=0.6mol,则反应的n(NH3)=2n(CO2)=1.2mol,氨气的转化率=[1.2mol/4mol×100%=30%,故答案为:30%;
(2)阳极上尿素失电子和氢氧根离子反应生成碳酸根离子、氮气和水,电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O;
令金属氢化物为RHx,金属R的相对分子质量为a,则
x
a+x]=0.077,即923x=77a,X为金属的化合价,讨论可得x=2,a=24,故该金属氢化物为MgH2,该反应方程式为2Mg2Cu+3H2
350℃
.
MgCu2+3MgH2,
故答案为:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O;2Mg2Cu+3H2
350℃
.
MgCu2+3MgH2;
(3)无毒的含碳、N元素的物质分别为二氧化碳、氮气,根据元素守恒知,还生成水,所以反应方程式为3K2CO3+CO(NH2)2+3Br2
50−60℃
.
6KBr+4CO2↑+N2↑+2H2O,故答案为:3K2CO3+CO(NH2)2+3Br2
50−60℃
.
6KBr+4CO2↑+N2↑+2H2O.点评:
本题考点: 化学平衡的计算;热化学方程式;原电池和电解池的工作原理;转化率随温度、压强的变化曲线.
考点点评: 本题考查较综合,涉及电解原理、氧化还原反应、化学平衡的计算等知识点,根据物质的性质、反应方程式进行分析解答,注意(2)中氢化物的确定,为难点.1年前查看全部
- (2010•攀枝花三模)以抛物线y2=4x的焦点为圆心,且与直线y=x相切的圆的标准方程为(x−1)2+y2=12(x−
(2010•攀枝花三模)以抛物线y2=4x的焦点为圆心,且与直线y=x相切的圆的标准方程为(x−1)2+y2=
1 2 (x−1)2+y2=.1 2  妙手书生1年前1
妙手书生1年前1 -
 fuyi861002 共回答了13个问题
fuyi861002 共回答了13个问题 |采纳率76.9%解题思路:依题意可求得抛物线焦点即圆心的坐标,进而根据点到直线的距离公式求得圆的半径,则圆的方程可得.依题意可知抛物线的焦点为(1,0),到直线直线y=x的距离即圆的半径为
1
12+12=
2
2
故圆的标准方程为(x−1)2+y2=
1
2
故答案为(x−1)2+y2=
1
2点评:
本题考点: 抛物线的简单性质;圆的标准方程.
考点点评: 本题主要考查了抛物线的简单性质,圆的方程,点到直线的距离等问题.属基础题.1年前查看全部
大家在问
- 1There was once a farmer. His land was hilly and the soil was
- 2有关 《唐才子传》 李白 王维 文章的评析
- 3我会用”——————,——————”来赞美亲爱的老师.(根据情境在横线上填上合适的诗句)
- 4My aunt sent me什么MP4 player as my birthday present?急
- 5填带有舌字的成语形容信口胡说( )
- 6(本题满分14分)已知点 ( ),过点 作抛物线 的切线,切点分别为 、 (其中 ).(Ⅰ)求 与 的值(用 表示);(
- 7把“CHINA”这五个字母涂上五种不同的颜色,每个字母只能涂一种颜色.共有多少种涂色方法?
- 8这句英文中,请问fifteen hundred是什么意思,
- 9NaHSO4+Ca(HCO3)2= NaHSO3+NaHSO4= HAC(醋酸)+Ba(OH)2=
- 10英语翻译请高手用准确严谨的措辞,ITS PRODUCTS AS PROVIDED AND MARKED BELOW,AN
- 11向斜形成山岭的原因是什么?
- 12解方程:X+7分之3=7分之8、X-15分之4=15分之7、10分之5+X=10分之13、X-7分之5=1
- 13你能写出带“鼎”字的成语吗?( )( )( )( )(
- 14讨论函数f(x)=lim根号下1+|x|^3n的连续性与可导性,n趋向于无穷
- 15分数64分子55的分子减去一个数,分母同时加上这个数后,所得的新分数化简为13分子4,这个数