SiO2+2KOH=K2Sio3+H2O
 virginiacj2022-10-04 11:39:541条回答
virginiacj2022-10-04 11:39:541条回答怎么把它变成离子方程式?如何取舍

已提交,审核后显示!提交回复
共1条回复
 痴恋一根草 共回答了18个问题
痴恋一根草 共回答了18个问题 |采纳率83.3%- SiO2+2OH- =2SiO3^2-+H2O
水,氧化物,弱电解质不拆,离子化合物拆开 - 1年前
相关推荐
- 高锰酸钾与硅烷反应反应方程式如下SiH4 + 2KMnO4 + = K2SiO3 + 2MnO2 + H2+ H2O我想
高锰酸钾与硅烷反应
反应方程式如下SiH4 + 2KMnO4 + = K2SiO3 + 2MnO2 + H2+ H2O
我想明白为什么会生成氢气,高锰酸钾应该强氧化性,并且为什么比例是这个比例呢?满意追加
 成都de小罗1年前1
成都de小罗1年前1 -
 tt88hong 共回答了18个问题
tt88hong 共回答了18个问题 |采纳率94.4%H:-1 si:+4
高锰酸钾把H氧化成H2 没问题,估计是氧不够咯
比例的话,按照电子转移比例写就好.
2个H升了2价,2个H升了4价,总共就是6价.一个高锰酸钾Mn降了3价……比例是2:1
然后为了升降平衡,就需要1个SiH4 + 2个KMnO4,后面的就是自己配把1年前查看全部
- (2014•浙江模拟)固体粉末X中可能含有Fe、Fe2O3、MnO2、CuO、K2SiO3、K2SO3、NaNO2、KA
(2014•浙江模拟)固体粉末X中可能含有Fe、Fe2O3、MnO2、CuO、K2SiO3、K2SO3、NaNO2、KAlO2中的若干种.某同学为确定该固体粉末的成分,取X进行连续实验:以下说法正确的是( )

A.溶液甲中一定含有K2SiO3、NaNO2,可能含有KAlO2
B.由于在溶液甲中加入足量稀盐酸后再加入BaCl2溶液,因此无法判断溶液中是否有K2SO3
C.气体A和气体B一定均为纯净物
D.原混合物中一定含有Fe2O3 chainson1年前1
chainson1年前1 -
 w饭语1啼极枯 共回答了20个问题
w饭语1啼极枯 共回答了20个问题 |采纳率90%解题思路:固体X加水溶解过滤分为两组:易溶组:K2SiO3、K2SO3、NaNO2、KAlO2,难溶组:Fe、Fe2O3、MnO2、CuO;
溶液甲加入过量稀盐酸,放出有色气体,说明发生反应:2H++NO2-=NO2↑+NO↑+H2O,溶液甲中一定存在NaNO2;产生沉淀A,说明发生反应:2H++SiO2-=H2SiO3↓,则一定存在K2SiO3;
溶液A加入BaCl2溶液,无沉淀说明不存在K2SO3,否则会发生反应:2H++2NO2-+SO32-=SO42-+2NO↑+H2O,生成的硫酸根离子再与BaCl2溶液反应产生白色沉淀,无法确定是否含有KAlO2;
固体甲加入足量浓盐酸,加热后产生有色气体B,则B一定为Cl2,则混合物中含有MnO2;溶液B滴加KSCN溶液产生血红色溶液,说明溶液B中存在Fe3+,但来源有两种可能:一种是直接Fe2O3被盐酸溶解所得,另一种是Fe被盐酸溶解后产生Fe2+,Fe2+被MnO2或Cl2氧化成Fe3+,则原混合物中至少存在Fe、Fe2O3中的一种,
根据以上分析对各选项进行判断.固体X加水溶解过滤分为两组,易溶组:K2SiO3、K2SO3、NaNO2、KAlO2,难溶组:Fe、Fe2O3、MnO2、CuO;
溶液甲加入过量稀盐酸,放出有色气体,说明存在NaNO2(2H++NO2-=NO2↑+NO↑+H2O);产生沉淀A,说明存在K2SiO3(2H++SiO2-=H2SiO3↓);
溶液A加入BaCl2溶液,无沉淀说明不存在K2SO3,否则会发生2H++2NO2-+SO32-=SO42-+2NO↑+H2O,再与BaCl2溶液反应产生白色沉淀,无法确定KAlO2是否存在;
固体甲加入足量浓盐酸,加热,产生有色气体B,一定是Cl2,则一定含有MnO2;溶液B滴加KSCN溶液产生血红色溶液,说明溶液B中存在Fe3+,但来源有两种可能:一种是直接Fe2O3被盐酸溶解所得,另一种是Fe被盐酸溶解后产生Fe2+,Fe2+被MnO2或Cl2氧化成Fe3+,所以Fe、Fe2O3至少存在一种;
A.根据以上分析可知,溶液甲中一定含有K2SiO3、NaNO2,可能含有KAlO2,故A正确;
B.根据分析可知,溶液甲中一定不存在K2SO3,否则会生成白色沉淀硫酸钡,故B错误;
C.气体A为一氧化氮和二氧化氮的混合物,气体B为氯气,属于纯净物,故C错误;
D.原混合物中Fe、Fe2O3至少存在一种,不一定含有Fe2O3,故D错误;
故选A.点评:
本题考点: 几组未知物的检验.
考点点评: 本题考查物质的检验和鉴别的实验方案的设计,侧重于元素化合物知识的综合运用,题目难度中等,注意把握反应的现象,根据现象结合物质的性质进行判断.1年前查看全部
- (2013•嘉兴二模)固体粉末X中可能含有FeO、Fe2O3、MnO2、K2SiO3、K2SO3、KAlO2、MgCl2
(2013•嘉兴二模)固体粉末X中可能含有FeO、Fe2O3、MnO2、K2SiO3、K2SO3、KAlO2、MgCl2、K2CO3、NaNO2中的若干种.为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如下:
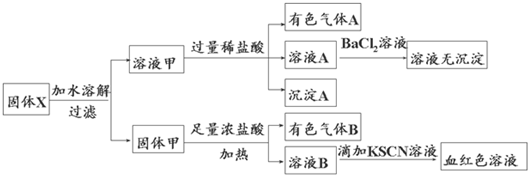
根据上述实验,以下说法正确的是( )
A. 溶液甲中一定含有K2SiO3、NaNO2、可能含有KAlO2、K2CO3
B. 由于在溶液甲中加入足量稀盐酸后再加入BaCl2溶液,因此无法判断溶液中是否有K2SO3
C. 气体A和气体B一定均为纯净物
D. 原混合物中一定含有Fe2O3 饵刀1年前4
饵刀1年前4 -
 梦血 共回答了18个问题
梦血 共回答了18个问题 |采纳率88.9%解题思路:有色气体A应为NO2,可能含有CO2气体,说明一定含有NaNO2,固体甲与浓盐酸反应生成有色气体B,B应为Cl2,则应含有MnO2,沉淀A应为H2SiO3,说明含有K2SiO3,则一定不含有MgCl2,溶液B加KSCN溶液呈血红色,说明含有Fe3+,则固体中可能含有FeO、Fe2O3,Fe2+可被氯气氧化生成Fe3+,以此解答该题.有色气体A应为NO2,可能含有CO2、SO2等气体,说明一定含有NaNO2,固体甲与浓盐酸反应生成有色气体B,B应为Cl2,则应含有MnO2,沉淀A应为H2SiO3,说明含有K2SiO3,则一定不含有MgCl2,溶液B加KSCN溶液呈血红色,说明含有Fe3+,则固体中可能含有FeO、Fe2O3,Fe2+可被氯气氧化生成Fe3+,
A.有以上分析可知一定含有K2SiO3、NaNO2,可能含有K2CO3,也可能含有KAlO2,加入过量盐酸生成AlCl3,与以上物质不反应,不能确定,故A正确;
B.因含有NaNO2,如含有K2SO3,二者在酸性条件下发生氧化还原反应生成SO42-,加入氯化钡生成硫酸钡沉淀,加入足量稀盐酸后再加入BaCl2溶液没有沉淀,则一定不含有K2SO3,故B错误;
C.有色气体A应为NO2,可能含有CO2气体,而浓盐酸易挥发,生成的氯气中一定含有HCl气体,故C错误;
D.溶液B加KSCN溶液呈血红色,说明含有Fe3+,则固体中可能含有FeO、Fe2O3,Fe2+可被氯气氧化生成Fe3+,故D错误.
故选A.点评:
本题考点: 物质的检验和鉴别的实验方案设计;物质的检验和鉴别的基本方法选择及应用.
考点点评: 本题考查物质的检验和鉴别的实验方案的设计,侧重于元素化合物知识的综合运用,题目难度中等,注意把握反应的现象,根据现象结合物质的性质进行判断,易错点为B和D,注意体会.1年前查看全部
大家在问
- 1用括号内所给单词的适 用括号内所给单词的适当形式填空. 1. Where can I buy so
- 2阿基米德曾讲过,如果给我一个支点和一根足够长的杆,我可以撬动地球
- 3能够代表下图中人物思想的,由其弟子根据其受课笔记编撰而成书的书名是《_____》.
- 4求解非齐次方程组 增广矩阵2 -7 3 1 6,3 5 2 2 4 ,9 4 1 7 2的通解,我一直算不出来用2 7
- 5防止铁的腐蚀中,外加电流阴极保护法和铁上镀一层锌皮,哪一种更好,为什么呢?
- 6统计图有哪几种?急
- 7如图是某超市07年一年中四种洗发用品的销售情况统计图.
- 8甲乙丙三人独立地破译一份密码,他们每人一处此密码的概率都是0.25则密码能被翻译出的概率是?
- 9读“美国本土降水分布图”,完成下列问题.
- 10与日期相同的经度范围怎么求举列说明.
- 118x+5x-2x=11x是不是方程
- 12一个长方体玻璃缸(从里面量),底面积是300平方厘米,高9厘米,里面盛有3厘米深的水,现在将一块不规则形状的石头浸没于水
- 13求句子描写,写有关爱情,能催人泪下的句子!
- 14这种水果里含有太多的糖分.英文there [ ] [ ] [ ] [ ] in this kind of fruit.
- 15写出一个同类词。 Example: book pencil desk (pen)
