MnCl2和K2S2O8在Ag+催化条件生成什么?
 观聊不语2022-10-04 11:39:541条回答
观聊不语2022-10-04 11:39:541条回答
MnCl2和K2S2O8在Ag+催化条件生成什么?
知道能生成KMNO4
但是具体的化学方程式怎么写?
知道能生成KMNO4
但是具体的化学方程式怎么写?

已提交,审核后显示!提交回复
共1条回复
 gg湖 共回答了23个问题
gg湖 共回答了23个问题 |采纳率95.7%- 2Mn2+ +5S2O82- +8H2O==2MnO4- +10SO42- +16H+
- 1年前
相关推荐
- 已知硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸
已知硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸.
(1)请写出并配平上述反应的化学方程式______.
(2)此反应的还原剂是______,它的氧化产物是______.
(3)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有______. 542779911年前1
542779911年前1 -
 gb784533 共回答了15个问题
gb784533 共回答了15个问题 |采纳率93.3%解题思路:(1)根据反应物为硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液,生成物为高锰酸钾、硫酸钾和硫酸,利用质量守恒定律和电子守恒来写出并配平上述反应的化学方程式;
(2)含元素化合价升高的物质为还原剂,还原剂被氧化,对应的产物为氧化产物;
(3)根据电子守恒来判断Cl元素的化合价变化,进一步确定生成物.(1)由信息可知,反应物与生成物,则MnSO4+K2S2O8+H2O→KMnO4+K2SO4+8H2SO4,
Mn元素的化合价由+2价升高到+7价,
S元素的化合价由+7降低为+6价,
由电子守恒及质量守恒定律可知,配平的化学反应为2MnSO4+5K2S2O8+8H2O=2KMnO4+4K2SO4+8H2SO4,
故答案为:2MnSO4+5K2S2O8+8H2O=2KMnO4+4K2SO4+8H2SO4;
(2)因Mn元素的化合价升高,则MnSO4为还原剂,被氧化,发生氧化反应,KMnO4为氧化产物,
故答案为:MnSO4;KMnO4;
(3)硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,
S元素的化合价还是由+7降低为+6价,
由氧化还原反应中电子守恒可知,则Cl元素的化合价升高,即为-1价升高到0,
因单质中元素的化合价为0,即生成物还有Cl2,故答案为:Cl2.点评:
本题考点: 氧化还原反应;氧化还原反应方程式的配平.
考点点评: 本题考查氧化还原反应,明确反应物与生成物并利用化合价的变化来写反应方程式是解答本题的关键,并注意电子守恒的应用来解答此类习题.1年前查看全部
- 过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2,:S2O8 ^2- +2I- =====2SO4 ^2- +
过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2,:S2O8 ^2- +2I- =====2SO4 ^2- +I2
通过改变反应信息系统,Fe^3+,Fe^2+均可催化上述反应.试用离子方程式表示Fe^3+对上述反应催化的过程__________,____________.(不必配平) ping子1年前1
ping子1年前1 -
 ronanmetal 共回答了13个问题
ronanmetal 共回答了13个问题 |采纳率92.3%2Fe^3+ + 2I^- ----> I2 + 2Fe^2+
S2O8 ^2- + 2Fe^2+ =====2SO4 ^2- + 2Fe^3+1年前查看全部
- K2S2O8中硫元素的化合价多少?
 冰魄1年前1
冰魄1年前1 -
 jerry3210 共回答了19个问题
jerry3210 共回答了19个问题 |采纳率89.5%表面看似乎+8,其实不是硫没有+8价,由于有一个过氧键,所以过二硫酸钾硫元素化合价就是最高价+6价.1年前查看全部
- 化学式MnSO4+K2S2O8+H2O=KMnO4+K2S2O4+H2SO4(Ag离子为催化剂),怎么配平?
化学式MnSO4+K2S2O8+H2O=KMnO4+K2S2O4+H2SO4(Ag离子为催化剂),怎么配平?
、、 sailorwy1年前3
sailorwy1年前3 -
 lixiaojing303 共回答了10个问题
lixiaojing303 共回答了10个问题 |采纳率90%2;2;4;2;1;4
二楼对的
不能用电子守恒比较麻烦
观察,锰元素两边各只出现一次,先不管
奇偶配钾,再配硫.检查.1年前查看全部
- MnO4+ K2S2O8+ =KMNO4+ K2SO4+ H2SO4求补全并配平
MnO4+ K2S2O8+ =KMNO4+ K2SO4+ H2SO4求补全并配平
MnSO4+ K2S2O8-(负一价)+ =KMNO4+ K2SO4+ H2SO4 5483001年前4
5483001年前4 -
 lsk2000 共回答了12个问题
lsk2000 共回答了12个问题 |采纳率91.7%MnSO4+ K2S2O8-+ =KMNO4+ K2SO4+ H2SO4
补全一般是补氢离子,氢氧根或者水
该反应生成硫酸,而且缺少氢元素,可以考虑反应缺水.
MnSO4+ K2S2O8+ H2O=KMnO4+ K2SO4+ H2SO4
实际上S2O8-中S是+6价,因为硫只有6个价电子.其中两个氧是-1价
1、先标出化合价升降:
+2 -1*2 +7 -2
MnSO4+ K2S2O8+ H2O=KMnO4+ K2SO4+ H2SO4
升5 降2
2、用最小公倍数配平氧化还原部分:
2 MnSO4+ 5 K2S2O8 + H2O === 2 KMnO4+ 4 K2SO4 + H2SO4
3、用观察法配平其它原子:
2 MnSO4+ 5 K2S2O8 + 8 H2O === 2 KMnO4+ 4 K2SO4 + 8 H2SO41年前查看全部
- H2O+K2S2O8+MnSO4------K2SO4+KMnO4+H2SO4
H2O+K2S2O8+MnSO4------K2SO4+KMnO4+H2SO4
怎么配平? htabing1年前2
htabing1年前2 -
 oo包包 共回答了14个问题
oo包包 共回答了14个问题 |采纳率78.6%化合价变化
S(得电子)+7 ——> +6,一个S得1个电子,一个K2S2O8得2个电子
Mn(失电子)+2 ——> +7,一个Mn失5个电子,一个MnSO4也失5个电子
所以K2S2O8前配5,MnSO4前配2,然后根据Mn原子守恒配KMnO4,再根据K+守恒配K2SO4,后根据S原子守恒配H2SO4,最后根据H原子守恒配水
8 H2O + 5 K2S2O8 + 2 MnSO4 === 4 K2SO4 + 2 KMnO4 + 8 H2SO41年前查看全部
- 已知MnSO4和K2S2O8两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾\硫酸钾和硫酸.
已知MnSO4和K2S2O8两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾硫酸钾和硫酸.
1.写出并配平上述反应的方程式_______
2.此反应的还原剂是______,它的氯化产物是____
3.此反应的离子反应方程式______________
4.若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾硫酸钾硫酸生成外,其他的生成物还有________________
回答第4问就可以
为什么是氯气?为什么 西西м1年前2
西西м1年前2 -
 一个人关闭 共回答了22个问题
一个人关闭 共回答了22个问题 |采纳率90.9%1) 2MnSO4+45K2S2O8+8H2O=2KMnO4+4K2SO4+8H2SO4
2) 2.此反应的还原剂是 硫酸锰(Mnso4)
氧化产物是 高锰酸钾 KMnO4
4)有氯气是因为产生了高锰酸根和氢离子就相当于产生了高锰酸,高锰酸氧化性强于氯气,就把氯离子氧化了产生氯气
答道第三个了才看见你的问题补充1年前查看全部
- 【化合价】K2S2O8 中S化合价是+7价?
【化合价】K2S2O8 中S化合价是+7价?
S的最高价不是+6价么? jzzhang5201年前5
jzzhang5201年前5 -
 云生天南 共回答了17个问题
云生天南 共回答了17个问题 |采纳率82.4%不是1年前查看全部
- K2S2O8到底是不是沉淀阿.有人做过实验么?
 huazizi1年前1
huazizi1年前1 -
 ytgxy 共回答了7个问题
ytgxy 共回答了7个问题 |采纳率85.7%20ºC溶解度约5g,当然算易溶于水.不过溶解速度较慢1年前查看全部
- K2S2O8与Mncl2作用 用Ag+作催化加 方程式
 afang1年前1
afang1年前1 -
 laoyagong 共回答了18个问题
laoyagong 共回答了18个问题 |采纳率88.9%在AgNO3催化下,Mn2+被过二硫酸根氧化为MnO4-:
5 S2O82- + 2 Mn2+ + 8 H2O = 4 SO42- + 2 MnO4- + 16 H+
5 K2S2O8 + 2 MnSO4 + 8 H2O = 4 K2SO4 + 2 KMnO4 + 8 H2SO4
如果用MnCl2,除了Mn2+被氧化,Cl-还会被氧化为Cl2,
7 S2O82- + 2 Mn2+ + 4 Cl- + 8 H2O = 6 SO42- + 2 MnO4- + 16 H+ + 2 Cl2↑
7 K2S2O8 + 2 MnCl2 + 8 H2O = 6 K2SO4 + 2 KMnO4 + 8 H2SO4 + 2 Cl21年前查看全部
- 高一化学题已知MnSO4和K2S2O8两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾\硫酸钾和硫酸.1.写出并
高一化学题
已知MnSO4和K2S2O8两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾硫酸钾和硫酸.
1.写出并配平上述反应的方程式_______
2.此反应的还原剂是______,它的氯化产物是____
3.此反应的离子反应方程式______________
4.若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾硫酸钾硫酸生成外,其他的生成物还有________________ 惜汐1年前2
惜汐1年前2 -
 wuxianwang 共回答了33个问题
wuxianwang 共回答了33个问题 |采纳率81.8%1 2 MnSO4 + 5 K2S2O8 + 8 H2O = 2 KMnO4 + 4 K2SO4 + 8 H2SO4
2 还原剂为MnSO4,氧化产物为KMnO4
3 2 Mn 2+ + 5 S2O8 2- + 8 H2O = 2 MnO4 - + 10 SO4 2- + 16 H +
4 Cl2(氯气)1年前查看全部
- 过硫酸钾K2S2O8 中的硫是几价?
 lpxiang1年前1
lpxiang1年前1 -
 后人物成 共回答了23个问题
后人物成 共回答了23个问题 |采纳率100%+7价1年前查看全部
- 自主招生的化学题已知硫酸锰和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下发生氧化还原反应.生成锰酸钾.硫酸钾和硫酸
自主招生的化学题
已知硫酸锰和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下发生氧化还原反应.生成锰酸钾.硫酸钾和硫酸 配平化学方程式和离子方程式 离子方程式 我推出的是这个8H2O+2Mn2++5S2O82-+==2MnO4-+10SO42-+16H+ 由这个怎么推出化学方程式
答案却是8H2O+2Mn2++5S2O82-+==2MnO4-+8SO42-+16H+ 硫都不守恒 到底哪个对 qq佳人谁来邀1年前3
qq佳人谁来邀1年前3 -
 db12341230 共回答了14个问题
db12341230 共回答了14个问题 |采纳率100%Mn升了5价 ,S降了一价 , 又因为两个S降价 , 所以(左边) Mn*2 S*5 你们两个都对的对 ,但右边答案错了
接下来配电荷守恒 左边. 右边. (答案电荷不守恒,原子也不守恒) 所以你的是对的,答案是错的 .
相信自己吧.1年前查看全部
- 碘在科研与生活中有重要应用.某兴趣小组用0.50mol•L-1KI、0.2%淀粉溶液、0.20mol•L-1K2S2O8
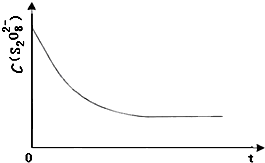 碘在科研与生活中有重要应用.某兴趣小组用0.50mol•L-1KI、0.2%淀粉溶液、0.20mol•L-1K2S2O8、0.10mol•L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
碘在科研与生活中有重要应用.某兴趣小组用0.50mol•L-1KI、0.2%淀粉溶液、0.20mol•L-1K2S2O8、0.10mol•L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
已知:S2O82-+2I-═2SO42-+I2(慢)I2+2S2O32-═S4O62-+2I- (快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的______(填化学式)耗尽后,溶液颜色将由无色变成为蓝色.为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-):n(S2O82-)<______.
(2)某同学设计实验如下表所示:
该实验的目的是______;表中V1=______mL,理由是______.0.20mol•L-1K2S2O8溶液的体积/mL 0.10mol•L-1Na2S2O3溶液的体积/mL H2O的体积/mL 0.50mol•L-1KI溶液的体积 淀粉溶液 实验1 10.0 4.0 0.0 4.0 2.0 实验2 9.0 4.0 1.0 4.0 2.0 实验3 8.0 4.0 V1 4.0 2.0
(3)已知某条件下,浓度c(S2O82-)~反应时间t的变化曲线如图,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)~t的变化曲线示意图(进行相应的标注) 洹畔一叟1年前1
洹畔一叟1年前1 -
 彪悍的毛一定结实 共回答了25个问题
彪悍的毛一定结实 共回答了25个问题 |采纳率92%(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,先发生S2O82-+2I-═2SO42-+I2(慢),后发生I2+2S2O32-═S4O62-+2I- (快),当S2O32-耗尽后,碘才能与淀粉作用显示蓝色,根据I2+2S2O32-═S4O62-+2I- (快)方程式知,I2与S2O32-的物质的量的关系为1:2,即1mol碘需2molS2O32-,根据方程式S2O82-+2I-═2SO42-+I2知,生成1mol碘需为1molS2O82-,即n(S2O32-):n(S2O82-)=2:1,为确保能观察到蓝色,碘需有剩余,即n(S2O32-):n(S2O82-)<2:1,
故答案为:Na2S2O3;<2;
(2)对照实验1和2发现,实验2取的0.20mol•L-1K2S2O8溶液的体积9mL,比实验1少了1mL,说明取的K2S2O8物质的量少,加水1mL,保证了溶液的体积不变,所以在其它条件不变的情况下,探究的是该反应速率与K2S2O8浓度的关系,同样原理对照实验1和3,为保证溶液的体积相同,须加2mL水,
故答案为:探究该反应速率与K2S2O8浓度的关系;2 mL;理由是保证反应物K2S2O8浓度改变,而其他的不变,才到达实验目的;
(3)保持其它条件不变,降低温度,反应速率降低,到达液颜色将由无色变成为蓝色的时间变长,而使用催化剂,能加快化学反应速率,所以到达液颜色将由无色变成为蓝色的时间变短,故答案为: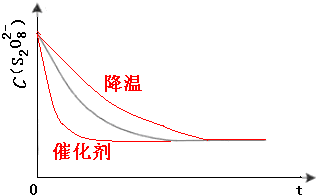 .
1年前查看全部
.
1年前查看全部
- 过二硫酸钾(K2S2O8)常作氧化剂,K2S2O8溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色,
过二硫酸钾(K2S2O8)常作氧化剂,K2S2O8溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色,该反应的例子方程式为 我想问的是最后方程里边K2S2O8变成了硫酸根 为什么不是其他SO3 SO2或者是H2S之类的 题目也没有说K2S2O8会变成什么呀 这是怎么判断的
 emesxh1年前1
emesxh1年前1 -
 睾跟邪 共回答了20个问题
睾跟邪 共回答了20个问题 |采纳率95%过硫酸钾的硫为 7价先被还原为 6后氧化性减弱(除浓硫酸)已经达到稳定,不会再降价.如氯 5价要直降至-1价才稳定而一般不会生成0价的CL2.1年前查看全部
- 已知硫酸锰(Mnso4) 和过二硫酸钾(k2s2o8)两种盐溶液在银离子的催化下可发生氧化还原反应,生成高锰酸,硫酸钾,
已知硫酸锰(Mnso4) 和过二硫酸钾(k2s2o8)两种盐溶液在银离子的催化下可发生氧化还原反应,生成高锰酸,硫酸钾,硫酸
此反应的离子方程式可表示为 光光PP1年前2
光光PP1年前2 -
 pitt083 共回答了14个问题
pitt083 共回答了14个问题 |采纳率92.9%2Mn2+ +5S2O2- +8H2O =Ag+=2MnO4- +10SO42- +16H+1年前查看全部
- 化学试剂的鉴别.第一组 NaCl KBr KI第二组 Na2SO4 Na2S2O3 Na2S K2S2O8 第三组 Na
化学试剂的鉴别.
第一组 NaCl KBr KI
第二组 Na2SO4 Na2S2O3 Na2S K2S2O8
第三组 NaNO2 NaNO3 Na2co3 Na3PO4
现在是试剂在眼前 不知道哪瓶对应哪瓶 pannisi1年前1
pannisi1年前1 -
 阿程83 共回答了18个问题
阿程83 共回答了18个问题 |采纳率88.9%(1)分别滴加稀HNO3+AgNO3,生成白色沉淀的为NaCl,淡黄色沉淀的为KBr,黄色沉淀的为KI.
(2)分别滴加稀H2SO4,生成黄色或白色沉淀的为Na2S2O3,生成臭鸡蛋味气体的为Na2S,再往无反应现象的两瓶中分别滴加MnSO4+少量AgNO3,溶液变紫红色的为K2S2O8,无反应的为Na2SO4.
(3)分别滴加稀HCl,生成红棕色气体的为NaNO2,无色气体的为Na2CO3,再往无反应现象的两瓶中分别滴加BaCl2,生成沉淀的为Na3PO4,无反应的为NaNO3.
注:过二硫酸盐K2S2O8在Ag+的催化作用下可将Mn2+氧化成最高价态得锰酸根离子MnO4-紫红色.
且AgNO3必须为少量,否则生成Ag2SO4白色沉淀的量会较大,影响观察.
祝愉快1年前查看全部
- 采用惰性电极电解K2S2O8溶液,在阴阳两极分别得到什么产物,为什么?
采用惰性电极电解K2S2O8溶液,在阴阳两极分别得到什么产物,为什么?
我觉得是阴极生成,K2SO4;阳极生成,O2
解释我觉得应该用电极电势大小的知识来解释,但我自己又说不好. luanyue1年前2
luanyue1年前2 -
 abby307 共回答了19个问题
abby307 共回答了19个问题 |采纳率100%阴极:K₂;阳极:O₂.电解液中还有H+、SO₄﹣.1年前查看全部
- 硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化发生氧化还原反应,生成高锰酸钾,硫酸钾和硫酸
硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化发生氧化还原反应,生成高锰酸钾,硫酸钾和硫酸
1.写出并配平化学方程式
2.反应中的还原剂和氧化还原产物分别是?
3.若该反应所用的硫酸锰改为氯化锰,当她跟过量的过硫酸钾反应时,除有高锰酸钾,硫酸钾,硫酸生成外,其他的生成物还有?(原因)
4.请问过硫酸钾中的硫是几价? 我说你是我的小狗1年前3
我说你是我的小狗1年前3 -
 no1hsy 共回答了14个问题
no1hsy 共回答了14个问题 |采纳率100%2MnSO4+5K2S2O8+8H2O=2KMnO4+4K2SO4+8H2SO4
还原剂是MnSO4,氧化产物是KMnO4,还原产物是硫酸钾和硫酸.
还会产生氯气,因为氯离子可以被高锰酸钾氧化为氯气,而过硫酸钾氧化性比高锰酸钾强,可以将氯离子氧化为氯气.
其中硫为+7价1年前查看全部
- 已知硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾,硫酸钾和硫酸
已知硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾,硫酸钾和硫酸
(1)请写出并配平上述反应的化学方程式.
(2)此反应的还原剂是,氧化产物是.
(3)此反应的离子反应方程式可表示为
(4)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾,硫酸钾,硫酸生成外,其它的生成物有? ppmso1年前2
ppmso1年前2 -
 风-舞 共回答了20个问题
风-舞 共回答了20个问题 |采纳率95%2MnSO4 + 5K2S2O8 + 8H2O 2(MnO4)- + 10(SO4)2-
Ag+
还生成氯气1年前查看全部
大家在问
- 1组词瓣()()钓()()各组2个
- 2我是不重要的人 中译英~谢谢!如题最好口语一点的
- 3算一算,填一填.1949年、1840年、2008年、1900年、2012年、1975年、3000年、1921年平年___
- 4A suitcase with shirt,rousers and shoes was stolen from the
- 5200ml20%的盐酸(密度为1.10g/ ml)和含碳酸钙50g的大理石,最多可制得多少二氧化碳
- 6英语翻译what can we do about this the worst thing is to do nothi
- 72010年上海世博会中国馆--“东方之冠”给人强烈的视觉冲击,它的主体结构是由四根钢筋混凝土制作的核心筒。其中的钢属于
- 8如图,在矩形纸片ABCD中,AD=4cm,AB=10cm,按图中方式折叠,使点B与点D重合,折痕为EF,求DF的长
- 9工业上对海水资源综合开发利用的部分工艺流程如图所示.
- 10写出下面的英语表达法;14号 1号 第29 10号
- 11《归园田居》~陶渊明
- 12请问这段英语表达的是什么意思?Before I purchased the fabrics I wonder if yo
- 13当我到那里时,发现他在等我.When I got there ,I _ him _ _ me .
- 14[af(x)+bf(y)/f(x)+f(y)]的二重积分 积分区域为x^2+y^2
- 15计算:1-3(x-1/2y²)+(-x+1/2y²)过程,算式!(初一试题)
