将Na2CO3•10H2O和 NaHCO3的混合物n g,溶于水制成200mL溶液,测得c(Na+)
 吹吧吹吧2022-10-04 11:39:542条回答
吹吧吹吧2022-10-04 11:39:542条回答A. 3.l g
B. 5.3 g
C. 9.0 g
D. 11.0 g

已提交,审核后显示!提交回复
共2条回复
 bvihlkhklh 共回答了15个问题
bvihlkhklh 共回答了15个问题 |采纳率86.7%- 解题思路:Na2CO3•10H2O和 NaHCO3的混合物加热分解,最终固体物质为Na2CO3,根据钠离子守恒,可知n(Na2CO3)=[1/2]n(Na+),根据n=cV计算混合物中含有的n(Na+),再根据m=nM计算最终得到的固体碳酸钠的质量.
Na2CO3•10H2O和 NaHCO3的混合物加热分解,最终固体物质为Na2CO3,混合物中含有的n(Na+)=0.2L×0.5mol/L=0.1mol,根据钠离子守恒,可知n(Na2CO3)=[1/2]n(Na+)=0.1mol×[1/2]=0.05mol,最终得到的固体碳酸钠的质量为0.05mol×106g/mol=5.3g,
故选:B.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物的有关计算,清楚发生的反应是关键,注意利用钠离子守恒进行的计算,侧重对学生思维能力的考查. - 1年前
 lihuigang 共回答了15个问题
lihuigang 共回答了15个问题 |采纳率- 利用c(Na+)= 0.5 mol/L和200ml
求出n(Na+)=0.1mol
因为加热到质量不变就是:
Na2CO3·10H2O=Na20+CO2↑+10H2O↑
2NaHCO3=Na2O+H2O↑+2CO2↑
所以:固体就是Na2O
利用n(Na+)=0.1mol,得n(Na2O)=0.05mol
m(Na2O)=0.05mol*(2... - 1年前
相关推荐
- 将Na2CO3•10H2O与NaHCO3的混合物m g溶解于水,配制成100mL溶液,测知溶液中Na+的质量m
将Na2CO3•10H2O与NaHCO3的混合物m g溶解于水,配制成100mL溶液,测知溶液中Na+的质量m(Na+)=0.92g,若将溶液蒸干并加热至质量不变,可得固体的质量是( )
A.1.86g
B.2.55g
C.2.12g
D.无法确定 mrchow1年前1
mrchow1年前1 -
 我爱骐骐 共回答了19个问题
我爱骐骐 共回答了19个问题 |采纳率94.7%解题思路:将Na2CO3•10H2O与NaHCO3的混合物mg溶解于水,将溶液蒸干并加热至质量不变,最后得到的固体为Na2CO3,根据Na元素守恒可计算Na2CO3的物质的量,进而计算Na2CO3的质量.将Na2CO3•10H2O与NaHCO3的混合物mg溶解于水,将溶液蒸干并加热至质量不变,
NaHCO3加热分解生成Na2CO3,最后得到的固体为Na2CO3,
配制成100mL溶液,测知溶液中Na+的质量m(Na+)=0.92g,
则n(Na+)=[0.92g/23g/mol]=0.04mol,
n(Na2CO3)=[1/2×n(Na+)=0.04mol×
1
2]=0.02mol,
m(Na2CO3)=0.02mol×106g/mol=2.12g,
故选C.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物的计算,题目难度不大,本题注意加热后固体的成分的判断,根据Na元素守恒计算.1年前查看全部
- 将NaHCO3和Na2CO3•10H2O的混合物45.4g溶于水制成400ml溶液,其中Na+浓度为1mol/L;将相同
将NaHCO3和Na2CO3•10H2O的混合物45.4g溶于水制成400ml溶液,其中Na+浓度为1mol/L;将相同质量的上述混合物加热至质量不再变化,此时残留固体质量为( )
A. 21.2g
B. 24.2g
C. 16.8g
D. 31.8g changecareer1年前1
changecareer1年前1 -
 sanders 共回答了19个问题
sanders 共回答了19个问题 |采纳率89.5%解题思路:固体混合物加热至恒重时,剩余固体为Na2CO3,根据Na元素守恒计算出剩余固体Na2CO3的物质的量,进而计算Na2CO3质量.固体混合物加热至恒重时,剩余固体为Na2CO3,
400mL溶液中c(Na+)═1mol•L-1.
则n(Na+)═0.4L×1mol•L-1=0.4mol,
n(Na2CO3)=0.2mol,
m(Na2CO3)=0.2mol×106g/mol=21.2g,
故选:A.点评:
本题考点: 钠的重要化合物;有关混合物反应的计算.
考点点评: 本题考查混合物的计算,难度不大,注意加热后剩余固体的成分为碳酸钠,根据钠元素质量守恒计算.1年前查看全部
- (2010•宝山区二模)石碱(化学式为(Na2CO3•10H2O)在生活中常被用作去除油腻的洗涤剂.请回答:
(2010•宝山区二模)石碱(化学式为(Na2CO3•10H2O)在生活中常被用作去除油腻的洗涤剂.请回答:
(1)石碱中Na:C:O:H元素的质量比为:______.
(2)石碱中钠元素的质量分数为______(精确到0.1%).
(3)石碱的摩尔质量为______. longzhu371年前1
longzhu371年前1 -
 ncizxw 共回答了17个问题
ncizxw 共回答了17个问题 |采纳率88.2%(1)石碱化学式为Na2CO3•10H2O,则石碱中Na:C:O:H元素的质量比为:(23×2):12:(16×13):(1×20)=23:6:104:10.
(2)石碱化学式为Na2CO3•10H2O,则石碱中钠元素的质量分数为 [23×2/23×2+12+16×13+1×20]×100%=16.1%.
(3)摩尔质量在数值上等于相对分子质量;石碱化学式为Na2CO3•10H2O,
则石碱的相对分子质量为:23×2+12+16×13+1×20=286;
故石碱的摩尔质量为286g/mol.
故答案为:
(1)23:6:104:10;
(2)16.1%;
(3)286g/mol.1年前查看全部
- 配制500ml 0.2mol/L的碳酸钠溶液,称取28.6g na2co310h2o配置,浓度为什么有影响
 CK对你好不好1年前2
CK对你好不好1年前2 -
 kkkkli123 共回答了16个问题
kkkkli123 共回答了16个问题 |采纳率87.5%无影响,只不过配制时水用不着加那么多了.1年前查看全部
- 实验室用Na2CO3•10H2O晶体配制0.02mol/L的Na2CO3溶液480mL.
实验室用Na2CO3•10H2O晶体配制0.02mol/L的Na2CO3溶液480mL.
(1)①实验中用到的玻璃仪器有量筒、玻璃棒、烧杯,还缺少______;
②实验中两次用到玻璃棒,其作用分别是______、______.
(2)应用托盘天平称取Na2CO3•10H2O晶体的质量为:______g.
(3)根据下列操作对所配溶液的浓度各有什么影响,将其序号填在下面空格:
①碳酸钠失去了部分结晶水;②用“左码右物”的称量方法称量晶体;
③碳酸钠晶体不纯,其中混有氯化钠;④容量瓶中原有少量蒸馏水.
⑤定容时俯视液面;⑥摇匀后发现液面低于刻度线再加水.
其中引起所配溶液浓度:a.偏高的有______;b.偏低的有______;c.无影响的有______. 人云亦云1231年前1
人云亦云1231年前1 -
 _淮南栀子 共回答了21个问题
_淮南栀子 共回答了21个问题 |采纳率100%解题思路:(1)①根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器;②实验中溶解和移液两次用到玻璃棒,其作用分别是搅拌,加快固体溶解; 引流(2)根据n=cv计算溶质Na2CO3的物质的量,利用Na2CO3•10H2O的物质的量等于Na2CO3的物质的量,根据m=nM计算Na2CO3•10H2O的质量;
(3)根据c=[n/V]分析操作对溶质的物质的量或对溶液的体积的影响判断;(1)①转移溶液时,通过玻璃棒引流,防止液体漏出;配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到500mL容量瓶中,并用玻璃棒...
点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查一定物质的量浓度溶液的配制,易错点是计算溶质的质量,很多同学将溶液的体积认为是480mL而导致出错.1年前查看全部
- 实验室用Na2CO3•10H2O晶体配制250mL 0.1mol/L Na2CO3溶液,回答下列问题
实验室用Na2CO3•10H2O晶体配制250mL 0.1mol/L Na2CO3溶液,回答下列问题:
(1)用托盘天平称取Na2CO3•10H2O的质量为______g.
(2)操作中所需仪器除托盘天平、烧杯、玻璃棒外,还需要______(填仪器名称);
(3)配制时,正确的操作顺序是(用字母表示,每个字母只能用一次)______;
A.用蒸馏水洗涤烧杯及玻璃棒2-3次,洗涤液均注入容量瓶,振荡
B.用托盘天平称量所需的Na2CO3•10H2O晶体,放入烧杯中,再加入少量水,用玻璃棒慢慢搅动,使其完全溶解
C.将已冷却的Na2CO3溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,摇匀
E.改用胶头滴管加水,使溶液凹液面的最低点恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1-2cm处
(4)若出现如下情况,对所配溶液的浓度将有何影响(填“偏高”、“偏低”或“无影响”):
①没有进行A操作______;
②称量时,Na2CO3•10H2O已失去部分结晶水______;
③若定容时俯视刻度线______;
④定容摇匀时,发现液面下降,又加水至刻度线______;
⑤容量瓶用蒸馏水洗净后没有干燥______. jy28737251年前1
jy28737251年前1 -
 肥仔COCO 共回答了26个问题
肥仔COCO 共回答了26个问题 |采纳率92.3%解题思路:(1)计算出需要Na2CO3•10H2O晶体的物质的量,根据摩尔质量计算出质量,注意托盘天平准确到0.1g;
(2)根据配制一定物质的量浓度的溶液使用的仪器完成,注意容量瓶必须标明容积;
(3)根据配制一定物质的量浓度溶液的操作步骤进行排序;
(4)①没有洗涤,溶质的物质的量减小;
②失去结晶水,称取的溶质质量偏大,物质的量偏大;
③定容时俯视,导致配制的溶液体积减小;
④加入蒸馏水,配制的溶液体积偏大;
⑤容量瓶内的蒸馏水对配制结果没有影响.(1)需要Na2CO3•10H2O的物质的量是:0.250L×0.1mol/L=0.025mol,质量为:0.025×286=7.15g,用托盘天平称取质量是7.2g,
故答案是:7.2;
(2)配制一定浓度的溶液需要的仪器有:托盘天平、烧杯、玻璃棒、胶头滴管、250mL容量瓶等,
故答案是:250mL容量瓶;胶头滴管;
(3)配制步骤是:计算、称量、容积、冷却、转移、洗涤、定容,所以正确的操作顺序是B、C、A、F、E、D,
故答案是:B、C、A、F、E、D;
(4)①配制溶液时必须相同,否则配制的溶液中溶质的物质的量减小,浓度偏低,
故答案是:偏低;
②由于晶体失去结晶水,称取的溶质的质量变大,溶质的物质的量变大,浓度偏高,
故答案是:偏高;
③进行定容时,若是俯视刻度线,导致配制的溶液体积偏小,浓度偏高,
故答案是:偏高;
④定容摇匀时,发现液面下降,又加水至刻度线,导致配制的溶液体积偏大,浓度偏低,
故答案是:偏低;
⑤容量瓶用蒸馏水洗净后没有干燥,不会影响配制结果,
故答案是:无影响.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了配制一定物质的量浓度的溶液的配制方法及误差分析,涉及题量稍大,难度中等,可以根据所学知识完成.1年前查看全部
- 将14.3gNa2CO3•10H2O固体溶于水配成 2.5L溶液,求所得溶液物质的量浓度 是多少.
 朝花夕gg1年前1
朝花夕gg1年前1 -
 鱼凫王 共回答了16个问题
鱼凫王 共回答了16个问题 |采纳率87.5%n=m/M=14.3g/286g/mol=0.05mol C=n/V=0.05mol/2.5L=0.02mol/L1年前查看全部
- 用Na2CO3•10H2O晶体,配制0.2mol/L的Na2CO3溶液480mL.
用Na2CO3•10H2O晶体,配制0.2mol/L的Na2CO3溶液480mL.
(1)实验中用到的玻璃仪器有量筒、玻璃棒、烧杯,还缺少______、______;
(2)应用托盘天平称取Na2CO3•10H2O的晶体的质量为______;
(3)配制溶液时有以下几个操作:
①溶解 ②摇匀 ③洗涤 ④冷却 ⑤称量 ⑥转移溶液⑦定容
正确的操作顺序是______(填序号).
(4)根据下列操作所配溶液的浓度偏高的有______.(填序号)
①碳酸钠失去了部分结晶水 ②用“左码右物”的称量方法称量晶体
③碳酸钠晶体不纯,其中混有氯化钠④称量碳酸钠晶体时所用砝码生锈
⑤容量瓶未经干燥就使用 ⑥定容时俯视刻度线
(5)取所配Na2CO3溶液200mL,向其中滴加足量的稀盐酸,产生的气体在标准状况下的体积为______L,将得到的气体全部通入足量的澄清石灰水,充分反应后,将沉淀过滤、洗涤、干燥,最后可得固体______g. degole1年前1
degole1年前1 -
 1502019 共回答了21个问题
1502019 共回答了21个问题 |采纳率90.5%解题思路:(1)配制480mL溶液,需要选用500mL容量瓶,根据配制500mL 0.2mol/L的Na2CO3溶液步骤选取实验仪器;
(2)根据m=nM=cVM计算需要用托盘天平称取Na2CO3•10H2O的晶体的质量;
(3)根据配制500mL 0.2mol/L的Na2CO3溶液的实验操作的步骤对各操作进行排序;
(4)根据c=[n/V]可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大;
(5)根据n=cV计算出溶液中碳酸钠的物质的量,再根据碳原子守恒计算出二氧化碳的物质的量及标况下二氧化碳的体积;根据碳原子守恒计算出生成碳酸钙沉淀的物质的量及质量.(1)实验室没有480mL的容量瓶,配制时应该选用500mL的容量瓶,配制步骤有:计算、称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,所以还缺少500 mL容量瓶、胶头滴管,
故答案为:500mL容量瓶;胶头滴管;
(2)应用托盘天平称取Na2CO3•10H2O的晶体的质量为:m=nM=cVM=0.2mol/L×0.5L×286g/mol=28.6g,
故答案为:28.6g;
(3)配制步骤为:计算、称量、溶解、移液、洗涤、定容、摇匀等操作,所以正确的操作顺序为:⑤①④⑥③⑦②,
故答案为:⑤①④⑥③⑦②;
(4)①碳酸钠失去了部分结晶水,导致称量溶质的质量增大,所以溶质的物质的量偏大,配制溶液的浓度偏高,故①正确;
②用“左码右物”的称量方法称量晶体导致称量溶质的质量增小,所以溶质的物质的量偏小,配制溶液的浓度偏低,故②错误;
③碳酸钠晶体不纯,其中混有氯化钠,导致碳酸钠的物质的量偏小,配制溶液的浓度偏低,故③错误;
④称量碳酸钠晶体时所用砝码生锈,导致称量溶质的质量增大,所以溶质的物质的量偏大,配制溶液的浓度偏高,故④正确;
⑤容量瓶未经干燥就使用不影响溶质的物质的量,也不影响溶液的体积,所以对配制的溶液浓度无影响,故⑤错误;
⑥定容时俯视刻度线,导致加入的蒸馏水体积偏小,配制的溶液体积偏小,溶液的物质的量难度偏高,故⑥正确;
故答案为:①④⑥;
(5)取所配Na2CO3溶液200mL,浓度为0.2mol/L,则碳酸钠的物质的量为:0.2mol/L×0.2L=0.04mol,向其中滴加足量的稀盐酸,根据碳原子守恒,生成二氧化碳0.04mol,产生的二氧化碳气体在标准状况下的体积为:22.4L/mol×0.04mol=0.896L;二氧化碳与氢氧化钙反应生成碳酸钙,根据碳原子守恒,生成碳酸钙的物质的量为0.04mol,质量为:100g/mol×0.04mol=4.0g,
故答案为:0.896;4.0.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了配制一定物质的量浓度的溶液的方法,注意掌握配制一定物质的量浓度的溶液的方法,该题是中等难度的试题,试题基础性强、难易适中,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,该题的难点在于误差分析,注意明确误差分析的方法.1年前查看全部
- 某温度下,Na2CO3饱和溶液中溶质的质量分数为a%,向其中加入m mol Na2CO3•10H2O
某温度下,Na2CO3饱和溶液中溶质的质量分数为a%,向其中加入m mol Na2CO3•10H2O,或者n mol Na2CO3,可析出相同质量的Na2CO3•10H2O,则( )
A. a%可能是40%,m>n
B. a%可能是40%,m=n
C. a%可能是30%,m>n
D. a%可能是30%,m<n gy02981年前1
gy02981年前1 -
 hxdn33 共回答了18个问题
hxdn33 共回答了18个问题 |采纳率100%解题思路:根据饱和溶液中加入m mol Na2CO3•10H2O,或者n mol Na2CO3,可析出相同质量的Na2CO3•10H2O,可知(m-n)mol的
Na2CO3可与10mmol的水恰好形成饱和溶液来分析解答.因原来的溶液为饱和溶液,有晶体析出后的溶液还是饱和溶液,
则根据题意可知,(m-n)mol的Na2CO3可与10mmol的水恰好形成饱和溶液,
则m-n>0,即m>n,
在饱和溶液中
(m−n)×106
(m−n)×106+10m×18×100%=a%,
则[106
106+180×
1
1−
n/m]×100%<34%,即a%不会大于34%,则可能为30%,
故选C.点评:
本题考点: 有关溶质质量分数的简单计算;溶质的质量分数、溶解性和溶解度的关系.
考点点评: 本题较难,学生应注意饱和溶液这个关键信息,能得到(m-n)mol的Na2CO3可与10mmol的水恰好形成饱和溶液,并能利用不等式来分析问题.1年前查看全部
- 有一含NaCl、Na2CO3•10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化
有一含NaCl、Na2CO3•10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数.
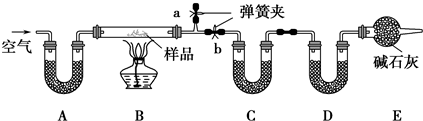
(1)加热前通入空气的目的是______,操作方法为______.
(2)装置A、C、D中盛放的试剂分别为:A______,C______,D______.
(3)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl的含量将______(填“偏高”、“偏低”或“无影响”,下同);若B中反应管右侧有水蒸气冷凝,则测定结果中NaHCO3的含量将______;若撤去E装置,则测得Na2CO3•10H2O的含量将______.
(4)若样品质量为wg,反应后C、D增加的质量分别为m1g、m2g,由此可知混合物中NaHCO3的质量分数为
%4200m2 11w (用含w、m1、m2的代数式表示).
%4200m2 11w  fda11201年前1
fda11201年前1 -
 小虫不哭 共回答了18个问题
小虫不哭 共回答了18个问题 |采纳率88.9%解题思路:将混合物加热会产生H2O(g)、CO2等气体,应在C、D中分别吸收,由干燥剂的性质知应先吸收水,再吸收二氧化碳,即C中的干燥剂吸水后不能吸收CO2;由D的增重(NaHCO3分解产生的CO2的质量)可求出NaHCO3质量.由C的增重(Na2CO3•10H2O分解产生的H2O及已经知道的NaHCO3分解产生的H2O的质量)可求出Na2CO3•10H2O的质量,从而求出NaCl的质量;故应在实验前想法赶出装置中的空气,关键操作应是赶B中的空气,所以关闭b,打开a就成为操作的关键,缓缓通入则是为了赶出效果更好;E中碱石灰可防止外界空气中的H2O(g)、CO2进入装置D影响实验效果,
根据以上分析进行解答(1)(2)(3);
(4)装置D中增加的质量为二氧化碳的质量,根据反应方程式2NaHCO3
Na2CO3+CO2↑+H2O计算出碳酸氢钠的质量,再计算出碳酸氢钠的质量分数.△ .(1)本实验中需要分别测定反应生成的二氧化碳和水的质量,所以实验前必须将装置中的水蒸气和二氧化碳赶走,避免影响测定结果;操作方法为:关闭b,打开a,缓缓通入空气,直至a处出来的空气不再使澄清石灰水变浑浊为止,
故答案为:除去装置中的水蒸气和二氧化碳;关闭b,打开a,缓缓通入空气,直至a处出来的空气不再使澄清石灰水变浑浊为止;
(2)装置A用于吸收空气中的二氧化碳和水,可以使用碱石灰;装置C吸收Na2CO3•10H2O和NaHCO3分解生成的水蒸气,可以使用无水硫酸铜;装置D吸收碳酸氢钠分解生成的二氧化碳,可以用碱石灰,
故答案为:碱石灰;无水硫酸铜(或无水CaCl2、P2O5等);碱石灰;
(3)若将A装置换成盛放NaOH溶液的洗气瓶,则m(H2O)增加,使Na2CO3•10H2O和NaHCO3的含量偏高,NaCl的含量偏低;
若B中反应管右侧有水蒸气冷凝,测定碳酸钠的质量是根据装置D中质量变化计算的,与水蒸气的量无关,则测定结果中NaHCO3的含量不变;
E中碱石灰可防止外界空气中的H2O(g)、CO2进入装置D,若撤去E装置,则测定的碳酸氢钠的质量偏大,碳酸氢钠分解生成水的质量偏高,而Na2CO3•10H2O的测定是根据生成水的总质量计算的,则测得Na2CO3•10H2O的含量将偏低,
故答案为:偏低;无影响;偏低;
(4)若样品质量为wg,反应后C、D增加的质量分别为m1g、m2g,则碳酸氢钠分解生成的二氧化碳的质量为m2g,
2NaHCO3
△
.
Na2CO3+CO2↑+H2O
16844
m(NaHCO3) m2g
m(NaHCO3)=
168×m2g
44=
42m2
11g,
混合物中NaHCO3的质量分数为:
42m2
11g
mg×100%=
4200m2
11w%,
故答案为:
4200m2
11w%.点评:
本题考点: 探究碳酸钠与碳酸氢钠的性质;探究物质的组成或测量物质的含量.
考点点评: 该本题综合考查元素化合物性质、测定混合物中各成分的质量分数,题目难度中等,解题时必须结合实验装置和物质的性质进行综合分析,综合考查学生实验能力和分析能力,注意把握物质的性质以及实验原理.1年前查看全部
- (1)已知:Na2CO3•10H2O(s)=Na2CO3(s)+10H2O(g)△H1=+532.36kJ•mol-1
(1)已知:Na2CO3•10H2O(s)=Na2CO3(s)+10H2O(g)△H1=+532.36kJ•mol-1
Na2CO3•10H2O(s)=Na2CO3•H2O(s)+9H2O(g)△H2=+473.63kJ•mol-1
写出Na2CO3•H2O脱水分解反应的热化学方程式______.
(2)已知16g固体单质S完全燃烧SO2气体时,放出148.4kJ的热量,则该反应的热化学方程式为______. 冰封都市1年前1
冰封都市1年前1 -
 340h4mu 共回答了21个问题
340h4mu 共回答了21个问题 |采纳率90.5%解题思路:(1)依据热化学方程式和盖斯定律计算得到所需要的热化学方程式;
(2)根据热化学方程式的书写方法可知,化学计量数与反应热成正比,并注意标明物质的聚集状态来解答.(1)①Na2CO3•10H2O(s)═Na2CO3(s)+10H2O(g)△H1=+532.36kJ•mol-1
②Na2CO3•10H2O(s)═Na2CO3•H2O(s)+9H2O(g)△H1=+473.63kJ•mol-1
由盖斯定律①-②得到:Na2CO3•H2O(s)═Na2CO3(s)+H2O(g)△H1=+58.73kJ•mol-1,
故答案为:Na2CO3•H2O(s)═Na2CO3(s)+H2O(g)△H1=+58.73kJ•mol-1.
(2)16g固体硫完全燃烧时放出148.4kJ的热量,即1molS完全燃烧时放出放出296.8kj热量,则热化学方程式为:S(s)+O2(g)=SO2(g);△H=-296.8 kJ/mol,
故答案为:S(s)+O2(g)=SO2(g);△H=-296.8 kJ/mol.点评:
本题考点: 热化学方程式.
考点点评: 本题考查化学反应中的能量变化及利用盖斯定律确定反应及其能量的关系,注意键能计算焓变的方法,题目难度中等,注重基础知识的考查.1年前查看全部
- 有一含NaCl、Na2CO3•10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装
有一含NaCl、Na2CO3•10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数.
A是碱石灰
C是无水氯化钙
D是碱石灰
E是碱石灰
1、若B中反应管右侧有水蒸气冷凝,则测定结果中测定结果中NaHCO3的含量将___________;
2、若撤去E装置,则测得Na2CO3•10H2O的含量__________.
3、请问为什么D、E都是碱石灰?分别有什么用?
图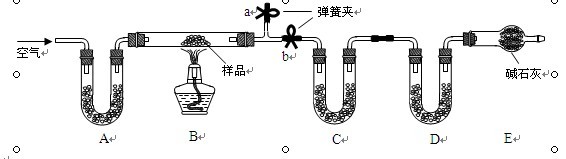
 lier1241年前1
lier1241年前1 -
 流变的风 共回答了17个问题
流变的风 共回答了17个问题 |采纳率100%答:
1.不变.因为D中碱石灰就吸收的CO2不变.
2.偏低.因为D中碱石灰就会吸收空气中的CO2和水蒸气,使计算出的NaHCO3含量偏高,生成的H2O偏多,计算出Na2CO3•10H2O生成的H2O就少了,Na2CO3•10H2O的含量就偏低了.
3.D的作用为NaHCO3分解产生的CO2,从而计算NaHCO3含量;E防止空气中的CO2和水蒸气进入D中造成影响.1年前查看全部
- 在一定温度下,向足量的饱和碳酸钠溶液中加入1.06g无水碳酸钠粉未,搅拌后静置,最终所得的晶体(Na2CO3•10H2O
在一定温度下,向足量的饱和碳酸钠溶液中加入1.06g无水碳酸钠粉未,搅拌后静置,最终所得的晶体(Na2CO3•10H2O)的质量是( )
A. 等于1.06g
B. 大于1.06g,小于2.86g
C. 等于2.86g
D. 大于2.86g lcno021211年前3
lcno021211年前3 -
 yxbo 共回答了17个问题
yxbo 共回答了17个问题 |采纳率88.2%解题思路:向足量的饱和碳酸钠溶液中加入无水碳酸钠粉未,析出晶体Na2CO3•10H2O,原饱和碳酸钠溶液水减少,也有碳酸钠晶体析出.1.06克无水Na2CO3的物质的量为[1.06g/106g/mol]=0.01mol,加入到饱和Na2CO3溶液中生成0.01molNa2CO3•10H2O结晶水合物,其质量为0.01mol×286g/mol=2.86g,
又原饱和溶液由于加入无水Na2CO3与水反应而消耗溶液中的水,会有晶体析出,故析出晶体的质量大于2.86g,
故选D.点评:
本题考点: 化学方程式的有关计算;溶液中溶质的质量分数及相关计算.
考点点评: 本题考查饱和溶液的计算问题,难度不大,注意析出晶体后剩余溶液仍为饱和溶液,析出晶体为结晶水合物.1年前查看全部
- 实验室用碳酸钠晶体(Na2CO3•10H2O)配制1.00mol/L的Na2CO3溶液500mL,回答下列问题.
实验室用碳酸钠晶体(Na2CO3•10H2O)配制1.00mol/L的Na2CO3溶液500mL,回答下列问题.
(1)所需主要仪器为:药匙、托盘天平、烧杯、______、______和胶头滴管.
(2)本实验需称量碳酸钠晶体(Na2CO3•10H2O)______g.
(3)容量瓶上标有刻度线、______、______.
(4)试分析下列操作,对所配溶液的浓度有何影响.
①若定容时俯视读数,会导致所配溶液浓度______.
②若用未经干燥的容量瓶去配制溶液,则所配溶液浓度______.
(5)常温下,某同学从一种强酸性的未知无色溶液中检验出Ag+,他还想通过实验检验溶液中是否含有大量的Cl-、CO32-、Cu2+、Fe3+、K+等.其中______是需要检验的,而______是不需要检验的. ohyear561年前1
ohyear561年前1 -
 闪闪红星123 共回答了11个问题
闪闪红星123 共回答了11个问题 |采纳率100%解题思路:(1)根据实验操作的步骤(计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签)以及每步操作需要仪器确定反应所需仪器分析;
(2)根据n=cv计算溶质Na2CO3的物质的量,利用Na2CO3•10H2O的物质的量等于Na2CO3的物质的量,根据m=nM计算Na2CO3•10H2O的质量;
(3)根据容量瓶的特点回答;
(4)根据c=[n/V]计算不当操作对n或V的影响,如果n偏大或V偏小,则所配制溶液浓度偏高;
(5)依据“强酸性的未知无色溶液中检验出Ag+”判断不能存在的离子.(1)因配制顺序是:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签,一般用天平称量(用到药匙)称量,在烧杯中溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀.所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、100mL容量瓶、胶头滴管,
故答案为:玻璃棒、500mL容量瓶;
(2)因Na2CO3的物质的量n=cV=0.5L×1.0mol•L-1=0.5mol,Na2CO3•10H2O的物质的量等于Na2CO3的物质的量,所以Na2CO3•10H2O的质量0.5mol×286g/mol=143.0g,故答案为:143.0;
(3)容量瓶是精密仪器,上标有:容积、温度、刻度线,故答案为:温度;容积;
(4)①定容时俯视观察液面,溶液的液面低于刻度线,溶液的体积偏小,浓度偏大,故答案为:偏大;
②容量瓶中原有少量蒸馏水,对溶液的体积不变,浓度不变,故答案为:无影响;
(5)强酸性的未知无色溶液中检验出Ag+,故此溶液中含有大量Ag+和H+,其中Cl-、CO32-不能与其共存,溶液无色,故不能含有:Cu2+(蓝色)、Fe3+(棕黄色),不能检验是否含有K+,故答案为:K+;Cl-、CO32-、Cu2+、Fe3+.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了一定物质的量浓度溶液的配制过程、仪器以及误差分析,难度不大,注意实验的基本操作方法和注意事项.1年前查看全部
- 将NaHCO3和Na2CO3•10H2O的混合物45.4g溶于水制成400ml溶液,其中Na+浓度为1mol/L;将相同
将NaHCO3和Na2CO3•10H2O的混合物45.4g溶于水制成400ml溶液,其中Na+浓度为1mol/L;将相同质量的上述混合物加热至质量不再变化,此时残留固体质量为( )
A. 21.2g
B. 24.2g
C. 16.8g
D. 31.8g keshaopeng1年前1
keshaopeng1年前1 -
 雪舞红裙 共回答了17个问题
雪舞红裙 共回答了17个问题 |采纳率88.2%解题思路:固体混合物加热至恒重时,剩余固体为Na2CO3,根据Na元素守恒计算出剩余固体Na2CO3的物质的量,进而计算Na2CO3质量.固体混合物加热至恒重时,剩余固体为Na2CO3,
400mL溶液中c(Na+)═1mol•L-1.
则n(Na+)═0.4L×1mol•L-1=0.4mol,
n(Na2CO3)=0.2mol,
m(Na2CO3)=0.2mol×106g/mol=21.2g,
故选:A.点评:
本题考点: 钠的重要化合物;有关混合物反应的计算.
考点点评: 本题考查混合物的计算,难度不大,注意加热后剩余固体的成分为碳酸钠,根据钠元素质量守恒计算.1年前查看全部
- (2010•宝山区二模)石碱(化学式为(Na2CO3•10H2O)在生活中常被用作去除油腻的洗涤剂.请回答:
(2010•宝山区二模)石碱(化学式为(Na2CO3•10H2O)在生活中常被用作去除油腻的洗涤剂.请回答:
(1)石碱中Na:C:O:H元素的质量比为:23:6:104:1023:6:104:10.
(2)石碱中钠元素的质量分数为16.1%16.1%(精确到0.1%).
(3)石碱的摩尔质量为286g/mol286g/mol. 公孙子鲁1年前1
公孙子鲁1年前1 -
 yyren_ly 共回答了18个问题
yyren_ly 共回答了18个问题 |采纳率83.3%(1)石碱化学式为Na2CO3•10H2O,则石碱中Na:C:O:H元素的质量比为:(23×2):12:(16×13):(1×20)=23:6:104:10.
(2)石碱化学式为Na2CO3•10H2O,则石碱中钠元素的质量分数为
23×2
23×2+12+16×13+1×20×100%=16.1%.
(3)摩尔质量在数值上等于相对分子质量;石碱化学式为Na2CO3•10H2O,
则石碱的相对分子质量为:23×2+12+16×13+1×20=286;
故石碱的摩尔质量为286g/mol.
故答案为:
(1)23:6:104:10;
(2)16.1%;
(3)286g/mol.1年前查看全部
- (2011•信阳一模)把7.4g Na2CO3•10H2O和NaHCO3组成的固体混合物溶于水配成100mL溶
(2011•信阳一模)把7.4g Na2CO3•10H2O和NaHCO3组成的固体混合物溶于水配成100mL溶液,其中c(Na+)═0.6mol•L-1.若把等质量的固体混合物加热至恒重,残留固体的质量是( )
A.3.18g
B.2.12g
C.4.22g
D.5.28g 粮食哭oo1年前1
粮食哭oo1年前1 -
 曜曜吖 共回答了18个问题
曜曜吖 共回答了18个问题 |采纳率83.3%解题思路:固体混合物加热至恒重时,剩余固体为Na2CO3,根据Na元素守恒计算出剩余固体的物质的量,进而计算质量.固体混合物加热至恒重时,剩余固体为Na2CO3,
100mL溶液,其中c(Na+)═0.6mol•L-1.
则n(Na+)═0.1L×0.6mol•L-1=0.06mol,
n(Na2CO3)=0.03mol,
m(Na2CO3)=0.03mol×106g/mol=3.18g,
故选A.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物的计算,题目难度不大,注意加热后剩余固体的成分,根据质量守恒计算.1年前查看全部
- 把2.27gNaHCO3和Na2CO3•10H2O组成的混合物溶于水配成100ml溶液,其中C(Na+)=0.2mol•
把2.27gNaHCO3和Na2CO3•10H2O组成的混合物溶于水配成100ml溶液,其中C(Na+)=0.2mol•L-1,若将等质量的该混合物加热至恒重,所得固体质量为( )
A. 0.84g
B. 1.06g
C. 1.43g
D. 2.27g vivian1027_zc1年前1
vivian1027_zc1年前1 -
 smallcat823 共回答了14个问题
smallcat823 共回答了14个问题 |采纳率92.9%解题思路:固体混合物加热至恒重时,剩余固体为Na2CO3,根据Na元素守恒计算出剩余固体Na2CO3的物质的量,再根据m=nM计算Na2CO3质量.100mL溶液中c(Na+)═0.2mol•L-1,则n(Na+)═0.1L×0.2mol•L-1=0.02mol,
固体混合物加热至恒重时,剩余固体为Na2CO3,由钠元素守恒,则n(Na2CO3)=[0.02mol/2]=0.01mol,m(Na2CO3)=0.01mol×106g/mol=1.06g,
故选:B.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物的计算,难度不大,注意加热后剩余固体的成分为碳酸钠,再根据钠元素质量守恒计算.1年前查看全部
- 把NaHCO3和Na2CO3•10H2O混合物6.56g溶于水制成100mL溶液,测得溶液中钠离子的浓度为0.5mol/
把NaHCO3和Na2CO3•10H2O混合物6.56g溶于水制成100mL溶液,测得溶液中钠离子的浓度为0.5mol/L.向该溶液中加入一定量盐酸恰好完全反应,将溶液蒸干后,所得固体质量为( )
A. 2.93g
B. 5.85g
C. 6.56g
D. 无法确定 r4wx1年前1
r4wx1年前1 -
 shotom 共回答了20个问题
shotom 共回答了20个问题 |采纳率90%解题思路:n(Na+)=0.1L×0.5mol/L=0.05mol,反应后所得固体为NaCl,则n(NaCl)=0.05mol,m(NaCl)=0.05mol×58.5g/mol=2.925g.反应的有关方程式为:NaHCO3+HCl=NaCl+CO2↑+H2O,Na2CO3+2HCl=2NaCl+CO2↑+H2O,反应后所得固体为NaCl,
n(Na+)=0.1L×0.5mol/L=0.05mol,根据Na元素守恒,则
n(NaCl)=0.05mol,m(NaCl)=0.05mol×58.5g/mol=2.925g,近似为2.93g,
故选A.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物的计算,题目难度不大,本题注意根据反应方程式判断最终反应产物,根据质量守恒计算.1年前查看全部
- 用Na2CO3•10H2O晶体,配制0.2mol/L的Na2CO3溶液480mL.
用Na2CO3•10H2O晶体,配制0.2mol/L的Na2CO3溶液480mL.
(1)实验中用到的玻璃仪器有量筒、玻璃棒、烧杯,还缺少______,______;
(2)应用托盘天平称取Na2CO3•10H2O的晶体的质量为______g;
(3)配制溶液时有以下几个操作:
①溶解 ②摇匀 ③洗涤 ④冷却 ⑤称量 ⑥转移溶液⑦定容
正确的操作顺序是______(填序号).
(4)根据下列操作对所配溶液的浓度各有什么影响,完成填空.
①碳酸钠失去了部分结晶水 ②用“左码右物”的称量方法称量晶体③碳酸钠晶体不纯,其中混有氯化钠④称量碳酸钠晶体时所用砝码生锈⑤容量瓶未经干燥就使用
其中引起所配溶液浓度偏高的有______,无影响的有______.(填序号) johnkewell1年前1
johnkewell1年前1 -
 ownsky 共回答了18个问题
ownsky 共回答了18个问题 |采纳率83.3%解题思路:(1)根据操作步骤选取实验仪器.
(2)根据m=nM=CVM计算碳酸钠的质量.
(3)根据实验操作的步骤排序;
(4)根据c=[n/V] 分析操作对溶质的物质的量或对溶液的体积的影响判断.(1)配制步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,所以还缺少500 mL容量瓶、胶头滴管.
故答案为:500 mL容量瓶、胶头滴管.
(2)m=nM=CVM=0.2mol/L×0.5L×286g/mol=28.6g.
故答案为:28.6.
(3)配制步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,故答案为:⑤①④⑥③⑦②.
故答案为:⑤①④⑥③⑦②.
(4)①碳酸钠失去了部分结晶水,导致称量溶质的质量增大,所以溶质的物质的量偏大,配制溶液的浓度偏高.
②用“左码右物”的称量方法称量晶体导致称量溶质的质量增小,所以溶质的物质的量偏小,配制溶液的浓度偏低.
③碳酸钠晶体不纯,其中混有氯化钠,导致碳酸钠的物质的量偏小,配制溶液的浓度偏低.
④称量碳酸钠晶体时所用砝码生锈,导致称量溶质的质量增大,所以溶质的物质的量偏大,配制溶液的浓度偏高.
⑤容量瓶未经干燥就使用不影响溶质的物质的量,也不影响溶液的体积,所以对配制的溶液浓度无影响.
故选:①④; ⑤.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了一定物质的量浓度溶液的配制,难度不大,会根据配制溶液的体积选取容量瓶.1年前查看全部
- 把Na2CO3•10H2O和NaHCO3的混合物13.12g溶于水制成200mL溶液,则得c(Na+)为0.
把Na2CO3•10H2O和NaHCO3的混合物13.12g溶于水制成200mL溶液,则得c(Na+)为0.5mol/L.
若将上述固体混合物用酒精灯加热至恒重,可得固体物质的质量是多少? huangying19791年前1
huangying19791年前1 -
 rlbk 共回答了17个问题
rlbk 共回答了17个问题 |采纳率88.2%溶液中的Na的物质的量:0.5*(200/1000)=0.1 mol
由于Na2CO3•10H2O和NaHCO3加热后最后剩余的估计都是为Na2CO3,因此根据Na元素守恒,可知道最后的Na2CO3为0.1/2=0.05mol
所以最后固体物质的质量是:0.05*106=5.3 g1年前查看全部
- 把2.27gNaHCO3和Na2CO3•10H2O组成的混合物溶于水配成100ml溶液,其中C(Na+)=0.2mol•
把2.27gNaHCO3和Na2CO3•10H2O组成的混合物溶于水配成100ml溶液,其中C(Na+)=0.2mol•L-1,若将等质量的该混合物加热至恒重,所得固体质量为( )
A. 0.84g
B. 1.06g
C. 1.43g
D. 2.27g zysqg1年前2
zysqg1年前2 -
 ubr55 共回答了20个问题
ubr55 共回答了20个问题 |采纳率90%解题思路:固体混合物加热至恒重时,剩余固体为Na2CO3,根据Na元素守恒计算出剩余固体Na2CO3的物质的量,再根据m=nM计算Na2CO3质量.100mL溶液中c(Na+)═0.2mol•L-1,则n(Na+)═0.1L×0.2mol•L-1=0.02mol,
固体混合物加热至恒重时,剩余固体为Na2CO3,由钠元素守恒,则n(Na2CO3)=[0.02mol/2]=0.01mol,m(Na2CO3)=0.01mol×106g/mol=1.06g,
故选:B.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物的计算,难度不大,注意加热后剩余固体的成分为碳酸钠,再根据钠元素质量守恒计算.1年前查看全部
- 在t℃时,100g水加入mg Na2CO3或加入ngNa2CO3•10H2O 均可使溶液达到饱和,则
在t℃时,100g水加入mg Na2CO3或加入ngNa2CO3•10H2O 均可使溶液达到饱和,则m和n的关系式正确的是( )
A.m=[106n/286]
B.m=[1060n/2860+18n]
C.m=[1060n/2860+10.6n]
D.m=[1060n/2860+28.6n] feitian1351年前1
feitian1351年前1 -
 不疼不养 共回答了24个问题
不疼不养 共回答了24个问题 |采纳率95.8%解题思路:根据“在一定温度下,饱和溶液的质量分数保持不变”的规律,列出等式求解.因为温度不变,所以两种情况所得的饱和溶液质量分数相等.
ngNa2CO3•10H2O 中Na2CO3的质量为[106n/106+180]
根据溶液的质量分数相等得等式
[m/100+m=
106n
106+180
100+n]
整理得:m=[1060n/2860+18n]
故选B点评:
本题考点: 固体溶解度的概念.
考点点评: 固体的溶解度只随温度的改变而改变,在一定温度下,某饱和溶液的质量分数不变.1年前查看全部
- 将Na2CO3•10H2O和NaHCO3的混合物11.94g,溶于水配制成200mL溶液,测得Na+浓度c(Na+)=0
将Na2CO3•10H2O和NaHCO3的混合物11.94g,溶于水配制成200mL溶液,测得Na+浓度c(Na+)=0.5mol/L.若将11.94g该混合物加热至质量不再改变时,得到的固体物质的质量为( )
A.3.1g
B.5.3g
C.9.0g
D.11.0g 吉YouRen1年前1
吉YouRen1年前1 -
 看作15风 共回答了16个问题
看作15风 共回答了16个问题 |采纳率87.5%解题思路:Na2CO3•10H2O和 NaHCO3的混合物加热分解,最终固体物质为Na2CO3,根据钠离子守恒,可知n(Na2CO3)=[1/2]n(Na+),根据n=cV计算混合物中含有的n(Na+),再根据m=nM计算最终得到的固体碳酸钠的质量.混合物中含有的n(Na+)=0.2L×0.5mol/L=0.1mol,
Na2CO3•10H2O和 NaHCO3的混合物加热分解,最终固体物质为Na2CO3,根据钠离子守恒,可知n(Na2CO3)=[1/2]n(Na+)=0.1mol×[1/2]=0.05mol,最终得到的固体碳酸钠的质量为0.05mol×106g/mol=5.3g,
故选:B.点评:
本题考点: 化学方程式的有关计算;有关混合物反应的计算.
考点点评: 本题考查混合物的有关计算,难度中等,注意利用钠离子守恒进行的计算,侧重对学生思维能力的考查.1年前查看全部
- 毫升溶液中溶解了14.3克Na2CO3•10H2O,这种溶液的物质的量浓度是多少?
毫升溶液中溶解了14.3克Na2CO3•10H2O,这种溶液的物质的量浓度是多少?
题目是500毫升溶液中溶解了14.3克Na2CO3•10H2O,这种溶液的物质的量浓度是多少? 她让我换个名字1年前1
她让我换个名字1年前1 -
 xzc316 共回答了17个问题
xzc316 共回答了17个问题 |采纳率94.1%n(Na2CO3)=n(Na2CO3•10H2O)=m/M=14.3/286=0.05mol
c(Na2CO3)=n/V=0.05/0.5=0.1mol/L
这种溶液的物质的量浓度是0.1mol/L.1年前查看全部
- 由Na2O、Na2O2、Na2CO3•10H2O组成的混合物0.05mol,溶于水后加入50mL 2mol/L
由Na2O、Na2O2、Na2CO3•10H2O组成的混合物0.05mol,溶于水后加入50mL 2mol/L的盐酸恰好完全反应,则原混合物中各成分的物质的量之比为( )
A. 1:1:1
B. 1:2:3
C. 1:2:1
D. 任意比 xyjzyx1年前3
xyjzyx1年前3 -
 硫化明胶 共回答了22个问题
硫化明胶 共回答了22个问题 |采纳率77.3%解题思路:根据物质的性质,写出对应的化学方程式,设出未知量,找出它们的关系,然后求出未知量.Na2O+H2O=2NaOH 2Na2O2+2H2O=4NaOH+O2
x2x y 2y
NaOH+HCl=NaCl+H 2O Na2CO3 +2HCl=2NaCl+H2O+CO2
2(x+y)2(x+y) 0.05-x-y 2(0.05-x-y)
所以2(x+y)+2(0.05-x-y)=0.05×2解得 0.1=0.1 (说明与物质的量之比无关)
故选:D.点评:
本题考点: 钠的重要化合物;化学方程式的有关计算.
考点点评: 本题主要考查学生根据化学方程式找出已知量和未知量的关系列比例式求解问题的能力.根据化学方程式的计算,就是依据反应物和生成物的质量比进行的;由已知物的质量可以求出生成物的质量,反之,已知生成物的质量也可算出所需反应物的质量.1年前查看全部
- 将NaHCO3和Na2CO3•10H2O的混合物45.4g溶于水制成400ml溶液,其中Na+浓度为1mol/L;将相同
将NaHCO3和Na2CO3•10H2O的混合物45.4g溶于水制成400ml溶液,其中Na+浓度为1mol/L;将相同质量的上述混合物加热至质量不再变化,此时残留固体质量为( )
A. 21.2g
B. 24.2g
C. 16.8g
D. 31.8g shirlyluck3651年前2
shirlyluck3651年前2 -
 zjnn7877037 共回答了14个问题
zjnn7877037 共回答了14个问题 |采纳率71.4%解题思路:固体混合物加热至恒重时,剩余固体为Na2CO3,根据Na元素守恒计算出剩余固体Na2CO3的物质的量,进而计算Na2CO3质量.固体混合物加热至恒重时,剩余固体为Na2CO3,
400mL溶液中c(Na+)═1mol•L-1.
则n(Na+)═0.4L×1mol•L-1=0.4mol,
n(Na2CO3)=0.2mol,
m(Na2CO3)=0.2mol×106g/mol=21.2g,
故选:A.点评:
本题考点: 钠的重要化合物;有关混合物反应的计算.
考点点评: 本题考查混合物的计算,难度不大,注意加热后剩余固体的成分为碳酸钠,根据钠元素质量守恒计算.1年前查看全部
- 把7.4gNaHCO3和Na2CO3•10H2O的混合物溶于水制成100mL溶液,其中Na+浓度为0.6mol•L-1,
把7.4gNaHCO3和Na2CO3•10H2O的混合物溶于水制成100mL溶液,其中Na+浓度为0.6mol•L-1,若把这种混合物加热至恒重时,其质量应减少______.
 绿洲之星1年前1
绿洲之星1年前1 -
 lym_7_124 共回答了17个问题
lym_7_124 共回答了17个问题 |采纳率94.1%解题思路:碳酸氢钠受热分解成碳酸钠、氧气和水,Na2CO3•10H2O加热失去结晶水变成碳酸钠,所以固体混合物加热至恒重时,剩余固体为Na2CO3,根据Na元素守恒计算出剩余固体Na2CO3的物质的量,进而计算Na2CO3质量,总质量减去碳酸钠的质量即为减少的质量.100mL溶液中c(Na+)=0.6mol/L,则n(Na+)=0.1L×0.6mol/L=0.06mol,固体混合物加热至恒重时,剩余固体为Na2CO3,根据Na元素守恒可知n(Na2CO3)=[1/2]n(Na+)=0.03mol,则m(Na2CO3)=0.03mol×106g/mol=3.18g,故固体混合物加热到质量不变为止,减少的质量为7.4g-3.18g=4.22g;
故答案为:4.22g.点评:
本题考点: 钠的重要化合物;化学方程式的有关计算.
考点点评: 本题考查混合物的计算,难度不大,明确碳酸氢钠和十水碳酸钠加热分解得到的产物是解题关键,注意依据钠元素质量守恒进行计算.1年前查看全部
- 使用Na2CO3•10H2O晶体配制0.1mol•L-1的Na2CO3溶液,其正确的方法是( )
使用Na2CO3•10H2O晶体配制0.1mol•L-1的Na2CO3溶液,其正确的方法是( )
A.称取该晶体28.6 g溶于1 L水中
B.称取10.6 g该晶体,溶于水制成1 L溶液
C.将该晶体加热除去结晶水,称取10.6 g溶于水中制成1 L溶液
D.称取该晶体28.6 g溶于水中制成1 L溶液 xiaoyuu1年前1
xiaoyuu1年前1 -
 大度和尚 共回答了21个问题
大度和尚 共回答了21个问题 |采纳率95.2%解题思路:A、根据称取该晶体28.6 g溶于1 L水中得到溶液体积不是1L判断;
B、根据配制1L0.1mol•L-1的Na2CO3溶液需要的碳酸钠晶体的质量分析;
C、根据碳酸钠容易结合结晶水,无法准确称量10.6g碳酸钠判断;
D、根据碳酸钠溶液的浓度计算出需要碳酸钠晶体的质量,再进行分析配制是否正确.A、28.6g晶体的物质的量为0.1mol,将晶体溶于1L水中,所得到的溶液不是1L,故A错误;
B、需要称量碳酸钠晶体28.6g,碳酸钠晶体的质量不足,配制的溶液浓度小于0.1mol/L,故B错误;
C、未冷却到室温时不能进行称量,而冷却到室温又会吸收空气中的水,无法准确称量碳酸钠的质量,故C错误;
D、28.6 g碳酸钠晶体的物质的量为0.1mol,溶于水中制成1 L溶液,溶液的浓度为0.1mol/L,故D正确;
故选D.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查了配制一定物质的量浓度的溶液的方法及简单计算,题目难度不大,注意配制溶液时,必须保证最后配制的溶液体积.1年前查看全部
- 将碳酸钠晶体(Na2CO3•10H2O)和氯化钠的固体混合物30g,放入一定量的质量分数为10%的盐酸中,恰好完全反应,
将碳酸钠晶体(Na2CO3•10H2O)和氯化钠的固体混合物30g,放入一定量的质量分数为10%的盐酸中,恰好完全反应,生成4.4g气体.求:
(1)原混合物中碳酸钠晶体的质量;
(2)反应后溶液中溶质的质量分数;
(3)原混合物中钠元素的质量分数. zx120811年前1
zx120811年前1 -
 风雨逐缘 共回答了18个问题
风雨逐缘 共回答了18个问题 |采纳率94.4%解题思路:(1)碳酸钠与盐酸反应可放出气体二氧化碳,根据反应的化学方程式,由生成二氧化碳的质量计算参加反应的HCl质量、碳酸钠的质量及生成氯化钠的质量;利用碳酸钠晶体中碳酸钠的质量分数与碳酸钠的质量计算出混合物中碳酸钠晶体的质量;
(2)反应后溶液为氯化钠溶液,其中溶质氯化钠质量为混合物中氯化钠与反应生成氯化钠质量和,反应后溶液的质量=混合物的质量+稀盐酸的质量-放出气体二氧化碳的质量,其中稀盐酸的质量可由HCl质量与溶液的质量分数计算;
(3)依据反应前后元素的质量守恒,混合物中钠元素的质量=生成的氯化钠中钠元素的质量+原混合物中钠元素的质量,再据质量分数计算.设原混合物中Na2CO3的质量为X,参加反应的盐酸中氯化氢的质量为Y,生成氯化钠的质量为Z.
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 117 44
X Y Z 4.4g
[106/X]=[44/4.4g] X=10.6g
[73/Y]=[44/4.4g]Y=7.3g
[117/Z]=[44/4.4g] Z=11.7g
(1)碳酸钠晶体的质量为:10.6g÷[106/286]=28.6g
(2)加入盐酸的质量为:7.3g÷10%=73g
反应后溶液中溶质的质量分数为:
11.7g+(30g−28.6g)
30g+73g−4.4g×100%=[13.1g/98.6g]×100%≈13.3%
(3)原混合物中氯化钠的质量是30g-28.6g=1.4g,生成的氯化钠为11.7g,所以原混合物中钠元素的质量是(1.4g+11.7g)×[23/58.5]×100%≈5.15g
则原混合物中钠元素的质量分数是[5.15g/30g]×100%=17.2%
答:(1)原混合物中碳酸钠晶体的质量为28.6g;(2)反应后溶液中溶质的质量分数为13.3%;(3)原混合物中钠元素的质量分数为17.2%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 根据方程式中物质的质量比,有一种物质的质量可以计算另一种物质的质量,要根据题意细心分析解答.1年前查看全部
- .把NaHCO3与Na2CO3•10H2O的混合物6.56克溶于水配制成100mL溶液,已知此溶液中Na+的
.把NaHCO3与Na2CO3•10H2O的混合物6.56克溶于水配制成100mL溶液,已知此溶液中Na+的物质浓度为0.5mol/L;如果将6.56g这种混合物加热到恒重,求此时所得固体的质量
 王大栋1年前2
王大栋1年前2 -
 dtdrde 共回答了14个问题
dtdrde 共回答了14个问题 |采纳率92.9%加热到恒重的话,所得固体只有Na2CO3了,由Na+浓度为0.5mol/L,可得Na的物质贩量为0.5mol/L*0.1L=0.05mol,由钠的物质的量守恒得,所得固体的质量为0.05/2*106=2.65克1年前查看全部
- 实验室用Na2CO3•10H2O晶体配制240mL 0.1mol/L Na2CO3溶液,回答下列问题
实验室用Na2CO3•10H2O晶体配制240mL 0.1mol/L Na2CO3溶液,回答下列问题:
(1)用托盘天平称取Na2CO3•10H2O的质量为______g.
(2)操作中所需仪器除托盘天平、烧杯、玻璃棒外,还需要______(填仪器名称).
(3)配制时,正确的操作顺序是(用字母表示,每个字母只能用一次)______;
A.用蒸馏水洗涤烧杯及玻璃棒2-3次,洗涤液均注入容量瓶,振荡
B.用托盘天平称量所需的Na2CO3•10H2O晶体,放入烧杯中,再加入少量水,用玻璃棒慢慢搅动,使其完全溶解
C.将已冷却的Na2CO3溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡摇匀
E.改用胶头滴管加水,使溶液凹液面的最低点恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1-2cm处
(4)溶液注入容量瓶前需恢复到室温,这是因为______;
(5)若出现如下情况,对所配溶液的浓度将有何影响(填“偏高”、“偏低”或“无影响”):
①没有进行A操作______;
②称量时,Na2CO3•10H2O已失去部分结晶水______;
③若定容时俯视刻度线______;
④定容摇匀时,发现液面下降,又加水至刻度线______;
⑤容量瓶用蒸馏水洗净后没有干燥______. hjy12051年前1
hjy12051年前1 -
 angel_wangm 共回答了18个问题
angel_wangm 共回答了18个问题 |采纳率72.2%解题思路:(1)根据n=cv计算溶质Na2CO3的物质的量,利用Na2CO3•10H2O的物质的量等于Na2CO3的物质的量,根据m=nM计算Na2CO3•10H2O的质量;
(2)根据配制步骤是计算、称量、溶解、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(3)根据配制步骤是计算、称量、溶解、洗涤、定容、摇匀、装瓶来对操作顺序进行排序;
(4)根据必须在一定温度下使用来分析;
(5)根据c=[n/V]并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析.(1)由于无240ml的容量瓶,故选用250ml的容量瓶,所配溶液额体积为250ml,所需的Na2CO3的物质的量n=cV=0.25L×0.1mol•L-1=0.025mol,Na2CO3•10H2O的物质的量等于Na2CO3的物质的量,所以Na2CO3•10H2O的质量0.025mol×286g/mol=7.2g,故答案为:7.2;
(2)操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器有托盘天平、烧杯、玻璃棒、250mL容量瓶、胶头滴管,故所需的仪器还有250ml容量瓶,胶头滴管,故答案为:250ml容量瓶,胶头滴管;
(3)操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀可知正确的操作顺序为:BCAFED,故答案为:BCAFED;
(4)容量瓶只能在一定温度下使用,物质溶解或稀释时会伴随有热效应,温度改变可使溶液体积和容量瓶容积发生变化,至所配溶液浓度不准,故答案为:容量瓶只能在一定温度下使用,物质溶解或稀释时会伴随有热效应,温度改变可使溶液体积和容量瓶容积发生变化,至所配溶液浓度不准;
(5)①没有进行A操作,会导致溶质的损失,故所配溶液的浓度偏低,故答案为:偏低;
②称量时,Na2CO3•10H2O已失去部分结晶水,则固体中Na2CO3的质量分数偏高,所配制出的溶液的浓度偏高;
③若定容时俯视刻度线,会导致溶液体积偏小,浓度偏大,故答案为:偏高;
④定容摇匀时,发现液面下降是正常的,若又加水至刻度线则导致浓度偏低,故答案为:偏低;
⑤容量瓶用蒸馏水洗净后没有干,只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故答案为:无影响;点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.1年前查看全部
- 关于纳的化学题钠长期暴露在空气中最终会变成什么?是NaCO3还是NaCO3•10H2O或是别的.提示:在空气
关于纳的化学题
钠长期暴露在空气中最终会变成什么?
是NaCO3还是NaCO3•10H2O或是别的.
提示:在空气中会遇水,但又会风化.
也正是这里把握搞糊涂了,到底最后变成什么? 懒人小心1年前4
懒人小心1年前4 -
 心情一般般123 共回答了16个问题
心情一般般123 共回答了16个问题 |采纳率93.8%这道题是反映钠化学性质的经典题,也是经常碰到的题.在此过程中钠有几个变化过程(反应的先后顺序一般是固定的,除非是特别潮湿的空气中):1.钠先与空气中的氧气反应:4Na+O2=2Na2O ,2.再与空气中的水蒸气反应:Na2O+H2O=2NaOH ,3.2NaOH+CO2=Na2CO3+H2O ,4.Na2CO3+10H2O=Na2CO3*10H2O ,5.Na2CO3*10H2O=Na2CO3+10H2O .所以最后留下的是Na2CO3. 即使是在潮湿空气中最后还是只剩下Na2CO3(即先与水反应,只是1,2步反应不一样,最后都是只剩下了Na2CO3.1年前查看全部
- 把7.4g Na2CO3•10H2O和NaHCO3组成的固体混合物溶于水配成100mL溶液,其中c(Na+)═
把7.4g Na2CO3•10H2O和NaHCO3组成的固体混合物溶于水配成100mL溶液,其中c(Na+)═0.6mol•L-1.若把等质量的固体混合物加热至恒重,残留固体的质量是( )
A. 3.18g
B. 2.12g
C. 4.22g
D. 5.28g 最斤分1年前1
最斤分1年前1 -
 jun266 共回答了19个问题
jun266 共回答了19个问题 |采纳率94.7%解题思路:固体混合物加热至恒重时,剩余固体为Na2CO3,根据Na元素守恒计算出剩余固体的物质的量,进而计算质量.固体混合物加热至恒重时,剩余固体为Na2CO3,
100mL溶液,其中c(Na+)═0.6mol•L-1.
则n(Na+)═0.1L×0.6mol•L-1=0.06mol,
n(Na2CO3)=0.03mol,
m(Na2CO3)=0.03mol×106g/mol=3.18g,
故选A.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物的计算,题目难度不大,注意加热后剩余固体的成分,根据质量守恒计算.1年前查看全部
- 现有下列物质:①Na2CO3•10H2O晶体 ②锌
现有下列物质:①Na2CO3•10H2O晶体②锌③氯化氢④CO2⑤NaHSO4固体⑥Ba(OH)2固体 ⑦红褐色的氢氧化铁液体⑧氨水⑨稀硝酸⑩熔融NaCl
(1)按物质的分类方法填写表格的空白处 (填编号):
(2)上述物质中有物质之间在溶液中可发生离子反应:H++OH-══H2O,写出一个该离子反应对应的化学方程式______分类标准 能导电的物质 电解质 非电解质 属于该类的物质
(3)将⑨滴加到⑦中至过量的实验现象是______
(4)将③通入⑧中至恰好完全反应,则溶液导电能力的变化为______
(5)⑤的溶液中加入②反应的离子方程式为______. bluecap1年前1
bluecap1年前1 -
 warmpool 共回答了22个问题
warmpool 共回答了22个问题 |采纳率90.9%解题思路:(1)能导电的物质必须含有自由电子或自由离子;
电解质是指:在水溶液里或熔融状态下能导电的化合物.该定义的前提必须是化合物;
非电解质是指:在水溶液里或熔融状态下都不能导电的化合物.该定义的前提必须是化合物;
(2)H++OH-=H2O表示强酸与强碱反应生成可溶性盐和水的离子反应;
(3)胶体加入电解质会发生聚沉,氢氧化铁胶体逐滴加入硝酸溶液,先发生聚沉产生氢氧化铁沉淀,然后氢氧化铁与硝酸发生酸碱中和反应生成可溶性硝酸铁和水;
(4)电解质溶液导电能力强弱取决于离子浓度的大小,氨水中加入盐酸依据反应物和生成物的性质判断离子浓度的变化进而判断导电能力变化;
(5)硫酸氢钠电离产生的氢离子与锌反应生成氢气.(1)①Na2CO3•10H2O晶体中不含自由移动的电子或离子,不导电; Na2CO3•10H2O晶体是化合物,在水溶液或者熔融状态下都能导电,属于电解质;②锌是金属含有自由电子,能导电;锌是单质,既不是电解质也不是非电解质...
点评:
本题考点: 电解质与非电解质;电解质溶液的导电性.
考点点评: 本题考查了物质导电的条件,电解质和非电解质的概念,胶体的性质,离子方程式书写,题目综合性强,难度中等,(3)题有关氢氧化铁胶体性质的考查是本题的难点,学生容易顾此失彼,考虑不全面,解题关键是牢固掌握氢氧化铁胶体性质.1年前查看全部
- I.实验室用Na2CO3•10H2O晶体配制50g 质量分数为21.2%的Na2CO3溶液.回答下列问题:
I.实验室用Na2CO3•10H2O晶体配制50g 质量分数为21.2%的Na2CO3溶液.回答下列问题:
(1)应用托盘天平称取Na2CO3•10H2O晶体______ g.
(2)用托盘天平和小烧杯称出碳酸钠晶体的质量,天平平衡后的状态如图.由图中可以看出,该同学在操作时犯了一个错误是______.实际称量的碳酸钠晶体质量为______g.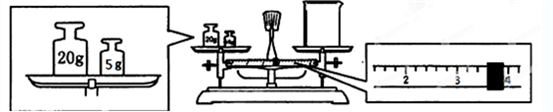
II.实验室要配制2.5mol/L 的稀硫酸溶液90mL,回答下列问题:
(1)用量筒量取质量分数为98%,密度为1.84g/cm3的浓硫酸______mL.
(2)配制时,必须使用的仪器除量筒、烧杯外,还缺少的仪器是______.
(3)配制溶液的过程中,其他操作都正确,下列操作会使所配溶液浓度偏高的是______.
A.用量筒量取浓硫酸时俯视
B.稀释硫酸时,未冷却到室温即转移到容量瓶中
C.量取浓H2SO4后的量筒进行洗涤,并将洗涤液转移到容量瓶中.
D.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至凹液面最低处与刻度线相切
E.容量瓶不干燥. GZLINNAN1年前1
GZLINNAN1年前1 -
 晕458 共回答了15个问题
晕458 共回答了15个问题 |采纳率93.3%解题思路:I.(1)利用Na2CO3的物质的量和Na2CO3•10H2O的物质的量相等计算;
(2)天平平衡原理为左盘内质量=右盘内质量+游码数值,据此计算.
II.(1)实验室无90ml容量瓶,须按100ml容量瓶计算;
(2)根据配制溶液的实验操作过程选择所用仪器;
(3)A.俯视读数体积偏小;
B.液体有热胀冷缩;
C.量筒无须洗涤;
D.定容摇匀后,无须再加蒸馏水;
E.容量瓶不干燥,无影响;I.(1)实验室配制50g 质量分数为21.2%的Na2CO3溶液,需要Na2CO3的质量为:50×21.2%=10.6克,Na2CO3的物质的量为0.1mol,Na2CO3的物质的量和Na2CO3•10H2O的物质的量相等,Na2CO3•10H2O的物质的量为0.1mol,Na2CO3•10H2O的质量为:0.1mol×286g/mol=28.6g,故答案为:28.6g;
(2)天平平衡原理为左盘内质量=右盘内质量+游码数值,所以实际称得碳酸钠晶体的质量为25g-3.6g=21.4g.
故答案为:砝码和物品位置颠倒;21.4g;
II.(1)实验室无90ml容量瓶,须按100ml容量瓶计算,根据C浓×V浓=C稀×V稀,2.5mol/L×0.1L=
VmL×1.84g/cm3×98%
98g/mol,V=13.6mL,故答案为:13.6;
(2)配制步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,一般量筒量取浓硫酸,把浓硫酸倒入烧杯进行溶解,冷却后转移到100mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,配成100mL溶液,所以需要的仪器有玻璃棒、天平、药匙、烧杯、胶头滴管、100mL容量瓶,所以还需要玻璃棒、胶头滴管、100mL容量瓶,故答案为:玻璃棒、胶头滴管、100mL容量瓶;
(3)A.用量筒量取浓硫酸时俯视.用量筒量取液体时,俯视读数,使所读液体的体积偏小,使配制的溶液浓度偏小,故A错误;
B.稀释硫酸时,未冷却到室温即转移到容量瓶中.液体具有热胀冷缩的性质,溶解后没有冷却到室温直接转移到容量瓶,冷却后会导致所配溶液的体积偏小,所配溶液浓度偏高,故B正确;
C.量取浓H2SO4后的量筒进行洗涤,并将洗涤液转移到容量瓶中.量筒在设计时就考虑了不洗涤带来的误差,所以,洗涤量筒只能使配制的浓度偏大,故C正确;
D.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至凹液面最低处与刻度线相切,定容、摇匀、静置后发现凹面低于刻度线又加水至刻度线,溶液的体积偏大,浓度偏小,故D错误;
E.容量瓶不干燥.容量瓶洗涤后内壁有水珠而未作干燥处理,溶液的体积不变,浓度不变,故E错误;
故选BC.点评:
本题考点: 配制一定物质的量浓度的溶液;溶液中溶质的质量分数及相关计算.
考点点评: 本题考查了一定物质的量浓度溶液的配制,根据实验步骤分析是解答的关键,难度中等.1年前查看全部
- 将9.58g Na2CO3•10H2O与NaHCO3的混合物溶于水配成100mL溶液,测得c(Na+)=1mo
将9.58g Na2CO3•10H2O与NaHCO3的混合物溶于水配成100mL溶液,测得c(Na+)=1mol/L.再取同质量的混合物,充分加热至质量不变时,所得固体的质量为( )
A.5.30g
B.7.78g
C.6.72g
D.6g muzhongwuren661年前1
muzhongwuren661年前1 -
 memory2001 共回答了21个问题
memory2001 共回答了21个问题 |采纳率85.7%解题思路:将Na2CO3•10H2O与NaHCO3的混合物9.58g溶解于水,可计算钠离子的物质的量,同质量的混合物,充分加热至质量不变时,最后得到的固体为Na2CO3,根据Na元素守恒可计算Na2CO3的物质的量,进而计算Na2CO3的质量.同质量的混合物,充分加热至质量不变时,最后得到的固体为Na2CO3,
9.58g Na2CO3•10H2O与NaHCO3的混合物溶于水配成100mL溶液,测得c(Na+)=1mol/L,
则n(Na+)=1mol/L×0.1L=0.1mol,
n(Na2CO3)=[1/2]n(Na+)=0.1mol×[1/2]=0.05mol,
m(Na2CO3)=0.05mol×106g/mol=5.30g,
故选A.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查混合物的计算,题目难度不大,本题注意加热后固体的成分的判断,根据Na元素守恒计算.1年前查看全部
- 把NaHCO3和Na2CO3•10H2O混合物6.56g溶于水制成100mL溶液,测得溶液中钠离子的浓度为0.5mol/
把NaHCO3和Na2CO3•10H2O混合物6.56g溶于水制成100mL溶液,测得溶液中钠离子的浓度为0.5mol/L.向该溶液中加入一定量盐酸恰好完全反应,将溶液蒸干后,所得固体质量为( )
A. 2.93g
B. 5.85g
C. 6.56g
D. 无法确定 冷血小枪1年前2
冷血小枪1年前2 -
 1半斤八两 共回答了29个问题
1半斤八两 共回答了29个问题 |采纳率93.1%解题思路:n(Na+)=0.1L×0.5mol/L=0.05mol,反应后所得固体为NaCl,则n(NaCl)=0.05mol,m(NaCl)=0.05mol×58.5g/mol=2.925g.反应的有关方程式为:NaHCO3+HCl=NaCl+CO2↑+H2O,Na2CO3+2HCl=2NaCl+CO2↑+H2O,反应后所得固体为NaCl,
n(Na+)=0.1L×0.5mol/L=0.05mol,根据Na元素守恒,则
n(NaCl)=0.05mol,m(NaCl)=0.05mol×58.5g/mol=2.925g,近似为2.93g,
故选A.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物的计算,题目难度不大,本题注意根据反应方程式判断最终反应产物,根据质量守恒计算.1年前查看全部
- 把4.54克Na2CO310H2O和NaHCO3组成的混合物溶于水,配成100ml溶液,其 【Na+】=0.4mol/L
把4.54克Na2CO310H2O和NaHCO3组成的混合物溶于水,配成100ml溶液,其 【Na+】=0.4mol/L;若把等质量的混合物加热到恒重时,残留物的质量为 问“若把等质量的混合物加热到恒重时”代表什么意思啊
 野蛮小狐狸1年前1
野蛮小狐狸1年前1 -
 chz2004ily 共回答了22个问题
chz2004ily 共回答了22个问题 |采纳率100%你根据Na离子浓度,可以分别计算出碳酸钠和碳酸氢钠的质量,“等质量的混合物”就是说得这两种物质的混合物.PS:建议你多看看教辅读物的例题,其实化学就是熟能生巧.做题时,化学和物理要特别注意琢磨字眼.好好学习.1年前查看全部
- 将Na2CO3•10H2O和NaHCO3的混合物11.94g,溶于水配制成200mL溶液,测得Na+浓度c(Na+)=0
将Na2CO3•10H2O和NaHCO3的混合物11.94g,溶于水配制成200mL溶液,测得Na+浓度c(Na+)=0.5mol/L.若将11.94g该混合物加热至质量不再改变时,得到的固体物质的质量为( )
A. 3.1g
B. 5.3g
C. 9.0g
D. 11.0g 齐东闲散人1年前2
齐东闲散人1年前2 -
 zytiii 共回答了20个问题
zytiii 共回答了20个问题 |采纳率100%解题思路:Na2CO3•10H2O和 NaHCO3的混合物加热分解,最终固体物质为Na2CO3,根据钠离子守恒,可知n(Na2CO3)=[1/2]n(Na+),根据n=cV计算混合物中含有的n(Na+),再根据m=nM计算最终得到的固体碳酸钠的质量.混合物中含有的n(Na+)=0.2L×0.5mol/L=0.1mol,
Na2CO3•10H2O和 NaHCO3的混合物加热分解,最终固体物质为Na2CO3,根据钠离子守恒,可知n(Na2CO3)=[1/2]n(Na+)=0.1mol×[1/2]=0.05mol,最终得到的固体碳酸钠的质量为0.05mol×106g/mol=5.3g,
故选:B.点评:
本题考点: 化学方程式的有关计算;有关混合物反应的计算.
考点点评: 本题考查混合物的有关计算,难度中等,注意利用钠离子守恒进行的计算,侧重对学生思维能力的考查.1年前查看全部
- 把7.4g Na2CO3•10H2O和NaHCO3组成的固体混合物溶于水配成100mL溶液,其中c(Na+)═
把7.4g Na2CO3•10H2O和NaHCO3组成的固体混合物溶于水配成100mL溶液,其中c(Na+)═0.6mol•L-1.若把等质量的固体混合物加热至恒重,残留固体的质量是( )
A. 3.18g
B. 2.12g
C. 4.22g
D. 5.28g 小冰雹1年前1
小冰雹1年前1 -
 喃芩子子 共回答了14个问题
喃芩子子 共回答了14个问题 |采纳率100%解题思路:固体混合物加热至恒重时,剩余固体为Na2CO3,根据Na元素守恒计算出剩余固体的物质的量,进而计算质量.固体混合物加热至恒重时,剩余固体为Na2CO3,
100mL溶液,其中c(Na+)═0.6mol•L-1.
则n(Na+)═0.1L×0.6mol•L-1=0.06mol,
n(Na2CO3)=0.03mol,
m(Na2CO3)=0.03mol×106g/mol=3.18g,
故选A.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物的计算,题目难度不大,注意加热后剩余固体的成分,根据质量守恒计算.1年前查看全部
- 实验室要用Na2CO3•10H2O晶体配制500mL 0.1mol•L-1 Na2CO3溶液,回答下
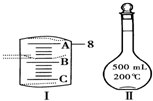 实验室要用Na2CO3•10H2O晶体配制500mL 0.1mol•L-1 Na2CO3溶液,回答下列问题:
实验室要用Na2CO3•10H2O晶体配制500mL 0.1mol•L-1 Na2CO3溶液,回答下列问题:
(1)应该用托盘天平称取Na2CO3•10H2O______g.
(2)如图Ⅰ表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为8,量筒中液体的体积是______mL.
(3)若实验中如图Ⅱ所示的仪器有下列情况,对配制溶液的浓度有何影响?(填“偏高”、“偏低”或“无影响”)
A.定容前容量瓶底部有水珠______;
B.定容时加水超过刻度线______;
C.最终定容时俯视观察液面______. 情飞51年前1
情飞51年前1 -
 寻寻912 共回答了27个问题
寻寻912 共回答了27个问题 |采纳率96.3%解题思路:(1)根据500mL 0.1mol•L-1 Na2CO3溶液中含有的碳酸钠的物质的量计算出需要Na2CO3•10H2O晶体的质量;
(2)根据量筒的构造及图示凹液面所在的刻度线读出量筒中液体的体积;
(3)根据cB=
可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量nB和溶液的体积V引起的,若nB比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若nB比理论值大,或V比理论值小时,都会使所配溶液浓度偏大.nB V (1)配制500mL 0.1mol•L-1 Na2CO3溶液,溶液中含有碳酸钠的物质的量为:0.1mol•L-1×0.5L=0.05mol,需要Na2CO3•10H2O晶体的质量为286g/mol×0.05mol=14.3g,
故答案为:14.3;
(2)量筒刻度线从下向上逐渐增大,根据图示,A为8,则B刻度为7;A与B、B与C刻度间相差1mL,则每个小刻度为0.2mL,液面位于B刻度之上一个小刻度,所以溶液的体积为7.2mL,
故答案为:7.2;
(3)A、定容前容量瓶底部有水珠,对溶质的物质的量没有影响,所以不影响配制结果,故答案为:无影响;
B、定容时加水超过刻度线,导致配制的溶液体积偏大,根据cB=
nB
V可得,配制的溶液浓度偏低,
故答案为:偏低;
C、最终定容时俯视观察液面,导致加入的蒸馏水体积偏小,根据cB=
nB
V可得,配制的溶液浓度偏高,
故答案为:偏高.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了配制一定物质的量浓度的溶液的方法及误差分析,题目难度中等,误差分析是难点,可以根据操作对cB=nBV产生的影响进行分析,试题基础性强,贴近高考,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力.1年前查看全部
- NaHCo3和Na2co310H2O的混合物45.4克溶于水制成400ml溶液,NA+浓度为1mol.L-1;
NaHCo3和Na2co310H2O的混合物45.4克溶于水制成400ml溶液,NA+浓度为1mol.L-1;
将相同质量的上述混合加热至质量不再变化,此时固体质量 hxc78451年前2
hxc78451年前2 -
 轻舞的大象 共回答了16个问题
轻舞的大象 共回答了16个问题 |采纳率87.5%21.2g
n(Na+)=0.4*1=0.4mol
由Na+守恒,加热后得0.2molNa2CO3
质量是106*0.2=21.2g1年前查看全部
- 实验室用碳酸钠晶体(Na2CO3•10H2O)配制1.00mol/L的Na2CO3溶液240mL,回答下列问题:
实验室用碳酸钠晶体(Na2CO3•10H2O)配制1.00mol/L的Na2CO3溶液240mL,回答下列问题:
(1)所需主要仪器为:药匙、托盘天平、烧杯、量筒、______、______和胶头滴管;
(2)本实验须称量碳酸钠晶体(Na2CO3•10H2O)______g.
(3)容量瓶上标有刻度线、______、______.
(4)试分析下列操作,对所配溶液的浓度有何影响.
①若定容时俯视读数,会导致所配溶液浓度______.②若用未经干燥的容量瓶去配制溶液,会导致所配溶液浓度______. oo之恋1年前1
oo之恋1年前1 -
 井小MAN和LOLI包 共回答了14个问题
井小MAN和LOLI包 共回答了14个问题 |采纳率92.9%解题思路:(1)根据实验操作步骤以及每步操作所用仪器判断所需主要仪器;
(2)根据溶液的体积、浓度计算溶质的物质的量,进而计算质量;
(3)根据容量瓶的使用特点判断;
(4)根据c=[n/V],判断实验操作对n或V的影响,以此判断实验误差.(1)配制实验所需实验步骤有称量、溶解、移液、洗涤、定容以及摇匀等操作,称量药品用托盘天平,加入到烧杯中溶解并用玻璃棒搅拌,冷却后用玻璃棒引流将液体转移到250ml容量瓶中,当溶液体积距离刻度线1~2cm时改用胶头滴管定容,故答案为:玻璃棒;250ml的容量瓶;
(2)实验室无240ml容量瓶,只能配制250ml溶液,配制1.00mol/L的Na2CO3溶液250mL,溶质的物质的量为1.00mol/L×0.25L=0.25mol,
质量为:0.25mol×286g/mol=71.5g,故答案为:71.5;
(3)容量瓶只能在常温下使用,不能用来盛装过冷或过热的液体,容量瓶上标有使用温度,容量瓶用来配制一定体积的溶液,不同的容量瓶有不同的使用规格,标有容积,
故答案为:温度;容积;
(4)①若定容时俯视读数,会导致所配溶液体积偏小,溶液浓度偏高;
②若用未经干燥的容量瓶去配制溶液,对实验结果无影响,
故答案为:偏高;无影响.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查溶液的配制实验,题目难度不大,注意实验的基本操作方法和注意事项.1年前查看全部
- 10℃时,Na2CO310H2O溶解度为a,在同样的温度下,碳酸钠的溶解度是多少?
10℃时,Na2CO310H2O溶解度为a,在同样的温度下,碳酸钠的溶解度是多少?
令人抓狂的化学>_ flyprexy1年前2
flyprexy1年前2 -
 雨蕉居士 共回答了13个问题
雨蕉居士 共回答了13个问题 |采纳率84.6%Na2CO310H2O的摩尔质量为286g/mol.因为Na2CO310H2O溶解度为a,所以此时有(100+180a/286)g的水,而溶质为有106a/286g的Na2CO3,所以在同样的温度下,碳酸钠的溶解度是100*(106a/286)/(100+180a/286)=106a/(286+1.8a)g1年前查看全部
- (2010•宝山区二模)石碱(化学式为(Na2CO3•10H2O)在生活中常被用作去除油腻的洗涤剂.请回答:
(2010•宝山区二模)石碱(化学式为(Na2CO3•10H2O)在生活中常被用作去除油腻的洗涤剂.请回答:
(1)石碱中Na:C:O:H元素的质量比为:23:6:104:1023:6:104:10.
(2)石碱中钠元素的质量分数为16.1%16.1%(精确到0.1%).
(3)石碱的摩尔质量为286g/mol286g/mol. markchean1年前1
markchean1年前1 -
 先鸣 共回答了29个问题
先鸣 共回答了29个问题 |采纳率93.1%(1)石碱化学式为Na2CO3•10H2O,则石碱中Na:C:O:H元素的质量比为:(23×2):12:(16×13):(1×20)=23:6:104:10.
(2)石碱化学式为Na2CO3•10H2O,则石碱中钠元素的质量分数为
23×2
23×2+12+16×13+1×20×100%=16.1%.
(3)摩尔质量在数值上等于相对分子质量;石碱化学式为Na2CO3•10H2O,
则石碱的相对分子质量为:23×2+12+16×13+1×20=286;
故石碱的摩尔质量为286g/mol.
故答案为:
(1)23:6:104:10;
(2)16.1%;
(3)286g/mol.1年前查看全部
- Na2CO3如何变为Na2CO3•10H2O写出方程式
Na2CO3如何变为Na2CO3•10H2O写出方程式
 shirley_静1年前3
shirley_静1年前3 -
 304329954 共回答了14个问题
304329954 共回答了14个问题 |采纳率85.7%将碳酸钠制成热的饱和溶液,然后慢慢的降温结晶,碳酸钠会以水合分子的形式析出.
Na2CO3+10H2O=Na2CO3•10H2O1年前查看全部
- 实验室要用Na2CO3•10H2O晶体配制500mL 0.1mol•L-1 Na2CO3溶液,回答下
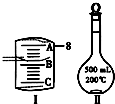 实验室要用Na2CO3•10H2O晶体配制500mL 0.1mol•L-1 Na2CO3溶液,回答下列问题:
实验室要用Na2CO3•10H2O晶体配制500mL 0.1mol•L-1 Na2CO3溶液,回答下列问题:
(1)应该用托盘天平称取Na2CO3•10H2O______g.
(2)如图Ⅰ表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为8,量筒中液体的体积是______mL.
(3)若实验中如图Ⅱ所示的仪器有下列情况,对配制溶液的浓度有何影响?(填“偏高”、“偏低”或“无影响”):A.定容前容量瓶底部有水珠______;B.定容时加水超过刻度线______;C.最终定容时俯视观察液面______.D.为加速溶解过程对烧杯中溶液进行加热,未冷却至室温就将其转移到Ⅱ所示的仪器中,并迅速定容______. kingsj1年前1
kingsj1年前1 -
 brayan_lv 共回答了20个问题
brayan_lv 共回答了20个问题 |采纳率95%解题思路:(1)根据n=CV和m=nM来计算;
(2)根据量筒小刻度在下,A与B,B与C刻度间相差1mL,则AB间每一小格为0.2mL,得出量筒中液体的体积.
(3)根据C=[n/V],通过判断不当操作对溶质的物质的量n和溶液体积V的影响来分析误差.(1)实验室配制500mL0.1mol/LNa2CO3溶液需要Na2CO3•10H2O的质量为:0.5L×0.1mol/L×286g/mol=14.3g,故答案为:14.3;
(2)量筒小刻度在下,A与B、B与C刻度间相差1mL,刻度A为8,则刻度B为7,AB间每一小格为0.2mL,则量筒中液体的体积为7.2mL,故答案为:7.2;
(3)A.定容前容量瓶底部有水珠,只要最后定容时凹液面与刻度线相切即可,至于水是事先就有的还是后来加入的,对浓度无影响,故答案为:无影响;
B.定容时加水超过刻度线,则溶液体积偏大,浓度偏低,故答案为:偏低;
C.最终定容时俯视观察液面.则导致溶液体积偏小,则浓度偏高,故答案为:偏高;
D.为加速溶解过程对烧杯中溶液进行加热,未冷却至室温就将其转移到Ⅱ所示的仪器中,并迅速定容,则冷却后溶液体积偏小,则浓度偏高,故答案为:偏高.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了一定物质的量浓度溶液的配制以及误差分析,难度不大,注意实验的基本操作方法和注意事项.1年前查看全部
大家在问
- 1(本小题满分14分)在△ABC中,角A、B、C的对边分别为a、b、c.
- 2荼靡的意思?
- 3标有220V,100W 电炉 ,两端实际电压为220V.求实际功率、
- 44.816×10的23次方氢原子H2O多少mol
- 5有关母爱的作文素材,要新颖的,急。
- 6塑料制品是由石油提炼出来的吗?
- 7法国、德国的首都分别是 [ ] A.伦敦、柏林
- 8初一英语阅读理解Have you ever seen the Airbus A380?The Airbus A380 i
- 9在显微镜下观察血涂片时,红细胞和白细胞的主要区别是( ) A.白细胞体积大,有细胞核 B.细胞体积大,无细胞核 C.红
- 10为什么现在的计算器算一道数结果按加号键就对按等于键就不对呢?
- 11在358后面补上三个数码组成一个六位数,使得它分别能被3、4、5整除,则这个数最小是______.
- 12双龙洞孔隙有多大,内洞有多少平方米,多高,长和宽分别是多少?外洞的面积体积长宽高分别是多少,双龙为什么叫双龙,两条龙有多
- 13已知直线L经过点M(1,0),且被两平行直线3x y-6=0,3x y 3=0截得的线段的长度为9,求直线L的方程.
- 14已知等腰三角形一腰上的高线等于另一腰的一半,那么这个等腰三角形的一个底角等于______.
- 15初中化学反应的先后顺序好像是先中和反应是吧,然后是什么反应呢?如果如果有多个酸和多个碱又该怎么反应呢?在置换反应中是先与
