硫酸镁溶液和氯化钾溶液方程式硫酸镁溶液和氯化钾溶液混合方程式?它们能反映吗?
 xiaoapples2022-10-04 11:39:541条回答
xiaoapples2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 carlw 共回答了14个问题
carlw 共回答了14个问题 |采纳率85.7%- 不反应,因为它们混合不生成水、气体、沉淀.
- 1年前
相关推荐
- 欲除去硫酸镁溶液中的少量硫酸,可选用( )
欲除去硫酸镁溶液中的少量硫酸,可选用( )
A. NaOH
B. Ba(OH)2
C. Mg
D. MgCl2 lyon171年前2
lyon171年前2 -
 外滩二十号 共回答了19个问题
外滩二十号 共回答了19个问题 |采纳率84.2%解题思路:除去硫酸镁中的硫酸,实质就是除去酸,根据酸的性质选择适当的物质,注意不能带入新的杂质.A、加入氢氧化钠会和硫酸、硫酸镁都反应,把原物质也除去,故此项错误.
B、氢氧化钡溶液能与硫酸镁和硫酸都发生反应,会把原物除去,故此项错误.
C、根据金属活动性顺序,镁能与硫酸反应,生成氢气和硫酸镁,方法可行,此项正确.
D、氯化镁和硫酸不反应,不能除去杂质,故方法错误.
故选C点评:
本题考点: 物质除杂或净化的探究.
考点点评: 所选择的除杂剂,要能将杂质从混合物中除去,并且不会生成新的杂质.1年前查看全部
- 临床上发现:用25%的硫酸镁溶液l0~20mL与10%的葡萄糖溶液500mL的混合液可以治疗支气管哮喘.下表是硫酸镁的部
临床上发现:用25%的硫酸镁溶液l0~20mL与10%的葡萄糖溶液500mL的混合液可以治疗支气管哮喘.下表是硫酸镁的部分溶解度数
则:(1)若要配制25%的硫酸镁溶液,溶液温度应控制在上表出现的______两个温度之间;温度(℃) 10 20 30 40 60 80 溶解度(g/100g水) 28.2 33.7 38.9 44.5 54.6 55.8
(2)若要配制上述条件下500g 25%的硫酸镁溶液,则需要水的体积为______mL(已知此实验条件下水的密度为lg/mL):称蟹硫酸镁时需要用到的主要仪器的名称是______,实验过程中用到的玻璃棒的作用是______. didar5211年前1
didar5211年前1 -
 摩凡佗 共回答了24个问题
摩凡佗 共回答了24个问题 |采纳率100%解题思路:(1)一定温度下,物质溶于水所得溶液的溶质质量分数存在最大值,该温度下达饱和时溶液的溶质质量分数最大.
25%的硫酸镁溶液为哪个温度下的溶质质量分数最大值,则为配制时应控制的溶液温度.低于此温度溶液的溶质质量分数不能达到25%,则无法配制成25%的硫酸镁溶液,配制溶液时应控制温度不低于此温度.
(2)利用溶液的溶质质量分数,计算配制溶液时溶剂水的量;并对配制操作中部分仪器的作用进行说明.(1)硫酸镁饱和溶液的溶质质量分数为25%时,此时硫酸镁的溶解度=[25/100−25]×100g═33.3克,利用硫酸镁的部分溶解度表可查得,此溶解度介于温度为10-20℃之间.
(2)配制500g 25%的硫酸镁溶液需要溶质硫酸镁的质量=500g×25%=125g,则需要溶剂水的质量=500g-125g=375g(合375mL);
称量硫酸镁固体时需要使用托盘天平;配制过程中为加快固体硫酸镁的溶解,需要使用玻璃棒不断搅拌,直到固体全部溶解.
故答案为:(1)10℃-20℃,(2)375;托盘天平;搅拌,加速硫酸镁溶解.点评:
本题考点: 一定溶质质量分数的溶液的配制;常用仪器的名称和选用;溶质的质量分数、溶解性和溶解度的关系.
考点点评: 一定温度下,某物质溶于水所形成溶液的溶质质量分数最大值=[该温度下该物质的溶解度/100+该温度下该物质的溶解度]×100%.1年前查看全部
- 临床上发现:用25%的硫酸镁溶液l0~20mL与10%的葡萄糖溶液500mL的混合液可以治疗支气管哮喘.下表是硫酸镁的部
临床上发现:用25%的硫酸镁溶液l0~20mL与10%的葡萄糖溶液500mL的混合液可以治疗支气管哮喘.下表是硫酸镁的部分溶解度数
则:(1)若要配制25%的硫酸镁溶液,溶液温度应控制在上表出现的______两个温度之间;温度(℃) 10 20 30 40 60 80 溶解度(g/100g水) 28.2 33.7 38.9 44.5 54.6 55.8
(2)若要配制上述条件下500g 25%的硫酸镁溶液,则需要水的体积为______mL(已知此实验条件下水的密度为lg/mL):称蟹硫酸镁时需要用到的主要仪器的名称是______,实验过程中用到的玻璃棒的作用是______. jymxh1年前1
jymxh1年前1 -
 bmswj 共回答了22个问题
bmswj 共回答了22个问题 |采纳率95.5%(1)硫酸镁饱和溶液的溶质质量分数为25%时,此时硫酸镁的溶解度=
25
100-25 ×100g═33.3克,利用硫酸镁的部分溶解度表可查得,此溶解度介于温度为10-20℃之间.
(2)配制500g 25%的硫酸镁溶液需要溶质硫酸镁的质量=500g×25%=125g,则需要溶剂水的质量=500g-125g=375g(合375mL);
称量硫酸镁固体时需要使用托盘天平;配制过程中为加快固体硫酸镁的溶解,需要使用玻璃棒不断搅拌,直到固体全部溶解.
故答案为:(1)10℃-20℃,(2)375;托盘天平;搅拌,加速硫酸镁溶解.1年前查看全部
- 将少量硫酸溶液的硫酸镁溶液转化为中性溶液,在没有指示剂的条件下,
将少量硫酸溶液的硫酸镁溶液转化为中性溶液,在没有指示剂的条件下,
质最适合的是()
A.NaOH B.Mg C.Ba(OH)2 D.BaCl2 朱耀峰1年前4
朱耀峰1年前4 -
 wjt_1127 共回答了15个问题
wjt_1127 共回答了15个问题 |采纳率93.3%B.Mg
其余如不控制用量皆不为中性1年前查看全部
- (2014•松北区一模)实验室有四瓶失去标签的溶液,现标为A、B、C、D,分别是碳酸钾溶液、氢氧化钠溶液、硫酸镁溶液和稀
(2014•松北区一模)实验室有四瓶失去标签的溶液,现标为A、B、C、D,分别是碳酸钾溶液、氢氧化钠溶液、硫酸镁溶液和稀盐酸中的一种.
【提出问题】如何区分出四种溶液?
【进行实验】甲同学取少量A溶液于试管中,加入一定量氢氧化钡溶液,观察到无明显现象,由此甲同学认为A一定不是(1)______,甲同学继续向实验后的溶液中滴加酚酞溶液,酚酞溶液由无色变为红色,则甲同学得出结论:A是氢氧化钠溶液.
【表达与交流】乙同学不同意甲同学的结论,乙同学的理由是(2)______.
于是乙同学另取少量A于试管中,向其中滴加一种试剂是(3)______溶液,观察到的明显现象是(4)______,由此证明了甲同学的结论是错误的,同时确定了A.
同学们继续实验:取B、C、D三种溶液置于试管中,分别依次滴加氯化钡溶液和稀硝酸,观察现象.
【收集证据】观察到C中产生白色沉淀,滴加稀硝酸后,沉淀溶解,产生气泡;D中产生白色沉淀,滴加稀硝酸后,沉淀不溶解;B中无明显现象.
【解释与结论】写出D中发生反应的化学方程式(5)______.
同学们最终通过实验区分出了四种溶液. 淘淘爱乐1年前1
淘淘爱乐1年前1 -
 caijinghuang 共回答了16个问题
caijinghuang 共回答了16个问题 |采纳率87.5%解题思路:(1)根据物质的性质进行分析,氢氧化钡能够和硫酸镁、碳酸钾反应产生沉淀分析;
(2)根据氢氧化钠显碱性,但由于没有另取溶液,若氢氧化钡溶液过量,也会使酚酞试液变成红色分析;
(3)根据氢氧化钠和稀盐酸的性质不同进行鉴别;
(4)根据选择的试剂描述现象;
(5)根据现象判断D溶液的成分并写出反应的方程式.(1)甲同学取少量A溶液于试管中,加入一定量氢氧化钡溶液,观察到无明显现象,因此A一定不是碳酸钾溶液和硫酸镁溶液,因为氢氧化钡能够和硫酸镁、碳酸钾反应产生沉淀;
(2)由于没有另取溶液,若氢氧化钡溶液过量,也会使酚酞试液变成红色,因此甲同学的结论不正确;
(3)由于氢氧化钠显碱性,盐酸显酸性,因此可以利用石蕊试液鉴别;
(4)若石蕊试液由紫色变为红色,说明溶液显酸性的盐酸而不是碱性的氢氧化钠;
(5)由于滴加氯化钡溶液和稀硝酸,在D中产生的沉淀不溶解,因此说明D中含有硫酸根离子,既D是硫酸镁,反应的方程式为:MgSO4+BaCl2=BaSO4↓+MgCl2;
故答案为:(1)碳酸钾溶液和硫酸镁溶液;
(2)酚酞溶液由无色变为红色,也可能是由于氢氧化钡溶液过量引起的,所以无法判定溶液一定是氢氧化钠溶液;
(3)紫色石蕊;
(4)由紫色变为红色;
(5)MgSO4+BaCl2=BaSO4↓+MgCl2
(注:3、4问其他合理答案也可).点评:
本题考点: 酸、碱、盐的鉴别;常见碱的特性和用途;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了常见物质的推断,完成此题,可以依据物质的性质结合题目提供的信息进行分析得出结论.1年前查看全部
- (2014•江西模拟)同学们欲探究金属的性质,做了如图所示的实验:三支试管里分别装有硫酸镁溶液、硫酸铜溶液和稀硫酸,然后
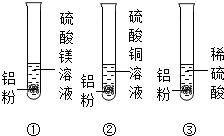 (2014•江西模拟)同学们欲探究金属的性质,做了如图所示的实验:三支试管里分别装有硫酸镁溶液、硫酸铜溶液和稀硫酸,然后各加入少量的***.
(2014•江西模拟)同学们欲探究金属的性质,做了如图所示的实验:三支试管里分别装有硫酸镁溶液、硫酸铜溶液和稀硫酸,然后各加入少量的***.
【实验现象】①、②试管内始终无明显现象,而试管③中开始时无明显现象,但片刻后出现大量的气泡.
【分析与反思】
试管③中开始时无明显现象的原因是______,片刻后产生的气体是______.
【实验整理】实验完毕,同学们将三支试管中的残余物一起倒入一个干净的废液缸中,片刻后发现有气泡冒出,并有红色固体析出.
【现象分析】析出红色固体的原因是______(用化学方程式表示)该事实说明铝的金属活动性比铜更______.
【再探究】同学们想确定废液缸中残余固体的成分.
【提出猜想】小亮的猜想是:含有铜和铝;小莉的猜想:含有铜和镁.小花认为小莉的猜想不成立,理由是______,并且小花认为合理的猜想还有______.
【实验探究】同学们滤出废液缸中的残余固体,经检验小亮的猜想正确.请完成下表:实验步骤 实验现象 结论 向滤出的固体中加入______ ______ 残余固体中含有铜和铝  psy12171年前1
psy12171年前1 -
 heleniverson 共回答了9个问题
heleniverson 共回答了9个问题 |采纳率88.9%解题思路:【分析与反思】根据铝表面的氧化铝保护膜先和稀硫酸反应然后铝才能和稀硫酸反应生成硫酸铝和氢气分析;
【现象分析】根据铝和硫酸铜反应生成硫酸铝和铜,铝的活动性比铜强解答;
【提出猜想】铝的活动性比铜活动性强,只要含有铝一定含有铜,铝和稀硫酸反应生成硫酸铝和氢气解答.【分析与反思】铝表面的氧化铝保护膜先和稀硫酸反应然后铝才能和稀硫酸反应生成硫酸铝和氢气;故答案:铝表面有一层致密的氧化铝保护膜干扰了实验;氢气;
【现象分析】铝和硫酸铜反应生成硫酸铝和铜,铝的活动性比铜强;故答案:2Al+3CuSO4=Al2(SO4)3+3Cu;强;
【提出猜想】铝的活动性比铜活动性强,只要含有铝一定含有铜,铝和稀硫酸反应生成硫酸铝和氢气;故答案:稀硫酸;有气泡.点评:
本题考点: 金属的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.1年前查看全部
- 某同学将同浓度的氢氧化钡滴入配好的硫酸镁溶液中,看到出现浑浊.请设计一个简单实验证明氢氧化钡溶液与
某同学将同浓度的氢氧化钡滴入配好的硫酸镁溶液中,看到出现浑浊.请设计一个简单实验证明氢氧化钡溶液与
硫酸镁溶液混合后发生的是离子反应.写出实验步骤,预期现象与结论 猫猫玉米1年前1
猫猫玉米1年前1 -
 lilonglin 共回答了22个问题
lilonglin 共回答了22个问题 |采纳率100%氢氧化钡溶液滴入硫酸镁溶液中,得到氢氧化镁沉淀和硫酸钡沉淀.这两种沉淀都是白色沉淀.溶解度都很小.1年前查看全部
- 下列反应的离子方程式正确的是 A.铝片跟氢氧化钠溶液反应:Al+2OH - = +H 2 ↑ B.硫酸镁溶液跟氢氧化钡溶
下列反应的离子方程式正确的是
A.铝片跟氢氧化钠溶液反应:Al+2OH - = 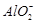 +H 2 ↑
+H 2 ↑B.硫酸镁溶液跟氢氧化钡溶液反应: 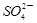 +Ba 2 + =BaSO 4 ↓
+Ba 2 + =BaSO 4 ↓C.碳酸钙跟醋酸反应:CaCO 3 +2CH 3 COOH=Ca 2 + +2CH 3 COO - +H 2 O+CO 2 ↑ D.铜片跟稀硝酸反应:Cu+ 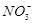 +4H + =Cu 2 + +NO↑+2H 2 O
+4H + =Cu 2 + +NO↑+2H 2 O 小核桃精灵1年前1
小核桃精灵1年前1 -
 0987363 共回答了25个问题
0987363 共回答了25个问题 |采纳率88%C
1年前查看全部
- 配置溶液质量分数为百分之2的硫酸镁溶液500克需百分之25的硫酸镁质量为多少
 love名典小小1年前1
love名典小小1年前1 -
 liutao1597 共回答了17个问题
liutao1597 共回答了17个问题 |采纳率94.1%这是稀释问题,溶液中溶质的质量不变,
500X2%=25%m
m=40g1年前查看全部
- 酸性硫酸镁溶液电解后阴阳极的产物是什么
 5050444161年前2
5050444161年前2 -
 leekam 共回答了17个问题
leekam 共回答了17个问题 |采纳率88.2%其实吧.
本质就是点解水,生成氧气和氢气.
和你说下电解顺序吧.
阴极:S离子大于I离子大于Br离子大于Cl离子大于OH根离子大于含氧酸根离子
(就是还原性顺序)
阳极:Ag离子大于Hg离子大于Cu离子大于H离子大于.大于Mg离子
大于Na离子大于K离子
(就是氧化性顺序)1年前查看全部
- 硫酸镁俗名泻盐,随着人们对镁的生理功能认识的加深,硫酸镁在临床上的新用途不断被发现.例如,用25%的硫酸镁溶液10~20
硫酸镁俗名泻盐,随着人们对镁的生理功能认识的加深,硫酸镁在临床上的新用途不断被发现.例如,用25%的硫酸镁溶液10~20mL与10%的葡萄糖溶液500mL的混合液可以治疗支气管哮喘.下表是硫酸镁的部分溶解度数据.
(1)欲配制25%的硫酸镁溶液,温度(T)应满足______.温度(℃) 10 20 30 40 60 80 90 100 溶解度(g/100g水) 28.2 33.7 38.9 44.5 54.6 55.8 52.9 50.4
(2)在上述条件下配制1000g 25%的硫酸镁溶液需要硫酸镁______g. jinhai841年前1
jinhai841年前1 -
 云山烟雨 共回答了17个问题
云山烟雨 共回答了17个问题 |采纳率88.2%(1)硫酸镁饱和溶液的溶质质量分数为25%时,此时硫酸镁的溶解度=
25
100-25 ×100%═33.3克,利用硫酸镁的部分溶解度表可查得,温度为20℃或以上时能配置25%的硫酸镁溶液;所以,配制25%的硫酸镁溶液,配制时应控制的溶液温度至少达到20℃.
(2)配制1000 g 25%的硫酸镁溶液需要溶质硫酸镁的质量=1000g×25%=250g;
故答案为;(1)T≥20℃(或20℃≤T≤100℃);
(2)2501年前查看全部
- 在mg20%的氢氧化钠溶液中滴加2~3滴酚酞试液,然后边搅拌边逐滴向其中加入硫酸镁溶液,至溶液的红色完全褪去时,滤去沉淀
在mg20%的氢氧化钠溶液中滴加2~3滴酚酞试液,然后边搅拌边逐滴向其中加入硫酸镁溶液,至溶液的红色完全褪去时,滤去沉淀,称得剩余溶液的总质量为3mg.
(1)计算所加硫酸镁溶液的质量分数;
(2)用N表示溶液中离子的数目,不同种离子用离子符号注明[如N(Na + )表示钠离子的数目],请建立坐标系,绘制上述滴加过程中各种离子的数目随溶液的不断加入而变化的关系图. 格子小熊1年前1
格子小熊1年前1 -
 fiting333 共回答了25个问题
fiting333 共回答了25个问题 |采纳率88%(1)依据题意可知溶液的总质量增加了2mg,其中包括硫酸镁与氢氧化钠反应导致的溶液质量增加以及硫酸镁溶液中所含的水,则设氢氧化钠转化为硫酸钠导致的溶液质量增加量为x,硫酸镁的质量为y,
2NaOH+MgSO 4 ═Na 2 SO 4 +Mg(OH) 2 ↓△m
8012014258142-80=62
0.2m y x
80
62 =
0.2m
x ,
80
120 =
0.2m
y
解得:x=0.155mg,y=0.3mg,
硫酸镁溶液中所含的水的质量为2mg-0.155mg,
硫酸镁溶液的总质量为(0.3m+2m-0.155m)g,
则硫酸溶液中溶质的质量分数为
0.3mg
(0.3m+2m-0.155m)g ×100%═13.99%,
答:所加硫酸镁溶液的质量分数13.99%.
(2)因钠离子不参加反应,在整个过程中其数目不随硫酸镁溶液的加入发生变化,即钠离子数目一直不变;
开始溶液中没有硫酸根离子,然后硫酸根离子随硫酸镁溶液的加入在不断增多,但是硫酸根离子浓度是钠离子浓度的一半.开始为氢氧化钠溶液,随硫酸镁溶液的加入,氢氧根离子和镁离子结合生成沉淀,至沉淀最多使氢氧根离子沉淀完全,则氢氧根离子接近为0;故答案为:
1年前
61年前查看全部
- 硫酸镁溶液加热并灼热会得到固体吗?
 铁马雄风1年前2
铁马雄风1年前2 -
 放屁狗 共回答了20个问题
放屁狗 共回答了20个问题 |采纳率85%硫酸镁溶液加热并灼热得到硫酸镁固体
确定~
y111uan 所说的MgSO4=高温=MgO+SO3.这个温度要1000多度 就看你灼烧到什么地步了
题目里面应该会出现条件1年前查看全部
- 硫酸镁溶液中溶剂是什么
 hejingnihao01年前4
hejingnihao01年前4 -
 woyaojiaru995 共回答了22个问题
woyaojiaru995 共回答了22个问题 |采纳率95.5%溶剂为水
在化学中,关于溶液的组成
如果一种是固体或气体,另一种是液体,则溶剂为液体
如果两种物质都是液体,则量多的为溶剂
如果有水,则不论多少,一般都认为水是溶剂.
水是最常见的溶剂
在溶液表达时,溶剂为水的可以省略,如氯化钠溶液,溶剂为水,不是水的则必须说明溶剂种类,如碘的酒精溶液,溶剂为酒精,必须指明
希望对你有所帮助,亲!欢迎追问!1年前查看全部
- 一道高深的化学题硫酸镁溶液蒸干后为什么会得到纯硫酸镁?我知道硫酸是不挥发的!但是硫酸根是强酸根阴离子,为什么会和水结合生
一道高深的化学题
硫酸镁溶液蒸干后为什么会得到纯硫酸镁?我知道硫酸是不挥发的!但是硫酸根是强酸根阴离子,为什么会和水结合生成硫酸,如果不加热蒸干,硫酸镁溶液中有H2SO4分子吗?
如果是硫酸铝呢?同样的结果吗?
我想问一下:如果没有生成硫酸,书上为什么说因为硫酸镁水解后生成的硫酸是不挥发的物质,所以在蒸干后还是得到原物质(硫酸镁)! 爱过就别后悔1年前1
爱过就别后悔1年前1 -
 Joannachenanjie 共回答了27个问题
Joannachenanjie 共回答了27个问题 |采纳率88.9%但是硫酸根是强酸根阴离子,为什么会和水结合生成硫酸.
不是这样子,硫酸是强酸,在水中完全电离,H+和SO42-并没有结合,而是完全分开的,硫酸溶液中已经没有结合一起的硫酸分子了.
所谓生成硫酸只是Mg 2+离子的水解产生氢离子,等效产生了少部分硫酸.
Mg2++2H2O ↔ Mg(OH)2+2H+
其实并没有产生你所想的那种结合的硫酸分子.
楼上的自己没学好之前不要误导别人,硫酸铝也是同样的结果.1年前查看全部
- 硫酸镁溶液和硫酸铝溶液如何分离?
 junhorizon1年前2
junhorizon1年前2 -
 芷01 共回答了15个问题
芷01 共回答了15个问题 |采纳率93.3%由于铝离子水解能力远大于镁离子,所以只要在混合溶液中加MgO(或MgCO3、Mg(OH)2),使溶液pH升高,Al3+形成氢氧化铝沉淀而析出,再过滤就得到硫酸镁溶液.1年前查看全部
- 我要配浓度为50%的硫酸镁溶液100毫升,需要多少克的硫酸镁?多少毫升的水?
 79240821年前1
79240821年前1 -
 ly6ly 共回答了10个问题
ly6ly 共回答了10个问题 |采纳率100%硫酸镁分子质量是120,水的分子质量是18,溶液的浓度为50%,故物质的量比为18:120,则密度为(18+120)/120=1.15
硫酸镁质量为100*1.15*50%=57.5g
水需要(100*1.15-57.5)/1=57.5ml1年前查看全部
- 下列设计方案可行,且化学方程式书写正确的是( ) A.用铁片和硫酸镁溶液验证镁、铁两种金属的活动性顺序:Fe+MgSO
下列设计方案可行,且化学方程式书写正确的是( ) A.用铁片和硫酸镁溶液验证镁、铁两种金属的活动性顺序:Fe+MgSO 4 ═FeSO 4 +Mg B.用盐酸除去氢氧化钾溶液中的碳酸钾:K 2 CO 3 +2HCl═2KCl+H 2 O+CO 2 ↑ C.实验室用大理石和稀盐酸反应制取二氧化碳:CaCO 3 +2HCl═CaCl 2 +H 2 O+CO 2 ↑ D.用稀硫酸除铁锈:Fe 2 O 3 +H 2 SO 4 ═FeSO 4 +H 2 O  suntaolol1年前1
suntaolol1年前1 -
 lemonkyle 共回答了15个问题
lemonkyle 共回答了15个问题 |采纳率86.7%A、由金属活动性顺序表可知镁的活动性比铁强,因此铁不可能置换出镁盐溶液中的镁,所以不可能发生Fe+MgSO 4 ═FeSO 4 +Mg的反应;
B、用盐酸除去氢氧化钾溶液中的碳酸钾,由于盐酸既能和氢氧化钾反应又能和碳酸钾反应,所以不可行;
C、实验室制取二氧化碳常采用大理石与稀盐酸完成,其方程式为:CaCO 3 +2HCl═CaCl 2 +H 2 O+CO 2 ↑;
D、稀硫酸除锈的原理是铁锈的主要成分氧化铁与稀硫酸发生反应,其产物是硫酸铁和水不是硫酸亚铁和水;
故选C.1年前查看全部
- 若将含有硫酸的硫酸镁溶液中和至中性,在没有指示剂的条件下可以选用:A氨水 B氢氧化钠 C镁条 D碳酸镁
若将含有硫酸的硫酸镁溶液中和至中性,在没有指示剂的条件下可以选用:A氨水 B氢氧化钠 C镁条 D碳酸镁
主要关于酸碱盐的一道习题!希望知道的学者, shenzhenszu1年前1
shenzhenszu1年前1 -
 sneueueu 共回答了18个问题
sneueueu 共回答了18个问题 |采纳率94.4%C
其余如不控制用量皆不为中性1年前查看全部
- 最好有分析在氢氧化铁胶体中逐滴滴入下列某种溶液,出现的现象是先沉淀,后沉淀溶解.这种溶液是A稀硫酸 B饱和硫酸镁溶液 C
最好有分析
在氢氧化铁胶体中逐滴滴入下列某种溶液,出现的现象是先沉淀,后沉淀溶解.这种溶液是
A稀硫酸 B饱和硫酸镁溶液 C盐酸溶液 D饱和硫酸铵溶液 ww2yuki1年前3
ww2yuki1年前3 -
 mac6060 共回答了21个问题
mac6060 共回答了21个问题 |采纳率95.2%选A,C两个
因为一开始的沉淀是因为电解质破坏了胶体的稳定性.
后来的溶解是因为氢氧化铁被酸给溶解了的缘故.1年前查看全部
- (2010•达县模拟)某同学取出50g某硫酸镁溶液,向其中逐滴加入溶质质量分数为10%的NaOH溶液.反应过程中生成沉淀
(2010•达县模拟)某同学取出50g某硫酸镁溶液,向其中逐滴加入溶质质量分数为10%的NaOH溶液.反应过程中生成沉淀的质量与所用NaOH溶
液质量的关系如图所示.(反应的化学方程式为:2NaOH+MgSO4=Na2SO4+Mg(OH)2↓)
(1)当NaOH溶液质量为40g时,溶液的pH______7(填“>”、“<”或“=”),这时溶液的溶质为______填化学式).
(2)计算此硫酸镁溶液的溶质的质量分数. (写出详细计算过程) ghfx6132151年前1
ghfx6132151年前1 -
 wtn1223 共回答了15个问题
wtn1223 共回答了15个问题 |采纳率93.3%(1)由图示可知,当NaOH溶液质量为40g时,沉淀不再生成,说明反应已完全,溶液呈中性,pH=7; 此时氢氧化钠被完全中和,故溶液的溶质为Na2SO4;
(2)设参与反应的MgSO4质量为x,
2NaOH+MgSO4=Na2SO4+Mg(OH)2↓
80120
40g×10%,x
∴80:120=(40g×10%):x,
解之得:x=6g,
硫酸镁溶液的溶质的质量分数为:[6g/50g]×100%=12%.
答:硫酸镁溶液的溶质的质量分数为12%.1年前查看全部
- 写离子方程式1氢氧化锌与稀硝酸2钡溶液与硫酸镁溶液反应3澄清石灰水与盐酸反应4浓硫酸和镁反应5硫酸镁和氢氧化钠溶液为什么
写离子方程式
1氢氧化锌与稀硝酸
2钡溶液与硫酸镁溶液反应
3澄清石灰水与盐酸反应
4浓硫酸和镁反应
5硫酸镁和氢氧化钠溶液
为什么浓H2SO4不拆开写 sunyee1年前3
sunyee1年前3 -
 涅磐蝴蝶 共回答了17个问题
涅磐蝴蝶 共回答了17个问题 |采纳率88.2%1、Zn(OH)2 +2H+==Zn2++2H2O
2、Ba2+ +2OH-+Mg2+ + SO42-==BaSO4↓ +Mg(OH)2↓
3、OH- +H+==H2O
4、Mg+2H2SO4(浓)==Mg2+ +SO42-+SO2↑+2H20
5、Mg2+ +2OH-==Mg(OH)2↓
浓硫酸之所以不能拆是因为其浓度太高了,在溶液中很少有游离的H+或者SO42-
所以不能拆.硫酸可以和水以任意比例混合.1年前查看全部
- 向质量为m的 20%的氢氧化钠溶液中逐滴加入硫酸镁溶液,至恰好完全反应时,滤去沉淀,称量所得滤液总质量为3m.
向质量为m的 20%的氢氧化钠溶液中逐滴加入硫酸镁溶液,至恰好完全反应时,滤去沉淀,称量所得滤液总质量为3m.
(1)计算所加硫酸镁溶液中溶质的质量分数(最后结果精确到0.1%);
(2)用N表示溶液中离子的数目,不同种离子用离子符号注明[如N (Na+)表示钠离子的数目],请建立坐标系,绘制上述滴加过程中各种离子的数目随溶液的不断加入而变化的关系图. 且听哇声一片1年前1
且听哇声一片1年前1 -
 515642 共回答了15个问题
515642 共回答了15个问题 |采纳率93.3%解题思路:(1)根据氢氧化钠和硫酸镁反应的方程式利用氢氧化钠的质量可求反应的硫酸镁和生成沉淀的质量,而后利用质量守恒定律可知硫酸镁溶液的量,进而可得硫酸镁的质量分数;
(2)依据反应前后物质是否能电离以及离子的个数关系分析解答即可;(1)设参加反应的MgSO4的质量为x,生成Mg(OH)2沉淀的质量为y.
2NaOH+MgSO4=Na2SO4+Mg(OH)2↓
8012058
m×20%x y
解得:x=0.3 my=0.145 m
由m+MgSO4溶液的质量=3m+0.145m
知MgSO4溶液的质量=2.145m
所以 MgSO4溶液中MgSO4的质量分数=[0.3m/2.145m]×100%=14.0%
(2)由反应方程式2NaOH+MgSO4=Na2SO4+Mg(OH)2↓可知溶液中的钠离子不会变化(来源于氢氧化钠溶液),而随着硫酸镁的滴加硫酸根离子则会不断变大,但由于Na2SO4可知溶液中的钠离子和硫酸根离子的个数比应该为2:1,溶液中的氢氧根离子随着硫酸镁的滴加会不断变少最终完全反应时消失;故可得如下图象[注:图中应反映出恰好完成反应后,N(Na+):N(SO42-)=2:1]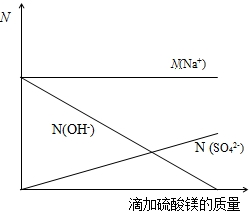
故答案为:(1)所加硫酸镁溶液中溶质的质量分数为14.0%;(2)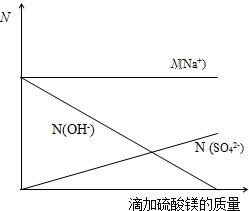
点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 此题是一道化学方程式计算题,熟练掌握相关方程式的计算和利用质量守恒定律是解题的关键;1年前查看全部
- 一定质量的20%的烧碱溶液和一定质量的硫酸镁溶液恰好完全反应,所得溶液的质量为109.2g,其中溶质的质量分数为13%,
一定质量的20%的烧碱溶液和一定质量的硫酸镁溶液恰好完全反应,所得溶液的质量为109.2g,其中溶质的质量分数为13%,计算硫酸镁溶液中溶质的质量分数.(计算过程保留两位小数)
 听听雨1年前1
听听雨1年前1 -
 来自乡村 共回答了11个问题
来自乡村 共回答了11个问题 |采纳率81.8%解题思路:烧碱溶液和硫酸镁溶液恰好完全反应生成氢氧化镁沉淀和硫酸钠溶液,硫酸钠溶液既是反应后所得溶液,知所得溶液的质量为109.2g,其中溶质的质量分数为13%,根据反应的化学方程式求得氢氧化钠、硫酸镁、氢氧化镁的质量,进而求得硫酸镁溶液中溶质的质量分数.硫酸钠的质量为109.2g×13%=14.2g
设反应的硫酸镁的质量为y,氢氧化钠的质量为x,生成的氢氧化镁质量为z.
2NaOH+MgSO4═Mg(OH)2↓+Na2SO4
8012058142
xyz14.2g
[80/x=
142
14.2g] [120/y=
142
14.2g] [58/z=
142
14.2g]
x=8g
y=12g
z=5.8g
烧碱溶液的质量为8g÷20%=40g
硫酸镁溶液的质量为109.2g+5.8g-40g=75g
硫酸镁溶液的溶质质量分数为[12g/75g]×100%=16%
答:硫酸镁溶液中溶质的质量分数为16%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 此题考查了溶质质量分数与化学方程式相结合的计算题,综合性较强,需细心分析解答.1年前查看全部
- 用硫酸镁溶液 怎么能制备出来七水硫酸镁(要详细,
 fanmeina1年前1
fanmeina1年前1 -
 zb001024 共回答了16个问题
zb001024 共回答了16个问题 |采纳率87.5%硫酸镁常指七水硫酸镁,因为它不容易潮解,比无水硫酸镁更容易称量,便于在工业中进行的定量控制.在硫酸镁饱和溶液中,可以结晶出分别带有1、2、3、4、5、6、12个水的水合结晶物,精确控制温度在-1.48.18℃饱和水溶液中,析出七水硫酸镁.在-3.1.8℃饱和水溶液中,析出十二水硫酸镁,在-1.48.18℃饱和水溶液中,析出七水硫酸镁,在48.67.5℃饱和水溶液中,析出六水硫酸镁,高于67.5℃时析出一水硫酸镁,六水硫酸镁在87~92℃间发生异元熔化,并生成五水或四水硫酸镁,四水硫酸镁在106℃下转化成三水硫酸镁,三水硫酸镁在122~124℃下转化二水硫酸镁,二水硫酸镁在161~169℃下转化成稳定的一水硫酸镁1年前查看全部
- 氯化镁和氯化钡的混合溶液(不加热),哪些成分能和硫酸镁溶液反应?
 o_i_jib4_2he632c1年前2
o_i_jib4_2he632c1年前2 -
 king1338188 共回答了14个问题
king1338188 共回答了14个问题 |采纳率100%钡离子!但是我觉得硫酸镁应该是微溶物!1年前查看全部
- 在mg20%的氢氧化钠溶液中滴加2~3滴酚酞试液,然后边搅拌边逐滴向其中加入硫酸镁溶液,至溶液的红色完全褪去时,滤去沉淀
在mg20%的氢氧化钠溶液中滴加2~3滴酚酞试液,然后边搅拌边逐滴向其中加入硫酸镁溶液,至溶液的红色完全褪去时,滤去沉淀,称得剩余溶液的总质量为3mg.
(1)计算所加硫酸镁溶液的质量分数;
(2)用N表示溶液中离子的数目,不同种离子用离子符号注明[如N(Na+)表示钠离子的数目],请建立坐标系,绘制上述滴加过程中各种离子的数目随溶液的不断加入而变化的关系图. 寒冬美景1年前0
寒冬美景1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 关于化学的蒸发类应用如下题,5%的硫酸镁溶液240g,若蒸发掉215.4g水后,剩下的水刚好形成硫酸镁晶体MgSO4.X
关于化学的蒸发类应用
如下题,5%的硫酸镁溶液240g,若蒸发掉215.4g水后,剩下的水刚好形成硫酸镁晶体MgSO4.XH2O,则X值为多少? xlp5211年前1
xlp5211年前1 -
 jacky45mm 共回答了25个问题
jacky45mm 共回答了25个问题 |采纳率88%5%的硫酸镁溶质的质量是240×5%=12克
蒸发掉水剩下的晶体质量是240-215.4=24.6克
说明有12.6g的水
硫酸 120-----12
水 18------1.8------12.6=7×1.8
说以X=71年前查看全部
- 硫酸镁溶液的标定方法最好是用EDTA对硫酸镁进行标定,请给出具体的操作步骤及计算公式,越详细越好,
 股圣北斗星1年前1
股圣北斗星1年前1 -
 狮屁特 共回答了22个问题
狮屁特 共回答了22个问题 |采纳率77.3%用移液管移取50ml待测硫酸镁溶液于250ml锥形瓶中,加入1ml硫酸和5ml过硫酸钾溶液,再加热煮沸至水分几乎完全蒸发完,冷却至室温,再加入50ml去离子水和3ml三乙醇胺溶液,再用氢氧化钾溶液调节pH近中性,再加入5ml氨-氯化铵缓冲溶液和2~3滴铬黑T指示液,再用EDTA标准溶液进行滴定,至溶液颜色由紫红色变为蓝色时即为终点~
结果:镁离子含量为[(EDTA标准液浓度)*(EDTA标准液消耗的体积)*0.02431*10^6]/0.05L
【平の楽\(^o^)/小平平】1年前查看全部
- 如何配置500mL,1mol/L的硫酸镁溶液?已知MgSO4·7H2O的摩尔质量为246.5g/mol
 alex1390841年前2
alex1390841年前2 -
 idoal 共回答了19个问题
idoal 共回答了19个问题 |采纳率94.7%1、计算所需要的MgSO4·7H2O的物质的量 n= c .v =500ml * 1mol/L = 0.5mol
则需要的MgSO4·7H2O质量为 m= n* M = 0.5mol * 246.5 g/mol =12.325 g
2、称量 :如果是用托盘天平称量,则称量12.3 g MgSO4·7H2O,如果用分析天平或电子天平称,则称12.325g MgSO4·7H2O
把称好的MgSO4·7H2O放于烧杯中,加适量蒸馏水,用玻璃棒不断搅拌,使其溶解.
4、将3溶解后的液体,转移到500ml容量瓶中,并用蒸馏水洗涤烧杯内壁及玻璃棒3-4次,并把洗涤液一并加入到容量瓶中,摇匀.
5、往容量瓶加入蒸馏水,至离刻度线1-2厘米时,改用胶头滴管加水,至液面弧线刚好跟刻度线相切为止,注意要平视.
6、震荡,摇匀.
7、将配制好的溶液转移到试剂瓶中,贴上标签.1年前查看全部
- 硫酸镁溶液能使石蕊变红吗?硫酸镁水解的,怎么讲也比苯酚强吧,石蕊变色是5-8,
 天晴雪儿1年前9
天晴雪儿1年前9 -
 latxe 共回答了14个问题
latxe 共回答了14个问题 |采纳率92.9%硫酸镁水解的化学方程式是MgSO4+2H2O=可逆=Mg(OH)2+H2SO4,离子方程式是Mg2+ +2H2O=可逆=Mg(OH)2+2H+ .
故可以,但不太明显1年前查看全部
- 硫酸镁俗名泻盐,随着人们对镁的生理功能认识的加深,硫酸镁在临床上的新用途不断被发现.例如,用25%的硫酸镁溶液10~20
硫酸镁俗名泻盐,随着人们对镁的生理功能认识的加深,硫酸镁在临床上的新用途不断被发现.例如,用25%的硫酸镁溶液10~20mL与10%的葡萄糖溶液500mL的混合液可以治疗支气管哮喘.下表是硫酸镁的部分溶解度数据.
(1)欲配制25%的硫酸镁溶液,温度(T)应满足______.温度(℃) 10 20 30 40 60 80 90 100 溶解度(g/100g水) 28.2 33.7 38.9 44.5 54.6 55.8 52.9 50.4
(2)在上述条件下配制1000g 25%的硫酸镁溶液需要硫酸镁______g. worship20061年前1
worship20061年前1 -
 飘出历史 共回答了12个问题
飘出历史 共回答了12个问题 |采纳率83.3%解题思路:(1)一定温度下,物质溶于水所得溶液的溶质质量分数存在最大值,该温度下达饱和时溶液的溶质质量分数最大.
25%的硫酸镁溶液为哪个温度下的溶质质量分数最大值,则为配制时应控制的溶液温度.低于此温度溶液的溶质质量分数不能达到25%,则无法配制成25%的硫酸镁溶液,配制溶液时应控制温度不低于此温度.
(2)利用溶液的溶质质量分数,计算配制溶液时溶质的量.(1)硫酸镁饱和溶液的溶质质量分数为25%时,此时硫酸镁的溶解度=[25/100−25]×100%═33.3克,利用硫酸镁的部分溶解度表可查得,温度为20℃或以上时能配置25%的硫酸镁溶液;所以,配制25%的硫酸镁溶液,配制时应控制的溶液温度至少达到20℃.
(2)配制1000 g 25%的硫酸镁溶液需要溶质硫酸镁的质量=1000g×25%=250g;
故答案为;(1)T≥20℃(或20℃≤T≤100℃);
(2)250点评:
本题考点: 固体溶解度的影响因素;溶质的质量分数、溶解性和溶解度的关系;有关溶质质量分数的简单计算.
考点点评: 此题考查一定温度下,某物质溶于水所形成溶液的溶质质量分数最大值=[溶解度/100克+溶解度]×100%,及配制溶液计算溶质溶剂的方法.1年前查看全部
- (2014•市中区一模)有一溶液X,分别滴加到盛有氯化铁、碳酸钠、硫酸镁溶液的试管中并振荡,产生的现象如下表,则溶液X是
(2014•市中区一模)有一溶液X,分别滴加到盛有氯化铁、碳酸钠、硫酸镁溶液的试管中并振荡,产生的现象如下表,则溶液X是( )
试管中盛放物质 氯化铁溶液 碳酸钠溶液 硫酸镁溶液 现象 产生红褐色沉淀 无明显现象 产生白色沉淀
A.AgNO3溶液
B.NaOH溶液
C.Ba(OH)2溶液
D.BaCl2溶液 逃跑的猪1年前1
逃跑的猪1年前1 -
 银耳糖水 共回答了14个问题
银耳糖水 共回答了14个问题 |采纳率92.9%解题思路:根据题意,有一溶液X,分别滴加到盛有氯化铁、碳酸钠、硫酸镁溶液的试管中并振荡,与氯化铁溶液反应生成红褐色沉淀(氢氧化铁),与碳酸钠溶液反应无明显现象,与硫酸镁溶液反应生成白色沉淀,据此进行分析判断;解答本题最简单的方法是采用带入验证法.A、AgNO3溶液与氯化铁溶液反应生成氯化银白色沉淀和硝酸铁,没有红褐色沉淀生成,故选项错误.
B、NaOH溶液与氯化铁溶液反应生成氢氧化铁红褐色沉淀和氯化钠;与碳酸钠溶液交换成分没有沉淀、气体或水生成,不能发生反应,无明显现象;与硫酸镁溶液反应生成氢氧化镁白色沉淀和硫酸钠;符合要求,故选项正确.
C、Ba(OH)2溶液与氯化铁溶液反应生成氢氧化铁红褐色沉淀和氯化钡;与碳酸钠溶液反应生成碳酸钡白色沉淀,而不是无明显现象,故选项错误.
D、BaCl2溶液与氯化铁溶液交换成分没有沉淀、气体或水生成,不能发生反应,故选项错误.
故选:B.点评:
本题考点: 物质的鉴别、推断;盐的化学性质.
考点点评: 本题难度不大,掌握盐的化学性质是正确解答本题的关键,明确实验现象、采用带入验证法是正确解答本题的捷径.1年前查看全部
- 1.若将含有硫酸的硫酸镁溶液中和到中性,在不用指示剂的条件下,加入的试剂比较好的是1.氨水 2.碳酸镁 3.氢氧化钠 4
1.若将含有硫酸的硫酸镁溶液中和到中性,在不用指示剂的条件下,加入的试剂比较好的是1.氨水 2.碳酸镁 3.氢氧化钠 4.氧化镁
A.1 和3 B 2和 4 C 2 和3 D 1 和4
2.盛石灰水的试剂瓶瓶口内壁有一层白膜,要除去这层白膜,应先加 ,再加 才能洗干净.
3.NaOH溶液中混有碳酸钠,应用 试剂除去,反应的化学方程式为 .
4.在化合物R(OH)下标x中,R元素与氢氧根的质量比为9:17,该化合物式量为78,则氢氧根的个数为 ,R元素的相对原子质量为 .
5.9.4克的氧化钾溶解在90.6克水中,所得溶液的百分比浓度为 . mmmm城市1年前1
mmmm城市1年前1 -
 千家喂 共回答了29个问题
千家喂 共回答了29个问题 |采纳率86.2%1.氨水不可以,因为不知道用量可能过量呈碱性
碳酸镁可以,MgCO2+H2SO4=MgSO4+CO2↑+H2O,并且如果过量的话可以直接过滤
NaOH不可以同氨水理由
MgO可以 MgO+H2SO4=MgSO4+H2O,MgO多余的过滤
2.白膜是CaCO3
先加稀HCl,再加蒸馏水
3.用的是适量的Ca(OH)2
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
4.式量是78
根据R和OH的质量比知道
R占了78×9/(9+17)=27
OH占了78-27=51,OH占了3个
即OH-是3个,R是27
5.9.4gK2O
K2O+H2O=2KOH
94 112
9.4g x
解得x=11.2g
而溶液的质量是9.4+90.6=100g
所以浓度是11.2%1年前查看全部
- 将氢氧化钡溶液逐渐加入到混有少量硝酸的硫酸镁溶液中,所的沉淀与加入的氢氧化钡的质量变化图像
将氢氧化钡溶液逐渐加入到混有少量硝酸的硫酸镁溶液中,所的沉淀与加入的氢氧化钡的质量变化图像
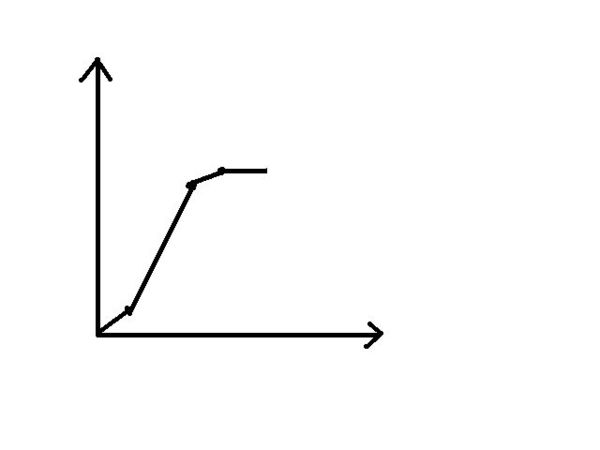
横坐标表示氢氧化钡的质量 纵坐标表示生成沉淀的质量
答案是这样的,但是为什么呢
 济南男人1年前1
济南男人1年前1 -
 littlejj 共回答了16个问题
littlejj 共回答了16个问题 |采纳率68.8%第一段,斜率小点,是因为Mg(OH)2没有生成
第二段,BaSO4 Mg(OH)2同时生成斜率最大
第三段,只有Mg(OH)2生成.这里的Mg是第一段没有与OH-反应的Mg2+
第四段,MgSO4反应完了.没沉淀生成1年前查看全部
- 体积均为a L的硫酸铁、硫酸锌、硫酸镁溶液,均能和b L 1mol/LBaCl2(氯化钡)溶液恰好完
 oldcommoner1年前1
oldcommoner1年前1 -
 A20011062 共回答了16个问题
A20011062 共回答了16个问题 |采纳率93.8%列出他们的方程式.知道他们的反应比.设硫酸铁、硫酸锌、硫酸镁溶液量溶度为x,则反应的硫酸铁、硫酸锌、硫酸镁为 axmol ,你知道反应比 就可以解出x1年前查看全部
- 硫酸镁溶液到底怎么服用,多长时间有反应?
硫酸镁溶液到底怎么服用,多长时间有反应?
急,我明天跟医生预约做肠镜,医生让我晚8点的时候服用一半硫酸镁溶液,可是我已经喝了有45分钟了,也喝了水,现在怎么一点反应也没有啊,是什么原因?急死我了 守侯羽衣蓝1年前1
守侯羽衣蓝1年前1 -
 ㄘㄠㄎㄌ 共回答了16个问题
ㄘㄠㄎㄌ 共回答了16个问题 |采纳率93.8%最快也得两个小时以后起效,也不是非常巨烈的.只是排软便而已,想快可以喝甘露醇注射液.1年前查看全部
- 向氢氧化钠溶液中滴加几滴金属盐溶液,一定能得到白色沉淀的是氯化钙溶液还是硫酸镁溶液,
向氢氧化钠溶液中滴加几滴金属盐溶液,一定能得到白色沉淀的是氯化钙溶液还是硫酸镁溶液,
氢氧化钙不是白色沉淀吗 divinecom1年前3
divinecom1年前3 -
 律律 共回答了16个问题
律律 共回答了16个问题 |采纳率93.8%两者对比一下,氢氧化镁是难溶的,氢氧化钙是微溶的,所以硫酸镁溶液更有可能!氢氧化钙是石灰水,微溶的,初中的时候,有个实验通入CO2,才产生沉淀CaCO31年前查看全部
- 硫酸镁溶液中加入过量氢氧化钾溶液,最终是白色沉淀吗?
 白沁澜1年前2
白沁澜1年前2 -
 用左手跳舞 共回答了13个问题
用左手跳舞 共回答了13个问题 |采纳率69.2%是.白色的氢氧化镁沉淀1年前查看全部
- 欲除去硫酸镁溶液中的少量硫酸,最好选用( ) A 氢氧化钠 B 氢氧化钡 C 镁 D 氯化镁
 左邻右里11年前4
左邻右里11年前4 -
 张伯阳 共回答了24个问题
张伯阳 共回答了24个问题 |采纳率91.7%C
A氢氧化钠会与硫酸镁反应
B氢氧化钡会与硫酸镁反应
D氯化镁不与硫酸反应1年前查看全部
- 分别将以下物质测定锌和铜的活动性:1)Zn、Cu、稀硫酸;2)Zn、Cu、硫酸镁溶液 3)Zn、Cu、硫酸锌溶液.
 mjfgary1年前2
mjfgary1年前2 -
 znlovejn 共回答了17个问题
znlovejn 共回答了17个问题 |采纳率94.1%选1
Zn+H2SO4=ZnSO4+H2↑,Cu不能反应,证明Zn比Cu活泼.
2都不反应
3都反应1年前查看全部
- 急.或老师进用铜做电极电解硫酸镁溶液,阴极会有气体生成吗?为什么?希望有详写.
 life_source1年前1
life_source1年前1 -
 和风吹雨 共回答了19个问题
和风吹雨 共回答了19个问题 |采纳率94.7%阳极:Cu - 2e- = Cu2+,阴极:2H2O + 2e- = H2↑ + 2OH-,阴极附近溶液:Mg2+ + 2OH- = Mg(OH)2↓1年前查看全部
- 实验室有四瓶失去标签的溶液,现标为A、B、C、D,分别是碳酸钾溶液、氢氧化钠溶液、硫酸镁溶液和稀盐酸中的一种。
实验室有四瓶失去标签的溶液,现标为A、B、C、D,分别是碳酸钾溶液、氢氧化钠溶液、硫酸镁溶液和稀盐酸中的一种。
【提出问题】如何区分出四种溶液?
【进行实验】甲同学取少量A溶液于试管中,加入一定量氢氧化钡溶液,观察到无明显现象,由此甲同学认为A一定不是(1) ,甲同学继续向实验后的溶液中滴加酚酞溶液,酚酞溶液由无色变为红色,则甲同学得出结论:A是氢氧化钠溶液。
【表达与交流】乙同学不同意甲同学的结论,乙同学的理由是(2) 。
于是乙同学另取少量A于试管中,向其中滴加一种试剂是(3) 溶液,观察到的明显现象是(4) ,由此证明了甲同学的结论是错误的,同时确定了A。
同学们继续实验:取B、C、D三种溶液置于试管中,分别依次滴加氯化钡溶液和稀硝酸,观察现象。
【收集证据】观察到C中产生白色沉淀,滴加稀硝酸后,沉淀溶解,产生气泡;D中产生白色沉淀,滴加稀硝酸后,沉淀不溶解;B中无明显现象。
【解释与结论】写出D中发生反应的化学方程式(5) 。
同学们最终通过实验区分出了四种溶液。 可可意义1年前0
可可意义1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 请给出下列化学方程式及现象铝丝浸入硫酸镁溶液中铝丝浸入硫酸铜溶液中铝丝浸入硫酸铝溶液中铝丝浸入硝酸银溶液中
 huangming5211年前1
huangming5211年前1 -
 gg幽竹 共回答了12个问题
gg幽竹 共回答了12个问题 |采纳率75%铝丝浸入硫酸镁溶液中没有明显现象.(无)
铝丝浸入硫酸铜溶液中铝条表面附有一层红铜,直观现象为铝条变红.(化学方程式 2Al+3CuSo4=3Cu+Al2(So4)3 )
铝丝浸入硫酸铝溶液中没有明显现象.
铝丝浸入硝酸银溶液中铝条表面先附有一层白色物质,后迅速变黑.(银被氧化) 化学方程式 Al+3AgNO3=3Ag+Al(NO3)3 ,4Ag+O2=2Ag2O1年前查看全部
- 下列物质中,能和铜反映的是:A.稀硫酸 B.硫酸镁溶液 C.硫酸亚铁溶液 D.氯化铁溶液
下列物质中,能和铜反映的是:A.稀硫酸 B.硫酸镁溶液 C.硫酸亚铁溶液 D.氯化铁溶液
我要反应方程式…… kdjlk23lfjlask1年前1
kdjlk23lfjlask1年前1 -
 qiqi13544191001 共回答了16个问题
qiqi13544191001 共回答了16个问题 |采纳率87.5%D
Cu + 2FeCl3 == CuCl2 + 2FeCl21年前查看全部
- 不用其它试剂,鉴别下列溶液不用其它试剂,鉴别硫酸铜溶液,氢氧化钠溶液,硫酸镁溶液,氯化钠溶液 最好说明下现象
 魔鬼like1年前4
魔鬼like1年前4 -
 现代女孩 共回答了21个问题
现代女孩 共回答了21个问题 |采纳率90.5%硫酸铜溶液,是蓝色的,可以看出来,是第一个鉴别出来的.
硫酸铜溶液导入其他3种溶液,有蓝色沉淀的是NaOH溶液.
NaOH溶液倒入剩下2种溶液,有白色沉淀的是硫酸镁溶液,
剩下的是NaCl1年前查看全部
- 硫酸镁溶液中滴加氢氧化钠溶液,现象是什么?
 火凤曲哲1年前2
火凤曲哲1年前2 -
 jin1 共回答了15个问题
jin1 共回答了15个问题 |采纳率100%溶液中出现白色沉淀
MgCl2+2NaOH=2NaCl+Mg(OH)2↓1年前查看全部
- 有下列七种溶液:A、氢氧化钠溶液;B、氢氧化钡溶液;C、硫酸铝溶液;D、明矾溶液;E、混有少量硝酸的硫酸镁溶液;F、氯化
有下列七种溶液:A、氢氧化钠溶液;B、氢氧化钡溶液;C、硫酸铝溶液;D、明矾溶液;E、混有少量硝酸的硫酸镁溶液;F、氯化铁溶液;任取其中的一种溶液(甲)逐滴加入到另一种溶液(乙)中至过量,观察到自始至终均有白色沉淀.试回答下列问题:
(1)产生上述实验现象的试剂组合有(请用字母代号逐一列出,表格各栏可填满,可不填满,也可补充)
(2)请在下列坐标中作出第1组实验所得沉淀的物质的量(n 沉淀 /mol)随B溶液体积(V B /L)变化的曲线.组别 1 2 3 4 5 6 7 8 甲 B 乙 D
(3)如图是某一组实验中所得沉淀的物质的量(n 沉淀 /mol)随甲溶液中溶质的物质的量(n 甲 /mol)变化的曲线.符合图(右)曲线的试剂组合是:甲______(填化学式)、乙______(填化学式).
 999感冒药1年前1
999感冒药1年前1 -
 接龙822 共回答了20个问题
接龙822 共回答了20个问题 |采纳率95%(1)B(氢氧化钡溶液)+D(明矾溶液) 自始至终都有白色沉淀(BaSO 4 );B(氢氧化钡溶液)+C(硫酸铝溶液) 自始至终都有白色沉淀(BaSO 4 );B(氢氧化钡溶液)+E(混有少量硝酸的硫酸镁溶液) 自始至终都有白色沉淀(BaSO 4 );这三组中的甲、乙两种物质互相交换,又得到3种组合,共有6种组合,另A(氢氧化钠溶液)+E(混有少量硝酸的硫酸镁溶液),将A加入到E中开始没有白色沉淀生成,则有:
组别 1 2 3 4 5 6 7 8
甲 B C B E E D
乙 C B E B A B 故答案为:
组别 1 2 3 4 5 6 7 8
甲 B C B E E D
乙 C B E B A B (2)将氢氧化钡溶液逐滴加入明矾溶液中,当
n[Ba(O H) 2 ]
n[KAl( SO 4 ) 2 ] =
3
2 时,产生沉淀的物质的量最大,此时反应式为:
3Ba(OH) 2 +2KAl(SO 4 ) 2 =3BaSO 4 ↓+2Al(OH) 3 ↓+K 2 SO 4 ;当
n[Ba (OH) 2 ]
n[KAl ( SO 4 ) 2 ] =2 时,产生沉淀的物质的量最小,反应为:
2Ba(OH) 2 +KAl(SO 4 ) 2 =2BaSO 4 ↓+KAlO 2 +2H 2 O;产生1 mol Al(OH) 3 沉淀时需消耗3 mol OH - ,溶解1 mol Al(OH) 3 沉淀时需消耗1 mol OH - ,据此作出图象如下:
,故答案为:
;
(3)甲为Ba(OH) 2 ,乙为HNO 3 和MgSO 4 的混合溶液时,符合给出的图示关系,原理:将Ba(OH) 2 溶液逐滴加入HNO 3 和MgSO 4 的混合溶液中,开始加入的Ba(OH) 2 将HNO 3 中和,产生的沉淀只有BaSO 4 ;等到将HNO 3 完全被中和后再继续滴加Ba(OH) 2 溶液,在产生BaSO 4 沉淀的同时还会产生Mg(OH) 2 沉淀,图象中线的斜率增大(陡度增大);等到溶液中的 完全沉淀后,再继续滴加Ba(OH) 2 溶液,只产生Mg(OH) 2 沉淀,此时图象中直线的斜率变小,当溶液中的Mg 2+ 完全沉淀后,产生的沉淀量保持不变(图象保持水平).
故答案为:Ba(OH) 2 ;HNO 3 和MgSO 41年前
81年前查看全部
- 硫酸镁溶液为什么盐湖中的硫酸镁在盐湖温度降至10摄氏度是都没有析出,而氯化钠则析出?
 云-云1年前1
云-云1年前1 -
 a暗香盈袖a 共回答了12个问题
a暗香盈袖a 共回答了12个问题 |采纳率100%溶解度是随温度的降低而减小的.所以NACL析出.
常温时,硫酸镁的溶解度是54 g.
结晶过程可以看作溶解的反过程,结晶浓度可以认为是饱和浓度,即溶解度
硫酸镁的溶解度(g/100g水):0度25.5,10度30.4,20度35.1,25度37.4,30度39.7,40度44.7,50度50.4,60度54.8,超过70度下降
20摄氏度36g 温度升高溶解度提高 到65度时溶解度最大为54g
所以在65度时重结晶最好1年前查看全部
大家在问
- 1描写大自然的词语
- 2跪求描写山水的优美句子,不要古诗和古诗句!
- 3描写大自然的古诗(不是句子)谢谢了!
- 4写出各种描写雨的成语(至少十个)
- 5“同学们拿着碗争先恐后用飞一般的速度去食堂打饭”这是不是病句?
- 6一束光经凸透镜折射后为什么一定比原来靠近主光轴
- 7请问核辐射是怎么会是啊,为什么生物会死亡和变异啊?
- 8在天底下,一碧千里,而并不茫茫.“并不茫茫”的意思是什么?
- 9儿字 加两笔是什么字?
- 10用一种试剂鉴别氢氧化钡,氯化钾,硫酸
- 11我相信幸运一直伴随着你 英文拼写是怎样的
- 12渃字潮汕音怎么读
- 13岽字的潮汕音怎么读
- 14化学元素周期表背诵口诀谁知道?
- 15今晚天空月圆如镜,繁星满天,多美的夜景啊,这句话错在哪里
