元素周期律和周期表是学习化学的重要工具,下表是元素周期表的部分信息.
 完美你发2022-10-04 11:39:541条回答
完美你发2022-10-04 11:39:541条回答| 1H 1.008 | 2He 4.003 | |||||||
| 3Li 6.974 | 4Be 9.012 | 5B 10.81 | xC 12.01 | 7N 14.01 | 8O 16.00 | 9F 19.00 | 10Ne 20.18 | |
| 11Na 22.99 | 12Mg 24.31 | … … | 13Al 26.98 | ySi 28.09 | 15P 30.97 | 16S 32.06 | 17Cl 35.45 | 18Ar 39.95 |
(1)地壳中含量最多元素的名称是______,该元素原子的质子数为______
(2)从表中查出镁(Mg)元素的相对原子质量为______;
(3)请写出图中x与y的值:x=______,y=______
(4)表中不同种元素最本质的区别是______(填序号):
A.质子数不同B.中子数不同C.相对原子质量不同
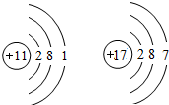
(5)序号为11、17的元素的原子结构示意图如图所示,试根据规律,在右边画出序号为12的原子结构示意图______.

已提交,审核后显示!提交回复
共1条回复
 ymwz 共回答了20个问题
ymwz 共回答了20个问题 |采纳率95%- 解题思路:(1)根据地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝,铁,进行解答;
(2)根据元素周期表提供的信息进行解答;
(3)根据元素周期律:同一周期从左到右原子序数逐渐递增,进行解答;
(4)根据元素是具有相同核电荷数(即核内质子数)的一类原子的总称,不同种元素之间的本质区别是质子数不同,进行解答;
(5)根据题中信息和核外电子层的排布进行解答.(1)根据地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝,铁,可知地壳中含量最多元素的名称是:氧;
从元素周期表中可查出该元素原子的质子数为:8,故答案为:氧;8;
(2)从元素周期表中可查出镁(Mg)元素的相对原子质量为:24.31;故答案为:24.31;
(3)根据元素周期律:同一周期从左到右原子序数依次递增,x介于5与7之间,所以x=6;y介于13 与15 之间,所以y=14;
故答案为:6;14;
(4)根据元素是具有相同核电荷数(即核内质子数)的一类原子的总称,不同种元素之间的本质区别是质子数不同,故选A;
(5)根据题中信息和核外电子层的排布,可知元素序号为12的原子结构示意图为;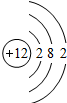 故答案为:
故答案为: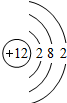 .
.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图;元素的概念.
考点点评: 本题主要考查学生对元素周期表知识的理解与应用及原子结构示意图的书写. - 1年前
相关推荐
- 一道 元素周期律的问题电子层数相同的三种元素X Y Z 已知最高价氧化物对应水化物的酸性 HXO4>H2YO4>H3ZO
一道 元素周期律的问题
电子层数相同的三种元素x y z 已知最高价氧化物对应水化物的酸性 hxo4>h2yo4>h3zo4,则 下列错误的是
a 原子序数 x>y.>z
b 气态***化物稳定性 hx>h2y>zh3
c 非金属性 x>y>z
d 气态***化物的还原性.hx>h2y>zh3
我想要每一个选项都 dd7oaf1年前1
dd7oaf1年前1 -
 danny2apple 共回答了19个问题
danny2apple 共回答了19个问题 |采纳率100%选D.
X:Cl Y:S Z:P
A.正确,原子序数 X>Y>Z
B.正确,气态氢化物稳定性 HX>H2Y>ZH3
C 正确,非金属性 X>Y>Z
D.错误,气态氢化物的还原性.ZH3>H2Y>HX1年前查看全部
- 一个关于元素周期律的问题···形成化合物最多,单质是自然界中硬度最大的物质,气态氢化物中氢的质量分数最大的元素.这是什么
一个关于元素周期律的问题···
形成化合物最多,单质是自然界中硬度最大的物质,气态氢化物中氢的质量分数最大的元素.这是什么元素?
 紫夜蓝雨_5181年前1
紫夜蓝雨_5181年前1 -
 147983273 共回答了18个问题
147983273 共回答了18个问题 |采纳率83.3%自然界中硬度最大的物质是金刚石,也就是碳单质
氢的质量分数最大的气态氢化物是甲烷CH4
所以是碳元素1年前查看全部
- 用元素周期律的知识解释为什么氟的非金属性最强
 小唐VS三星1年前1
小唐VS三星1年前1 -
 老zz僧 共回答了23个问题
老zz僧 共回答了23个问题 |采纳率100%F:原子半径最小,最外层电子数较多(7个,很容易得到一个电子变成稳定结构).1年前查看全部
- 元素周期律的科学阐述及其意义
 qazrfv1年前1
qazrfv1年前1 -
 gangsan 共回答了14个问题
gangsan 共回答了14个问题 |采纳率71.4%内容一:同一周期(稀有气体除外),从左到右,因为原子核电荷数大的对电子的吸引力打,随着原子序数的递增,元素原子的半径递减; 同一族中,从上到下,因为原子电子层数的变化,随着原子序数的递增,元素原子半径递增.内容二:位于同一主族的元素,周期较大的元素金属性强,非金属性弱,根据物理知识猜测原因:核外电子数越多,每个电子受到的作用力越小,就越容易失去电子.位于同一周期的元素,从左到右,随着原子序数的递增,元素的金属性递减,因为核外电子数的增加,元素在电子得失的过程当中更倾向于得到电子.内容三:元素单质的还原性越强,金属性就越 强;单质氧化性越强,非金属性就越强.内容四:最高价氧化物所对应的水化物的酸碱性是非金属性的一种表现,所以他的递变规律与非金属性的递变规律相似:同一周期中,从左到右,随着原子序数的递增,单质的氧化性增强,还原性减弱;所对应的简单阴离子的还原性减弱,简单阳离子的氧化性增强.同一族中,从上到下,随着原子序数的递增,单质的氧化性减弱,还原性增强;所对应的简单阴离子的还原性增强,简单阳离子的氧化性减弱.内容五:单质与氢气化合的难易程度也是非金属性的表现之一,所以可以得出:同一周期中,从左到右,随着原子序数的递增,单质与氢气化合越容易;同一族中,从上到下,随着原子序数的递增,单质与氢气化合越难.内容六:根据非金属性的递变规律,同一周期中,从左到右,随着原子序数的递增,元素气态氢化物的稳定性增强;同一族中,从上到下,随着原子序数的递增,元素气态氢化物的稳定性减弱
【元素周期律的意义】 元素周期律[1]是自然科学的基本规律,也是无机化学的基础.各种元素形成有周期性规律的体系,成为元素周期系,元素周期表则是元素周期系的表现形式.元素周期表是学习和研究化学的一种重要工具.元素周期表是元素周期律的具体表现形式,它反映了元素之间的内在联系,是对元素的一种很好的自然分类.我们可以利用元素的性质、它在周期表中的位置和它的原子结构三者之间的密切关系来指导我们对化学的学习研究.过去,门捷列夫曾用元素周期律来预言未知元素并获得了证实.此后,人们在元素周期律和周期表的指导下,对元素的性质进行了系统的研究,对物质结构理论的发展起了一定的推动作用.不仅如此,元素周期律和周期表为新元素的发现及预测它们的原子结构和性质提供了线索.元素周期律和周期表对于工农业生产也有一定的指导作用.由于在周期表中位置靠近的元素性质相近,这样就启发了人们在周期表中一定的区域内寻找新的物质.元素周期律的重要意义,还在于它从自然科学方面有利地论证了事物变化中量变引起质变的规律性.元素周期律和周期表,揭示了元素之间的内在联系,反映了元素性质与它的原子结构的关系,在哲学、自然科学、生产实践各方面,都有重要意义.(1)在哲学方面,元素周期律揭示了元素原子核电荷数递增引起元素性质发生周期性变化的事实,从自然科学上有力地论证了事物变化的量变引起质变的规律性.元素周期 表是周期律的具体表现形式,它把元素纳入一个系统内,反映了元素间的内在联系,打破了曾经认为元素是互相孤立的形而上学观点.通过元素周期律和周期表的学 习,可以加深对物质世界对立统一规律的认识.(2)在 自然科学方面,周期表为发展物质结构理论提供了客观依据.原子的电子层结构与元素周期表有密切关系,周期表为发展过渡元素结构,镧系和锕系结构理论,甚至 为指导新元素的合成,预测新元素的结构和性质都提供了线索.元素周期律和周期表在自然科学的许多部门,首先是化学、物理学、生物学、地球化学等方面,都是 重要的工具.(3)在生产上的某些应用 由于在周期表中位置靠近的元素性质相似,这就启发人们在周期表中一定的区域内寻找新的物质.1年前查看全部
- 元素周期律问题1、为什么与水反应最剧烈的非金属是氟?我是这样想的:金属性越强,与水反应越剧烈.在同一周期中,金属性从左到
元素周期律问题
1、为什么与水反应最剧烈的非金属是氟?
我是这样想的:金属性越强,与水反应越剧烈.在同一周期中,金属性从左到右递减,而氟恰恰是第二周期最靠右的元素,因此金属性应该最弱,与水反应应该最不剧烈(与事实相反).请问哪里错了?
2、N和S的非金属性哪个强?
我是这样想的:O比N强,但它也比S强,这不是不能比较了吗?类似的,Na与Ca的原子半径哪个大,怎么比较?
3、怎么按元素周期律寻找既能溶于强酸又能溶于强碱的氧化物? 江南六饼1年前1
江南六饼1年前1 -
 jianqing88 共回答了19个问题
jianqing88 共回答了19个问题 |采纳率100%1.对于金属来说,金属性越强,与水反应越剧烈.但氟是非金属,不遵从这个规则.因为金属与水反应是被氧化,而F2与水反应是被还原.2H2O+2F2=4HF+O2 所以本身二者不具有类比性
2.可以看气态氢化物稳定性,NH3更稳定,所以N非金属性更强.Ca的原子半径比Na大,因为不同周期数对原子半径的影响更大.
3.在周期表上金属与非金属元素的交界处可以找到两性氧化物.1年前查看全部
- 氢氧化锂和氢氧化铯谁的碱性强?根据元素周期律回答
 twtmm1年前4
twtmm1年前4 -
 爱上哭泣的沙漠 共回答了24个问题
爱上哭泣的沙漠 共回答了24个问题 |采纳率100%氢氧化铯碱性强
锂<钠<钾<铷<铯这五个还原性依次增强.氢氧化物碱性也依次增强1年前查看全部
- 元素周期律中对角线规律,说元素性质有相似之处,是化学性质相似还是物理性质相似?或者都相似?
 bapgfudng1年前2
bapgfudng1年前2 -
 fengge521 共回答了25个问题
fengge521 共回答了25个问题 |采纳率84%主要是指化学性质相似.如:
Li Be B C
Na Mg Al Si
Li Mg 均可以在N2中燃烧
Be Al 均可形成双聚氯化物
B Si 均可与碱发生反应1年前查看全部
- 元素周期律题X,Y.Z为三个不同短周期非金属的单质.在一定条件下有如下反应;Y+X-->A(气),Y+Z-->B(气)1
元素周期律题
X,Y.Z为三个不同短周期非金属的单质.在一定条件下有如下反应;Y+X-->A(气),Y+Z-->B(气)
1.常温下X.Y.Z均为气体,且A和B化合生成固体C是有白烟.则Y的化学式为--
固体C的化学方程式--
2.若常温下Y为固体,X.Y为气体,A在空气中充分燃烧可生成B.则B的化学式.
向苛性钠中通入过量A,反应离子方程式---将Y与1中某单质的水溶液充分反应可生成两种强酸,该反应方程式为-- lzj30001年前1
lzj30001年前1 -
 leekr001 共回答了23个问题
leekr001 共回答了23个问题 |采纳率91.3%在常温下的Y好 现在的XY不一样,因为Y是固体,而在燃烧的A生成了B体A在空气中扩散可苛性了钠中过量的A,这样就 会产生两种强酸的气体.
则是 X+Y-->y(气) A+B--1年前查看全部
- 运用元素周期律分析下面的推断,其中错误的是( )
运用元素周期律分析下面的推断,其中错误的是( )
A. 铍(Be)的氧化物的水化物可能具有两性
B. 砹(At2)为有色固体;HAt不稳定;AgAt感光性很强,不溶于水也不溶于稀酸
C. 硫酸锶(SrSO4)是难溶于水的白色固体
D. 硒化氢(H2Se)是比H2S稳定的气体 嘴巴鱼1年前3
嘴巴鱼1年前3 -
 li6211 共回答了9个问题
li6211 共回答了9个问题 |采纳率88.9%解题思路:A.根据元素周期表中对角线规则知处于对角线的元素具有相似性;
B.同主族元素性质具有相似性;
C.同主族元素性质具有相似性;
D.元素的非金属性越强,其氢化物的稳定性越强.A.元素周期表中Be和Al处于对角线位置上,处于对角线的元素具有相似性,所以BeO、Be(OH)2可能均有两性,故A正确;
B.同一主族元素具有相似性,所以卤族元素性质具有相似性,根据元素的性质、氢化物的性质、银盐的性质可推知砹(At)为有色固体,HAt不稳定,AgAt感光性很强,且不溶于水也不溶于稀酸,故B正确;
C.同主族元素性质具有相似性,钡和锶位于同一主族,性质具有相似性,硫酸钡是不溶于水的白色物质,所以硫酸锶也是不易溶于水的白色物质,故C正确;
D.S和Se位于同一主族,且S元素的非金属性比Se强,所以H2S比H2Se稳定,故D错误;
故选D.点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题考查同主族元素的性质的相似性和递变性,题目难度不大,注意把握元素周期律的递变性和相似性.1年前查看全部
- 运用元素周期律分析下面的推断正确的是( )
运用元素周期律分析下面的推断正确的是( )
A. 铍(Be)是一种轻金属,它的氧化物的水化物可能具有两性
B. 砹单质是一种有色固体,砹化氢很不稳定,砹化银是难溶于水的白色沉淀
C. 硫酸锶难溶于水,但易溶于盐酸
D. 硒化氢是无色、有毒、比硫化氢稳定的气体 李大伟1年前1
李大伟1年前1 -
 Gter 共回答了19个问题
Gter 共回答了19个问题 |采纳率84.2%解题思路:A.根据对角线规则判断;
B.同主族元素的性质具有相似性和递变性以及同主族从上到下元素的非金属性减弱,氢化物稳定性逐渐减弱;
C.同主族元素的性质具有相似性;
D.同主族元素的原子,从上到下氢化物的稳定性逐渐减弱.解;A.Be和Al位于对角线位置,对应的单质、化合物的性质相似,则铍(Be)是一种轻金属,它的氧化物的水化物可能具有两性,故A正确;
B.砹(At)属于卤素单质,从上到下氢化物稳定性逐渐减弱,单质由气体过渡为固体,所以At为有色固体,HAt不稳定,有AgCl、AgBr、AgI颜色逐渐加深可知AgAt应为有色固体,故B错误;
C.锶与钡是同主族元素,BaSO4是难溶于水的白色固体,所以SrSO4也是难溶于水的白色固体,且不溶于酸,故C错误;
D.硒和硫为同主族元素,同主族元素的原子,从上到下氢化物的稳定性逐渐减弱,硒化氢(H2Se)比硫化氢稳定性差,故D错误.
故选A.点评:
本题考点: 同一主族内元素性质递变规律与原子结构的关系;元素周期表的结构及其应用;元素周期律的作用.
考点点评: 本题考查同主族元素的性质的相似性和递变性,题目难度不大,注意把握元素周期律的递变性和相似性.1年前查看全部
- 运用元素周期律分析下面的推断,其中错误的是
运用元素周期律分析下面的推断,其中错误的是
A. 砹(85号元素)是一种有色固体,HAt应该不稳定,且AgAt是有色难溶于水固体 B. 铍(Be)是一种金属,它的氧化物的水化物可能具有两性 C. 硫酸锶(SrSO4)是难溶于水和盐酸的的白色固体 D. 硒化氢(H2Se)是无色、有毒、比H2S稳定的气体 自由空间09311年前1
自由空间09311年前1 -
 诚管天下 共回答了20个问题
诚管天下 共回答了20个问题 |采纳率90%答案D 同主族元素自上而下非金属性逐渐减弱,所以相应氢化物的稳定性逐渐减弱.即H2S比H2Se稳定,答案是D.查看原帖1年前查看全部
- 奠定现代化学基础的是:A原子论和分子学说的建立 B元素周期表和元素周期律的发现 C火的发现和使用
 朝阳幽菊1年前3
朝阳幽菊1年前3 -
 libingyun 共回答了15个问题
libingyun 共回答了15个问题 |采纳率86.7%道尔顿和阿伏伽德罗等科学家的研究,创立了原子论和分子学说,奠定了近现代化学的基础1年前查看全部
- 关于元素周期律的一道题A、B、C、D四种周期元素的原子半径:D>C>A>B.已知A、B同周期,A、C同主族,C原子核内的
关于元素周期律的一道题
A、B、C、D四种周期元素的原子半径:D>C>A>B.已知A、B同周期,A、C同主族,C原子核内的质子数等于A、B原子核内的质子数之和,C原子最外层电子数是D原子最外层电子数的3倍.下列说法正确的是:
A、 A、C两元素位于元素周期表中的第VIA族
B、 C元素的氧化物可与D元素的最高价氧化物对应的水化物反应
C、 A、C两元素形成的最高价氧化物对应水化物的酸性C>A
D、 B、C、D三种元素的简单离子半径:C>D>B
要说明为什么 NND如花1年前1
NND如花1年前1 -
 东北唐唐 共回答了20个问题
东北唐唐 共回答了20个问题 |采纳率85%推断
A:氧O(质子数为8)
B:硼B(质子数为5)
C:铝Al(质子数为13,最外层电子数为3)
D:钾K(最外层电子数为1)
(同周期元素,原子序数大的元素,半径越小;同主族元素原子序数大的半径大)
答案:(B)Al2O3是两性氧化物,溶于酸也溶于碱
PS:如果正确请采纳并给分1年前查看全部
- 元素周期律这一章的题反应向正反映方向移动,反应物浓度一定降低.这句话为什么不对?
 emily09301年前2
emily09301年前2 -
 feidao1024 共回答了16个问题
feidao1024 共回答了16个问题 |采纳率75%假如在密闭容器中进行的反应,增大压强(就是缩小体积),那么反应向正反应方向移动,但反应物浓度一定增加
因为体积缩小对浓度的影响远大于反应向正反应方向移动对浓度的影响
假如投入更多反应物,那么平衡移动只多消耗一点反应物,浓度肯定增大
要使浓度减小,反应又向正向进行,可以改变温度或减小生成物的浓度1年前查看全部
- 氢氟酸为什么是弱酸,根据元素周期律,不是应该是强酸吗?
 encroger1年前2
encroger1年前2 -
 hiltonee 共回答了12个问题
hiltonee 共回答了12个问题 |采纳率100%因为F的半径很小,与H原子会紧紧结合在一起,难以电离,所以是HF是弱酸.1年前查看全部
- 帮忙提供一些关于高一化学下册《物质结构,元素周期律》的题,含标准答案.
 naviee1年前1
naviee1年前1 -
 飞着的狐狸 共回答了15个问题
飞着的狐狸 共回答了15个问题 |采纳率73.3%周期表计准了,适当随便的题目都可以1年前查看全部
- 元素周期律是元素原子核外电子排布周期性变化的结果,这句话为什么不对?
 摇滚垃圾1年前1
摇滚垃圾1年前1 -
 navynavys 共回答了19个问题
navynavys 共回答了19个问题 |采纳率78.9%素周期律(Periodic law),指元素的性质随着元素的原子序数(即原子核外电子数或核电荷数)的增加呈周期性变化的规律.周期律的发现是化学系统化过程中的一个重要里程碑.1年前查看全部
- 元素周期律请进来的高手帮忙讲一下电离能与电负性怎样比较元素的第二电离能
 汀溪兰香A1年前2
汀溪兰香A1年前2 -
 eckx6j 共回答了12个问题
eckx6j 共回答了12个问题 |采纳率83.3%电离能(I)
基态的气态原子失去一个电子形成气态一价正离子时所需能量称为元素的第一电离能(I1).元素气态一价正离子失去一个电子形成气态二价正离子时所需能量称为元素的第二电离能(I2).第三、四电离能依此类推,并且I1<I2<I3….由于原子失去电子必须消耗能量克服核对外层电子的引力,所以电离能总为正值,SI单位为J• mol-1,常用kJ•mol-1.通常不特别说明,指的都是第一电离能.
电离能可以定量的比较气态原子失去电子的难易,电离能越大,原子越难失去电子,其金属性越弱;反之金属性越强.所以它可以比较元素的金属性强弱.影响电离能大小的因素是:有效核电荷、原子半径、和原子的电子构型.
(1)同周期主族元素从左到右作用到最外层电子上的有效核电荷逐渐增大,电离能也逐渐增大,到稀有气体由于具有稳定的电子层结构,其电离能最大.故同周期元素从强金属性逐渐变到非金属性,直至强非金属性.
(2)同周期副族元素从左至右,由于有效核电荷增加不多,原子半径减小缓慢,有电离能增加不如主族元素明显.由于最外层只有两个电子,过渡元素均表现金属性.
(3)同一主族元素从上到下,原子半径增加,有效核电荷增加不多,则原子半径增大的影响起主要作用,电离能由大变小,元素的金属性逐渐增强.
(4)同一副族电离能变化不规则.
电负性
周期表中各元素的原子吸引电子能力的一种相对标度 .又称负电性.元素的电负性愈大,吸引电子的倾向愈大,非金属性也愈强.电负性的定义和计算方法有多种,每一种方法的电负性数值都不同,比较有代表性的有3种:
① L.C.鲍林提出的标度.根据热化学数据和分子的键能,指定氟的电负性为3.98,计算其他元素的相对电负性.
②R.S.密立根从电离势和电子亲合能计算的绝对电负性.
③A.L.阿莱提出的建立在核和成键原子的电子静电作用基础上的电负性.利用电负性值时,必须是同一套数值进行比较.
电负性综合考虑了电离能和电子亲合能,首先由莱纳斯·鲍林于1932年提出.它以一组数值的相对大小表示元素原子在分子中对成键电子的吸引能力,称为相对电负性,简称电负性.元素电负性数值越大,原子在形成化学键时对成键电子的吸引力越强.
同一周期从左至右,有效核电荷递增,原子半径递减,对电子的吸引能力渐强,因而电负性值递增;同族元素从上到下,随着原子半径的增大,元素电负性值递减.过渡元素的电负性值无明显规律.就总体而言,周期表右上方的典型非金属元素都有较大电负性数值,氟的电负性值数大(4.0);周期表左下方的金属元素电负性值都较小,铯和钫是电负性最小的元素(0.7).一般说来,非金属元素的电负性大于2.0,金属元素电负性小于2.0.
电负性概念还可以用来判断化合物中元素的正负化合价和化学键的类型.电负性值较大的元素在形成化合物时,由于对成键电子吸引较强,往往表现为负化合价;而电负性值较小者表现为正化合价.在形成共价键时,共用电子对偏移向电负性较强的原子而使键带有极性,电负性差越大,键的极性越强.当化学键两端元素的电负性相差很大时(例如大于1.7)所形成的键则以离子性为主.
常见元素电负性(鲍林标度)
氢 2.2 锂 0.98 铍 1.57 硼 2.04 碳 2.55 氮 3.04 氧 3.44 氟 3.98
钠 0.93 镁 1.31 铝 1.61 硅 1.90 磷 2.19 硫 2.58 氯 3.16
钾 0.82 钙 1.00 锰 1.55 铁 1.83 镍 1.91 铜 1.9 锌 1.65 镓 1.81 锗 2.01 砷 2.18 硒 2.48 溴 2.96
铷 0.82 锶 0.95 银 1.93 碘 2.66 钡 0.89 金 2.54 铅 2.331年前查看全部
- 我想知道所有的元素周期律特例,就是实际情况与元素周期律不符合的,如金属性中Sn>Pb
我想知道所有的元素周期律特例,就是实际情况与元素周期律不符合的,如金属性中Sn>Pb
应用的知识…… 83汽水糖1年前1
83汽水糖1年前1 -
 zppig-008 共回答了18个问题
zppig-008 共回答了18个问题 |采纳率100%碱金属元素中钠比钾的密度大
卤族元素中除氟外与水反应都生成卤化氢和次卤酸
氮族,氧族和卤族元素对应的氢化物的熔沸点依次升高,除了氨气,水和氟化氢
就只知道这些了
知识储备有限...1年前查看全部
- 运用元素周期律分析下面的推断,其中不正确的是( )
运用元素周期律分析下面的推断,其中不正确的是( )
A. 锂(Li)与水反应比钠与水反应剧烈
B. 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸
C. 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂
D. HBrO4的酸性比HIO4的酸性强 第3杯咖啡1年前1
第3杯咖啡1年前1 -
 不想伤害你的我 共回答了20个问题
不想伤害你的我 共回答了20个问题 |采纳率80%解题思路:A.元素的金属性越强,对应的单质与水反应越剧烈;
B.根据同主族元素的性质相似性分析;
C.根据同主族元素的性质的相似性和递变性分析;
D.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强.A.金属性:Na>Li,元素的金属性越强,对应的单质与水反应越剧烈,则钠与水反应比锂与水反应剧烈,故A错误;
B.卤族元素的单质从上到下颜色逐渐加深,则砹(At)为有色固体,卤族元素单质的卤化银都不溶于水也不溶于硝酸,故B正确;
C.碱金属元素从上到下元素的金属性逐渐增强,对应的单质与氧气反应的产物有氧化物、过氧化物、超氧化物等,越来越复杂,故C正确;
D.非金属性:Br>I,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则HBrO4的酸性比HIO4的酸性强,故D正确.
故选A.点评:
本题考点: 同一主族内元素性质递变规律与原子结构的关系;元素周期律的作用.
考点点评: 本题考查同主族元素的性质的相似性和递变性,题目难度不大,注意把握元素周期律的递变性和相似性.1年前查看全部
- 关于元素周期律和元素周期表的下列说法,正确的是( )
关于元素周期律和元素周期表的下列说法,正确的是( )
A.目前发现的所有元素占据了周期表里全部位置,不可能再有新的元素被发现
B.元素的性质随着原子序数的增加而呈周期性变化
C.俄国化学家道尔顿为元素周期表的建立做出了巨大的贡献
D.同一主族的元素从上到下,金属性呈周期性变化 zhenyu11年前1
zhenyu11年前1 -
 路口_ww 共回答了19个问题
路口_ww 共回答了19个问题 |采纳率94.7%解题思路:A.元素周期表没有填满,还可以再发现新的元素;
B.原子最外层电子数决定元素的性质;
C.俄国化学家门捷列夫对元素周期表做出了巨大贡献;
D.同一主族的元素从上到下,金属性逐渐增强.A.随着科学技术的发展,人们可以不断合成一些元素,元素周期表中元素的种类在不断的增加,故A错误;
B.原子最外层电子数决定元素的性质,元素周期表中元素的核外电子排布呈周期性变化,则元素性质呈周期性变化,故B正确;
C.俄国化学家门捷列夫对元素周期表做出了巨大贡献,而不是道尔顿,故C错误;
D.同一主族的元素从上到下,金属性逐渐增强,而不是周期性变化,故D错误.
故选B.点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题考查元素周期律与元素周期律知识,题目难度不大,注意相关基础知识的积累.1年前查看全部
- 首先发现元素周期表和元素周期律的是谁
 今看红日1年前3
今看红日1年前3 -
 雨水109 共回答了20个问题
雨水109 共回答了20个问题 |采纳率85%德米特里·门捷列夫,19世纪俄国化学家,他发现了元素周期律,并就此发表了世界上第一份元素周期1年前查看全部
- 根据元素周期表和元素周期律的有关知识,下列叙述正确的是( )
根据元素周期表和元素周期律的有关知识,下列叙述正确的是( )
A.碱金属从锂到铯与水反应的剧烈程度逐渐减弱
B.卤族元素的单质与氢气反应都需要加热或光照条件
C.碱金属的活泼性(从锂到铯)依次增强,卤族元素单质(从F2到I2)的活泼性却相反
D.VIA元素的非金属性比VIIA弱 rpjupkr1年前1
rpjupkr1年前1 -
 陌染 共回答了23个问题
陌染 共回答了23个问题 |采纳率91.3%解题思路:A、金属性越强,与水反应越剧烈;
B、非金属性越强,与氢气化合越容易;
C、同主族从上到下元素的金属性在增强,非金属性在减弱;
D、同周期,元素的非金属性从左向右逐渐增强.A、碱金属从锂到铯,金属性在增强,则与水反应的剧烈程度逐渐增强,故A错误;
B、非金属性越强,与氢气化合越容易,F2与氢气在暗处就能反应,故B错误;
C、由同主族性质变化规律可知,碱金属的活泼性(从锂到铯)依次增强,族元素单质(从F2到I2)的活泼性依次减弱,故C正确;
D、同周期时,VIA元素的非金属性比VIIA弱,如不在同周期,则不一定正确,如O的非金属性大于Cl,故D错误;
故选C.点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题考查元素周期表和元素周期律,熟悉元素的性质变化规律是解答本题的关键,难度不大.1年前查看全部
- 元素周期律是学习和研究化学的重要工具.下表是元素周期表的部分信: 1 H
元素周期律是学习和研究化学的重要工具.下表是元素周期表的部分信:
认真分析信息,回答:1 H
氢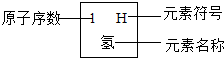
2 He
氦3 Li
锂4 Be
铍5 B
硼6 C
碳7 N
氮8 O
氧9 F
氟10 Ne
氖11 Na
钠12 Mg
镁13 Al
铝14 Si
硅15 P
磷16 S
硫X Cl
氯18 Ar
氩19 K
钾20 Ca
钙…
(1)分析上表规律,可推知,表中X=______;
(2)地壳中含量最多的金属元素的原子核内质子数是______,该元素的氧化物化学式为______.
(3)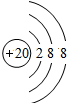 表示的是(写粒子符号)______.
表示的是(写粒子符号)______.
(4)实验证明:在上表同一横行中,从左到右,原子失去电子的能力逐渐减弱,得电子能力逐渐增强;同一纵行中,从上到下,原子失去电子的能力逐渐增强,得电子能力逐渐减弱.则上图元素中失去电子能力最强的元素原子是______(填原子符号,下同),得电子能力最强的元素原子是______. c登录名1年前1
c登录名1年前1 -
 蒸发的血 共回答了21个问题
蒸发的血 共回答了21个问题 |采纳率100%解题思路:根据地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝,铁,同一周期元素从左到右原子序数逐渐递增,在表同一横行中,从左到右,原子失去电子的能力逐渐减弱,得电子能力逐渐增强;同一纵行中,从上到下,原子失去电子的能力逐渐增强,得电子能力逐渐减弱,进行分析解答本题.(1)分析表中规律同一周期元素从左到右原子序数逐渐递增,X介于16和18之间,可推知,表中X=17;故答案为:17;
(2)地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝,铁,由此可知含量最多的金属元素是铝,它的原子核内质子数从元素周期表中可查得是13,氧化物化学式为 Al2O3,故答案为:13;Al2O3;
(3)根据粒子的结构示意图可知质子数=20>核外电子数=18,由此可知该原子失去2个电子,粒子符号为Ca2+,故选Ca2+;
(4)根据在表同一横行中,从左到右,原子失去电子的能力逐渐减弱,得电子能力逐渐增强;同一纵行中,从上到下,原子失去电子的能力逐渐增强,得电子能力逐渐减弱.则元素中失去电子能力最强的元素原子是 K,得电子能力最强的元素原子是 F,故答案为:K;F.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图;地壳中元素的分布与含量;化学式的书写及意义.
考点点评: 本题可查学生根据地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝,铁,同一周期元素从左到右原子序数逐渐递增,在表同一横行中,从左到右,原子失去电子的能力逐渐减弱,得电子能力逐渐增强;同一纵行中,从上到下,原子失去电子的能力逐渐增强,得电子能力逐渐减弱,进行分析解题的能力.1年前查看全部
- (2010•淮北模拟)最早发现元素周期律并编制出元素周期表的科学家是( )
(2010•淮北模拟)最早发现元素周期律并编制出元素周期表的科学家是( )
A.拉瓦锡
B.门捷列夫
C.道尔顿
D.阿弗加德罗 pjp20001年前1
pjp20001年前1 -
 layabout098 共回答了14个问题
layabout098 共回答了14个问题 |采纳率92.9%解题思路:根据科学家们各自做出的贡献来考虑本题.A、拉瓦锡首先通过实验验证出空气是由氮气和氧气组成的结论;
B、门捷列夫发现元素周期律并编制出元素周期表;
C、道尔顿提出了近代原子学说;
D、阿弗加德罗提出了分子与原子的区别.
故选B点评:
本题考点: 化学的历史发展过程.
考点点评: 熟记化学发展史中各科学家所作出的巨大贡献.1年前查看全部
- 元素周期律和周期表是学习化学的重要工具,下表是元素周期表的部分信息 请认真分析表中信息,回答下列问题:
元素周期律和周期表是学习化学的重要工具,下表是元素周期表的部分信息 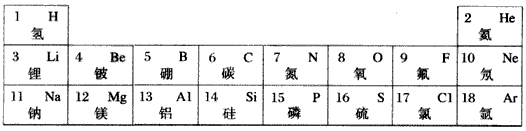
请认真分析表中信息,回答下列问题:
(1)空气中含量最多的元素名称是 ,该元素原子的质子数为 。
(2) 所表示的粒子符号为 ,它的最外层电子数为 。
所表示的粒子符号为 ,它的最外层电子数为 。
(3)由原子序数为8和13的两种元素组成的化合物是 (写化学式)。
(4)元素周期表同一横行元素的排列规律是从左至右 。 jing76041年前1
jing76041年前1 -
 距离仙境10米 共回答了13个问题
距离仙境10米 共回答了13个问题 |采纳率107.7%(1)N;7
(2)S;6
(3)A1 2 O 3
(4)原子序数(核电荷数)依次增大、(或由金属逐渐过渡到非金属)(合理即可)1年前查看全部
- 根据原子结构的有关知识和元素周期律,思考并回答有关114号元素的几个问题.
根据原子结构的有关知识和元素周期律,思考并回答有关114号元素的几个问题.
(1)原子核外有几个电子层?最外层电子数可能是多少?
(2)它在周期表中位于第几周期、第几族?
(3)它属于金属元素还是非金属元素?
元素周期表翻的到我还问? zhulieyie1年前2
zhulieyie1年前2 -
 白无常和黑无常 共回答了17个问题
白无常和黑无常 共回答了17个问题 |采纳率88.2%翻元素周期表,不就知道了1年前查看全部
- 第五章 物质结构 元素周期律4.将原子里具有相同的 和 的中子数的 元素的原子互称为同位素.5.平常所说的某种元素的原子
第五章 物质结构 元素周期律
4.将原子里具有相同的 和 的中子数的
元素的原子互称为同位素.
5.平常所说的某种元素的原子量,是 .
计算公式:M= .
6.核外电子的分层排布规律:
首先,各电子层最多容纳的电子数目 ,即K层为 个,L层
个,其次,最外层电子数目不超过 (K层为最外层不超过 个),第三,次外层电子数不超过 个,倒数第三层电子数目不超过 个.
7.能量最低原理,就是核外电子总是尽先排布在能量 低的电子层里,然后再由 往 依次排布在能量逐步 高的电子层里.
8.写出下列元素的原子或离子的结构示意图:氢离子 硫
氮 氯离子 磷 碳 钠离子 .
9.元素周期律,是指 .
元素性质的周期性变化是 必然结果.
10.从原子结构的观点看,元素周期表中同一横行的短周期元素,其 相同,不同;同一纵行的主族元素,其 相同,不同.
11.元素周期表分 个周期,第1、2、3周期为 周期,元素种类依次为 ;第4、5、6周期为 周期,元素种类依次为 ;第7周期为 周期,目前有种 元素,如果全部排满是 种元素.
12.元素周期表中有 个纵行,分为 个族,其中 个主族 个副族,还有 族和 族.
13.除第一和第七周期外,每一周期的元素都是从 元素开始,以 结束.
14.同周期元素性质的递变
同一周期元素从左到右(除稀有气体外),随核电荷数依次 ,原子半径逐渐 ,原子核对最外层电子的吸引力逐渐 ,原子失电子的能力逐渐 ,得电子的能力逐渐 ,因此,元素的金属性逐渐 ,非金属性逐渐 .
表现在:元素的最高价氧化物对应水化物的碱性逐渐 ,酸性逐渐 ;元素单质与氢气化合的能力逐渐 ,形成气态氢化物的稳定性逐渐 . 浅浅水树1年前1
浅浅水树1年前1 -
 moyuzaizai 共回答了11个问题
moyuzaizai 共回答了11个问题 |采纳率72.7%4.将原子里具有相同的 质子数 和 不同的 的中子数的 同种
元素的原子互称为同位素.
6.核外电子的分层排布规律:
首先,各电子层最多容纳的电子数目 ,即K层为 2 个,L层 8
个,其次,最外层电子数目不超过 8 (K层为最外层不超过 2 个),第三,次外层电子数不超过 8 个,倒数第三层电子数目不超过 18 个
9.课本上有
10.从原子结构的观点看,元素周期表中同一横行的短周期元素,其 电子层数 相同, 最外层电子数 不同;同一纵行的主族元素,其 最外层电子数 相同, 电子层数 不同.
11.元素周期表分 7 个周期,第1、2、3周期为 短 周期,元素种类依次2,8,8为 ;第4、5、6周期为 长 周期,元素种类依次为 18,18,32 ;第7周期为 不完全 周期,目前有种 27 元素,如果全部排满是 32 种元素.
12.元素周期表中有 18 个纵行,分为 16 个族,其中 7 个主族 7 个副族,还有 第Ⅷ 族和 0 族.
13.除第一和第七周期外,每一周期的元素都是从 金属 元素开始,以 非金属 结束.
14.同周期元素性质的递变
同一周期元素从左到右(除稀有气体外),随核电荷数依次 增大 ,原子半径逐渐 减小 ,原子核对最外层电子的吸引力逐渐 ,原子失电子的能力逐 减弱渐 ,得电子的能力逐渐 增强 ,因此,元素的金属性逐渐 减弱 ,非金属性逐渐 增强 .
表现在:元素的最高价氧化物对应水化物的碱性逐渐 减弱 ,酸性逐渐 增强 ;元素单质与氢气化合的能力逐渐 增强 ,形成气态氢化物的稳定性逐增强渐 .1年前查看全部
- 高一化学必修二第一章规律总结就是元素周期律,周期表那些递变性,比较稳定性,酸性…越全越好,
 chenkesheng1年前1
chenkesheng1年前1 -
 _小猪鲁鲁_ 共回答了15个问题
_小猪鲁鲁_ 共回答了15个问题 |采纳率93.3%主族元素同一周期中,元素的碱性从左到右递减,酸性从左到右递增,原子半径随着原子序数的增加而减小.在同一族中,元素的碱性从上到下递增,酸性从上到下递减,原子半径随着原子序数的增加而增大.1年前查看全部
- 元素周期表同主族同周期元素性质递变规律和元素周期律的内容及实质是什么?
 咸菜691年前1
咸菜691年前1 -
 玄水 共回答了24个问题
玄水 共回答了24个问题 |采纳率83.3%同周期元素,从左至右金属性递减,非金属性递增.同主族元素从上之下金属性逐渐增强,非金属性逐渐渐弱1年前查看全部
- 下列说法中正确的是( )A. 元素周期律的本质是随着核荷数的增加元素化合价呈周期性的变化B. 核外电子排布的周期性变化
下列说法中正确的是( )
A. 元素周期律的本质是随着核荷数的增加元素化合价呈周期性的变化
B. 核外电子排布的周期性变化是元素性质周期性变化的本质
C. 元素周期表中可以把元素分成s、p、d、f四个区
D. 最外层电子数≤2的元素一定是金属元素 hotoppo1年前1
hotoppo1年前1 -
 vbox 共回答了22个问题
vbox 共回答了22个问题 |采纳率100%解题思路:A.元素的化学性质取决于其价层电子数,结构决定性质;
B.元素的化学性质取决于其价层电子数,结构决定性质;
C.元素周期表中可以把元素分成5个区;
D.元素周期表中最外层电子数≤2的元素不一定是金属元素.A.元素周期律的实质是随着原子序数的递增,元素原子最外层电子排布呈周期性的变化,故A错误;
B.元素周期律的实质是随着原子序数的递增,元素原子最外层电子排布呈周期性的变化,故B正确;
C.元素周期表中,按电子排布,可把周期表中元素分为s、p、d、f、ds五个区,除ds区外,区的名称来自构造原理最后填入电子的能级的符号,故C错误;
D.元素周期表中最外层电子数≤2的元素不一定是金属元素,如H、He元素都是非金属元素,故D错误;
故选B.点评:
本题考点: 元素周期律的作用.
考点点评: 本题考查元素周期律及元素周期表的结构,明确元素周期律的实质,知道元素周期表五区的划分标准,难度不大.1年前查看全部
- 与元素周期律有关的相关问题1、如何比较同周期或同主族元素单质熔点如:碳、硅;2、稀硝酸有挥发性吗?3、如何比较对角线上(
与元素周期律有关的相关问题
1、如何比较同周期或同主族元素单质熔点如:碳、硅;
2、稀硝酸有挥发性吗?
3、如何比较对角线上(从左上到右下方)元素的金属性或非金属性,如N和s;铝和锗
4金属性与金属的活泼性有何区别?(为什么金属性中钠大于钙而活泼性中钙大于钠(根据金属活动顺序表))
5、原子核对核外电子吸引力如何判断?(如电子层数不同如氢和氯) 肖锋朗1年前2
肖锋朗1年前2 -
 13494 共回答了21个问题
13494 共回答了21个问题 |采纳率81%1:单质的熔点
(1)同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,非金属单质的熔点递减;
(2)同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增
2:不具有,盐酸具有挥发性,硝酸易分解.
3:对角线原则是指某些相邻两个主族上下相差一个周期的元素之间性质显示出的规律性的相似
比如锂和镁,钠和钙,铍和铝,氧和氯等
4:金属性常表示元素的原子失去电子的倾向;元素的非金属性是指元素的原子得电子的能力.
金属性比较规律:1、由金属活动性顺序表进行判断.1年前查看全部
- 关于元素周期律化合价最高最低问题
关于元素周期律化合价最高最低问题
1)知道最外层电子数,如何求得最高正化合价,最低负化合价?
2)怎么知道最高价氧化物或气态氢化物,分析一下原理,比如S P O等
3)如何最低最高价氧化物对应水化物的化学式? win16971年前5
win16971年前5 -
 美食ww1 共回答了18个问题
美食ww1 共回答了18个问题 |采纳率83.3%1、一般来说,金属元素的最外层电子数等于最高正价,没有负价,非金属元素的最外层电子等于最高正价,最低负价为最外层电子数减去8,有些没有正价,
2、S的最外层电子数为6,为-2,+6价,H为+1价,所以为H2S,SO3,P的最外层电子数为5,为-3,+5价,所以为H3P,P2O5,
3、确定化合价了就很好写了,比如S,最高氧化物为SO3,对应的水化物就加个H2O上去,变成H2SO41年前查看全部
- 19世纪中叶,俄国化学家门捷列夫对化学学科的巨大贡献是( ) A.提出了原子学说 B.提出了元素周期律 C.提出了分子
19世纪中叶,俄国化学家门捷列夫对化学学科的巨大贡献是( ) A.提出了原子学说 B.提出了元素周期律 C.提出了分子学说 D.制定了科学的元素周期表  魔鬼的ll1年前1
魔鬼的ll1年前1 -
 CryingJoker 共回答了15个问题
CryingJoker 共回答了15个问题 |采纳率80%A.道尔顿提出了近代原子学说,故A错误;
B.1869年,俄国化学家门捷列夫发现了元素周期律,故B正确;
C.阿佛加德罗提出了分子学说,故C错误;
D.1869年,俄国化学家门捷列夫发现了元素周期律,并编制出元素周期表,故D正确.
故选BD.1年前查看全部
- (2009•汕头模拟)根据元素周期表和元素周期律分析下面的推断,其中不正确的是( )
(2009•汕头模拟)根据元素周期表和元素周期律分析下面的推断,其中不正确的是( )
A.铍的原子失电子能力比镁弱
B.砹的氢化物不稳定
C.硒化氢比硫化氢稳定
D.氢氧化锶比氢氧化钙的碱性强 e然博爱1年前1
e然博爱1年前1 -
 yang_tianqing 共回答了19个问题
yang_tianqing 共回答了19个问题 |采纳率100%解题思路:A.同主族从上到下金属增强,金属性越强,失去电子能力越大;
B.同主族从上到下非金属性减弱;
C.同主族从上到下非金属性减弱,非金属性越强,气态氢化物越稳定;
D.同主族从上到下金属增强,金属性越强,对应最高价氧化物的水化物的碱性越强.A.同主族从上到下金属增强,金属性Mg>Be,所以铍的原子失电子能力比镁弱,故A正确;
B.同主族从上到下非金属性减弱,砹为第七周期元素,非金属性较弱,所以砹的氢化物不稳定,故B正确;
C.同主族从上到下非金属性减弱,非金属性S>Se,所以硒化氢不如硫化氢稳定,故C错误;
D.同主族从上到下金属增强,金属性Sr>Ca,对应最高价氧化物的水化物的碱性为氢氧化锶比氢氧化钙的碱性强,故D正确;
故选C.点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题考查元素周期律和元素周期表,熟悉同主族元素的性质变化规律及非金属性、金属性的比较即可解答,题目难度不大.1年前查看全部
- 元素周期律指得是什么?我只知道元素周期表 周期律是什么
 moler1年前1
moler1年前1 -
 永远懂你 共回答了20个问题
永远懂你 共回答了20个问题 |采纳率80%元素周期律
元素的物理、化学性质随原子序数逐渐变化的规律叫做元素周期律.元素周期律由门捷列夫首先发现,并根据此规律创制了元素周期表.
结合元素周期表,元素周期律可以表述为:
随着原子序数的增加,元素的性质呈周期性的递变规律:
在同一周期中,元素的金属性从左到右递减,非金属性从左到右递增,
在同一族中,元素的金属性从上到下递增,非金属性从上到下递减;
同一周期中,元素的最高正氧化数从左到右递增(没有正价的除外),最低负氧化数从左到右逐渐增高;
同一族的元素性质相近.
以上规律不适用于稀有气体.
此外还有一些对元素金属性、非金属性的判断依据,可以作为元素周期律的补充:
元素单质的还原性越强,金属性就越强;单质氧化性越强,非金属性就越强.
元素的最高价氢氧化物的碱性越强,元素金属性就越强;最高价氢氧化物的酸性越强,元素非金属性就越强.
元素的气态氢化物越稳定,非金属性越强.
还有一些根据元素周期律得出的结论:
元素的金属性越强,其第一电离能就越小;非金属性越强,其第一电子亲和能就越大.
元素周期律的预见性
门捷列夫在创制周期表时,没有完全按照原子量的大小排列,而是严格遵守了“同族元素性质相近”这一规律.在周期表中留下的空位后来都被填上(如钪、镓等),而且性质也与门氏的预言吻合.他还根据周期律更正了铟等元素的原子量.
时至今日,人们还在用元素周期律来推测已发现和未发现的放射性元素的性质.
元素周期律的本质
电子构型是元素性质的决定性因素,而元素周期律是电子构型呈周期性、递变性变化规律的体现.
为了达到稳定状态,不同的原子选择不同的方式.同一周期元素中,轨道越“空”的元素越容易失去电子,轨道越“满”的越容易得电子.随着从左到右价层轨道由空到满的逐渐变化,元素也由主要显金属性向主要显非金属性逐渐变化.同一族元素中,由于周期越高,价电子的能量就越高,就越容易失去,因此排在下面的元素一般比上面的元素更具有金属性.具有同样价电子构型的原子,理论上得或失电子的趋势是相同的,这就是同一族元素性质相近的原因.1年前查看全部
- 碳酸氢钠、碳酸钠、氢氧化钠的溶解性大小怎么用元素周期律来比较?
 rufeng371年前2
rufeng371年前2 -
 kaikai1109 共回答了24个问题
kaikai1109 共回答了24个问题 |采纳率79.2%都是金属钠呀,
他们溶解度不同不是那个原因
记注就可以了.氢氧化钠 > 碳酸钠 > 碳酸氢钠1年前查看全部
- 原子半径最小的元素是什么?到底是氢还是氦啊?元素周期律里这样说的啊:两原子,若最外层电子数不同,电子层数相同,原子半径随
原子半径最小的元素是什么?
到底是氢还是氦啊?元素周期律里这样说的啊:两原子,若最外层电子数不同,电子层数相同,原子半径随原子序数的增大而减小.按照这个规律,应该是氦原子的半径最小啊,但,为什么说是氢呢? A200109321年前4
A200109321年前4 -
 JACKER2010 共回答了13个问题
JACKER2010 共回答了13个问题 |采纳率100%是氢.因为稀有气体元素的原子半径测定与相邻非金属元素的测定方法不同,这个规律不适用于稀有气体,所以是氢1年前查看全部
- 下列关于元素周期表和元素周期律的说法正确的是( ) A.Li、Na、K元素的原子核外电子层数随着核电荷数的增加而减少
下列关于元素周期表和元素周期律的说法正确的是()
A.Li、Na、K元素的原子核外电子层数随着核电荷数的增加而减少 B.第二周期元素从Li到F,非金属性逐渐减弱 C.因为K比Na容易失去电子,所以K比Na的还原性强 D.O与S为同主族元素,且O比S的非金属性弱  叶吟1年前1
叶吟1年前1 -
 meita包包 共回答了19个问题
meita包包 共回答了19个问题 |采纳率84.2%C
考查元素周期律的应用。同主族自上而下核外电子层数逐渐增多,原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱,所以选项AD不正确,C正确。同周期自左向右,非金属性逐渐增强,B不正确,答案选C。1年前查看全部
- 元素周期律的记忆问题怎么准确记忆元素周期律 什么从左到右金属性变弱 非金属性增强 所有的等等不要告诉我多做题就记住了
 sir1731年前3
sir1731年前3 -
 黑色新tt 共回答了14个问题
黑色新tt 共回答了14个问题 |采纳率78.6%记经典的!
例第二周期:左为Na,右为Cl,金属变非金属,金属性明显减弱!
由此得:从左到右金属性变弱, 非金属性增强1年前查看全部
- 第四周期的X是一种类硅元素,根据元素周期律,下列有关X性质的描述正确的是:
第四周期的X是一种类硅元素,根据元素周期律,下列有关X性质的描述正确的是:
A:X的单质不易于水发生反应.B:XO2可被碳或氢还原成X.C:XCL4的沸点比SiCl4高.D:XH4的稳定性比SiH4的高 qnsc332821年前3
qnsc332821年前3 -
 清水蓝调214 共回答了22个问题
清水蓝调214 共回答了22个问题 |采纳率86.4%ABC正确,D错误
因为该元素为类硅元素,所以与硅同族,又是第四周期,因此为第4主族第4周期,即为锗元素.
A.金属性越强与水反应越强,硅几乎不与水反应,虽然锗比硅金属性强,但是还是不易与水反应
B.SiO2可与氢气反应,同样GeO2也可以
C.GeCl4的相对分子质量比SiCl4大,分子间作用力更大,沸点更高
D.Ge的金属性比Si强,因此对应氢化物的稳定性弱于Si
ABC1年前查看全部
- 百度没有人才了吗 有木有 元素周期律的 原子对最外层的电子吸引力的
百度没有人才了吗 有木有 元素周期律的 原子对最外层的电子吸引力的
钾的原子序数比钠的大 对外电子的引力更大 但为什么钾比钠更容易失去电子 再解释下原子序数和电子层数关系 当原子序数和电子层数同时增加时 对最外层电子的引力为什么减小了 liuwei08241年前1
liuwei08241年前1 -
 fjzrong 共回答了27个问题
fjzrong 共回答了27个问题 |采纳率85.2%可以这样理解,物理上有个万有引力公式F=GMm/R²
第一个问题:钾的原子序数比钠的大 对外电子的引力更大 但为什么钾比钠更容易失去电子?
答:万有引力公式适用于任何条件,因此也适用原子核对电子吸引力,因为引力是由质量和距离决定的,但是距离计算时候是平方,所以距离的影响就相对要大一点,原子序数大了,半径也就大了,所以距离电子的距离也就随之变大,所以先考虑距离影响,更容易失去电子.
第二个问题:原子序数和电子层数关系
答:原子序数1-2,是1层,3-10是2层,11-18是三层,以此类推,具体参见元素周期表,第几横行就有几层电子.
第三个问题:当原子序数和电子层数同时增加时 对最外层电子的引力为什么减小?
答:根据第一问,距离的影响是主要的,距离变大了,引力减小了1年前查看全部
- 高中化学元素周期律和金属性非金属性怎么学好一点
 若一0061年前1
若一0061年前1 -
 hjm865 共回答了12个问题
hjm865 共回答了12个问题 |采纳率100%我也老记不住,只能多做题巩固,还有弄清本质,非金属性金属性就是指氧化性和还原性,和金属,非金属不同!注意从左右上下推金属性,应用等,特别注意s!那么你地化学就会有质的飞跃.1年前查看全部
- 下列关于元素周期表和元素周期律说法错误的是( ) A.Li.Na.k元素的原子核外电子层数随
下列关于元素周期表和元素周期律说法错误的是( ) A.Li.Na.k元素的原子核外电子层数随
下列关于元素周期表和元素周期律说法错误的是( )
A.Li.Na.k元素的原子核外电子层数随着核电荷数的增加而增多
B.因为Na比k容易失电子,所以na比k的金属性强
C.处稀有气体外,同一周期元素随着核电荷数增多,非金属性逐渐增强
D.O与S为同主族元素,且O比S的非金属性强 逆天笑1年前3
逆天笑1年前3 -
 叁柒叁 共回答了17个问题
叁柒叁 共回答了17个问题 |采纳率94.1%A、.Li电子层2层、核电荷数为3;Na电子层3层、核电荷数为,k电子层数为4层、核电荷数为19,所以.LiNa.k元素的原子核外电子层数随着核电荷数的增加而增多.A正确;
B、钾原子的比钠的电子层多,原子半径大,钾原子比钠原子原子核对核外电子的吸引能力弱,失电子能力增强,金属性增强,所以钾比钠的金属性强,B错误;
C、除稀有气体外,同一周期随随着核电荷数增多,原子半径逐渐减小,得电子能力增加,所以非金属性逐渐增强,C正确;
D、O与S为同主族元素,都是第六主族元素,O比硫的原子半径小,吸引核外电子能力大,得电子能力强,所以O比S的非金属性强,D正确.1年前查看全部
- 元素沸点如何通过元素周期律判断元素溶沸点升降?
 lichee_li1年前2
lichee_li1年前2 -
 3show 共回答了13个问题
3show 共回答了13个问题 |采纳率92.3%不对哦.
从上到下:
1、若是金属,如第IA族,第IIA族,逐渐减小.
因为金属原子半径增大,金属键减弱,熔沸点降低.
如Na的熔点比较低,低于水的沸点100摄氏度,但Cs的熔点更低,甚至低于人的体温.
2、若是非金属,分子晶体,如F2,Cl2,Br2,I2,则逐渐升高,因为分子量增大,分子间作用力增大,熔沸点升高.
如F2,Cl2是气体,Br2是液体,I2是固体.
3、若是非金属,原子晶体,如C金刚石和Si晶体,则逐渐降低,因为Si原子半径大,共价键弱,熔沸点较金刚石低.
若是同周期,从左到右,第一要看晶体的类型,一般经历的是金属晶体--原子晶体--分子晶体.
一般认为原子晶体最高,离子晶体其次,金属晶体第三,分子晶体较低.1年前查看全部
- 下列有关原子结构和元素周期律叙述中不正确的是( )
下列有关原子结构和元素周期律叙述中不正确的是( )
A.第IA族碱金属元素最高价氧化物的水化物的碱性随原子序数递增而增强
B.同周期元素(除0族元素外)从左到右,原子半径和离子半径都逐渐减小
C.第ⅦA元素从上到下,其氢化物的稳定性逐渐减弱
D.第ⅦA族元素是同周期中非金属性最强的元素 Dick19751年前1
Dick19751年前1 -
 zhailina 共回答了19个问题
zhailina 共回答了19个问题 |采纳率89.5%解题思路:A、元素金属性越强,最高价氧化物的水化物的碱性越强;
B、同周期从左到右核电荷数增大,原子核对对电子吸引增大,原子半径逐渐减小,电子层结构相同核电荷数越大离子半径越小,最外层电子数相同电子层越多离子半径越大;
C、非金属性越强,氢化物的还原性越弱;
D、同周期随原子序数增大,元素的非金属性增强(稀有气体除外).A、元素的金属性越强,则最高价氧化物对应的水化物的碱性越强,第IA族碱金属元素随原子序数递增金属性递增,故A正确;
B、同周期从左到右核电荷数增大,原子核对对电子吸引增大,原子半径逐渐减小,简单阳离子电子层结构相同,简单阴离子电子层结构相同,核电荷数越大离子半径越小,阴离子半径大于阳离子半径,故B错误;
C、第ⅦA族自上而下非金属性减弱,非金属性越强,氢化物的还原性越弱,故自上而下氢化物还原性增强,故C正确;
D、同周期随原子序数增大,元素的非金属性增强(稀有气体除外),故D正确;
故选:B.点评:
本题考点: 原子结构与元素周期律的关系.
考点点评: 本题考查结构性质位置关系、元素周期律等,难度中等,注意掌握同周期、同主族元素化合物性质的相似性越递变性.1年前查看全部
- 从元素周期律,C的还原性不是比Si强吗?但实际为什么Si更强?
从元素周期律,C的还原性不是比Si强吗?但实际为什么Si更强?
不好意思,搞错了… _^怕死拉 冰川柠檬1年前2
冰川柠檬1年前2 -
 andruw 共回答了19个问题
andruw 共回答了19个问题 |采纳率78.9%对于同主族元素,从上到下,金属性增强,还原性增强.而Si在C的下方,所以Si还原性比C强.
对于反应2C + SiO2 =高温= Si + 2CO,应该这样解释:在高温下,C的还原性比Si强.
所以,在一般情况下Si还原性比C强;在高温条件下C还原性比Si强.1年前查看全部
- 元素周期律的意义和用途
 风舞曲1年前1
风舞曲1年前1 -
 nanpple 共回答了15个问题
nanpple 共回答了15个问题 |采纳率80%元素周期表是元素周期律用表格表达的具体形式,它反映元素原子的内部结构和它们之间相互联系的规律.元素周期表简称周期表.元素周期表有很多种表达形式,目前最常用的是维尔纳长式周期表(见书末附表).元素周期表有7个周期,有16个族和4个区.元素在周期表中的位置能反映该元素的原子结构.周期表中同一横列元素构成一个周期.同周期元素原子的电子层数等于该周期的序数.同一纵行(第Ⅷ族包括3个纵行)的元素称“族”.族是原子内部外电子层构型的反映.例如外电子构型,IA族是ns1,IIIA族是ns2 np1,O族是ns2 np6,IIIB族是(n-1) d1·us2等.元素周期表能形象地体现元素周期律.根据元素周期表可以推测各种元素的原子结构以及元素及其化合物性质的递变规律.当年,门捷列夫根据元素周期表中未知元素的周围元素和化合物的性质,经过综合推测,成功地预言未知元素及其化合物的性质.现在科学家利用元素周期表,指导寻找制取半导体、催化剂、化学农药、新型材料的元素及化合物.1年前查看全部
- 元素周期律.C、N、O、F元素的最高正价依次升高正不正确
 轩轩56号1年前1
轩轩56号1年前1 -
 thp888 共回答了20个问题
thp888 共回答了20个问题 |采纳率85%正确的,最高正价与元素最外层电子数有关1年前查看全部
大家在问
- 1在央视春晚中,魔术师刘谦的精彩表演叫人叫绝,使人们对魔术产生了浓厚的兴趣.《银币穿越玻璃杯》的魔术是在不动大杯的情况下,
- 2从大自然中得到的启示,或从什么动物,植物,身上得到的哪些启示,想发明什么?
- 3高三英文同义词辨析awesome aweful awkward这三个词意思有点相近歪,请指出它们最主要区别及用法.高手上
- 4没有你,我也可以一样骄傲的活.怎么翻译?要翻译成英语,翻译好了加分
- 5荣德基小学卷子六年级人教版
- 6(2014•新泰市模拟)下列生物的个体发育过程为变态发育的是( )
- 7一个直角三角形的两条直角边长分别是3cm和4cm,斜边长5cm.分别一两条直角边为轴旋转一周,各形成一个什么形状的物体?
- 8( )agree to your plan.和__ of them will accept your idea beca
- 9你经常在网上看列车时刻表吗?翻译英文
- 103道数学题 关于x的方程ax+1=|x|仅有一解,求a的取值范围
- 11送东阳马生序中全文的中心句
- 12分别求以下两个数列的通项公式.数列|bn|的前n项和为Tn,Tn=1-1/2bn
- 13读讨厌的青蛙读后感
- 14直线l过抛物线的焦点并且与抛物线y^2=2px相交于A(x1,y1)和B(x2,y2)两点
- 15乙醇和乙醛哪个酸性大?
