溶胶为什么不一定有电泳现象
 思远的仙人2022-10-04 11:39:541条回答
思远的仙人2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 我怎么这么倒霉 共回答了18个问题
我怎么这么倒霉 共回答了18个问题 |采纳率94.4%- 1、理论上带电的固溶胶也可以发生电泳现象的,不过不明显!2、现象不明显的原因当然是因为相应的有色粒子无法大范围自由移动!
- 1年前
相关推荐
- 胶体粒子在溶胶中可自由移动 是否正确
 一吻之隔1年前2
一吻之隔1年前2 -
 shaka2008 共回答了12个问题
shaka2008 共回答了12个问题 |采纳率83.3%应该是正确的.
布朗运动同样适合于液态胶体1年前查看全部
- 向氢氧化铁溶胶中逐滴加入一种液体,首先使溶胶发生凝聚而沉淀,继续加入使沉淀消失,这种液体是( )
向氢氧化铁溶胶中逐滴加入一种液体,首先使溶胶发生凝聚而沉淀,继续加入使沉淀消失,这种液体是( )
A.蒸馏水
B.0.5 mol•L-1硫酸镁溶液
C.0.5 mol•L-1氯化钾溶液
D.0.5 mol•L-1盐酸 月华清瑜1年前1
月华清瑜1年前1 -
 rckeke 共回答了18个问题
rckeke 共回答了18个问题 |采纳率100%解题思路:胶体具有均一稳定性,加入电解质会使胶体发生聚沉,氢氧化铁胶体逐滴加入溶液,先产生沉淀后沉淀溶解,说明先胶体聚沉,后能溶解沉淀.A.蒸馏水不能使胶体聚沉,故A错误;
B.硫酸镁是电解质,能引起胶体聚沉,但不能溶解氢氧化铁沉淀,故B错误;
C.氯化钾是电解质,能引起胶体聚沉,但不能溶解氢氧化铁沉淀,故C错误;
D.加入HCl是电解质溶液,会引起氢氧化铁胶体聚沉,继续加入HCl,氢氧化铁沉淀会溶解,故D正确.
故选D.点评:
本题考点: 胶体的重要性质.
考点点评: 本题考查胶体的性质应用,难度不大,电解质非电解质的判断,熟悉胶体的性质、物质的性质是解答本题的关键.1年前查看全部
- 将某溶液逐滴加入Fe(OH)3溶胶内,开始时产生沉淀,继续滴加时沉淀又溶解,该溶液是( )
将某溶液逐滴加入Fe(OH)3溶胶内,开始时产生沉淀,继续滴加时沉淀又溶解,该溶液是( )
A.2mol•L-1 H2SO4溶液
B.2mol•L-1 NaOH溶液
C.2mol•L-1 MgSO4溶液
D.硅酸溶胶 irisandyuki1年前1
irisandyuki1年前1 -
 zjj晶晶 共回答了16个问题
zjj晶晶 共回答了16个问题 |采纳率100%解题思路:根据胶体的性质及所加物质的性质分析,胶体和电解质溶液能发生聚沉现象.能使胶体聚沉的物质有电解质溶液和带相反电荷的胶体.
A、稀硫酸是电解质溶液能使Fe(OH)3溶胶聚沉,但H2SO4可使Fe(OH)3沉淀溶解,故A正确;
B、氢氧化钠能使Fe(OH)3溶胶聚沉,但不能溶解沉淀,故B错误;
C、MgSO4溶液能使Fe(OH)3溶胶聚沉,但不能溶解沉淀,故C错误;
D、硅酸溶液的胶粒带负电荷,能使Fe(OH)3溶胶聚沉,但不能溶解沉淀,故D错误.
故选A.点评:
本题考点: 胶体的重要性质.
考点点评: 本题考查了胶体的性质,胶体区别于其它分散系的本质特征是胶体粒子直径介于1-100nm之间,而不是丁达尔效应,丁达尔效应是物理变化不是化学变化.1年前查看全部
- 雾霾是雾和霾的混合物,在空气中能形成溶胶,PM2.5是“罪魁”.下列有关说法中不正确的是( )
雾霾是雾和霾的混合物,在空气中能形成溶胶,PM2.5是“罪魁”.下列有关说法中不正确的是( )
A.化石燃料的燃烧、垃圾焚烧产生的烟尘以及道路和建筑施工的扬尘都是形成雾霾天气的原因之一
B.调整工业能源结构,研制开发燃料电池汽车,能有效地减少PM2.5的污染
C.PM2.5粒径小,富含大量的有毒、有害物质,佩戴口罩就能防止PM2.5的污染,因此不必治理
D.在雾霾天气中,开车打开车灯时从侧面可能看到一条光亮的通路 jiang10001年前1
jiang10001年前1 -
 beyond0123 共回答了17个问题
beyond0123 共回答了17个问题 |采纳率94.1%解题思路:A、雾霾天气的形成主要来源于扬尘和化石燃料燃烧产生的颗粒物;
B、鼓励购买清洁能源汽车,会减少PM2.5污染;
C、即便是医用口罩,对PM2.5的污染的防治也是有限的;
D、雾属于胶体,具有丁达尔现象.A、雾霾天气的形成主要来源于化石燃料的燃烧、垃圾焚烧产生的烟尘以及道路和建筑施工的扬尘,故A正确;
B、调整工业能源结构,鼓励购买清洁能源汽车,会减少PM2.5污染,故B正确;
C、PM2.5粒径小,富含大量的有毒、有害物质,即便是医用口罩,对PM2.5的污染的防治也是有限的,故C错误;
D、雾属于胶体,在雾霾天气中,开车打开车灯时从侧面可能看到一条光亮的通路,故D正确;
故选C.点评:
本题考点: 常见的生活环境的污染及治理.
考点点评: 本题主要考查了雾霾的形成与危害,难度不大,注意环境的保护.1年前查看全部
- 有一AL(OH)3溶胶,加入KCL.当其在溶胶中的浓度为80mmol/L,溶胶恰能聚沉,若在其中加入K2C2O4
有一AL(OH)3溶胶,加入KCL.当其在溶胶中的浓度为80mmol/L,溶胶恰能聚沉,若在其中加入K2C2O4
则骑在溶胶中的浓度为0.4mmol/L时,溶胶恰能聚沉.试问 AL(OH)3的电性是正还是负?
为使该溶胶聚沉,约需要CACL2的浓度多少? 兵痴1年前1
兵痴1年前1 -
 温情开春 共回答了18个问题
温情开春 共回答了18个问题 |采纳率88.9%从题中知道,氯化钾和草酸钾对强氧化铝胶体聚沉能力不一样,由于正离子都是钾离子,所以只能是负离子的作用了.所以氢氧化铝胶粒带正电.
至于CaCl2所需的浓度,由于其和氯化钾的负离子一样,故两者聚沉能力(对带正电氢氧化铝胶粒来说)差不多的,所以约需要80mmol/L.1年前查看全部
- 溶胶胶粒带电的原因为1.胶核的选择性吸附2.表面分子的离解对吗?
 shiyuan10175221年前1
shiyuan10175221年前1 -
 w1214 共回答了12个问题
w1214 共回答了12个问题 |采纳率91.7%胶粒带电,是因为胶粒的表面积大,易于选择性吸附溶液中的阴阳离子,从而可能带上正、负电荷.
这里的选择性吸附往往是吸附与它的结构相似的离子.1年前查看全部
- 把硫酸逐滴加入到Fe(OH)3溶胶内,发生聚沉,聚沉的物质是什么
 mumuxing1年前1
mumuxing1年前1 -
 toshi2007 共回答了16个问题
toshi2007 共回答了16个问题 |采纳率87.5%聚沉的物质为 氢氧化铁!因为聚沉的原理为 带电物质 遇电荷 吸附其上 然后由于质量变大 所以聚沉!若没记错 氢氧化铁是正电性 遇硫酸根离子 吸附聚沉1年前查看全部
- 化学题关于《化学与生活》把一定量的淀粉和少量淀粉酶配成溶胶灌于半透膜袋中并置于盛有热的蒸馏水的烧杯中(如图所示).一段时
化学题关于《化学与生活》
把一定量的淀粉和少量淀粉酶配成溶胶灌于半透膜袋中并置于盛有热的蒸馏水的烧杯中(如图所示).一段时间后进行如下实验,回答相关问题.
(1)淀粉在上述实验中发生反应的化学反应方程式:________________,
(2)取烧杯中的溶液少许滴入新制Cu(OH)2悬浊液中加热煮沸,观察到的现象是__________.发生反应的化学反应方程式为_______________ _.
(3)要证明淀粉在这段时间内未水解完全,应进行怎样的实验_______________.
(4)若要说明淀粉酶在上述反应中是催化剂,淀粉酶在此过程中没有发生水解,试设计实验证明之. 华容刀客1年前2
华容刀客1年前2 -
 87278558 共回答了21个问题
87278558 共回答了21个问题 |采纳率95.2%(1)(C6H12O6)n→C6H12O6 +C6H12O6
淀粉 葡萄糖 果糖
(2)产生砖红色沉淀,方程式看书
(3)碘遇淀粉变蓝,滴入碘液,溶液变蓝说明未完全水解.1年前查看全部
- (9分)在①渗析 ②盐析 ③聚沉 ④溶胶 ⑤凝胶 ⑥布朗运动
(9分)在①渗析 ②盐析 ③聚沉 ④溶胶 ⑤凝胶 ⑥布朗运动 ⑦电泳 ⑧丁达尔效应 ⑨中和 ⑩水解中选择适当的词语填入下列每小题的空格中(填编号)。
(1)用平行可见光照射肥皂水,从侧面可以见到光带。这种现象称为 。
(2)在浓肥皂水中加入饱和食盐水,肥皂聚沉,这种现象称为 。
(3)冷却热的肥皂水并使之全部固化后的物质叫 。
(4)在肥皂水中加入酚酞变成红色,说明高级脂肪酸根离子发生了 。
(5)在Fe(OH) 3 胶体中加入(NH 4 ) 2 SO 4 ,产生红褐色沉淀,这种现象叫做 。
(6)用半透膜把制取的Fe(OH) 3 胶体中含有的NaCl分离出去的方法叫做 。 cnsdier1年前1
cnsdier1年前1 -
 神奇之神 共回答了23个问题
神奇之神 共回答了23个问题 |采纳率91.3%(1)⑧ (2)② (3)⑤ (4)⑩ (5)③ (6)①
解答此题的关键是熟悉题目中涉及的概念。1年前查看全部
- 用下列方法来制备溶胶:①0.5mol/LBaCl2溶液与等体积的2mol/LH2SO4相混合;
用下列方法来制备溶胶:①0.5mol/LBaCl2溶液与等体积的2mol/LH2SO4相混合;
②把1mL饱和氯化铁逐滴加入20mL沸水中;
③把1mL水玻璃溶液加入10mL1mol/L盐酸中;
④向10mol/L0.01mol/LH2S溶液中逐滴加入8~10滴0.01mol/L氯水.
其中,能得到胶体溶液的是?
答案给了②③④都能,是不是答案错了? 个个人1年前1
个个人1年前1 -
 可爱的笨猪猪 共回答了24个问题
可爱的笨猪猪 共回答了24个问题 |采纳率91.7%①0.5mol/LBaCl2溶液与等体积的2mol/LH2SO4相混合;---不能,生成的是BaSO4沉淀,即悬浊液②把1mL饱和氯化铁逐滴加入20mL沸水中;----能,生成的是红褐色的Fe(OH)3胶体③把1mL水玻璃溶液加入10mL1mol/L盐酸中;------不...1年前查看全部
- 用AgNO3和KCl(过量)制备AgCl溶胶.下列说法错误的是 ( )胶粒是带负电荷的
用AgNO3和KCl(过量)制备AgCl溶胶.下列说法错误的是 ( )胶粒是带负电荷的
A.胶核是AgCl
B.胶核吸附的离子是Cl-
C.在电场中胶粒向负极运动
D.胶核和吸附的离子组成的胶粒是带正电荷的
E.胶核和吸附的离子组成的 guolihui1年前1
guolihui1年前1 -
 shenpei1997 共回答了20个问题
shenpei1997 共回答了20个问题 |采纳率85%如果是氯化钾过量,则胶粒核心是AgCl,吸附的应该是过量的钾离子从而带正电荷,电泳时向负极移动.所以B是错误的
胶团是由胶粒和外层吸附电子构成,一般胶粒核心外面会吸附一些稳定剂中和胶核不同种的离子,然后外层吸附层再吸附一些和胶核吸附离子异号的稳定剂离子,然后外层扩散层再吸附一些离子.整个胶团是电中性的.胶粒所带电荷种类和稳定剂以及胶核有关,比如对于本题,胶核是AgCl,稳定剂是KCl,所以胶核吸附的是钾离子,带正电荷1年前查看全部
- 现有下列8种物质,请按要求回答问题:①淀粉溶胶 ②锌 ③氧化铁 ④碳 ⑤盐酸
现有下列8种物质,请按要求回答问题:①淀粉溶胶 ②锌 ③氧化铁 ④碳 ⑤盐酸 ⑥苛性钠 ⑦碳酸钙⑧氢氧化铜悬浊液
(1)运用树状分类法将这些物质(用化学式表示)进行分类.(要求分至最基本的类型,参看下图例示,将上述物质分类写在下图中)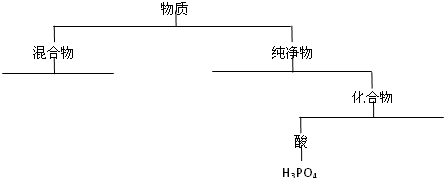
(2)常温下,上述物质两两混合,能够制取的气体有______,所发生的反应属离子反应的写出离子方程式,并注明反应类型(按反应形式分)______. goalmachine_cn1年前1
goalmachine_cn1年前1 -
 DDMNLYX 共回答了18个问题
DDMNLYX 共回答了18个问题 |采纳率83.3%解题思路:(1)由不同种分子构成的物质属于混合物,有一种分子构成的物质属于纯净物,有不同元素组成的纯净物是化合物,电离出的阳离子全部是氢离子的化合物叫酸;
(2)根据物质之间的反应来判断反应类型,分析制取的气体.(1)由不同种分子构成的物质属于混合物,如①⑤⑧,有一种分子构成的物质属于纯净物,如③④⑥⑦,电离出的阳离子全部是氢离子的纯净物叫酸,如⑤,
故答案为:①⑤⑧;③④⑥⑦;⑤;
(2)盐酸和碳酸钙反应可以制取二氧化碳,锌和盐酸反应可以制取氢气,离子方程式为:CaCO3+2H+═Ca2++H2O+CO2↑,为复分解反应,Zn+2H+═Zn2++H2↑,为置换反应,
故答案为:CO2、H2;CaCO3+2H+═Ca2++H2O+CO2↑,复分解反应;Zn+2H+═Zn2++H2↑,置换反应.点评:
本题考点: 混合物和纯净物;酸、碱、盐、氧化物的概念及其相互联系.
考点点评: 本题考查学生物质的分类知识和离子方程式的书写知识,较简单.1年前查看全部
- 医用化学填空题三、主观填空题(共 6 道试题,共 15 分.)1.Fe(OH)3溶胶的胶团结构式是( )该胶粒在电场中的
医用化学填空题
三、主观填空题(共 6 道试题,共 15 分.)
1.Fe(OH)3溶胶的胶团结构式是( )该胶粒在电场中的泳动方向是( ).
2.A液、B液都是C液的等渗液.A液和B液无化学反应,两着以( ) 混合,所得的混合液仍是C的( ).
3.当温度一定时,解离度随弱电解质浓度减小而( ) ,H+离子浓度随弱电解质浓度减小而( ) .
4.电对的电极电势越大,电对中的还原态的还原能力越( ) ,电对中的氧化态的氧化能力越( ) .
5.已知H2CO3的pKa1=6.37、pKa2θ=10.25,若用H2CO3- NaHCO3组成缓冲溶液,其抗酸成分是( ) ,抗碱成分是( ,该溶液的缓冲范围为( )
6.配合物[Fe(en) 3]Cl3名称为( ) ,中心原子为( ) 配体为( ) ,配位数为 ( )
计算题
1.配制pH=5.05的缓冲溶液500ml,应取0.1 mol•L-1HAc及0.1 mol•L-1NaOH各多少ml?( pKa(HAc) = 4.75) 哈和湖1年前1
哈和湖1年前1 -
 hnair 共回答了15个问题
hnair 共回答了15个问题 |采纳率80%1.Fe(OH)3溶胶的胶团结构式是([(Fe(OH)3)m nI-,(n-x)Fe(OH)2+]x- xFe(OH)2+ )该胶粒在电场中的泳动方向是( 向负极 ).
2.A液、B液都是C液的等渗液.A液和B液无化学反应,两着以( 等浓度 ) 混合,所得的混合液仍是C的( 等渗液 ).
3.当温度一定时,解离度随弱电解质浓度减小而(增大 ) ,H+离子浓度随弱电解质浓度减小而( 减小 ) .
4.电对的电极电势越大,电对中的还原态的还原能力越( 弱 ) ,电对中的氧化态的氧化能力越( 强 ) .
5.已知H2CO3的pKa1=6.37、pKa2θ=10.25,若用H2CO3- NaHCO3组成缓冲溶液,其抗酸成分是( NaHCO3 ) ,抗碱成分是( H2CO3 ,该溶液的缓冲范围为( 5.37~7.37 )
6.配合物[Fe(en) 3]Cl3名称为( 三氯化三乙二胺合铁(Ⅲ) ) ,中心原子为( Fe ) 配体为( en ) ,配位数为 ( 6 )
计算题
1.配制pH=5.05的缓冲溶液500ml,应取0.1 mol•L-1HAc及0.1 mol•L-1NaOH各多少ml?( pKa(HAc) = 4.75)
由PH=pKa-log(c酸/c盐)
c酸/c盐=1/2
应取0.1 mol•L-1HAc300ml及0.1 mol•L-1NaOH200ml各1年前查看全部
- 将某溶液逐滴加入Fe(OH)3溶胶内,开始产生沉淀,继续滴加沉淀又溶解,该溶液是( 2mol/L H2SO4溶液) 为什
将某溶液逐滴加入Fe(OH)3溶胶内,开始产生沉淀,继续滴加沉淀又溶解,该溶液是( 2mol/L H2SO4溶液) 为什么不1mol/L
 peng956251年前1
peng956251年前1 -
 晓风轻语 共回答了22个问题
晓风轻语 共回答了22个问题 |采纳率95.5%1mol/L也可以1年前查看全部
- 溶胶制备我在制备过程中,A液是乙醇加钛酸丁酯,B液是乙醇加PH=1的水,再将a液滴b液过程中,一滴下去,我的液体马上就乳
溶胶制备
我在制备过程中,A液是乙醇加钛酸丁酯,B液是乙醇加PH=1的水,再将a液滴b液过程中,一滴下去,我的液体马上就乳白色了,放置后上层清液下层居然还有沉淀,这是怎么了,我哪里可能出错 香雪兰20301年前1
香雪兰20301年前1 -
 菜籽SO 共回答了24个问题
菜籽SO 共回答了24个问题 |采纳率95.8%太专业了,不能帮什么忙,不过从你的结果看,应该生成沉淀了.能不能将药液半滴半滴的加入,或是更小一点,或者倒过来加入,就是B加入A中.
以上只是拙见!1年前查看全部
- 现有四种电解质溶液对某AgCl溶胶的临界聚沉浓度分别为:Na3PO4 300 mmol·L-1,Na2SO4 25 mm
现有四种电解质溶液对某AgCl溶胶的临界聚沉浓度分别为:Na3PO4 300 mmol·L-1,Na2SO4 25 mmol·L-1,AlCl3 5 mmol·L-1.则该溶胶在电泳时,其胶粒将泳向 (10.0分)
A.正极
B.不移动
C.负极
D.无法确定 kk敢工1年前1
kk敢工1年前1 -
 肖金华 共回答了32个问题
肖金华 共回答了32个问题 |采纳率96.9%向正极移动,原因,临界聚沉值越大聚沉能力越小,看出氯化铝聚沉能力最大 根据反电荷影响的原理,说明胶体带负电,向正极移动1年前查看全部
- Fe(OH)3溶胶的胶团结构式是 该胶粒在电场中的泳动方向是 .
Fe(OH)3溶胶的胶团结构式是 该胶粒在电场中的泳动方向是 .
试题满分:2 分
第 1 空、 满分:1 分
第 2 空、 满分:1 分
2.A液、B液都是C液的等渗液.A液和B液无化学反应,两着以 混合,所得的混合液仍是C的 .
试题满分:2 分
第 1 空、 满分:1 分
第 2 空、 满分:1 分
3.当温度一定时,解离度随弱电解质浓度减小而 ,H+离子浓度随弱电解质浓度减小而 .
试题满分:2 分
第 1 空、 满分:1 分
第 2 空、 满分:1 分
4.电对的电极电势越大,电对中的还原态的还原能力越 ,电对中的氧化态的氧化能力越 .
试题满分:2 分
第 1 空、 满分:1 分
第 2 空、 满分:1 分
5.已知H2CO3的pKa1=6.37、pKa2θ=10.25,若用H2CO3- NaHCO3组成缓冲溶液,其抗酸成分是 ,抗碱成分是 ,该溶液的缓冲范围为
试题满分:3 分
第 1 空、 满分:1 分
第 2 空、 满分:1 分
第 3 空、 满分:1 分
6.配合物[Fe(en) 3]Cl3名称为 ,中心原子为 配体为 ,配位数为 . eric9921年前1
eric9921年前1 -
 陋质何堪受殷勤 共回答了18个问题
陋质何堪受殷勤 共回答了18个问题 |采纳率88.9%1题 {[Fe(OH)3.xFe3+].(x-m)Cl-}.mCl- 在电场中向负极移动.
2题:A、B以任意体积比混合后仍是C的等渗溶液
3题:增加 减小
4题:弱 强
5题:碳酸氢根 碳酸 pH在5.37至7.37之间
6题?三氯化三(乙二胺)合铁(3) (注意:括号里的“3”应写罗马数字)
中心原子为铁,配体是乙二胺分子,配位数为61年前查看全部
- 9.用等体积的0.001mol.L-1AgNO3溶液和0.005mol.L-1KCl溶液制备AgCl溶胶,胶团结构为(
9.用等体积的0.001mol.L-1AgNO3溶液和0.005mol.L-1KCl溶液制备AgCl溶胶,胶团结构为( ),电泳的胶粒向(
 gaowanli1年前1
gaowanli1年前1 -
 zugvogel 共回答了14个问题
zugvogel 共回答了14个问题 |采纳率100%AgCl,Cl-
阳极移动1年前查看全部
- 有下列词语:①渗析 ②盐析 ③聚沉 ④溶胶
有下列词语:①渗析②盐析③聚沉 ④溶胶⑤凝胶⑥布朗运动⑦电泳⑧丁达尔效应⑨中和⑩水解,选出适当的词语将其序号填入下列空格中.
(1)往浓肥皂中加入饱和食盐水(或固体食盐),肥皂凝聚,这种现象称为______.
(2)在豆浆中透过强光,可看到光带,这种现象称为______.
(3)在水泥和冶金工厂常用高压电对气溶胶作用,除去大量烟尘,以减少对空气的污染.这种做法应用的主要原理是______.
(4)在Fe(OH)3胶体中加入(NH4)2SO4产生红褐色沉淀,这种现象叫做______.
(5)用半透膜把制取Fe(OH)3胶体中生成的氯化钠分离出去的方法叫做______. 孟婆原名叫桃花1年前1
孟婆原名叫桃花1年前1 -
 niko2004 共回答了16个问题
niko2004 共回答了16个问题 |采纳率87.5%解题思路:(1)盐析一般是指溶液中加入无机盐类而使某种物质溶解度降低而析出的过程;
(2)光束通过胶体时,产生光亮的通路,称为丁达尔效应;
(3)胶粒在电场的作用下,做定向运动,这种现象称为电泳;
(4)胶粒遇电解质溶液发生聚沉;
(5)胶粒不能透过半透膜.(1)NaCl使高级脂肪酸钠凝聚的过程叫盐析,故答案为:②;
(2)豆浆的分散系为胶体,有丁达尔效应,故答案为:⑧;
(3)胶粒在电场的作用下,做定向运动,这种现象称为电泳,可用来除尘,故答案为:⑦;
(4)Fe(OH)3胶体遇到(NH4)2SO4发生聚沉,故答案为:③;
(5)胶粒不能透过半透膜,离子能透过,可用渗析提纯胶体,故答案为:①.点评:
本题考点: 胶体的重要性质;物质的分离、提纯和除杂.
考点点评: 本题考查胶体的性质,难度不大,注意丁达尔效应是胶体的特有性质.1年前查看全部
- 氢氧化铁溶胶,含塑化剂的白酒,含有细菌的矿泉水均具有丁达尔效应 错在哪里
 雷奇1年前2
雷奇1年前2 -
 镞偬-1057 共回答了16个问题
镞偬-1057 共回答了16个问题 |采纳率75%当一束光线透过胶体,从入射光的垂直方向可以观察到胶体里出现的一条光亮的“通路”,这种现象叫丁达尔现象,也叫丁达尔效应(Tyndall effect)、丁泽尔现象、丁泽尔效应.
反过来看上述几种液体,哪一个不是胶体呢.
答案是:含有细菌的矿泉水,它不是胶体.
有资料介绍白酒是一种胶体.1年前查看全部
- 对于AgI正溶胶,下列胶团结构式中,正确的是( ).
对于AgI正溶胶,下列胶团结构式中,正确的是( ).
A.[(AgI)nK+(n-x)NO3-]xNO3- B.[(AgI)nI-(n-x)K+]x K+
C.[(AgI)nAg+(n-x)NO3-]xNO3- D.[(AgI)n NO3- (n-x) K+]x K+
对于AgI负溶胶,下列胶团结构式中,正确的是( ).
A.[(AgI)nK+(n-x)NO3-]xNO3- B.[(AgI)nI-(n-x)K+]x K+
C.[(AgI)nAg+(n-x)NO3-]xNO3- D.[(AgI)n NO3- (n-x) K+]x K+ PMSF1年前2
PMSF1年前2 -
 小屋上的夜莺 共回答了11个问题
小屋上的夜莺 共回答了11个问题 |采纳率81.8%如果形成胶体时KI过量,则AgI胶体粒子吸附I—离子而带负电;反之,当AgNO3过量时,则AgI胶粒吸附Ag+离子而带正电.
所以第一个选C,第二个选B1年前查看全部
- 溶胶是有电性的 正负电性是由什么决定的?是看吸附离子呢,还是看反离子.
溶胶是有电性的 正负电性是由什么决定的?是看吸附离子呢,还是看反离子.
正溶胶,负溶胶是怎么定义的?是不是正溶胶电性一定是正的,负溶胶电性一定是负的。 紫xx猫儿1年前2
紫xx猫儿1年前2 -
 by3721by 共回答了24个问题
by3721by 共回答了24个问题 |采纳率87.5%首先,胶体粒子简称胶粒,胶粒由胶核、吸附层、双电层、扩散层组成,具体是以胶核为中心,胶核之外为吸附层,吸附层之外为双电层,双电层之外为扩散层.
例如,氢氧化铁胶粒中,胶核显正电性(这应该很好理解吧?.算了,还是解释一下吧.——其实是以胶核为中心,正粒子分散于胶核表面,即分散于吸附层),负离子受正离子的库仑引力影响,分散于吸附层外侧,即双电层;由于胶核正电性较强,又有少量负电荷分散于双电层外侧,即扩散层.
但是!负电性还不足以抵消正电性,故胶粒是带电的.但胶粒之间还有负离子,总体看来,整个体系中正负电性抵消,故胶体不带电.
所谓的正负溶胶,即指胶粒的正负,但要搞清——溶胶是不带电的!而且,胶粒的正负,要取决于胶核及其外部负离子的总效应,并不一定为正或负.1年前查看全部
- 混合等体积的C(KI)为0.008mol/Lhe C(AGNO3)为0.1mol/L两溶液制成AGI溶胶,
混合等体积的C(KI)为0.008mol/Lhe C(AGNO3)为0.1mol/L两溶液制成AGI溶胶,
试问相同浓度的MGSO4溶液和K3[FE(CN)6]溶液,哪一种更容易使上述溶胶聚沉 kuailezhu041年前1
kuailezhu041年前1 -
 muda 共回答了17个问题
muda 共回答了17个问题 |采纳率94.1%j1年前查看全部
- 将某溶液逐滴加入 氢氧化铁溶胶内,开始产生沉淀,继续滴加时沉淀又溶解,该溶液是
将某溶液逐滴加入 氢氧化铁溶胶内,开始产生沉淀,继续滴加时沉淀又溶解,该溶液是
1.2mol/L氢氧化钠溶液
2.2mol/L硫酸溶液
3 2mol/L硫酸镁溶液
4.三氯化铁溶液
我的意思是,为什么这四个物质都能使氢氧化铁胶体聚沉? 551979210111年前2
551979210111年前2 -
 gilesgong 共回答了20个问题
gilesgong 共回答了20个问题 |采纳率95%2
先是中和胶体所带电荷发生聚沉
然后是酸碱反应,硫酸溶解氢氧化铁
胶体可以吸附带电离子从而显电性.
硫酸镁不能溶解氢氧化铁吧.
它们在水里电离,产生带正电和带负电的离子,与胶体所带电荷相互中和,胶体之间排斥力减小,就聚沉了.1年前查看全部
- 在电泳测定时 把电极直接插到溶胶中会发生什么现象?辅助溶液的电导率必须和所测胶体的电导率十分接近
 yeteng4251年前1
yeteng4251年前1 -
 pipiyue 共回答了12个问题
pipiyue 共回答了12个问题 |采纳率83.3%胶体会沉淀的.电极进入胶体,通电后,胶体的颗粒会增大的,同时所带的电荷液会变化,最后会沉淀的.1年前查看全部
- 为制备AgI负溶胶,应向25ml0.016mol/L KI溶液中最多加入多少毫升的0.005mol/L AgNO3溶液?
 梦想成真20071年前1
梦想成真20071年前1 -
 抠门 共回答了16个问题
抠门 共回答了16个问题 |采纳率81.3%制备AgI负溶胶,保持I(-)稍过量就可以了:
25*0.016 > 0.005 * V1年前查看全部
- 气溶胶算不算胶体(百科说气溶胶大小为0.001~100微米,可是胶体不是要1~100nm)
气溶胶算不算胶体(百科说气溶胶大小为0.001~100微米,可是胶体不是要1~100nm)
pm2.5属于气溶胶?pm2.5的直径在多少? wbsan200361年前1
wbsan200361年前1 -
 fu41439422 共回答了19个问题
fu41439422 共回答了19个问题 |采纳率89.5%PM2.5肯是气溶胶,可吸入颗粒物PM2.5是指悬浮在空气中,能进入人体的呼吸系统,空气动力学当量直径小于 等于2.5微米的颗粒物(国家环境保护总局[EB/OL].http://www.sepa.gov.cn/,2007).
气溶胶也是胶体,至于颗粒直径大小不一致,只是界定范围没那么严格,通常说法而已(个人见解).
希望对你有用.1年前查看全部
- 此溶胶的胶团结构式!
 awyk811年前1
awyk811年前1 -
 蝶翠华庭 共回答了19个问题
蝶翠华庭 共回答了19个问题 |采纳率89.5%从题目看,氢氧化钠是过量的,生成的胶核核心是氢氧化铝,其胶团结构为:
[(Al(OH)3)m·nOH-·(n-x)Na+]x-·xNa+
溶胶带负电,反离子的价态越高,聚沉能力越大,故从大到小:La3+>Mg2+>K+1年前查看全部
- 高分子溶液与溶胶都是多相不稳定系统吗
 蔡飞1年前1
蔡飞1年前1 -
 lrmlrm0001 共回答了15个问题
lrmlrm0001 共回答了15个问题 |采纳率80%高分子溶液与溶胶,其实都是胶体.胶体是一种分散质粒子直径介于粗分散体系和溶液之间的一类分散体系,这是一种高度分散的多相不均匀体系.胶体的稳定性介于溶液和浊液之间,在一定条件下能稳定存在,属于介稳体系.1年前查看全部
- 为什么加入电解质会破坏溶胶,使溶胶聚沉
 songhao1年前2
songhao1年前2 -
 DKDKDK_0990 共回答了16个问题
DKDKDK_0990 共回答了16个问题 |采纳率100%因为胶体微粒比表面积大,吸附能力强,常常会吸附某种电荷,因此现象胶体微粒之间彼此排斥而悬浮.加入电解质破坏了原来的平衡,使胶体微粒之间的碰撞机会增多,聚集成大的颗粒而彼此的排斥减弱,因而聚沉.1年前查看全部
- 请问往Fe(OH)3溶胶中加入硫酸盐溶液,为何会破坏溶胶的稳定性而析出沉淀?
 yerenhua12031年前1
yerenhua12031年前1 -
 kevinwooo 共回答了13个问题
kevinwooo 共回答了13个问题 |采纳率92.3%破坏胶体的稳定性,促使胶体颗粒互相接触,成为较大的颗粒,关键在于减少胶体的带电量.胶体脱稳的机理:要使胶体颗粒沉降就必须破坏胶体的稳定性,促使胶体颗粒互相接触,成为较大的颗粒,关键在于减少胶体的带电量.这可以通过压缩扩散层厚度,降低ξ电位来达到.Fe(OH)3溶胶中加入硫酸盐溶液,使Fe(OH)3胶体表面电荷被中和,聚集沉聚而破坏了.1年前查看全部
- 对于AgI负溶胶,下列胶团结构式中,正确是的( )
对于AgI负溶胶,下列胶团结构式中,正确是的( )
A.[(AgI)mK+(n-x)NO3)]x+xNO3-
B.[(AgI)mI-(n-x)K+]x-xK+
C.[(AgI)mAg+(n-x)NO3-]x+xNO3-
D.[(AgI)mNO3-(n-x)K+]x-xK+ 缥缈小白1年前1
缥缈小白1年前1 -
 木子醒同 共回答了16个问题
木子醒同 共回答了16个问题 |采纳率87.5%AgI 负溶胶胶团结构式: [ (AgI)m I - (n-x) K+ ]x- x K+ -1年前查看全部
- 任何溶胶加入可溶性电解质后,都能使胶体微粒凝成较大颗粒形成沉淀而析出
任何溶胶加入可溶性电解质后,都能使胶体微粒凝成较大颗粒形成沉淀而析出
错在哪里啊? 丁杰1年前1
丁杰1年前1 -
 yiwang1982 共回答了20个问题
yiwang1982 共回答了20个问题 |采纳率95%形成的胶体沉淀有可能与可溶性电解质反应
如:向氢氧化铁胶体溶液中加入可溶性电解质稀硫酸,那么溶液先出现红褐色沉淀,后沉淀氢氧化铁与硫酸反应,沉淀溶解,就不析出了1年前查看全部
- Fe(OH)3胶体中什么物质中和了Fe(OH)3胶体的正电性使溶胶成电中性
 wq7107101年前1
wq7107101年前1 -
 abc锋 共回答了16个问题
abc锋 共回答了16个问题 |采纳率68.8%氢氧化铁胶体是靠胶核本身带负电(氢氧根离子)而外部包裹一层水溶性阳离子达到稳定状态的.一般来说如果产生溶胶的是氢氧化钠的话,这层阳离子就是钠离子.1年前查看全部
- 不同用量的大分子会对溶胶产生什么影响---物理化学
 兵临城下db1年前1
兵临城下db1年前1 -
 g5coj 共回答了17个问题
g5coj 共回答了17个问题 |采纳率94.1%浓度越高,粘度越大~1年前查看全部
- 为什么溶胶能够稳定存在
 且介1年前1
且介1年前1 -
 zhuzhifeng2003 共回答了19个问题
zhuzhifeng2003 共回答了19个问题 |采纳率94.7%其实溶胶是不能长期稳定存在的.那是因为胶粒之间带有电荷(不同胶粒电荷种类不同),同种电荷相斥是溶胶能存在的主要原因.1年前查看全部
- 任何溶胶加入可溶性电解质后,都能使胶体微粒凝成较大颗粒形成沉淀而析出 对吗?
任何溶胶加入可溶性电解质后,都能使胶体微粒凝成较大颗粒形成沉淀而析出 对吗?
完整 Duleibuaa1年前1
Duleibuaa1年前1 -
 太过分啦 共回答了18个问题
太过分啦 共回答了18个问题 |采纳率100%除了楼上说的反应造成不析出之外,一些不吸引电荷的胶粒加入电解质也不一定析出.1年前查看全部
- 为什么可溶性电解质能使溶胶凝成较大颗粒
 凭祥人1年前1
凭祥人1年前1 -
 迷糊一晚 共回答了21个问题
迷糊一晚 共回答了21个问题 |采纳率76.2%溶胶一般会带有一定的电荷,同种电荷相互排斥使他们分散在溶液中
加入可溶性电解质会中和这些电荷,然后小溶胶颗粒就凝聚成大颗粒了1年前查看全部
- 将某溶液逐滴加入Fe(OH)3溶胶内,开始时产生沉淀,继续滴加时沉淀又溶解,该溶液是
将某溶液逐滴加入Fe(OH)3溶胶内,开始时产生沉淀,继续滴加时沉淀又溶解,该溶液是
答案是H2SO4可是胶体沉降后,为什么沉淀又会消失,不是H2SO4是电解质才是其沉降的吗,为什么H2SO4最后又与沉淀发生中和呢? 雪千寻smile1年前1
雪千寻smile1年前1 -
 搁浅的巫女 共回答了17个问题
搁浅的巫女 共回答了17个问题 |采纳率94.1%H2SO4是硫酸啊,酸碱中和啊.没有什么问题啊1年前查看全部
- 将某溶液逐滴加入Fe(OH)3溶胶内,开始时产生沉淀,继续滴加时沉淀又溶解,该溶液是( )
将某溶液逐滴加入Fe(OH)3溶胶内,开始时产生沉淀,继续滴加时沉淀又溶解,该溶液是( )
A. 2mol•L-1 H2SO4溶液
B. 2mol•L-1 NaOH溶液
C. 2mol•L-1 MgSO4溶液
D. 硅酸溶胶 chorn1年前2
chorn1年前2 -
 竹青林 共回答了16个问题
竹青林 共回答了16个问题 |采纳率87.5%解题思路:根据胶体的性质及所加物质的性质分析,胶体和电解质溶液能发生聚沉现象.能使胶体聚沉的物质有电解质溶液和带相反电荷的胶体.
A、稀硫酸是电解质溶液能使Fe(OH)3溶胶聚沉,但H2SO4可使Fe(OH)3沉淀溶解,故A正确;
B、氢氧化钠能使Fe(OH)3溶胶聚沉,但不能溶解沉淀,故B错误;
C、MgSO4溶液能使Fe(OH)3溶胶聚沉,但不能溶解沉淀,故C错误;
D、硅酸溶液的胶粒带负电荷,能使Fe(OH)3溶胶聚沉,但不能溶解沉淀,故D错误.
故选A.点评:
本题考点: 胶体的重要性质.
考点点评: 本题考查了胶体的性质,胶体区别于其它分散系的本质特征是胶体粒子直径介于1-100nm之间,而不是丁达尔效应,丁达尔效应是物理变化不是化学变化.1年前查看全部
- 对氢氧化铁溶胶来说,硫酸钾凝结能力应比氯化钾
 忽然黯蓝1年前1
忽然黯蓝1年前1 -
 美丽姑娘卓玛拉 共回答了12个问题
美丽姑娘卓玛拉 共回答了12个问题 |采纳率75%对氢氧化铁溶胶来说,硫酸钾凝结能力应比氯化钾(强)
因为氢氧化铁胶粒呈正电性,而等质量的硫酸钾和氯化钾中,K2SO4中电离出的SO42-所带电荷比KCl电离出的Cl-所带电荷多,所以硫酸钾凝结能力应比氯化钾强.1年前查看全部
- 溶液,溶胶,大分子溶液之间的异同点
 2冷冷的秋1年前1
2冷冷的秋1年前1 -
 曾经流过泪 共回答了18个问题
曾经流过泪 共回答了18个问题 |采纳率100%溶液是指溶质溶于溶剂形成的均一溶液
溶胶是指溶质和溶剂形成的胶状体
大分子溶液之大分子化合物1年前查看全部
- 液态二氧化硅溶胶喷洒在已经硬化的水泥表面会发生什么化学反应
液态二氧化硅溶胶喷洒在已经硬化的水泥表面会发生什么化学反应
希望能列出具体的方程式.尽量讲的详细点.剩下的85分全部给你!
hare_2009的知识渊博,回答的很好。你大概是水泥方面的专家吧!生成的硅酸钙凝胶的颜色是什么?如果喷洒在白水泥的表面,也会生成硅酸钙凝胶吗?我的QQ号是1198175784 交个朋友好吗!以后有问题希望能向你请教! liuzeyan1年前2
liuzeyan1年前2 -
 静水流渊 共回答了17个问题
静水流渊 共回答了17个问题 |采纳率94.1%水泥水化的产物为硅酸钙凝胶、氢氧化钙、铝酸钙和硫铝酸钙,其中氢氧化钙可以与活性二氧化硅反应生成硅酸钙凝胶,称作二次水化反应或火山灰反应.天然火山灰、粉煤灰、矿粉和硅灰拌入水泥,它们的活性(无定形)二氧化硅均能与水泥水化产生的氢氧化钙反发生火山灰反应,将对强度不利和多孔氢氧化钙转化成硅酸钙凝胶.
二氧化硅溶胶的活性较高,喷洒在硬化水泥表面,可以渗透进入水泥浆内部一定深度,同样会发生火山灰反应,提高水泥表面层的强度、密实度以及抗化学腐蚀能力.火山灰反应方程式为:
nCa(OH)2 + SiO2 + mH2O —— nCaO*SiO2*(n+m)H2O
硅酸钙凝胶是白色的.白水泥也是硅酸盐水泥,只不过含铁量很低.所以,白水泥水化后同样会产生大量氢氧化钙,也能够与二氧化硅溶胶反应生成硅酸钙凝胶.1年前查看全部
- 请问氢氧化铁溶胶能用硝酸铁来制备吗?有效日期至08年10月8日?
请问氢氧化铁溶胶能用硝酸铁来制备吗?有效日期至08年10月8日?
传统的氢氧化铁溶胶都是将氯化铁饱和溶液滴在沸水中,想请问一下,能否用硝酸铁饱和溶液制备?具体原因是什么?另外,大侠们知道硝酸铁的溶解度是多少吗? 无女则刚1年前1
无女则刚1年前1 -
 lyp_1206 共回答了16个问题
lyp_1206 共回答了16个问题 |采纳率87.5%可以,硝酸和盐酸一样,都是挥发性酸,在沸水条件下,反应生成的硝酸挥发掉,便可得到氢氧化铁溶胶.但是,一般不采用该方法,一是硝酸在水中溶解度比盐酸大,因而挥发性要差一些,二是生成的硝酸在加热状态下容易产生二氧化氮,有毒的.查看原帖1年前查看全部
- 溶胶 溶液 沉淀 区别溶液的溶质和溶剂有没有明显的相界面啊
 男儿自当ss1年前2
男儿自当ss1年前2 -
 冯小妮 共回答了18个问题
冯小妮 共回答了18个问题 |采纳率88.9%三种分散系,分散质粒子的大小不同.
溶液,分散质粒子直径小于10^-9 m,即小于1 nm
溶胶,在10^-9 10^-7 m之间,即1~100 nm之间
沉淀,分散质粒子较大,在10^-7 m以上,即大于100 nm,所以颗粒发生了沉降.1年前查看全部
- 将某溶液逐滴加入氢氧化铁溶胶内,开始时产生沉淀,继续滴加时沉淀溶解,该溶液是( )
将某溶液逐滴加入氢氧化铁溶胶内,开始时产生沉淀,继续滴加时沉淀溶解,该溶液是( )
A. 2mol/L H2SO4 溶液
B. 2mol/L NaOH溶液
C. 2mol/L MgSO4溶液
D. 硅酸溶胶 yydgs1年前1
yydgs1年前1 -
 惯坏了 共回答了18个问题
惯坏了 共回答了18个问题 |采纳率94.4%解题思路:胶体在电解质的作用下发生凝聚,在Fe(OH)3溶胶内滴入H2SO4溶液,H2SO4开始起电解质溶液的作用,使Fe(OH)3胶体发生凝聚,形成沉淀,继续滴加,硫酸与Fe(OH)3沉淀发生中和反应沉淀溶解.A、在Fe(OH)3溶胶内滴入H2SO4溶液,H2SO4开始起电解质溶液的作用,使Fe(OH)3胶体发生凝聚,形成沉淀,继续滴加,硫酸与Fe(OH)3沉淀发生中和反应沉淀溶解,故A正确;
B、加入2mol/L氢氧化钠溶液只能使胶体聚沉,而不能使胶体溶解,故B错误;
C、加入2mol/L硫酸镁溶液只能使胶体聚沉,而不能使胶体溶解,故C错误;
D、加入硅酸溶液能使胶体聚沉,但硅酸酸性极弱,不能与Fe(OH)3沉淀发生中和反应而溶解,故D错误.
故选A.点评:
本题考点: 胶体的重要性质
考点点评: 本题考查胶体的性质,题目难度不大,注意胶体的性质,本题易错点为D项,注意硅酸的酸性较弱,不能与Fe(OH)3沉淀发生中和反应.1年前查看全部
- 二氧化硅溶胶的问题它们的活性(无定形)二氧化硅均能与水泥水化产生的氢氧化钙反发生火山灰反应,“活性(无定形)二氧化硅”是
二氧化硅溶胶的问题
它们的活性(无定形)二氧化硅均能与水泥水化产生的氢氧化钙反发生火山灰反应,“活性(无定形)二氧化硅”是指 1:液体二氧化硅 2:液体二氧化硅溶胶 3:二氧化硅溶胶!究竟是哪一个?特请hare_2009解答.不懂的过客,就不要废话了.
硅酸钙凝胶的硬度怎么样,应该和水泥差不多吗? 风中的秋虫1年前1
风中的秋虫1年前1 -
 蛮风 共回答了18个问题
蛮风 共回答了18个问题 |采纳率94.4%二氧化硅有多种形态,最常见的是晶体形态,即石英,常温下没有活性活性;无定形二氧化硅也称作玻璃态二氧化硅,是高温急冷形成的固态二氧化硅矿物,常温下有化学活性,能够与碱发生反应.所以,无定形二氧化硅不是液体,也不是溶胶.
硅酸钙凝胶是水泥水化反应对强度贡献最大的水化产物,砂浆或混凝土主要依靠硅酸钙凝胶胶凝形成整体,它的硬度就代表水泥石硬度.此外,硅酸钙凝胶的化学稳定性非常高,酸碱盐均不能溶解或腐蚀.
二氧化硅溶胶的化学活性很高,常温下能与氢氧化钙反应.然而,液体溶胶的粘度一定要很低,才能渗透进入硬化水泥浆体,发生火山灰反应,实现提高强度、降低渗透性的作用.1年前查看全部
- 憎水溶胶,亲水溶液、粒子胶体、分子胶体区别
 cloe1年前1
cloe1年前1 -
 ssuukkee 共回答了17个问题
ssuukkee 共回答了17个问题 |采纳率100%粒子胶体:故名思议就是由粒子形成的胶体
分子胶体:由分子形成的胶体
憎水胶体和亲水胶体既可以是粒子胶体也可以是分子胶体.
憎水胶体加入电解质后就能使溶胶聚沉,它的稳定性主要决定于胶粒表面电荷的多少
亲水胶体加入少量盐类不会引起明显的沉淀,因为它的稳定性主要决定于胶粒表面的溶剂化层.1年前查看全部
- 老师说珍珠是固溶胶,可它为什么没有丁达尔现象
 阿八山gg1年前1
阿八山gg1年前1 -
 幸福再等我 共回答了13个问题
幸福再等我 共回答了13个问题 |采纳率92.3%也有,只是固溶胶相比液体气体不太明显,另外珍珠透光性不是很强,大部分光都被吸收了1年前查看全部
大家在问
- 1Don't ask ()(she) any questions.()(her) knows nothing.
- 2“嫦娥一号”是我国自主研制、成功发射的第一个月球探测器.“嫦娥一号”的发射过程包括火箭发射、入轨、变轨、奔月、绕月等过程
- 3公园里有一个圆形喷水池,周长是31.4米.这个喷水池的面积是多少?
- 4海边语用英语怎么说
- 5premium milk是什么?
- 6我感觉身体不舒服用音语怎么说,急急急急急急急急急急急!!!!
- 7内能包括哪些?机械能包括哪些?风能?光能?生物能?动能?化学能?
- 8读下图,完成小题。 小题1:若A表示海洋,B表示陆地,箭头表示的洋流为( ) A.北半球暖流 B.南半球暖流 C.北半球
- 9红楼梦描写景色 句子
- 10我国古代的经典四书是那四书? 求解答。
- 11下面是宋朝高观国的词《声声慢》的下片,填入横线处的两句正确的一项是 [
- 12这俩图形的周长是多少
- 13以 What should we do when an earthquake breaks out?为题,写一篇英语短文
- 14GB/T12459 90E(S) 50-SCH5代表的是什么意思啊
- 15西方乐器的英文,顺便带上中文翻译
