铝的活动性比铁强,但铝在空气中表现出良好的抗腐性,其原因在_______ .
 53502022-10-04 11:39:543条回答
53502022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 汇中68 共回答了18个问题
汇中68 共回答了18个问题 |采纳率94.4%- 铝被氧化后,形成了致密的氧化膜,阻碍了进一步的腐蚀.所以能在空气中表现出良好的抗腐性
- 1年前
 菊乐 共回答了194个问题
菊乐 共回答了194个问题 |采纳率- 铝的活动性比铁强,但铝在空气中表现出良好的抗腐性,其原因在_______ 铝的表面形成一种致密的氧化物薄膜 阻止铝的继续氧化
- 1年前
 cadishabby 共回答了1个问题
cadishabby 共回答了1个问题 |采纳率- 铝在空气中被氧化成三氧化二铝,三氧化二铝遇空气中的水蒸气转化成氢氧化铝,而氢氧化铝则不同意被腐蚀,铁和空气中的氧气,水蒸气反映生成氢氧化铁,而氢氧化铁遇偏酸偏碱都易反应,生成的氯化铁能再与水蒸气反应生成氢氧化铁,使反应循环进行,自然会被腐蚀...
- 1年前
相关推荐
- 同学们一起探究铝铁铜三种金属的活动性,小明同学设计了用铜丝、铁丝、铝丝和稀盐酸,只用了一只试管,取一次盐酸的探究方案.小
同学们一起探究铝铁铜三种金属的活动性,小明同学设计了用铜丝、铁丝、铝丝和稀盐酸,只用了一只试管,取一次盐酸的探究方案.小明同学方案中插入金属的顺序是( )
A.Cu Fe Al
B.Fe Cu Al
C.Al Fe Cu
D.Al Cu Fe 芙蕖秋韵1年前1
芙蕖秋韵1年前1 -
 可爱的小青鸟 共回答了16个问题
可爱的小青鸟 共回答了16个问题 |采纳率81.3%解题思路:根据金属活动性顺序解答本题,在金属活动性顺序中,排在氢前面的金属能与算反应生成氢气,排在前面的金属能把排在其后面的金属从其盐溶液中置换出来;在金属活动性顺序中,排在氢前面的金属能与算反应生成氢气,排在前面的金属能把排在其后面的金属从其盐溶液中置换出来;
在金属活动性顺序中,三种金属的活动性:铝>铁>(H)>铜;故插入金属的顺序是铜、铁、铝;
故答案:A点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 同学们要会利用金属活动顺序表设计实验,去验证金属的活动性强弱.氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.1年前查看全部
- 为探究X.Y.Z三种金属的活动性顺序,某科学小组进行了下列实验
为探究X.Y.Z三种金属的活动性顺序,某科学小组进行了下列实验
(1)向试管中加少量的稀盐酸,插入X,产生气泡,溶液由无色变为浅绿色.
(2)在(1)所得溶液中插入Y,无明显现象.
(3)在(1)所得溶液中插入Z,溶液由浅绿色变为无色. 李毅在uu1年前3
李毅在uu1年前3 -
 野猫的恋情 共回答了19个问题
野猫的恋情 共回答了19个问题 |采纳率94.7%知道活动性强的制取弱的
①X可以置换出H2,则X在H前面
②Y不能吧X从其盐溶液中置换出来说明X>Y
③Z能把X从其盐溶液置换出来,则Z>X
则Z>X>Y1年前查看全部
- (14分)Ⅰ.有甲、乙两位学生均想利用原电池反应检测金属的活动性顺序,两人均使用镁片和铝片作电极,但甲同学将电极放入2
(14分)
Ⅰ.有甲、乙两位学生均想利用原电池反应检测金属的活动性顺序,两人均使用镁片和铝片作电极,但甲同学将电极放入2 mol/L H 2 SO 4 溶液中,乙同学将电极放入2 mol/L的NaOH溶液中,如图: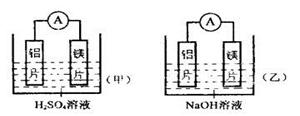
(1)写出甲池中正极的电极反应式: ;
(2)写出乙池中负极的电极反应式: ;
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出 活动性更强,而乙会判断出 活动性更强(填元素符号)。
(4)由此实验,可得到如下哪些正确结论?()
Ⅱ.向一个容积为2 L的密闭容器中充入2 mol A和1 mol B,发生如下反应:2 A(g) + B(g)A.利用原电池反应判断金属活动性顺序时应注意选择合适的电解质 B.镁的金属性不一定比铝的金属性强 C.该实验说明金属活动顺序表已过时,已设有实用价值 D.该实验说明化学研究对象复杂、化学反应受条件影响较大,因此应具体问题具体分析  xC(g) + D(g),反应达到平衡时C的浓度为1.2 mol/L,B的浓度为0.1 mol/L。
xC(g) + D(g),反应达到平衡时C的浓度为1.2 mol/L,B的浓度为0.1 mol/L。
(1)x= ;
(2)若使容器温度升高,平衡时混合气体的平均相对分子质量减小,则正反应为
(填“吸热”或“放热”)反应;
(3)若维持容器体积和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是 (用序号填空)
①4 mol A + 2 mol B
②3 mol C + 1 mol D
③3 mol C + 1 mol D +1 mol B 剑文飞1年前1
剑文飞1年前1 -
 272671053 共回答了26个问题
272671053 共回答了26个问题 |采纳率80.8%Ⅰ.(1)2H + +2e - = H 2 ↑(2分)
(2)2Al+8OH - -6e - = 2AlO 2 - +4H 2 O (或Al+4OH - -3e - = AlO 2 - +2H 2 O)(2分)
(3)Mg;Al (每空1分)(4)A D(2分)
Ⅱ.(1)3(2分)(2)吸热(2分)(3)②(2分)
Ⅰ.(1)在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。甲中铝是正极,镁是负极。正极反应式为2H + +2e - = H 2 ↑。
(2)乙中,由于铝可以和氢氧化钠溶液反应,而镁不能,所以镁是正极,铝是负极。负极反应式为2Al+8OH - -6e - = 2AlO 2 - +4H 2 O 。
(3)根据原理可知,甲中镁的活泼性强于铝的。而乙中则得出铝的活泼性强于镁的。
(4)根据以上实验事实可知,选项AD是正确的。
Ⅱ.(1)平衡时B的浓度为0.1 mol/L,则消耗的B的浓度是0.5mol/L-0.1mol/L=0.4mol/L。由于浓度的变化之比是相应的化学计量数之比,所以x=3。
(2)由于正反应是体积增大的反应,所以当混合气体的平均相对分子质量减小时,平衡是向正反应方向移动的,即正反应是吸热反应。
(3)由于平衡的建立和途径无关,②③分别相当于AB的物质的量是2mol、1mol和2mol、2mol,所以②符合。③相当于增大A的转化率,达到平衡时C的浓度大于1.2 mol/L。①相当于在原平衡的基础上增大压强,平衡向逆反应方向移动,但达到平衡时C的浓度大于1.2 mol/L,而小于2.4mol/L。答案选②。1年前查看全部
- 下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是( )
下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是( )
A. 在氧化-还原反应中,甲原子失去的电子比乙原子失去的电子多
B. 同价态的阳离子,甲比乙的氧化性强
C. 甲能跟稀盐酸反应放出氢气而乙不能
D. 将甲、乙作电极组成原电池时,甲是负极 漫长2581年前2
漫长2581年前2 -
 mmxopq 共回答了14个问题
mmxopq 共回答了14个问题 |采纳率92.9%解题思路:A、根据金属的金属性强弱与得失电子多少是否有关分析;
B、根据金属的金属性强弱与同价阳离子的关系分析;
C、与酸反应置换氢气的难易分析;
D、根据原电池的电极分析;A、金属的金属性强弱与得失电子的难易有关,与得失电子的多少无关,故A错误.
B、同价态的阳离子,甲比乙的氧化性强,则乙的金属性比甲的强,故B错误.
C、甲能跟稀盐酸反应放出氢气而乙不能,根据金属活动性顺序表知,金属甲的活动性比金属乙的活动性强,故C正确.
D、将甲、乙作电极组成原电池时,一般是活泼的金属作负极,但也有非常现象,如:镁、铝和氢氧化钠形成的原电池中,铝作负极而镁作正极,所以不能说明金属甲的活动性比金属乙的活动性强,故D错误;
故选C.点评:
本题考点: 常见金属的活动性顺序及其应用.
考点点评: 本题考查了金属活泼性的判断方法,要注意的是:金属的金属性强弱与得失电子的难易有关,与得失电子的多少无关.1年前查看全部
- 钙的活动性比钠强,为什么在写成硅酸盐的氧化物的形式的时候,先写Na2O后写Ca2O?
钙的活动性比钠强,为什么在写成硅酸盐的氧化物的形式的时候,先写Na2O后写Ca2O?
硅酸盐写成氧化物形式的时候是:活泼金属氧化物—较活泼金属的氧化物—Si2O—(H2O)
这么写的呀。比如说NA2O·CAO·6SIO2 九九玲珑1年前2
九九玲珑1年前2 -
 hamas317 共回答了18个问题
hamas317 共回答了18个问题 |采纳率88.9%金属活动顺序只是反应金属活泼的方面,而氧化物则不一定.氧化钠比氧化钙活泼.你看氧化钠还能被氧化成过氧化钠而钙就不行.氢氧化钠的碱性也比氢氧化钙强.每种物质都有它独特的性质,并不是像数学一样用逻辑推导的.1年前查看全部
- 如何比较锰和铁的活动性?初三化学试题、
如何比较锰和铁的活动性?初三化学试题、
猜想:金属锰的活动性比铁强
验证方法:将银白色的锰投入到氯化亚铁溶液中
现象:金属锰表面有黑色物质析出
结论:猜想正确
除了用上述方法比较锰和铁的活动性以外,还可采取______________的方法.
 davidboy0211年前1
davidboy0211年前1 -
 tjsyw 共回答了28个问题
tjsyw 共回答了28个问题 |采纳率92.9%让Mn、Fe和盐酸反应比较放氢气速率1年前查看全部
- x,y,z,三种金属的活动性可用下列哪些化学方程式说明?
 榕树下的守护者1年前2
榕树下的守护者1年前2 -
 aqie_001 共回答了18个问题
aqie_001 共回答了18个问题 |采纳率83.3%方程式有些难打我就语言说一下好了.
看x能否和酸发生氧化反应.(在能和氢离子反应的条件下)
y能否和x和z的盐发生置换反应.
反之也是如此.1年前查看全部
- 关于氢原子的活动性的比较请问苯酚中羟基上的氢原子与乙醇羟基的氢原子哪个更活泼 还有就是羟基上氢原子的活泼性怎么比较啊
 beijingfengzi1年前1
beijingfengzi1年前1 -
 爱新觉罗疯子 共回答了23个问题
爱新觉罗疯子 共回答了23个问题 |采纳率95.7%苯酚中羟基上的氢原子比乙醇羟基的氢原子活泼,氢原子活性与物质的酸性有关,由强酸制弱酸的反应原理可以得出.
苯酚+NaOH→苯酚钠+H2O,而乙醇不与NaOH反应,所以苯酚>乙醇.1年前查看全部
- 请详细解释一下这个化学题小明设计实验探究铁、铜、银三种金属的活动性顺序.他设计了四个实验方案,分别选择的试剂是:①铜、银
请详细解释一下这个化学题
小明设计实验探究铁、铜、银三种金属的活动性顺序.他设计
了
四个实验方案,分别选择的试剂是:①铜、银、硫酸亚铁溶液;②
铁、银、硫酸铜溶
液
;③银、硫酸亚铁溶液、硫酸铜溶液
;④铜、硫酸亚铁溶液、硝酸银溶液
.上述
四个方案所选试剂正确的是:
这题答案给的是2和4 czescc1年前5
czescc1年前5 -
 zxzxstar 共回答了17个问题
zxzxstar 共回答了17个问题 |采纳率82.4%小明设计实验探究铁、铜、银三种金属的活动性顺序.他设计了四个实验方案,分别选择的试剂是①铜、银、硫酸亚铁溶液;
②铁、银、硫酸铜溶液;
③银、硫酸亚铁溶液、硫酸铜溶液;
④铜、硫酸亚铁溶液、硝酸银溶液.
上述四个方案所选试剂正确的是:②④
②铁与硫酸铜溶液反应;说明铁的活动性比铜强
银不与硫酸铜溶液反应;说明铜的活动性比银强.
④铜与硫酸亚铁溶液不反应、说明铜的活动性不如铁.
铜与硝酸银溶液反应,说明铜的活动性比银强.1年前查看全部
- 用实验验证Zn、Cu、Ag三种金属的活动性顺序,请写出两种可行方案所需的物质.
 新潮三毛1年前3
新潮三毛1年前3 -
 bushibao 共回答了18个问题
bushibao 共回答了18个问题 |采纳率94.4%解题思路:用实验验证Zn、Cu、Ag三种金属的活动性顺序,根据其活动性Zn>Cu>Ag,所选择的物质一定要能分别证明各金属的活动性强弱.在金属活动性顺序中,只有前面的金属可以把排在它后面的金属从盐溶液中置换出来,要比较金属的活动性大小,常用金属与盐溶液的反应.要验证三种金属活动性大小关系时,通常采取“三取中”的方法即:取中间金属单质与两端的金属的盐溶液反应或取中间金属的盐溶液与两端金属的单质反应.根据三种金属的活动性顺序Zn>Cu>Ag,可选择中间金属的盐溶液和其他两种金属,即Zn,CuSO4溶液,Ag;
或中间金属和其他两种金属的盐溶液 即ZnSO4溶液,Cu,AgNO3溶液.
答:Zn、CuSO4、Ag或 Cu、ZnSO4、AgNO3等.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 本题主要考查了对金属活动性顺序的应用和理解,难度不是很大,通过练习,培养学生的理解能力和应用能力.1年前查看全部
- 证明铁的活动性比铜强的化学方程式
 sklier1年前3
sklier1年前3 -
 pylaozi 共回答了18个问题
pylaozi 共回答了18个问题 |采纳率88.9%将铁丝浸入硫酸铜溶液中,有红色固体出现,证明铁的活动性比铜强 Fe + CuSO4 == FeSO4 +Cu1年前查看全部
- 金属活动性顺序(高一用)高一用的活动性顺序 但是不要太全【比如无机化学书上那个太全了……全的我想撞墙 背不完的】也不要拿
金属活动性顺序(高一用)
高一用的活动性顺序 但是不要太全
【比如无机化学书上那个太全了……全的我想撞墙 背不完的】
也不要拿初中的来蒙我 嗯 就是这样 endeavor_gw1年前6
endeavor_gw1年前6 -
 凯小 共回答了19个问题
凯小 共回答了19个问题 |采纳率94.7%(初中)钾钙钠镁铝、锌铁锡铅氢、铜汞银铂金.
(高中)钾钙钠镁铝锰锌、铬铁镍、锡铅氢、铜汞银铂金.
常见的就是这几种1年前查看全部
- 原电池关于正负极材料.一般情况下是活动性较强的是负极,较弱的是正极.也只是一般情况下而已,那么不一般的时候怎么样?为什么
原电池关于正负极材料.
一般情况下是活动性较强的是负极,较弱的是正极.也只是一般情况下而已,那么不一般的时候怎么样?为什么会这样? 长沙不了情1年前1
长沙不了情1年前1 -
 888813 共回答了15个问题
888813 共回答了15个问题 |采纳率86.7%这要从原电池的原理来分析.正极是得电子的一极,负极是失电子的一极.那么我们就以金属和酸的反应为例,由于失电子的是金属单质,得电子的是氢离子,所以负极材料一定是能与溶液中的酸反应的,正极材料要么不能与溶液中的酸反应,要么不如负极金属那么容易与那个酸反应.这么一看,自然是活动性更强的是负极了!
然而,如果我们把电池里的溶液换成碱溶液,那么情况就变了——只有两性金属可以和碱反应.所以,如果溶液为氢氧化钠,负极为锡(锡是两性金属),正极为铁,那么不就正好是一个原电池了吗?这就是你所谓的“不一般情况”了.之所以这样,就是因为虽然铁比锡活泼,但铁根本不能与氢氧化钠反应,而锡能,所以锡就是负极啦.
再例如,负极为锌,正极为铝,溶液时浓硫酸,温度为常温.由于常温下浓硫酸会使铝、铁等金属钝化,所以虽然铝比锌活泼,但由于铝被钝化后就不能与浓硫酸反应了,所以锌是负极.
这样讲你能明白吗?不明白的话欢迎使用追问功能或者Hi我.:)1年前查看全部
- 化学题一道,会的快进.为了探究金属的活动性顺序,张丽同学用铁丝、锌片、铜丝、稀盐酸.硫酸铜溶液、硝酸银溶液进行以下实验.
化学题一道,会的快进.
为了探究金属的活动性顺序,张丽同学用铁丝、锌片、铜丝、稀盐酸.硫酸铜溶液、硝酸银溶液进行以下实验.
实验一:将锌片与铜片分别放入稀盐酸中,锌片表面有气泡产生,铜片无明显变化;
实验二:将铁丝放入硫酸铜溶液中,铁丝表面有红色固体沉积;
实验三:将铜片放入硝酸银溶液中,铜片表面有黑色物质生成,一段时间后逐渐变为银白色.
(1)由以上实验可以得出金属活动性的关系是——;
(2)要确定上述四种金属的活动性顺序,应补充——实验,理由是——. candy铃子1年前6
candy铃子1年前6 -
 sheday1 共回答了18个问题
sheday1 共回答了18个问题 |采纳率100%(1)实验一:金属活动性Zn大于Cu
实验二:金属活动性Fe大于Cu
实验三:金属活动性Cu大于Ag
由以上实验可以得出金属活动性的关系是Zn大于Cu Fe大于Cu Cu大于Ag
(2)将锌片放入硫酸亚铁溶液中.理由是上述实验无法比较Zn和Fe的金属活动性强弱1年前查看全部
- 一个胡思乱想的化学问题氧化物溶于水后不能独立存在是因为氧离子于H2O生成OH-那么不溶是什么原因呢?是因为阳离子活动性弱
一个胡思乱想的化学问题
氧化物溶于水后不能独立存在是因为氧离子于H2O生成OH-
那么不溶是什么原因呢?是因为阳离子活动性弱1吗?
如果很蠢别嘛我 乱想的 疯果1年前6
疯果1年前6 -
 吴宫燕市 共回答了20个问题
吴宫燕市 共回答了20个问题 |采纳率100%非金属氧化物固体多为分子晶体,其中由共价键连接,水是极性分子,因为分子结构无法抵消原子间的电负性,所以非极性物质无法溶于水,或微溶.楼主的问题太宽泛,初三的知识不足以解释水溶性,主要是由于分子间力导致水溶性不同.如氨气,由于N和水的O存在较强分子间作用力,氢键,所以氨气的水溶性格外强.
金属氧化物多为离子晶体,ALCL3除外,溶于水之间离子键被破坏,转化为自由离子,有的沉淀不溶,我想是因为不溶物原子间电负性的差别,电负性通俗讲就是两个原子抢电子,谁抢的过来一点的衡量.
讲的不太清楚,还是等学到大学再来理解吧,初中差太多.1年前查看全部
- 一道化学实验题现有铁片、铜片,盐酸和硝酸汞溶液四种物质,为了确定Fe、Cu、Hg、H的活动性顺序,同学们设计了很多实验方
一道化学实验题
现有铁片、铜片,盐酸和硝酸汞溶液四种物质,为了确定Fe、Cu、Hg、H的活动性顺序,同学们设计了很多实验方案,其中用三个实验步骤,便能确定它们的活动性顺序的最佳方案.请简述实验步骤. 铃木重秀1年前2
铃木重秀1年前2 -
 tianya0688 共回答了26个问题
tianya0688 共回答了26个问题 |采纳率92.3%铁片放入盐酸中:Fe>H
铜放入盐酸中:H>Cu
铜放入硝酸汞中:Cu>Hg
Fe>H>Cu>Hg1年前查看全部
- 现有银,铜,铁,锌四种金属,若要验证它们的活动性顺序,现已选择了食醋,你认为还需要的另一种溶液是
现有银,铜,铁,锌四种金属,若要验证它们的活动性顺序,现已选择了食醋,你认为还需要的另一种溶液是
现有银、铜、铁、锌四种金属,若要验证它们的活动性顺序,现已选择了食醋,你认为还需要的另一种溶液是 gxgjb1年前1
gxgjb1年前1 -
 h1as55ah 共回答了18个问题
h1as55ah 共回答了18个问题 |采纳率94.4%氯化铁…1年前查看全部
- 实验室用铜、铁、锌、铝与稀硫酸反应,以研究金属的活动性顺序:
实验室用铜、铁、锌、铝与稀硫酸反应,以研究金属的活动性顺序:
(1)为了使此实验成功,必须做到两个相同:既( )和( ).
(2)此反应比较上述四种金属的活动性的依据是看( ). 阿坷1年前1
阿坷1年前1 -
 070603060 共回答了18个问题
070603060 共回答了18个问题 |采纳率88.9%使用药品的规格相同,反应时间相同
依据是相同时间内产生氢气的多少1年前查看全部
- 1为什么除了K Ca Na三种金属外,其余金属能将比自身活动性弱的金属从其盐溶液里置换出来
1为什么除了K Ca Na三种金属外,其余金属能将比自身活动性弱的金属从其盐溶液里置换出来
2什么是共价化合物 【从结构上讲,电解质均为共价化合物或离子化合物】 霸柔1年前1
霸柔1年前1 -
 seng112 共回答了27个问题
seng112 共回答了27个问题 |采纳率88.9%K Ca Na 三种金属进入水中后会先与水反应,置换出水中的氢,而其他金属能置换出活动性比自己弱的金属的原因是活动性强易失去电子,相应的活动性弱易得到电子,置换反应通过电子的转移发生
共价化合物是指原子之间通过共价键(公用电子对)结合在一起形成分子的化合物1年前查看全部
- 比较Cu、Fe、Ag三种金属的活动性顺序
比较Cu、Fe、Ag三种金属的活动性顺序
操作及现象:把铁、银分别放入硫酸铜溶液中,铁表面没有现象;而银表面会附着一层红色物质,并且溶液会由蓝色逐渐变为无色 yizhibudong1年前1
yizhibudong1年前1 -
 wangisking 共回答了21个问题
wangisking 共回答了21个问题 |采纳率95.2%铁最活波、铜居中间、银最不活波1年前查看全部
- (2007•济宁)为探究金属的活动性顺序,张丽同学利用铁丝、锌片、铜丝、稀盐酸、硫酸铜溶液、硝酸银溶液进行了下面的实验:
(2007•济宁)为探究金属的活动性顺序,张丽同学利用铁丝、锌片、铜丝、稀盐酸、硫酸铜溶液、硝酸银溶液进行了下面的实验:
实验一:将锌片与铜片分别放入稀盐酸中,锌片表面有气泡产生,铜片无明显变化;
实验二:将铁丝放入硫酸铜溶液中,铁丝表面有红色固体沉积;
实验三:将铜片放入硝酸银溶液中,铜片表面有黑色物质生成,一段时间后逐渐变为银白色.
(1)由实验可得出的金属活动性关系是______;
(2)要确定上述四种金属的活动性顺序,应补充______实验,理由是______. c54531d4d01060f41年前1
c54531d4d01060f41年前1 -
 qjx0816 共回答了16个问题
qjx0816 共回答了16个问题 |采纳率75%解题思路:分析探究实验所出现的实验现象,判断四种金属的活动性强弱关系;并对实验方案中的不足进行修改和完善.(1)由实验一的现象可得知,锌在活动性顺序表中处于H之前而铜处于H之后;由实验二的现象可知,金属铁的活动性比铜强;由实验三的现象可知,金属铜的活动性比银强;
故答案为:锌、铁>铜>银(或Zn、Fe>Cu>Ag);
(2)由探究方案中的三个实验的分析,可发现金属锌与铁的活动性强弱关系尚未明确,因此需要补充检验两金属活动性强弱的实验;可利用两金属与酸反应比反应速率或利用两金属间的置换来检验;
故答案为:锌、铁与稀盐酸(稀HCl)【或锌与硫酸亚铁(FeSO4)溶液】;通过比较二者的反应速率,确定锌与铁的活动性顺序[或锌是否可以置换出硫酸亚铁溶液中的铁,确定锌与铁的活动性顺序)说明(2)小题中,其他合理答案也可得分.]点评:
本题考点: 金属活动性的探究.
考点点评: 根据金属与酸反应看反应速率,或金属与盐溶液反应看结果的方法,比较金属的活动性.1年前查看全部
- 某兴趣小组的同学在探究Al和Cu的活动性时,将一根用砂纸打磨过的Al丝浸入CuSO 4 溶液中,他们发现在铝的表面覆盖红
某兴趣小组的同学在探究Al和Cu的活动性时,将一根用砂纸打磨过的Al丝浸入CuSO 4 溶液中,他们发现在铝的表面覆盖红色物质的同时,有较多的气泡产生.
[提出问题]气体的成分是什么呢?
[提出猜想]①甲同学认为该气体可能是H 2 ②乙同学认为该气体可能是O 2 ③丙同学认为该气体可能是SO 2 ④丁同学认为该气体可能是CO 2
[分析]从CuSO 4 的水溶液中所含元素种类分析,甲同学认为丁同学的猜想是不成立的,理由是CuSO 4 的水溶液中 _________ .
[实验探究]①乙同学用试管收集了一试管气体,嗅了一下气味,发现无气味,证明同学的猜想也不成立.
②进一步用实验探究该气体的成分:
[反思]由该探究实验可知CuSO 4 溶液显 _________ 性(填“酸”或“碱”或“中”).  浦东往东1年前1
浦东往东1年前1 -
 肖丽娟 共回答了22个问题
肖丽娟 共回答了22个问题 |采纳率90.9%[分析]无含碳元素的物质存在;
[实验探究]②木条不复燃;有爆鸣声;
[反思]酸.1年前查看全部
- M是一种活动性比铁强的金属,M离子(M2+)与其它几种离子构成的化合物的溶解性见下表:
M是一种活动性比铁强的金属,M离子(M2+)与其它几种离子构成的化合物的溶解性见下表:
有下列各组物质:①M+HCl;②M(NO3)2+BaCl2;③MO+HCl;④M(0H)2+NaCl;⑤M(0H)2+HCl;⑥M(NO3)2+HCl;⑦MCO3+HCl;⑧MSO4+BaCl2,其中不能直接反应制取MCl2的是( )O2- OH - CO32- Cl一 SO42- NO3- M 2+ 难溶 难溶 难溶 易溶 易溶 易溶
A. ②④⑥
B. ⑤⑥⑦⑧
C. ①②④⑦
D. ①③⑤⑧ tangege1年前9
tangege1年前9 -
 阿土伯11 共回答了14个问题
阿土伯11 共回答了14个问题 |采纳率85.7%解题思路:根据金属活动性顺序和复分解反应发生的条件解答,复分解反应发生的条件为有气体、沉淀、水等物质产生.金属M在铁的前边,可以和盐酸反应生成氯化物和氢气,所以①可行;根据酸的性质可以知道金属氧化物和碱都可以和盐酸反应,故③⑤可行;⑦⑧的生成物中分别有气体和沉淀,能够发生复分解反应⑦⑧也可行;②④⑥反应生成物中既无沉淀也无气体或者水生成,因此不能直接制取MCl2.
故选A.点评:
本题考点: 复分解反应及其应用;金属活动性顺序及其应用;物质的相互转化和制备.
考点点评: 本题考查的是复分解反应发生条件的综合拓展及盐酸的有关性质.1年前查看全部
- 将铁和铜分别放入硝酸银溶液中,为什么不能比较铁和铜的金属的活动性
 超爱apple1年前1
超爱apple1年前1 -
 mqgyear 共回答了14个问题
mqgyear 共回答了14个问题 |采纳率92.9%由于铁和铜的活泼性均在银前面,
故均能从硝酸银溶液中置换出银,
反应现象故相同,均为在铁(铜)片上,有一层银色的金属覆盖
要比较的话:应该用金属活泼性在铁和铜之间的盐溶液,
或直接用稀硫酸:放氢气的是铁,无现象的是铜1年前查看全部
- 一个化学问题电解两种离子共存的溶液时,某离子先析出,能否说明该离子的活动性顺序较小.两种离子都是金属离子.请写出具体的原
一个化学问题
电解两种离子共存的溶液时,某离子先析出,
能否说明该离子的活动性顺序较小.
两种离子都是金属离子.
请写出具体的原因.谢谢. rick_carter1年前2
rick_carter1年前2 -
 lgjian312 共回答了19个问题
lgjian312 共回答了19个问题 |采纳率89.5%先析出的金属,离子的得电子能力强,说明单质的失电子能力就弱,所以先析出来的单质活动性弱,离子活动性强.要区分看的1年前查看全部
- 氢气可否与金属氧化物反应,将金属氧化物中的比它活动性弱的金属元素置换出来 还有氢气可溶于水吗
 小鱼乐游游1年前3
小鱼乐游游1年前3 -
 怎么搞滴 共回答了20个问题
怎么搞滴 共回答了20个问题 |采纳率90%氢气当然以与金属氧化物反应,不但将金属氧化物中的比它活动性弱的金属元素置换出来,也能将金属氧化物中的比它活动性强的金属元素置换出来,如氢气还原氧化铁.氢气难溶于水.1年前查看全部
- 水果电池正负极的选择和金属活动性有什么关系?是活动性强的做正极,还是弱的?
 定不下心的人1年前2
定不下心的人1年前2 -
 wenglp 共回答了21个问题
wenglp 共回答了21个问题 |采纳率81%这是作原电池的一种家用方法,
原理是活泼的失去电子,
所以负极活动性强,而正极可以不是金属,常见的是碳棒,
因为失去的电子是与离子溶液放生反应的.1年前查看全部
- 已知金属甲比金属乙同价态的阳离子的氧化性强 能否说明金属甲的活动性比金属乙的活动性强呢?
 风吹着沙1年前2
风吹着沙1年前2 -
 kentclark 共回答了31个问题
kentclark 共回答了31个问题 |采纳率83.9%不能,举个反例:Fe + Cu2+ =Cu + Fe2+则因为氧化剂氧化性大于氧化产物铜离子氧化性大于亚铁离子,但显然,铁比铜活泼.平常所说的金属活动性和其离子氧化性顺序的关系是比较笼统的关系,像这种题目就不能一概而论1年前查看全部
- 仅用Cu、AgCl、H2O三种物质,无法比较Cu和Ag的活动性 原因是什么
 lubeh1年前7
lubeh1年前7 -
 小雨668 共回答了14个问题
小雨668 共回答了14个问题 |采纳率100%AgCl沉淀,你怎么让他跟Cu反应比较?!1年前查看全部
- 能验证铁,铜,银三种金属的活动性顺序的一组试剂是
能验证铁,铜,银三种金属的活动性顺序的一组试剂是
A:Fe,CuCl2溶液,Ag
B:FeCl2溶液,CuCl2溶液,Ag
C:FeCl2溶液,Cu,Ag
D:FeCl2溶液,Cu,AgCl shanghaixiaojie1年前4
shanghaixiaojie1年前4 -
 xukeke456 共回答了14个问题
xukeke456 共回答了14个问题 |采纳率85.7%选A.
CuCl2溶液、Fe单质、Ag单质
把Fe单质与Ag单质分别放入到CuCl2溶液中,出现红色固体的是Fe,没有变化的是Ag.
由此证明Fe可以置换出Cu,Ag不能置换出Cu,所以金属活动性顺序是Fe>Cu>Ag1年前查看全部
- 活动性最强的金属是()为什么是锂,不是铯啊.求告知
 憨楠1年前3
憨楠1年前3 -
 jin339 共回答了12个问题
jin339 共回答了12个问题 |采纳率91.7%锂(Lithium),是一种化学元素,是金属活动性较强的金属(金属性最强的金属是铯),活动性.由于金属活动性的判定依据是金属的标准电极电势,而金属性只与金属失电子能力有关,因此会产生金属性与金属活动性不一致的情况..,所以金属活动性最强的是金属是锂.金属性最强的是铯1年前查看全部
- La(镧)是一种活动性比锌还强的金属元素,它的氧化物La2O3所对应的碱La(OH)3难溶于水,而LaCl3、La(NO
La(镧)是一种活动性比锌还强的金属元素,它的氧化物La2O3所对应的碱La(OH)3难溶于水,而LaCl3、La(NO3)3都溶于水.下列各组中物质能直接反应制得LaCl3的是( )
A. La与盐酸
B. La2O3与AgCl
C. La(OH)3与MgCl2
D. BaCl2与La(NO3)3 shomnia1年前2
shomnia1年前2 -
 angelina110 共回答了19个问题
angelina110 共回答了19个问题 |采纳率89.5%解题思路:根据题干提供的信息结合已有的知识进行分析,在金属活动性顺序中,氢前的金属能与酸反应生成氢气,酸碱盐的溶液若两两结合能产生气体、沉淀或水,则反应能够进行,据此解答即可.A、La(镧)是一种活动性比锌还强的金属元素,则镧能与盐酸反应生成氯化镧,故A正确;
B、金属氧化物不与氯化银发生化学反应,故B错误;
C、氢氧化镧是不溶于水的碱,不能与氯化镁发生复分解反应,故C错误;
D、氯化钡与硝酸镧交换成分,没有气体、沉淀或水生成,不符合复分解反应的条件,反应不能进行,故D错误;
故选A.点评:
本题考点: 复分解反应及其发生的条件;金属活动性顺序及其应用.
考点点评: 本题为信息给予题,完成此题,可以依据题干提供的信息结合物质的性质进行.1年前查看全部
- 用实验验证Zn,Cu,Ag三重金属的活动性顺序,请写出三种可行的方案所用的试剂:1 2 3
 stglwang1年前1
stglwang1年前1 -
 七叶情中 共回答了22个问题
七叶情中 共回答了22个问题 |采纳率95.5%1、氯化铜.只有Zn可以置换Cu.Ag不能置换,说明Ag活性比Cu差.
2、氧气.Zn常温下明显氧化.Cu高温氧化.Ag几乎不氧化.
3、硫酸.与Zn发生显著反应.与Cu在空气中缓慢反应变蓝.与Ag基本不反应.1年前查看全部
- (2014•上海模拟)某同学设计了一实验方案,以证明Fe、Cu、Ag三种金属的活动性顺序,它使用了铁片、银片和硫酸铜溶液
(2014•上海模拟)某同学设计了一实验方案,以证明Fe、Cu、Ag三种金属的活动性顺序,它使用了铁片、银片和硫酸铜溶液即达到目的,试完成该同学设计的实验报告:
(1)实验步骤 (2)观察到的现象 (3)结论 取两只试管,分别加入铁片和银片,再在两只试管中各加入硫酸铜溶液约2mL 加入铁片的试管中:
______
加入银片的试管中:
______结论:金属活动性顺序(用“>”表示)
______ missilelwq1年前1
missilelwq1年前1 -
 leowan 共回答了18个问题
leowan 共回答了18个问题 |采纳率88.9%解题思路:根据铁、铜银的活动性顺序及金属和盐溶液反应的规律铁能置换出硫酸铜中的铜,析出的铜呈红色会覆盖在铁的表面,银不能置换出硫酸铜中的铜预计实验的现象,并得出结论.铁片能够与硫酸铜溶液发生置换反应,生成的红色铜覆盖在铁的表面,因此,可观察到表片表现出现光亮的红色固体;而银不能置换出硫酸铜中的铜,因此无明显现象,因此得出的结论是:Fe>Cu>Ag.
故答案为:
(1)实验步骤 (2)观察到的现象 (3)结论
铁表面有红色固体析出;
无明显现象 Fe>Cu>Ag点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 本题考查了金属活动性顺序的应用.完成此题,可以依据金属活动性顺序及其意义进行分析.1年前查看全部
- 12.下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是[ ] A.在氧化一还原反应中,甲原子失去的
12.下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是[ ] A.在氧化一还原反应中,甲原子失去的
12.下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是[ ]
A.在氧化一还原反应中,甲原子失去的电子比乙原子失去的电子多
B.同价态的阳离子,甲比乙的氧化性强
C.甲能跟稀盐酸反应放出氢气而乙不能
D.将甲、乙作电极组成原电池时,甲是负极
如何判断金属活动性强弱? pierexuan1年前1
pierexuan1年前1 -
 若若水水 共回答了20个问题
若若水水 共回答了20个问题 |采纳率100%如果是单选的话选C,判断的方法还是比较多的,打多就是看外层电子更容易失去的金属活动性强,或者阳离子更稳定,即氧化性差等等,C即表现了甲的外层电子更容易丢失1年前查看全部
- Mn,fe,mg,cu四种金属的活动性
 vxdeathxv1年前5
vxdeathxv1年前5 -
 benrb 共回答了16个问题
benrb 共回答了16个问题 |采纳率87.5%由金属活动性表 K Ca Na Mg Al Mn Zn Gr Fe Ni Sn Pb (H) Cu Hg Ag Pt Au
所以
Mg > Mn > Fe > Cu (绝对正确)1年前查看全部
- 验证铁和铜活动性顺序时,可以选用两种不同类别的溶液,可选用( )和( )溶液.
 悄然而至的h弹1年前4
悄然而至的h弹1年前4 -
 wweew 共回答了14个问题
wweew 共回答了14个问题 |采纳率100%盐酸和硫酸铜溶液
分别加盐酸,Fe与HCl反应有气泡,Cu与HCl反应无明显现象.分别加入硫酸铜溶液中,Fe+CuSO4有一铜析出(说明Fe金属性比Cu强),铜不会与硫酸铜反应.由此证明铁的金属性比铜强.
或者可以用盐酸和氯化亚铁.铜加入氯化亚铁溶液中,无明显显现,说明铜不能将铁置换出来,说明铜金属性比铁弱.
简单说,除了用盐酸、硫酸、还可以用铁和铜的可溶性盐.1年前查看全部
- 某兴趣小组的同学为探究金属的活动性、以及铜锈蚀的条件进行了以下系列
某兴趣小组的同学为探究金属的活动性、以及铜锈蚀的条件进行了以下系列
实验,仔细分析后回答下列问题:
(1)实验一:小明按下图1所示以“金属表面产生气泡的快慢”为标准来判断锌、铝、铁
的活动性强弱,有同学认为不够合理,理由是________________________________。铝与
稀盐酸刚接触时反应缓慢,一段时间后剧烈,产生气泡速率随着加快,其原因可能是
_________________________________________。
(2)实验二:为探究铁、铜、银三种金属活动性的顺序,小红提出按上图2进行两步实验,
即可证明三种金属活动性顺序。你认为其方案可行吗?_______(填“可行”或“不可行”) 。
a. 试管①中现象是________________________________________________。
b. 试管②中发生反应的化学方程式为________________________________________。
(3)实验三:小芳、小亮两位同学发现铜质眼镜架上出现了一些绿色的锈渍。经查阅资料得知,铜锈的化学成分是碱式碳酸铜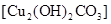 。他们依照钢铁生锈的探究方法设计如下实验(下图3所示)。请回答:
。他们依照钢铁生锈的探究方法设计如下实验(下图3所示)。请回答:
a. 推测一段时间后会出现铜锈的是________试管内的铜片。(填“①”、“②”或“③”)
b. 小芳同学认为要弄清导致铜锈蚀的因素,还应该补充实验,如上图4所示的实验,其目
的是________________________________________________________________。 月光柔1年前1
月光柔1年前1 -
 人生就是人生 共回答了23个问题
人生就是人生 共回答了23个问题 |采纳率87%1年前查看全部
- 为什么FeCl3溶液与Cu能反应,Cu的金属活动性不是比Fe弱吗
 0f00fg00ghh111年前4
0f00fg00ghh111年前4 -
 小妮猪 共回答了22个问题
小妮猪 共回答了22个问题 |采纳率86.4%你理解错了,是Fe3+的氧化性大于Cu2+的氧化性,所以Fe3+能将Cu氧化成Cu2+.
方程式:2FeCl3+ Cu= CuCl2+ 2FeCl2
2Fe3+ + Cu = Cu2+ + 2Fe2+1年前查看全部
- 证明锌 银(H)、铜的活动性顺序
证明锌 银(H)、铜的活动性顺序
用最简单的方法,证明锌 银(H)、铜的活动性顺序,至少要选用下列物质中的(填序号)_______________________ 1.ZN 2.AG 3.CU 4.CUSO4 5.稀硫酸 6.AGNO3溶液 7.FESO4溶液~ 阿布哟1年前1
阿布哟1年前1 -
 wdhmz 共回答了17个问题
wdhmz 共回答了17个问题 |采纳率94.1%用最简单的方法,证明锌 银(H)、铜的活动性顺序,至少要选用下列物质中的(填序号)______1、2、3、4、5_________________ 1.ZN 2.AG 3.CU 4.CUSO4 5.稀硫酸 6.AGNO3溶液 7.FESO4溶液 分别将锌、银放入硫酸铜溶液中,锌能把铜置换出来,而银不能,说明铜的活动性小于锌,大于银;再将锌、铜分别于放入稀硫酸中即可判断出锌、氢、铜的活动性.1年前查看全部
- 某化学兴趣小组为测定Fe、Cu、Ag三种金属的活动性顺序设计了四种方案,每种方案所用的试剂如下:
某化学兴趣小组为测定Fe、Cu、Ag三种金属的活动性顺序设计了四种方案,每种方案所用的试剂如下:
(1)其中你认为不可行的是______;
A.Fe、Ag、CuSO4溶液B.Fe、Cu、AgNO3溶液、稀盐酸
C.Cu、FeCl2溶液、AgNO3溶液D.Cu、Ag、Fe、稀盐酸
(2)在上述(1)中A方案将洁净铁丝浸入硫酸铜溶液中的反应现象是______,溶液由蓝色变成浅绿色.
(3)写出上述(1)中C方案发生反应的化学方程式______. 墜落天使1年前1
墜落天使1年前1 -
 NEWLYCHEN 共回答了18个问题
NEWLYCHEN 共回答了18个问题 |采纳率83.3%解题思路:验探究三种金属的活动性可以有不同的方案设计,根据实验现象进行分析归纳,总结金属的活动性强弱.对于实验方案能否得出结论,要从是否能够彼此反应与否来进行验证,若都不反应或者都反应,就可能得不到结论.所以要对每个方案都要分析论证.在欲探究的三种金属铁、铜、银活动性为铁>铜>银.所以我们在实验设计时可以设计的最简单的就是三种药品的方法:①取中间的金属对应的可溶性的盐溶液,其余两种都用单质,本题就是Fe、CuSO4溶液(其他可溶性铜盐也可以)、Ag.具体操作是取两只试管,分别加入Fe和Ag单质后滴加几滴铜的盐溶液,观察实验现象.铁的表面变红,得出:Fen>Cu;而Ag的表面无明显现象,得出Cu>Ag.所以Fe>Cu>Ag.这就是对应的A方案.所以A 正确.②取中间的金属的单质,另外两种取对应盐溶液.本题就是铁盐、铜片、银盐.具体操作:将亚铁盐和银盐分别滴加到打磨后的铜片上(分开),观察实验现象.滴加亚铁盐处无明显变化,说明Fe>Cu;滴加银盐处颜色变成白色,说明Cu>Ag.在上面的两类方案中,②在操作起来更方便快捷,现象对比更明显.
B、Fe、Cu、AgNO3溶液、稀盐酸.具体实验为Fe、Cu先后分别滴加硝酸银和稀盐酸溶液,观察现象.Fe和Cu都能够和硝酸银反应,得出:Fe>Ag和Cu>Ag,而Fe和稀盐酸反应,Cu和稀盐酸不反应,则得出:Fe>Cu.所以得出Fe>Cu>Ag. 正确.
C、Cu、FeCl2溶液、AgNO3溶液.可以进行的实验时将铜粉或者铜丝分别插入(或加入)到FeCl2溶液和AgNO3溶液,铜丝遇到FeCl2溶液无明显现象,得出Fe>Cu;遇到AgNO3溶液表面变成白色,溶液也变成蓝色,得出Cu>Ag.所以得出Fe>Cu>Ag.正确.
D、Cu、Ag、Fe、稀盐酸.将稀盐酸分别滴加到Cu、Ag、Fe金属上,只有Fe表面有气泡生成,证明Fe>H;其余均无明显现象,得出H>Cu,H>Ag.这样可以得出Fe>Cu,Fe>Ag.至于Cu和Ag哪个更活泼,实验无法下结论.错误.
故选D
(2)将洁净铁丝浸入硫酸铜溶液中铁会置换出硫酸铜溶液中的铜因此铁丝表面覆盖一层红色物质铜;
(3)在金属活动顺序表中铜在银之前,由此可写出化学反应式:Cu+2AgNO3═2Ag+Cu(NO3)2.点评:
本题考点: 金属活动性顺序及其应用;金属活动性的探究;书写化学方程式、文字表达式、电离方程式.
考点点评: 同学们要会利用金属活动顺序表设计实验,去验证金属的活动性强弱.氢前边的金属会与酸反应,但氢后边的金属不会与酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.但也要注意,与金属反应酸一般是指稀硫酸和盐酸,不包括浓硫酸和硝酸.1年前查看全部
- 为验证镁、铁、铜三种金属的活动性顺序,可选用的一组物质是?
 苏格拉底家的猪1年前3
苏格拉底家的猪1年前3 -
 美容zz 共回答了19个问题
美容zz 共回答了19个问题 |采纳率89.5%解题思路:设计三种金属活动性的探究实验,需要注意不同的设计方案,然后在不同的方案中选择操作最简单、现象最明显、结论最信服的方案付诸实施.这就要求在平时要勤于反思不同实验设计,也就是多对实验进行评价分析.给定的三种金属镁铁铜的活动性顺序是Mg>Fe>Cu.设计方案时既可以考虑到这一点,也可以完全放弃已有知识.
(一)以已有知识为前提的设计方案:①MgCl2(可溶性镁盐)、Fe、CuCl2(可溶性铜盐);可以采取操作:将打磨后的铁片上分开滴加另外两种溶液,滴加铜盐处变成红色,滴加MgCl2处无明显的变化.②Mg、FeCl2(可溶性亚铁盐)、Ag;可进行的操作是将溶液分别滴加到两种金属上,镁条表面变黑,而银的表面无明显现象(铁在置换状态下往往为黑色).③将三种金属都加入到相同质量和质量分数的同一酸中,两种反应且反应速率不同,另一种不反应.④将三种金属中滴加AgNO3溶液中对比反应速率.
(二)不借助先前已有知识:将金属分别与另外的金属对应的盐一一实验,根据现象分析后下结论.如Mg、FeCl2、CuCl2、Fe等.
故答案:
MgCl2(可溶性镁盐)、Fe、CuCl2(可溶性铜盐);Mg、FeCl2(可溶性亚铁盐)、Ag;将三种金属都加入到相同质量和质量分数的同一酸中;将三种金属中滴加相同质量和相同质量分数的AgNO3溶液;Mg、FeCl2、CuCl2、Fe等.(其他合理也可以).点评:
本题考点: 金属活动性的探究.
考点点评: 注意在平时的练习中拓展自己的思路,让自己尽可能发散思维,考虑一题多解.1年前查看全部
- 懂的人进.1、欲验证Fu Cu Ag 三种金属的活动性顺序、下列实验方案中不可行的方案是:A Cu Ag FeSo4溶液
懂的人进.
1、欲验证Fu Cu Ag 三种金属的活动性顺序、下列实验方案中不可行的方案是:
A Cu Ag FeSo4溶液 B Fe Ag CuSo4溶液 C Fe Cu 稀盐酸 AgNo3溶液
D Cu FeSo4溶液 AgNo3溶液
2、某单质X能从某溶液中置换出单质Y,由此推断下列说法中正确的是:
A X一定是排在金属活动性顺序中氢以前的金属
B X是金属时,Y一定是金属
C X是金属时,Y可能是金属,也可能是非金属
D X、Y都是金属时、Y一定比X活泼.
3、用化学方程式解释下列事实
生活中的铝制品具有较强的抗腐蚀性:
4、常用洗洁精洗涤油污,因为洗洁精与油、水混合会产生_____作用.
5、不同的铁制品所采取的铁的保护方法有所不同.如自行车的链条常采用____的方法防锈,自行车的车身(即车架)常采用_________的方法防锈.
6、小明同学为了探究铜、铁、银、三种金属的活动性强弱,做了如下实验:他找来一块铜片,用砂纸打磨干净,然后分别在a、b、c三处滴上不同的溶液:
在a处滴上HCl 在b处滴上FeSo4溶液 在c处滴上AgNo3溶液
① 一段时间后观察a、b、c三处,无明显变化的地方是_______________
②写出产生黑色斑点的地方所涉及的化学反应方程式___________________
③据此实验,你认为小明得出的正确结论是______________
不好意思 我没积分了、 等我有积分了、 会再给你的、 nasox1年前1
nasox1年前1 -
 luohong000 共回答了13个问题
luohong000 共回答了13个问题 |采纳率84.6%第一个选C,第二个选C,3题,4Al+3O2=2Al2O3.4,乳化.5涂油,刷漆.6①a,b处,②2AgNO3+Cu=Cu(NO3)2+2Ag.③金属活动性顺序Fe>Cu>Ag.第六题第二个问稍微有点问题,黑色斑点只能是反应产生的,但是Cu只能和AgNO3反应,所以写那个.OK1年前查看全部
- (2004•广州)下面各组金属用硫酸亚铁溶液,就能比较它们的活动性强弱的是( )
(2004•广州)下面各组金属用硫酸亚铁溶液,就能比较它们的活动性强弱的是( )
A.铜和银
B.铜和锌
C.汞和铜
D.铅和汞 大连男人0081年前1
大连男人0081年前1 -
 xjlcp 共回答了16个问题
xjlcp 共回答了16个问题 |采纳率93.8%解题思路:根据活动性强的金属能将活动性弱的金属从其盐溶液中置换出来,分析各组金属与硫酸亚铁溶液发生反应的情况,判断各组金属的活动性强弱关系.A、铜、银都不能与硫酸亚铁发生反应,用硫酸亚铁溶液,不能比较铜、银两种金属的活动性强弱;故A不正确;
B、铜不能与硫酸亚铁反应,而锌能置换硫酸亚铁中的铁,用硫酸亚铁溶液,能比较铜、锌两种金属的活动性强弱;故B正确;
C、汞、铜都不能与硫酸亚铁发生反应,用硫酸亚铁溶液,不能比较铜、汞两种金属的活动性强弱;故C不正确;
D、汞、铅都不能与硫酸亚铁发生反应,用硫酸亚铁溶液,不能比较铜、铅两种金属的活动性强弱;故D不正确;
故选B.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 利用活动性强的金属能将活动性弱的金属从其盐溶液中置换出来的反应特点,可用来检验金属的活动性.1年前查看全部
- 某化学兴趣小组为测定Fe、Cu、Ag三种金属的活动性顺序,设计了四种方案,每种方案所用试剂如下,你认为不可行的是( )
某化学兴趣小组为测定Fe、Cu、Ag三种金属的活动性顺序,设计了四种方案,每种方案所用试剂如下,你认为不可行的是( )
A.Fe,Ag,CuSO4溶液
B.Cu,Ag,FeSO4溶液
C.Fe,Cu,稀硫酸,AgNO3溶液
D.Cu,FeSO4溶液,AgNO3溶液 whocares1231年前1
whocares1231年前1 -
 wyprock 共回答了24个问题
wyprock 共回答了24个问题 |采纳率87.5%解题思路:根据金属活动顺序进行思考,Fe、Cu、Ag这三种金属的金属活动性由强到弱的顺序为Fe>Cu>Ag.在金属活动顺序表中,前边的金属可以把后边的金属从其盐溶液中置换出来,所以可以选择相应的金属和盐溶液进行反应来证明这三种金属的活动性强弱.A、铁可以置换CuSO4溶液中的铜而出现红色固体,证明铁的活动性比铜强,银和CuSO4溶液不反应,证明铜比银的活动性强,因此,可以证明三种金属的活动性强弱,故错误.
B、因为铁的活动性在三种金属中最强,所以Cu,Ag都不能和FeSO4溶液反应,得不出Cu,Ag的活动性强弱,所以此方案不可行,故此项正确.
C、Fe,Cu,稀硫酸,AgNO3溶液四种物质中,铁能与稀硫酸反应,也能与AgNO3溶液反应,证明铁比氢和银的活动性强,铜和稀硫酸不反应,但能与AgNO3溶液反应,证明铜的活动性比氢弱,比银强,也能得出三种金属的活动性强弱,故错误.
D、Cu,FeSO4溶液,AgNO3溶液这三种物质中,铜与FeSO4溶液不反应,证明铁的活动性比铜强,铜与AgNO3溶液能反应,证明铜比银的活动性强,因此此项也错误.
故选B点评:
本题考点: 金属活动性的探究.
考点点评: 同学们要会利用金属活动顺序表设计实验,去验证金属的活动性强弱.氢前边的金属会与酸反应,但氢后边的金属不会与酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.但也要注意,与金属反应酸一般是指稀硫酸和盐酸,不包括浓硫酸和硝酸.1年前查看全部
- 影响碳单质化学活动性的主要外界因素是
影响碳单质化学活动性的主要外界因素是
A 阳光
B 温度
C 气压
D 密度 风满vv1年前2
风满vv1年前2 -
 愤怒制造者 共回答了19个问题
愤怒制造者 共回答了19个问题 |采纳率94.7%B1年前查看全部
- 手机中使用的锂(Li)电池是新型的高能电池.它的原子结构示意图为锂是一种活动性比铁强的金属.
手机中使用的锂(Li)电池是新型的高能电池.它的原子结构示意图为
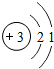 锂是一种活动性比铁强的金属.
锂是一种活动性比铁强的金属.
(1)写出锂离子的符号______;锂的氧化物的化学式为______.
(2)写出锂与稀硫酸反应的化学方程式______. rlbk1年前1
rlbk1年前1 -
 洗澡鱼 共回答了20个问题
洗澡鱼 共回答了20个问题 |采纳率95%解题思路:(1)根据锂的原子结构示意图可知,其最外层电子数为1,在化学反应中易失去1个电子而形成带1个单位正电荷的阳离子;根据元素的正化合价数等于其原子的最外层电子数,氧元素显-2价,写出其氧化物的化学式即可.
(2)锂是一种活动性比铁强的金属,锂与稀硫酸反应生成硫酸锂和氢气,写出反应的化学方程式即可.(1)由锂的原子结构示意图可知,其最外层电子数为1,在化学反应中易失去1个电子而形成带1个单位正电荷的阳离子,锂离子的符号为:.元素的正化合价数等于其原子的最外层电子数,锂元素显+1价,氧元素显-2价,其化学...
点评:
本题考点: 化学符号及其周围数字的意义;化学式的书写及意义;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,掌握原子结构示意图的含义、离子符号、化学式与化学方程式的书写是正确解答本题的关键.1年前查看全部
- 只用一支试管,知去一次盐酸就能证明铝,铁,铜的活动性顺序,那他们插入的顺序是什么?
只用一支试管,知去一次盐酸就能证明铝,铁,铜的活动性顺序,那他们插入的顺序是什么?
第一次是铁,第二和第三呢?,如果调换他们三个的顺序也能得到结论,那顺序是什么? volance1年前1
volance1年前1 -
 mole-rose 共回答了16个问题
mole-rose 共回答了16个问题 |采纳率93.8%第二铜,第三铝1年前查看全部
- 有甲乙两组同学分别探究3种金属的化学活动性,甲组同学选用了3种物质( )进行实验,乙组同学经过讨论,选
有甲乙两组同学分别探究3种金属的化学活动性,甲组同学选用了3种物质( )进行实验,乙组同学经过讨论,选
有甲乙两组同学分别探究3种金属的化学活动性,甲组同学选用了3种物质( )(填化学式,下同)进行实验,乙组同学经过讨论,选取 了与甲组同学完全不同的3种物质( )进行实验.结果两组同学都得到了相同的正确结论 花rr86281年前1
花rr86281年前1 -
 冒险家 共回答了13个问题
冒险家 共回答了13个问题 |采纳率69.2%Cu FeCl2 AgNO3
Fe Ag CuSO41年前查看全部
大家在问
- 1这榆树在园子的西北角上,来了风,这榆树先啸,来了雨,大榆树县就冒烟了.中啸和
- 2modern solar energy technologies can provide electrical gene
- 3小红的妈妈将一笔钱存入银行,银行三年期(整存整取)的年利率为3.69%,三年到期时扣除20%的利息税后可取出5442.8
- 4下列各组中的两种物质相互作用时,改变反应条件或反应物的用量,不会影响产物组成的是( )
- 5高中易溶于水的有机物和密度比水大和密度比水小的有机物
- 6求高手分析作文是否离题以小悦悦的事件为材料,引出题目“寻找爱心”,文体不限我不擅长写议论文,所以我就写了一篇记叙文开头用
- 7英语翻译不是名词也不是动词!好象是量词!
- 8小华参加数学竞赛,一共10道题目,规定答对一题得10分,答错一题倒扣5分,小华十道提全部答完却只得了70分,小华答对了几
- 9英语翻译随着2010年世博会的一天天临近,人们也越来越关注自己生活的城市.我认为,我所居住的地方——XXXXX,是一个安
- 10一个数扩大了以百倍什么概念题目是这样的,A/b=3...5,如果A 和 B 同时扩大100倍,余数是多少?
- 11妈妈买了10只茶杯,共花了100元,其中大茶杯每只12元,小茶杯每只7元,问妈妈大,小茶杯各买了几只?
- 12修路队三天修完一条路,第一天修了2.4千米,第二天修的比第一天多1.2千米,还剩这条路的4/7,这条路有多长
- 13算不出的对数是有理数还是无理数例如:lg2是有理数还是无理数我的想法是1.令lg2=t那么10^t=2如果t是个无理数的
- 14把下面的句子插入文中,使它上下文衔接,最恰当的是()A.①②之间B.②③之间C.③④之间D.④句后.
- 15已知点D、E分别在△ABC的边AB,AC上,且DE//BC,向量AD=1/3向量AB.设向量AB=向量a,向量AC=向量

