2012揭阳水平测试 英语语法填空一道题
 kiky8310012022-10-04 11:39:541条回答
kiky8310012022-10-04 11:39:541条回答In Crisis,Become As One When I was struggling with cancer a few years ago,my wife and I formed our own "couple caution circle".Anytime a doctor came 16 news of my progress,my wife would give me a big hug.The reports were seldom good during the early stages of my illness.One day a doctor brought 17 (particular) frightening news.Staring at my reports,the doctor said in a low voice,"It doesn't look like you' re going to make it." Before I could ask him a question,my wife 18 (stand) up,handed me my clothes,adjusted the tubes 19 (fasten)to my body and said,"Let's get out of here.This man is 20 risk to your health."
19为什么填fastened?

已提交,审核后显示!提交回复
共1条回复
 汗水 共回答了16个问题
汗水 共回答了16个问题 |采纳率87.5%- fasten 是动词,首先这句话已经有动词adjusted了,所以不能填原型fasten, 看句意,导管是被固定在他身上的,他的妻子是把‘固定在他身上的导管’调整了一下,所以用过去分词
- 1年前
相关推荐
- (2013•揭阳二模)一个棱长为2的正方体沿其棱的中点截去部分后所得几何体的三视图如图示,则该几何体的体积为( )
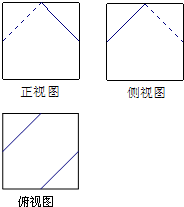 (2013•揭阳二模)一个棱长为2的正方体沿其棱的中点截去部分后所得几何体的三视图如图示,则该几何体的体积为( )
(2013•揭阳二模)一个棱长为2的正方体沿其棱的中点截去部分后所得几何体的三视图如图示,则该几何体的体积为( )
A.7
B.[22/3]
C.[47/6]
D.[23/3] gg惊现飞刀1年前0
gg惊现飞刀1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 请问谁有揭阳2010小学升初中语文试卷?最好是连答案也有...
 ddccbbaa1年前1
ddccbbaa1年前1 -
 ricky012345 共回答了15个问题
ricky012345 共回答了15个问题 |采纳率100%=_=小朋友 你想干嘛1年前查看全部
- (2013•揭阳)将甲、乙两种金属片分别放入硫酸铜溶液中,甲表面析出金属铜,乙没有明显现象.据此判断三种金属的金属活动性
(2013•揭阳)将甲、乙两种金属片分别放入硫酸铜溶液中,甲表面析出金属铜,乙没有明显现象.据此判断三种金属的金属活动性顺序是( )
A.甲>铜>乙
B.乙>铜>甲
C.铜>甲>乙
D.甲>乙>铜 soyo01年前1
soyo01年前1 -
 szanlyl 共回答了22个问题
szanlyl 共回答了22个问题 |采纳率86.4%解题思路:根据活动性强的金属能把活动性弱的金属从其盐溶液中置换出来,由将甲、乙两种金属片分别放入硫酸铜溶液中所出现的现象,判断三种金属的金属活动性顺序.甲表面析出金属铜,乙没有明显现象,说明甲能置换出硫酸铜中的铜而乙不能,则甲的活动性大于铜而乙的活动性小于铜;三种金属的金属活动性顺序为甲>铜>乙;
故选:A.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 利用金属与盐溶液的反应可以验证金属间活动性强弱,活动性强的金属能把活动性弱的金属从其盐溶液中置换出来.1年前查看全部
- (2014•揭阳二模)已知(1+i)(1-mi)是实数(i是虚数单位),则实数m的值为( )
(2014•揭阳二模)已知(1+i)(1-mi)是实数(i是虚数单位),则实数m的值为( )
A.±1
B.1
C.-1
D.0 haiyunstar1年前1
haiyunstar1年前1 -
 人言独舞乱衣鬓 共回答了14个问题
人言独舞乱衣鬓 共回答了14个问题 |采纳率85.7%解题思路:直接化简(1+i)(1-mi)为a+bi(a,b∈R)的形式,由虚部为零求得m的值.(1+i)(1-mi)=1-mi+i-mi2=(1+m)+(1-m)i,
∵(1+i)(1-mi)是实数,
∴1-m=0,
即m=1.
故选:B.点评:
本题考点: 复数代数形式的乘除运算.
考点点评: 本题考查了复数代数形式的乘除运算,考查了复数的基本概念,是基础题.1年前查看全部
- (2014•揭阳三模)氯化亚铜(CuCl)是有机合成工业中应用较广泛的催化剂,它是白色粉末,微溶于水,不溶于乙醇,在空气
(2014•揭阳三模)氯化亚铜(CuCl)是有机合成工业中应用较广泛的催化剂,它是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化.从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程如下:

请回答下列问题:
(1)电镀污泥的主要成分是______(写化学式).
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为:______.
(3)析出CuCl晶体时的最佳pH在______左右.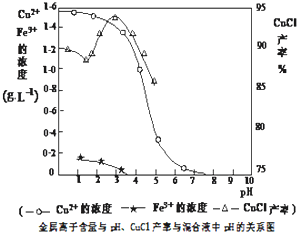
(4)析出的CuCl晶体要立即用无水乙醇洗涤,然后真空干燥、冷却,密封包装.真空干燥,密封包装的目的是______.
(5)从滤液A中可回收的主要物质是______(写化学式).
(6)以碳棒为电极电解CuCl2溶液可得到CuCl.写出电解CuCl2溶液后的阴极上发生的反应为______. 雪与水的纠缠1年前1
雪与水的纠缠1年前1 -
 shenhao00412 共回答了18个问题
shenhao00412 共回答了18个问题 |采纳率94.4%解题思路:电镀废液中加入碱可生成Cu(OH)2、Fe(OH)3沉淀,在pH约为4时,用酸浸得到硫酸铜溶液和氢氧化铁沉淀,在硫酸铜溶液中加入氯化钠、铁,发生氧化还原反应生成CuCl,发生2Cu2++2Cl-+Fe=2CuCl↓+Fe2+,最后所得滤液为硫酸亚铁,结合CuCl的性质和题目要求解答该题.(1)电镀废液主要含Cu2+、Fe3+,加入碱可生成Cu(OH)2、Fe(OH)3沉淀,
故答案为:Cu(OH)2、Fe(OH)3;
(2)在硫酸铜溶液中加入氯化钠、铁,发生氧化还原反应生成CuCl,发生2Cu2++2Cl-+Fe=2CuCl↓+Fe2+,
故答案为:2Cu2++2Cl-+Fe=2CuCl↓+Fe2+;
(3)由图2可知,析出CuCl沉淀的最佳pH应为CuCl的产率最大,且氢氧化铁杂质较少,应约为3左右,
故答案为:3;
(4)由题给信息可知CuCl微溶于水,不溶于乙醇,在空气中会被迅速氧化,为防止氧化应隔绝空气,在干燥、真空环境中可加快乙醇和水的蒸发,
故答案为:加快乙醇和水的蒸发,防止CuCl被空气氧化.
(5)由框图分析可知:滤液A中主要物质是Na2SO4和FeSO4,
故答案为:Na2SO4和FeSO4;
(6)电解CuCl2溶液时,阴极上发生的反应为Cu2+得到电子生成+1价铜,
故答案为:Cu2++Cl-+e-═CuCl↓点评:
本题考点: 金属的回收与环境、资源保护;电解原理;铜金属及其重要化合物的主要性质.
考点点评: 本题考查制备方案的设计,侧重于学生的分析能力和实验能力的考查,注意把握题给信息,答题时注意审题,把握自学能力的培养,难度中等.1年前查看全部
- (2014•揭阳一模)如图,已知AB是圆O的直径,C是AB延长线上一点,CD切圆O于D,CD=4,AB=3BC,则圆O的
 (2014•揭阳一模)如图,已知AB是圆O的直径,C是AB延长线上一点,CD切圆O于D,CD=4,AB=3BC,则圆O的半径长是______.
(2014•揭阳一模)如图,已知AB是圆O的直径,C是AB延长线上一点,CD切圆O于D,CD=4,AB=3BC,则圆O的半径长是______.  starformore1年前1
starformore1年前1 -
 e9jgzh 共回答了16个问题
e9jgzh 共回答了16个问题 |采纳率81.3%解题思路:利用切割线定理即可得出.设圆的半径为r,∵AB=3BC,∴2r=3BC.
∵CD切圆O于D,∴CD2=CB•CA,∴42=
2r
3•(
2r
3+2r),化为r2=9,解得r=3.
故答案为:3.点评:
本题考点: 与圆有关的比例线段.
考点点评: 本题考查了切割线定理,属于基础题.1年前查看全部
- (2009•揭阳二模)海底黑烟囱可在海底堆积硫化物的颗粒,形成多种金属矿产.若从海底黑烟囱附近的矿产物中分离出富铜矿Cu
(2009•揭阳二模)海底黑烟囱可在海底堆积硫化物的颗粒,形成多种金属矿产.若从海底黑烟囱附近的矿产物中分离出富铜矿CuFeS2,可用于冶炼铜,熔炼过程主要反应为:
2CuFeS2=Cu2S+2FeS+S…①2Cu2S+3O2=2Cu2O+2SO2…②
Cu2O+FeS=Cu2S+FeO③2FeS+3O2+SiO2=2FeO•SiO2+2SO2…④
2FeO+SiO2=2FeO•SiO2⑤Cu2S+2Cu2O=6Cu+SO2 ⑥
下列有关说法不正确的是( )
A.上述反应均属于氧化还原反应
B.该厂可同时建硫酸厂和炼铁厂
C.该厂的原料除富铜矿外,还需空气和硅石
D.反应④转移12e- a99961年前1
a99961年前1 -
 闲看流水过小桥 共回答了19个问题
闲看流水过小桥 共回答了19个问题 |采纳率94.7%解题思路:A.化学反应前后有元素化合价变化的一定是氧化还原反应;依据元素化合价变化分析反应判断;
B.根据工业上制备硫酸和炼铁原理进行解答;
C.根据冶炼铜,熔炼过程主要反应进行解答;
D.2FeS+3O2+SiO2=2FeO•SiO2+2SO2中S元素的化合价升高,氧气中O元素的化合价降低,据此分析进行解答.A.反应①中,CuFeS2中铜元素的化合价为+2,Cu元素的化合价降低,O元素的化合价降低,S元素的化合价由-2价升高为+4价;②中S元素的化合价升高,氧气中O元素的化合价降低;③中,铜氧、硫、铁四种元素化合价未变,不是氧化还原反应;④中S元素的化合价升高,氧气中O元素的化合价降低;⑤中,氧、硅、铁三种元素化合价未变,不是氧化还原反应;⑥中,Cu2S中Cu元素的化合价降低,S元素的化合价升高;则③⑤不是氧化还原反应,故A错误;
B.工业制硫酸常用接触法,先制气制取SO2,然后在接触室中进行的反应为2SO2+O2
催化剂
.
加热2SO3,最后用98.3%的硫酸吸收,①中的硫可制取二氧化硫,②④⑥产生二氧化硫,所以该厂可同时建硫酸厂;炼铁厂常以焦炭、赤铁矿(主要成分是氧化铁)、空气等为主要原料炼铁,反应①③④⑤均有氧化亚铁,能提供含铁的原料,所以该厂可同时建炼铁厂,故B正确;
C.硅石的主要成分为二氧化硅,从反应④⑥看出需硅石,从反应②④需氧气可知需空气,故C正确;
D.2FeS+3O2+SiO2=2FeO•SiO2+2SO2中FeS中S元素从-2价升高为二氧化硫中的+4价,2FeS转移12e-,氧气中O元素的化合价降低为-2价转移12e-,故D正确;
故选A.点评:
本题考点: 金属冶炼的一般原理;氧化还原反应;铜金属及其重要化合物的主要性质.
考点点评: 本题考查冶炼铜,熔炼过程,明确反应中的元素的化合价变化是解答本题的关键,注意选项D转移的电子数目为易错点,题目难度中等.1年前查看全部
- (2011•揭阳一模)下列科研思路错误的是( )
(2011•揭阳一模)下列科研思路错误的是( )
A.从热泉中寻找耐热细菌
B.从贫瘠的土壤中寻找分解尿素的细菌
C.从成熟的葡萄皮上寻找酵母菌
D.从生长在酸奶的乳酸菌中获得生产所需的纤维素酶 xd13141年前1
xd13141年前1 -
 jianbao3511602 共回答了16个问题
jianbao3511602 共回答了16个问题 |采纳率93.8%解题思路:筛选菌株的思路是;在寻找目的菌株时,要根据它对生存环境的要求,到相应的环境中寻找.A、热泉中含有耐高温的细菌,因此分离耐热菌要从热泉中寻找,A正确;
B、分解尿素的细菌在尿素含量高的环境中分布较多,因此要从尿素含量高的土壤中寻找分解尿素的细菌,B错误;
C、成熟的葡萄皮上含有较多的葡萄糖,酵母菌含量较多,因此要从成熟的葡萄皮上寻找酵母菌,C正确;
D、生长在酸奶中乳酸菌不以纤维素为碳源,乳酸菌不能产生纤维素酶,D错误.
故选:BD.点评:
本题考点: 酒酵母制酒及乙酸菌由酒制醋;以尿素为氮源,测定能生长的细菌的数量.
考点点评: 对于寻找目的菌株的一般思路的理解是解题的关键.1年前查看全部
- (2010•揭阳模拟)如果等差数列{an}中,a3+a5+a7=12,那么a1+a2+…+a9的值为( )
(2010•揭阳模拟)如果等差数列{an}中,a3+a5+a7=12,那么a1+a2+…+a9的值为( )
A.18
B.27
C.36
D.54 mengfenjin1年前1
mengfenjin1年前1 -
 古堡雪狼 共回答了21个问题
古堡雪狼 共回答了21个问题 |采纳率95.2%解题思路:根据等差数列的性质化简a3+a5+a7=12,即可得到a5的值,然后再利用等差数列的性质化简所求的式子,把a5的值代入即可求出值.由a3+a5+a7=12得:3a5=12,
解得:a5=4,
则a1+a2+…+a9=
9(a1+a9)
2=9a5=36.
故选C.点评:
本题考点: 等差数列的性质.
考点点评: 此题考查学生灵活运用等差数列的性质及等差数列的前n项和公式化简求值,是一道基础题.1年前查看全部
- (2010•揭阳二模)下列命题中是真命题的是( )
(2010•揭阳二模)下列命题中是真命题的是( )
A.对∀x∈R,x2≥x
B.对∀x∈R,x2<x
C.对∀x∈R,∃y∈R,y2<x
D.∃x∈R,对∀y∈R,xy=x hh5201年前1
hh5201年前1 -
 joecky 共回答了20个问题
joecky 共回答了20个问题 |采纳率90%解题思路:对于所给的四个命题,可以看出,当x=[1/2]时,不等式不成立,A不正确;
当x=0时,不等式不成立,B不正确;
当x是负数时,不等式不成立,C不正确,
当x=0时,不管y取什么值,等式都成立,D正确.A不正确,当x=[1/2]时,不等式不成立;
B不正确,当x=0时,不等式不成立,
C不正确,当x是负数时,不等式不成立,
D正确,当x=0时,不管y取什么值,等式都成立.
故选D.点评:
本题考点: 四种命题的真假关系.
考点点评: 本题考查四种命题的真假关系,是一个基础题,这种命题的判断,对于假命题,只要举出一个反例,说明它不正确,对于正确的命题,需要加以证明.1年前查看全部
- 揭阳2012高三一模化学题第22题
揭阳2012高三一模化学题第22题
揭阳高三一模化学题第22题.那个电池,求分析.正极负极反应以及答案详解.图无法上传,题头是:“右图是一电池,下列有关说法正确的是” geniuslee09111年前0
geniuslee09111年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2009•揭阳模拟)一台电动机的输出功率是10KW,这表明电动机工作时( )
(2009•揭阳模拟)一台电动机的输出功率是10KW,这表明电动机工作时( )
A.每秒钟能消耗10KW的电能
B.每秒钟对外做10KW的功
C.每秒钟对外做10J的功
D.每秒钟对外做104J的功 BenjaminLei1年前1
BenjaminLei1年前1 -
 白变布 共回答了11个问题
白变布 共回答了11个问题 |采纳率81.8%电动机功率P=10kW=10000W,正常工作时间t=1s,
电流做功W=Pt=10000W×1s=1×104 J;而AB单位错误,故D正确,ABC错误;
故选D.1年前查看全部
- 2011揭阳二模的一道化学题33.(16分)某化学兴趣小组在探究次氯酸钠溶液的性质时发现:往过量FeSO4溶液中滴入几滴
2011揭阳二模的一道化学题
33.(16分)某化学兴趣小组在探究次氯酸钠溶液的性质时发现:往过量FeSO4溶液中滴入几滴NaClO溶液,并加入适量硫酸,溶液立即变黄.请你协助他们完成该反应还原产物的探究.
(1)甲同学推测该反应的还原产物为Cl2;乙同学推测该反应的还原产物为 .
(2)你认为甲同学的推测是否正确?(填“正确”或“不正确”).请用简要的文字或离子方程式说明理由 .
根据乙同学的推测,上述反应的离子方程式为 .
(3)请你设计一个实验方案,验证乙同学的推测是否正确.要求在答题卡上按下表格式写出实验步骤、预期现象和结论(可以不填满):
实验操作x05预期现象和结论
x05
x05
x05
33.(16分)
(1)Cl- (2分)
(2)不正确 (2分) 因为FeSO4过量,反应中有剩余,而Cl2与Fe2+不能共存,因此还原产物不可能为Cl2(或2Fe2++Cl2=2Cl-+2Fe3+) (2分).
2Fe2+ +ClO-+2H+=2Fe3++Cl-+H2O (3分)
(3)(7分)
实验步骤x05预期现象和结论
取上述反应后的溶液少许于试管A中,滴加过量Ba(NO3)2溶液,静置.(2分) x05有白色沉淀生成(1分)
取试管A中的上层清液于试管B中,滴几滴稀HNO3和几滴AgNO3溶液.(2分)x05若有白色沉淀生成,则乙同学的推测正确(1分);若没有白色沉淀生成,则乙同学的推测不正确(1分).
[问]
实验中加入了过量的硫酸铁,而后又再加硫酸.也就是溶液中不是肯定含有硫酸根离子吗?为何第一步还有检验硫酸根离子呢,而且,为何要用过量Ba(NO3)2溶液? 木妍1年前1
木妍1年前1 -
 symby 共回答了12个问题
symby 共回答了12个问题 |采纳率83.3%第一步是除去硫酸根离子.不是检验.所以要用过量的Ba(NO3)2溶液.除去硫酸根离子后是避免对Agcl生成的干扰.1年前查看全部
- 广东揭阳惠来县葵潭镇溪口村有座倒立的石拱桥,较长一头高一头低并不对称,只有两端有桥墩,是怎么受力的
 咸蛋滚动中1年前1
咸蛋滚动中1年前1 -
 一枝棠1238 共回答了18个问题
一枝棠1238 共回答了18个问题 |采纳率83.3%我看了一下网上所拍摄的视频,这座桥不是“石拱桥”,应该是一座钢筋混凝土的板式桥,按道理,该板式桥下的桥墩原来应该是均匀分布的,现在中间没有看到桥墩,估计有三个桥墩被毁坏掉到水里了.由于原来桥面的这块钢筋混凝...1年前查看全部
- 揭阳地都的名胜古迹 作文 300字
 优诺八八1年前1
优诺八八1年前1 -
 yw2003 共回答了11个问题
yw2003 共回答了11个问题 |采纳率100%揭阳地都蟹是非常有名的1年前查看全部
- (2008•揭阳一模)如图是某细胞内发生的生理过程示意图,请回答:
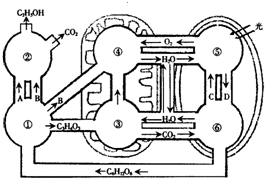 (2008•揭阳一模)如图是某细胞内发生的生理过程示意图,请回答:
(2008•揭阳一模)如图是某细胞内发生的生理过程示意图,请回答:
(1)在生物学上,把①③④这三个生理过程合称为______,⑤这一生理过程称为______.
(2)过程⑥为过程⑤提供的物质C有______.
(3)过程⑤与过程④均能大量生成ATP,ATP的用途有什么不同______.
(4)有同学说:“依图分析光合作用的生成物和反应物与有氧呼吸的反应物和生成物是吻合的,二者应互为可逆反应.”你是否赞同此观点?______.试从反应场所、反应条件和能量变化三个方面加以说明.
①______.②______.③______. zhuzz0001年前1
zhuzz0001年前1 -
 只是为什么 共回答了12个问题
只是为什么 共回答了12个问题 |采纳率91.7%解题思路:本题是对有氧呼吸的过程和场所、光合作用的过程和场所及光合作用与呼吸作用关系的考查,分析题图可知①是有氧呼吸的第一阶段,②是无氧呼吸的第二阶段,③是有氧呼吸的第二阶段,④是有氧呼吸的第三阶段,⑤是光反应阶段,⑥暗反应阶段.(1)分析题图可知,③④过程在线粒体中进行,线粒体是有氧呼吸的主要场所,则①为有氧呼吸的第一阶段,③是有氧呼吸的第二阶段,④是有氧呼吸的第三阶段,①③④三个生理过程合称有氧呼吸;⑤⑥过程在叶绿体中进行,⑤过程需要光照,为光反应.
(2)光反应阶段产生ATP用于暗反应,暗反应消耗ATP时产生了ADP、Pi.
(3)光反应产生的ATP用于暗反应过程中三碳化合物的还原,细胞呼吸产生的ATP用于暗反应以外是其他各项生命活动.
(4)光合作用产生氧气和有机物是细胞呼吸的原料,细胞呼吸产生的二氧化碳为光合作用提供原料,从物质上来看是可逆的,但是光合作用与呼吸作用并不是可逆过程,原因是:①反应场所不同,光合作用在叶绿体内进行,有氧呼吸是在细胞质基质和线粒体内完成.②反应条件不同:催化光合作用与呼吸作用的酶的种类不同;光合作用必须有光照条件,呼吸作用不需要光照条件.③能量是不可逆的,光合作用中能量变化是光能→电能→活跃的化学能→稳定的化学能,有氧呼吸中能量变化是稳定的化学能→(电能)→活跃的化学能、(热能),呼吸作用释放的能量不能再被光合作用利用.
故答案应为:
(1)有氧呼吸(或“细胞呼吸、呼吸作用”)光反应
(2)ADP、Pi
(3)过程⑤产生的ATP用于暗反应(或C3的还原),过程④产生的ATP用于各种生命活动
(4)不赞成
①光合作用在叶绿体内进行,有氧呼吸主要是在线粒体内完成(或答“在细胞质基质与线粒体中进行”);
②二者反应的条件不同.光合作用需要光和色素,有氧呼吸不需要光和色素:二者的不同步骤需要的酶种类不同;
③能量变化不可逆.光合作用中能量变化是光能、电能、活跃的化学能、稳定的化学能;而在有氧呼吸中能量变化是稳定的化学能、(电能)、活跃的化学能、(热能).总之,两反应的能量变化并非是可逆的.点评:
本题考点: 有氧呼吸的过程和意义.
考点点评: 本题的知识点是有氧呼吸的过程和场所,光合作用的过程和场所,光合作用与呼吸作用的关系分析,线粒体和叶绿体的结构,分析题图获取信息是解题的突破口,对光合作用、呼吸作用的过程的掌握和应用是解题的关键.1年前查看全部
- (2014•揭阳一模)如图,两根足够长平行光滑的金属导轨相距为l,导轨与水平面夹角为θ,并处于磁感应强度为B2、方向垂直
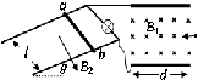 (2014•揭阳一模)如图,两根足够长平行光滑的金属导轨相距为l,导轨与水平面夹角为θ,并处于磁感应强度为B2、方向垂直导轨平面向下的匀强磁场中.两金属导轨的上端与阻值为R的灯泡连接,并连接水平放置、长和宽都为d的平行金属板,板内存在垂直纸面向里的磁感应强度为B1的匀强磁场.长为l的金属棒ab垂直于金属导轨,且始终与导轨接触良好.当金属棒固定不动时,质量为m、电荷量为q的粒子流沿中线射入金属板内,恰好在金属板的左下边沿穿出.粒子重力不计,重力加速度为g,导轨和金属棒的电阻不计.
(2014•揭阳一模)如图,两根足够长平行光滑的金属导轨相距为l,导轨与水平面夹角为θ,并处于磁感应强度为B2、方向垂直导轨平面向下的匀强磁场中.两金属导轨的上端与阻值为R的灯泡连接,并连接水平放置、长和宽都为d的平行金属板,板内存在垂直纸面向里的磁感应强度为B1的匀强磁场.长为l的金属棒ab垂直于金属导轨,且始终与导轨接触良好.当金属棒固定不动时,质量为m、电荷量为q的粒子流沿中线射入金属板内,恰好在金属板的左下边沿穿出.粒子重力不计,重力加速度为g,导轨和金属棒的电阻不计.
(1)粒子流带何种电荷,速度多大?
(2)现将金属棒由静止释放,待棒沿导轨匀速下滑后,粒子流水平通过,求金属棒质量M. 想入非非281年前1
想入非非281年前1 -
 被雪吹过的夏天 共回答了15个问题
被雪吹过的夏天 共回答了15个问题 |采纳率80%解题思路:(1)粒子受向下的洛伦兹力,由左手定则判断粒子的电性;由几何关系确定粒子圆周运动的半径,由牛顿第二定律求粒子的速度;
(2)对匀速通过金属板的粒子流,其所受的电场力等于洛伦兹力,可求得两板间电压,棒做匀速运动,由受力平衡列方程求质量M.(1)由左手定则,可判定粒子流带正电.粒子流在磁场中做匀速圆周运动,由牛顿第二定律,有:
qv0B1=m
v02
r
得:r=
mv0
qB1
粒子流恰好在金属板的边沿穿出,由几何关系得:
r2-(r-[d/2])2=d2
解得:r=[5d/4]
故v0=
5dqB1
4m
(2)对匀速通过金属板的粒子流,其所受的电场力等于洛伦兹力,有:
q[U/d]=qv0B1
金属板的电压U,U=IR
金属棒受到的安培力F安=B2Il
棒做匀速运动,由力的平衡条件,有:
F安=Mgsinθ
联立式子,解得:M=
5B12B2d2lq
4mgRsinθ
答:(1)粒子流带正电荷,速度为
5dqB1
4m;
(2)现将金属棒由静止释放,待棒沿导轨匀速下滑后,粒子流水平通过,金属棒质量M为
5B12B2d2lq
4mgRsinθ.点评:
本题考点: 带电粒子在匀强磁场中的运动;牛顿第二定律.
考点点评: 本题考查了带点粒子在磁场中的圆周运动以及电磁感应与力学的综合应用,是一道很好的考查能力的综合题.1年前查看全部
- (2007•揭阳一模)下列说法一定正确的是( )
(2007•揭阳一模)下列说法一定正确的是( )
A.1mol Fe3+完全水解生成氢氧化铁胶体粒子的数目约为6.02×1023
B.电解质溶液的导电过程就是电解的过程
C.处于平衡状态的可逆反应中,若增加某反应物的量,平衡向正反应方向移动,被增加的物质的转化率减小
D.正盐的水溶液呈酸碱性是由于水的电离平衡被破坏所造成的 kiuuhg1年前1
kiuuhg1年前1 -
 公主累 共回答了14个问题
公主累 共回答了14个问题 |采纳率85.7%解题思路:A、胶体粒子是氢氧化铁的集合体分析;
B、电解质溶液导电是阴阳离子在电极上发生的氧化还原反应,发生了电解;
C、平衡状态下的可逆反应若物质为固体,增加反应物的量不影响平衡移动;
D、正盐的水溶液呈酸碱性是离子水解的原因.A、胶体粒子是氢氧化铁的集合体,1mol Fe3+完全水解生成氢氧化铁胶体粒子的数目小于6.02×1023,故A错误;
B、电解质溶液导电是阴阳离子在电极上发生的氧化还原反应,电解质溶液的导电过程就是电解的过程,故B正确;
C、平衡状态下的可逆反应若物质为固体,增加反应物的量不影响平衡移动,故C错误;
D、正盐的水溶液呈酸碱性是离子水解的原因,是由于水的电离平衡被破坏所造成的,故D正确;
故选:BD.点评:
本题考点: 盐类水解的应用;化学平衡的影响因素;电解质溶液的导电性.
考点点评: 本题考查了胶体组成分析,化学平衡影响因素的分析判断,盐类水解的分析应用,掌握基础是关键,题目难度中等.1年前查看全部
- (2012•揭阳)下列化学方程式符合事实且书写正确的是( )
(2012•揭阳)下列化学方程式符合事实且书写正确的是( )
A.向氢氧化钠溶液中通入少量的CO2:CO2+2NaOH═Na2CO3+H2O
B.用稀硫酸洗去附着在试管壁上的铜:Cu+H2SO4═CuSO4+H2↑
C.铁丝在氧气中燃烧的反应:4Fe+3O2
2Fe2O3点燃 .
D.木炭在氧气中完全燃烧:2C+O2
2CO2点燃 . jim7221年前1
jim7221年前1 -
 test001 共回答了20个问题
test001 共回答了20个问题 |采纳率100%解题思路:A、化学方程式符合事实且书写正确.
B、铜的金属活动性弱,不能与稀硫酸反应;
C、违背客观事实,生成物为四氧化三铁,而非氧化铁;
D、不符合质量守恒,化学反应前后原子个数不相等A、向氢氧化钠溶液中通入少量的CO2:CO2+2NaOH═Na2CO3+H2O;化学方程式符合事实且书写正确,故A正确.
B、铜的金属活动性弱,不能与稀硫酸反应,所以反应不能进行,故B错误;
C、违背客观事实,生成物为四氧化三铁,改为:3Fe+2O2
点燃
.
Fe3O4故C错误;
D、该反应中反应前后氧原子的个数不相等;应改为:C+O2
点燃
.
CO2故D错误;
故选A.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 确定反应物、生成物、反应条件,正确书写化学方程式;并且掌握书写化学方程式的方法和步骤.1年前查看全部
- (2012•揭阳)如图所示,是一种指甲刀的结构示意图,下列说法正确的是( )
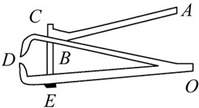 (2012•揭阳)如图所示,是一种指甲刀的结构示意图,下列说法正确的是( )
(2012•揭阳)如图所示,是一种指甲刀的结构示意图,下列说法正确的是( )
A.ABC是一个省力杠杆
B.D处刀刃较薄,可以增大压力
C.杠杆ABC上有粗糙的花纹,可以减小摩擦
D.指甲刀只有两个杠杆,一个省力杠杆,一个费力杠杆 青春性心理1年前1
青春性心理1年前1 -
 凤舞九天summer 共回答了15个问题
凤舞九天summer 共回答了15个问题 |采纳率93.3%解题思路:(1)对于杠杆类型的判断可从动力臂与阻力臂的大小关系上入手;
(2)压强的大小与压力的大小和受力面积的大小有关;
(3)滑动摩擦力的大小与压力的大小和接触面的粗糙程度有关.A、对于ABC,如图所示,在使用时,它的动力臂大于阻力臂,所以它是省力杠杆,符合题意;
B、在相同的压力下,D处刀刃较薄,受力面积小,产生的压强大,压力的作用效果明显,并不是压力增大了,不符合题意;
C、杠杆ABC上有粗糙的花纹,增大接触面的粗糙程度,可以增大摩擦,不符合题意;
D、指甲刀中有三个杠杆:ABC、OBD、0ED,其中ABC是省力杠杆,其它两个都是费力杠杆,不符合题意.
故选A.点评:
本题考点: 杠杆的分类;摩擦力大小的影响因素;压强.
考点点评: 本题利用生活中某一实例,较全面地考查了物理知识的应用,揭示了物理来源于生活又应用于生活的物理意识,是中考的常见题型.1年前查看全部
- (2011•揭阳)用图所示所示的滑轮组提升重物,若拉力F将绳子的自由端移动3m时,重物升高lm,请你在图中画出绳子绕法.
 Jessie771年前0
Jessie771年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2013•揭阳一模)设nA为阿伏加德罗常数的数值,下列说法正确的是( )
(2013•揭阳一模)设nA为阿伏加德罗常数的数值,下列说法正确的是( )
A.标准状况下,11.2L的H2O中,含有的原子数为1.5nA
B.0.1mol•L-1 的(NH4)2SO4溶液中,所含NH4+数小于 0.2nA
C.常温常压下,16g的O2和O3混合气体中,含有的电子数为8 nA
D.质量相同的N2和CO中,含有的原子数均为2nA 徐yy1年前1
徐yy1年前1 -
 也曾有爱 共回答了18个问题
也曾有爱 共回答了18个问题 |采纳率94.4%解题思路:A.标准状况下,水为液体,不能使用气体摩尔体积;
B.溶液中NH4+水解,NH4+浓度小于0.2mol/L,溶液体积未知,不能确定NH4+数目小于 0.2nA;
C.O2和O3都由氧原子构成,根据n=[m/M]计算氧原子物质的量,每个氧原子含有8个电子,据此计算含有电子物质的量,再根据N=nNA计算含有电子数目;
D.N2和CO都是双原子分子,若二者物质的量为1mol,则含有含有的原子数均为2nA.A.标准状况下,水为液体,不能使用气体摩尔体积,11.2L水的物质的量远远大于0.5mol,故A错误;
B.溶液中NH4+水解,NH4+浓度小于0.2mol/L,溶液体积未知,不能确定NH4+数目小于 0.2nA,故B错误;
C.O2和O3都由氧原子构成,16g的O2和O3混合气体中氧原子物质的量为[16g/16g/mol]=1mol,每个氧原子含有8个电子,故含有电子物质的量为8mol,含有电子数目为8mol×nAmol-1=8nA,故C正确;
D.N2和CO都是双原子分子,若二者物质的量为1mol,则含有含有的原子数均为2nA,二者质量相同,但不一定是28g,故D错误;
故选C.点评:
本题考点: 阿伏加德罗常数.
考点点评: 本题考查常用化学计量的有关计算,难度不大,注意气体摩尔体积的使用条件与对象.1年前查看全部
- (2007•揭阳二模)已知函数f(x)=logax(a>0,a≠1)的图象如图所示,函数y=g(x)的图象与y=f(x)
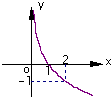 (2007•揭阳二模)已知函数f(x)=logax(a>0,a≠1)的图象如图所示,函数y=g(x)的图象与y=f(x)的图象关于直线y=x对称,则函数y=g(x)的解析式为( )
(2007•揭阳二模)已知函数f(x)=logax(a>0,a≠1)的图象如图所示,函数y=g(x)的图象与y=f(x)的图象关于直线y=x对称,则函数y=g(x)的解析式为( )
A.g(x)=2x
B.g(x)=(
)x1 2
C.g(x)=log
x1 2
D.g(x)=log2x szyongancn1年前1
szyongancn1年前1 -
 afjp 共回答了19个问题
afjp 共回答了19个问题 |采纳率94.7%解题思路:根据函数y=g(x)的图象与y=f(x)的图象关于直线y=x对称可知,函数y=g(x)是y=f(x)的反函数,由此可得y=g(x)的解析式.函数f(x)=logax(a>0,a≠1)的图象如右图示,
∴loga2=-1,a=[1/2],∴f(x)=log
1
2x.
函数y=g(x)的图象与y=f(x)的图象关于直线y=x对称,
所以y=g(x)是y=f(x)的反函数,即g(x)=(
1
2)x,
故选B.点评:
本题考点: 反函数.
考点点评: 本题属于基础性题,解题思路清晰,方向明确,注意抓住函数y=g(x)的图象与y=f(x)的图象关于直线y=x对称这一特点,确认f(x)是原函数的反函数非常重要,是本题解决的突破口.1年前查看全部
- (2014•揭阳一模)方程2x-1+x=5的解所在的区间是( )
(2014•揭阳一模)方程2x-1+x=5的解所在的区间是( )
A.(0,1)
B.(1,2)
C.(2,3)
D.(3,4) wwk89846121年前1
wwk89846121年前1 -
 kingzhi 共回答了25个问题
kingzhi 共回答了25个问题 |采纳率88%解题思路:方程2x-1+x=5的解所在的区间就是函数f(x)=2x-1+x-5的零点所在的区间,根据函数零点的判定定理可得函数f(x)的零点所在的区间,由此可得结论.令f(x)=2x-1+x-5,则 方程2x-1+x=5的解所在的区间就是函数f(x)=2x-1+x-5的零点所在的区间.
由于f(2)=4-5=-1,f(3)=4+3-5=2>0,根据函数零点的判定定理可得函数f(x)=2x-1+x-5的零点所在的区间为(2,3),
故选 C.点评:
本题考点: 函数的零点.
考点点评: 本题主要考查函数的零点的判定定理的应用,体现了转化的数学思想,属于基础题.1年前查看全部
- (2014•揭阳)在测矿石密度时,选用了天平、量筒、小矿石、细线、烧杯和水等器材进行实验:
 (2014•揭阳)在测矿石密度时,选用了天平、量筒、小矿石、细线、烧杯和水等器材进行实验:
(2014•揭阳)在测矿石密度时,选用了天平、量筒、小矿石、细线、烧杯和水等器材进行实验:
(1)在调节天平时,发现指针位置如图甲所示,此时应将平衡螺母向______调(选填“左”或“右”).
(2)用调节好的天平秤小矿石的质量.天平平衡时,放在右盘中的砝码和游码的位置如图乙所示,则被测物体的质量是______g;量筒量出小矿石的体积如图丙所示,体积为______cm3,则小矿石的密度ρ=______kg/m3. c4diy1年前0
c4diy1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2011•揭阳二模)甲、乙表示真核细胞内基因表达的两个主要步骤,请回答(括号中填编号,横线上填文字):
(2011•揭阳二模)甲、乙表示真核细胞内基因表达的两个主要步骤,请回答(括号中填编号,横线上填文字):
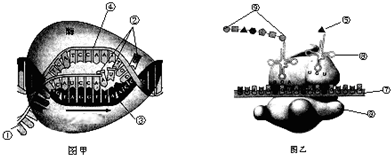
(1)图甲进行的主要场所是______,所需要的原料是______.图乙所示过程称为______,完成此过程的细胞器是______、______.
(2)图乙中⑥的名称是______,若其上的三个碱基为UGU,则在⑦上与之对应的三个碱基序列是______.
(3)已知某基因片段碱基排列为:
.由它控制合成的多肽中含有“-脯氨酸-谷氨酸-谷氨酸-赖氨酸-”的氨基酸序列(脯氨酸的密码子是:CCU、CCC、CCA、CCG;谷氨酸的GAA、GAG;赖氨酸的是AAA、AAG;甘氨酸的是GGU、GGC、GGA、GGG).①-CCTGAAGAGAAG- ②-GGACTTCTCTTC-
①翻译上述多肽的mRNA是由该基因的______链转录的(以图中①或②表示).
②若该基因片段指导合成的多肽的氨基酸排列顺序变成了“-脯氨酸-谷氨酸-甘氨酸-赖氨酸-”.则该基因片段模板链上的一个碱基发生的变化是:______. x_fk_pdd3pv63_e11年前1
x_fk_pdd3pv63_e11年前1 -
 hongjidan 共回答了14个问题
hongjidan 共回答了14个问题 |采纳率85.7%解题思路:图甲中所示的过程是乙DNA分子的一条链为母板,合成RNA的过程,即转录;其中①是RNA,②是核糖核苷酸,③是DNA分子中转录的母板链,④DNA分子的另一条链.图乙是在核糖体上以mRNA为母板,利用20种氨基酸合成多肽或蛋白质,即翻译过程;⑤是氨基酸,⑥是转运RNA,⑦是mRNA,⑧是核糖体,⑨是多肽(蛋白质).(1)图甲表示转录过程,主要是在细胞核中进行,转录过程是利用四种核糖核苷酸为原料合成mRNA过程.图乙表示翻译过程,是在核糖体上进行的.
(2)⑥是tRNA,其上有三个碱基是反密码子,mRNA上有密码子与之对应,反密码子是UGU,则密码子是ACA.
(3)多肽顺序是-脯氨酸-谷氨酸-谷氨酸-赖氨酸-,通过密码子表可知脯氨酸的密码子是CC_,所以判断模板是②链.对比两条链可知,氨基酸由谷氨酸变成甘氨酸,查密码子表可知是由GAG→GGG,所以对应DNA分子中是由T→C.
故答案为:
(1)细胞核核糖核苷酸(答“核苷酸”不给分)翻译⑧核糖体
(2)转运RNA(或tRNA)ACA
(3)②T→C点评:
本题考点: 遗传信息的转录和翻译.
考点点评: 本题考查基因表达和基因突变的相关知识,意在考查学生的识图和判断能力,属于中档题.1年前查看全部
- (2014•揭阳三模)下述实验方案能达到实验目的是( )
(2014•揭阳三模)下述实验方案能达到实验目的是( )
编号 A B C D 实验
方案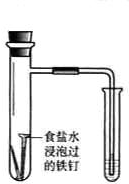
食盐水

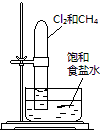
置于光亮处实验
目的验证铁钉发生析氢腐蚀 从碘与NaCl混合溶液中分离出碘 实验室制备乙炔 验证甲烷与氯气发生化学反应
A.A
B.B
C.C
D.D 栗子狗1年前1
栗子狗1年前1 -
 narutoxjf 共回答了21个问题
narutoxjf 共回答了21个问题 |采纳率100%解题思路:A.食盐水为中性,发生吸氧腐蚀;
B.应用萃取的方法分离;
C.不能用启普发生器制备乙炔;
D.甲烷与氯气发生取代反应生成HCl,试管中液面上升.A.食盐水为中性,发生吸氧腐蚀,而酸性溶液中发生析氢腐蚀,故A错误;
B.加热溶液,不能使碘升华,应用萃取的方法分离,故B错误;
C.反应放热、迅速,且生成的氢氧化钙浊液易堵塞玻璃管,不能用启普发生器制备乙炔,故C错误;
D.甲烷与氯气发生取代反应生成HCl,试管中液面上升,实验装置可验证甲烷与氯气发生了化学反应,故D正确;
故选D.点评:
本题考点: 化学实验方案的评价;金属的电化学腐蚀与防护;乙炔炔烃;物质的分离、提纯的基本方法选择与应用;甲烷的取代反应.
考点点评: 本题考查化学实验方案的评价,为高频考点,涉及电化学腐蚀、电解原理、常见有机物性质等,把握物质的性质及实验装置图的作用、反应原理为解答的关键,注意实验方案的评价性、操作性分析,题目难度不大.1年前查看全部
- (2008•揭阳二模)科学家成功开发便携式固体氧化物燃料电池,它以丙烷气体为燃料.电池中的一极通入空气,另一极通入丙烷气
(2008•揭阳二模)科学家成功开发便携式固体氧化物燃料电池,它以丙烷气体为燃料.电池中的一极通入空气,另一极通入丙烷气体,电解质是固态氧化物,在熔融状态下能传导O2-.下列对该燃料电池的说法不正确的是( )
A.在熔融电解质中,O2-由负极移向正极
B.该电池的总反应是:C3H8+5O2=3CO2+4H2O
C.电路中每通过5mol电子,约有5.6L标准状况下的丙烷被完全氧化
D.通丙烷的电极为电池负极,发生的电极反应为:C3H8-20e-+10O2-=3CO2+4H2O 草跟水飘1年前1
草跟水飘1年前1 -
 淮南壮丁 共回答了18个问题
淮南壮丁 共回答了18个问题 |采纳率83.3%解题思路:丙烷燃料电池的总反应式与丙烷燃烧的方程式相同,都为C3H8+5O2=3CO2+4H2O,电池工作时,丙烷在负极被氧化,电极方程式为C3H8-20e-+10O2-=3CO2+4H2O,氧气在正极被还原,电极反应式为O2-4e-=2O2-,熔融电解质中阳离子向正极移动,阴离子向负极移动.A.在熔融电解质中,O2-由正极移向负极,故A错误;
B.丙烷燃料电池的总反应式与丙烷燃烧的方程式相同,都为C3H8+5O2=3CO2+4H2O,故B正确;
C.n(C3H8)=[5.6L/22.4L/mol]=0.25mol,C3H8被氧化为CO2,根据化合价的变化可知,转移电子的物质的量为0.25mol×[3×4-(-8)]=5mol,也可根据电极反应式判断,故C正确;
D.电池工作时,丙烷在负极被氧化,电极方程式为C3H8-20e-+10O2-=3CO2+4H2O,故D正确.
故选A.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查化学电源新型电池,题目难度中等,本题注意把握丙烷燃料电池的工作原理,能正确写出电极反应式为解答该题的关键,注意题中电解质.1年前查看全部
- (2007•揭阳一模)对染色体、DNA、基因三者关系的叙述中,错误的是( )
(2007•揭阳一模)对染色体、DNA、基因三者关系的叙述中,错误的是( )
A.每条染色体上含有一个或两个DNA,DNA分子上含有多个基因
B.都能复制、分离和传递,且三者行为一致
C.三者都是生物细胞内的遗传物质
D.生物的传宗接代中,染色体的行为决定着DNA和基因的行为 zsg10151年前1
zsg10151年前1 -
 hi2uall99 共回答了20个问题
hi2uall99 共回答了20个问题 |采纳率100%解题思路:每条染色体上含有一个或两个DNA,DNA分子上含有许多个基因,所以生物的传种接代中,染色体的行为决定着DNA和基因的行为;三者都能复制、分离和传递,且三者的行为一致;染色体是真核生物遗传物质的主要载体,不是遗传物质,且细胞类生物的遗传物质就是DNA,而不能说主要是DNA.少数病毒的遗传物质是RNA.A、每条染色体上含有一个或两个DNA,DNA分子上含有多个基因,基因是有遗传效应的DNA片段,A正确;
B、染色体是真核生物遗传物质的主要载体,染色体的行为决定着DNA和基因的行为,三者都能复制、分离和传递,且三者的行为一致,B正确;
C、染色体是真核生物遗传物质的主要载体,不是遗传物质,C错误;
D、每条染色体上含有一个或两个DNA,DNA分子上含有许多个基因,所以生物的传种接代中,染色体的行为决定着DNA和基因的行为,D正确.
故选:C点评:
本题考点: 基因与DNA的关系.
考点点评: 本题考查染色体、DNA和基因三者之间的关系.意在考查考生的识记能力和理解判断能力,属于容易题.1年前查看全部
- (2014•揭阳一模)设数列{an}是公比为正数的等比数列,a1=2,a3-a2=12.
(2014•揭阳一模)设数列{an}是公比为正数的等比数列,a1=2,a3-a2=12.
(1)求数列{an}的通项公式;
(2)若数列{bn}满足:bn=log3(
)+log3an,求数列{an+bn}的前n项和Sn.3n 2  cq沉默1年前1
cq沉默1年前1 -
 gunroses1983 共回答了20个问题
gunroses1983 共回答了20个问题 |采纳率85%(1)设数列{an}的公比为q,由a1=2,a3-a2=12,
得2q2-2q-12=0,即q2-q-6=0.
解得q=3或q=-2,
∵q>0,∴q=-2不合题意舍去,
∴an=2×3n−1;
(2)由bn=log3(
3n
2)+log3an,且an=2×3n−1,得
bn=log3(
3n
2×2×3n−1)=log332n−1=2n−1,
∴数列{bn}是首项b1=1,公差d=2的等差数列,
∴Sn=(a1+a2+…+an)+(b1+b2+…+bn)=
2(3n−1)
3−1+
n(1+2n−1)
2=3n-1+n2.1年前查看全部
- (2009•揭阳二模)如图所示遗传系谱中有甲(基因为D、d)、乙(基因为E、e)两种遗传病,其中一种为红绿色盲,已知Ⅱ8
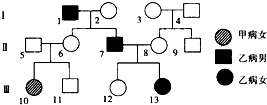 (2009•揭阳二模)如图所示遗传系谱中有甲(基因为D、d)、乙(基因为E、e)两种遗传病,其中一种为红绿色盲,已知Ⅱ8只携带甲或乙一种致病基因.下列叙述不正确的是( )
(2009•揭阳二模)如图所示遗传系谱中有甲(基因为D、d)、乙(基因为E、e)两种遗传病,其中一种为红绿色盲,已知Ⅱ8只携带甲或乙一种致病基因.下列叙述不正确的是( )
A.甲病为常染色体上的隐性遗传病,乙病为红绿色盲
B.Ⅲ13个体乙病基因只来源于Ⅰ2
C.图中Ⅱ6的基因型为DdXEXe
D.Ⅱ7和Ⅱ8生一个两病兼发的男孩的概率为0 奕荃1年前1
奕荃1年前1 -
 tiger_29 共回答了16个问题
tiger_29 共回答了16个问题 |采纳率81.3%解题思路:分析题图:Ⅱ5和Ⅱ6都不患甲病,但他们有一个患甲病的女儿(Ⅲ10),即“无中生有为隐性,隐性看女病,女病男正非伴性”,说明甲病是常染色体隐性遗传病;已知甲、乙两种病中有一种是红绿色盲,则乙病为红绿色盲.A、由以上分析可知,甲病为常染色体上的隐性遗传病,乙病为红绿色盲,A正确;
B、Ⅲ13个体的基因型为XeXe,其乙病基因来源于I2和I3,B错误;
C、Ⅲ10患甲病,其基因型为dd,而Ⅱ6不患甲病,则其基因型为Dd,I1患乙病,其基因型为XeY,Ⅱ6不乙病,则其基因型为XEXe,因此Ⅱ6的基因型为DdXEXe,C正确;
D、已知Ⅱ8只携带甲或乙一种致病基因,由图可知其携带的是乙病致病基因,即Ⅱ8不携带甲致病基因,因此其子代不可能患甲病,所以Ⅱ7和Ⅱ8生一个两病兼发的男孩的概率为0,D正确.
故选:B.点评:
本题考点: 伴性遗传;常见的人类遗传病.
考点点评: 本题结合系谱图,考查伴性遗传、基因自由组合定律的实质及应用,要求考生掌握人类遗传病的特点,能根据系谱图和题干信息“其中一种为红绿色盲”准确判断两种遗传病的遗传方式,再结合题图准确判断各选项,属于考纲理解和应用层次的考查.1年前查看全部
- (2008•揭阳二模)某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行
(2008•揭阳二模)某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行:
①称量a g样品,置于烧杯中;
②加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250mL溶液;
③准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,加热使反应完全;
④趁热迅速加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到坩埚内,加热、搅拌,直到固体全部由红褐色变为红棕色后,在干燥器中冷却至室温后,称量;
⑦…
请根据上面叙述,回答:
(1)下图所示仪器中,本实验步骤①②③中必须用到的仪器是E和______(填字母).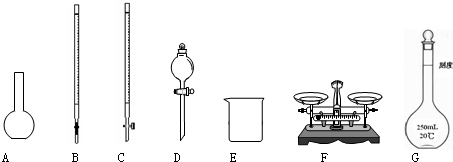
(2)写出步骤③中发生反应的离子方程式______.
(3)洗涤是洗去附着在沉淀上的______(写离子符号),洗涤沉淀的操作是______.
(4)第⑥步的操作中,将沉淀物加热,冷却至室温,称量其质量为m1g;再次加热并冷却室温称量其质量为m2g,且m1-m2=0.3,接下来的操作应当是______.
(5)若坩埚质量是W1,坩埚与加热后固体总质量是W2,则样品中铁元素的质量分数为
×100%(W2−W1)g×
×112 160 250 25 a g .(列出算式,不需化简)
×100%(W2−W1)g×
×112 160 250 25 a g
(6)该兴趣小组中甲学生认为:实验步骤③中不加入氯水,其余步骤不变,仍可达到实验目的.你认为甲学生的观点是否正确?______(填正确或错误);请说明理由:______. 语衡1年前1
语衡1年前1 -
 qzgyh99 共回答了16个问题
qzgyh99 共回答了16个问题 |采纳率87.5%解题思路:(1)根据称量、溶解、配制一定物质的量浓度的溶液、准确量取溶液等操作确定所需仪器;
(2)根据氯水能将FeCl2氧化生成FeCl3;
(3)根据溶液中含有氨水、氯化铵来确定离子;根据洗涤沉淀的方法;
(4)根据最后两次称得的质量差不超0.1g确定反应完全进行;
(5)氢氧化铁加热灼烧后生成氧化铁,坩埚质量是W1,坩埚与加热后固体总质量是W2,则氧化铁的质量为(W2-W1)g.氧化铁中铁元素的质量等于样品中铁元素的质量,进而计算铁元素的质量分数;
(6)根据FeCl3、FeCl2溶液中加入过量氨水,生成Fe(OH)3和Fe(OH)2沉淀,在操作过程中Fe(OH)2会被空气进一步氧化生成Fe(OH)3,最后所得生成物只有Fe2O3;(1)称量时需要天平、钥匙;
溶解时需要烧杯、玻璃棒;
配制一定物质的量浓度的溶液时需要量筒、烧杯、玻璃棒、胶头滴管、一定规格的容量瓶;
准确量取溶液需要酸式滴定管、洗耳球,
故答案为:C F G;
(2)氯水能将FeCl2氧化生成FeCl3,离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(3)溶液中含有氨水、氯化铵,所以离子有:NH4+、Cl-、OH-;洗涤沉淀的方法是向漏斗里注入蒸馏水,使水面没过滤渣,等水自然流完后,重复操作2~3次,
故答案为:NH4+、Cl-、OH-;向漏斗里注入蒸馏水,使水面没过滤渣,等水自然流完后,重复操作2~3次;
(4)最后两次称得的质量差不超0.1g确定反应完全进行,
故答案为:继续加热,放置干燥器中冷却,称量,至最后两次称得的质量差不超0.1g.
(5)铁元素质量守恒,即红棕色固体中的铁就是样品中铁,Fe2O3中铁元素的质量为(W2-W1)g×[112/160],样品中铁元素的质量(W2-W1)g×[112/160]×[250/25],样品中铁元素的质量分数
(W2−W1)g×
112
160×
250
25
a g×100%,
故答案为:
(W2−W1)g×
112
160×
250
25
a g×100%.
(6)因FeCl3、FeCl2溶液中加入过量氨水,生成Fe(OH)3和Fe(OH)2沉淀,在操作过程中Fe(OH)2会被空气进一步氧化生成Fe(OH)3,最后所得生成物只有Fe2O3,仍可达到实验目的,
故答案为:正确;FeCl3、FeCl2溶液中加入过量氨水,生成Fe(OH)3和Fe(OH)2沉淀,在操作过程中Fe(OH)2会被空气进一步氧化生成Fe(OH)3,最后所得生成物只有Fe2O3,对实验结果无影响.点评:
本题考点: 探究物质的组成或测量物质的含量.
考点点评: 本题主要考查学生溶液的配制、对实验原理理解、对实验操作的评价、物质含量的测定、化学计算等,难度中等,需要学生具备扎实的基础知识与分析问题、解决问题能力.1年前查看全部
- 写一篇《青春给力,振兴揭阳》的作文,我重重有赏,(不要被人知道的)
 花tt121年前1
花tt121年前1 -
 绍兴小毡帽 共回答了20个问题
绍兴小毡帽 共回答了20个问题 |采纳率70%走入青春的大门,好象是一夜间的事,然后沉湎其间不知道岁月时间的长短,将要走出大门时,却是那么的恋恋不舍,恨不能从新来过.我看到那些赞美青春的文章,对青春的赞美,有对青春短暂的感慨,有希望留驻青春的愿望,还有...1年前查看全部
- (2006•揭阳一模)2004年诺贝尔生理学或医学奖,授予美国科学家理查德•阿克塞尔和琳达•巴克,以表彰两人在气味受体和
 (2006•揭阳一模)2004年诺贝尔生理学或医学奖,授予美国科学家理查德•阿克塞尔和琳达•巴克,以表彰两人在气味受体和嗅觉系统组织方式研究中作出的贡献.他们发现,一种嗅觉受体细胞只拥有一种类型的气味受体,即每个单独的嗅觉受体细胞只表达一种气味受体基因.气味受体有多少,就有多少类型的嗅觉受体细胞.当气味分子流动到我们的鼻端黏膜处的嗅觉受体细胞处时,气味分子可以粘附于细胞膜上特殊的气味受体上;我们基因的3%被用来编码嗅觉受体细胞细胞膜上的不同气味受体.如图为嗅觉受体细胞膜模式图(局部).请据图回答:
(2006•揭阳一模)2004年诺贝尔生理学或医学奖,授予美国科学家理查德•阿克塞尔和琳达•巴克,以表彰两人在气味受体和嗅觉系统组织方式研究中作出的贡献.他们发现,一种嗅觉受体细胞只拥有一种类型的气味受体,即每个单独的嗅觉受体细胞只表达一种气味受体基因.气味受体有多少,就有多少类型的嗅觉受体细胞.当气味分子流动到我们的鼻端黏膜处的嗅觉受体细胞处时,气味分子可以粘附于细胞膜上特殊的气味受体上;我们基因的3%被用来编码嗅觉受体细胞细胞膜上的不同气味受体.如图为嗅觉受体细胞膜模式图(局部).请据图回答:
(1)A代表细胞膜上的______分子,C代表______.
(2)气味物质分子首先要与图中A结合,才有产生嗅觉的可能,所以准确地说,A应称为______.
(3)图中A具有特异性,这种特异性最终是由______决定的.
(4)气味物质分子一旦与嗅觉受体细胞结合后,该细胞膜内外的电位状况是______.
(5)某些有机溶剂(如苯酚)可溶解B,造成膜的损伤,使嗅觉分辨能力下降,B的完整化学名称是______. 陈大牙1年前1
陈大牙1年前1 -
 笑狂修 共回答了16个问题
笑狂修 共回答了16个问题 |采纳率100%解题思路:分析题图:图示为嗅觉受体细胞膜模式图(局部),其中A是蛋白质分子;B为磷脂双分子层,是构成细胞膜的基本骨架;C是多糖,其与蛋白质结合形成糖蛋白,具有识别功能.(1)由以上分析可知,A代表蛋白质,C代表多糖.
(2)气味物质分子首先要与图中A结合,才有产生嗅觉的可能,由此可见,A应称为气味受体.
(3)A是蛋白质分子,具有特异性,这种特异性最终是由遗传物质决定的.
(4)气味物质分子一旦与嗅觉受体细胞结合后,导致该细胞兴奋,细胞膜对钠离子的通透性增强,钠离子内流,形成内正外负的膜电位.
(5)B是磷脂双分子层.
故答案为:
(1)蛋白质多糖
(2)气味受体
(3)DNA(或基因、遗传物质)
(4)膜外为负、膜内为正
(5)磷脂双分子层点评:
本题考点: 细胞膜的成分;细胞膜内外在各种状态下的电位情况.
考点点评: 本题结合嗅觉受体细胞膜模式图,考查细胞膜的成分、神经调节,要求考生识记细胞膜的成分,能准确判断图中各物质的名称;此外还要求考生识记神经调节的相关知识.1年前查看全部
- (2011•揭阳)老师办公室有一台饮水机,它的铭牌如表,工作电路如图所示,S0是温控开关,可以自动控制饮水机的加热或保温
 (2011•揭阳)老师办公室有一台饮水机,它的铭牌如表,工作电路如图所示,S0是温控开关,可以自动控制饮水机的加热或保温状态.[C水=4.2×103J/(kg•℃)]问:
(2011•揭阳)老师办公室有一台饮水机,它的铭牌如表,工作电路如图所示,S0是温控开关,可以自动控制饮水机的加热或保温状态.[C水=4.2×103J/(kg•℃)]问:
(1)将热水箱装满水后从20℃加热到90℃,水吸收的热量是多少?热水箱容量 2.0L 额定电压 220V 加热功率 880W
(2)饮水机在加热状态下正常工作lOmin,消耗的电能是多少?
(3)若在保温状态下,饮水机消耗的功率是44W,则R2的阻值是多少? longzaijiutian781年前1
longzaijiutian781年前1 -
 阳桃 共回答了18个问题
阳桃 共回答了18个问题 |采纳率94.4%解题思路:(1)先根据m=ρV求出水的质量,又知道水的、初温和末温,根据公式Q吸=cm(t-t0)求出水吸收的热量;
(2)由表格数据可知加热功率,根据W=Pt求出正常工作lOmin消耗的电能;
(3)由电路图可知,温控开关断开时,电路为R2的简单电路,此时电路中的总电阻最大,电功率最小,饮水机处于保温状态,根据P=
求出R2的阻值.U2 R (1)根据ρ=[m/V]可得,热水箱装满水后水的质量:
m=ρV=1.0×103kg/m3×2×10-3m3=2kg,
水吸收的热量:
Q吸=cm(t-t0)=4.2×103J/(kg•℃)×2kg×(90℃-20℃)=5.88×105J;
(2)饮水机在加热状态下的功率为880W,则工作lOmin消耗的电能:
W加热=P加热t=880W×10×60s=5.28×105J;
(3)温控开关断开时,电路为R2的简单电路,饮水机处于保温状态,
由P=
U2
R可得,R2的阻值:
R2=
U2
P保温=
(220V)2
44W=1100Ω.
答:(1)将热水箱装满水后从20℃加热到90℃,水吸收的热量是5.88×105J;
(2)饮水机在加热状态下正常工作lOmin,消耗的电能是5.28×105J;
(3)R2的阻值是1100Ω.点评:
本题考点: 电功与热量的综合计算;电功率的计算.
考点点评: 本题考查了学生对吸热公式、电功率公式、电功公式的掌握和运用,是一道电学与热学的综合应用题,与生活实际相联系,属于中考常见题型.1年前查看全部
- (2008•揭阳二模)若原子核外电子的排布的基本规律为最外层电子数不超过5个,次外层电子数不超过10个,倒数第三层电子数
(2008•揭阳二模)若原子核外电子的排布的基本规律为最外层电子数不超过5个,次外层电子数不超过10个,倒数第三层电子数不超过15个,而各电子层电子的最大容量仍为2n2,则元素周期表中第三、第四、第五周期含有的元素分别有( )
A.5种、10种、15种
B.8种、18种、18种
C.8种、10种、15种
D.9种、10种、15种 心语谁解1年前1
心语谁解1年前1 -
 北窗 共回答了16个问题
北窗 共回答了16个问题 |采纳率100%解题思路:元素周期表的周期数等于原子核外电子层数,各电子层电子的最大容量为2n2,则每层电子数最多为2、8、18、32、50等排列,最外层电子数不超过5个,次外层电子数不超过10个,倒数第三层电子数不超过15个,第一周期有2种元素,第2周期有5种元素,第3周期最后一种元素的原子的核外电子数分别为2、8、5,第4周期最后一种元素的原子的核外电子数分别为2、8、10、5,第5周期最后一种元素的原子的核外电子数分别为2、8、15、10、5,以此解答该题.若原子核外电子的排布的基本规律为最外层电子数不超过5个,次外层电子数不超过10个,倒数第三层电子数不超过15个,而各电子层电子的最大容量仍为2n2,
则周期表中每一周期最后一种元素的核外电子排布分别为:
第1周期:2;
第2周期:2、5;
第3周期:2、8、5;
第4周期:2、8、10、5;
第5周期:2、8、15、10、5,
则元素周期表中第三、第四、第五周期含有的元素分别有8、10、15种,
故选C.点评:
本题考点: 原子核外电子排布;元素周期表的结构及其应用.
考点点评: 本题考查元素核外电子排布和原子周期表的关系,侧重于学生的分析能力和自学能力的考查,注意把握题给信息,为解答该题的关键,根据周期表中每一周期最后一种元素的核外电子排布判断,题目难度中等.1年前查看全部
- (2009•揭阳模拟)亚洲的气候特点是______、______、______.
 ff皇牌蛋黄派1年前1
ff皇牌蛋黄派1年前1 -
 vrain0014 共回答了17个问题
vrain0014 共回答了17个问题 |采纳率100%解题思路:亚洲气候的特点是:亚洲气候复杂多样,季风气候显著,大陆性特征明显,其中亚洲分布最广的气候类型是温带大陆性气候,亚洲面积广大,地跨寒温热三带,且地形复杂多样,除温带海洋性气候外,世界上的各种气候在亚洲都有分布.亚洲气候的特点是:亚洲气候复杂多样,季风气候显著,大陆性特征明显.
故答案为:复杂多样;大陆性特征明显;季风气候显著.点评:
本题考点: 亚洲的气候.
考点点评: 本题考查亚洲的气候特点,牢记即可.1年前查看全部
- (2013•揭阳)张明利用下图所示的电路做“探究通过导体的电流与导体电阻的关系”的实验.他使用的器材有:两节新干电池,三
 (2013•揭阳)张明利用下图所示的电路做“探究通过导体的电流与导体电阻的关系”的实验.他使用的器材有:两节新干电池,三个定值电阻:R1=5Ω、R2=10Ω、R3=20Ω,标有“15Ω1A”的滑动变阻器、电流表、电压表和开关各一只,导线若干.
(2013•揭阳)张明利用下图所示的电路做“探究通过导体的电流与导体电阻的关系”的实验.他使用的器材有:两节新干电池,三个定值电阻:R1=5Ω、R2=10Ω、R3=20Ω,标有“15Ω1A”的滑动变阻器、电流表、电压表和开关各一只,导线若干.
(1)电路中滑动变阻器的作用是______(答出一条即可).
(2)正确连接好电路后,小明首先将R1接入电路,移动滑动变阻器滑片使R1两端的电压为1.5V,读出电流表的示数.
①小明将用R2替换R1接入电路,接下来他应该进行的操作是______,读出电流表的示数
②小明用R3替换R2接入电路进行实验,发现无论怎样移动滑动变阻器,R3两端的电压始终无法达到1.5V.经查,电路连接无误,各元件均完好.请找出一种可能的原因______.
③在不改变电路的前提下,针对②中的问题,怎样改进该实验,请写出你的办法______. kkndsshun1年前1
kkndsshun1年前1 -
 老肉 共回答了14个问题
老肉 共回答了14个问题 |采纳率85.7%解题思路:(1)探究电流和电阻的关系,要控制电阻两端电压不变,滑动变阻器在电路中的作用有:保护电路,控制电阻两端电压不变.
(2)①实验中要保证电阻两端电压不变,更换电阻后,要移动滑动变阻器滑片位置,使电压表示数保持不变;
②电阻两端电压达不到1.5V,可从滑动变阻器阻值大小、电源电压大小、电阻本身等方面分析原因;
③在不改变实验器材的前提下,可适当提高电阻两端的电压,以便达到实验目的.(1)在本实验中滑动变阻器的作用是:基本作用:保护电路;主要作用:通过调整滑动变阻器,控制电阻两端的电压不变;(3)①用R2替换R1接入电路,接下来他应该进行的操作是:移动滑动变阻器滑片使R2两端的电压为1.5V...
点评:
本题考点: 探究电流与电压、电阻的关系实验.
考点点评: 1、本题考查了连接实物电路图、滑动变阻器的作用、实验操作与实验现象分析等问题;
2、先分析清楚实验的原理图,再连接实物电路图;
3、连接实物图时应注意:①电压表、电流表的正负极不要接反.②注意电压表、电流表的量程不要接错.③滑动变阻器的分压与限流接法,滑片移动时阻值的变化应符合题意要求.④作图要美观,连线不要交叉.1年前查看全部
- (2014•揭阳模拟)日本多火山、地震的原因是( )
(2014•揭阳模拟)日本多火山、地震的原因是( )
A.多山地、丘陵
B.位于太平洋板块和印度洋板块交界处
C.位于板块的内部
D.位于太平洋板块和亚欧板块交界处 Httpxx1年前1
Httpxx1年前1 -
 8917126 共回答了21个问题
8917126 共回答了21个问题 |采纳率81%解题思路:(1)日本位于亚洲东部、太平洋西北部,是一个多山的岛国,由北海道、本州、四国、九州4个大岛、数千个小岛及附近的海域组成,最大的岛屿是本州岛,西隔日本海和中国、韩国等隔海相望;
(2)日本地处环太平洋火山地震带上,多火山、地震.日本地处环太平洋火山地震带上(太平洋板块和亚欧板块交界处),地壳比较活跃,故多火山、地震.
故选:D.点评:
本题考点: 日本的主要岛屿、地震带、火山和城市.
考点点评: 本题考查了日本多火山、地震的原因,属基础题.1年前查看全部
- (2012•揭阳)如图所示是电热水壶铭牌.为了测量它烧水时的实际功率,石磊和哥哥合作进行了如下实验:关掉家里所有用电器,
(2012•揭阳)如图所示是电热水壶铭牌.为了测量它烧水时的实际功率,石磊和哥哥合作进行了如下实验:关掉家里所有用电器,将该电水壶装了0.6L(600cm3) 20℃的水,接入家庭电路中,闭合壶的开关,测得壶中的水从20℃上升到100℃所用的时间是3.5min.同时观察到家中电能表(见图)转过的转数正好为90转(r).已知水的比热容c=4.2×103J/(kg•℃).请根据相关信息,求:
(1)电水壶中水吸收的热量;
(2)电水壶烧水的实际功率.
 lfxiaoyaolin1年前1
lfxiaoyaolin1年前1 -
 晨睡 共回答了16个问题
晨睡 共回答了16个问题 |采纳率93.8%解题思路:由热量公式Q=cm△t计算吸收的热量,由电表信息可以求解消耗的电能,已知消耗的电能和时间,利用公式P=[W/t]得到实际功率.(1)水的质量m=ρV=1g/cm3×600cm3=600g=0.6kg
水吸收的热量Q=cm△t=4.2×103J/(kg•℃)×0.6kg×80℃=201600J;
(2)消耗的电能W=[90r/1500r/kwh]=0.06kW•h=216000J
电水壶烧水的实际功率P=[W/t]=[0.06kwh
3.5/60h]≈1.03kW.
答:
(1)电水壶中水吸收的热量是201600J;
(2)电水壶烧水的实际功率是1.03kW.点评:
本题考点: 热量的计算;电功率的计算.
考点点评: 本题是一道电学与热学的综合应用题,与生活相连,使学生觉得学了物理有用,注意计算时的单位变换要正确.1年前查看全部
- (2013•揭阳二模)人类和某些动物的眼睛像一架照相机.眼球内的晶状体相当于一个凸透镜,视网膜相当于光屏,我们看物体时,
(2013•揭阳二模)人类和某些动物的眼睛像一架照相机.眼球内的晶状体相当于一个凸透镜,视网膜相当于光屏,我们看物体时,是通过睫状肌的伸缩来调节晶状体的弯曲程度,改变晶状体的焦距,使不同远近的物体都能在像距相同的视网膜上生成清晰的倒立的实像,如图所示.

眼睛与照相机不同的是:人的眼睛是通过调节焦距来获得清晰的像,普通照相机是通过改变像距使像变得清晰.
(1)眼睛的晶状体相当于照相机的______.
A.快门B.光圈C.镜头D.胶片
(2)眼睛的视网膜相当于照相机的______.
A.快门B.光圈C.镜头D.胶片
(3)如图的眼睛存在哪类视力问题?哪种透镜能对它进行矫正?______、______. 谈宝宝1年前1
谈宝宝1年前1 -
 kill117 共回答了12个问题
kill117 共回答了12个问题 |采纳率100%解题思路:(1)眼睛的晶状体是一个焦距可调凸透镜,相当于照相机的镜头;
(2)正常眼睛成的像在视网膜上,所以视网膜相当于照相机的胶片;
(3)当晶状体曲度过大时,对光的折射能力增强,物体成的像在视网膜的前方,形成近视眼,需要佩戴凹透镜进行矫正.(1)眼睛的晶状体是一个焦距可调凸透镜,相当于照相机的镜头;
(2)正常眼睛成的像在视网膜上,所以视网膜相当于照相机的胶片;
(3)观察上图可以发现,晶状体把光线会聚到了视网膜的前方,说明晶状体的曲度变大,是近视眼,需要用凹透镜进行矫正.
故答案是:(1)C;(2)D;(3)近视眼;凹透镜.点评:
本题考点: 近视眼的成因与矫正办法;眼睛及其视物原理.
考点点评: 该题考查眼睛的成像原理以及近视眼的成因与矫正的方法,既提醒青少年注意用眼健康,又考查了物理知识,是一道好题.1年前查看全部
- (2007•揭阳二模)(理科做)一个口袋内装有大小相同的4个红球和6个白球.
(2007•揭阳二模)(理科做)一个口袋内装有大小相同的4个红球和6个白球.
(I)从中任摸2个球,求摸出的2个球颜色不同的概率;
(II)从中任摸4个球,求摸出的4个球中红球数不少于白球数的概率;
(Ⅲ)每次从中任摸4个球,放回后再摸4个球,如此反复三次,求三次中恰好有一次4个球都是白球的概率. Q哥-南1年前1
Q哥-南1年前1 -
 39831817 共回答了8个问题
39831817 共回答了8个问题 |采纳率87.5%解题思路:(Ⅰ)从10个球中摸出2个球,有
种摸法,摸出的两个球颜色不同的摸法有C 210C 14
种,由此能求出摸出的2个球颜色不同的概率.C 16
(Ⅱ)摸出的4个球中红球数不少于白球数的情况有4红、3红1白、2红2白三种,由此能求出其概率.
(Ⅲ)每次从中任摸4个球,4个球恰好都是白球的概率p=
=[1/15],由此能求出三次中恰好有一次4个球都是白球的概率.C 44C 46(Ⅰ)从10个球中摸出2个球,有
C210种摸法,
摸出的两个球颜色不同的摸法有
C14
C16种,
∴摸出的2个球颜色不同的概率p=
C14
C16
C210=[8/15].
(Ⅱ)摸出的4个球中红球数不少于白球数的情况有4红、3红1白、2红2白三种,
其概率P=
C44
C410+
C34
C16
C410+
C24
C26
C410=[23/42].
(Ⅲ)∵每次从中任摸4个球,4个球恰好都是白球的概率p=
C44
C46=[1/15],
∴每次从中任摸4个球,放回后再摸4个球,如此反复三次,
三次中恰好有一次4个球都是白球的概率:
p=
C13•(
1
15)•(
14
15)2=[196/1125].点评:
本题考点: 等可能事件的概率.
考点点评: 本题考查等可能事件的概率的求法,解题时要认真审题,注意排列组合知识和n次独立重复试验的概率公式的合理运用.1年前查看全部
- (2012•揭阳)在宏观、微观和符号之间建立联系是化学学科的特点.
(2012•揭阳)在宏观、微观和符号之间建立联系是化学学科的特点.
现有A、B、C、D四种物质,其微观示意图见下表.
(1)B物质相对分子质量为______;物质 A B C D 
微观示意图 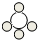


(2)上述物质中属于单质的是______(填物质序号);属于有机物的是______(填写化学式)
(3)一个C分子是由______构成的;
(4)写出反应A+D→B+C的化学方程式:CH4+2O2
CO2+2H2O点燃 .CH4+2O2.
CO2+2H2O点燃 . 孙亮8881年前1
孙亮8881年前1 -
 降火清食 共回答了13个问题
降火清食 共回答了13个问题 |采纳率76.9%解题思路:根据物质的微观结构图分子各分子的结构,并根据结构写出ABCD代表的物质化学式,然后进行分析判断即可;由ABCD四种物质的分子结构可知它们分别是:CH4、H2O、CO2、O2,据此解答下题:
(1)B是水,其相对分子质量等于1×2+16=18;
(2)单质是由同种元素组成的纯净物,所以O2是单质,含碳的化合物是有机物(一氧化碳、二氧化碳和碳酸盐除外),所以CH4属于有机物.
(3)C分子是二氧化碳的分子,其结构是每两个氧原子和一个碳原子构成一个二氧化碳分子.
(4)依据ABCD的化学式可知A+D→B+C的化学方程式为:CH4+2O2
点燃
.
CO2+2H2O;
故答案为:(1)18;(2)D;CH4;(3)两个氧原子和一个碳原子.(4)CH4+2O2
点燃
.
CO2+2H2O;点评:
本题考点: 微粒观点及模型图的应用;单质和化合物的判别;有机物与无机物的区别;相对分子质量的概念及其计算;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了微观示意图表示的化学反应以及物质化学式的确定,完成此题,可以依据图示以及质量守恒定律进行.1年前查看全部
- (2007•揭阳二模)已知数列{an}的前n项和Sn和通项an满足Sn=[1/2(1−an).
(2007•揭阳二模)已知数列{an}的前n项和Sn和通项an满足Sn=[1/2(1−an)
 zstbee20061年前1
zstbee20061年前1 -
 happley 共回答了14个问题
happley 共回答了14个问题 |采纳率78.6%解题思路:(I)利用数列递推式,再写一式,两式相减,利用等比数列的通项公式,即可求数列{an}的通项公式;
(Ⅱ)求出Sn的表达式,即可证明结论;
(III)求出bn=f(a1)+f(a2)+…+f(an),利用裂项法求和即可.(Ⅰ)当n≥2时,an=
1
2(1−an)−
1
2(1−an−1)=−
1
2an+
1
2an−1,
∴2an=-an+an-1
∴
an
an−1=
1
3,----------------------------------(4分)
由S1=a1=
1
2(1−a1)得a1=
1
3
∴数列{an}是首项a1=
1
3、公比为[1/3]的等比数列,
∴an=
1
3×(
1
3)n−1=(
1
3)n------(6分)
(Ⅱ)证明:由Sn=
1
2(1−an)得Sn=
1
2[1−(
1
3)n]---------------------------------(8分)
∵1−(
1
3)n<1,∴[1/2[1−(
1
3)n]<
1
2]
∴Sn<
1
2---------------------------------------------------------(10分)
(Ⅲ)∵f(x)=log
1
3x,
∴bn=log
1
3a1+log
1
3a2点评:
本题考点: 数列与不等式的综合;数列的求和.
考点点评: 本题考查数列的通项与求和,考查不等式的证明,确定数列的通项,正确运用裂项法是关键.1年前查看全部
- (2013•揭阳一模)人类活动深刻影响着地理环境,以下关于人类活动及其影响符合事实的是( )
(2013•揭阳一模)人类活动深刻影响着地理环境,以下关于人类活动及其影响符合事实的是( )
A.城市工业集中,大量消耗化石燃料,排放二氧化碳,产生热岛效应
B.在比较封闭的海湾,石油泄漏会导致赤潮的爆发
C.修建水库可能会引起河口三角洲的快速增长
D.在干旱地区,不合理的灌溉方式可能会导致土壤次生盐碱化 kkkk21年前1
kkkk21年前1 -
 虾米派125 共回答了24个问题
虾米派125 共回答了24个问题 |采纳率87.5%解题思路:人类活动深刻影响着地理环境,不同的人类活动会对地理环境产生不同的影响.A、城市工业生产排放的二氧化碳是种温室气体,可使城市温度升高,形成热岛效应,故正确.
B、赤潮的爆发与石油泄漏没有关系,赤潮是由氮、磷等物质过剩引起的现象,故错误.
C、修建水库后下游地区河流的含沙量会降低,使得河口三角洲的面积会减小,故错误.
D、大水漫灌会使得地下水位升高,盐类物质存留地表形成此生盐碱化,故正确.
故选:AD点评:
本题考点: 地理环境对人类的影响.
考点点评: 本题考查人类活动对地理环境的影响,特别是一些不合理的活动会导致生态环境问题,以课本内容的识记和理解为主.1年前查看全部
- (2008•揭阳)小芳同学利用伏安法测量额定电压为2.5V的小灯泡正常发光时的电阻和电功率.
(2008•揭阳)小芳同学利用伏安法测量额定电压为2.5V的小灯泡正常发光时的电阻和电功率.
(1)图1中的电路没有连接完整,请你把图1中的元件连接完整,(要求滑片P向右移动时变阻器接入电路的阻值变大).
(2)电路连接后,闭合开关,调节滑动变阻器,发现电流表和电压表的示数都为零,用另一只电压表进行检测,测得电源MN两端电压为3V;滑动变阻器接入电路的两接线柱间电压也是3V,则电路的故障可能是______.
(3)排除故障后,调节滑动变阻器,当电压表的示数为______ V时,小灯泡正常发光,这时电流表的示数如图2所示,通过小灯泡的电流为______ A,小灯泡正常发光时的电阻是______Ω,功率是______ W.
 等你幻想1年前1
等你幻想1年前1 -
 billssss 共回答了14个问题
billssss 共回答了14个问题 |采纳率92.9%解题思路:(1)将电压表与灯泡并联,根据灯泡的额定电压确定电压表的量程;
滑动变阻器与灯泡串联,滑片P向右移动时变阻器接入电路的阻值变大,则接入电路中的长度变长;
(2)电流表的示数为零,则电路某处断路,根据断开处的电压等于电源电压进行判断;
(3)当灯泡两端的电压等于额定电压时,灯泡正常发光,根据图2读出电流表的示数,注意量程和分度值;
由R=[U/I]计算出电阻,由P=UI计算出电功率.(1)将电压表与灯泡并联,灯泡的额定电压为2.5V,所以电压表应选择0~3V;
滑片P向右移动时变阻器接入电路的阻值变大,则滑动变阻器的下面接左边的A接线柱,如图所示:
(2)电流表和电压表的示数都为零,则电路某处断路,滑动变阻器两端的电压等于电源电压,则滑动变阻器断路;
(3)灯泡的额定电压为2.5V,则当电压表的示数为2.5V时,灯泡正常发光;
由图2知,电流表的量程为0~0.6A,分度值为0.02A,示数为0.3A;
则R=[U/I]=[2.5V/0.3A]=8.3Ω;P=UI=2.5V×0.3A=0.75W.
故答案为:(1)见上图;(2)滑动变阻器断路;(3)2.5;0.3;8.3;0.75.点评:
本题考点: 伏安法测电阻的探究实验;电功率的测量.
考点点评: 此题是用伏安法测灯泡的电阻和电功率的实验,考查了电压表和滑动变阻器的连接,电流表的读数及电阻和电功率的计算,还考查了有关电路故障的分析,要掌握串联电路中的断路处等于电源电压的特点.1年前查看全部
- (2005•揭阳)现有如下8种装置,请用它们的序号回答下列问题.
(2005•揭阳)现有如下8种装置,请用它们的序号回答下列问题.

(1)实验室制取H2应选用的发生装置为______,收集装置可选用______,其化学反应方程式为______.
(2)根据CO2+C
2CO制取CO,若以CaCO3、盐酸、炭为原料,CO2发生装置最好选用______,CO发生装置最好选用______.△ .
(3)根据反应2NH4Cl(固)+Ca(OH)2
2NH3↑+CaCl2+2H2O制取氨气,并知氨气密度比空气小,且易溶于水,则发生装置选用______,收集装置选用______.△ . 九海子1年前1
九海子1年前1 -
 蚊子听花开 共回答了27个问题
蚊子听花开 共回答了27个问题 |采纳率88.9%(1)实验室常用稀硫酸和锌反应制取氢气,属于固液常温下反应制取气体,可用装置F或G为发生装置,由于氢气难溶于水,可用B为收集装置,又由于氢气是最轻的气体,可用A收集装置;反应的方程式是:Zn+H2SO4=ZnSO4+H2↑;
(2)若以CaCO3与盐酸为原料制取CO2,属于固液常温下反应制取气体,可用装置F或G为发生装置;若用CO2和C在高温条件下反应制取CO,应用E为发生装置;
(3)加热氯化铵和熟石灰的混合物来制取氨气,属于加热固体制取气体,应选用C为发生装置;由于氨气密度比空气小,且易溶于水,收集方法只能用向下排空气法收集,应选用A为收集装置.
故答为:(1)F或G,B或A,Zn+H2SO4=ZnSO4+H2↑;(2)F或G,E;(3)C,A.1年前查看全部
- (2008•揭阳一模)下列判断细胞死活的方法中,表述错误的是( )
(2008•揭阳一模)下列判断细胞死活的方法中,表述错误的是( )
A.将植物细胞置于较高浓度的蔗糖溶液中,发生质壁分离的是活细胞
B.在高倍镜下观察,若发现细胞质流动,则表明细胞是活的
C.将某细菌与水绵一起制成临时装片,用极细的光束照射水绵,若发现细菌没有趋向水绵照光部位,则说明细菌为死细胞
D.洋葱根尖经解离后,若发现细胞被龙胆紫溶液染上了色,则表明根尖细胞在解离前已死亡 bethewinnerqf1年前1
bethewinnerqf1年前1 -
 ltman2002 共回答了18个问题
ltman2002 共回答了18个问题 |采纳率88.9%解题思路:活细胞是细胞完成各项生命活动的条件,而判断细胞死活的方法有多种.A、将植物细胞置于较高浓度的蔗糖溶液中,细胞失水而发生质壁分离的细胞是活细胞,若不能发生质壁分离的细胞则是死细胞,A正确;
B、在高倍镜下观察,通过观察叶绿体的运动方向来判断细胞质的流动方向,若发现细胞质流动,则表明细胞是活的,反之则细胞已经死亡,B正确;
C、将某细菌与水绵一起制成临时装片,用极细的光束照射水绵,若发现细菌没有趋向水绵照光部位,是不能说明细菌为死细胞,因为此细菌是好氧性细菌才行,如果是厌氧性细菌,也不会趋向水绵照光部位,C错误;
D、洋葱根尖经解离后,若发现细胞被龙胆紫溶液染上了色,只能说此时的细胞是死细胞,而不能说是在解离前,因为染色是在解离后,解离时用的解离液是盐酸和酒精,也会杀死细胞,所以不能确定解离前就是死细胞,D错误.
故选:CD.点评:
本题考点: 细胞质壁分离与质壁分离复原现象及其原因;观察线粒体和叶绿体;光合作用的发现史;观察细胞的有丝分裂.
考点点评: 本题主要考查细胞质壁分离与质壁分离复原现象及其原因、观察线粒体和叶绿体、光合作用的发现史、观察细胞的有丝分裂的相关知识,涉及到多个实验,能力要求高、综合性强.1年前查看全部
- (2009•揭阳二模)某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)则下
(2009•揭阳二模)某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)则下列分析推理中不正确的是
( )50mL盐酸 50mL盐酸 50mL盐酸 m(混合物) 9.2g 15.7g 27.6g V(CO2)(标况) 2.24L 3.36L 3.36L
A.盐酸的物质的量浓度为3.0 mol/L
B.根据表中数据不能计算出混合物中NaHCO3的质量分数
C.15.7 g混合物恰好与盐酸完全反应
D.加入混合物9.2 g时盐酸过量 zhhyong1231年前1
zhhyong1231年前1 -
 zjzcf 共回答了21个问题
zjzcf 共回答了21个问题 |采纳率90.5%解题思路:由题意可知:9.2 g混合物与50 mL盐酸反应时盐酸过量,而27.6 g混合物与50 mL盐酸作用时盐酸不足;
由反应H++HCO3-=CO2↑+H2O知,盐酸的物质的量为:n(HCl)=n(CO2)=0.15 mol,
设9.2 g混合物中NaHCO3、KHCO3的物质的量分别为x和y,
则有:x+y=0.1mol①
84x+100y=9.2g ②
解得:x=0.05 mol,y=0.05 mol
所以c(HCl)=0.15 mol/0.05 L=3 mol/L,
w(NaHCO3)=[84/84+100]×100%=45.65%
又由n(NaHCO3)=n(KHCO3),84•n(NaHCO3)+100•n(KHCO3)=15.7g,
解得n (NaHCO3)=0.085 mol,所以15.7 g混合物完全反应消耗HCl的物质的0.17 mol>0.15 mol,故不能恰好完全反应.A.由表知,最后一栏为盐酸不足,可根据生成气体的物质的量计算盐酸的浓度,c(HCl)=
n(CO2)
0.05L=
3.36L
22.4L/mol
0.05L=3.0mol/L,故A正确;
B.第一组实验盐酸过量,固体完全反应,两成分中所含碳酸氢根的物质的量n(HCO3-)等于二氧化碳的物质的量,
则84n(NaHCO3)+100[[2.24L/22.4L/mol]-n(NaHCO3)]=9.2 g,解得:n(NaHCO3)=0.05 mol,能计算NaHCO3的质量分数,故B错误;
C.由分析可知n(NaHCO3)=n(KHCO3),84•n(NaHCO3)+100•n(KHCO3)=15.7g,解得n (NaHCO3)=0.085 mol,所以15.7 g混合物完全反应消耗HCl的物质的0.17 mol>0.15 mol,
故不能恰好完全反应;或从前两组中的数据可以看出,二氧化碳的体积增加了[1/2],混合物的质量也需要增加[1/2],第二组中实际参加反应的混合物是9.2g+[1/2]×9.2g=13.8克,15.7克的混合物过量,故C错误;
D.由于第二组实验所得气体多于第一组实验,且盐酸同量,说明加入混合物9.2 g时盐酸过量,故D正确.
故选BC.点评:
本题考点: 有关混合物反应的计算;钠的重要化合物.
考点点评: 本题考查化合物的计算,题目难度较大,本题注意比较三组数据,判断反应的程度,为解答该题的关键点,也是易错点,答题时注意体会.1年前查看全部
大家在问
- 1如果一个三角形的两条边分别长5厘米和8厘米,另一条边可能是几厘米?(整厘米数)
- 2由于废话太多写不下,所以从下面进入正题吧
- 3假设你是一位火星移民,请写一篇英语短文介绍地球上的概况和人们的娱乐方式给未来的儿女.
- 4She ______that same song so many time
- 5平行四边形的一个角变为直角,则这个图形一定是( )
- 6Full name is NOT a valid
- 7阅读理解. My name is Jimmy.I live with
- 8细胞液,细胞内液,细胞质基质,液泡里的液体都是什么关系呀?
- 9从《孙权劝学》中我们可以看出孙权.吕蒙.鲁肃各是一个怎样的人.简要概括.
- 10下列句子中加点的成语使用正确的一项是( )
- 11若(m-2)x…初一‘巴蜀英才’上50页的一道数学题:若(m-2)x |m-3| (←这个|m-3|是X的|m-3|次方
- 12what dose it mean to the children?
- 13修一条公路,已经修了3.5米,刚好占剩下部分的8分之5,这条公路全长多少米
- 14—What happened to Sally?
- 15如图,这是一座游泳池的示意图,为了给水池四周的地面铺上瓷砖,用瓷砖数的情况如表,其中长度单位是1米,请你自己设定字母用代
