1-20号元素(稀有气体元素除外)中(填元素符号):
 sxmonkey68442022-10-04 11:39:541条回答
sxmonkey68442022-10-04 11:39:541条回答(1)原子半径最小的是______,原子半径最大的是______.
(2)与水反应最剧烈的金属单质是______.
(3)气态氢化物最稳定元素的是______,其电子式为______.
(4)最活泼的金属和最活泼的非金属构成的化合物的电子式为______.

已提交,审核后显示!提交回复
共1条回复
 ll的云 共回答了22个问题
ll的云 共回答了22个问题 |采纳率95.5%- 解题思路:(1)原子半径最小的为H,原子半径最大的为K;
(2)金属性越强,对应的单质越活泼,与水反应越剧烈;
(3)元素的非金属性越强,对应的氢化物越稳定;
(4)最活泼的金属和最活泼的非金属形成的化合物为KF.(1)同周期元素从左到右,原子半径逐渐减小,同主族元素从上到下,原子半径逐渐增大,则-20号元素中原子半径最小的为H,原子半径最大的为K,
故答案为:H;K;
(2)同周期元素从左到右,金属性逐渐减弱,同主族元素从上到下,金属性逐渐增强,则金属性最强的为K,与水反应最剧烈,故答案为:K;
(3)同周期元素从左到右,非金属性逐渐最增强,同主族元素从上到下,非金属性逐渐减弱,则非金属性最强的为F,对应的氢化物最稳定,电子式为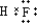 ,
,
故答案为: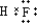 ;
;
(4)最活泼的金属和最活泼的非金属形成的化合物为KF,电子式为 ,故答案为:
,故答案为: .
.点评:
本题考点: 元素周期律和元素周期表的综合应用;元素周期律的作用.
考点点评: 本题考查元素周期表和元素周期律,明确元素的单质及其化合物的性质即可解答,题目难度不大,注意非金属性的比较和氢氧化铝的两性. - 1年前
相关推荐
- 要快速背诵化学元素周期表的1-20号元素有什么小技巧吗?
 大盘跳水1年前1
大盘跳水1年前1 -
 我爱余 共回答了17个问题
我爱余 共回答了17个问题 |采纳率94.1%亲爱李皮彭,坦荡养福来.(氢氦锂铍硼,碳氮氧氟氖)
那美女桂林,牛肉要加钙.(钠镁铝硅磷,硫氯氩钾钙)
这个是传说中的谐音法^v^1年前查看全部
- 元素周期表1-20号的金属元素有几种
元素周期表1-20号的金属元素有几种
稀有气体的是什么?原子半径最大的是? Rabbitling13141年前4
Rabbitling13141年前4 -
 室内一盏灯 共回答了16个问题
室内一盏灯 共回答了16个问题 |采纳率81.3%金属元素:3 LI锂﹑4 Be铍﹑11 Na钠﹑12 Mg镁﹑13 Al铝﹑19 K钾﹑20 Ca钙 稀有气体:2 He氦﹑10 Ne氖﹑18 Ar氩 半径最大:K1年前查看全部
- 1-20号元素最高价氢化物,水化物的分子式怎么写啊?
 金子的宝贝1年前1
金子的宝贝1年前1 -
 yaci_yang 共回答了14个问题
yaci_yang 共回答了14个问题 |采纳率92.9%X表示1~20化学元素,n,m表示一个分子中有多少个该原子 氧化物 通式为XnOm 根据化合价守恒即可 氢化物 中 氢小于等于2个左边 eg:H2O H2S HCl 多于2个右边eg:CH4 NH31年前查看全部
- 默写1-20号元素符号(每小格0.5分,共4分)
默写1-20号元素符号(每小格0.5分,共4分)
HHeLiBeBC______ OF______ Mg______Si______ Ar K______. wangqinwyl1年前1
wangqinwyl1年前1 -
 精悍1 共回答了23个问题
精悍1 共回答了23个问题 |采纳率91.3%解题思路:书写元素的元素符号时,如果只有一个字面,必须大写,如果有两个或两个以上字面时,第一个字母必须大写,以后的字面必须小写.1-20号元素符号分别是:HHeLiBeBC N OF Ne Na Mg AlSi P S Cl Ar K Ca.
故填:N;Ne、Na;Al;P、S、Cl;Ca.点评:
本题考点: 元素的符号及其意义.
考点点评: 本题主要考查学生对化学用语的书写和理解能力,题目重点考查了学生对化学符号的书写,考查全面,注重基础,题目难度较小.1年前查看全部
- 26,1-20号元素(稀有气体元素除外)中:(用元素符号和化学式填空
26,1-20号元素(稀有气体元素除外)中:(用元素符号和化学式填空
(1) 原子半径最小的 ________ ,原子半径最大的是 ___________
(2) 与水反应最剧烈的金属单质是 —— , 非金属单质是 —— (填化学式)
(3) 既能与酸反应,又能与碱反应的金属单质是 ——
(4) 硬度最大的单质是——
(5) 气态氢化物的水溶液酸性最强的是—— (填化学式)
(6) 最高价氧化物对应的水化物碱性最强的是——(填化学式) liyongqing791年前6
liyongqing791年前6 -
 亓言人 共回答了9个问题
亓言人 共回答了9个问题 |采纳率66.7%1) 原子半径最小的 ___H_____ ,原子半径最大的是 ______K_____
(2) 与水反应最剧烈的金属单质是 —K— ,非金属单质是 —F2— (填化学式)
(3) 既能与酸反应,又能与碱反应的金属单质是 —Al—
(4) 硬度最大的单质是—金刚石—
(5) 气态氢化物的水溶液酸性最强的是—HCl— (填化学式)
(6) 最高价氧化物对应的水化物碱性最强的是—KOH—(填化学式)
分析:(1)半径的比较一看电子层数,电子层越多半径越大,所以半径最小在第一周期找,半径最大在第四周期找.同一周期,随核电荷数的递增,原子半径逐渐减小,稀有气体突然增大,所以H原子半径最小,K原子半径最大.
(2)金属性越强、非金属性越强分别与水反应越剧烈,在1-20号元素(稀有气体元素除外)中,K的金属性最强,氟气的非金属最强.
(3)在1-20号元素中只有铝既能与酸反应,又能与强碱反应,反应的化学方程式为:
2Al +3H2SO4 = Al2(SO4)3 +3H2↑
2Al +2H2O+2NaOH =2Na AlO2 +3H2↑
(4)硬度最大的单质就是金刚石
(5)气态氢化物中酸性最强是卤族元素中的气态氢化物,而氢卤酸中只有氢氟酸是弱酸其余为强酸,而且酸性随核电荷的递增逐渐增强,所以在1-20号元素中HCl酸性最强.
(6)金属性越强最高价氧化物对应的水化物碱性最强,在1-20号元素中,K的金属性最强,1年前查看全部
- 在原子序数为1-20号的元素中,用适当的化学符号填写下列空白(稀有气体除外):气态氢化物最稳定的是______,气态氢化
在原子序数为1-20号的元素中,用适当的化学符号填写下列空白(稀有气体除外):气态氢化物最稳定的是______,气态氢化物中含有H元素质量分数最大的氢化物是______.酸性最强的无氧酸是______,碱性最强的是______.  苦咸1年前1
苦咸1年前1 -
 不要拿砖头杂我 共回答了19个问题
不要拿砖头杂我 共回答了19个问题 |采纳率84.2%在短周期元素的所有原子中,同周期元素的原子从左到右原子半径逐渐减小,得电子能力逐渐增强,气态氢化物的稳定性逐渐增强,同主族元素原子从下到上原子半径逐渐减小,得电子能力逐渐增强,气态氢化物的稳定性逐渐增强,在原子序数为1-20号的元素中,F的非金属性最强,所以气态氢化物最稳定的是HF,气态氢化物中含有H元素质量分数最大的是氢碳个数比最大的,即CH 4 ,酸性最强的无氧酸是盐酸,同周期元素的原子从左到右最高价氧化物对应水化物的碱性逐渐减弱,同主族元素原子从上到下最高价氧化物对应水化物的碱性逐渐增强,K的金属性最强,所以最强碱是氢氧化钾,故答案为:HF;CH 4 ;HCl;KOH.1年前查看全部
- 化学的角标法 1-20号的原子 谁给我下 要快
化学的角标法 1-20号的原子 谁给我下 要快
还要Z N A的数字
左下角 标的是什么? mmduoren1年前3
mmduoren1年前3 -
 郁郁儿 共回答了15个问题
郁郁儿 共回答了15个问题 |采纳率86.7%那个叫做质量数
左上角是核电荷数
左下是质量数(或者平均质量数,如果是描述元素就是平均质量数)如果是单个原子就是该原子的质量数,比如有十个碳原子,五个是14的相对质量,五个是12的相对质量,那么它们的平均质量就是13 而如果是一个原子,那么它的质量就不是平均了,就是确定值,所以元素周期表上的相对原子质量是有小数的,因为那是平均质量
右上角是粒子所带电荷数,原子的为零
右下角表示 粒子数目1年前查看全部
- 1.在1-20号元素中,和氖原子具有相同核外电子排布的阳离子有-----------(写出离子符号),阴离子有-----
1.在1-20号元素中,和氖原子具有相同核外电子排布的阳离子有-----------(写出离子符号),阴离子有-------------;和氩原子具有相同核外电子排布的阳离子有-----------阴离子有----------------
 ultraii1年前2
ultraii1年前2 -
 beihouw1972_12k 共回答了18个问题
beihouw1972_12k 共回答了18个问题 |采纳率88.9%氖原子具有相同核外电子排布的阳离子有-Mg2+,Na+,----------(写出离子符号),阴离子有--O2-,-----------;和氩原子具有相同核外电子排布的阳离子有---K+,Ca2+--------阴离子有--Cl-,S2---------------1年前查看全部
- 已知A,B为1-20号元素,某离子化合物AB2,各离子的电子层结构相同,且电子总数为54,可推知A、B分别是什么元素?并
已知A,B为1-20号元素,某离子化合物AB2,各离子的电子层结构相同,且电子总数为54,可推知A、B分别是什么元素?并写出AB2化学式和电子式.
 yu_xiao1年前2
yu_xiao1年前2 -
 幽默大虾 共回答了18个问题
幽默大虾 共回答了18个问题 |采纳率88.9%CaCl2氯化钙1年前查看全部
- 总结1-20号化学元素的性质物理性质不用太具体,化学性质具体,抓重点
 even1061年前1
even1061年前1 -
 温盐水 共回答了18个问题
温盐水 共回答了18个问题 |采纳率88.9%素周期表有7个周期,16个族.每一个横行叫作一个周期,每一个纵行叫作一个族.这7个周期又可分成短周期(1、2、3)、长周期(4、5、6)和不完全周期(7).共有16个族,又分为7个主族(ⅠA-ⅦA),7个副族(ⅠB-ⅦB),一个第ⅧB族,一个零族.
元素在周期表中的位置不仅反映了元素的原子结构,也显示了元素性质的递变规律和元素之间的内在联系.
同一周期内,从左到右,元素核外电子层数相同,最外层电子数依次递增,原子半径递减(零族元素除外).失电子能力逐渐减弱,获电子能力逐渐增强,金属性逐渐减弱,非金属性逐渐增强.元素的最高正氧化数从左到右递增(没有正价的除外),最低负氧化数从左到右递增(第一周期除外,第二周期的O、F元素除外).
同一族中,由上而下,最外层电子数相同,核外电子层数逐渐增多,原子序数递增,元素金属性递增,非金属性递减.
元素周期表的意义重大,科学家正是用此来寻找新型元素及化合物1年前查看全部
- 元素周期表 个周期 个族 原子序数 数值上等于?1-20号元素的符号
 魔怨1年前1
魔怨1年前1 -
 zjw20006 共回答了23个问题
zjw20006 共回答了23个问题 |采纳率73.9%元素周期表总共有7个周期,16个族,原子序数=质子数=核电荷数=核外电子数,1-20号元素是:
H、He、Li、Be、B、C、N、O、F、Ne、Na、Mg、Al、Si、P、S、Cl、Ar、K、Ca
【如果我的回答能帮到你,请选择“好评”,谢谢.】1年前查看全部
- (2013•齐齐哈尔二模)以下框图中的字母代表1-20号元素形成的常见单质及化合物,这些物质之间转化关系如图所示:其中A
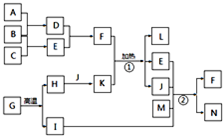 (2013•齐齐哈尔二模)以下框图中的字母代表1-20号元素形成的常见单质及化合物,这些物质之间转化关系如图所示:其中A、B、C为单质,其余为化合物,J常温下呈液态,B在A中燃烧产生苍白色火焰,实验室常用①反应制取气体E,反应②为侯德榜制碱法的主要反应原理,L为常见的干燥剂.
(2013•齐齐哈尔二模)以下框图中的字母代表1-20号元素形成的常见单质及化合物,这些物质之间转化关系如图所示:其中A、B、C为单质,其余为化合物,J常温下呈液态,B在A中燃烧产生苍白色火焰,实验室常用①反应制取气体E,反应②为侯德榜制碱法的主要反应原理,L为常见的干燥剂.
请根据框图中物质转化关系及上面的文字信息回答下列问题:
(1)D、E、F、K、N中既属于电解质又能促进水电离的是______(填化学式).
(2)写出I的电子式______,用电子式表示L的形成过程______.
(3)写出反应①的化学方程式2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O△ .2NH4Cl+Ca(OH)2.写出过量的N与K在溶液中发生反应的离子方程式______.
CaCl2+2NH3↑+2H2O△ .
(4)除去固体M中混有少量F的操作方法______.
(5)反应②实验过程中应向M的饱和溶液中先通入______后通入______(填化学式). hipw1年前1
hipw1年前1 -
 ldbzz 共回答了17个问题
ldbzz 共回答了17个问题 |采纳率100%解题思路:框图中的字母代表1-20号元素形成的常见单质及化合物,其中A、B、C为单质,其余为化合物,B在A中燃烧产生苍白色火焰,应是氢气与氯气反应生成HCl,故D为HCl,D与E反应生成F,反应②为侯德榜制碱法的主要反应原理,反应生成F与N,可推知F为NH4Cl、N为NaHCO3,故E为NH3、B为H2、A为H2、C为N2,实验室常用①反应制取气体E,L为常见的干燥剂,J常温下呈液态,可推知K为Ca(OH)2,J为H2O,L为CaCl2,结合转化关系可知,H为CaO,G为CaCO3,I为CO2,M为NaCl,据此解答.框图中的字母代表1-20号元素形成的常见单质及化合物,其中A、B、C为单质,其余为化合物,B在A中燃烧产生苍白色火焰,应是氢气与氯气反应生成HCl,故D为HCl,D与E反应生成F,反应②为侯德榜制碱法的主要反应原理,反应生成F与N,可推知F为NH4Cl、N为NaHCO3,故E为NH3、B为H2、A为H2、C为N2,实验室常用①反应制取气体E,L为常见的干燥剂,J常温下呈液态,可推知K为Ca(OH)2,J为H2O,L为CaCl2,结合转化关系可知,H为CaO,G为CaCO3,I为CO2,M为NaCl,
(1)HCl、NH3、Ca(OH)2,会抑制水的电离,且氨气不属于电解质,NH4Cl、NaHCO3属于电解质,溶液中铵根离子、碳酸根离子发生水解又能促进水电离,
故答案为:NH4Cl、NaHCO3;
(2)I为CO2,其电子式为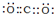 ,用电子式表示L(CaCl2)的形成过程为:
,用电子式表示L(CaCl2)的形成过程为: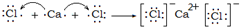 ,
,
故答案为: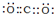 ;
;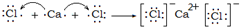 ;
;
(3)反应①的化学方程式为:2NH4Cl+Ca(OH)2
△
.
CaCl2+2NH3↑+2H2O,
过量的N与K在溶液中发生反应的离子方程式为:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-,
故答案为:2NH4Cl+Ca(OH)2
△
.
CaCl2+2NH3↑+2H2O;Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-;
(4)NH4Cl加热易分解,除去固体NaCl中混有少量NH4Cl的操作方法是加热,
故答案为:加热;
(5)反应②实验过程中应向NaCl的饱和溶液中先通入NH3 后通入CO2,
故答案为:NH3;CO2.点评:
本题考点: 无机物的推断.
考点点评: 本题考查无机物推断,涉及侯德邦制碱、实验室氨气的制备、石灰生产等,需要学生熟练掌握元素化合物性质,B在A中燃烧产生苍白色火焰及侯德邦制碱是推断突破口,难度中等.1年前查看全部
- ABCDE为1-20号元素中的五种,他们的原子数中子数不等,已知:1.A与D、B与E同族
ABCDE为1-20号元素中的五种,他们的原子数中子数不等,已知:1.A与D、B与E同族
2.B与C同周期,C与E不同周期
3.A与E的原子序数之和为28
4.0.1mol C单质与足量的E的最高价氧化物对应水化物的溶液反应生成3.36L(标准状况下)的氢气
推测 ABCDE的元素符号 庄哲1年前1
庄哲1年前1 -
 心少了一半 共回答了18个问题
心少了一半 共回答了18个问题 |采纳率94.4%A:F
B:Na
C:Al
D:Cl
E:K1年前查看全部
- 用1-20号元素符号或微粒符号填空
用1-20号元素符号或微粒符号填空
最外层电子数等于次外层电子数的元素
最外层电子数等于电子层数的元素有
最外层电子数为电子层数的两倍的元素
与氖原子具有相同电子层结构的微粒有
与氩原子具有相同电子层结构的微粒有
由两个原子核、10个电子结和成的分子是 有5个原子核、10个电子结合成的分子是 callabc1年前3
callabc1年前3 -
 pouling 共回答了21个问题
pouling 共回答了21个问题 |采纳率90.5%最外层电子数等于次外层:Be Ar
最外层电子数等于电子层数:H Be Al
最外层电子数等于电子层数的两倍:Be C S
与氖的电子层结构相同的微粒:N3- O2- F- Na+ Mg2+ Al3+
与氩的电子层结构相同的微粒:K+ Ca2+ Cl- S2-
二核十电子分子:HF
五核十电子分子:CH41年前查看全部
- 1-20号元素的常见化合价
 幽谷清泉01年前1
幽谷清泉01年前1 -
 扬子江12 共回答了13个问题
扬子江12 共回答了13个问题 |采纳率92.3%这是常见元素的化合价一价金属银钠钾,还有亚铜亚汞是一价,二价金属锌钡铜,还有钙镁亚铁汞,氟氯溴碘常显一,有时还显三五七,氢一价,氧二价,铁三铝三记住它,硫有二四和六价,氮磷三五是常规 其实化合价是有规律的 可参照元素周期表 取决于最外层电子数1年前查看全部
- 1-20号元素中,原子半径最小的是?还原性最强的单质是?H元素的气态氢化物的空间构型是?
1-20号元素中,原子半径最小的是?还原性最强的单质是?H元素的气态氢化物的空间构型是?
还有C,N,F,Na,Al,S,Cl,K,Ca中原子半径最小的是?还原性最强的是?谢谢! 支持051年前3
支持051年前3 -
 郭金昌- 共回答了18个问题
郭金昌- 共回答了18个问题 |采纳率94.4%1-20号元素中,原子半径最小的是H还原性最强的单质是Na.还有C,N,F,Na,Al,S,Cl,K,Ca中原子半径最小的是F,还原性最强的是K.1年前查看全部
- 1-20号化学元素各有哪几种价态(分条回答,并且每种价态后面写上几种代表性物质
1-20号化学元素各有哪几种价态(分条回答,并且每种价态后面写上几种代表性物质
1-20号化学元素各有哪几种价态(分条回答,并且每种价态后面写上几种代表性物质(#∩_∩#))么么哒(*^.^*) aisha60ma1年前3
aisha60ma1年前3 -
 rr-猪猪 共回答了13个问题
rr-猪猪 共回答了13个问题 |采纳率100%1年前查看全部
- 各物质位1-20号元素 C H为无色有刺激性气味气体.D是一种黄绿色气体单质.物质I可用于饮水消毒.反应2 4是化工的重
各物质位1-20号元素 C H为无色有刺激性气味气体.D是一种黄绿色气体单质.物质I可用于饮水消毒.反应2 4是化工的重要反应.(部分反应条件未列出)
1 A+H2O=B+C
2 B(高温)=E+F F+H2O=I
4 D+I=J+K+H2O
3 C+H=G
5 I+G=K+C+H2O
各物质是什么?
(A由三种元素组成)
各物质为1-20号元素组成的单质或化合物
我也觉得这题好像有点问题,如果把I何J换一下就就完美的解决了。 yyhcool1年前5
yyhcool1年前5 -
 立木新东 共回答了23个问题
立木新东 共回答了23个问题 |采纳率87%A CaCN2
B CaCO3
C NH3
D Cl2
E CO2
F CaO
G NH4Cl
H HCl
I Ca(ClO)2
J Ca(OH)2
K CaCl2
还不懂的话 给我留言1年前查看全部
- 已知1-20号元素的离子:aW2+、bX+、CY2-、dZ- 具有相同的电子层结构,下列关系正确的是( )
已知1-20号元素的离子:aW2+、bX+、CY2-、dZ- 具有相同的电子层结构,下列关系正确的是( )
A.离子半径:aW2+>bX+>dZ->CY2-
B.b=c+3
C.Z元素的非金属性比Y的强,HZ沸点一定比H2Y的高
D.上述四种元素的最高价氧化物水化物都能与Al(OH)3反应生成盐和水 lee0078291年前1
lee0078291年前1 -
 风月53 共回答了22个问题
风月53 共回答了22个问题 |采纳率90.9%解题思路:离子aW2+、bX+、cY2-、dZ-都具有相同的电子层结构,则有a-2=b-1=c+2=d+1,可知原子序数a>b>d>c,W、X同周期,Y、Z同周期,且位于W、X的上一周期,
A.电子层结构相同,核电荷数越大离子半径越小;
B.根据核外电子数相等解答;
C.Y、Z周期随原子序数增大非金属性增强,Y为O、Z为F或者Y为S、Z为Cl;
D.若W为Mg,则X为Na、Y为O、Z为F,氢氧化镁不能与氢氧化铝反应,而O、F不存在氧化物对应水化物.A.aW2+、bX+、CY2-、dZ- 具有相同的电子层结构,则原子序数a>b>d>c,电子层结构相同,核电荷数越大离子半径越小,故离子半径:aW2+<bX+<dZ-<CY2-,故A错误;
B.bX+、CY2-具有相同的电子层结构,则核外电子数相等,故b-1=c+2,即b=c+3,故B正确;
C.CY2-、dZ- 具有相同的电子层结构,则Y、Z周期,其原子序数Y<Z,Y为O、Z为F或者Y为S、Z为Cl,非金属性Z元素的非金属性比Y的强,但若Y为O、Z为F时,HF的沸点比H2O的低,故C错误;
D.若W为Mg,则X为Na、Y为O、Z为F,氢氧化镁不能与氢氧化铝反应,而O、F不存在氧化物对应水化物,故D错误,
故选B.点评:
本题考点: 原子结构与元素的性质.
考点点评: 本题考查结构与位置关系、元素周期律等,难度中等,根据电荷与核外电子排布相同推断元素在周期表中的位置是关键.1年前查看全部
- 1-20号离子结构示意图(是离子,不是原子)
 kgdtong1年前0
kgdtong1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 在原子序数为1-20号的元素中,用适当的化学符号填写下列空白(稀有气体除外):气态氢化物最稳定的是______,气态氢化
在原子序数为1-20号的元素中,用适当的化学符号填写下列空白(稀有气体除外):气态氢化物最稳定的是______,气态氢化物中含有H元素质量分数最大的氢化物是______.酸性最强的无氧酸是______,碱性最强的是______.
 林柔柔1年前1
林柔柔1年前1 -
 流星的语言 共回答了18个问题
流星的语言 共回答了18个问题 |采纳率94.4%解题思路:在短周期元素的所有原子中,同周期元素的原子从左到右原子半径逐渐减小,得电子能力逐渐增强,气态氢化物的稳定性逐渐增强,单质的氧化性逐渐增强,最高价氧化物对应水化物的碱性逐渐减弱;同主族元素原子从上到下原子半径逐渐增大,单质的氧化性逐渐减弱,最高价氧化物对应水化物的碱性逐渐增强.在短周期元素的所有原子中,同周期元素的原子从左到右原子半径逐渐减小,得电子能力逐渐增强,气态氢化物的稳定性逐渐增强,同主族元素原子从下到上原子半径逐渐减小,得电子能力逐渐增强,气态氢化物的稳定性逐渐增强,在原子序数为1-20号的元素中,F的非金属性最强,所以气态氢化物最稳定的是HF,气态氢化物中含有H元素质量分数最大的是氢碳个数比最大的,即CH4,酸性最强的无氧酸是盐酸,同周期元素的原子从左到右最高价氧化物对应水化物的碱性逐渐减弱,同主族元素原子从上到下最高价氧化物对应水化物的碱性逐渐增强,K的金属性最强,所以最强碱是氢氧化钾,故答案为:HF;CH4;HCl;KOH.
点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题是一道元素周期表结构、元素周期律知识的综合题目,要求学生具有分析和解决问题的能力,难度不大.1年前查看全部
- 写出1-20号元素形成的单质的化学式
 妍儿的守护1年前1
妍儿的守护1年前1 -
 anne_hqx666 共回答了18个问题
anne_hqx666 共回答了18个问题 |采纳率94.4%H2,He,Li,Be,B,
C,N2,O2,F2,Ne,
Na,Mg,Al,Si,P,
S,Cl2,Ar,K,Ca1年前查看全部
- ABCD四种1-20号元素,原子序数是D>A>B>C,A,B电子层数相同,C,D最外层电子数相同
ABCD四种1-20号元素,原子序数是D>A>B>C,A,B电子层数相同,C,D最外层电子数相同
A的原子结构:+x )x )4x )2x.B,C可形成离子化合物B3C2,(1)A的元素名称为----其气态氢化物为---(2)B,C最高价氧化物对应水化物的化学式分别为--------- ------- 不羁我心1年前2
不羁我心1年前2 -
 hanfeng1215 共回答了23个问题
hanfeng1215 共回答了23个问题 |采纳率95.7%首先第一层电子数为2,则x=2,A为14号元素Si
A、B电子层数相同,B为12号元素Mg 这一步是由B3C2推出B的化合价必须是2的倍数
继而C是N 这一步是因为C的化合价必须是3的倍数
C、D最外层电子数相同,则D是P
(1)硅;SiH4
(2)Mg(OH)2;HNO31年前查看全部
- 化学元素1-20号化合价以及不同化合价所对应的物质
化学元素1-20号化合价以及不同化合价所对应的物质
RT 最好都概括完全了 ldz310849171年前3
ldz310849171年前3 -
 ff杨晨 共回答了13个问题
ff杨晨 共回答了13个问题 |采纳率100%(一价氢氯钾钠银) (二价氧钙镁钡锌) 三铝四硅五价磷 二三铁、二四碳 一至五价都有氮 铜汞二价最常见 正一铜氢钾钠银 正二铜镁钙钡锌 三铝四硅四六硫 二四五氮三五磷 一五七氯二三铁 二四六七锰为正 碳有正四与正二 再把负价牢记心 负一溴碘与氟氯 负二氧硫三氮磷1年前查看全部
- 1-20号元素中形成化合物种类最多的2钟元素是什么?
 zjl70941年前2
zjl70941年前2 -
 wj_wqy198587 共回答了19个问题
wj_wqy198587 共回答了19个问题 |采纳率100%C和H1年前查看全部
- 在原子序数为1-20号的元素中,将有关物质填入下列空格:(用化学用语回答)
在原子序数为1-20号的元素中,将有关物质填入下列空格:(用化学用语回答)
(1)与水反应最剧烈的金属是______;最高价氧化物对应水化物是______.
(2)与水反应最剧烈的非金属单质是______,化学反应方程式为:______.
(3)常温下,有颜色的气体单质是______,其中,常用于环境消毒的元素的最高价氧化物对应的水化物是______.
(4)最高价氧化物对应的水化物碱性最强的是______,气态氢化物最稳定的是______.
(5)常温下,既能溶于强酸,又能溶于强碱的氧化物是______. 南一小毅1年前1
南一小毅1年前1 -
 maowenzhao 共回答了20个问题
maowenzhao 共回答了20个问题 |采纳率90%解题思路:(1)金属性越强,单质与水反应越剧烈;(2)非金属性越强,单质与水反应越剧烈;(3)常温下有颜色的气体单质是氯气;氯元素的最高价氧化物对应的水化物是高氯酸;(4)金属性越强其最高价氧化物对应水化物的碱性越强,最强的是氢氧化钾;(5)氧化铝属于两性氧化物,既能与强酸反应又能与强碱反应.(1)金属性越强,与水反应越剧烈,根据金属活动性顺序表,知道K最强,其最高价氧化物的水化物是KOH,故答案为:K;KOH;
(2)非金属性越强,单质与水反应越剧烈,F的非金属性最强,氟气与水的反应为2F2+2H2O=4HF+O2,故答案为:F2;2F2+2H2O=4HF+O2;
(3)常温下有颜色的气体单质是F2、Cl2;氯元素的最高价氧化物对应的水化物是高氯酸,故答案为:F2、Cl2;HClO4;
(4)金属性越强,最高价氧化物对应水化物的碱性越强,金属性最强的是钾,非金属性越强,气态氢化物越稳定,非金属性最强的是F,
故答案为:KOH;HF;
(5)氧化铝属于两性氧化物,既能与强酸反应又能与强碱反应,故答案为:Al2O3.点评:
本题考点: 元素周期律的作用;元素周期律和元素周期表的综合应用.
考点点评: 本题考查元素周期律,比较基础,侧重对基础知识的巩固,掌握金属性与非金属性强弱比较及实验事实.1年前查看全部
- 求1-20号原子结构图告诉我外层电子数
 liglyn1年前2
liglyn1年前2 -
 沓菊 共回答了13个问题
沓菊 共回答了13个问题 |采纳率92.3%H:1
He:2
Li:2 1
Be:2 2
B:2 3
C:2 4
N:2 5
O:2 6
F:2 7
Ne:2 8
Na:2 8 1
Mg:2 8 2
Al:2 8 3
Si:2 8 4
P:2 8 5
S:2 8 6
Cl:2 8 7
Ar:2 8 8
K:2 8 8 1
Ca:2 8 8 21年前查看全部
- 1-20号元素电子式.麻烦都写下来
 阳之颠1年前3
阳之颠1年前3 -
 ocomebaby 共回答了11个问题
ocomebaby 共回答了11个问题 |采纳率90.9%H 1He 2Li 2 1Be 2 2B 2 3C 2 4N 2 5O 2 6F 2 7Ne 2 8Na 2 8 1Mg 2 8 2Al 2 8 3Si 2 8 4P 2 8 5S 2 8 6Cl 2 8 7Ar 2 8 8K 2 8 8 1Ca 2 8 8 2这个是前20元素的电子层分布.电子式就是看 元素的最外层电子.1--20 号元素...1年前查看全部
- 含氢量最高的气态氢化物,1-20号元素中
 enca1年前1
enca1年前1 -
 这里太麻烦了 共回答了15个问题
这里太麻烦了 共回答了15个问题 |采纳率93.3%B2H6是第一个气态氢化物,硼元素原子量10,含氢量不如甲烷.那么就是CH4甲烷最高,后边元素质量大,含氢量都少.
希望对你有帮助O(∩_∩)O1年前查看全部
- 求:1-20号元素中硬度最大的单质是?怎么求的?
 asdtfqwtew1年前1
asdtfqwtew1年前1 -
 lamian007 共回答了21个问题
lamian007 共回答了21个问题 |采纳率90.5%C,金刚石的硬度最大,其主要成分为碳.1年前查看全部
- 1-20号元素(稀有气体元素除外)中:1.原子半径最小的是:2.原子半径最大的是:3.与水反应最强烈的金属单质是:___
1-20号元素(稀有气体元素除外)中:1.原子半径最小的是:2.原子半径最大的是:3.与水反应最强烈的金属单质是:___,非金属 单质是:___ 4.硬度最大的单质是:___ 5.气态氢化物的水溶液酸性最强的是:___ 6.最高价氧化物对应水化物碱性最强的是:___
 阿飞091年前1
阿飞091年前1 -
 leather162622 共回答了16个问题
leather162622 共回答了16个问题 |采纳率81.3%1) 原子半径最小的 ___H_____ ,原子半径最大的是 ______K_____
(2) 与水反应最剧烈的金属单质是 —K— ,非金属单质是 —F2— (填化学式)
(3) 既能与酸反应,又能与碱反应的金属单质是 —Al—
(4) 硬度最大的单质是—金刚石—
(5) 气态氢化物的水溶液酸性最强的是—HCl— (填化学式)
(6) 最高价氧化物对应的水化物碱性最强的是—KOH—(填化学式)1年前查看全部
- 有50名运动员排成一队报数,1-20号 35-50号退场,这时操场上有多少名运动员?
 douma1年前2
douma1年前2 -
 雨夜月影 共回答了14个问题
雨夜月影 共回答了14个问题 |采纳率92.9%34-20=141年前查看全部
- 化学问题--1-20号元素中酸性最强的化合物是什么?
化学问题--1-20号元素中酸性最强的化合物是什么?
怎样理解元素的非金属性强弱可以从起最高价氧化物的水化物的酸性强弱来判断?只表现原子,离子,金属,非金属氧化性的含义是什么?
只表现原子,离子,金属,非金属氧化性的含义是什么?
如
I- Cu S Fe 它们中那些只表现氧化性?
其判断依据又是什么?
什么样的物质只表现氧化性,什么样的物质只表现还原性? 4424416121年前5
4424416121年前5 -
 StaR1128 共回答了17个问题
StaR1128 共回答了17个问题 |采纳率82.4%1.成酸元素的最高价氧化物对应的水化物酸性越强,则元素非金属性越强;
例如:第三周期:Si,P,S,Cl 它们的最高价氧化物分别是:SiO2,P2O5,SO3和Cl2O7,则对应的酸是,H2SiO3(或H4SiO4)极弱的酸,H3PO4(中强酸),H2SO4(强酸),HClO4(最强的酸).显然酸性依次递增.
导致这个结果的原因是:随着非金属性的增强,中心原子对酸分子的羟基-OH上的氧原子的吸电子能力增强,具有很强的极化作用,从而使羟基-O-H中的氧氢键易断裂解离出H+,从而酸性大大增强.例如:S原子的非金属性强于P,因而+6的硫原子对H2SO4分子的羟基-O-H中的氧氢键“破坏作用”比P对H3PO4的严重,因而H2SO4的氧氢键更易电离出H+,从而酸性更强.
2.一般情况下,低价态表现还原性,高价态表现氧化性.
不过也有反例,次氯酸及其盐属于Cl的含氧酸盐的低价态,不过氧化性反而最强.磷酸及其盐属于磷的高价态物质,并没有显著的氧化性.
氧化剂:1.活泼非金属(F2,O3,O2,Cl2,Br2,I2,S);2.高价态物质:(KMnO4,K2MnO4,Mn2O7,K2Cr2O7,CrO3,SO3,浓H2SO4,HNO3,HClO4及其盐,KClO3,Fe3+,MnO2,Cu2+,Ag+等);3.卤素的氧化物及含氧酸盐(ClO2,Cl2O7,Cl2O,Br2O,HClO,NaClO,NaClO2,HClO3及其盐,HIO3及其盐,HIO4及其盐.等等);4.过氧化物:Na2O2,H2O2等.
还原剂:1.金属单质:K,Ca,Na,Mg,Fe,Cu等;2.低价态物质:H2SO3及其盐,Fe2+,Cl-,Br-,I-,S2-,H2S,HBr,HCl,HI,CO,CH4,NH3等.3.某些非金属:H2,P,S等1年前查看全部
- 根据元素周期表1-20号元素的性质和递变规律,请回答下列问题:
根据元素周期表1-20号元素的性质和递变规律,请回答下列问题:
(1)属于金属元素的有______种,失电子能力最强的元素是______(填元素符号);
(2)形成化合物种类最多的两种元素是______(填元素符号);
(3)第三周期中,原子半径最大的元素的单质(稀有气体除外)与氧气反应生成的所有化合物的化学式为______;
(4)推测P、O元素最简单气态氢化物的稳定性较强的是______(填化学式);
(5)第ⅢA族某元素最高价氧化物对应水化物呈两性,该水化物与烧碱溶液反应的离子方程式为______. 比率庐江1年前1
比率庐江1年前1 -
 woxindead 共回答了22个问题
woxindead 共回答了22个问题 |采纳率95.5%解题思路:(1)前20号元素中,Li、Be、Na、Mg、Al、K、Ca为金属元素,K的金属性最强;
(2)有机物的种类最多,主要组成元素为C、H;
(3)第三周期中,原子半径最大的元素的单质为Na,与氧气反应生成氧化钠、过氧化钠;
(4)非金属性越强,气态氢化物越稳定;
(5)第ⅢA族某元素最高价氧化物对应水化物呈两性,该水化物为Al(OH)3,与NaOH反应生成四羟基铝酸钠.(1)前20号元素中,Li、Be、Na、Mg、Al、K、Ca为金属元素,共7种金属元素,K的金属性最强,最容易失去电子,故答案为:7;K;
(2)有机物的种类最多,主要组成元素为C、H,故答案为:C、H;
(3)第三周期中,原子半径最大的元素的单质为Na,与氧气反应生成氧化钠、过氧化钠,其化学式分别为Na2O、Na2O2,故答案为:Na2O、Na2O2;
(4)非金属性O>P,则O的气态氢化物稳定,即H2O稳定,故答案为:H2O;
(5)第ⅢA族某元素最高价氧化物对应水化物呈两性,该水化物为Al(OH)3,与NaOH反应生成四羟基铝酸钠,该反应的离子反应为Al(OH)3+OH-=[Al(OH)4]-,
故答案为:Al(OH)3+OH-=[Al(OH)4]-.点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题考查元素周期表和元素周期律,明确元素的单质及其化合物的性质即可解答,题目难度不大,注意非金属性的比较和氢氧化铝的两性.1年前查看全部
- 根据下列五种1-20号元素的电离能数据(KJ/MOL),元素代号 I1 I2 I3 I4 X 2080 4000 610
根据下列五种1-20号元素的电离能数据(KJ/MOL),元素代号 I1 I2 I3 I4 X 2080 4000 6100 9400
Y 500 4600 6900 9500
Z 740 1500 7700 10500
M 580 1800 2700 11600
N 420 4100 6400 8900
上述元素处于同一族的是( ),电解它们熔融的最高价氧化物,阴极电极反应式为( ),若X元素原子最外层有2个P电子,则X的氢化物的化学键类型是( ),其空间构型是( ) 做_而后爱之1年前1
做_而后爱之1年前1 -
 shelpherd1973 共回答了18个问题
shelpherd1973 共回答了18个问题 |采纳率66.7%X碳 Y钠 Z镁 M铝 N钾
根据电离能的跳跃确定最外层有几个电子,然后根据得失电子规律,同一主族从上到下电离能依次递减,同一周期从左到右电离能依次递增
还要根据形成电子层的稳定性来看,铝的第一电离能小于镁是因为铝失去一个电子最外层P轨道无电子比较稳定1年前查看全部
大家在问
- 1如图所示,某同学在做“探究平面镜成像特点”的实验时,在桌子上铺好一张大白纸,然后在中间画一横线,将一块玻璃板竖直沿此直线
- 2三角形按边分类可以分为______和______.
- 3一个因数是另一个因数是2倍,积是450,这两个因数分别是多少?
- 4家庭电路中的电灯昏暗,看电表表盘转得飞快,这种现象的发生可能是( )
- 5改写同义句:But I don't play sports well.
- 6He has been a member of the club already翻译
- 7怎样判断化学反应中两种物质反不反应?
- 8下列说法正确的是( )A.比较两个物体运动快慢时,必须选择同一参考系B.由公主岭开往长春的火车于6:24分开出指的是时
- 913.25安士等于多少克?
- 10已知,如图,⊙O的直径AB与弦CD相交于点E,AE=1,BE=5,∠AEC=45°,求CD的长.
- 11Do you know what colour is the hat
- 12一射手对同一目标独立地进行4次射击,已知至少命中一次的概率为[80/81],则此射手的命中率是( )
- 13she lives life joyously and always
- 14求神人,求解.2x-3=x/2 求x,拜托袅..
- 151立方米冰等于多少公斤要精确的答案

