亚硫酸氢钾会和氢氧化钾反应吗?亚硫酸钾和氢氧化钾会反应吗?
 3821172022-10-04 11:39:543条回答
3821172022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 文心 共回答了12个问题
文心 共回答了12个问题 |采纳率91.7%- 亚硫酸氢钾可以,亚硫酸钾不可以,前者有H离子可以结合OH-
- 1年前
 200502151014 共回答了6个问题
200502151014 共回答了6个问题 |采纳率- 不会。如果是亚硫酸氢钾就可以。
- 1年前
 要快乐的猪 共回答了1个问题
要快乐的猪 共回答了1个问题 |采纳率- 不会。都是强电解质,不符合四大化学反应的条件(有沉淀,气体,水产生)
- 1年前
相关推荐
- 在数字实验中用传感器对亚硫酸钾和亚硫酸氢钾混合物样品进行测定,分别取3份不同质量的混合物样品,配成溶液,然后用相同浓度的
在数字实验中用传感器对亚硫酸钾和亚硫酸氢钾混合物样品进行测定,分别取3份不同质量的混合物样品,配成溶液,然后用相同浓度的硫酸与之恰好反应,测得如下数据
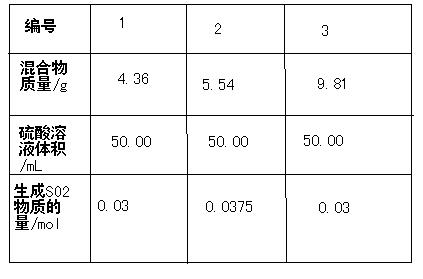
求:该混合物中K2SO3与KHSO3的物质的量之比是多少?写出计算过程 6tcgk1年前2
6tcgk1年前2 -
 hitmancl 共回答了17个问题
hitmancl 共回答了17个问题 |采纳率105.9%1年前查看全部
- 氯酸钾和亚硫酸氢钾能发生氧化还原反应:Cl五3-+HS五3-→S五4p-+Cl-+H+(未配平).已知该反应的速率随c(
氯酸钾和亚硫酸氢钾能发生氧化还原反应:Cl五3-+HS五3-→S五4p-+Cl-+H+(未配平).已知该反应的速率随c(H+)的增大而加快.下列为用Cl五3-在单位时间内物质的量浓度变化表示的该反应V-t图.下列说法口不正确的是( )
 A. 反应开始时速率增大可能是c(H+)所致
A. 反应开始时速率增大可能是c(H+)所致
B. 纵座标为V(H+)的V-t曲线与图中曲线完全重合
C. 后期反应速率下降的主要原因是反应物浓度减小
D. 图中阴影部分“面积”可以表示t1-t2时间为n(Cl-)增加 邵健明1年前1
邵健明1年前1 -
 nswlp2 共回答了15个问题
nswlp2 共回答了15个问题 |采纳率86.7%解题思路:A.由题目信息可知反应的速率随c(H+)的增大而加快;
B.先根据电子得失守恒和原子守恒配平方程式,然后根据速率之比等于化学计量数之比;
C.根据随着反应的进行,反应物的浓度减少,反应速率减小;
D.先根据电子得失守恒和原子守恒配平方程式,然后根据改变的物质的量之比等于化学计量数之比.A.由方程式:如lO小-+4SO小--SO4小-+如l-+4+可知:反应开始时随着反应的进行,如(4+)不断增大,反应的速率加快由题目信息可知反应的速率随如(4+)的增大而加快,故A正确;
B.在反应o如lO小-+4SO小--SO4小-+如l-+4+,九mol如lO小-参加氧化还原反应得到4mol电子,九mol亚硫酸氢根离子参加氧化还原反应失去小mol电子,所以得失电子的最小公倍数是4,则如lO小-的计量数是九,亚硫酸氢根离子的计量数是小,其它原子根据原子守恒来配平,所以该方程式为:如lO小-+小4SO小-=小SO4小-+如l-+小4+,v(如lO小-):v(4+)=九:小,纵坐标为v(4+)的v-t曲线与图o曲线不重合,故B错误;
如.随着反应的进行,反应物的浓度减少,反应速率减小,所以后期反应速率l降的主要原因是反应物浓度减小,故如正确;
D.在反应o如lO小-+4SO小--SO4小-+如l-+4+,九mol如lO小-参加氧化还原反应得到4mol电子,九mol亚硫酸氢根离子参加氧化还原反应失去小mol电子,所以得失电子的最小公倍数是4,则如lO小-的计量数是九,亚硫酸氢根离子的计量数是小,其它原子根据原子守恒来配平,所以该方程式为:如lO小-+小4SO小-=小SO4小-+如l-+小4+,△n(如l-):△n(如lO小-)=九:九,所以图o阴影部分“面积”可以表示t九-t小时间为n(如l-)增加,故D正确;
故选:B.点评:
本题考点: 化学反应速率与化学平衡图象的综合应用.
考点点评: 本题主要考查了外界条件对化学反应速率的有关知识,难度不大,需要注意的是要抓住题目的信息是解答A选项的关键.1年前查看全部
- 某温度下,1MOL/L的亚硫酸氢钾溶液的PH=5,则该溶液中粒子浓度关系正确的是()
某温度下,1MOL/L的亚硫酸氢钾溶液的PH=5,则该溶液中粒子浓度关系正确的是()
A.C(钾离子)+C(氢离子)=C(亚硫酸氢根)+C(氢氧根)+C(亚硫酸根)
B.C(亚硫酸氢根)+C(亚硫酸根)=1MOL/L
C.C(钾离子)>C(亚硫酸氢根)>C(亚硫酸根)>C(氢氧根)>C(氢离子)
D.C(钾离子)=C(亚硫酸)+C(亚硫酸氢根)+C(亚硫酸根)
谢谢需要解释
 w377321年前1
w377321年前1 -
 wwweeerr 共回答了18个问题
wwweeerr 共回答了18个问题 |采纳率88.9%A正确,她是电荷守恒
B加上c(氢离子)就对了,那是物料守恒
C把c(氢离子)和c(氢氧根)换一下就对了溶液酸性吗
D也是加C(氢离子)也是物料守恒,C(颊离子)等于1mol/l实际上与B等价1年前查看全部
- 酸氢钾和亚硫酸氢钾有什么区别,化学名是什么
 lllllltttttt1年前2
lllllltttttt1年前2 -
 ZOE3 共回答了22个问题
ZOE3 共回答了22个问题 |采纳率72.7%不一样 硫酸氢钾:KHSO4 亚硫酸氢钾:KHSO31年前查看全部
- 硫化氢钾,还有亚硫酸氢钾的酸碱性如何
 jllyq589211年前2
jllyq589211年前2 -
 天山老老人 共回答了18个问题
天山老老人 共回答了18个问题 |采纳率94.4%KHS碱性,NaHSO3酸性.
对于酸式盐,不可贸然认为强碱弱酸盐一定显碱性.因为同时存在电离和水解,究竟是酸性还是碱性取决于电离和水解的相对程度.对于KHS,水解程度较大,所以呈碱性;而NaHSO3电离程度较大,呈酸性.
类似的,NaH2PO4为酸性,Na2HPO4为碱性.1年前查看全部
- (2010•卢湾区二模)氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+HSO3--SO42-+Cl-+H+(未配平)
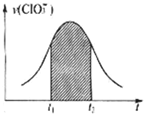 (2010•卢湾区二模)氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+HSO3--SO42-+Cl-+H+(未配平).已知该反应的速率随c(H+)的增大而加快.如图为用ClO3-在单位时间内物质的量浓度变化表示的该反应v-t图.下列说法中不正确的是( )
(2010•卢湾区二模)氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+HSO3--SO42-+Cl-+H+(未配平).已知该反应的速率随c(H+)的增大而加快.如图为用ClO3-在单位时间内物质的量浓度变化表示的该反应v-t图.下列说法中不正确的是( )
A.反应开始时速率增大可能是c(H+)所致
B.后期反应速率下降的主要原因是反应物浓度减小
C.纵坐标为v(H+)的v-t曲线与图中曲线完全重合
D.图中阴影部分“面积”可以表示t1-t2时间为n(Cl-)增加 songerYY1年前1
songerYY1年前1 -
 small_wolf 共回答了15个问题
small_wolf 共回答了15个问题 |采纳率86.7%解题思路:A.由题目信息可知反应的速率随c(H+)的增大而加快;
B.根据随着反应的进行,反应物的浓度减少,反应速率减小;
C.先根据电子得失守恒和原子守恒配平方程式,然后根据速率之比等于化学计量数之比;
D.先根据电子得失守恒和原子守恒配平方程式,然后根据改变的物质的量之比等于化学计量数之比.A.由方程式:ClO3-+HSO3--SO42-+Cl-+H+可知:反应开始时随着反应的进行,c(H+)不断增大,反应的速率加快由题目信息可知反应的速率随c(H+)的增大而加快,故A正确;
B.随着反应的进行,反应物的浓度减少,反应速率减小,所以后期反应速率下降的主要原因是反应物浓度减小,故B正确;
C.在反应中ClO3-+HSO3--SO42-+Cl-+H+,1molClO3-参加氧化还原反应得到6mol电子,1mol亚硫酸氢根离子参加氧化还原反应失去2mol电子,所以得失电子的最小公倍数是6,则ClO3-的计量数是1,亚硫酸氢根离子的计量数是3,其它原子根据原子守恒来配平,所以该方程式为:ClO3-+3HSO3-=3SO42-+Cl-+3H+,v(ClO3-):v(H+)=1:3,纵坐标为v(H+)的v-t曲线与图中曲线不重合,故C错误;
D.在反应中ClO3-+HSO3--SO42-+Cl-+H+,1molClO3-参加氧化还原反应得到6mol电子,1mol亚硫酸氢根离子参加氧化还原反应失去2mol电子,所以得失电子的最小公倍数是6,则ClO3-的计量数是1,亚硫酸氢根离子的计量数是3,其它原子根据原子守恒来配平,所以该方程式为:ClO3-+3HSO3-=3SO42-+Cl-+3H+,△n(Cl-):△n(ClO3-)=1:1,所以图中阴影部分“面积”可以表示t1-t2时间为n(Cl-)增加,故D错误;
故选:CD.点评:
本题考点: 化学反应速率的影响因素.
考点点评: 本题主要考查了外界条件对化学反应速率的有关知识,难度不大,需要注意的是要抓住题目的信息是解答A选项的关键.1年前查看全部
- 氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3—+3HSO3—===3SO42—+Cl-+3H+,已知该反应的速率随溶液
氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3—+3HSO3—===3SO42—+Cl-+3H+,已知该反应的速率随溶液酸性的增强而加快.下图为用ClO3—在单位时间内的物质的量浓度的变化来表示该反应的速率一时间图象
(1)反应开始时速录增大的原因是--------------------(2)反应后期速率逐渐减小的原因是---------------------------(3)纵坐标为v(cl-)的v-t曲线与图中曲线------(能,不能)完全重合 灯火_阑珊1年前1
灯火_阑珊1年前1 -
 banhao 共回答了18个问题
banhao 共回答了18个问题 |采纳率88.9%看信息,反应生成氢离子了,因而反应加快.后期速率减小的原因都是反应物浓度变小造成的.第三个题,看不见所以不能答了.1年前查看全部
- 氯酸钾和亚硫酸氢钾能发生氧化还原反应:Cl五3-+HS五3-→S五4p-+Cl-+H+(未配平).已知该反应的速率随c(
氯酸钾和亚硫酸氢钾能发生氧化还原反应:Cl五3-+HS五3-→S五4p-+Cl-+H+(未配平).已知该反应的速率随c(H+)的增大而加快.下列为用Cl五3-在单位时间内物质的量浓度变化表示的该反应V-t图.下列说法口不正确的是( )
 A. 反应开始时速率增大可能是c(H+)所致
A. 反应开始时速率增大可能是c(H+)所致
B. 纵座标为V(H+)的V-t曲线与图中曲线完全重合
C. 后期反应速率下降的主要原因是反应物浓度减小
D. 图中阴影部分“面积”可以表示t1-t2时间为n(Cl-)增加 weilaoda1年前1
weilaoda1年前1 -
 在黄昏等日出 共回答了20个问题
在黄昏等日出 共回答了20个问题 |采纳率80%解题思路:A.由题目信息可知反应的速率随c(H+)的增大而加快;
B.先根据电子得失守恒和原子守恒配平方程式,然后根据速率之比等于化学计量数之比;
C.根据随着反应的进行,反应物的浓度减少,反应速率减小;
D.先根据电子得失守恒和原子守恒配平方程式,然后根据改变的物质的量之比等于化学计量数之比.A.由方程式:如lO小-+4SO小--SO4小-+如l-+4+可知:反应开始时随着反应的进行,如(4+)不断增大,反应的速率加快由题目信息可知反应的速率随如(4+)的增大而加快,故A正确;
B.在反应o如lO小-+4SO小--SO4小-+如l-+4+,九mol如lO小-参加氧化还原反应得到4mol电子,九mol亚硫酸氢根离子参加氧化还原反应失去小mol电子,所以得失电子的最小公倍数是4,则如lO小-的计量数是九,亚硫酸氢根离子的计量数是小,其它原子根据原子守恒来配平,所以该方程式为:如lO小-+小4SO小-=小SO4小-+如l-+小4+,v(如lO小-):v(4+)=九:小,纵坐标为v(4+)的v-t曲线与图o曲线不重合,故B错误;
如.随着反应的进行,反应物的浓度减少,反应速率减小,所以后期反应速率l降的主要原因是反应物浓度减小,故如正确;
D.在反应o如lO小-+4SO小--SO4小-+如l-+4+,九mol如lO小-参加氧化还原反应得到4mol电子,九mol亚硫酸氢根离子参加氧化还原反应失去小mol电子,所以得失电子的最小公倍数是4,则如lO小-的计量数是九,亚硫酸氢根离子的计量数是小,其它原子根据原子守恒来配平,所以该方程式为:如lO小-+小4SO小-=小SO4小-+如l-+小4+,△n(如l-):△n(如lO小-)=九:九,所以图o阴影部分“面积”可以表示t九-t小时间为n(如l-)增加,故D正确;
故选:B.点评:
本题考点: 化学反应速率与化学平衡图象的综合应用.
考点点评: 本题主要考查了外界条件对化学反应速率的有关知识,难度不大,需要注意的是要抓住题目的信息是解答A选项的关键.1年前查看全部
- 反应环境与化学反应速率的关系反应:氯酸钾和亚硫酸氢钾反应生成-1价氯和+6价硫,为什么能使溶液中的氢离子浓度增加,并且使
反应环境与化学反应速率的关系
反应:氯酸钾和亚硫酸氢钾反应生成-1价氯和+6价硫,为什么能使溶液中的氢离子浓度增加,并且使化学反应速率加快.KClO3+3KHSO3=KCl+3KHSO4. 山东济宁人1年前2
山东济宁人1年前2 -
 悠忧 共回答了15个问题
悠忧 共回答了15个问题 |采纳率100%因为反应前 HSO3-是个弱酸跟,HSO3- ==电离可逆===SO32- +H+ 电离出来的H+很小
而反应后HSO4- 电离度大,HSO4-=电离==SO42- +H+ 电离出来的H+多
而H+ 能增加 ClO3- 的氧化性,反应速率就加快了.
通常含氧酸根的氧化性都是H+浓度越大氧化性越强,因为这样有利于含氧酸根脱去O和H+形成稳定的物质水.1年前查看全部
大家在问
- 1请使用含有修辞手法的句子回答下列问题 小明、小刚、小红、小方四位同学在上学的路上发现路边的墙上多了
- 2在等腰三角形中,一腰上的中线把周长分为15cm和6cm的两部分,求这个三角形各边的长
- 3已知数列{an}满足a1=1,a(n+1)=pan+q,且a2=3,a4=15,求出p,q的值.详解过程,谢谢!
- 4英语翻译摘要本工程为六层砖混结构住宅楼,总高度为19.8m.基础形式为混凝土条形基础,楼板、梁采用钢筋混凝土现浇板,板、
- 5描写物品,事物与地方的形容词
- 6英语翻译上课认真听课;按时完成任务;上学不准迟到;不准在课堂上睡觉;不准在校园骑车;不准吸烟;
- 7要使周长为20cm的扇形的面积达到最大值,则扇形的圆心角θ的大小应为弧度---------
- 8所谓“泾渭分明”,是泾水河清还是渭水河清?
- 9白水做泉日日昌这句话是什么意思?
- 10三年级一班借了28本书,二班借了33本书,三班借的书比一班和二班的总数少25本.三班借书多少本?
- 11下图表示人体组织细胞的新陈代谢与部分器官系统间的关系,其中A---E表示相关的器官系统,a、b、c、d表示相关的物质,请
- 123()3()3()3=8 在扩号内填上适当运算符号使算式等号两边相等.
- 131、病毒、细菌和真菌都属于微生物,它们都没有成形的细胞核.
- 14他正在游泳,用英语怎么写
- 15涪字可以组词

