在恒温恒容的状态下,体系的压强和体系中的各种气体的物质的量有什么关系?
 ciczlm2022-10-04 11:39:541条回答
ciczlm2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 顶顶就上去 共回答了18个问题
顶顶就上去 共回答了18个问题 |采纳率94.4%- 由pv=nRT,恒温恒容的状态下,体系的压强和体系中的各种气体的物质的量成正比
- 1年前
相关推荐
- 比如N2+3H2=2NH3在恒温恒容一开始投料2molN2 6molH2反应平衡后再恒温恒压下再投一样的料平衡移动不移动
比如N2+3H2=2NH3在恒温恒容一开始投料2molN2 6molH2反应平衡后再恒温恒压下再投一样的料平衡移动不移动
答案给的不移动,我一直觉得是正向移动,恒温恒压下虽然压强不变通入反应气体不影响移动但是反应物物质的量浓度增大了,我总觉得应该是正想移动吧 拿铁的鬼魂1年前3
拿铁的鬼魂1年前3 -
 胭脂马 共回答了13个问题
胭脂马 共回答了13个问题 |采纳率76.9%不移动,反应物得浓度不会增大,再次投料时,容器体积会增大,因为要保持恒压,也就说容器体积会增大一倍,因此浓度不变.相当于在另个等同的容器中分别加入2 mol N2和6molH2,待反应平衡时,将两个容器合并到一起.二者互不影响.因此反应平衡不移动,如果将已知条件改成恒温恒容,则平衡正向移动.1年前查看全部
- 如何使反应前后气体体积数不变的可逆反应的平衡移动(在恒温恒容下)
如何使反应前后气体体积数不变的可逆反应的平衡移动(在恒温恒容下)
书上说改变反应物浓度是没用的,但我认为v正〉v逆,不就要移动了吗.加压不移动我是知道的,但是如果我就提高反应物的浓度为什么不移动呢
 liyidao9991年前1
liyidao9991年前1 -
 getloud 共回答了24个问题
getloud 共回答了24个问题 |采纳率87.5%用模型假设法可知1年前查看全部
- 2so3+o2可逆so3 恒温恒容增加生成物反应向正方向移动,但是根据勒夏特列原理增加生成物反应
2so3+o2可逆so3 恒温恒容增加生成物反应向正方向移动,但是根据勒夏特列原理增加生成物反应
2so3+o2可逆so3 恒温恒容增加生成物反应向正方向移动,但是根据勒夏特列原理增加生成物反应想着着阻碍这种改变方向进行,那么它应该向正. 妍向日葵1年前1
妍向日葵1年前1 -
 xman513 共回答了18个问题
xman513 共回答了18个问题 |采纳率94.4%因为生成物只有一种气体,所以最终的结果是平衡正向移动,SO3达到平衡时比原平衡中的体积分数增加了.平衡移动是逆向移动(过程).1年前查看全部
- 化学平衡中恒温恒容充入稀有气体,为什么不会发生平衡移动呢.压强不是变了吗?解析说浓度没变,所以平衡不改变.但是根据勒夏特
化学平衡中恒温恒容充入稀有气体,为什么不会发生平衡移动呢.压强不是变了吗?解析说浓度没变,所以平衡不改变.但是根据勒夏特列原理,当改变一个条件(如压强),其他条件不变时,其平衡总是向体积缩小的方向移动.为什么,
 152322711年前4
152322711年前4 -
 huajin17 共回答了13个问题
huajin17 共回答了13个问题 |采纳率92.3%你需要根据最基本的理论来看,勒夏特里原理说的压强是指反应物和产物的总压强,而不包括其他气体,其他气体的压强与他无关,通过反应,它也不能改变其他气体的压强;
这里从原理上,就是单位体积有效活化分子数还是没变,所以正逆反应速率不会变,平衡不会移动;1年前查看全部
- 同一反应在恒温恒压和恒温恒容两种情况下,反应物的转化率如何变化?
 说些么子1年前1
说些么子1年前1 -
 枯井不波 共回答了14个问题
枯井不波 共回答了14个问题 |采纳率92.9%只讨论气态的 压强对非气态的无影响 分三种情况讨论 反应物的系数大 小 等于生成物的系数 恒压对大于有促进作用 因为随着反应的进行 气体会减少 恒压就相等于加压 如合成氨 要在高压下进行 小于反之 等于无影响 实例是碘与氢气合成氢碘酸1年前查看全部
- 在恒温恒压密闭容器M(如图Ⅰ)和恒温恒容密闭容器N(如图Ⅱ)中,分别加入a molA和a molB,
在恒温恒压密闭容器M(如图Ⅰ)和恒温恒容密闭容器N(如图Ⅱ)中,分别加入a molA和a molB,起始时两容器体积均为VL,发生如下反应并达到化学平衡状态:2A(?)+B(?)⇌xC(g)△H<0,平衡时M中A、B、C的物质的量之比为1:3:4.下列判断不正确的是( )
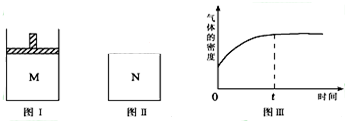
A.x=2
B.若N中气体的密度如图Ⅲ所示,则A、B只有一种是气态
C.A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D.若A、B均为气体,平衡时M中A的转化率小于N中A的转化率 招工1年前1
招工1年前1 -
 xroucadsm1038 共回答了18个问题
xroucadsm1038 共回答了18个问题 |采纳率83.3%解题思路:A.根据起始量和平衡时M中A、B、C的物质的量之比为1:3:4,用三段式法进行计算;
B.由图三可知:随着反应的进行,气体密度增大,N是体积不变的容器,可知正反应气体质量增加,则反应物中至少有一种不是气体;
C.当B为非气体时,反应前后气体体积不变,这时M容器与N容器内反应达到平衡等效;
D.若A、B均为气体,正反应为气体体积减小的反应,则M容器相当于N容器中的反应达到平衡后再加压,平衡要向正反应方向移动.A.2A(?)+B(?)═xC(g)△H<0
起始量(mol) a a 0
变化量(mol) 2Y Y xY
平衡量(mol) a-2Y a-Y xY
根据题意可知(a-2Y):( a-Y):xY=1:3:4,解得x=2,a=2.5Y,故A正确;
B.由图三可知随着反应的进行,气体密度增大,生成物C是气体,N是体积不变的容器,根据ρ=[m/V],V不变,若要ρ增大,则气体混合物质量m应该增大,因此反应物中至少有一种不是气体,又因为初始状态气体密度不是0,则A、B一定有一种是气体,所以A、B只有一种是气体,故B正确;
C.当B为非气体时,反应为气体体积不变的可逆反应,这时M容器与N容器内反应达到平衡等效,由于起始加入的反应物的量相等,故平衡时生成物的量相等,故C正确;
D.若A、B均为气体,这时正反应为气体体积减小的反应,则M容器相当于N容器中的反应达到平衡后再加压,平衡要向正反应方向移动,A的转化率将增大,即M中A的转化率则大于N中A的转化率,故D错误;
故选D.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查可逆反应平衡状态的判断和计算以及外界条件对平衡状态的影响,试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生的逻辑推理能力和抽象思维能力,提高学生灵活运用基础知识解决实际问题的能力,题目难度中等.1年前查看全部
- (1)在恒温恒容的密闭容器中,充入物质的量之比为1:4的N2 和H2,一定时间后达到平衡时,测得N2和H2的物
(1)在恒温恒容的密闭容器中,充入物质的量之比为1:4的N2 和H2,一定时间后达到平衡时,测得N2和H2的物质的量之比为1:5.计算平衡混合气体中NH3的体积分数及N2的转化率.
(2)在恒温、恒压和使用催化剂的条件下,已知:在容积可变的密闭容器中,充入含3molH2和1molN2混合气体,反应达平衡时有a molNH3生成,N2的转化率为b%.若仍在恒温、恒压和使用催化剂的条件下,在体积可变的密闭容器中充入x molH2和y molN2,反应达平衡时有3a molNH3生成,N2的转化率仍为b%.则x=______,y=______. sunlingjun1年前1
sunlingjun1年前1 -
 乖乖柔儿 共回答了25个问题
乖乖柔儿 共回答了25个问题 |采纳率96%解题思路:(1)设出氮气、氢气的物质的量n、4n及氨气的转化率x,根据达到平衡时N2和H2的物质的量之比为1:5,计算出混合气体中NH3的体积分数及N2的转化率;
(2)压强不变,气体的物质的量不影响平衡,充入含3molH2和1molN2混合气体,反应达平衡时有a molNH3生成,N2的转化率为b%;若平衡时有3a molNH3生成,N2的转化率仍为b%,则充入氮气3mol,氢气是氮气的3倍,即9mol.(1)设氮气、氢气的物质的量为n、4n,达到平衡时氮气的质量为x,
N2 (g)+3H2(g)⇌2NH3(g)
1 3
n•x3nx
根据N2和H2的物质的量之比为1:5,列式为:(n-nx):(4n-3nx)=1:5,
解得:x=50%,
反应消耗了0.5nmol氮气,则生成了2×0.5nmol=nmol,
氨气的体积分数为:[n/n−0.5n+4n−3×0.5n+n]×100%=25%,
答:氨气的体积分数为25%,氮气的转化率为50%;
(2)在恒温恒压条件下,1molN2与3molH2的混合气体通入一个容积可变的容器中发生反应,达平衡后,生成a molNH3,
则只通入N2与H2,达平衡时生成3amolNH3,则开始时应通入N23mol,且平衡时NH3 的质量分数与前者相同,
及极限转化后起始的量与原起始量成正比,故H2的物质的量为3mol×3=9mol,
故答案为:9;3.点评:
本题考点: 化学平衡的计算.
考点点评: 本题较难,考查化学平衡中等效平衡的计算,明确温度与压强不变时,起始反应物的量成正比则平衡等效是解答本题的关键.1年前查看全部
- 下列说法能说明反应P(s)+2Q(g)=S(g)+R(g)在恒温恒容的密闭容器中已达平衡的是
下列说法能说明反应P(s)+2Q(g)=S(g)+R(g)在恒温恒容的密闭容器中已达平衡的是
选项之一容器内气体压强密度不随时间变化对么?
选项之一是 容器内气体压强、密度不随时间变化对么? chen8012201年前2
chen8012201年前2 -
 赖寒 共回答了13个问题
赖寒 共回答了13个问题 |采纳率92.3%不对 因为反应前后气体分子数都是2 即物质的量相等 即体积相等 所以压强始终没改变
能判断达到平衡的是:Vp(正)=Vs(逆) 或 容器中各物质的量不再改变 若是有颜色的气体 则颜色不再改变1年前查看全部
- 对于化学平衡中的恒温恒压与恒温恒容为什么会带来不同的结果?
对于化学平衡中的恒温恒压与恒温恒容为什么会带来不同的结果?
比如说这个问题:
(1)要恒温恒压条件下,同等倍数增加平衡时各物质的浓度,对化学平衡无影响.
(2)恒温恒容条件下,同等倍数增加平衡时各物质的浓度,对反应前后气体体积有变化的反应有影响. tominy1年前1
tominy1年前1 -
 Davstand 共回答了17个问题
Davstand 共回答了17个问题 |采纳率94.1%恒温恒压时体系体积可变 而恒容时体积不可变
恒温恒容时增加各物质的浓度会导致体系压强增大 反应向气体体积减小的方向移动
而恒温恒压条件下,同等倍数增加平衡时各物质的浓度时 体系体积也增大相同倍数 故对化学平衡无影响1年前查看全部
- 在恒温恒容的密闭容器中,对可逆反应2SO 2 (g)+O 2 (g) 2SO 3 (g),下列判断不正确的是 A.达到化
在恒温恒容的密闭容器中,对可逆反应2SO 2 (g)+O 2 (g)
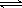 2SO 3 (g),下列判断不正确的是
2SO 3 (g),下列判断不正确的是A.达到化学平衡时,2 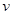 正 (O 2 )=
正 (O 2 )=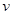 逆 (SO 3 )
逆 (SO 3 )B.若单位时间内生成x molSO 3 的同时消耗x mol SO 2 ,则反应达到平衡状态 C.达到化学平衡时,容器中气体压强不再变化 D.达到化学平衡时,容器中混合气体的平均相对分子质量不再变化  qdsxxxxx11年前1
qdsxxxxx11年前1 -
 妩媚的脸 共回答了18个问题
妩媚的脸 共回答了18个问题 |采纳率83.3%B
平衡时正逆反应速率相等,各种物质的浓度或含量均不再发生变化,所以A正确。恒温恒容时,压强随气体的物质的量增加而增大。混合气体的平均相对分子质量是混合气的质量和混合气的总物质的量的比值,反应前后质量是不变,但反应前后气体体积是变化的,所以选项C和D均是正确的。选项B中的反应速率方向是相同的,在任何情况下生成x molSO 3 的同时消耗x mol SO 2 是横成立的,所以选项B是错误的。答案选B。1年前查看全部
- 在恒温恒容的密闭容器中,通入x mol N2和y mol H2发生如下反应:N2
在恒温恒容的密闭容器中,通入x mol N2和y mol H2发生如下反应:N2+3H2
 2NH3,,平衡后,测得反应放出的热量为18.4kJ,混合气体总的物质的量为3.6mol,容器内的压强变为原来的90%.又知N2和H2的转化率相同.
2NH3,,平衡后,测得反应放出的热量为18.4kJ,混合气体总的物质的量为3.6mol,容器内的压强变为原来的90%.又知N2和H2的转化率相同.
(1)通过计算说明起始充入N2和H2的物质的量分别为:x=______,y=______.平衡后NH3的体积分数[1/9][1/9]
(2)写出该反应的热化学方程式______.
(3)如果把上述反应在恒温恒压的条件下反应放出的热量应该______18.4kJ(填大于、小于或等于).
(4)若起始加入N2、H2和NH3的物质的量分别为a mol、b mol、c mol,达平衡时各物质的含量与上述平衡完全相同.
①若c=2,在相同的条件下达平衡时,该反应吸收的热量为______kJ.
②若维持反应向正反应方向进行,则起始时c的取值范围为______. 8195201年前1
8195201年前1 -
 风飘离 共回答了23个问题
风飘离 共回答了23个问题 |采纳率91.3%解题思路:(1)化学反应前后,气体的压强之比等于物质的量之比;
(2)热化学方程式中反应的各物质系数之比等于物质的量之比;
(3)反应是一个气体体积减小的反应,随着反应的进行,体系的压强越来越小;
(4)反应放热或吸热的多少与参与反应的物质的量的多少有关,采用归边相等的方法来分析是确定范围的一个方法.(1)假设氮气和氢气的转化率为α,
N2+3H2 2NH3,
2NH3,
各物质的起始物质的量x y 0
变化的物质的量 xα yα
平衡时的物质的量 x-xα y-yα
则生成的氨气的物质的量为2xα=[2yα/3],所以y=3x,化学反应前后,气体的压强之比等于物质的量之比,所以[3.6mol
(x+y)mol=0.9,即 x+y=4,故x=1,y=3,
并且(x-xα)+(y-yα)+2xα=3.6mol,即α=20%,平衡后NH3的体积分数=
2×20%×1mol/3.6mol]×100%=[1/9],故答案为:1;3;[1/9];
(2)反应后的物质的量为3.6 mol,因压强为原来的90%,故原气体的物质的量为4 mol,应加入H23 mol,气体的物质的量由4 mol减少到平衡时的3.6 mol,由差量法求得产生
0.4 mol NH3,由此推知产生2 mol NH3放出热量92 kJ,故答案为:N2(g)+3H2(g)⇌2NH3(g);△H=-92 kJ/mol;
(3)反应是一个气体体积减小的反应,随着反应的进行,体系的压强越来越小,如果上述反应在恒温恒压的条件下进行,可以看成是相当于把原平衡增大了压强,则平衡向正向进行,所以放热更多,故答案为:大于;
(4)此为恒容条件下反应前后化学计量数不等的平衡问题,应采用归边相等的方法来分析:因达到平衡时c为0.4 mol,若要反应向正方向进行,c应小于0.4,故0≤c<0.4,若c=2 mol,a=0,b=0,反应逆向进行达到平衡时亦剩余0.4 mol,反应掉1.6 mol,故放[1.6mol/2mol]×92 kJ•mol-1×[1/2]=73.6 kJ,故答案为:73.6;0≤c<0.4.点评:
本题考点: 热化学方程式;有关反应热的计算;化学平衡的计算.
考点点评: 本题是一道有关热化学知识的综合题,难度较大,考查学生分析和解决问题的能力.1年前查看全部
- 向恒温恒容(2L)的密闭容器中充入2molSO2和一定量的O2,发生反应2SO2+O2=2SO2,进行到4min后达到平
向恒温恒容(2L)的密闭容器中充入2molSO2和一定量的O2,发生反应2SO2+O2=2SO2,进行到4min后达到平衡,这时C(SO2)=0.2molL,且二氧化硫和氧气转化率相等,在向容器中冲入1molSO3,达到心平衡,为什么二氧化硫和氧气物质的量的比为二比一?
 爱你没有永远1年前2
爱你没有永远1年前2 -
 钓鱼台7块钱一包 共回答了27个问题
钓鱼台7块钱一包 共回答了27个问题 |采纳率92.6%2SO2 + O2= 2SO3
开始(mol/L) 1.0 x 0
转化(mol/L) 0.8 0.4 0.8
平衡(mol/L) 0.2 x-0.4 0.8
因为二氧化硫和氧气转化率相等,而SO2的转化率为(0.8/1.0)=80%.所以O2的转化率为(0.4/x)=80%.解方程0.4/x=80%,解得X=0.5mol/L.但由于容器的体积为2L,所以O2的物质的量为1mol.因此SO2:O2=2:11年前查看全部
- 化学中有关可逆反应中恒温恒容和恒温恒压有什么不同?
化学中有关可逆反应中恒温恒容和恒温恒压有什么不同?
如题所示 像转化率 平衡移动和等效平衡中这两个因素有什么不同影响 最好列出具体例子 如果还有别的问题的异同涉及这两个因素也请列出来 如果说得好 我会追分的 我有120分 但不要把百科上的复制过来
二楼的大哥阿 你说的那些不同是学过初中的都能从字面上理解 fenylt1年前1
fenylt1年前1 -
 miaomiao8392 共回答了12个问题
miaomiao8392 共回答了12个问题 |采纳率91.7%类别 恒温恒容 恒温恒压
相同点:温度一定
不同点:体积一定,压强可能改变 压强一定,体积可能改变
对平衡的影响:
CO +H2O(g) = CO2 + H2 压强改变,平衡不移动 体积改变,平衡不移动(因为△=0)
N2 + 3 H2 = 2NH3 加压,平衡向右移动,转化率增加 体积增加,平衡向左移动,转化率降低
(因为该反应△>0)
△是指气体反应物前面的系数之和 减去 气体生成物前面系数之和,如△>0是指1+3—2>01年前查看全部
- 在恒温恒容的容器中发生2NO2(g)===N2O4(g)达到平衡时,再向容器中通入NO2重新达到平衡后,与第一次相比
在恒温恒容的容器中发生2NO2(g)===N2O4(g)达到平衡时,再向容器中通入NO2重新达到平衡后,与第一次相比
NO2的体积分数怎么样?
如果说勒沙特列原理不能逆转一种改变,浓度增大后平衡时NO2的体积分数怎么会变小呢?还有书上说向平衡体系中充入某种气态反应物要考虑浓度增大的影响而不考虑浓度增大带来的压强增大的影响? MELON2951年前1
MELON2951年前1 -
 新伤痕 共回答了8个问题
新伤痕 共回答了8个问题 |采纳率87.5%看到你有这种疑惑 我并不奇怪 因为我的学生很多都有这种疑惑 我也解答过很多次
其实 勒夏特列原理也有他不能够解决的问题 现在才高二 抽时间可以阅读一下《勒沙特列诞生150周年想到的》 但是这个原理对大多数的平衡都是试用的
这个题的解答 NO2 体积分数减小了
需要考虑压强
以下我给你讲的是高中应考知识 用等效平衡去解答
给你举个例子 恒温恒容的容器 设体积 V L 取两个编号A 与 B外界条件全部一样
往A中加入 1 mol 的 NO2 反应平衡的时候 设NO2的体积分数是 x %
再往B中加 1 mol 的NO2 这个B容器平衡的时候是不是NO体积分数仍然是x%
现在将两个容器 合成一个2V 的 容器 是不是这个时候的 NO2体积分数仍然应该是 V L NO2仍然是 x %
要是到这里没有疑惑的话就好办
现在将这个 2 V 的容器压缩成一个 体积是V L的容器 根据勒夏特列原理 是不是平衡会向 N2O4移动 所以 NO2分数会减小 小于 x %
以上这个过程是不是和 往一个已经加入1 molNO2的 V L容器平衡后再加1 mol的NO2是不是应该等效的
所以分数减小
其实等效平衡学习之后 无论你怎么加NO2都可以用某一种方法去等效 结果都减小 (这儿考虑了压强的因素)1年前查看全部
- 在恒温恒容的密闭容器中,有可逆反应2NO(g)+O 2 (g)⇌2NO 2 (g).下列不能说明该反应已达到化学平衡状态
在恒温恒容的密闭容器中,有可逆反应2NO(g)+O 2 (g)⇌2NO 2 (g).下列不能说明该反应已达到化学平衡状态的是( ) A.反应容器中压强不随时间变化而变化 B.混合气体颜色保持不变 C.混合气体的密度保持不变 D.各物质的物质的量浓度保持不变  天哪天高云淡1年前1
天哪天高云淡1年前1 -
 pc_ziyan 共回答了17个问题
pc_ziyan 共回答了17个问题 |采纳率82.4%A、反应前后气体的化学计量数之和不相等,当达到平衡时,气体的压强不变,故A不符合;
B、混合气体中二氧化氮是红棕色气体,四氧化二氮是无色气体,颜色变化,浓度改变,混合气体颜色保持不变;说明反应达到平衡,故B不符合;
C、反应前后气体质量守恒,容器体积不变,密度不变,不能说明反应达到平衡,故C符合;
D、各物质的物质的量浓度保持不变说明反应达到平衡,故D不符合;
故选C.1年前查看全部
- 为什么可逆反应中恒温恒压等效平衡是物质的量按计量数成倍增减而恒温恒容是正逆相反平衡时绝对量相同?
 保尔11年前1
保尔11年前1 -
 lenger 共回答了10个问题
lenger 共回答了10个问题 |采纳率90%如果恒温恒压,则容器体积正比于气体体积,等效平衡是物质的量按系数成倍增减.
如果恒温恒容,先设置中间态,将容器体积扩大使得压强不变.然后再缩减容器体积至原体积.此时要看反应前后气体体积是否变化来判断.1年前查看全部
- 在恒温恒容的密闭容器中,发生反应3A(g)+B(g) xC(g)。
在恒温恒容的密闭容器中,发生反应3A(g)+B(g)  xC(g)。
xC(g)。
Ⅰ、将3molA和2molB在一定条件下反应,达平衡时C的体积分数为a;
Ⅱ、若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。
下列说法正确的是[ ]A.若Ⅰ达平衡时,A、B、C各增加1mol,则B的转化率将一定增大
B.若向Ⅰ平衡体系中再加入3molA和2molB,C的体积分数若大于a,可断定x>4
C.若x=2,则Ⅱ体系起始物质的量应当满足3n(B) =n(A)+3
D.若Ⅱ体系起始物质的量当满足3n(C) +8n(A)==12 n(B)时,可判断x=4 mtiyu1年前1
mtiyu1年前1 -
 特区性情中人 共回答了18个问题
特区性情中人 共回答了18个问题 |采纳率88.9%CD1年前查看全部
- 在恒温恒容的密闭容器里发生可逆反应:2A(气)+B(气)<===> 2C(气)……答案选B,为什么?
在恒温恒容的密闭容器里发生可逆反应:2A(气)+B(气)<===> 2C(气)……答案选B,为什么?
在恒温恒容的密闭容器里发生可逆反应:2A(气)+B(气) <===>2C(气).容器内开始加入下列各组物质,达到平衡时逆反应速率最小的是( )
A.2 mol A和1 mol Bx05x05B.1 mol A和1 mol B
C.1 mol A和2 mol Bx05x05D.1 mol B和1 mol C 缠禅知易1年前2
缠禅知易1年前2 -
 piscesor 共回答了18个问题
piscesor 共回答了18个问题 |采纳率100%果断B
相同条件下,气体反应速率只和气体的分压有关(或者说物质的量浓度有关),而B中气体C的物质的量最少,分压最小,那么答案不就显然了嘛······1年前查看全部
- 判断化学平衡的标志 为什么分了 等体反应和非等体反应?这两部分里又分了 恒温恒压 和恒温恒容?这些因素和化学平衡有什么关
判断化学平衡的标志 为什么分了 等体反应和非等体反应?这两部分里又分了 恒温恒压 和恒温恒容?这些因素和化学平衡有什么关系?
麻烦您都说清楚一点 何岂哉1年前1
何岂哉1年前1 -
 lovelypig 共回答了17个问题
lovelypig 共回答了17个问题 |采纳率82.4%克拉伯龙方程式Pv=nRT(P代表压强 V代表体积 N代表物质的量 R代表一个常数 T代表绝对温度)
恒温恒压时T和P不变 R为常数 当V变大 则N变大 浓度变大 平衡移动
恒温恒容时T和V不变 R为常数 当P变大 则N变大 浓度变大 平衡移动
还有 增大P有很多途径 要仔细考虑1年前查看全部
- 体积不变反应的化学等效平衡无论是恒温恒容还是恒温恒压,只要极值等比即等效,因为压强改变对该类反应的化学平衡没影响.但是,
体积不变反应的化学等效平衡
无论是恒温恒容还是恒温恒压,只要极值等比即等效,因为压强改变对该类反应的化学平衡没影响.
但是,当恒温恒容时,如果反应物比例恒定,但第二次加的反应物物质的量为第一次加的两倍,这样的话,反应物的浓度不是较大吗,这样平衡不就向正方向移动了?为什么呢. 开关门1年前4
开关门1年前4 -
 lizhuan999 共回答了21个问题
lizhuan999 共回答了21个问题 |采纳率90.5%LZ不是这样了解的.压强不一定对化学平衡没影响.
我们这样理解,比如你现在有一个罐子塞满甲乙两种东西,但是你再强行的塞入一些甲进去,那会不会比较难放进去.
所以我们这样说,在恒温恒容的情况下,加入反应物进去并不是增加它的浓度,而是压强,也就是说,不管加多少反应物或者生成物下去,平衡会一直向压强地的方向进行,比如2NO2↔N2O2这个化学平衡,不管我们加入多少的NO2或者N2O2,反应都是向正方向移动的.
化学平衡是很难学的.希望LZ努力,如果有什么不明白可以找我,我懂的,就尽量帮你.1年前查看全部
- 在恒温恒容的密闭容器中,有可逆反应2NO(g)+O2(g)⇌2NO2(g).下列不能说明该反应已达到化学平衡状态的是(
在恒温恒容的密闭容器中,有可逆反应2NO(g)+O2(g)⇌2NO2(g).下列不能说明该反应已达到化学平衡状态的是( )
A.正反应生成NO2的速率和逆反应生成O2的速率相等
B.反应容器中压强不随时间变化而变化
C.混合气体颜色深浅保持不变
D.混合气体平均相对分子质量保持不变 天父1年前1
天父1年前1 -
 jzg517 共回答了21个问题
jzg517 共回答了21个问题 |采纳率90.5%解题思路:反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,可由此进行判断.A.正反应生成NO2的速率和逆反应生成O2的速率等于2:1时,反应达到平衡状态,故A错误;
B.反应前后气体的化学计量数之和不相等,当达到平衡时,气体的压强不变,故B正确;
C.当反应达到平衡状态时,二氧化氮的浓度不变,则混合气体颜色深浅不变,故C正确;
D.反应前后气体的化学计量数之和不相等,当达到平衡时,气体的物质的量不变,则混合气体的平均摩尔质量不再改变,故D正确;
故选A.点评:
本题考点: 化学平衡状态的判断.
考点点评: 本题考查了化学平衡状态的判断,难度不大,注意反应前后气体颜色变化,浓度不变来判断是否达到平衡状态.1年前查看全部
- 恒温恒压,2HI=H2+I2,平衡后充入HI,平衡向哪里移动?恒温恒容?
恒温恒压,2HI=H2+I2,平衡后充入HI,平衡向哪里移动?恒温恒容?
先听我说说我的想法.我认为都是向右移.因为恒温恒压下,充入HI虽然结果是等效平衡,但是如果不移动,刚充入时HI的体积分数要比H2和I2大得多,还不得移完以后才等效么?我上网查了一下,一堆人说是不移.
我已经不是初学者.我是高三同学.我觉得你们说的“最终不移动”是指等效平衡.如果考试出来,加HI移动吗?你说HI能不移吗?怎么想它都要移,最终建立等效平衡达到相同状态.我刚查了《化学平衡移动条件》一节,有一句话说“增加反应物浓度,平衡向正反应方向移动.”好了,明天去问老师. 4444221年前1
4444221年前1 -
 hugo米兰V 共回答了19个问题
hugo米兰V 共回答了19个问题 |采纳率78.9%你的想法其实代表一大部分初学者的看法.你可以分开看嘛,把已达平衡和未达平衡的碘化氢分开,已达平衡的平衡不移动,未达平衡的平衡肯定要移动,最终因为是和前面已达平衡的条件相同,因此未达平衡的部分也将移动到前面已达平衡的相同程度,最终看来平衡不移1年前查看全部
- 在恒温恒容的密闭容器中,对于可逆反应A(g)+B(g)⇌2C(g),可以判断达到化学平衡状态的是( )
在恒温恒容的密闭容器中,对于可逆反应A(g)+B(g)⇌2C(g),可以判断达到化学平衡状态的是( )
A. 体系压强不变
B. 单位时间消耗n molA,同时生成2nmolC
C. A的转化率不变
D. 容器内气体密度不变 mxj751年前1
mxj751年前1 -
 黄金vvvv 共回答了12个问题
黄金vvvv 共回答了12个问题 |采纳率100%解题思路:反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,可由此进行判断.A、该反应是一个反应前后气体体积不变的化学反应,无论该反应是否达到平衡状态,容器中气体压强始终不变,故A错误;
B、单位时间消耗n molA,同时生成2nmolC只能表明反应正向进行,不能证明正逆反应速率相等,故B错误;
C、A的转化率不变说明A的浓度不随时间的变化而变化,达到平衡状态,故C正确;
D、反应后气体的总质量不变,容器的体积不变,无论该反应是否达到平衡状态,容器内气体密度始终不变,故D错误.
故选C.点评:
本题考点: 化学平衡状态的判断.
考点点评: 本题考查平衡状态的判断,对于反应前后气体的计量数之和不相等的可逆反应来说,可从浓度、温度、颜色、压强、百分含量等角度判断是否达到平衡状态,注意反应前后气体体积不变的化学反应不能用压强来判断是否达到平衡状态.1年前查看全部
- 在恒温恒容的密闭容器里发生可逆反应:2A(g)+B(g)⇌2C(g).容器内开始加入下列各组物质,达到平衡时逆反应速率最
在恒温恒容的密闭容器里发生可逆反应:2A(g)+B(g)⇌2C(g).容器内开始加入下列各组物质,达到平衡时逆反应速率最小的是( )
A. 2molA和1molB
B. 1molA和1molB
C. 1molA和2molB
D. 1molB和1molC ssll1年前1
ssll1年前1 -
 冷冰冰597 共回答了16个问题
冷冰冰597 共回答了16个问题 |采纳率87.5%解题思路:恒温恒容的密闭容器,由pV=nRT可知,物质的量越多,压强越大,反应速率越大,所以达到平衡逆反应速率就大,以此来解答.恒温恒容的密闭容器,由pV=nRT可知,物质的量越多,压强越大,正逆反应速率越大,
A、C中反应物的物质的量为3mol,
B中反应物的物质的量为2mol,
D中极限转化为反应物时反应物的物质的量为2.5mol,
显然B中物质的量最少,压强最小,则达到平衡时逆反应速率最小,
故选B.点评:
本题考点: 化学反应速率和化学计量数的关系.
考点点评: 本题考查反应速率与压强的关系,注意选项D中极限转化为反应物,明确物质的量大压强大,反应速率大即可解答,题目难度不大.1年前查看全部
- 在恒温恒压密闭容器M(如图Ⅰ)和恒温恒容密闭容器N(如图Ⅱ)中,两容器中均加入a molA和a molB,起始时两容器体
在恒温恒压密闭容器M(如图Ⅰ)和恒温恒容密闭容器N(如图Ⅱ)中,两容器中均加入a molA和a molB,起始时两容器体积均为VL,发生如下反应并达到化学平衡状态:2A(?)+ B(?)
 xC(g) ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断不正确的是()
xC(g) ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断不正确的是()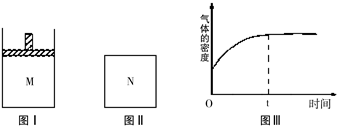
A.x=2
B.若N中气体的密度如图Ⅲ所示,则A、B只有一种是气态
C.A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D.若A、B均为气体,平衡时M中A的转化率小于N中A的转化率 最喜欢阳春三月1年前1
最喜欢阳春三月1年前1 -
 b3836 共回答了13个问题
b3836 共回答了13个问题 |采纳率92.3%D
1年前查看全部
- 在可逆反应2SO2+O2⇌2SO3的平衡状态,保持恒温恒容向容器中加入一定量的O2,下列说法正确的是 (K为平
在可逆反应2SO2+O2⇌2SO3的平衡状态,保持恒温恒容向容器中加入一定量的O2,下列说法正确的是 (K为平衡常数)( )
A. 平衡右移,K不变,SO2转化率增大
B. 平衡右移,K变大,O2转化率减小
C. 平衡右移,K不变,O2转化率增大
D. 平衡右移,K变大,O2转化率增大 shooting_star_101年前1
shooting_star_101年前1 -
 青燕子2004 共回答了20个问题
青燕子2004 共回答了20个问题 |采纳率80%解题思路:恒温恒容向容器中加入一定量的O2,平衡向右移动,促进二氧化硫的转化,但温度不变,K不变,以此来解答.恒温恒容向容器中加入一定量的O2,平衡向右移动,促进二氧化硫的转化,SO2转化率增大,O2转化率减小,
但温度不变,K不变,
故选:A.点评:
本题考点: 化学平衡的影响因素;化学平衡常数的含义.
考点点评: 本题考查影响化学平衡的因素,把握浓度导致的平衡移动为解答本题的关键,注意平衡常数K只与温度有关,题目难度不大.1年前查看全部
- 在恒温恒容的密闭容器中,发生反应3A(g)+B(g)⇌xC(g).
在恒温恒容的密闭容器中,发生反应3A(g)+B(g)⇌xC(g).
Ⅰ、将3molA和2molB在一定条件下反应,达平衡时C的体积分数为a;
Ⅱ、若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a.下列说法正确的是( )
A. 若Ⅰ达平衡时,A、B、C各增加1mol,则B的转化率将一定增大
B. 若向Ⅰ平衡体系中再加入3molA和2molB,C的体积分数若大于a,可断定x>4
C. 若x=2,则Ⅱ体系起始物质的量应当满足3n(B)=n(A)+3
D. 若Ⅱ体系起始物质的量当满足3n(C)+8n(A)═12n(B)时,可判断x=4 九个敌人1年前1
九个敌人1年前1 -
 jiakang2 共回答了18个问题
jiakang2 共回答了18个问题 |采纳率88.9%解题思路:在恒温恒容的密闭容器中,将3molA和2molB在一定条件下反应,达平衡时C的体积分数为a,若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a,二者应为等效平衡,应存在n(A)+[3/x]n(C)=3,n(B)+[1/x]n(C)=2,以此解答该题.A.由于x值不确定,则若Ⅰ达平衡时,A、B、C各增加1mol,B的转化率不能确定,故A错误;
B.因容器体积不变,若x=4时,C的体积分数应为a,现大于a,x应小于4,促进平衡正向移动,故B错误;
C.由恒温恒容时,当n(A)、n(B)、n(C)为起始物质的量,平衡时n(C)的体积分数仍为a,n(A)+[3/x]n(C)=3,n(B)+[1/x]n(C)=2,若x=2,二者联式可得3n(B)=n(A)+3,故C正确;
D.由恒温恒容时,当n(A)、n(B)、n(C)为起始物质的量,平衡时n(C)的体积分数仍为a,n(A)+[3/x]n(C)=3,n(B)+[1/x]n(C)=2,若x=4,二者联式可得3n(C)+8n(A)═12n(B),故D正确.
故选CD.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡的计算,题目难度较大,注意从等效平衡的角度解答该题,易错点为A,注意x不确定,A、B、C各增加1mol,B的转化率可能增加,也可能不变.1年前查看全部
- 在恒温恒容的密闭容器中,对于可逆反应A(g)+B(g) 2C(g),可以判断达到化学平衡状态的是 [
在恒温恒容的密闭容器中,对于可逆反应A(g)+B(g)
 2C(g),可以判断达到化学平衡状态的是
2C(g),可以判断达到化学平衡状态的是 [ ]
A. 体系压强不变
B. 单位时间消耗n molA,同时生成2nmolC
C. A的转化率不变
D. 容器内气体密度不变 ebinwan1年前1
ebinwan1年前1 -
 东方红花 共回答了26个问题
东方红花 共回答了26个问题 |采纳率80.8%C1年前查看全部
- 在恒温恒容的容器中进行反应2A B,若反应物的浓度由0.1mol/L降到0.06mol/L需要20s,那么由0.06mo
在恒温恒容的容器中进行反应2A
 B,若反应物的浓度由0.1mol/L降到0.06mol/L需要20s,那么由0.06mol/L降到0.036mol/L所需反应时间应( )
B,若反应物的浓度由0.1mol/L降到0.06mol/L需要20s,那么由0.06mol/L降到0.036mol/L所需反应时间应( )A.等于10s B.等于12s C.大于12s D.小于12s  martin8204021年前1
martin8204021年前1 -
 左耳朝东 共回答了19个问题
左耳朝东 共回答了19个问题 |采纳率89.5%C
1年前查看全部
- 在恒温恒容的情况下2NO2(g)=N2O4(g)往反应内加入NO2,问NO2的体积分数如何改变为什么
在恒温恒容的情况下2NO2(g)=N2O4(g)往反应内加入NO2,问NO2的体积分数如何改变为什么
加入反应物平衡应该正向进行,但是如果正向压强减小,反应又逆向进行,那NO2的体积分数怎么判断?并且有因素加入NO2,这样刚开始他NO2的体积分数是增大的?要减少又不太现实.
小弟再次献丑,希望明白的各位大哥大姐能帮我解答迷惑 很想活得自私点1年前1
很想活得自私点1年前1 -
 鲤凝 共回答了25个问题
鲤凝 共回答了25个问题 |采纳率72%刚加入时候是增大的,加入之后容器内压力增大,反应正向加速进行,大量的NO2转变成N2O4平衡后NO2的体积减小1年前查看全部
- 对于aA+bB=cC+dD的反应,只增加其中一种反应物的浓度,(两种反应物都增加呢?)在恒温恒容和恒温恒压下平衡分别向那
对于aA+bB=cC+dD的反应,只增加其中一种反应物的浓度,(两种反应物都增加呢?)在恒温恒容和恒温恒压下平衡分别向那方移动?依据是什么?这两种条件(恒温恒容和恒温恒压)有什么区别?
 风儿fe1年前1
风儿fe1年前1 -
 他的珍妮 共回答了24个问题
他的珍妮 共回答了24个问题 |采纳率91.7%如果都是气体 且 a+b=c+d
恒温恒容 增加其中一种反应物的浓度 反应向逆方向移动
恒温恒压 增加其中一种反应物的浓度 反应向逆方向移动
如果都是气体 且 a+b>c+d
恒温恒容 增加其中一种反应物的浓度 反应向逆方向移动
恒温恒压 增加其中一种反应物的浓度 反应向逆方向移动
如果都是气体 且 a+b<c+d
恒温恒容 增加其中一种反应物的浓度 反应向逆方向移动
恒温恒压 增加其中一种反应物的浓度 反应向逆方向移动
至于 恒容 恒压 的区别只在于 恒容增大体积方应向体积减小的方向移动(就是系数相加较小的方向)
恒压增大体积方应不移动
这是根据夏列特勒原理 推倒的1年前查看全部
- 在恒温恒容的密闭容器中发生可逆反应2NO2(g)=2NO(g)+O2(g)
在恒温恒容的密闭容器中发生可逆反应2NO2(g)=2NO(g)+O2(g)
在恒温恒容的密闭容器中发生可逆反应2NO2(g)=(可逆)2NO(g)+O2(g).下列不能说明该反应已达到化学平衡状态的是
A.NO2的分解速率和NO2的生成速率相等
B.混合气体颜色深浅保持不变
C.反应容器中压强不随时间变化而变化
D.NO2的分解速率和NO的生成速率相等
选什么, 红叶漫天舞1年前1
红叶漫天舞1年前1 -
 tianya109 共回答了20个问题
tianya109 共回答了20个问题 |采纳率80%A对,分解速率就是正反应的,生成速率是逆反应的,正逆相等达到平衡
B对,由于只有NO2有色,且体积恒定,当颜色不变时说明NO2浓度不变,因此平衡
C对,恒容下压强跟分子数有关,由于前后体积不等,压强不变说明分子数不变,因此平衡
D错,因为反应1分子NO2就会生成1分子NO,因此不管什么时候NO2的分解和NO的生成都是等的1年前查看全部
- 化学平衡时恒温恒容和恒温恒压的解题方法
 天雷教的oo1年前1
天雷教的oo1年前1 -
 冰蛋糕 共回答了22个问题
冰蛋糕 共回答了22个问题 |采纳率86.4%所以等效平衡也是一种思维分析方式和解题方法.这种方法往往用在相似平衡的计算在恒温、恒压下,改变起始时加入物质的物质的量,只要按化学方程式系数比换算1年前查看全部
- 1mol的氢气与1mol的氮气分别在恒温恒压、恒温恒容的容器中发生可逆反应,哪个转化率高呢?
 一个永远心痛的人1年前2
一个永远心痛的人1年前2 -
 lkoooqqe311 共回答了22个问题
lkoooqqe311 共回答了22个问题 |采纳率95.5%恒温恒压.反应生成氨气体积是减小的,若是恒容相当于压强减小,不利于向氨气的转化1年前查看全部
- 恒温恒压和恒温恒容状态下充入惰性气体平衡移动吗?
 xueqi4081年前2
xueqi4081年前2 -
 三亚机票 共回答了16个问题
三亚机票 共回答了16个问题 |采纳率93.8%恒容不移动,假加压.恒压移动,相当于减压,向气曾方向移动.1年前查看全部
- 化学平衡中恒温恒容充入稀有气体,为什么不会发生平衡移动呢.老师说是浓度没变,但是我认为压强改变了
化学平衡中恒温恒容充入稀有气体,为什么不会发生平衡移动呢.老师说是浓度没变,但是我认为压强改变了
例如N2+3H2=2NH3
如果恒温恒容的条件下充入稀有气体,那很明显压强会增大,平衡向右移动呀
难道说这里的压强影响不大吗. 自然的自然1年前1
自然的自然1年前1 -
 ㄒoㄒ 共回答了12个问题
ㄒoㄒ 共回答了12个问题 |采纳率100%浓度不变
这个压力增大就是稀有气体的压力呀1年前查看全部
- A+B=C (ABC都是气体) 恒温恒容条件下 充入1摩尔A 和 1摩尔B 达平衡时,C的体积分数为40% 若在密闭容器
A+B=C (ABC都是气体) 恒温恒容条件下 充入1摩尔A 和 1摩尔B 达平衡时,C的体积分数为40% 若在密闭容器中
A+B=C ( ABC都是气体)
恒温恒容条件下 充入1摩尔A 和 1摩尔B
达平衡时,C的体积分数为40%
若充入2摩尔A 和 2摩尔B 则反应达平衡时 C的体积分数为_______ 容器的容积为__________
题中给的原容器的容积为V升, 霈霈_Sk1年前1
霈霈_Sk1年前1 -
 yiyi_yi 共回答了21个问题
yiyi_yi 共回答了21个问题 |采纳率90.5%40%
容器的容积不可知1年前查看全部
- 在恒温恒容的容器中进行反应,N2(g)+3H2(g)可逆生成2NH3(g),若氮气浓度由0.1mol/L降到0.06mo
在恒温恒容的容器中进行反应,N2(g)+3H2(g)可逆生成2NH3(g),若氮气浓度由0.1mol/L降到0.06mol/L需2s,那么由0.06mol/L降到0.024mol/L需要的反应时间为
A.等于1.8s B.等于1.2s C.大于1.8s D小于1.8s 爱你就hh你1年前4
爱你就hh你1年前4 -
 田野里滴麦子 共回答了21个问题
田野里滴麦子 共回答了21个问题 |采纳率95.2%0.1mol/L降到0.06mol/L需2s,说明降0.02mol/L需1s
0.06mol/L - 0.024mol/L = 0.036mol/L 若匀速降则需1.8S,但是随着反应的进行,浓度越来越低,所以速率越来越慢,就大于1.8s1年前查看全部
- 恒温恒容中的容指的是什么?恒温恒容与就等于恒温恒体积吗?容与体积是什么关系?
 昨夜东风之小楼1年前1
昨夜东风之小楼1年前1 -
 领距离 共回答了21个问题
领距离 共回答了21个问题 |采纳率90.5%容是指盛装气体的容器的体积,故恒温恒容即是恒温恒体积,容跟气体体积相等.我们无机化学课本上就是这个意思.1年前查看全部
- 当反应都是气体参加反应并且反应前后计量系数没有变化的时候,恒温恒容成倍的增大反应物的量,从浓度的角度考虑增大反应物的浓度
当反应都是气体参加反应并且反应前后计量系数没有变化的时候,恒温恒容成倍的增大反应物的量,从浓度的角度考虑增大反应物的浓度,平衡要右移,从压强考虑浓度增大压强增大,因为计量数不变平衡不移动 怎么会矛盾呢 怎么思考?
急 怎么会出现矛盾的答案呢?
例如:恒温恒容 1mol H2 和 1molI2反应达平衡后,向反应容器中再加2moH2 和2mol I2在同样的条件下建立新的平衡 实际为等效平衡,从浓度看应该右移但从压强看由于该反应是计量数相同的反应平衡不移动 不就矛盾了吗 这个怎么解释哈 玫瑰红酒滋味1年前1
玫瑰红酒滋味1年前1 -
 亲密ee 共回答了17个问题
亲密ee 共回答了17个问题 |采纳率100%考虑浓度时反应物浓度增大生成物的浓度也增加了一倍所以平衡不动1年前查看全部
- 恒温恒压于恒温恒容的等效平衡恒温恒容条件下 加入3mol氨气所达的平衡后氨的体积分数为m 为什么恒温恒压条件下加入的氨气
恒温恒压于恒温恒容的等效平衡
恒温恒容条件下 加入3mol氨气所达的平衡后氨的体积分数为m 为什么恒温恒压条件下加入的氨气只要大于0mol达平衡后氨的体积分数还是m 恒容条件下的反应进行时压强应该是在增大氨的体积分数应该比恒容条件下的大阿 loll00941年前1
loll00941年前1 -
 sdzbbslh 共回答了23个问题
sdzbbslh 共回答了23个问题 |采纳率100%既然题中堤到恒容那么压强就是不改变的,怎么能增大呢?1年前查看全部
- 勒夏特列原理真的对么?恒温恒容的容器内发生反应,2NO2=N2O4达到平衡时再向容器内通入一定量N2O4,平衡将如何移动
勒夏特列原理真的对么?
恒温恒容的容器内发生反应,2NO2=N2O4达到平衡时再向容器内通入一定量N2O4,平衡将如何移动?
通入N2O4,体系中压强变大,反应朝正,
但是N2O4的浓度也增大了,反应朝逆.
那平衡到底怎么移动?
难道这是勒夏特列原理的BUG? 快快滚远点1年前3
快快滚远点1年前3 -
 快乐人518 共回答了17个问题
快乐人518 共回答了17个问题 |采纳率82.4%体系的压强是增大了,但是对于二氧化氮而言它的分压却没有增大啊,加入的四氧化二氮会部分转化为二氧化氮,只是转化率比原体系的小而已.1年前查看全部
- 恒温恒容通入惰性气体压强改变吗
 20077101年前1
20077101年前1 -
 勇于32 共回答了16个问题
勇于32 共回答了16个问题 |采纳率93.8%当然改变了,但对于参与反应的气体,因为体系体积没有改变,故浓度不变 ,不会导致平衡的移动.1年前查看全部
- 等效平衡,急@!恒温恒压等效平衡新平衡中各组分浓度与原平衡是否相等,为什么?恒温恒容呢?
 liuxianqin1年前1
liuxianqin1年前1 -
 maxiaolin110 共回答了17个问题
maxiaolin110 共回答了17个问题 |采纳率88.2%在前后系数之和不等的情况下
前者
不一定相等
但是,比利时一定相等的
后者浓度必然相等
Hi上详解1年前查看全部
- 恒温恒容加入无关气体压强怎么变
 江川mm1年前1
江川mm1年前1 -
 xjw13223 共回答了18个问题
xjw13223 共回答了18个问题 |采纳率100%气体增多,压强增大,平衡不移动.1年前查看全部
- 在可逆反应2SO2+O2⇌2SO3的平衡状态,保持恒温恒容向容器中加入一定量的O2,下列说法正确的是 (K为平
在可逆反应2SO2+O2⇌2SO3的平衡状态,保持恒温恒容向容器中加入一定量的O2,下列说法正确的是 (K为平衡常数)( )
A.平衡右移,K不变,SO2转化率增大
B.平衡右移,K变大,O2转化率减小
C.平衡右移,K不变,O2转化率增大
D.平衡右移,K变大,O2转化率增大 无由雨1年前1
无由雨1年前1 -
 aurafrank 共回答了19个问题
aurafrank 共回答了19个问题 |采纳率94.7%解题思路:恒温恒容向容器中加入一定量的O2,平衡向右移动,促进二氧化硫的转化,但温度不变,K不变,以此来解答.恒温恒容向容器中加入一定量的O2,平衡向右移动,促进二氧化硫的转化,SO2转化率增大,O2转化率减小,
但温度不变,K不变,
故选:A.点评:
本题考点: 化学平衡的影响因素;化学平衡常数的含义.
考点点评: 本题考查影响化学平衡的因素,把握浓度导致的平衡移动为解答本题的关键,注意平衡常数K只与温度有关,题目难度不大.1年前查看全部
- 下列说法能说明反应P(g)+Q(g)⇌S(g)+R(g)在恒温恒容的密闭容器中已达到平衡的是
下列说法能说明反应P(g)+Q(g)⇌S(g)+R(g)在恒温恒容的密闭容器中已达到平衡的是
A.容器里P/Q/R/S四种物质共存 B.容器里Q、R的体积分数不再变化 C.容器内气体压强、密度不随时间变化 【B是对的 C为什么不对呢?我知道这里压强是不能决定是否达到平衡的 那密度呢】 zhengyangjun11年前1
zhengyangjun11年前1 -
 别怕我哭 共回答了10个问题
别怕我哭 共回答了10个问题 |采纳率100%气体无论多少,都是充满整个容器的.容器的体积即为气体的体积.
关注到密度的公式!
密度=m(气体)/V(容器) 分子不变(质量守恒),分母不变(题目说的,恒容)
密度始终不变.
判断平衡状态的量一定是从变化到不再变化的!而密度是恒量,一直未变.1年前查看全部
- 对于恒温恒容的容器,改变起始时加入物质的物质的量,通过可逆反应的化学计量数换算成方程式同一边的物质的物质的量与原平横时相
对于恒温恒容的容器,改变起始时加入物质的物质的量,通过可逆反应的化学计量数换算成方程式同一边的物质的物质的量与原平横时相同,则两平衡等效
请问怎么换算?
比如对于这个反应:2SO2+O2=2SO3,设各物质初始的物质的量为A.B.C
为什么AC,AB满足的关系是a+c=2 2b+c=2?
原题:在一定温度下,把2molSO2和1molO2通入一个一定容积的密闭容器里,发生如下反应:2SO2+O2 2SO3,当此反应进行到一定程度时,反应混合物就处于化学平衡状态。现在该容器中,维持温度不变,令a.b.c分别代表初始加入的SO2,O2和SO3的物质的量(mol)。如果a.b.c取不同的数值,他们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的百分含量仍跟上述平衡时的完全相同。请填写下列空白:
(1)若a=0,则C=______。
(2)若a=0.5则b=_______,c=_______。
(3)a、b、c必须满足的一般条件是(请用两个方程式表示,其中一个只含a和c,另一个只含b和c:______ ID间测了么1年前4
ID间测了么1年前4 -
 arimawj 共回答了21个问题
arimawj 共回答了21个问题 |采纳率90.5%1、意思是起始时不管各物质的量怎么变化(可以三个都有,可以只有某两个或者只有其中一个),反应达到平衡的时候各物质的浓度时相同的.就叫等效平衡.就像从不同的地方都可以到北京一样,过程和轨迹不同,但最后结果都是到了北京.
2、做等效平衡的题目的时候,你先将化学变化看做不可逆反应,将题目中的物质都,变成同一物质,看要是不同的反应形式的物质多少是相同的那么他们就是等效平衡.
3、如上面的题,我不知道为什么!是不是你没有把题目说清楚?
(1)若a=0,则C=2----.
(2)若a=0.5则b=------0.25,c=------1.5.
(3)a、b、c必须满足的一般条件是(请用两个方程式表示,其中一个只含a和c,另一个只含b和c:a+c=2 2b+c=21年前查看全部
- 有关化学反应计算的一道小题,急在恒温恒容容器中进行反应A(g)可逆号2B(g)+C(g),若A的浓度由0.1mol/L降
有关化学反应计算的一道小题,急
在恒温恒容容器中进行反应A(g)可逆号2B(g)+C(g),若A的浓度由0.1mol/L降到0.06mol/L需20s,那么由0.06mol/L降到0.024mol/L,需要的时间( )
A.等于18秒
B.等于12秒
C.大于18秒
D.小于18秒 聚散皆缘JSJY1年前2
聚散皆缘JSJY1年前2 -
 艺萌 共回答了25个问题
艺萌 共回答了25个问题 |采纳率80%假设反应是匀速进行的,当A的浓度由0.1mol/L降到0.06mol/L需20s,那么由0.06mol/L降到0.024mol/L则需要18s;而实际上随着反应的进行,物质的A浓度越来越小,所以正反应的速率越来越慢,所以实际需要的时间表大于18s.1年前查看全部
大家在问
- 1邹的左边偏旁念什么?
- 2新华超市每千克牛肉44元,比鸭蛋价格的4倍还多4元,每千克鸭蛋多少元?(用方程解)
- 3天空出现的彩虹,可以说明太阳光是一种什么而成的?
- 4有关液体表面的压强?在液体内部有对容器壁或者液体中物体的液体压强P=pgh,但是在液体与气体接触的表面层呢?如果仍用此公
- 5一个土字旁,右边一个亏是什么字
- 6一个月字旁一个亏读什么
- 7酸雨中加入自来水,pH值怎样变化 原因是什么 (用化学方程式表示)
- 8我变胖了 解方程一根铁丝围成一个长为100厘米,宽为30厘米的长方形,那么这根铁丝可以为围成边长多少厘米的正方形?可以围
- 9燃烧热的定义
- 10燃烧热的准确定义?
- 11王字旁加一个泰字念什么
- 12凡卡 课文那是没有月亮的夜晚,可是整个村子——白房顶啦,烟囱里冒着浓霜一身银白的树木啦,雪堆啦,全看得见.天空撒满了快活
- 13氯化钠是通过阴、阳离子的静电作用形成的化合物,因此氯化钠带有一定量的电荷
- 14盐酸滴定氢氧化钾酚酞做指示剂是什么颜色
- 15小明骑车从甲地到乙地,去时每小时行六千米,回来时每小时行九千米,往返共用五小时,小明往返共走了几千米
