离子交换膜电解槽的问题在离子交换膜电解槽中,为什么要在阴极通入含少量NaOH的水?通入的少量NaOH有什么作用?
 wzy_eagle2022-10-04 11:39:541条回答
wzy_eagle2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 xiaoxiao85 共回答了18个问题
xiaoxiao85 共回答了18个问题 |采纳率100%- 开始时通入的氢氧化钠就是为了增强电解液的导电性,使电解反应快速进行.
- 1年前
相关推荐
- 下列装置工作时实现化学能转化为电能的是 A.干电池 B.光伏电池 C.离子交换膜电解槽 D.风力发电机
 微笑夏天261年前1
微笑夏天261年前1 -
 添鑫 共回答了18个问题
添鑫 共回答了18个问题 |采纳率88.9%A
1年前查看全部
- (2010•江苏二模)食盐不仅是生活必需品,也是生产氯气和烧碱的重要原料.下图1是工业电解饱和食盐水的离子交换膜电解槽示
(2010•江苏二模)食盐不仅是生活必需品,也是生产氯气和烧碱的重要原料.下图1是工业电解饱和食盐水的离子交换膜电解槽示意图.
(1)B处出口产生的物质是______;C处进口的物质是______.
(2)______离子被阳离子交换膜阻止进入阳极区,原因是______.
(3)如图2所示,20℃时在混合溶液中,随着氢氧化钠含量的变化,氯化钠达到饱和状态时其溶质质量分数的变化曲线.
已知曲线上A、B、C、D四个点的坐标分别为:A(0,26.5);B(14.0,15.0);C(18.8,11.7);D(38.0,2.0).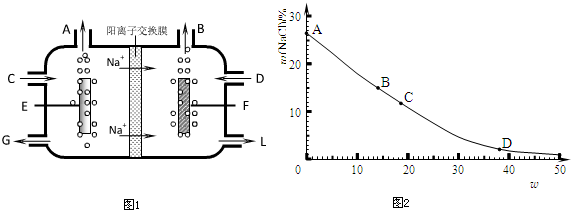
①20℃时,氯化钠在水中的溶解度为______g.
②D点处氢氧化钠的物质的量浓度约为多大?(已知D点处溶液的密度约为1.4g•mL-1,计算结果保留两位有效数字)______
③若现有20℃时,满足曲线上B点指标的溶液,可用______方法尽可能地降低氯化钠的含量,达到提纯氢氧化钠的目的. Audora1年前1
Audora1年前1 -
 小小的羽衣333 共回答了17个问题
小小的羽衣333 共回答了17个问题 |采纳率100%解题思路:(1)工业电解饱和食盐水,依据图装置分析,钠离子移向F极,说明F为阴极,E电极为阳极析出的是氯气,F电极析出的是氢气;
(2)F电极生成氢气破坏了水的电离生成氢氧根离子,离子交换膜阻止氢氧根离子进入阳极区是防止氢氧根离子在阳极私定终身生成氧气;
(3)①曲线的含义为:氯化钠在氢氧化钠溶液中的溶解能力随氢氧化钠溶液质量分数的增大而减小;
计算20℃时氯化钠在水中的溶解度,根据溶解度与饱和溶液溶质质量分数的关系,可利用20℃时氯化钠在水中的饱和溶液的溶质质量分数求得;
②曲线上D(38.0,2.0)点表示:混合溶液中氢氧化钠含量为38.0%时,混合溶液中氯化钠达饱和状态其溶质质量分数为2.0%.换言之,若此时溶液质量为100g,其中含38.0g氢氧化钠时溶解氯化钠2.0g达到饱和.依据质量分数和物质的量浓度的换算计算得到;
③曲线上B(14.0,15.0)点表示:混合溶液中氢氧化钠含量为14.0%时,混合溶液中氯化钠达饱和状态其溶质质量分数为15.0%.为降低氯化钠的含量(质量分数),根据曲线的含义可知,蒸发水分使混合溶液中氢氧化钠质量分数增大,氯化钠溶解能力减小而析出.(1)工业电解饱和食盐水,依据图装置分析,钠离子移向F极,说明F为阴极,E电极为阳极析出的是氯气,F电极析出的是氢气;故答案为:氢气;饱和食盐水;
(2)F电极生成氢气破坏了水的电离生成氢氧根离子,阳离子交换膜阻止氢氧根离子进入阳极区失电子生成氧气,混入氯气中;
故答案为:氢氧根; 避免氧气生成;
(3)①由曲线上A(0,26.5)点坐标可得,20℃时氯化钠在水中的饱和溶液的溶质质量为26.5%,此时氯化钠的溶解度为:
20℃氯化钠在水中溶解度=[26.5/100−26.5]×100g≈36.1g;
故答:36.1;
②曲线上D(38.0,2.0)点表示:混合溶液中氢氧化钠含量为38.0%时,混合溶液中氯化钠达饱和状态其溶质质量分数为2.0%.换言之,若此时溶液质量为100g,其中含38.0g氢氧化钠时溶解氯化钠2.0g达到饱和.混合溶液中氢氧化钠含量为38.0%时的物质的量浓度c=
1000cm3/L×1.4g/cm3×38.0%
40g/mol=13mol/L;
故答案为:13;
③使B点的溶液尽可能地降低氯化钠的含量,根据曲线含义,只要使氢氧化钠的含量增大氯化钠的溶解能力就减小,氯化钠结晶析出,剩余溶液则为较纯净的氢氧化钠溶液.可采取蒸发水分浓缩溶液增大氢氧化钠的含量,结晶出氯化钠.
故答案:蒸发结晶.点评:
本题考点: 电解原理.
考点点评: 本题考查了电解原理的工业应用,产物判断方法,电解分析应用,图象分析方法,溶解度的计算和溶液浓度的换算分析应用,题目难度中等.1年前查看全部
- (2014•重庆)工业上采用离子交换膜电解槽电解饱和食盐水,可以得到高浓度的烧碱溶液(含NaOH 35%~48%).某学
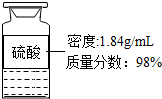 (2014•重庆)工业上采用离子交换膜电解槽电解饱和食盐水,可以得到高浓度的烧碱溶液(含NaOH 35%~48%).某学习小组为了验证附近氯碱化工厂产生的NaOH溶液是否达到高浓度标准,进行了如下操作,请你参与计算:
(2014•重庆)工业上采用离子交换膜电解槽电解饱和食盐水,可以得到高浓度的烧碱溶液(含NaOH 35%~48%).某学习小组为了验证附近氯碱化工厂产生的NaOH溶液是否达到高浓度标准,进行了如下操作,请你参与计算:
(1)到工厂采集了电解槽中的NaOH溶液100g.NaOH中氧元素的质量分数是______.
(2)在实验室用如图所示浓硫酸配制200g24.5%的稀硫酸,计算所取浓硫酸的体积(计算结果取整数).
(3)进行中和测定,向采集到的溶液中逐滴加入所配制的稀硫酸,并不断测定溶液的pH值,当pH=7时,消耗稀硫酸160g.通过计算判断此时电解槽中NaOH溶液是否达到高浓度标准. 穿水而过1年前0
穿水而过1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
大家在问
- 1硝酸钠为什么不能被稀硝酸溶解在碳酸钠溶液中滴加硝酸银溶液后产生了白色沉淀 再滴加稀硝酸后观察到:除了有气泡产生 还有不能
- 2实验 制作一个简易显微镜(1)选用的凸透镜的放大倍数:_________________________________
- 3exonuclease-activity是什么意思
- 4(2006•静安区模拟)现有一个E=1.5V的电池和一个满偏电流为1mA、内电阻为100Ω的电流表,及导线若干,要想把它
- 5A*B=C,当B一定时,A和C成( )比例
- 6小红同学在探究“串联并联电路中的电流的规律”时做了如下实验:
- 7Would you be ___ to show me the way to the station?A.good en
- 8[Co(NH3)6]3+ [Ni(NH3)6]2+ [Fe(Co)5]中心离子的杂化方式 并指出他们的几何构型,
- 9因为a^2-2a-3=a^2-2a+1-4=(a-1)^2-4,而(a-1)^2≥0,所以(a-1)^2-4≥-4,即a
- 10中国人民的抗日战争,从局部抗战开始到最后取得胜利经历了14年的时间。在此期间,抗日民族统一战线为抗战的胜利做出了重大贡献
- 11看电影时,因为电影幕布发生______反射,所以各个方向的观众都能看到画面;如图,看话剧时,演员穿白色上衣、红色裙子,若
- 12一个圆锥体的体积是9.42立方厘米,再增加( )立方厘米就能做成一个与它等底等高的圆柱体.
- 13如图,为处理含有某种杂质的污水,要制造一底宽为2米的无盖长方体沉淀箱,污水从A孔流入,经沉淀后从B孔流出.设箱体的长度为
- 14下列哪项不是人体呼吸道的功能( ) A.保证气体顺利通过 B.温暧、湿润、清洁人体吸入的空气 C.气体振动发出声音 D
- 15这本书的故事情节吸引了我改为双重否定句
