★先看大题图:1)质子数与中子数不相等的核素有__________________;互称同位素的核素有_________
 雪花美人2022-10-04 11:39:541条回答
雪花美人2022-10-04 11:39:541条回答
1)质子数与中子数不相等的核素有__________________;互称同位素的核素有___________________.
中子数相等的不同元素的原子是_________________.
2)现有10.0g由
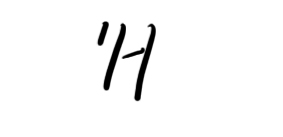
和

组成的水分子的物质的量为________;其中含质子数为________NA;中子数为_______________个.
3)由

和

构成的CO2摩尔质量为______________.标准状况下9.2g这种CO2所占有的体积约为_______________.

已提交,审核后显示!提交回复
共1条回复
 Shabl 共回答了19个问题
Shabl 共回答了19个问题 |采纳率84.2%- h1 c14 o18;hi&h2;o16&o18
0.2,2,2na
50,0.184*22.4 - 1年前
相关推荐
- 高中化学微粒相同质子数和电子数问题
高中化学微粒相同质子数和电子数问题
只有图片一张
最好解析一下

 将心放逐1年前1
将心放逐1年前1 -
 RRAPEME 共回答了17个问题
RRAPEME 共回答了17个问题 |采纳率94.1%A,质子数分别是10,10,11,电子书分别是10,10,10
B,质子数分别是9,9,10,电子书分别是10,10,10
C,质子数分别是11,11,11,电子书分别是10,10,10
D,质子数分别是8,9,11,电子书分别是10,10,101年前查看全部
- 某原子的质子数为26,中子数比质子数多4,则该原子中粒子总数为______.
 颠机1年前3
颠机1年前3 -
 我是你的圈圈 共回答了19个问题
我是你的圈圈 共回答了19个问题 |采纳率100%解题思路:依据原子中质子数等于电子数结合原子的内部结构分析解答即可;由于原子中质子数等于电子数,所以该原子核外的电子数为26,而中子数比质子数多4,所以中子数为26+4=30,则该原子中粒子总数为质子数+中子数+电子数=26+30+26=82;
故答案为:82点评:
本题考点: 原子的有关数量计算.
考点点评: 主要考查了原子的结构中质子,中子,电子之间的关系.掌握原子的核内质子数和核外电子数相等是解题的关键.1年前查看全部
- H(只标明了质子数为1,没有标明质量数)和D互称为同位素,
H(只标明了质子数为1,没有标明质量数)和D互称为同位素,
H(只标明了质子数为1,没有标明质量数)是核素对吗? 尹姬1年前1
尹姬1年前1 -
 拥有空无 共回答了16个问题
拥有空无 共回答了16个问题 |采纳率87.5%H(只标明了质子数为1,没有标明质量数),这样的话,可看做是H元素,不能看做核素,因而也不能与D、T互称同位素.
化学学习也是首先确定研究对象啊,指代不明是大忌,就会出现这样的麻烦.1年前查看全部
- 某元素R的一种单质分子中含有四个原子,该单质的气体的密度折算到标准状况下为5.71克每升,已知R原子中质子数等于中子数.
某元素R的一种单质分子中含有四个原子,该单质的气体的密度折算到标准状况下为5.71克每升,已知R原子中质子数等于中子数.
1.求R的质子数和相对原子质量 2.求R的气态氢化物与最高价氧化物在同温同压下的相对密度 3.求R的最高价氧化物对应水化物的浓溶液与R的气态氢化物之间发生氧化还原反应时,被氧化与被还原的元素的质量比 那年的雨夜1年前2
那年的雨夜1年前2 -
 fanyunxiaoyuer 共回答了16个问题
fanyunxiaoyuer 共回答了16个问题 |采纳率100%标况密度为 5.71*22.4=128
相对原子量为128/4=32
质子数16
即为S
浓硫酸与硫化氢反应 H2S+H2SO4=S↓+SO2↑+2H20
被氧化:被还原=1:11年前查看全部
- 为什么元素的化学性质与它的最外层电子数有关?难道不与质子数有关吗?
 卖风子的小衬衣1年前1
卖风子的小衬衣1年前1 -
 quan妖 共回答了21个问题
quan妖 共回答了21个问题 |采纳率90.5%质子数决定了电子的数目,质子数同时决定了原子所在的周期以及其最外层电子.化学反应一般都是最外层电子的反应,所以这样说没错.但是你说和质子数有关也是绝对正确的,但是因为化学反应一般都只会发生在原子最外层上所以最外层电子就比质子数更重要了.1年前查看全部
- 5mol二氧化碳与8mol二氧化硫的分子数之比是______,原子数之比______,电子数之比______,质子数之比
5mol二氧化碳与8mol二氧化硫的分子数之比是______,原子数之比______,电子数之比______,质子数之比______.
 竖爬的螃蟹1年前2
竖爬的螃蟹1年前2 -
 yuyoo_zhao 共回答了17个问题
yuyoo_zhao 共回答了17个问题 |采纳率82.4%解题思路:根据N=nNA结合分子的构成、每个分子中含有的电子数、每个分子中含有的质子数来分析解答.每个CO2和每个SO2分子中都含有3个原子,每个CO2分子中含有22个质子、22个电子、3个原子,每个SO2分子中含有3个原子、32个质子、32个电子,根据N=nNA知,二氧化碳和二氧化硫的分子数之比等于其物质的量之比=5mol:8mol=5:8,每个二氧化碳和每个二氧化硫分子中原子个数相等,所以其原子个数之比为5:8,其电子数之比=(5×22):(8×32)=55:128,其质子数之比等于其电子数=55:128,
故答案为:5:8;5:8;55:128;55:128.点评:
本题考点: 物质的量的相关计算.
考点点评: 本题考查了物质的量的有关计算,明确物质的量与分子数的关系及分子构成是解本题关键,知道分子中质子数和电子数的计算方法,题目难度不大.1年前查看全部
- ABCD为短周期元素,原子序数依次增大,AC及BD分别是同一主族,B、D两元素的原子核中质子数之和是A、C两元素的原子核
ABCD为短周期元素,原子序数依次增大,AC及BD分别是同一主族,B、D两元素的原子核中质子数之和是A、C两元素的原子核中质子数之和的两倍.四种元素单质中有两种气体、两种固体,ABCD各是什么元素?
跟我的结果一样,但下面有一小问说ABD可形成18电子和10电子的两种微粒,Ne、He、Na怎么形成微粒啊 魔女0491年前3
魔女0491年前3 -
 被溅起的水花 共回答了16个问题
被溅起的水花 共回答了16个问题 |采纳率87.5%因为ABCD为短周期元素,原子序数依次增大,AC及BD分别是同一主族
所以设A有x个质子所以C有x+8个质子.B有y个质子,D就有y+8个质子.
所以根据B、D两元素的原子核中质子数之和是A、C两元素的原子核中质子数之和的两倍
所以有等式2*(x+x+8)=y+y+8
解得2x+4=y x3时y为第3周期元素,那么D就是第4周期的元素了和题目不符
分别把x=1,2,3 代入原方程.
当X=1时 有 A:H B: C C: F D:Si AC不同主族 舍去
当x=2时 有A:He B: O C: Ne D:S 有3种气体了 所以舍去
当x=3时,有A:Li B: He C: Na D:Ne 完全符合
所以A:Li B: He C: Na D:Ne
这样子是吗,那你给的条件还不齐,
所以根据你给的条件
形成ABD可形成18电子和10电子的两种微粒
那肯定不能是稀有气体元素了
根据我们做过那么多题,10电子的微粒常见的有CH4 NH3 H2O HF 当然还有一些离子.18电子的微粒有HCl H2S PH3 H2O2这些分子
在这里面找出共同点, 那就是H
所以肯定有H 和H同一主族的还有Li Na 如果是Li的话 你再去分析一下 发现他们质子数的2倍是8,那么肯定不行了.所以就只能是Na
那么11+3=14 14*2=28
你已经有1种气体和一种固体了 所以你还缺少一种气体和一种固体
那么就只有N族元素和O族元素可以选了
最后算出的肯定是O和S
因为你没给出下一问嘛,所以就直接这样设了(当时也没想那么多)
因为这个比较特殊
根据题目可以知道ABCD的位置
A B
C D
或者
A
B
C D
第一个就是一开始求的了
第2个 一看就看出来了
A是在第一周期,况且右边还有元素 那么肯定不可能是He了
所以A :H C:Na
再根据要求你就可以推出(1+11)*2=x+x+8 x=8
那么进而求出B:O D;S
有时候做题就是这样的,可以从后面的问题得到一些关于前面题目的信息.1年前查看全部
- 原子与离子的区别简明扼要一点儿~镁原子和镁离子具有相同的 ( )A 电子层数 B 质子数 C 电子总数 D 最外层电子数
原子与离子的区别
简明扼要一点儿~
镁原子和镁离子具有相同的 ( )
A 电子层数 B 质子数 C 电子总数 D 最外层电子数
理由 meteroic1年前7
meteroic1年前7 -
 wsxuyinwen 共回答了9个问题
wsxuyinwen 共回答了9个问题 |采纳率100%选B
Mg原子核外电子排布是2,8,2,Mg2+核外电子排布是2,8
Mg2+是由Mg原子失去两个电子得到的,只是失去了两个电子,所以原子核没受影响,质子数不变
之所以电子层数不同,是因为Mg恰好失去了最外层全部的电子,所以电子层数少了一层1年前查看全部
- 原子中质子数一定等于( )核电核数 B:最小层电子数 C:中子数 D:中子数与电子数之和
 xtwzljz1年前3
xtwzljz1年前3 -
 好慧儿 共回答了20个问题
好慧儿 共回答了20个问题 |采纳率90%A:核电核数1年前查看全部
- 一种粒子的质子数和电子数与另一种粒子的质子数相等,两种粒子可能是相同的粒子吗?
 caoyg1年前2
caoyg1年前2 -
 hanyingpx 共回答了18个问题
hanyingpx 共回答了18个问题 |采纳率94.4%除了同位素外,还有可能是等电子微粒.如H2O和NH3都是10质子、10电子.1年前查看全部
- 下列关于原子的说法错误的是A原子是化学变化中最小的粒子 B任何原子中,质子数一定等于核外电子数 C所有的原子都由质子,中
下列关于原子的说法错误的是
A原子是化学变化中最小的粒子 B任何原子中,质子数一定等于核外电子数 C所有的原子都由质子,中子,电子三种粒子构成 D原子在化学反应中是不可再分的 agssfdg1年前1
agssfdg1年前1 -
 921zhouqi 共回答了17个问题
921zhouqi 共回答了17个问题 |采纳率88.2%C错.氕(氢1)就没有中子
AD是同一个意思1年前查看全部
- 核电荷数小于l8的某元素X,其原子的电子层数为n,最外层电子数为(2n+1),原子核内质子数为(2n 2 -1)。下列关
核电荷数小于l8的某元素X,其原子的电子层数为n,最外层电子数为(2n+1),原子核内质子数为(2n 2 -1)。下列关于元素X的说法中,不正确的是
A.其最高化合价为+3 B.可以形成化学式为KXO 3 的盐 C.其氢化物可以用来做喷泉实验 D.其最高价氧化物的水化物是强酸  silensilen1年前1
silensilen1年前1 -
 小宝爱阿珂 共回答了21个问题
小宝爱阿珂 共回答了21个问题 |采纳率85.7%A
1年前查看全部
- 原子中的等量关系 核电荷数=质子数=核外电子数=( )
 ff新剑1年前1
ff新剑1年前1 -
 c05202444 共回答了21个问题
c05202444 共回答了21个问题 |采纳率90.5%原子序数1年前查看全部
- 某元素的原子结构示意图为(M为质子数,N为最外层电子数,电子数与质子数关系相等)该粒子的核电荷数为?电子数为?质子数为?
某元素的原子结构示意图为(M为质子数,N为最外层电子数,电子数与质子数关系相等)该粒子的核电荷数为?电子数为?质子数为?第一层电子数为2,最外层电子数为?与该粒子的化学性质广西最密切的是?
 todaya1年前3
todaya1年前3 -
 尼斯湖底的水怪 共回答了19个问题
尼斯湖底的水怪 共回答了19个问题 |采纳率89.5%对于所有元素,核电荷数等于质子数加中子数;质子数等于电子数.最外层电子数与第一层电子数没有关系.由于看不到示意图,我只能回答这些了.1年前查看全部
- 在一次密立根油滴实验中,测得一滴油带有10ˉ¹²C的负电荷,该油滴所含电子数比质子数多多少个?
在一次密立根油滴实验中,测得一滴油带有10ˉ¹²C的负电荷,该油滴所含电子数比质子数多多少个?
 skyztj1年前1
skyztj1年前1 -
 liuzhihui702 共回答了14个问题
liuzhihui702 共回答了14个问题 |采纳率100%如果电子比质子多一个,就会带1.6*10^-19C的电荷.
所以电子笔质子多,10^-12/1.6*10^-19=6.25*10^6个电子1年前查看全部
- 下列各组微粒具有相同的质子数和电子数的是( )
下列各组微粒具有相同的质子数和电子数的是( )
A.OH-、H2O
B.NH4+、NH2-
C.H3O+、CH4
D.HCl、F2 wendycc1年前1
wendycc1年前1 -
 jeanneliy 共回答了23个问题
jeanneliy 共回答了23个问题 |采纳率87%解题思路:质子数等于原子的质子数之和,中性微粒中质子数等于电子数,阳离子的电子数等于质子数减去电荷数,而阴离子的电子数为质子数加电荷数.A、OH-的质子数为8+1=9,OH-的电子数为9+1=10,H2O的质子数为8+1×2=10,H2O的电子数为8+1×2=10,故A错误;
B、NH4+的质子数为7+4=11,NH4+的电子数为11-1=10,NH2-的质子数等于7+1×2=9,电子数等于7+1×2+1=10,故B错误;
C、H3O+的质子数等于8+1×3-1=10,H3O+电子数等于8+1×3=11,CH4的质子数为6+1×4=10,CH4的电子数为6+1×4=10,故C错误;
D、HCl的质子数为17+1=18,电子数为17+1=18,F2的质子数为9×2=18,F2的电子数为9×2=18,故D正确;
故选D.点评:
本题考点: 质子数、中子数、核外电子数及其相互联系.
考点点评: 本题考查微粒的质子数和电子数的关系,明确中性微粒、阳离子、阴离子的电子的数目计算是解答的关键,并注意中性微粒中质子数等于电子数.1年前查看全部
- (2009•宝鸡三模)已知X、Y、Z、W都是短周期的非金属元素,其原子序数依次增大.W原子的质子数是Y原子质子数的两倍,
(2009•宝鸡三模)已知x、y、z、w都是短周期的非金属元素,其原子序数依次增大.w原子的质子数是y原子质子数的两倍,x原子与w原子的最外层电子数之和是y和z原子的质子数之和的[1/3].y的氢化物分子中有三个共价键.
(1)x、z的元素名称分别是______、______,w元素原子结构示意图为______.
(2)y的氢化物分子的空间构型为______,属于______分子(填“极性”或“非极性”)
(3)由以上任意三种元素组成的化合物中,其水溶液显酸性的有(填写化学式)______、______.(任写两种)
(4)写出一个离子反应方程式,要求反应物与生成物的离子或分子均是由以上元素中的两种元素组成且各微粒所含的电子数相同.nh4++oh-
nh3↑+h2o[或nh3+h3o+═nh4++h2o或oh-+h3o+═2h2o]△ .nh4++oh-.
nh3↑+h2o[或nh3+h3o+═nh4++h2o或oh-+h3o+═2h2o]△ .
(5)***材料学家已成功制备了w元素与y元素组成的耐高温的新型材料w3y4.工业上可用w的氢化物与y的氢化物反应制得耐高温化合物和氢气,此反应的化学方程式为3sih4+4nh3
si3n4+12h2高温 .3sih4+4nh3.
si3n4+12h2高温 . 其实我最想开源1年前0
其实我最想开源1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 相对原子质量=质子数+中子数,为什么不是核外电子数+中子数,好像和什么离子有关吧,
 御剑流1年前1
御剑流1年前1 -
 我的阴暗无可救药 共回答了14个问题
我的阴暗无可救药 共回答了14个问题 |采纳率92.9%原子的核外电子数=质子数
但原子变成离子时会失去或得到电子,此时核外电子数≠质子数
即此时相对原子质量=质子数+中子数,不是核外电子数+中子数1年前查看全部
- 下列说法中正确的是( )A.所有的原子核内质子数都比中子数多B.氢离子(H+)实质上是一个裸露的质子C.核外电子排布相
下列说法中正确的是( )
A.所有的原子核内质子数都比中子数多
B.氢离子(H+)实质上是一个裸露的质子
C.核外电子排布相同的微粒,其化学性质也相同
D.非金属元素原子最外层电子数都大于4 17泡妞王1年前1
17泡妞王1年前1 -
 司马夏草 共回答了16个问题
司马夏草 共回答了16个问题 |采纳率93.8%解题思路:A.质子数与中子数无关;
B.氢原子失去一个电子形成氢离子;
C.核外电子排布相同的粒子,化学性质不一定相同;
D.氢原子最外层电子数为1.A.D中质子数=中子数,T中质子数小于中子数,故A错误;
B.氢原子失去一个电子剩余一个质子形成氢离子,故B正确;
C.核外电子排布相同的粒子,化学性质不一定相同,如Na+和OH-,故C错误;
D.氢原子最外层电子数为1,小于4,故D错误.
故选B.点评:
本题考点: 质子数、中子数、核外电子数及其相互联系;原子核外电子排布.
考点点评: 本题考查原子结构、质子数、中子数、核外电子数及其相互联系,题目难度不大,学习中注意相关基础知识的积累.1年前查看全部
- 图中的黑球和白球分别表示质子数不同的两种原子,其中表示化合物的是( )
图中的黑球和白球分别表示质子数不同的两种原子,其中表示化合物的是( )
A.
B.
C.
D.
 ih1hnm1年前1
ih1hnm1年前1 -
 benlacong 共回答了17个问题
benlacong 共回答了17个问题 |采纳率94.1%A、图中四个分子构成相同,为同种物质的分子,所示物质为纯净物;每个分子是由不同种原子所构成,对应物质为化合物;故A正确;
B、图中四个分子构成相同,且有同种原子构成,是同种单质组成的纯净物,故B不正确;
C、图中四个分子中两个构成相同为单质的分子,另两个是由不同原子构成的两种化合物分子,及该图示中含有三种分子,所示为混合物;故C不正确;
D、从结构上看图中四个分子可分为两种结构不同分子,因此所示物质为混合物,故D不正确;
故选A.1年前查看全部
- 某元素原子的核电荷数是电子层数的5倍,质子数是其最外层电子数的3倍,试推断该元素.(要求写明过程!
 想干就干吧1年前1
想干就干吧1年前1 -
 赵一人3 共回答了22个问题
赵一人3 共回答了22个问题 |采纳率90.9%K层(第一层)最多2个 L层(第二层)最多为8个 M层(第三层)可以有18个
某元素原子的核电荷数是电子层数的5倍,电子层数为2或3
质子数是其最外层电子数的3倍,电子层数为3
所以 元素原子的核电荷数是15 即 磷元素 P1年前查看全部
- 与钠离子电子数和质子数都一样的微粒 举例两个
与钠离子电子数和质子数都一样的微粒 举例两个
作业上的,拜托,我只想到铵根离子 风烟fay1年前1
风烟fay1年前1 -
 15号金色轰炸机 共回答了22个问题
15号金色轰炸机 共回答了22个问题 |采纳率95.5%H30+
NH4+1年前查看全部
- 关于铵根离子质子数的问题我想知道下铵根离子有多少个质子,中子跟电子?分别怎么算?
 庄不会1年前2
庄不会1年前2 -
 5212711 共回答了17个问题
5212711 共回答了17个问题 |采纳率94.1%不管是原子分子还是离子 原子的质子数不变 永远等于核电荷数,即原子序数
所以质子数还是7+4=11 但由于带一个单位正电荷(失去了一个电子),所以电子数为11-1=10
中子也不会变化 一般来看 H中子数为0 N中子数为7 所以 铵根中子数为7
如果还有疑问 百度HI找我 详谈1年前查看全部
- 有四种元素,其核电荷数均小于20,A能形成氧化物AO,AO中A元素占60%,且A中质子数等于中子数;B元素原子核内没有中
有四种元素,其核电荷数均小于20,A能形成氧化物AO,AO中A元素占60%,且A中质子数等于中子数;B元素原子核内没有中子;C原子和D - 都比B原子多17个电子.
(1)写出各元素的符号:A______、B______、C______、D______.
(2)A、D两元素形成的化合物的化学式为______,B、D两元素形成的化合物的化学式为______. fhazi_O1年前1
fhazi_O1年前1 -
 bobomwl 共回答了15个问题
bobomwl 共回答了15个问题 |采纳率93.3%(1):已知“A能形成氧化物AO,则A的化合价为+2价目,A原子最外层有两个电子,A的核电荷数小于20,A的质量分数为60%,则60%=
Ar(A)
Ar(A)+16 ×100%,Ar(A)=24,A元素原子核内质子数等于中子数”,因为相对原子质量=质子数+中子数,故质子数为12,A为镁元素,由“B元素原子内无中子”则B为氢元素,由“C原子和D - 都比B原子多17个电子”则C为氩元素,D为氯元素;
(2)四种元素两两组合,形成的化合物为MgCl 2 ,HCl
故答案为:(1)Mg、H、Ar、Cl (2)MgCl 2 、HCl1年前查看全部
- H+中含有的质子数和电子数同上
 chraisytam1年前2
chraisytam1年前2 -
 zhaogl0305 共回答了20个问题
zhaogl0305 共回答了20个问题 |采纳率100%没有H+吧?是没有"氢离子"的.因为氢只有一个电子,是不容易失去的.
如果是H的话只有一个电子的一个质子.
不过若按照H+这个化学符号来看,推断有一个质子,0个电子,显一个正电.``1年前查看全部
- 下列各图中“○”和“●”分别表示两种质子数不同的原子,下图所表示的四种物质中,与另外三种不属于同一类别的物质是( )
下列各图中“○”和“●”分别表示两种质子数不同的原子,下图所表示的四种物质中,与另外三种不属于同一类别的物质是( ) A. 
B. 
C. 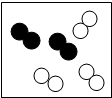
D. 
 昶月的天空1年前1
昶月的天空1年前1 -
 晨雾飘飘 共回答了22个问题
晨雾飘飘 共回答了22个问题 |采纳率90.9%A、为一种分子,为化合物,为纯净物;
B、为单质和化合物组成的混合物;
C、为两种单质组成的混合物;
D、为单质和两种化合物组成的混合物.
故选A.1年前查看全部
- 质子数与中子数相等的物质rt属于短周期的元素,质子数与中子数相等的物质
 癫疯对决1年前1
癫疯对决1年前1 -
 Y977144809 共回答了23个问题
Y977144809 共回答了23个问题 |采纳率95.7%氢的同位素:氘1年前查看全部
- 元素概念问题元素概念是:具有相同质子数的一类原子的总称.这里的“原子”是广义的原子,可以是原子和电子,那cl2这种基本粒
元素概念问题
元素概念是:具有相同质子数的一类原子的总称.这里的“原子”是广义的原子,可以是原子和电子,那cl2这种基本粒子属于cl元素吗?cl2是分子,应该不满足“原子”这一条件啊?想不通啊.
有个题:现有下列基本粒子:...cl2...问:其中,它们分别属于_种元素?答案给的是:本题列出的...种粒子分属...cl......种元素。也就是答案认为cl2属于cl元素啊。换个问法:元素指的都是原子吗?还是也可以指离子? 西城gg1年前4
西城gg1年前4 -
 w_g_q 共回答了18个问题
w_g_q 共回答了18个问题 |采纳率88.9%元素是表示具有相同质子数原子核的化学物质种类的集合名词.这里“广义的原子”的论述是正确的——若干粒子,只要明确具有一个质子数相同的原子核,无论是否是以电中性的原子存在,那么这些粒子同属于一种元素.1个Cl2分子由2个Cl原子构成,因此Cl2分子中Cl元素的含量为100%,无论是Cl2分子还是Cl2这种物质,它的组成是100%的氯元素——重点是“这种组成”体现了氯元素这种化学意义上的物质的“种类”.
应当注意,元素只能作为集合名词使用,所以诸如“一个Cl原子‘是’氯元素”“一个Cl2分子‘是’氯元素”的说法是更加错误的.由于作为集合名词,所以描述宏观上的物质组成的用法比较常见,不过被某些人以为“只能作为宏观概念”——这是一种误解.LZ的“Cl2属于氯元素”的这类说法,尽管有歧义,但并没有本质的错误(Cl2分子以及Cl2这种宏观的物质,都是氯元素这种物质集合的存在形式的体现).
另外需要注意,具体的元素只有一种,世界上不会有超过一种Cl元素(但可以有多种存在形式——原子或离子,有多种核素/同位素).
LZ给的题目不确切,对于具体的某种纯净物,可以说由某几种元素组成,不过单纯通过所含元素给物质分类(“分属”比较接近这层含义)但又不定量考虑具体的元素组成,在化学上是没多少意义的;如果说“对于其中的每一种物质,回答它由哪些元素组成”这样就没有歧义了.
====
[原创回答团]1年前查看全部
- 元素的化学性质是由什么决定的?我觉得不关质子数的问题,因为质子数只是决定元素的种类
 炎炎道人1年前4
炎炎道人1年前4 -
 欠你一份爱 共回答了16个问题
欠你一份爱 共回答了16个问题 |采纳率93.8%元素的化学性质是由什么决定的?
由核外电子的排布来决定的.
但是质子数确定后,它的原子核外电子数也就确定了1年前查看全部
- 一个阳离子 一个阴离子 他们的电子数和质子数都相等.可能吗.举例说明、
 green6543211年前4
green6543211年前4 -
 刚想换手机 共回答了21个问题
刚想换手机 共回答了21个问题 |采纳率85.7%不可能
如果电子数相等,那么阳离子的质子数必定多
我先回答的~1年前查看全部
- 完成下列表格,并根据表格填空:原子种类质子数中子数核外电子数相对原子质量氢10____________碳______66
完成下列表格,并根据表格填空:
通过表格,你可以获得哪些信息:(至少写三点)原子种类 质子数 中子数 核外电子数 相对原子质量 氢 1 0 ______ ______ 碳 ______ 6 6 ______ 氯 ______ ______ 17 35
(1)______;
(2)______;
(3)______. mimosa211年前1
mimosa211年前1 -
 风露1清愁 共回答了17个问题
风露1清愁 共回答了17个问题 |采纳率94.1%解题思路:根据:质子数=电子数、相对原子质量=质子数+中子数,将表格所缺内容填好,再通过观察数据找出规律性的东西,并能灵活运用.填好表格内容后,通过观察表格中的数据,得到了以下启示:在原子中质子数=电子数=核电荷数,相对原子质量=质子数+中子数,不同元素质子数不同,原子内质子数不一定等于中子数,有的原子的原子核中没有中子,但一定有质子.
故答案为:
原子种类质子数中子数核外电子数相对原子质量
氢1011
碳66612
氯17181735(1)在原子中质子数等于电子数;
(2)质子数和中子数可能相同,也可能不相同;
(3)相对原子质量=质子数+中子数;(不同种类的原子,质子数不同等).点评:
本题考点: 原子的定义与构成.
考点点评: 通过回答本题知道了在原子里:质子数=电子数=核电荷数;不同种类的原子,质子数不同;相对原子质量=质子数+中子数.1年前查看全部
- 原子中,质子数=中子数+电子数吗?
 jiangshanru1年前2
jiangshanru1年前2 -
 zhzejun2007 共回答了22个问题
zhzejun2007 共回答了22个问题 |采纳率81.8%质子数 = 电子数
因为每个质子带一个单位的正电荷,而每个电子带一个单位的负电荷
对于原子来说,原子是中性的,所以正电荷 和负电荷的数目应该相等才对
中子是不带电的,所以跟它没关系
离子跟原子不同,离子是整体显电性的,所以对于离子来说,质子和电子不相等
当然.你这里说的是原子,所以:质子数=电子数1年前查看全部
- (2008•肇庆)某原子结构示意图和在周期表中的信息如图.则该元素的质子数为______,元素的相对原子质量为_____
 (2008•肇庆)某原子结构示意图和在周期表中的信息如图.则该元素的质子数为______,元素的相对原子质量为______,它在化合物中的化合价为______.
(2008•肇庆)某原子结构示意图和在周期表中的信息如图.则该元素的质子数为______,元素的相对原子质量为______,它在化合物中的化合价为______.  kawase1年前1
kawase1年前1 -
 舞舞潇潇 共回答了18个问题
舞舞潇潇 共回答了18个问题 |采纳率94.4%解题思路:根据元素周期表中的一个小格所提供的信息和原子结构示意图及元素的正化合价数等于其原子的最外层电子数,进行解答.根据元素周期表中的一个小格所提供的信息可知:图中元素的质子数为 11;元素的相对原子质量为:23.0;
依据原子结构示意图及元素的正化合价数等于其原子的最外层电子数,可知图中元素化合物中的化合价为+1;
故答案为:11; 23.0;+1.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图.
考点点评: 本题考查了元素周期表中看图回答最简单的元素原子序数、相对原子质量,学生必须掌握的知识.1年前查看全部
- 氯化钠是由钠离子和氯离子构成的已知钠离子的原子核中质子数11,中子数为12下列有关钠离子的说法正确的是( )
氯化钠是由钠离子和氯离子构成的已知钠离子的原子核中质子数11,中子数为12下列有关钠离子的说法正确的是( )
A. 原子核外电子数为11
B. 它的相对原子质量和钠原子的相同
C. 原子核内的正电荷数为+10
D. 原子核外电子数为12 linagca1年前3
linagca1年前3 -
 wuway 共回答了27个问题
wuway 共回答了27个问题 |采纳率92.6%解题思路:A、根据钠离子是钠原子失去1个电子后形成的进行解答;
B、根据相对原子质量=质子数+中子数进行解答;
C、根据原子核内的正电荷数与质子数相同进行解答;
D、根据钠离子是钠原子失去1个电子后形成的进行解答.A、钠离子是钠原子失去1个电子后形成的,钠原子的核外电子数为11,所以钠离子核外电子数为10,故A错误;
B、相对原子质量=质子数+中子数,钠原子和钠离子中质子数和中子数相同,所以钠离子的相对原子质量和钠原子的相同,故B正确;
C、原子核内的正电荷数与质子数相同,所以钠离子中原子核内的正电荷数为+11,故C错误;
D、钠离子是钠原子失去1个电子后形成的,钠原子的核外电子数为11,所以钠离子核外电子数为10,故D错误.
故选:B.点评:
本题考点: 原子和离子的相互转化.
考点点评: 本题难度不大,解题的关键是掌握原子中核电荷数=质子数=电子数、相对原子质量=质子数+中子数.1年前查看全部
- 一个元素的质子数和中子数相等吗?
一个元素的质子数和中子数相等吗?
我纠正,是“一个原子的质子数和中子数是否相等?”
好象“不一定”居多。但8楼的说是相等的。谁能给我最最准确的答案? 风雨同竹1年前13
风雨同竹1年前13 -
 黑鸭子96 共回答了16个问题
黑鸭子96 共回答了16个问题 |采纳率75%有些元素原子的质子数和中子数是相同的,多数都在元素周期表的前面,比如碳,氮,氧,硅,磷等.还有许多元素的质子数和中子数并不相同,中子数比质子数多,表现在元素周期表上就是 原子量>2*原子序号 的元素了,多的部分就是多出的中子的质量.比如钠,质子数为11,中子数为12,所以原子量为23.
还有的元素的不同原子质子数相同,但是中子数不同,也就是所说的同位素,比如碳(C)就有C8到C19共十二种同位素.它们的质子数都是6,而中子数则各不相同.1年前查看全部
- 钠离子Na+原子核中质子数11,中子数12,那下面那个是对的 A原子核外电子数为11 B它的相对原
钠离子Na+原子核中质子数11,中子数12,那下面那个是对的 A原子核外电子数为11 B它的相对原
钠离子Na+原子核中质子数11,中子数12,那下面那个是对的
A原子核外电子数为11
B它的相对原子质量与钠原子相同
C原子核内正电荷数为+10
D原子核外电子数为12
说出原因, KingKong01年前2
KingKong01年前2 -
 01016 共回答了22个问题
01016 共回答了22个问题 |采纳率86.4%选B
对于原子质子数=核电荷数=核外电子数,对于Na+离子核外电子数比钠原子少一即为10个,AD不对;对于原子核的正电荷数不变还是11,C不对;B项相对原子质量都是11+12=231年前查看全部
- 131.元素X和Y在周期表中处于相邻周期,这两种元素的离子所含质子数之和为21,Y元素的原子核外电子数比X的原子核外电子
13
1.元素X和Y在周期表中处于相邻周期,这两种元素的离子所含质子数之和为21,Y元素的原子核外电子数比X的原子核外电子数多5个,下列叙述正确的是
A.Y元素的原子可通过共价键构成固体单质
B.x和硫元素可组成两种不同的化合物
C.x形成的单质属于金属单质
D.x和Y构成一种阴离子与过量盐酸反应可转化成Y的阴离子
我觉得氟化镁似乎符合题意,可答案给的是B.D 谁能给逐一分析一下啊?
2.判断正误
错误的请举个反例,
(1).只含共价键的化合物,就一定是共价化合物
(2).凡是第一主族和第六主族的原子化合时,一定形成离子键
(3).在氧化还原反应中,非金属单质一定是氧化剂
(4).金属阳离子被还原不一定得到金属单质
3.在标准状况下1体积水可溶解448体积氨气,在相同条件下,100g水能溶解多少克氨气? zxccvv1年前2
zxccvv1年前2 -
 4816985 共回答了22个问题
4816985 共回答了22个问题 |采纳率86.4%1.
Y是铝,X是氧.
因为 假设二者的电荷数是 a,b
a+b=21
b-a=5 所以b=13,a=8
B选项是二氧化硫和三氧化硫.
D选项是三氧化二铝与盐酸反应可以生成 四羟基和铝酸
2.
(1)错 过氧化钠 其中既有共价键,又有离子键.
(2)错 水分子中只有共价键
(3)错 C+O2=CO2 其中的C就是还原剂,而氧化剂是O2
(4).对,比如三价的铁就是这样
3.
100克水就是100毫升,可以溶解44800毫升的氨气,而44800毫升转化成物质的量是44800/2.4l/mol= 2mol,所以溶解的氨气的质量是2*17=34克
小气鬼,出了这么多题,都不舍得悬赏,要是不懂怎么做的话,给我留言吧1年前查看全部
- 如何确定原子所含质子数/
 willow_hu1年前3
willow_hu1年前3 -
 lh29 共回答了22个问题
lh29 共回答了22个问题 |采纳率90.9%原子所含的质子数 = 原子序数 = 核电荷数
比如氧原子,是8号元素,所以质子数是81年前查看全部
- 各元素的质子数和原子数比如:元素(质子数,原子数)H(1,0)He(2.2)Li(3,4)C(6,6)N(7,7)...
各元素的质子数和原子数
比如:元素(质子数,原子数)
H(1,0)
He(2.2)
Li(3,4)
C(6,6)
N(7,7)
.
.
.
.
.
.
越多越好, djf25227771年前4
djf25227771年前4 -
 日aa人不长命 共回答了16个问题
日aa人不长命 共回答了16个问题 |采纳率100%应该是中子数吧?
相对原子质量(取整数)=质子数+中子数
相对原子质量书后附表中有
质子数在元素周期表中查.
所以几乎所有的常见原子都可以估算出来了1年前查看全部
- 氦原子核内的质子数为2,中子数为1,而相对原子质量为4?
氦原子核内的质子数为2,中子数为1,而相对原子质量为4?
周期表上为4,但相对原子质量=质子数+中子数, wang_1978狼1年前2
wang_1978狼1年前2 -
 wjdb0222 共回答了21个问题
wjdb0222 共回答了21个问题 |采纳率76.2%氦在自然界中存在两种同位素,氦3和氦4,氦3如你所说,相对原子质量为3,氦4质子2中子2相对原子质量为4.
周期表上的相对原子质量数为自然界各种同位素按含量求平均数.而自然界氦4含量远高于氦3,所以为4.
你看到的原子核内的质子数为2,中子数为1,应该是氦31年前查看全部
- 互为同位素的原子质子数一定相同
 明天收购dd1年前5
明天收购dd1年前5 -
 menghuo123 共回答了12个问题
menghuo123 共回答了12个问题 |采纳率91.7%具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素.这是定义.首先,同位素的适用范围是核素,不是原子;其次,质量数相同只是满足同位素的条件之一,还要看中子数是否相同,才可以判断1年前查看全部
- 化学题0523根据氯原子结构示意图,不能确定的是A.质子数B.电子层数C相对原子质量D.元素类别详解,说下这几个都怎么看
化学题0523
根据氯原子结构示意图,不能确定的是
A.质子数
B.电子层数
C相对原子质量
D.元素类别
详解,说下这几个都怎么看啊,谢了 再补充下质子中子,核外电子层数,最外层电子数,谢了 vaperate1年前1
vaperate1年前1 -
 womendejiabb 共回答了17个问题
womendejiabb 共回答了17个问题 |采纳率100%C 因为根据结构示意图,能看出有几个电子层,把各个电子层上数字加起来就是核外电子数,核外电子数等于质子数,结构示意图中最外层上有多少个电子就是最外层电子数,但是看不出中子数,也就无法确定相对原子质量,相对原子质量等于中子数加质子数1年前查看全部
- 元素的种类是按质子数来分类的吗?
 574576071年前3
574576071年前3 -
 m_m5 共回答了17个问题
m_m5 共回答了17个问题 |采纳率88.2%是的.因为同一种元素所包含的核素可能有多种,比如氕、氘、氚就是氢元素的三中核素,但是他们的质子数是想同的,都是1,所以都属于氢元素.1年前查看全部
- 在原子里,核电荷数等于A、核外电子总数B、中子数C、质子数D、相对原子质量
 哈哈kgl哈1年前2
哈哈kgl哈1年前2 -
 听风雨轩 共回答了12个问题
听风雨轩 共回答了12个问题 |采纳率100%相对原子质量是=质子数+中子数=B+C1年前查看全部
- 核外电子数=质子数的条件是在同一原子内吗?(22 20:13:33)
 riddlel1年前5
riddlel1年前5 -
 cytlc 共回答了19个问题
cytlc 共回答了19个问题 |采纳率94.7%对于一个原子来说,核外电子数=质子数
对于离子就不是这样的了.1年前查看全部
- 原子质量定义为质子数加上中子数岂不是更容易理解,为什么非要用碳来作为标准?
 含笑幽灵1年前1
含笑幽灵1年前1 -
 30岁东北女不怕烂 共回答了23个问题
30岁东北女不怕烂 共回答了23个问题 |采纳率78.3%质子和中子质量是不一定的,会有点小小的差别,这就是核反应(聚变和裂变)会放出能量的原因.距离来说,氘核1中子1质子,2个氘核聚变成一个氦核,2中子2质子,但质量会有微小损失,变成巨大能量放出了.1年前查看全部
- 同位素就是质子数相同中子数不同的原子 这话哪错了?
 chenyuanchi1101年前3
chenyuanchi1101年前3 -
 若是偶然 共回答了19个问题
若是偶然 共回答了19个问题 |采纳率89.5%科技名词定义
中文名称:同位素 英文名称:isotope 定义1:具有相同原子序数(即质子数相同,因而在元素周期表中的位置相同),但质量数不同,亦即中子数不同的一组核素.所属学科:电力(一级学科);核电(二级学科) 定义2:中子数不同的同一种元素的一种原子形式,包括稳定同位素和放射性同位素.所属学科:生态学(一级学科);全球生态学(二级学科)1年前查看全部
- 磷元素在空气中自燃,其原子核中的质子数和中子数怎么变化
 zhou_3ss1年前3
zhou_3ss1年前3 -
 我也来一泡 共回答了22个问题
我也来一泡 共回答了22个问题 |采纳率86.4%化学变化中,是分子分成了原子,原子没有再分,而是重新组合形成新的分子,所以在化学变化中,原子没有变化,所以原子核里的中子和质子也不可能发生变化.磷在空气中燃烧时与空气中的氧气发生反应,磷原子与氧原子通过公用电子对,重新组合成五氧化二磷分子,原子核里的质子和中子都没有变化.
4P +5O2 点燃 2P2O51年前查看全部
大家在问
- 1设全集U=R,A={x|-2
- 2一炮筒和水平面的夹角成60度当它以速度100米每秒的速度发射炮弹时炮受反冲后退一直炮弹的质量是10 kg炮身质量是200
- 3在直角三角形ABC中,∠C=90°,BC=8,三角形面积=24,求斜边AB的高
- 4介词I have to go to school ___a hurry .she bought nothing___a
- 5怀着崇高的敬意,我悄悄地从后门走进教室.(缩句)
- 6若抛物线y=x^2-x+c上一点P的横坐标是-2,抛物线过点P的切线恰好过坐标原点,则c的值为______.
- 7有的人喜欢住城市,有的人喜欢住乡村。你喜欢住哪里?为什么?80词左右。(英语作文)
- 8急求关于Carl Sandburg 的英文简介求其著作、名句
- 9阅读理解. There are a lot of things tha
- 10麻烦翻译下,1.在我的印象中,典型的英国绅士总是带着一把雨伞
- 11十亿用科学计数法表示是什么
- 12我们应该倾听他们说话,并且要照顾他们用英文怎么写?
- 13桂林的漓江 作文
- 14关于英语的读音问题英语读音中两元音字母之间有一个辅音字母时,辅音字母归后一音节.但有的辅音听上去对前后元音都有影响如m和
- 15下列各句中加点的成语使用恰当的一句是 A.外面风传咱们厂的厂长要辞职,有人说这是谣言,但我想,空穴来风,恐怕总是会有点儿
