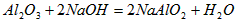某铝土矿样品中含有Al2O3、Fe2O3和SiO2,要将它们分离出来,要进行一系列操作:加入试剂、过滤、洗涤、灼烧等.依
 纯净海2022-10-04 11:39:542条回答
纯净海2022-10-04 11:39:542条回答A. NaOH溶液、盐酸、氨气
B. 盐酸、NaOH溶液、二氧化碳
C. NaOH溶液、盐酸、二氧化碳
D. 水、盐酸、NaOH溶液

已提交,审核后显示!提交回复
共2条回复
 guiyangysun 共回答了19个问题
guiyangysun 共回答了19个问题 |采纳率94.7%- 解题思路:根据Al2O3既能与盐酸反应,又能与NaOH反应,SiO2可与NaOH反应,而Fe2O3只与盐酸反应的性质设计实验方案,注意Al(OH)3既能与强碱反应,又能与强酸反应的性质.
A.NaOH溶液可以溶解Al2O3、SiO2不能溶解Fe2O3,过滤分离Fe2O3;之后加盐酸,硅酸钠溶液中会生成原硅酸沉淀,不能溶于过量盐酸中,而偏铝酸钠经酸化后生成氢氧化铝沉淀,继续加盐酸会溶于过量盐酸中生成氯化铝,此步...
点评:
本题考点: 物质分离、提纯的实验方案设计;硅和二氧化硅;镁、铝的重要化合物;铁的氧化物和氢氧化物.
考点点评: 本题综合考查物质的分离提纯的实验设计,题目难度中等,注意把握相关物质的性质,为解答该类题目的关键. - 1年前
 第一次天崖 共回答了7个问题
第一次天崖 共回答了7个问题 |采纳率- 氢氧化钠过量加入会使氧化铝和二氧化硅溶解,而氧化铁得到的是氢氧化铁的沉淀。通入二氧化碳使得氢氧化铝析出,然后加入盐酸又析出的是硅酸。A是错的,而是C是正确的。
- 1年前
相关推荐
- 下列工业制备方法不正确的是( ) A.工业提取镁是将海水中的镁转化为氯化镁再电解得到单质镁 B.工业提取铝是把铝土矿中
下列工业制备方法不正确的是( ) A.工业提取镁是将海水中的镁转化为氯化镁再电解得到单质镁 B.工业提取铝是把铝土矿中的氧化铝提纯后采用加热分解法制备单质铝 C.工业采用高炉法炼铁 D.工业采用接触法制造浓硫酸  myhoneybear1年前1
myhoneybear1年前1 -
 nanb451 共回答了15个问题
nanb451 共回答了15个问题 |采纳率93.3%A.镁是活泼金属,在工业上采用电解其熔融盐的方法冶炼,所以工业提取镁是将海水中的镁转化为氯化镁再电解得到单质镁,故A正确;
B.铝是活泼金属,工业上采用电解氧化铝的方法冶炼,铝是亲氧元素,不能用热分解法冶炼,故B错误;
C.铁是较活泼金属,工业上采用一氧化碳还原法冶炼,碳和空气反应生成二氧化碳,二氧化碳和碳反应生成一氧化碳,一氧化碳和氧化铁发生氧化还原反应生成铁,故C正确;
D.接触法制取硫酸过程为:造气阶段,4FeS 2 +11O 2
高温
.
2Fe 2 O 3 +8SO 2 ,接触氧化阶段 2SO 2 +O
催化剂
.
△ 2SO 3 ,三氧化硫吸收阶段:用98.3%的硫酸吸收,再用92.5%的硫酸稀释,故D正确;
故选B.1年前查看全部
- 工业上用铝土矿(主要成分是Al2O3)生产金属铝的过程.求其中的所有方程式
 blur11年前0
blur11年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 氮化铝(A1N)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于大规模集成电路生产、陶瓷工业等领域.工业上从铝土矿中
氮化铝(A1N)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于大规模集成电路生产、陶瓷工业等领域.工业上从铝土矿中获得物质X,从空气中获得氮气,再将物质X、N 2 和碳在一定条件下反应制得A1N和CO.则
(1)氮化铝陶瓷属于______.(填字母)
A.金属材料B.无机非金属材料
(2)通常情况下,空气中氮气的体积分数为______,将经过除尘净化、除去二氧化碳和水蒸气的空气液化,通过控制温度将______(填氧气或氮气)从液态空气中先蒸发出来.
(3)物质X的化学式______,制A1N的化学反应方程式______.
(4)铝在地壳中的含量居所有元素的第______位.铝元素摄人过多对人体有害,请给大家提一条减少生活中铝元素摄入的合理化建议______. 小优不哭1年前1
小优不哭1年前1 -
 思念旅行 共回答了12个问题
思念旅行 共回答了12个问题 |采纳率100%(1)金属材料是指金属单质或合金,最少需要有一种金属单质,而氮化铝陶瓷中没有金属单质,所以属于无机非金属材料;
(2)空气中各成分及体积分数为:氮气:78%、氧气:21%、稀有气体:0.94%、二氧化碳0.03%、水蒸气和杂质:0.03%.除去二氧化碳和水蒸气的空气主要是液态氧和液态氮,而液态氮的沸点比液态氧的沸点低,所以氮气先出来;
(3) 根据质量守恒定律可知反应前后元素种类不变,生成物为A1N和CO,而反应物中只有氮、碳元素,所以还缺少铝和氧,即氧化铝;
(4)地壳中含量最多的前五种元素是;氧、硅、铝、铁、钙.所以铝占第3位,不使用铝制的饮料瓶或餐具等.
故答案为:(1)B;
(2)78%;氮气;
(3)Al 2 O 3 ;Al 2 O 3 +N 2 +3C═2AlN+3CO;
(4)3;不用铝制易拉罐.1年前查看全部
- (4分)现代生活离不开铝,工业上以铝土矿为原料生产铝。现将一定量某铝土矿样品(主要成分Al 2 O 3 )溶于过量稀盐酸
(4分)现代生活离不开铝,工业上以铝土矿为原料生产铝。现将一定量某铝土矿样品(主要成分Al 2 O 3 )溶于过量稀盐酸并制成500 mL溶液。取100 mL该溶液,测得其中含 有H + 、Cl ― 、Mg 2 + 、Al 3 + 、Fe 3 + 五种离子(不考虑其它离子)。已知部分离子的物质的量浓度为:
c(H + ) = 0.02 mol·L ―1 c(Mg 2 + )= 0.01 mol·L ―1
c(Fe 3 + )= 0.02 mol·L ―1 c(Cl ― ) = 0.52 mol·L ―1
(1)溶液中Al 3 + 物质的量浓度为 mol·L ―1
(2)则该铝土矿样品中Al 2 O 3 的质量为 g。(精确至0.01 g) 张看too1年前1
张看too1年前1 -
 礼物漂亮 共回答了14个问题
礼物漂亮 共回答了14个问题 |采纳率78.6%(1)0.14mol·L ―1 (2)3.57g
1年前查看全部
- 铝是一种应用广泛的金属,工业上用Al 2 O 3 和冰晶石(Na 3 AlF 6 )混合熔融电解制得。铝土矿的主要成分是
铝是一种应用广泛的金属,工业上用Al 2 O 3 和冰晶石(Na 3 AlF 6 )混合熔融电解制得。铝土矿的主要成分是Al 2 O 3 ,含有杂质SiO 2 、Fe 2 O 3 、MgO。工业上从铝土矿中提炼Al 2 O 3 并制取铝的流程如下:
请回答下列问题:
(1)铝与NaOH溶液反应的离子方程式为 。
(2)图中涉及分离溶液与沉淀的玻璃仪器有烧杯、玻璃棒、_________。
(3)反应1涉及的化学方程式有 、 。滤液Ⅰ中加入CaO生成的沉淀是 _ (填化学式)。
(4)向滤液Ⅱ中通入气体A为 ,生成沉淀B的离子方程式为 。 cao2nima1年前1
cao2nima1年前1 -
 恋蓝日记 共回答了16个问题
恋蓝日记 共回答了16个问题 |采纳率93.8%(1)2Al+2H 2 O+2OH-=2AlO 2 -+3H 2 ↑ (2)漏斗
(3)Al 2 O 3 +2NaOH=2NaAlO 2 +H 2 O SiO 2 +2NaOH=Na 2 SiO 3 +H 2 O CaSiO 3
(4)CO 2 AlO 2 — +2H 2 O+CO 2 =Al(OH) 3 ↓+HCO 3 —
1年前查看全部
- 高中化学,为什么从铝土矿中提取铝,要先通过把AI2O3和NaOH反应等步骤,生成AI2O3再电解生成AI,而不是直接电解
高中化学,为什么从铝土矿中提取铝,要先通过把AI2O3和NaOH反应等步骤,生成AI2O3再电解生成AI,而不是直接电解?
 prica1年前2
prica1年前2 -
 hahaha19841203 共回答了18个问题
hahaha19841203 共回答了18个问题 |采纳率94.4%因为铝土矿中除了铝以外,还有其它成分,若直接电解,不可能得到纯净的铝
先通过把AI2O3和NaOH反应等步骤,得到AI2O3,再电解,可以得到纯净的铝1年前查看全部
- 某铝土矿的主要成分为Al2O3xH2O,还含有Fe2O3和SiO2杂质.称取17.50g铝土矿样品,加入200mL1.6
某铝土矿的主要成分为Al2O3xH2O,还含有Fe2O3和SiO2杂质.称取17.50g铝土矿样品,加入200mL1.65mol/L稀H2SO4,恰好完全反应,过滤得到滤渣0.30g,然后在滤液中加入足量NaOH溶液,得到沉淀2.14g.
(1) 该样品中,Fe2O3的物质的量为 .
(2) 试计算样品中Al2O3的质量.
(3)计算 Al2O3.xH2O 的x值 蓝色9991年前1
蓝色9991年前1 -
 爱你所以放开你 共回答了13个问题
爱你所以放开你 共回答了13个问题 |采纳率100%Al2O3xH2O、Fe2O3和SiO2中只有SiO2不与H2SO4反应,所以滤渣0.30g即是SiO2.
滤液中含Al3+和Fe3+(硫酸铝和硫酸铁),在滤液中加入足量NaOH溶液,Al3+变为AlO2-,Fe3+变为Fe(OH)3沉淀,所以沉淀2.14g是Fe(OH)3沉淀.
(1) 该样品中,Fe2O3的物质的量:n(Fe2O3)=1/2n(Fe(OH)3)=1/2*2.14/107=0.01mol.
(2) 样品中Al2O3的质量
Al2O3+3H2SO4=Al2(SO4)3+3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
根据反应式可知n(Al2O3)+n(Fe2O3)=1/3n(H2SO4)=1/3*1.65*200/1000=0.11mol
所以n(Al2O3)=0.11-n(Fe2O3)=0.11-0.01=0.1mol
m(Al2O3)=0.1*102=10.20g.
(3)计算 Al2O3.xH2O 的x值
m(xH2O)=m(样品)-m(Al2O3)-m(Fe2O3)-m(SiO2) =17.50-10.20-160*0.01-0.30=5.4g
因为n(Al2O3.xH2O )=n(Al2O3)=0.1mol,所以m(xH2O )=18x*n(Al2O3.xH2O )=18x*0.1=1.8x=5.4,得x=31年前查看全部
- 铝土矿中先加盐酸与先加氢氧化钠的利弊
铝土矿中先加盐酸与先加氢氧化钠的利弊
就是两种方法从铝土矿中提前氧化铝
1.在铝土矿中加入盐酸,再加人足量氢氧化钠,再通入二氧化碳
2.先加入氢氧化钠,再加人二氧化碳
哪种方法好?为什么? 一虫虫1年前1
一虫虫1年前1 -
 忍不住SO浮出水面 共回答了27个问题
忍不住SO浮出水面 共回答了27个问题 |采纳率85.2%第二种,因为节省原料
第一种:Al2O3-6HCl-12NaOH
第二种:Al2O3-2NaOH1年前查看全部
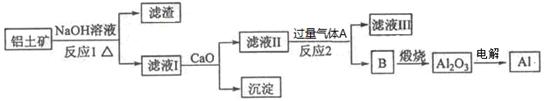
- 工业上用铝土矿(主要成分为Al2O3,还含有Fe2O3,SiO2),提取冶炼铝的原料氧化铝.提取的操作过程如下:
工业上用铝土矿(主要成分为Al2O3,还含有Fe2O3,SiO2),提取冶炼铝的原料氧化铝.提取的操作过程如下:
工业上用铝土矿(主要成分为Al2O3,还含有Fe2O3,SiO2),提取冶炼铝的原料氧化铝.提取的操作过程如下: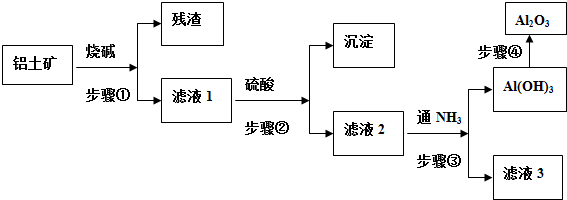
已知:2NaAlO2+4H2SO4(过量)═Al2(SO4)3+Na2SO4+4H2O
(1)实验室完成步骤①-③都有的实验操作为______,该实验操作所需要的玻璃仪器除烧杯外还需要______;
(2)步骤①反应的化学方程式是:______
(3)步骤①后所得残渣主要成分为:______(填化学式);滤液1中要加入过量稀硫酸,所得沉淀的是______(填化学式).
(4)步骤③通入NH3后得到Al(OH)3的离子方程式是:______.
(5)步骤④反应的化学方程式是:______.
 招福zz的跟屁虫1年前1
招福zz的跟屁虫1年前1 -
 名字不好改 共回答了23个问题
名字不好改 共回答了23个问题 |采纳率87%向铝土矿中加入足量烧碱溶液后,氧化铝是两性氧化物,既溶液强酸又溶于强碱.Fe2O3不溶于碱,SiO2溶于强碱,则在①得到的滤液1中含有偏铝酸根离子、硅酸根离子,滤渣为氧化铁;步骤②为向滤液1中加硫酸,硅酸根离子变为硅酸沉淀,偏铝酸根离子转化为铝离子,进入滤液,故滤液2中含有铝离子;步骤③为向滤液2中通氨气,将铝离子转化为氢氧化铝沉淀,加热氢氧化铝得氧化铝.
(1)实验室完成步骤①②③后,均得到沉淀和滤液,故三步均有的实验操作为过滤,过滤用到的玻璃仪器有:烧杯、漏斗、玻璃棒,故该实验操作所需要的玻璃仪器除烧杯外还需要漏斗和玻璃棒;
故答案为:过滤;漏斗、玻璃棒;
(2)向铝土矿(主要成分为Al2O3,还含有Fe2O3,SiO2)中加入足量烧碱溶液后,Fe2O3不溶于碱,氧化铝是两性氧化物,既溶液强酸又溶于强碱,发生反应:Al2O3+2NaOH═2NaAlO2+H2O,SiO2溶于强碱,发生反应:SiO2+2NaOH═Na2SiO3+H2O;
故答案为:Al2O3+2NaOH=2NaAlO2+H2O,SiO2+2NaOH=Na2SiO3+H2O;
(3)Fe2O3与氢氧化钠溶液不反应,过滤后所得残渣为Fe2O3;滤液1中含有偏铝酸根离子、硅酸根离子,加入过量稀硫酸,发生反应:AlO2-+4H+═Al3++2H2O和 SiO32++2H+═H2SiO3↓,所得沉淀的是:H2SiO3;
故答案为:Fe2O3;H2SiO3;
(4)滤液2中含有的离子为Al3+,步骤③通入NH3后,Al3+和NH3?H2O反应,离子方程式为:3NH3?H2O+Al3+═Al(OH)3↓+3NH4+或3NH3+3H2O+Al3+═Al(OH)3↓+3NH4+;
故答案为:3NH3?H2O+Al3+═Al(OH)3↓+3NH4+或3NH3+3H2O+Al3+═Al(OH)3↓+3NH4+;
(5)步骤④为氢氧化铝受热分2Al(OH)3
△
.
Al2O3+3H2O,故答案为:2Al(OH)3
△
.
Al2O3+3H2O.1年前查看全部
- 常温SiO2很难与强碱或强酸所反应.利用盐酸,氢氧化钠溶液,N2,二氧化碳和水从铝土矿中提取纯净的Al2O3
常温SiO2很难与强碱或强酸所反应.利用盐酸,氢氧化钠溶液,N2,二氧化碳和水从铝土矿中提取纯净的Al2O3
铝土矿主要为Al2O3,Fe2O3,SiO2
用化学方程式表示提纯的过程.设计工业生产实验方案
再加一问:制取1molAl理论上需要多少库仑的电量?用6V的直流电源进行供电,制2.7tAl需要消耗多少千焦的电能?
 ee秀1年前1
ee秀1年前1 -
 moumou_van 共回答了17个问题
moumou_van 共回答了17个问题 |采纳率88.2%1、加NaOH.
Al203+2Na0H==2NaAl02+H20 过滤除去氧化铁和二氧化硅
2、加过量二氧化碳
CO2+NaAl02+2H20==Al(OH)3+NaHCO3 过滤得到氢氧化铝沉淀
3、高温灼烧
2Al(0H)3==Al2O3+3H20
1molAl~3mole-~96485*3 库伦
q=It Q=I^2Rt=UIt=U*q=6*96485*3*(2.7*1000000/27)=1.7*10^11J=1.7*10^8KJ1年前查看全部
- 聚合铝(PAC)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铝灰、铝土矿、铝渣等为原料(主要成分为Al、Al
聚合铝(PAC)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铝灰、铝土矿、铝渣等为原料(主要成分为Al、Al 2 O 3 )可制取聚合铝。实验步骤如下:

要测定1mol聚合铝中a的值。
①测定时所需的试剂是 (填代号)。
(a) NaOH (b)AgNO 3 (c) pH试纸 (d) HNO 3
②需要直接测定的物理量是 (用文字表示)。
若该物理量的数值用β表示,试写出聚合铝中a值的表达式 。
③测定过程中所需的基本操作是 (按操作先后顺序的代号列出,可重复选择)。
(a) 洗涤 (b) 过滤 (c) 称量 (d) 干燥 (e) 冷却 东九哥1年前1
东九哥1年前1 -
 hawkeyeszy 共回答了26个问题
hawkeyeszy 共回答了26个问题 |采纳率92.3%1年前查看全部
- 工业上以铝土矿(主要成分是A12O3,含杂质Fe2O3和SiO2)为原料生产铝,其生产流程如下:
工业上以铝土矿(主要成分是A12O3,含杂质Fe2O3和SiO2)为原料生产铝,其生产流程如下:
(1)工业上由Al2O3 冶炼金属Al所采用的方法是______(填字母).
a.电解法b.加热分解c.加入还原剂
(2)若在实验室中完成上述流程,操作①~④中属于过滤的是______(填序号).
(3)加入试剂甲后发生反应的离子方程式是______.
(4)在溶液B中加入过量烧碱溶液的目的是______. wdxwyy1年前1
wdxwyy1年前1 -
 juemingzi_1 共回答了16个问题
juemingzi_1 共回答了16个问题 |采纳率100%解题思路:SiO2和盐酸不反应,Fe2O3和氢氧化钠不反应而氧化铝能反应,该工艺流程原理为:铝土矿加入盐酸,得到滤液B中含有铝离子、铁离子,沉淀A为二氧化硅,B溶液加入过量为氢氧化钠溶液,除去铁离子,将铝离子转化为偏铝酸根,进入滤液C中,试剂乙为二氧化碳,将偏铝酸根转化为氢氧化铝沉淀,加热分解得氧化铝,
(1)工业上利用电解熔融的Al2O3 冶炼金属Al,注意需要加入冰晶石,降低Al2O3 的熔点;
(2)由工业流程可知,操作①、②、③是分离固体与液体,应是过滤,操作④是对沉淀氢氧化铝加热灼烧生成氧化铝;
(3)由工艺流程可知操作②加入过量的氢氧化钠溶液,所以滤液C含有AlO2-,操作①应加入盐酸,试剂甲应为盐酸,溶解Fe2O3、Al2O3,二氧化硅不溶解,通过过滤操作除去;
(4)由工业流程可知,溶液B中含有铝离子、铁离子,加入过量的氢氧化钠溶液,使铁离子转化为氢氧化铁沉淀,除去铁离子,将铝离子转化为偏铝酸根.(1)工业上利用电解熔融的Al2O3 冶炼金属Al,注意需要加入冰晶石,降低Al2O3 的熔点,
故答案为:a;
(2)由工业流程可知,操作①、②、③是分离固体与液体,应是过滤,操作④是对沉淀氢氧化铝加热灼烧生成氧化铝,
故答案为:①、②、③;
(3)由工艺流程可知,操作②加入过量的氢氧化钠溶液,所以滤液C含有AlO2-,操作①应加入盐酸,试剂甲应为盐酸,溶解Fe2O3、Al2O3,二氧化硅不溶解,通过过滤操作除去,氧化铝与酸反应离子方程式为Al2O3+6H+=2Al3++3H2O,氧化铁与盐酸反应离子方程式为Fe2O3+6H+=2Fe3++3H2O,
故答案为:Al2O3+6H+=2Al3++3H2O;Fe2O3+6H+=2Fe3++3H2O;
(4)由工业流程可知,溶液B中含有铝离子、铁离子,加入过量的氢氧化钠溶液,使铁离子转化为氢氧化铁沉淀,除去铁离子,将铝离子转化为偏铝酸根,
故答案为:将铁离子转化为氢氧化铁沉淀,除去铁离子,将铝离子转化为偏铝酸根.点评:
本题考点: 常见金属元素的单质及其化合物的综合应用;硅和二氧化硅.
考点点评: 本题以框图题形式考查铝、硅、铁的化合物的性质、常用化学用语的书写、物质的分离提纯等,难度中等,清楚工艺流程原理是解题的关键,是对知识迁移的综合运用.1年前查看全部
- 铝土矿的主要成分是Al2O3,请计算Al2O3中铝元素和氧元素的原子个数比是多少?
 ww之都1年前3
ww之都1年前3 -
 微风之晨 共回答了12个问题
微风之晨 共回答了12个问题 |采纳率100%解题思路:根据氧化铝化学式的含义进行分析解答即可.由氧化铝的化学式可知,1个氧化铝分子是由2个铝原子和3个氧原子构成的,铝元素和氧元素的原子个数比是2:3.
故答案为:2:3.点评:
本题考点: 化学式的书写及意义.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用化学式的含义进行分析问题、解决问题的能力.1年前查看全部
- 铝土矿是工业上用来冶炼铝的矿石,某铝厂为了测定某铝土矿中各成分的含量,做如下实验:准确称取6 g铝土矿(含Al
铝土矿是工业上用来冶炼铝的矿石,某铝厂为了测定某铝土矿中各成分的含量,做如下实验:准确称取6 g铝土矿(含Al 2 O 3 、Fe 2 O 3 、SiO 2 )样品,放入盛有100 mL H 2 SO 4 溶液的烧杯中,充分反应后过滤,除去不反应的SiO 2 ,向滤液中加入10 mol/L的NaOH溶液,产生沉淀的质量与加入NaOH溶液的体积(mL)的关系如图所示 
(1)试求H 2 SO 4 溶液中H 2 SO 4 的物质的量浓度。
(2)若b=2.75,则铝土矿中各成分质量百分含量分别是多少?
(3)b值的范围在____________之间,在这个范围内,b值越大,__________的含量越少。 haoren1233211年前1
haoren1233211年前1 -
 翠袖笼纱 共回答了22个问题
翠袖笼纱 共回答了22个问题 |采纳率81.8%(1)1.75 mol/L
(2)w(Al 2 O 3 )=85%、w (Fe 2 O 3 ) =10%、w(SiO 2 )=5%
(3)5>b>1.63;Fe 2 O 31年前查看全部
- (2011•烟台模拟)工业上用铝土矿(主要成分为Al2O3,还含有Fe2O3、SiO2)提取氧化铝做冶炼铝的原料,提取的
(2011•烟台模拟)工业上用铝土矿(主要成分为Al2O3,还含有Fe2O3、SiO2)提取氧化铝做冶炼铝的原料,提取的操作过程如下:
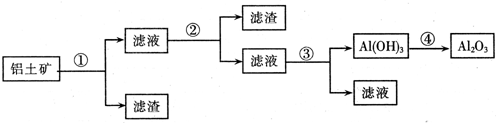
可供选择的试剂:稀盐酸、NaOH溶液、稀氨水,CO2等
请写出你所设计的方案中各反应的化学方程式.
①______;
②______;
③______;
④2Al(OH)3
Al2O3+3H2O△ .2Al(OH)3.
Al2O3+3H2O△ . 人事厅1年前1
人事厅1年前1 -
 来来往 共回答了18个问题
来来往 共回答了18个问题 |采纳率94.4%解题思路:氧化铝是两性氧化物,既溶液强酸又溶于强碱.只Fe2O3溶于强酸,不溶于碱,SiO2只溶于强碱,不溶于酸.
若①为盐酸时,则在①得到滤液中含有铝离子、铁离子,滤渣为二氧化硅.②为氢氧化钠溶液,除去铁离子,将铝离子转化为偏铝酸根,进入②得到滤液.试剂③为二氧化碳,将偏铝酸根转化为氢氧化铝沉淀.加热分解得氧化铝;
若①为氢氧化钠时,则在①得到滤液中含有偏铝酸根离子、硅酸根离子,滤渣为氧化铁.②为盐酸,除去硅酸根离子,将偏铝酸根离子转化为铝离子,进入②得到滤液.试剂③为氨水,将铝离子转化为氢氧化铝沉淀.加热分解得氧化铝.方案一:若①为盐酸,则在①得到滤液中含有铝离子、铁离子,滤渣为二氧化硅.②为氢氧化钠溶液,除去铁离子,将铝离子转化为偏铝酸根,进入②得到滤液.试剂③为二氧化碳,将偏铝酸根转化为氢氧化铝沉淀.加热分解得氧化铝.
①氧化铝与盐酸反应生成氯化铝和水,反应方程式为Al2O3+6HCl═2AlCl3+3H2O,
氧化铁与盐酸反应生成氯化铁与水,反应方程式为 Fe2O3+6HCl═2Fe2Cl3+3H2O.
故答案为:Al2O3+6HCl═2AlCl3+3H2O,Fe2O3+6HCl═2Fe2Cl3+3H2O;
②氯化铝与氢氧化钠反应生成四羟基合铝酸钠与氯化钠,反应方程式为AlCl3+4NaOH═Na〔Al(OH)4〕+3NaCl,
氯化铁与氢氧化钠反应生成氢氧化铁和氯化钠,反应方程式为 FeCl3+3NaOH═Fe(OH)3↓+3NaCl.
故答案为:AlCl3+4NaOH═Na〔Al(OH)4〕+3NaCl,FeCl3+3NaOH═Fe(OH)3↓+3NaCl;
③四羟基合铝酸钠溶液与二氧化碳反应,生成氢氧化铝和碳酸氢钠,反应方程式为Na〔Al(OH)4〕+CO2═Al(OH)3↓+NaHCO3,
故答案为:Na〔Al(OH)4〕+CO2═Al(OH)3↓+NaHCO3;
④氢氧化铝加热分解生成氧化铝和水,反应方程式为2Al(OH)3
△
.
Al2O3+3H2O,
故答案为:2Al(OH)3
△
.
Al2O3+3H2O.
(或若①为氢氧化钠溶液,则在①得到滤液中含有偏铝酸根离子、硅酸根离子,滤渣为氧化铁.②为盐酸,除去硅酸根离子,将偏铝酸根离子转化为铝离子,进入②得到滤液.试剂③为氨水,将铝离子转化为氢氧化铝沉淀.加热分解得氧化铝.
①Al2O3+2NaOH+3H2O═2Na〔Al(OH)4〕、SiO2+2NaOH═Na2SiO3+H2O;
②Na〔Al(OH)4〕+4HCl═AlCl3+NaCl+4H2O、Na2SiO3+2HCl═H2SiO3↓+2NaCl;
③AlCl3+3NH3•H2O═Al(OH)3↓+3NH4Cl;④2Al(OH)3═Al2O3+3H2O.)点评:
本题考点: 镁、铝的重要化合物;硅和二氧化硅;铁的氧化物和氢氧化物.
考点点评: 本题以框图题形式考查铝的化合物的性质,难度中等,清楚提取的操作过程原理,是对知识迁移的综合运用,1年前查看全部
- 工业上冶炼铝的原料是铝土矿(主要成份为Al2O3,杂质为Fe2O3、SiO2等).某研究小组设计的提纯Al2O3的操作过
工业上冶炼铝的原料是铝土矿(主要成份为Al2O3,杂质为Fe2O3、SiO2等).某研究小组设计的提纯Al2O3的操作过程如下:

已知:(1)Al(OH)3+NaOH=NaAlO2+2H2O;
(2)Al(OH)3、Fe(OH)3常温下均为难溶于水的固体.
请回答下列问题:
(1)操作Ⅱ名称是______.
(2)写出步骤①中发生反应的化学方程式(任写一个)______.
(3)写出滤液乙中含有的溶质的化学式______.
(4)步骤③中通入过量二氧化碳发生的化学反应方程式为:NaAlO2+CO2+2H2O=Al(OH)3↓+______.
(5)写出滤液丙中某种溶质在日常生活中的一种用途______. zqy8711101年前1
zqy8711101年前1 -
 -彼岸花开- 共回答了21个问题
-彼岸花开- 共回答了21个问题 |采纳率85.7%解题思路:(1)根据过滤是分离固体不溶物和液体的一种分离混合物的基本操作解答;
(2)根据氧化铝和稀盐酸反应生成氯化铝和水书写;
(3)根据氢氧化钠和稀盐酸反应生成氯化钠和水,氢氧化钠和氢氧化铝反应生成NaAlO2,还有剩余的氢氧化钠分析解答;
(4)根据质量守恒定律分析解答;
(5)根据碳酸氢钠的性质和用途分析解答.(1)氢氧化铝不溶于水,所以操作Ⅱ是为了分离氢氧化铝和滤液丙,故答案:过滤;
(2)氧化铝和稀盐酸反应生成氯化铝和水,反应的化学方程式为Al2O3+6HCl=2AlCl3+3H20,故答案:Al2O3+6HCl=2AlCl3+3H20;
(3)氢氧化钠和稀盐酸反应生成氯化钠和水,氢氧化钠和氢氧化铝反应生成NaAlO2,还有剩余的氢氧化钠,故答案:NaAlO2;NaOH;NaCl;
(4)反应前钠原子1个,铝原子一个,氧原子6个,氢原子一个;反应后氢氧化铝中一个铝原子、三个氢原子、三个氧原子,所以未知的这种物质的一个分子中含有一个钠原子、一个氢原子、一个碳原子、三个氧原子,故该物质为碳酸氢钠,化学式为NaHCO3;故答案为:NaHCO3.
(5)碳酸氢钠和稀盐酸反应生成氯化钠、水和二氧化碳,所以碳酸氢钠可治疗胃酸过多,故答案:治疗胃酸过多.点评:
本题考点: 混合物的分离方法;酸的化学性质;碱的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题以信息题的形式考查了常见化合物的性质,抓住题中的信息才能理清思路,掌握物质的性质是解题的关键.1年前查看全部
- 在线求指导:实验室中以铝土矿(主
在线求指导:实验室中以铝土矿(主
实验室中以铝土矿(主要成分是Al 2 O 3 和少量的SiO 2 和Fe 2 O 3 杂质)为原料制取Al 2 (SO 4 ) 3 和铵明矾晶体[NH 4 Al(SO 4 ) 2 ·12H 2 O]的工艺流程如下: 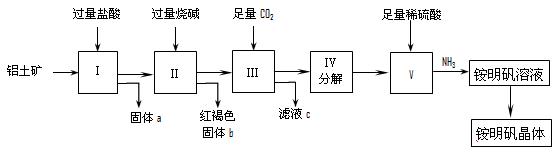
试回答下列问题:
⑴固体a的化学式为_____,III中通入过量CO 2 气体的离子方程式为____________ .
⑵由V制取铵明矾溶液的化学方程式为_________________,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)________ 、冷却结晶、过滤洗涤.
⑶以1000kg含氧化铝36%的铝土矿为原料制取Al 2 (SO 4 ) 3 ,需消耗质量分数98%的硫酸(密度1.84g/cm 3 )___________L(保留一位小数).
⑷若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量.若欲使制得的铵明矾和硫酸铝的物质的量之比为1:1,则投料时铝土矿中Al 2 O 3 和H 2 SO 4 的物质的量之比为___________. platina-pastern1年前1
platina-pastern1年前1 -
 卷云山上 共回答了17个问题
卷云山上 共回答了17个问题 |采纳率88.2%⑴SiO 2 ; AlO 2 - +CO 2 +2H 2 O ==HCO 3 - +Al(OH) 3 ↓
⑵Al 2 (SO 4 ) 3 + H 2 SO 4 + 2NH 3 ==2NH 4 Al(SO 4 ) 2 ; 蒸发浓缩
⑶575.4L
⑷3:101年前查看全部
- 无水AlCl3易升华,可用作有机合成的催化剂等.工业上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流
无水AlCl3易升华,可用作有机合成的催化剂等.工业上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下.
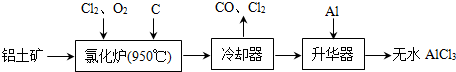
(1)氯化炉中Al2O3、C12和C反应的化学方程式为A12O3+3C12+3C
2A1C13+3CO高温 .A12O3+3C12+3C.
2A1C13+3CO高温 .
(2)用Na2SO3溶液可除去冷却器排出尾气中的Cl2,此反应的离子方程式为:______.
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是______.
(4)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16.25g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32g.
①写出除杂过程中涉及的离子方程式:______、______.
②AlCl3产品的纯度为______.
(5)工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl3•6H2O脱水制备无水AlCl3,实现这一步的方法是______. longhw1年前1
longhw1年前1 -
 我是spy 共回答了26个问题
我是spy 共回答了26个问题 |采纳率92.3%解题思路:(1)根据工艺流程可知升华器中含有AlCl3等,所以Al2O3、C12和C反应会生成A1C13,由冷凝器尾气可知还会生成CO;
(2)Cl2有强氧化性,将SO32-氧化为SO42-,自身被还原为2C1-;
(3)升华器中主要含有AlCl3和FeCl3,FeCl3熔点、沸点较低,升华制备无水AlCl3,应除去FeCl3;
(4)制备无水AlCl3含有杂质FeCl3,残留固体质量为0.32g为Fe2O3,根据铁原子守恒计算FeCl3质量,进而计算出AlCl3的质量,再根据产品的纯度定义计算.
(5)将AlCl3•6H2O脱水制备无水氯化铝可在HCl气流中加热脱结晶水(1)根据工艺流程可知氯化炉的产物,经冷却、升华可制备无水AlCl3,说明氯化炉的产物中含有A1C13,冷凝器尾气含有CO,所以Al2O3、C12和C反应,生成A1C13和CO,反应方程式为A12O3+3C12+3C
高温
.
2A1C13+3CO
(2)Cl2有强氧化性,将SO32-氧化为SO42-,自身被还原为2C1-.反应离子方程式为SO32-+C12+H2O═SO42-+2C1-+2H+
(3)升华器中主要含有AlCl3和FeCl3,FeCl3熔点、沸点较低,升华制备无水AlCl3,应除FeCl3去.所以加入少量Al目的是除去FeCl3,
(4)①除杂过程中铁离子与氢氧根离子结合成氢氧化铁沉淀,铝离子与氢氧根离子结合成偏铝酸根和水,离子方程式为:Fe3++3OH-=Fe(OH)3↓Al3++4OH-=AlO2-+2H2O
②根据铁原子守恒,令含有杂质FeCl3质量为m,则
Fe2O3~~~~~2FeCl3
160 325
0.32g m
[160/0.32g=
325
m]
解得,m=0.65g,
所以AlCl3产品的纯度为[16.25g−0.65g/16.25g]×100%=96%,
(5)将AlCl3•6H2O脱水制备无水氯化铝可在HCl气流中加热脱结晶水
故答案为:(1)A12O3+3C12+3C
高温
.
2A1C13+3CO
(2)SO32-+C12+H2O=SO42-+2C1-+2H+(3)除去FeCl3
(4)①Fe3++3OH-=Fe(OH)3↓Al3++4OH-=AlO2-+2H2O ②96%
(5)在HCl气流中加热脱结晶水点评:
本题考点: 物质的相互转化和制备.
考点点评: 本题考查了考生对自己存储的知识,进行分解、迁移转换、重组,使问题得到解决的应用能力,体现出化学是真实的.能够通过对生产、生活和科学实验中化学现象以及相关数据和图形等的观察,获取有关的感性知识和印象,并运用分析、比较、归纳等方法对所获取的信息进行初步加工和应用的能力.1年前查看全部
- 工业上用铝土矿(主要成分为Al 2 O 3 ,杂质为Fe 2 O 3 和SiO 2 )为原料冶炼铝的工艺流程之一为:
工业上用铝土矿(主要成分为Al 2 O 3 ,杂质为Fe 2 O 3 和SiO 2 )为原料冶炼铝的工艺流程之一为:
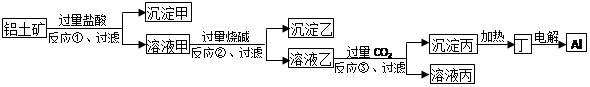
下列叙述不正确的是( )A.沉淀甲为SiO 2 B.生成沉淀乙的反应为:Fe 3+ +3OH - =Fe(OH) 3 ↓ C.溶液乙中含有AlO 2 - D.反应③为:2AlO 2 - +CO 2 +3H 2 O=2Al(OH) 3 ↓+CO 3 2-  braudelk1年前1
braudelk1年前1 -
 雪千亭 共回答了20个问题
雪千亭 共回答了20个问题 |采纳率100%D
1年前查看全部
- 工业上用铝土矿(成分为氧化铝、氧化铁)制取铝的过程如下: 请回答下列问题:
工业上用铝土矿(成分为氧化铝、氧化铁)制取铝的过程如下: 
请回答下列问题:
(1)水蒸气的作用__________________。
(2)沉淀C的化学式为________,该物质除了用于金属冶炼以外,还可用作________。
(3)操作I、操作II、操作III都用到的玻璃仪器是有________________。
(4)实验室洗涤Al(OH) 3 沉淀应该如何操作:_______________________。
(5)生产过程中,除NaOH、H 2 O可以循环使用外,还可以循环使用的物质有________(填化学式)。用此法制取铝的副产品是________(填化学式)。 粉色的翅膀1年前1
粉色的翅膀1年前1 -
 cabbage007 共回答了16个问题
cabbage007 共回答了16个问题 |采纳率100%(1)加热加快反应
(2)Fe 2 O 3 ;颜料;
(3)烧杯、漏斗、玻璃棒;
(4)用玻璃棒引流向过滤器中加水浸没沉淀,滤去洗液后,反复2到3次即可;
(5)CaO和CO 2 ;Fe 2 O 3 和O 2 ;1年前查看全部
- 6.工业上以铝土矿(主要成分Al2O3·3H2O)为原料生产铝,主要包括下列过程:
6.工业上以铝土矿(主要成分Al2O3·3H2O)为原料生产铝,主要包括下列过程:
(1)将铝土矿中的氧化铝水合物溶解在氢氧化钠溶液中;
(2)通入二氧化碳使(1)所得溶液中析出氢氧化铝固体
(3)使氢氧化铝脱水生成氧化铝;
(4)电解熔融氧化铝生成铝
请写出上述各有关反应的化学方程式,并推测哪一步转化过程消耗的能量最多,为什么?
 火V之舞1年前1
火V之舞1年前1 -
 bluefinky 共回答了24个问题
bluefinky 共回答了24个问题 |采纳率95.8%1.Al2O3+2NaOH=2NaAlO2+H2O
2.NaAlO2+CO2+2H2O=NaHCO3+Al(OH)3↓
3.2Al(OH)3=△=Al2O3+3H2O
4.2Al2O3=通电=4Al+3O2↑
4消耗的能量最多,4需要通电电解,而且熔融的氧化铝需要加热到高温熔化,耗能最多.1年前查看全部
- 工业上从铝土矿(含氧化铝、氧化铁等)制取铝的部分流程如下:
工业上从铝土矿(含氧化铝、氧化铁等)制取铝的部分流程如下:

滤液经处理得到Al2O3,再电解得到Al:2Al2O3
4Al+3O2↑经分析原料和残渣的部分成分见下表:电解 .
已知铝土矿中Fe2O3全部转入赤泥,则:Al2O3 Fe2O3 铝土矿 55% 16% 赤泥 15% 48%
(1)生产中每消耗1t铝土矿,将产生多少t赤泥?
(2)若由滤液到制得产品铝的过程中原料均没有损失,则整个生产过程中Al2O3的转化率为多少?
(3)每炼出1t铝理论上需铝土矿的质量为多少t? a1151年前1
a1151年前1 -
 不要爱情爱我 共回答了20个问题
不要爱情爱我 共回答了20个问题 |采纳率95%解题思路:(1)计算铝土矿中氧化铁的质量,反应中Fe2O3的质量不变,结合赤泥中氧化铁的质量分数,进而计算赤泥的质量;
(2)计算铝土矿中氧化铝的质量,再计算赤泥中氧化铝的质量,进而计算整个生产过程中Al2O3的转化率;
(3)根据方程式计算生成1t铝需要氧化铝的质量,结合氧化铝的转化率计算铝土矿中氧化铝的总质量,结合其质量分数计算铝土矿的质量.(1)1t铝土矿中氧化铁的质量为1t×16%,
赤泥中氧化铁的质量分数为48%,反应中Fe2O3的质量不变,
则赤泥的质量为:[1t×16%/48%]=[1/3]t,
答:生产中每消耗1t铝土矿,将产生赤泥[1/3]t;
(2)1t铝土矿中氧化铝的质量为1t×55%,赤泥中氧化铝的质量为[1/3]t×15%,
故氧化铝的转化率为:[(1t×55%)-([1/3]t×15%)]÷1t×55%=90.9%,
答:整个生产过程中Al2O3的转化率为90.9%;
(3)设生成1t铝需要氧化铝的质量为x,则:
2Al2O3
电解
.
4Al+3O2↑
204 108
x 1t
故x=[204/108]t
故铝土矿中氧化铝的质量为[204/108]t÷90.9%=2.078t
故需要铝土矿的质量为2.078t÷55%=3.78t
答:每炼出1t铝理论上需铝土矿的质量为3.78t.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查混合物计算、化学方程式有关计算,难度中等,关键是明确整个过程中氧化铁的质量不变.1年前查看全部
- 铝土矿制取铝的问题..
 _ll1年前1
_ll1年前1 -
 huwandao 共回答了14个问题
huwandao 共回答了14个问题 |采纳率92.9%C就是Fe2O3
因为Fe2O3不与NAOH H20反应1年前查看全部
- 铝土矿制取铝 可循环利用的物质除了NaoH H2O 还有啥?
 kejonia1年前1
kejonia1年前1 -
 玩世英雄 共回答了24个问题
玩世英雄 共回答了24个问题 |采纳率91.7%二氧化碳和氧化钙1年前查看全部
- 氧化还原反应?下列工业制备物质的过程中,无氧化还原反应发生的是,.A,合成氨 B,从铝土矿中获得铝 c,玻璃制备 C,从
氧化还原反应?
下列工业制备物质的过程中,无氧化还原反应发生的是,.A,合成氨 B,从铝土矿中获得铝 c,玻璃制备 C,从海水中获得氯气
 那些爆笑的日子1年前1
那些爆笑的日子1年前1 -
 ren314752090 共回答了11个问题
ren314752090 共回答了11个问题 |采纳率90.9%C是复分解反应
A是由N2和H2合成NH3,肯定是氧化还原
B是金属的冶炼,由化合物变单质也肯定是氧化还原
D是由氯化物变Cl2单质,也是!1年前查看全部
- 从铝土矿中提取铝涉及到的方程式 ①溶解②酸化③灼烧④电解
 pppyyy00331年前2
pppyyy00331年前2 -
 drunkard123 共回答了23个问题
drunkard123 共回答了23个问题 |采纳率78.3%Al2O3 + 2NaOH + 3H2O == 2Na[Al(OH)4]
Na[Al(OH)4] + HCl = NaCl + Al(OH)3↓
2Al(OH)3 ==Al2O3 + 3H2O
2Al2O3 ==通电== 4Al +3O2↑1年前查看全部
- 铝土矿的主要成分是Al2O3,含有Fe2O3、SiO2等杂质,按下列操作从铝土矿中提取Al2O3.回答下列问题:
铝土矿的主要成分是Al2O3,含有Fe2O3、SiO2等杂质,按下列操作从铝土矿中提取Al2O3.回答下列问题:
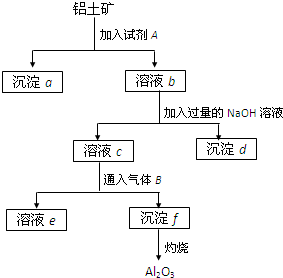
(1)沉淀物的化学式分别是:a______;d______;f______.
(2)溶液b中所含的金属阳离子是______;溶液c中所含的酸根离子是______.
(3)加入的试剂A是______,通入的气体B是______,能否将B换成A?其理由是______. manicurist_nail1年前1
manicurist_nail1年前1 -
 yaliantec 共回答了19个问题
yaliantec 共回答了19个问题 |采纳率78.9%解题思路:SiO2和盐酸不反应,Fe2O3和氢氧化钠不反应而氧化铝能,该工艺流程原理为:铝土矿加入试剂A盐酸,得到滤液b中含有铝离子、铁离子,沉淀a为二氧化硅,b溶液加入过量为氢氧化钠溶液,除去铁离子,将铝离子转化为偏铝酸根,进入滤液c中,气体B为二氧化碳,将偏铝酸根转化为氢氧化铝沉淀,加热分解得氧化铝,
(1)根据以上推断写出沉淀的化学式;
(2)铝土矿加入试剂A盐酸,得到滤液b中含有铝离子、铁离子,滤液c中含有偏铝酸根离子、氯离子和过量的氢氧化钠;
(3)试剂A为盐酸,气体B为二氧化碳,不能够用盐酸代替二氧化碳,根据氢氧化铝能够溶解于盐酸分析.SiO2和盐酸不反应,Fe2O3和氢氧化钠不反应而氧化铝能,该工艺流程原理为:铝土矿加入试剂A盐酸,得到滤液b中含有铝离子、铁离子,沉淀a为二氧化硅,b溶液加入过量为氢氧化钠溶液,除去铁离子,沉淀d为氢氧化铁,将铝...
点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题以框图题形式考查铝、硅、铁的化合物的性质、常用化学用语的书写、物质的分离提纯等,难度中等,清楚工艺流程原理是解题的关键,是对知识迁移的综合运用.1年前查看全部
- 铝土矿制铝里面的化学方程式是什么?主要是如何去除二氧化硅和氧化铁杂质
 燃情丛林1年前1
燃情丛林1年前1 -
 jsyyct 共回答了24个问题
jsyyct 共回答了24个问题 |采纳率87.5%SiO2与强碱或强酸是很难反应的.现利用盐酸、氢氧化钠溶液、氨气、二氧化碳和水从铝土矿中提取纯净的Al2O3
Al2O3+2NaOH 2NaAlO2+H2O
NaAlO2+CO2+2H2O Al(OH)3 +NaHCO3+2Al(OH)3 Al2O3+3H2O1年前查看全部
- 工业上用铝土矿制取铝的过程如下工业上用铝土矿(含氧化铝、氧化铁)制取铝的过程如下:请回答下列问题:
 angela_yy1年前1
angela_yy1年前1 -
 因为有你在 共回答了20个问题
因为有你在 共回答了20个问题 |采纳率85%虽然不知道你到底想问什么,但是制取铝的最终一步一定是在以冰晶石为载体电解熔融氧化铝,氧化铁作为杂质一般是用铝热法除去,如还有问题请继续1年前查看全部
- 若哈尔滨地铁工程需要铝合金108吨(含铝95%),在炼铝过程中,共损失铝5%,则需含氧化铝质量分数为60%的铝土矿质量为
若哈尔滨地铁工程需要铝合金108吨(含铝95%),在炼铝过程中,共损失铝5%,则需含氧化铝质量分数为60%的铝土矿质量为多少吨?只允许用初中范围内的知识,并写出用到的方程式,
 飘的风-是我1年前1
飘的风-是我1年前1 -
 我不是nn王 共回答了19个问题
我不是nn王 共回答了19个问题 |采纳率89.5%X×60%(1-5%)=108×95%
60%X=108
X=180
需含氧化铝质量分数为60%的铝土180吨1年前查看全部
- 170t含氧化铝80%的铝土矿,理论上可炼出金属铝多少吨
 dsfsd7581年前2
dsfsd7581年前2 -
 还是买不起钻戒 共回答了16个问题
还是买不起钻戒 共回答了16个问题 |采纳率87.5%72t1年前查看全部
- 170t含氧化铝80%的铝土矿,理论上可炼出金属铝多少吨啊
 rrpzc1年前2
rrpzc1年前2 -
 feie3 共回答了18个问题
feie3 共回答了18个问题 |采纳率88.9%Al2O3 -------- ----2Al
102 54
170 t*80% m
m=72t1年前查看全部
- 铝土矿(主要成分Al2O3*XH2O和少量Fe2O3,SiO2等)提取纯Al2O3作炼铝的原料,提取时操作如下:
铝土矿(主要成分Al2O3*XH2O和少量Fe2O3,SiO2等)提取纯Al2O3作炼铝的原料,提取时操作如下:
铝 (1)加过量盐酸┌——不溶物
土————————│ (2)加过量NaOH溶液┌—沉淀 加热
矿 过滤 └——滤液A ————————————│ (3)┌—沉淀———氧化铝
过滤 └—滤液B———│ 灼烧
过滤└—滤液
1写出滤液A中一种溶质与过量NaOH溶液反应而进入滤液B中的离子方程式为—————
2在实验(1)中除去铝土矿中的————;在实验(2)中,除去铝土矿中的————;在实验(3)中应加入的是————,其反应的离子方程式为————.
3若实验(1)中不过滤,对后面的操作将产生什么影响?—————— hxh20081年前1
hxh20081年前1 -
 deppcai 共回答了16个问题
deppcai 共回答了16个问题 |采纳率93.8%1:Al3++4OH-==2H2O+AlO2-
2:(1)SiO2(2)Fe2O3(3)氨水 Al3++3OH-==Al(OH)3
3:生成硅酸钠1年前查看全部
- 铝土矿提取铝的过程中,怎么除去SiO2?
铝土矿提取铝的过程中,怎么除去SiO2?
有没有具体的方程式?
是先加氢氧化钠溶液的情况下 始族该隐1年前2
始族该隐1年前2 -
 endstart0011 共回答了13个问题
endstart0011 共回答了13个问题 |采纳率76.9%先加NaOH溶液,也就是利用Al2O3和SiO2都有酸性氧化物的性质这一点.
2NaOH+SiO2=Na2SiO3+H2O
Al2O3+2NaOH=2NaAlO2+H20
接着通入过量CO2,这回利用的是Al的碱性,Si没有两性,所以不能反应.
CO2+2H20+NaAlO2=NaHCO3+Al(OH)3↓
单单解答这个题目,就是这个过程,但是我认为,更重要的是要了解整个过程,整体了解了,局部也就好掌握了,因此,虽然楼上的答案很多是抄抄过来的,虽然他回答的有点文不对题(把额外的也放进去了),但是作为知识点来讲,从复习角度讲,楼上的答案应该更有帮助.当然,考试的时候不要这样回答就好.1年前查看全部
- 铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得.铝土矿的主要成分是
铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得.铝土矿的主要成分是
Al2O3和SiO2等.从铝土矿中提炼Al2O3的流程如下: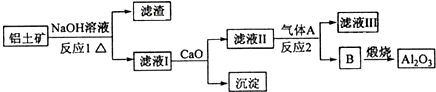
已知:CaO+Na2SiO3+H2O→CaSiO3↓+2NaOH
完成下列填空:
(1)写出流程中反应1的化学方程式______,
(2)流程中反应2的离子方程式为______. 4576246851年前1
4576246851年前1 -
 yunyunly 共回答了14个问题
yunyunly 共回答了14个问题 |采纳率78.6%解题思路:(1)铝土矿的主要成分是Al2O3和SiO2等,与NaOH反应分别为:Al2O3+2NaOH=2NaAlO2+H2O;SiO2+2NaOH=Na2SiO3+H2O;
(2)反应1的滤液中含有NaAlO2和Na2SiO3加入CaO,Na2SiO3变为CaSiO3沉淀,故滤液Ⅱ中的溶质为NaAlO2,通入A生成B,B煅烧生成Al2O3,故B为Al(OH)3,气体A应该为CO2,发生反应为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.(1)铝土矿的主要成分是Al2O3和SiO2等,与NaOH反应:Al2O3+2NaOH=2NaAlO2+H2O;SiO2+2NaOH=Na2SiO3+H2O;
故答案为:Al2O3+2NaOH=2NaAlO2+H2O;SiO2+2NaOH=Na2SiO3+H2O;
(2)反应1的滤液中含有NaAlO2和Na2SiO3加入CaO,Na2SiO3变为CaSiO3沉淀,故滤液Ⅱ中的溶质为NaAlO2,通入A生成B,B煅烧生成Al2O3,故B为Al(OH)3,反应Ⅱ为:NaAlO2生成Al(OH)3的反应,故气体A应该为CO2,发生反应为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-;
故答案为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.点评:
本题考点: 镁、铝的重要化合物.
考点点评: 本题考查化学工艺流程、无机物推断等,化合物的性质是解题的关键.1年前查看全部
- 铝土矿(氧化铝,氧化铁,二氧化硅)的酸溶法中,先加盐酸,氧化铝氧化铁溶解,再加强碱氢氧化钠铁离子
铝土矿(氧化铝,氧化铁,二氧化硅)的酸溶法中,先加盐酸,氧化铝氧化铁溶解,再加强碱氢氧化钠铁离子
沉淀,铝离子变成偏铝酸根,这部反应条件是加热?为什么?跪求名师指导 lzq16011年前1
lzq16011年前1 -
 hzmicky 共回答了18个问题
hzmicky 共回答了18个问题 |采纳率94.4%铝土矿中的氧化铝和氧化铁分阿尔法型和拜它型,其构型决定它的活性,在120~160°C的状况下,或加压0.4MPa.铝土矿的活性得到激活,容易和盐酸发生反应,从而被溶出,形成铝盐聚合物,(如聚合氯化铝,聚合硫酸铁等).1年前查看全部
- 工业上用铝土矿为原料生产铝,完成下列问题.
工业上用铝土矿为原料生产铝,完成下列问题.
生产流程如图
(1):物质A、B、C、D、E、F分别是什么?
(2):试剂甲、乙分别是什么?并写出各试剂发生的化学反应的方程式.
(3):操作1、2、3、4分别是什么?

 jiajia34681年前1
jiajia34681年前1 -
 chenmaochun 共回答了13个问题
chenmaochun 共回答了13个问题 |采纳率100%(1)A 二氧化硅 B 氯化铝 氯化铁 盐酸 C 偏铝酸钠 氯化钠 氢氧化钠D 氢氧化铁E 氯化钠 碳酸氢钠F 氢氧化铝(2)试剂甲 盐酸 盐酸分别和氧化铁、氧化铝反应试剂乙 二氧化碳 偏铝酸钠+二氧化碳+2水=氢氧化铝+碳酸氢...1年前查看全部
- (2012•崇安区二模)工业上用铝土矿(含氧化铝、氧化铁)制取铝的过程如下:
(2012•崇安区二模)工业上用铝土矿(含氧化铝、氧化铁)制取铝的过程如下:
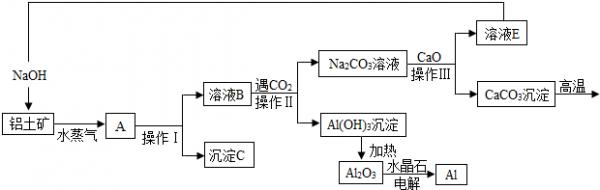
[查阅资料](1)氧化铝和氢氧化钠溶液能发生化学反应,而氧化铁不能和氢氧化钠反应
(2)2NaOH+Al2O3═2NaAlO2+H2O
请根据上述流程提供的信息回答下列问题:
(1)操作Ⅱ的名称是______.
(2)沉淀C的化学式是______,实验室用盐酸将其溶解得到______色的溶液.
(3)生产过程中,除H2O可以循环使用外,还可以循环使用的物质有______.
A.二氧化碳B.氧化钙C.氢氧化钠
(4)写出溶液B和二氧化碳发生反应的化学方程式______. zhengy19791年前1
zhengy19791年前1 -
 HI123ABC 共回答了10个问题
HI123ABC 共回答了10个问题 |采纳率80%解题思路:(1)固液分离用过滤;
(2)根据氧化铝能与氢氧化钠反应,氧化铁与氢氧化钠不反应解答
(3)根据生产流程图中的物质,找出反应物与生成物,然后分析生成物中的物质被用作反应物的即为可循环利用的物质.
(4)根据二氧化碳与偏铝酸钠反应的生成物及书写方程式原则写出化学方程式(1)操作Ⅱ分离溶液和沉淀的操作,是过滤
(2)A12O3、Fe2O3中加入浓的氢氧化钠溶液时,其中的A12O3会与之发生反应分别生成偏铝酸钠的水溶液,即为滤液B,所以沉淀C主要是Fe2O3,氧化铁与盐酸反应生成氯化铁溶液,呈黄色.
(3)生产过程中生成的物质,可再次被利用的即可为循环物质,氢氧化钠、二氧化碳及氧化钙都是可循环利用的物质.
(4)溶液B中的成分是偏铝酸钠,与二氧化碳反应生成碳酸钠和氢氧化铝,化学方程式为:
2NaAlO2+3H2O+CO2═Na2CO3+2Al(OH)3↓
故答案为:(1)过滤
(2)氧化铁(Fe2O3)黄色
(3)ABC(4)2NaAlO2+3H2O+CO2═Na2CO3+2Al(OH)3↓点评:
本题考点: 物质的相互转化和制备;过滤的原理、方法及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题是一道信息题,铝及铝的化合物知识初中没有讲解,对于学生来说知识迁移难度较大.可根据图示中物之间的反应情况对相关的问题进行探讨分析.1年前查看全部
- 10.(4分)现代生活离不开铝.工业上以铝土矿为原料生产铝. (1)将一定
10.(4分)现代生活离不开铝.工业上以铝土矿为原料生产铝. (1)将一定
10.(4分)现代生活离不开铝.工业上以铝土矿为原料生产铝.
(1)将一定量某铝土矿样品(主要成分Al2O3)溶于过量稀盐酸并制成500 mL溶液.取100 mL该溶液,测得其中含有H+、Cl-、Mg2+、Al3+、Fe3+五种离子(不考虑其它离子).已知部分离子的物质的量浓度:
c (H+) = 0.02 mol / L c (Mg2+) = 0.01 mol / L
c (Fe3+) = 0.02 mol / L c (Cl-) = 0.52 mol / L
则该铝土矿样品中Al2O3的质量为 g(精确至0.01).
已经求出AL3+浓度为0.14mol/L,然后该怎么算呢. earygtd1年前1
earygtd1年前1 -
 北岩南飞 共回答了17个问题
北岩南飞 共回答了17个问题 |采纳率88.2%就用比例,用物质的量来回比就出来了1年前查看全部
- 铝硅酸钠的化学式铝土矿中的二氧化硅、三氧化二铝与氢氧化钠反应会生成难溶的铝硅酸钠
 神经兔1年前1
神经兔1年前1 -
 小小旭 共回答了21个问题
小小旭 共回答了21个问题 |采纳率90.5%Na20·Al2O3·2SiO2·nH2O1年前查看全部
- 工业从铝土矿(主要成分是Al2O3•xH2O、SiO2、Fe2O3等)提取纯Al2O3做冶炼铝的原料,提取时操作过程如图
工业从铝土矿(主要成分是Al2O3•xH2O、SiO2、Fe2O3等)提取纯Al2O3做冶炼铝的原料,提取时操作过程如图,图中操作错误的是( )

A. ④⑤
B. ③④
C. ②⑤
D. ①② onisho1年前1
onisho1年前1 -
 如果一生 共回答了19个问题
如果一生 共回答了19个问题 |采纳率73.7%解题思路:铝土矿灼烧除去结晶水,灼热后的不挥发物质中加入过量的盐酸,Al2O3、Fe2O3溶解成铝盐、铁盐,过滤除去不溶的杂质二氧化硅等,溶液中含有过量的盐酸,向②的滤液中加入过量氢氧化钠使铝盐变成偏铝酸盐,而铁离子转化为氢氧化铁沉淀,过滤除去,滤液中含有过量的氢氧化钠,向③的滤液中加入过量盐酸,溶液中偏铝酸根、氢氧化钠转化为氯化铝、氯化钠,溶液溶质为氯化铝、氯化钠,不能生成氢氧化铝沉淀,应通入二氧化碳,可得氢氧化铝沉淀,氢氧化铝沉淀灼热分解生成氧化铝.如果把第二步的盐酸换成氢氧化钠 那溶解的只有氧化铝,变成偏铝酸盐,去掉步骤③,然后进行第四第五步就行了.铝土矿灼烧除去结晶水,灼热后的不挥发物质中加入过量的盐酸,Al2O3、Fe2O3溶解成铝盐、铁盐,过滤除去不溶的杂质二氧化硅等,溶液中含有过量的盐酸,向②的滤液中加入过量氢氧化钠使铝盐变成偏铝酸盐,而铁离子转化为氢氧化铁沉淀,过滤除去,滤液中含有过量的氢氧化钠,向③的滤液中加入过量盐酸,溶液中偏铝酸根、氢氧化钠转化为氯化铝、氯化钠,溶液溶质为氯化铝、氯化钠,不能生成氢氧化铝沉淀,应通入二氧化碳,可得氢氧化铝沉淀,故④错误,
氢氧化铝沉淀灼热分解生成氧化铝,干燥不能使氢氧化铝分解,故⑤错误.
故选:A.点评:
本题考点: 镁、铝的重要化合物;制备实验方案的设计.
考点点评: 考查学生对工艺流程的理解、元素化合物性质等,难度中等,掌握元素化合物的性质是关键.1年前查看全部
- 无水AlCl3可用作有机合成的催化剂、食品膨松剂等.工业上由铝土矿(主要成分是A12O3和Fe2O3)和石油焦(主要成分
无水AlCl3可用作有机合成的催化剂、食品膨松剂等.工业上由铝土矿(主要成分是A12O3和Fe2O3)和石油焦(主要成分是C)按如图所示流程进行一系列反应来制备无水AlCl3.
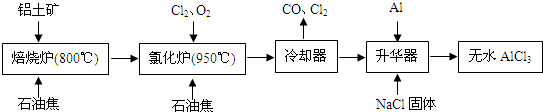
(1)AlCl3是______晶体.
(2)化炉中Al2O3、C12和C反应的化学方程式是A12O3+3C12+3C
2A1C13+3CO高温 .A12O3+3C12+3C.
2A1C13+3CO高温 .
(3)冷却器排出的尾气中含有大量CO和少量Cl2,需用Na2SO3溶液除去Cl2,写出此反应的离子方程式是______.
(4)华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是______.
(5)为测定无水AlCl3产品的纯度,现称取16.25g精制后的无水 AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,其残留固体质量为0.32g.则AlCl3产品的纯度为______. 想君发扬子1年前1
想君发扬子1年前1 -
 小熊1231 共回答了20个问题
小熊1231 共回答了20个问题 |采纳率90%解题思路:(1)根据工艺流程最后升华制备无水AlCl3,说明AlCl3沸点很低,应为分子晶体;
(2)根据工艺流程可知升华器中含有AlCl3等,所以Al2O3、C12和C反应会生成A1C13,由冷凝器尾气可知还会生成CO;
(3)Cl2有强氧化性,将SO32-氧化为SO42-,自身被还原为2C1-;
(4)升华器中主要含有AlCl3和FeCl3,FeCl3熔点、沸点较低,升华制备无水AlCl3,应除去FeCl3;
(5)制备无水AlCl3含有杂质FeCl3,残留固体质量为0.32g为Fe2O3,根据铁原子守恒计算FeCl3质量,进而计算出AlCl3的质量,再根据产品的纯度定义计算.(1)根据工艺流程最后升华制备无水AlCl3,说明AlCl3沸点很低,应为分子晶体,故答案为:分子;
(2)根据工艺流程可知氯化炉的产物,经冷却、升华可制备无水AlCl3,说明氯化炉的产物中含有A1C13,冷凝器尾气含有CO,所以Al2O3、C12和C反应,生成A1C13和CO,反应方程式为
A12O3+3C12+3C
高温
.
2A1C13+3CO,故答案为:A12O3+3C12+3C
高温
.
2A1C13+3CO;
(3)Cl2有强氧化性,将SO32-氧化为SO42-,自身被还原为2C1-.反应离子方程式为SO32-+C12+H2O═SO42-+2C1-+2H+,故答案为:SO32-+C12+H2O═SO42-+2C1-+2H+;
(4)升华器中主要含有AlCl3和FeCl3,FeCl3熔点、沸点较低,升华制备无水AlCl3,应除FeCl3去.所以加入少量Al目的是除去FeCl3,
故答案为:除去FeCl3;
(5)根据铁原子守恒,令含有杂质FeCl3质量为mg,则
Fe2O3~~~~~2FeCl3
160 325
0.32gmg
所以 [0.32g/160=
mg
325],解得,m=0.65g,
所以AlCl3产品的纯度为[16.25g−0.65g/16.25g]×100%=96%,
故答案为:96%.点评:
本题考点: 镁、铝的重要化合物;制备实验方案的设计.
考点点评: 本题考查了考生对自己存储的知识,进行分解、迁移转换、重组,使问题得到解决的应用能力,体现出化学是真实的.能够通过对生产、生活和科学实验中化学现象以及相关数据和图形等的观察,获取有关的感性知识和印象,并运用分析、比较、归纳等方法对所获取的信息进行初步加工和应用的能力.1年前查看全部
- (12分)已知铝土矿主要成分为Al 2 O 3 ,还含有少量的Fe 2 O 3 、SiO 2 等杂质。下图是工业上冶炼铝
(12分)已知铝土矿主要成分为Al 2 O 3 ,还含有少量的Fe 2 O 3 、SiO 2 等杂质。下图是工业上冶炼铝的工艺流程图:
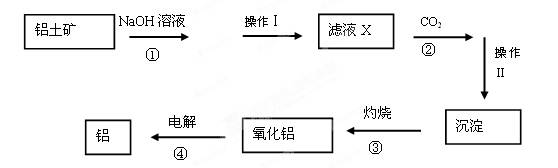
⑴操作Ⅰ和Ⅱ是用于分离溶液和沉淀,称为 。需要用到哪些玻璃仪器
⑵操作Ⅰ分离出的沉淀除了含有泥沙外,一定还含有 ,滤液X 中,含铝元素的溶质的化学式为 。写出步骤②中与过量CO 2 反应的化学方程式
中,含铝元素的溶质的化学式为 。写出步骤②中与过量CO 2 反应的化学方程式
⑶操作Ⅱ得到的 沉淀除了氢氧化铝还有 ,它属于 (填“酸”、“碱”或“盐”)类物质。
沉淀除了氢氧化铝还有 ,它属于 (填“酸”、“碱”或“盐”)类物质。
⑷实 验室里常往氯化铝溶液中加入 (填“氨水”或“NaOH溶液”),写出对应的离子方程式
验室里常往氯化铝溶液中加入 (填“氨水”或“NaOH溶液”),写出对应的离子方程式  留缘剑客1年前1
留缘剑客1年前1 -
 噜噜哩 共回答了29个问题
噜噜哩 共回答了29个问题 |采纳率93.1%1年前查看全部
- 14.某铝土矿里含氧化铝的质量分数为88%,计算理论上要用多少吨该矿石才能制取15吨的金属铝?
 梅花5211年前1
梅花5211年前1 -
 左左左28 共回答了15个问题
左左左28 共回答了15个问题 |采纳率86.7%根据化学式Al2O3计算,15吨金属铝需要氧化铝质量=15*102/54=28.33吨,需要铝土矿质量=28.33/88%=32.2吨.1年前查看全部
- 准确称取5克铝土矿(含Al2O3,Fe2O3,SiO2)样品,放入盛有50克某质量分数的硫酸溶液的烧杯中,充分反应后过滤
准确称取5克铝土矿(含Al2O3,Fe2O3,SiO2)样品,放入盛有50克某质量分数的硫酸溶液的烧杯中,充分反应后过滤,再向滤液中加入20%的氢氧化钠溶液,产生沉淀的质量与所加入的氢氧化钠溶液质量的关系如右图所示.试求:

(1)硫酸溶液的溶质质量分数为多少?
(2)铝土矿中含Al2O3、Fe2O3、SiO2各多少?
(提示:Al(OH)3+NaOH=NaAlO2+2H2O,NaAlO2易溶于水) shawthesky11年前1
shawthesky11年前1 -
 cute2006 共回答了19个问题
cute2006 共回答了19个问题 |采纳率94.7%(1)Al2O3、Fe2O3与H2SO4反应生成 Al2(SO4)3、Fe2(SO4)3,从图分析,过滤掉SiO2滤液有H2SO4、Al2(SO4)3、Fe2(SO4)3,
加入氢氧化钠全部反应需用NaOH溶液量为40克,转化为沉淀Fe(OH)3、Al(OH)3,硫酸与它们的反应转化为与NaOH反应.
设硫酸溶液的溶质是质量分数X
2NaOH+H2SO4=Na2SO4+2H2O
8098
40g×20%X×50g
80
98=
40g×20%
X×50g
X=19.6%
(2)从图分析,后来沉淀减少是由于Al(OH)3+NaOH=NaAlO2+2H2O,用于该反应的NaOH
溶液8克.设生成的氢氧化铝的质量是Y
Al(OH)3+NaOH=NaAlO2+2H2O
78 40
Y 8g×20%
78
40=
Y
8g×20%
Y=3.12克
根据化学方程式或化学反应前后原子个数不变
Al2O3~Al2(SO4)3~2Al(OH)3
102 78×2
Z 3.12g
102
156=
Z
3.12g
Z=2.04克
假设与硫酸铝反应的氢氧化钠质量是A
Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4
240 156
A3.12g
240
156=
A
3.12g
A=4.8g
Fe2O3~Fe2(SO4)3~6NaOH
160 240
B(40-4)g×20%-4.8g=2.4g
160
240=
B
2.4g
B=1.6g
SiO2:5-2.04-1.6=1.36克
答:(1)硫酸溶液的溶质质量分数为19.6%(2)铝土矿中含Al2O3、Fe2O3、SiO2的质量分别是2.04g、1.6g、1.36g.1年前查看全部
- 下列工业上制备物质的过程中,无氧化还原反应发生的是 A.合成氨 B.从铝土矿中获得铝 C.玻璃制备 D.从海水中获得氯气
 bluelong1年前1
bluelong1年前1 -
 柠檬水88 共回答了18个问题
柠檬水88 共回答了18个问题 |采纳率83.3%C
A 用氮气和氢气反应合成氨气,有化合价变化,是氧化还原反应
B从铝土矿中获得铝,铝元素由+3价变为0价,是氧化还原反应
C玻璃制备是硅酸钠和二氧化硅反应,硅酸钙和二氧化硅反应,不是氧化还原反应
D从海水中获得氯气是电解饱和的食盐水,有化合价变化,是氧化还原反应
故选C。1年前查看全部
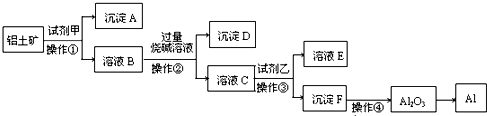
- (2009•江门一模)工业上用铝土矿(主要成分是A1203,还有少量的Fe203,SiO2)提取冶炼铝的原料氧化铝.工艺
(2009•江门一模)工业上用铝土矿(主要成分是A1203,还有少量的Fe203,SiO2)提取冶炼铝的原料氧化铝.工艺流程图如图:
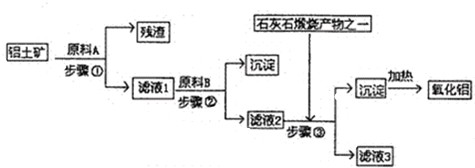
(1)原料A的名称是______,步骤①反应的离子方程式是______.
(2)滤液1中要加入稍过量原料B,原料B的化学式是______.步骤②反应的离子方程式是:______.
(3)步骤③的离子化学方程式是:______.
(4)步骤①②③的操作都是______(填操作名称),要检验Al(OH) 3沉淀是否完全的方法是______.
(5)如果省去步骤①,即溶解铝土矿是从加入原料B开始,则会对氧化铝的提取有什么影响?______. san2700211年前1
san2700211年前1 -
 善莫大焉 共回答了21个问题
善莫大焉 共回答了21个问题 |采纳率81%解题思路:SiO2和盐酸不反应,Fe2O3和氢氧化钠不反应而氧化铝能反应,向偏铝酸钠中通入过量的二氧化碳可以生成氢氧化铝沉淀.
由工艺流程可知步骤③通入的为二氧化碳,生成的沉淀为氢氧化铝,所以滤液2含有AlO2-.步骤②应加入氢氧化钠,除去铁离子,将铝离子转化为AlO2-,所以滤液1中含有Al3+,步骤①应为加入盐酸,除去SiO2.由工艺流程可知步骤③通入的为二氧化碳,生成的沉淀为氢氧化铝,所以滤液2含有AlO2-.步骤②应加入氢氧化钠,所以滤液1中含有Al3+,步骤①应为加入盐酸,除去SiO2.
(1)由上述分析可知,步骤①加入盐酸,除去SiO2,所以原料A为盐酸,
氧化铝与酸反应离子方程式为Al2O3+6H+=2Al3++3H2O,氧化铁与盐酸反应离子方程式为Fe2O3+6H+=2Fe3++3H2O.
故答案为:Al2O3+6H+=2Al3++3H2O;Fe2O3+6H+=2Fe3++3H2O.
(2)步骤①加入过量盐酸,滤液1中含有Al3+、Fe3+、H+等,应加入氢氧化钠,除去铁离子,将铝离子转化为AlO2-,反应为 H++OH-=H2O,Fe3++3OH-=Fe(OH)3↓,Al3++4OH-=AlO2-+2H2O.
故答案为:NaOH; H++OH-=H2O、Fe3++3OH-=Fe(OH)3、Al3++4OH-=AlO2-+2H2O.
(3)滤液2含有AlO2-,步骤③通入二氧化碳,与AlO2-反应生成的沉淀为氢氧化铝,
反应化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3.
故答案为:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3.
(4)由工艺流程可知步骤①②③的操作都是过滤.检验Al(OH) 3沉淀是否完全,只要检验滤液3中是否含有AlO2-即可.取滤液3的上层清液,通入二氧化碳,若出现浑浊,则说明沉淀不完全;若不出现浑浊,则说明沉淀完全.
故答案为:过滤;取滤液3的上层清液,通入二氧化碳,若出现浑浊,则说明沉淀不完全;若不出现浑浊,则说明沉淀完全.
(5)若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,通入二氧化碳会生成硅酸沉淀,最后使加热制得的Al2O3混有SiO2杂质.
故答案为:若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,最后使加热制得的Al2O3混有SiO2杂质.点评:
本题考点: 镁、铝的重要化合物;硅和二氧化硅;铁的氧化物和氢氧化物;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题以框图题形式考查铝的化合物的性质,难度中等,清楚冶炼铝工艺流程原理,是对知识迁移的综合运用.1年前查看全部
- 工业制备铝一般是从铝土矿(主要成分是Al 2 O 3 ,含有杂质Fe 2 O 3 )中得到纯净的Al 2 O 3 ,然后
工业制备铝一般是从铝土矿(主要成分是Al 2 O 3 ,含有杂质Fe 2 O 3 )中得到纯净的Al 2 O 3 ,然后是电解
Al 2 O 3 得到铝。下图是从铝土矿中提纯是的简单示意图。其中牵涉到的一个反应是:
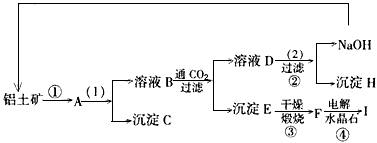
(1)写出图示中(1)的实验操作是______________;图示中(2)加入的试剂______________。
(2)试推断物质(写化学式)B_________;C_________;H__________;F____________。
(3)写出化学方程式: ①_______________________。④_______________________。 money_771年前1
money_771年前1 -
 小沙洲 共回答了20个问题
小沙洲 共回答了20个问题 |采纳率95%1年前查看全部
- (15分) 铝土矿(主要成分为Al 2 O 3 ,还含有SiO 2 、Fe 2 O 3 )是工业上制备氧化铝的主要原料。
(15分) 铝土矿(主要成分为Al 2 O 3 ,还含有SiO 2 、Fe 2 O 3 )是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:

① 沉淀 A、B的成分分别是 、 ;步骤②中的试剂a是 ;
② 试写出步骤③中发生反应的离子方式 __________ 、
__________ __________ ;
③试写出步骤③中滤液分解反应的方程式____________________________________.
④简述氯化铝溶液经过结晶得到氯化铝晶体的实验条件是 。 风中怪杰1年前1
风中怪杰1年前1 -
 萝卜英子 共回答了17个问题
萝卜英子 共回答了17个问题 |采纳率82.4%(1) ① SiO 2 Fe(OH) 3 NaOH溶液(各2分)
② CO 2 + OH - =HCO 3 - CO 2 + AlO 2 - + 2H 2 O = Al(OH) 3 ↓+ HCO 3 - (各2分)
③ 2NaHCO 3 Na 2 CO 3 + CO 2 ↑ + H 2 O (各2分)
Na 2 CO 3 + CO 2 ↑ + H 2 O (各2分)
④将溶液在较低温度下加热蒸发析出晶体,同时通入氯化氢气体防止水解。(3分)
(1)二氧化硅和盐酸不反应,所以A是二氧化硅。滤液甲中含有铝离子和铁离子,加入过量的氢氧化钠,则生成氢氧化铁沉淀,即B是氢氧化铁。滤液乙中含有偏铝酸钠,通入CO 2 生成氢氧化铝沉淀。
(2)滤液乙中还含有过量的氢氧化钠,所以方程式为CO 2 + OH - =HCO 3 - 、CO 2 + AlO 2 - + 2H 2 O = Al(OH) 3 ↓+ HCO 3 - 。
(3)碳酸氢钠不稳定,受热易分解,方程式为2NaHCO 3 Na 2 CO 3 + CO 2 ↑ + H 2 O。
Na 2 CO 3 + CO 2 ↑ + H 2 O。
(4)由于氯化铝易水解,所以在蒸发浓缩时必须防止水解,因此方法是将溶液在较低温度下加热蒸发析出晶体,同时通入氯化氢气体防止水解。1年前查看全部
大家在问
- 1英语翻译能请你在我休假的两周(12-Nov to 23-Nov )里帮我给北京办公室里的同事们订机票吗?如果可以感激不尽
- 2生活中的某些问题常常涉及化学知识.下列叙述错误的是( )
- 3《三峡》的翻译
- 4金属材料在生产、生活中应用广泛.
- 5硫酸钠的含量测定的步骤
- 6(Jackie chan有横线)is my favourite actor (对画线部分提问)
- 7小明沿着一个圆形水池的外沿走了一周,正好走了50步,每步的距离约是0.628米,这个水池的占地面积大约是______平方
- 8求以下成语意思满腔怒火:斩钉截铁:悬崖绝壁:万水千山:四面八方:排山倒海:夜以继日:端端正正:
- 9能答几道就几道,再线等!1.用加号、减号、乘号、括号,将下面各组数分别组成一个算式,使结果为21.①12、7、-9②1、
- 10复数z=[3−i/1+2i](i为虚数单位)在复平面内对应的点所在象限为( )
- 11椭圆ax^2+by^2=1与直线x+y=1相交于AB两点,AB的中点c与椭圆中心连线的斜率是√2/2 求椭圆的斜率
- 12在线求指导:— It looks heavy.S
- 13在一个面积是24平方厘米的正方形内画一个最大的圆,这个圆的面积是______平方厘米;再在这个圆内画一个最大的正方形,正
- 14如下图,长方形的场15厘米,宽9厘米,其中三角形A的面积是37平方厘米,求阴影部分面积.
- 15请问“请再试一下”的英文怎么说?