(2009•驻马店二模)可用示意图表示的是( )
 笨笨的圣骑士2022-10-04 11:39:541条回答
笨笨的圣骑士2022-10-04 11:39:541条回答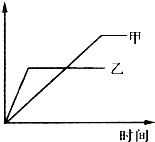 (2009•驻马店二模)可用示意图表示的是( )
(2009•驻马店二模)可用示意图表示的是( )| 反应 | 纵坐标 | 甲 | 乙 | |
| A | 2molSO2与1 molO2,在相同温度下2SO2+O2⇌SO3 | SO3的物 质的量 | 10个大 气压 | 2个大气 压 |
| B | 相同质量氨气,在同一容器中2NH3⇌N2+3H2;△H>0 | 氨气的 转化率 | 400℃ | 500℃ |
| C | 体积比1:3的N2、H2,在体积可变的恒压容器中N2+3H2⇌2NH3; | 氨气的浓度 | 活性高的 催化剂 | 活性一般 的催化剂 |
| D | 等质量钾、钠分别与水反应 | H2质量 | 钠 | 钾 |
A.A
B.B
C.C
D.D

已提交,审核后显示!提交回复
共1条回复
 一声都各 共回答了22个问题
一声都各 共回答了22个问题 |采纳率86.4%- 解题思路:A.甲的压强大,先达到平衡;
B.该反应为吸热反应,温度升高,平衡正向移动;
C.催化剂加快反应速率,平衡不移动;
D.活泼性K大于Na,等质量时,K的物质的量少,生成氢气少.A.甲的压强大,先达到平衡,与图象不符,故A错误;
B.该反应为吸热反应,温度升高,平衡正向移动,转化率增大,乙的转化率大,与图象不符,故B错误;
C.催化剂加快反应速率,平衡不移动,甲先达到平衡,且二者平衡时氨气的浓度相同,与图象不符,故C错误;
D.活泼性K大于Na,等质量时,K的物质的量少,生成氢气少,K先达到平衡且生成氢气少,与图象一致,故D正确;
故选D.点评:
本题考点: 化学平衡的影响因素;化学平衡建立的过程.
考点点评: 本题考查影响平衡及反应速率的因素,把握图中中纵横坐标的含有及图中“先拐先平数值大”的分析方法即可解答,明确温度、压强、催化剂对反应影响为解答的关键,题目难度不大. - 1年前
相关推荐
- (2008•驻马店二模)在容积固定的密闭容器中存在如下反应:A(g)+3B(g)⇌2C(g) 该反
(2008•驻马店二模)在容积固定的密闭容器中存在如下反应:A(g)+3B(g)⇌2C(g)该反应正反应为放热反应.某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:下列判断一定错误的是( )

A.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
B.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
C.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
D.图I研究的是压强对反应的影响,且乙的压强较高 芒果肉1年前1
芒果肉1年前1 -
 龙骑士30 共回答了18个问题
龙骑士30 共回答了18个问题 |采纳率72.2%解题思路:A、从化学反应速率来讲,是甲的温度较高,升高温度平衡左移动,B的转化率减小;
B、催化剂不影响化学平衡,平衡时压强不变,催化剂效率越高,到达平衡的时间越短;
C、催化剂只改变化学反应速率不影响化学平衡;
D、从化学反应速率来讲,是乙的压强较高,增大压强平衡右移,C的浓度增大.A、图Ⅱ根据到达平衡时间可知,如果甲、乙两个条件是温度对反应的影响,从化学反应速率来讲,是甲的温度较高,升高温度平衡向逆反应移动,故甲的转化率小于乙的转化率,图象与实际相符合,故A正确;
B、催化剂只改变化学反应速率不影响化学平衡,但甲的时间短,反应速率快,则甲的催化效率高,故B正确;
C、图I中,根据到达平衡时间可知,在乙条件下的化学反应速率,明显比在甲条件下的化学反应速率快;在乙条件下C的平衡浓度,比在甲条件下的C的平衡浓度大,相比较而言,条件乙既有利于此反应的化学反应速率增大又有利于平衡向正反应方向移动,说明甲、乙两个条件不仅影响化学反应速率,而且影响化学平衡,而催化剂不影响化学平衡,故C错误;
D、图Ⅰ根据到达平衡时间可知,如果甲、乙两个条件是压强对反应的影响,则乙的压强较高,增大压强平衡向正反应移动,故平衡时C的浓度增大,图象与实际相符合,故D正确;
故选C.点评:
本题考点: 物质的量或浓度随时间的变化曲线;转化率随温度、压强的变化曲线.
考点点评: 本题考查化学平衡图象题,做题时注意外界条件对化学平衡的影响,正确分析图象中曲线的变化特点是本题的解答关键.1年前查看全部
- (2009•驻马店二模)下列关于Na、Mg、Al的叙述中,正确的是( )
(2009•驻马店二模)下列关于Na、Mg、Al的叙述中,正确的是( )
A.Na、Mg、Al原子的最外层电子数依次增多,原子半径逐渐增大
B.Na、Mg、Al单质都具有灰色的金属光泽
C.常温下,Na、Mg、Al都与空气中的氧气反应
D.Na、Mg、Al的活动性逐渐减弱,前者都可以将后者从其盐溶液中置换出来 zeon15391年前1
zeon15391年前1 -
 ww416 共回答了18个问题
ww416 共回答了18个问题 |采纳率88.9%解题思路:A、同周期元素的原子半径从左到右依次减小;
B、根据金属的通性分析;
C、Na、Mg、Al属于活泼金属,根据其化学性质分析;
D、Na、Mg、Al的活动性逐渐减弱,Na与水剧烈反应,不与金属离子反应.A、同周期元素的原子半径从左到右依次减小,所以Na、Mg、Al原子的最外层电子数依次增多,原子半径逐渐减小,故A错误;
B、金属一般都具有银白色光泽,所以Na、Mg、Al单质都具有银白色的金属光,故B错误;
C、Na、Mg、Al属于活泼金属,常温下,Na、Mg、Al都与空气中的氧气反应,生成氧化物,故C正确;
D、Na、Mg、Al的活动性逐渐减弱,Na与水剧烈反应,不与金属离子反应,Mg也能与水反应,所以前者不能将后者从其盐溶液中置换出来,故D错误;
故选C.点评:
本题考点: 同一周期内元素性质的递变规律与原子结构的关系.
考点点评: 本题考查了学生原子结构和元素的性质之间的关系以及元素周期律的有关知识,难度不大.1年前查看全部
- (2009•驻马店二模)物质A、B、C、D等的转化关系如图所示.已知A是由两种元素组成的化合物,B是常见的气态单质,J是
(2009•驻马店二模)物质A、B、C、D等的转化关系如图所示.已知A是由两种元素组成的化合物,B是常见的气态单质,J是常见的金属单质,H的相对分子质量比D大16(部分反应物、生成物未列出),反应①是工业上制取K的第一步反应,反应②为化合反应.
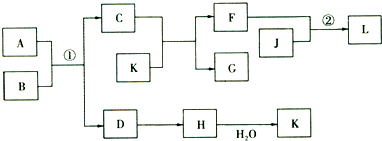
依据上述信息,回答下列的问题:
(1)J在元素周期表中的位置是______.
(2)F的水溶液显______(填“酸”、“碱”或“中”)性,用相关的离子方程式表示______.
(3)反应①的化学方程式为4FeS2+1102
2Fe2O3+8SO2高温 .4FeS2+1102.工业上反应①在______(填工业设备名称)中进行.
2Fe2O3+8SO2高温 .
(4)反应②的离子方程式为______. cn8u81年前1
cn8u81年前1 -
 61205419 共回答了29个问题
61205419 共回答了29个问题 |采纳率89.7%解题思路:此题的题眼是H的相对分子质量比D大16,H能与水反应,可知符合H、D的物质主要有一下几组:一氧化碳和二氧化碳;一氧化氮和二氧化氮;氧化钠和过氧化钠;二氧化硫和三氧化硫;题中给出信息A为固体,F是盐,反应①是工业上制取K的重要反应,很明显推得K是硫酸,A是FeS2,则B为O2,C为Fe2O3,D为SO2,H为SO3,由K和C的反应可知F为Fe2(SO4)3,G为H2O,J是常见的金属单质,可与Fe2(SO4)3发生化合反应,则J为Fe,L为FeSO4,结合对应物质的性质以及题目要求解答该题.H的相对分子质量比D大16,H能与水反应,可知符合H、D的物质主要有一下几组:一氧化碳和二氧化碳;一氧化氮和二氧化氮;氧化钠和过氧化钠;二氧化硫和三氧化硫;题中给出信息A为固体,F是盐,反应①是工业上制取K的重要反应,很明显推得K是硫酸,A是FeS2,则B为O2,C为Fe2O3,D为SO2,H为SO3,由K和C的反应可知F为Fe2(SO4)3,G为H2O,J是常见的金属单质,可与Fe2(SO4)3发生化合反应,则J为Fe,L为FeSO4,则
(1)由以上分析可知J为Fe,位于周期表第四周期、第Ⅷ族,故答案为:第四周期、第Ⅷ族;
(2)F为Fe2(SO4)3,为强酸弱碱盐,水解呈酸性,发生Fe3++3H2O⇌Fe(OH)3+3H+,故答案为:酸;Fe3++3H2O⇌Fe(OH)3+3H+;
(3)反应①为FeS2和O2的反应,方程式为4FeS2+1102
高温
.
2Fe2O3+8SO2,在沸腾炉中进行,故答案为:4FeS2+1102
高温
.
2Fe2O3+8SO2;沸腾炉;
(4)反应②的离子方程式为2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+.点评:
本题考点: 无机物的推断.
考点点评: 本题以元素化合物的推断为载体考查了元素化合物的性质,通过元素化合物的推断考查学生的推理、分析、判断等能力,解答本题的关键点为物质的相对分子质量关系以及工业生成的特点,注意把握相关物质的性质和用途,难度中等.1年前查看全部
- (2008•驻马店二模)从下列事实所得出的相应结论正确的是( )
(2008•驻马店二模)从下列事实所得出的相应结论正确的是( )
实验事实 结论 A 常温下白磷自燃,而氮气要在放电条件才与氧气反应 非金属性:P>N B CO2的水溶液可导电 CO2是电解质 C SO2通入溴水溶液,溶液褪色 SO2有漂白性 D 常温下,相同的铜片分别与浓硝酸和稀硝酸反应,前者反应更剧烈 氧化性:浓硝酸强于稀硝酸
A.A
B.B
C.C
D.D twolittleants1年前1
twolittleants1年前1 -
 美丽心情我nn 共回答了17个问题
美丽心情我nn 共回答了17个问题 |采纳率82.4%解题思路:A.氮气分子中N原子之间形成N≡N,键能大,化学性质稳定;
B.二氧化碳的水溶液导电是碳酸电离处于自由移动的离子导电,不是二氧化碳本身导电;
C.二氧化硫的漂白性指与有机色质化合为不稳定的无色物质;
D.同一还原剂与氧化剂反应,反应越剧烈说明氧化性越强.A.同主族自上而下非金属性减弱,故非金属性N>P,由于氮气分子中N原子之间形成N≡N,键能大,化学性质稳定,故A错误;
B.二氧化碳属于共价化合物,二氧化碳的水溶液导电是碳酸电离处于自由移动的离子导电,不是二氧化碳本身导电,二氧化碳水非电解质,故B错误;
C.二氧化硫的漂白性指与有机色质化合为不稳定的无色物质,二氧化硫使溴水褪色,发生氧化还原反应,体现二氧化硫的还原性,故C错误;
D.常温下,相同的铜片分别与浓硝酸和稀硝酸反应,前者反应更剧烈,说明浓硝酸的氧化性更强,故D正确,
故选:D.点评:
本题考点: 非金属在元素周期表中的位置及其性质递变的规律;硝酸的化学性质;二氧化硫的化学性质.
考点点评: 本题考查电解质、二氧化硫的性质、氧化性强弱比较、分子结构与性质等,为常考题型,综合考查学生对基础知识的理解掌握,难度不大.1年前查看全部
- (2008•驻马店二模)将一定量的CO2气体通入500.0mLNaOH溶液中,充分反应后,溶液低温蒸发,得到不含结晶水的
(2008•驻马店二模)将一定量的CO2气体通入500.0mLNaOH溶液中,充分反应后,溶液低温蒸发,得到不含结晶水的白色固体A,取3份质量不同的该白色固体A分别与50.00mL相同浓度的盐酸反应,得到气体的体积(在标准状况下)与固体A的质量关系如下:
(1)上表中第______组数据表明加入的50.00mL盐酸反应后有剩余,其理由是______.组别 Ⅰ Ⅱ Ⅲ 盐酸的体积/mL 50.00 50.00 50.00 固体A的质量/g 3.800 6.200 7.200 气体的体积/mL 896.0 1344 1344
(2)请通过计算,讨论,判断固体A是什么物质?______在第Ⅰ组固体A中,其成分的物质的量各是多少?______. jailjf1年前1
jailjf1年前1 -
 520YSJ 共回答了14个问题
520YSJ 共回答了14个问题 |采纳率85.7%解题思路:(1)Ⅰ~Ⅲ组所用盐酸的物质的量相同,而第Ⅰ组生成的气体比其他两组都少,以此判断反应的过量问题;
(2)根据第Ⅰ组数据,用讨论的方法判断物质的成分;设出碳酸氢钠、碳酸钠的物质的量,根据质量和物质的量列式计算出二者的物质的量.(1)Ⅰ~Ⅲ组所用盐酸的物质的量相同,而第Ⅰ组生成的气体比其他两组都少,所以第Ⅰ组盐酸过量,
故答案为:Ⅰ;Ⅰ、Ⅱ、Ⅲ组数据中盐酸的量相同,但Ⅰ组中产生的气体量最少;
(2))Ⅰ组中白色固体反应完全,Ⅰ组反应生成的CO2为:n(CO2)=[0.896L/22.4L/mol]=0.04mol,
若A全为Na2CO3,生成的CO2为:n(CO2)=[3.8g/106g/mol]=0.036mol<0.04mol,
若A全为NaHCO3,生成的CO2为:n(CO2)=[3.8g/84g/mol]=0.045mol>0.04mol,
由上可知,A应为NaHCO3和Na2CO3的混合物;
设Ⅰ组反应的3.800g A中Na2CO3和NaHCO3的物质的量分别为x、y,则
106x+84y=3.8
x+y=0.04,
x=0.02
y=0.02,
则Ⅰ组固体A中Na2CO3和NaHCO3的物质的量都为0.02mol,
故答案为:NaHCO3和Na2CO3的混合物;0.02mol、0.02mol.点评:
本题考点: 有关过量问题的计算.
考点点评: 本题考查混合物的计算,题目难度中等,本题注意对表中数据的分析,考查学生的数据分析能力,做题中注意讨论法的应用.1年前查看全部
- (2009•驻马店二模)下列有关化学用语正确的是( )
(2009•驻马店二模)下列有关化学用语正确的是( )
A.氮气的电子式:
B.CS2的电子式:S=C=S
C.次氯酸钙的化学式:Ca(ClO)2
D.臭氧的化学式:
O188 懒猫10071年前1
懒猫10071年前1 -
 轩辕历史十 共回答了15个问题
轩辕历史十 共回答了15个问题 |采纳率100%解题思路:A.N原子满足最外层8电子稳定结构;
B.S=C=S为结构简式;
C.次氯酸钙由钙离子和次氯酸根离子构成;
D.臭氧为分子,1个分子中含3个O原子.A.N原子满足最外层8电子稳定结构,氮气的电子式为
 ,故A错误;
,故A错误;
B.S=C=S为结构简式,则CS2的电子式为 ,故B错误;
,故B错误;
C.次氯酸钙由钙离子和次氯酸根离子构成,则次氯酸钙的化学式为Ca(ClO)2,故C正确;
D.臭氧为分子,1个分子中含3个O原子,臭氧的化学式为O3,故D错误;
故选C.点评:
本题考点: 电子式、化学式或化学符号及名称的综合.
考点点评: 本题考查化学用语,涉及电子式、结构简式、化学式等,注意化学用语的区别及规范应用,选项B注意与二氧化碳结构相似,题目难度不大.1年前查看全部
- (2008•驻马店二模)设NA代表阿伏伽德罗常数,下列说法不正确的是( )
(2008•驻马店二模)设NA代表阿伏伽德罗常数,下列说法不正确的是( )
A.71g 液氯含有NA个共价键
B.1L 0.1mol/L氨水中NH3、NH3•H2O、NH4+总数为0.1NA
C.常温常压下,14g N2和CO混合气体中含原子总数为NA
D.铁在氧气中燃烧,1mol Fe失去的电子数目为3NA xuliowen1年前1
xuliowen1年前1 -
 本加 共回答了17个问题
本加 共回答了17个问题 |采纳率100%解题思路:A、氯气分子中含有1个共价键,根据氯气的质量计算出氨气的物质的量,再计算出含有的共价键数目;
B、先计算出溶液中溶质的物质的量,再根据物料守恒计算NH3、NH3•H2O、NH4+总数;
C、氮气和一氧化碳的摩尔质量都是28g/mol,计算出混合气体的物质的量及含有的原子数;
D、铁在氧气中燃烧生成的是四氧化三铁,铁元素的平均化合价为[8/3]价.A、71g液氯含有氯气的物质的量为1mol,1mol氯气中含有1mol共价键,含有NA个共价键,故A正确;
B、1L 0.1mol/L氨水中含有溶质一水合氨的物质的量为0.1mol,根据物料守恒,NH3、NH3•H2O、NH4+的总物质的量为0.1mol,总数为0.1NA,故B正确;
C、14g氮气和一氧化碳的混合物的物质的量为0.5mol,0.5mol氮气和一氧化碳混合物中含有的原子的物质的量为1mol,含原子总数为NA,故C正确;
D、由于铁在氧气中燃烧生成产物为四氧化三铁,四氧化三铁中铁元素的平均化合价为[8/3]价,1mol Fe完全反应失去[8/3]mol电子,失去的电子数目为[8/3]NA,故D错误;
故选D.点评:
本题考点: 阿伏加德罗常数.
考点点评: 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,阿伏加德罗常数是高考的“热点”,它既考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容.要准确解答好这类题目,需要掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系;还要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.1年前查看全部
- (2011•驻马店二模)下列各组物质间的反应,不用指示剂无法判断反应发生的是( )
(2011•驻马店二模)下列各组物质间的反应,不用指示剂无法判断反应发生的是( )
A.镁与稀盐酸
B.烧碱溶液与稀硫酸
C.氧化铁与稀硫酸
D.氢氧化钠溶液与硫酸铜溶液 小强1221年前1
小强1221年前1 -
 casperf 共回答了20个问题
casperf 共回答了20个问题 |采纳率95%解题思路:物质间的反应若有明显的反应现象,如产生沉淀、气体、固体溶解的现象等,则不需要借助酸碱指示剂就能判断出反应发生;若物质间反应时没有明显现象的可以借助指示剂,如酸碱的中和反应等.A、镁与稀盐酸反应生成有大量气泡产生,现象明显,不需借助酸碱指示剂就能判断出反应发生,故选项错误.
B、烧碱溶液与稀硫酸反应生成硫酸钠和水,反应无明显现象,需要借助指示剂才能判断出反应发生,故选项正确.
C、氧化铁和稀硫酸反应生成硫酸铁和水,会观察到氧化铁溶解,溶液变黄,现象明显,不需借助酸碱指示剂就能判断出反应发生,故选项错误.
D、氢氧化钠溶液与硫酸铜溶液反应生成氢氧化铜蓝色沉淀和硫酸钠,有蓝色沉淀生成,现象明显,不需借助酸碱指示剂就能判断出反应发生,故选项错误.
故选:B.点评:
本题考点: 酸的化学性质;碱的化学性质.
考点点评: 本题难度不大,掌握酸的化学性质、碱的化学性质、物质发生化学反应时的现象是正确解答此类题的关键.1年前查看全部
- (2s11•驻马店)下面是小明和小敏两人hss为赛跑的行程e.
(2s11•驻马店)下面是小明和小敏两人hss为赛跑的行程e.

看e填空:(1)跑完全程小明用了______分钟.
(2)小明到达终点后,小敏再跑______分钟才能到达终点.
(它)小明平均每分钟跑______米,小敏平均每分钟跑______米. 静陌悠然1年前1
静陌悠然1年前1 -
 包公脸黑 共回答了20个问题
包公脸黑 共回答了20个问题 |采纳率80%解题思路:(1)又能统计图观察可知小明跑完全程的时间.
(2)用小敏用的时间减去小明用的时间就是小明到达终点后,小敏再跑几分钟才能到达终点的时间.
(3)运用路程除以时间分别求出他们的速度.(r)由图可知,跑完全程小明用了5分钟.
(2)y-5=r(分钟),
答:小明到达终点后,小敏再跑r分钟才能到达终点.
(i)小明平均每分钟跑的米数:
y00÷5=r20(米);
小敏平均每分钟跑的米数:
y00÷y=r00(米);
答:小明平均每分钟跑r20米,小敏平均每分钟跑r00米.
故答案为:5,r,r20,r00.点评:
本题考点: 单式折线统计图;从统计图表中获取信息.
考点点评: 此题首先根据问题从图中找出所需要的信息,然后根据数量关系式:路程÷时间=速度即可作出解答.1年前查看全部
- (2009•驻马店二模)为了研究问题的方便,我们把在物质晶体立体示意图中处于图中某一位置(如顶点)的一种粒子(如原子、离
(2009•驻马店二模)为了研究问题的方便,我们把在物质晶体立体示意图中处于图中某一位置(如顶点)的一种粒子(如原子、离子或分子)叫做一个质点.在下列各种物质的晶体中与其任意一个质点(原子或离子)存在直接的强烈相互作用的质点的数目表示正确的是( )
A.干冰--12
B.水晶--4
C.氯化铯一-6
D.晶体硅--4 童年味道1年前1
童年味道1年前1 -
 幸福密码yl 共回答了21个问题
幸福密码yl 共回答了21个问题 |采纳率85.7%解题思路:A.干冰为分子晶体,晶体中质点之间的作用力较弱;
B.水晶为二氧化硅,每个Si原子与4个O原子成键,而每个O原子与2个Si原子成键;
C.氯化铯中离子的配位数为8;
D.硅晶体中每个Si原子与其它四个Si原子成键.A.干冰为分子晶体,晶体中质点之间的作用力较弱,分子间不存在强烈的相互作用,分子内每个C原子与2个O原子成键,故A错误;
B.水晶为二氧化硅,每个Si原子与4个O原子成键,而每个O原子与2个Si原子成键,数目可能为2或4,故B错误;
C.氯化铯晶胞是体心立方晶胞,配位数为8,质点的数目为8,故C错误;
D.硅晶体中每个Si原子与其它四个Si原子成键,故D正确.
故选D.点评:
本题考点: 晶胞的计算;不同晶体的结构微粒及微粒间作用力的区别.
考点点评: 本题考查晶胞的计算,侧重于学生的分析能力和自学能力的考查,注意把握常见物质的晶体的结构,难度中等.1年前查看全部
- (2012•驻马店二模)下列各组物质反应后溶液的总质量减少的是( )
(2012•驻马店二模)下列各组物质反应后溶液的总质量减少的是( )
A.少量二氧化碳通入氢氧化钠溶液
B.少量二氧化碳通入氢氧化钙溶液
C.碳酸钙中加入稀盐酸
D.锌粒中加入硫酸铜溶液 风之幸子1年前1
风之幸子1年前1 -
 isispeter 共回答了17个问题
isispeter 共回答了17个问题 |采纳率82.4%解题思路:A、依据两者之间的反应情况分析解答;
B、依据两者反应会生成碳酸钙沉淀分析解答;
C、依据碳酸钙与盐酸反应会生成氯化钙和二氧化碳分析判断;
D、依据锌粒能置换出硫酸铜中的铜的质量变化分析解答;A、少量二氧化碳通入氢氧化钠溶液会生成碳酸钠和水,溶液的质量会增加(增加值为二氧化碳的质量);
B、由于二氧化碳和氢氧化钙反应会生成碳酸钙沉淀,而沉淀的质量大于二氧化碳的质量,所以溶液质量会减小;
C、碳酸钙与盐酸反应会生成氯化钙和二氧化碳,由于溶液中溶解的氯化钙的质量大于排放出的二氧化碳的质量,所以溶液质量会减小;
D、锌的活动性比铜强,而锌的原子量大于铜,所以锌粒能置换出硫酸铜中的铜,反应前为硫酸铜溶液,锌和硫酸铜溶液反应生成硫酸锌和铜,每65份质量的锌反应将生成64份质量的铜,则溶液质量减少;
故选B点评:
本题考点: 质量守恒定律及其应用.
考点点评: 此题是对溶液反应知识的考查,解题的关键是对溶液质量变化的分析,属于基础性知识的考查题.1年前查看全部
- (2012•驻马店二模)大蒜具有一定的抗癌功能和食疗价值,大蒜辣素(C6H10S2)是其有划成分之一.下列关于大蒜辣素的
(2012•驻马店二模)大蒜具有一定的抗癌功能和食疗价值,大蒜辣素(C6H10S2)是其有划成分之一.下列关于大蒜辣素的说法正确的是( )
A.C、H、S元素的质量比是6:10:2
B.属于无机化合物
C.相对分子质量为178g
D.一个分子中含有2个硫原子 南山樵夫991年前1
南山樵夫991年前1 -
 cbc2 共回答了18个问题
cbc2 共回答了18个问题 |采纳率94.4%解题思路:A、根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析判断.
B、含有碳元素的化合物叫有机化合物,简称有机物.
C、相对分子质量单位是“1”,不是“克”,往往省略不写.
D、根据化学式的含义进行分析判断.A、大蒜辣素中C、H、S元素的质量比是(12×6):(1×10):(32×2)≠6:10:2,故选项说法错误.
B、大蒜辣素(C6H10S2)是含有碳元素的化合物,属于有机物,故选项说法错误.
C、相对分子质量单位是“1”,不是“克”,往往省略不写,故选项说法错误.
D、由大蒜辣素(C6H10S2)的化学式可知,1个大蒜辣素分子中含有2个硫原子,故选项说法正确.
故选D.点评:
本题考点: 元素质量比的计算;有机物与无机物的区别;相对分子质量的概念及其计算.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用化学式的含有与有关计算进行分析问题、解决问题的能力.1年前查看全部
- (2012•驻马店模拟)小亮在测量某种液体的密度时,根据测量数据绘制出了烧杯和液体的总质量与液体体积的关系图象如图所示,
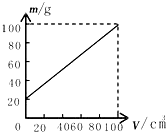 (2012•驻马店模拟)小亮在测量某种液体的密度时,根据测量数据绘制出了烧杯和液体的总质量与液体体积的关系图象如图所示,则烧杯的质量为______,液体的密度为______.
(2012•驻马店模拟)小亮在测量某种液体的密度时,根据测量数据绘制出了烧杯和液体的总质量与液体体积的关系图象如图所示,则烧杯的质量为______,液体的密度为______.  密码怎么总丢1年前1
密码怎么总丢1年前1 -
 580WBY 共回答了14个问题
580WBY 共回答了14个问题 |采纳率85.7%解题思路:①由质量和体积图象可以得到烧杯的质量;②根据烧杯质量和总质量可以得到液体的质量,查得对应的体积,利用ρ=mV就能得到液体的密度.①由图象知,当液体体积为零,也就是烧杯中没有液体时,质量为20g,所以烧杯的质量为m0=20g;
②由图象知,当液体的体积为V=100cm3时,
液体和烧杯的总质量为m总=100g,所以液体的质量为m=m总-m0=100g-20g=80g
液体的密度为ρ=[m/V]=
80g
100cm3=0.8g/cm3
故答案为:20g;0.8g/cm3.点评:
本题考点: 液体密度的测量.
考点点评: 从质量和体积图象中读出烧杯的质量,是得到液体密度的第一步.1年前查看全部
- (2012•驻马店二模)如图是硫燃烧的实验装置.
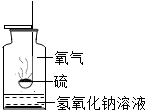 (2012•驻马店二模)如图是硫燃烧的实验装置.
(2012•驻马店二模)如图是硫燃烧的实验装置.
(1)硫在空气中燃烧不如在氧气中燃烧剧烈的原因是______,氢氧化钠溶液所起的作用是(用化学方程式表示).______.
(2)观察到实验现象后,为尽量减少二氧化硫逸散到空气中,要使燃烧的硫立即熄灭.采用的措施是把燃烧匙立即伸入氢氧化钠溶液中使火焰熄灭,依据的灭火原理______. 妞妞07231年前1
妞妞07231年前1 -
 zyzyid 共回答了19个问题
zyzyid 共回答了19个问题 |采纳率89.5%解题思路:(1)促进燃烧的方法有增大氧气的浓度和增大与氧气的接触面积;二氧化硫与氢氧化钠溶液反应生成亚硫酸钠和水;
(2)灭火的方法有降低温度到可燃物的着火点以下,隔绝氧气,撤离可燃物(1)空气中氧气只占空气体积的21%,其浓度比纯氧中浓度低,故硫在空气中燃烧不如在氧气中剧烈;
二氧化硫是大气污染物,可用氢氧化钠溶液吸收,二氧化硫与氢氧化钠溶液反应生成亚硫酸钠和水;
(2)灭火的方法有降低温度到可燃物的着火点以下,隔绝氧气,撤离可燃物,此实验过程中可将燃着的硫立即伸入氢氧化钠溶液中使其隔绝氧气和温度降低达到灭火的目的;
故答案为:
(1)空气中氧气的浓度比纯氧中浓度低;2NaOH+S02=Na2S03+H20
(2)隔绝空气,同时可以降低温度到着火点以下.点评:
本题考点: 氧气的化学性质;碱的化学性质;书写化学方程式、文字表达式、电离方程式;灭火的原理和方法.
考点点评: 本题考查促进燃烧的方法和灭火的方法,以及方程式的书写,了解相关知识才能正确应用解答问题.1年前查看全部
- (2012•驻马店二模)在河南,对水的保护和合理利用一直受到人们的普遍关注.试填写:
(2012•驻马店二模)在河南,对水的保护和合理利用一直受到人们的普遍关注.试填写:
(1)使用硬水会给生活和生产带来许多麻烦.在日常生活中,人们常用______的方法来降低水的硬度.为确认得到的水是软水还是硬水,我们常用______来检验.
(2)测定地下水的酸碱度用______(填字母).
a.无色酚酞溶液 b.pH试纸 c.紫色石蕊试液. 梦醒寒秋1年前1
梦醒寒秋1年前1 -
 922123 共回答了15个问题
922123 共回答了15个问题 |采纳率100%解题思路:(1)生活中通过煮沸水可以降低水的硬度;鉴别硬水和软水的方法是用肥皂水.
(2)测定溶液的酸碱度使用pH试纸.(1)生活中通过煮沸水可以降低水的硬度;鉴别硬水和软水的方法是用肥皂水.加入肥皂水后泡沫多、浮渣少的为软水.反之,泡沫少、浮渣多的为硬水.
故答案为:煮沸;肥皂水.
(2)测定溶液的酸碱度使用pH试纸.
故答案为:b.点评:
本题考点: 硬水与软水;溶液的酸碱度测定.
考点点评: 本题考查了鉴别硬水和软水的方法,以及酸碱溶液的测定,都是经常考查的基础知识,容易做好.1年前查看全部
- (2011•驻马店) 用递等式计算,能简算的要简算
(2011•驻马店)
+2用递等式计算,能简算的要简算
(1)4×0.8×2.5×12.5
(2)[3/4
+9 17
+31 4 8 17] (3)6.78×8.5+1.5×6.78 (4)(
+5 12
+1 9
)×72.3 8  _Dead_Ghost1年前1
_Dead_Ghost1年前1 -
 山川之巅喝小酒 共回答了21个问题
山川之巅喝小酒 共回答了21个问题 |采纳率90.5%解题思路:(1)运用乘法交换律与结合律简算;
(2)运用加法交换律与结合律简算;
(3)、(4)运用乘法分配律简算.(1)4×0.8×2.5×12.5,
=(4×2.5)×(0.8×12.5),
=10×10,
=100;
(2)[3/4]+2[9/17]+[1/4]+3[8/17],
=([3/4]+[1/4])+(2[9/17]+3[8/17]),
=1+6,
=7;
(3)6.78×8.5+1.5×6.78,
=(8.5+1.5)×6.78,
=10×6.78,
=67.8;
(4)([5/12]+[1/9]+[3/8])×72,
=[5/12]×72+[1/9]×72+[3/8]×72,
=30+8+27,
=65.点评:
本题考点: 运算定律与简便运算;分数的四则混合运算;小数四则混合运算.
考点点评: 完成本题要注意分析式中数据,运用合适的简便方法计算.1年前查看全部
- (2012•驻马店模拟)下列现象与物理知识相对应的是( )
(2012•驻马店模拟)下列现象与物理知识相对应的是( )
A.飞机起飞--流体压强与流速的关系
B.磁铁能吸引大头针--分子间存在引力
C.灰尘在空中飞舞--分子在永不停息地运动
D.冬季人们常用热水袋取暖--做功改变物体内能 alexwonk1年前1
alexwonk1年前1 -
 paopaomo 共回答了18个问题
paopaomo 共回答了18个问题 |采纳率83.3%A、飞机起飞是利用流体压强和速度的关系.说法正确,符合题意.
B、大头针是铁质材料,磁铁吸引大头针是因为磁铁具有磁性.说法错误,不符合题意.
C、灰尘是微小的物体,不是分子.灰尘飞舞可以利用力改变物体的运动状态解释.说法错误,不符合题意.
D、热水袋的利用热传递来改变物体内能的.说法错误,不符合题意.
故选A.1年前查看全部
- (2008•驻马店二模)短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13.X与Y、Z位于相邻周期,
(2008•驻马店二模)短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13.X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍.下列说法不正确的是( )
A.X的氢化物溶于水显酸性
B.Y的氧化物是共价化合物
C.Z的氢化物的水溶液在空气中存放不易变质
D.X和Y的最高价氧化物对应的水化物都是强酸 guoguo69441年前1
guoguo69441年前1 -
 语朦朦 共回答了22个问题
语朦朦 共回答了22个问题 |采纳率95.5%解题思路:短周期元素X、Y、Z的原子序数依次递增,Z原子最外层电子数是X原子内层电子数的3倍,则X只能有2个电子层,处于第二周期,X与Y、Z位于相邻周期,则Y、Z位于第三周期,故Z原子最外层电子数为6个电子,则Z为S;Z原子最外层电子数是Y原子最外层电子数的3倍,则Y原子最外层电子数为2,可推知Y为Mg;三原子的最外层电子数之和为13,则X的最外层电子数为13-2-6=5,即X为氮元素.短周期元素X、Y、Z的原子序数依次递增,Z原子最外层电子数是X原子内层电子数的3倍,则X只能有2个电子层,处于第二周期,X与Y、Z位于相邻周期,则Y、Z位于第三周期,故Z原子最外层电子数为6个电子,则Z为S;Z原子最外层电子数是Y原子最外层电子数的3倍,则Y原子最外层电子数为2,可推知Y为Mg;三原子的最外层电子数之和为13,则X的最外层电子数为13-2-6=5,即X为氮元素,则:
A.X的氢化物为氨气,氨气和水反应生成一水合氨,在水中电离生成按很离子合氢氧根离子,则溶液显碱性,故A错误;
B.Y的氧化物为氧化镁,是由镁离子和氧离子构成,则属于离子化合物,故B错误;
C.Z的氢化物为硫化氢,硫元素的化合价为最低价,具有较强的还原性,其水溶液在空气中存放易被氧化,故C错误;
D.N、S的最高价氧化物对应的水化物为硝酸和硫酸,都属于强酸,故D正确;
故选:D.点评:
本题考点: 原子结构与元素的性质.
考点点评: 本题考查结构位置性质关系应用,判断X为第二周期元素为突破口,是解答本题的关键,注意熟悉元素化合物知识.1年前查看全部
- (2012•驻马店模拟)如图所示的电路,电源电压不变,R1=4欧,R2=8欧,当开关闭合时,电流表的示数是0.3安,若开
 (2012•驻马店模拟)如图所示的电路,电源电压不变,R1=4欧,R2=8欧,当开关闭合时,电流表的示数是0.3安,若开关断开,电流表的示数是______A.
(2012•驻马店模拟)如图所示的电路,电源电压不变,R1=4欧,R2=8欧,当开关闭合时,电流表的示数是0.3安,若开关断开,电流表的示数是______A.  xm518881年前1
xm518881年前1 -
 战争 共回答了10个问题
战争 共回答了10个问题 |采纳率80%解题思路:当开关闭合时,电路为R1的简单电路,根据欧姆定律可求电源的电压;当开关断开时,两电阻串联,电流表测电路中的电流,根据电阻的串联和欧姆定律求出电流表的示数.当开关闭合时,电路为R1的简单电路,
电源的电压:
U=IR1=0.3A×4Ω=1.2V;
当开关断开时,两电阻串联,电流表测电路中的电流,
电流表的示数:
I′=[U
R1+R2=
1.2V/4Ω+8Ω]=0.1A.
故答案为:0.1.点评:
本题考点: 欧姆定律的应用;串联电路的电流规律;电阻的串联.
考点点评: 本题考查了串联电路的特点和欧姆定律的原因,能正确的分析开关闭合前后电路的变化是关键.1年前查看全部
- (2012•驻马店二模)下列各式中正确的是( )
(2012•驻马店二模)下列各式中正确的是( )
A.(-2x3)2=-4x6
B.a2+2ab+(-b)2=(a-b)2
C.(a-b)(b-a)=-(b-a)2
D.(2a-b)2=4a2-b2 phatom1年前1
phatom1年前1 -
 一中小妹 共回答了20个问题
一中小妹 共回答了20个问题 |采纳率85%解题思路:根据积的乘方的性质,完全平方公式,乘方的意义求解即可.A、(-2x3)2=4x6,故选项错误;
B、a2+2ab+(-b)2=(a+b)2,故选项错误;
C、(a-b)(b-a)=-(b-a)(b-a)=-(b-a)2,故选项正确;
D、(2a-b)2=4a2-4ab+b2,故选项错误.
故选C.点评:
本题考点: 完全平方公式;幂的乘方与积的乘方.
考点点评: 本题考查了积的乘方的性质,完全平方公式、乘方的意义,牢记定义及法则是解题的关键.1年前查看全部
- (2008•驻马店二模)已知X、Y、Z、W四种元素是元素周期表中连续三个短周期的元素,且原子序数依次增大.X、W同主族,
(2008•驻马店二模)已知X、Y、Z、W四种元素是元素周期表中连续三个短周期的元素,且原子序数依次增大.X、W同主族,Y、Z为同周期的相邻元素.W原子的质子数等于Y、Z原子最外层电子数之和.Y的氢化物分子中有3个共价键.Z原子最外层电子数是次外层电子数的3倍.试推断:
(1)X的元素符号为______,元素Z在周期表中的位置为______.
(2)由以上元素中的两种元素组成的物质中有一种能与H2O反应释放出空气中的主要成分之一的气体,则该物质的电子式为______,化学键类型为______.
(3)由X、Y、Z所形成的常见离子化合物的化学式为______,它与W的最高价氧化物的水化物的浓溶液加热时反应的离子方程式NH4++OH-
NH3↑+H2O△ .NH4++OH-
NH3↑+H2O△ .
(4)在由X、Y、Z、W四种元素形成的常见化合物或单质中,不能形成的晶体类型是______. 我是小胖子啊1年前1
我是小胖子啊1年前1 -
 TYsongge 共回答了20个问题
TYsongge 共回答了20个问题 |采纳率100%解题思路:X、Y、Z、W四种元素是元素周期表中连续三个短周期的元素,且原子序数依次增大.原子最外层电子数是次外层电子数的3倍,Z原子有2个电子层,最外层电子数为6,则Z为O元素;Y、Z为同周期的相邻元素,Y的氢化物分子中有3个共价键,则Y为N元素;W原子的质子数等于Y、Z原子最外层电子数之和,则W原子质子数为6+5=11,则W为Na元素;X、W同主族,X的原子序数最小,则X为氢元素,据此解答.X、Y、Z、W四种元素是元素周期表中连续三个短周期的元素,且原子序数依次增大.原子最外层电子数是次外层电子数的3倍,Z原子有2个电子层,最外层电子数为6,则Z为O元素;Y、Z为同周期的相邻元素,Y的氢化物分子中有3个共价键,则Y为N元素;W原子的质子数等于Y、Z原子最外层电子数之和,则W原子质子数为6+5=11,则W为Na元素;X、W同主族,X的原子序数最小,则X为氢元素,
(1)由上述分析可知,X为H元素,Z为O元素,处于周期表中第二周期ⅥA族,
故答案为:H;第二周期ⅥA族;
(2)由以上元素中的两种元素组成的物质中有一种能与H2O反应释放出空气中的主要成分之一的气体,则该物质为Na2O2,其电子式为 ,含有化学键类型为:离子键、共价键,
,含有化学键类型为:离子键、共价键,
故答案为: ;离子键、共价键;
;离子键、共价键;
(3)由H、N、O所形成的常见离子化合物的化学式为NH4NO3,它与W的最高价氧化物的水化物NaOH的浓溶液加热时,反应的离子方程式为:NH4++OH-
△
.
NH3↑+H2O,
故答案为:NH4NO3;NH4++OH-
△
.
NH3↑+H2O;
(4)在由H、N、O、Na四种元素形成的常见化合物或单质中,可以形成分子晶体如水,可以形成离子晶体如NaOH或金属晶体如Na,不能形成原子晶体,
故答案为:原子晶体.点评:
本题考点: 位置结构性质的相互关系应用.
考点点评: 本题考查结构位置性质关系应用,难度中等,推断元素是解题关键,侧重对基础知识的巩固,注意掌握电子式的书写.1年前查看全部
- (2008•驻马店二模)判断下列有关化学基本概念的依据正确的是( )
(2008•驻马店二模)判断下列有关化学基本概念的依据正确的是( )
A.共价化合物:是否含有共价键
B.氧化还原反应:元素化合价是否变化
C.置换反应:反应物是否为单质和化合物
D.离子晶体:晶体是否能够导电 wuyiranding1年前1
wuyiranding1年前1 -
 玎87 共回答了22个问题
玎87 共回答了22个问题 |采纳率90.9%解题思路:A.含有共价键的化合物不一定为共价化合物;
B.氧化还原反应的特征为元素化合价的升降;
C.根据置换反应的定义判断;
D.离子晶体不导电,只有存在自由移动的离子时才导电.A.含有共价键的化合物不一定为共价化合物,如NaOH,含有离子键和共价键,故A错误;
B.氧化还原反应的特征为元素化合价的升降,故B正确;
C.置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,如生成物没有单质参加,则一定不是置换反应,故C错误;
D.离子晶体不导电,只有存在自由移动的离子时才导电,故D错误.
故选:B.点评:
本题考点: 氧化还原反应;离子晶体;化学基本反应类型.
考点点评: 本题综合较为综合,涉及共价键、氧化还原反应、置换反应以及离子晶体等知识,侧重于学生的分析能力和物质的性质的综合考查,为高考常见题型,注意把握题给信息结合元素化合价的角度分析,难度不大.1年前查看全部
- (2011•驻马店)列式计算①105的[2/3]减去88除以[11/4]的商,差是多少?②一个数的[3/4]比[9/2]
(2011•驻马店)列式计算
①105的[2/3]减去88除以[11/4]的商,差是多少?
②一个数的[3/4]比[9/2]的40%少0.8,这个数是多少? mchtang1年前1
mchtang1年前1 -
 superbelieve 共回答了14个问题
superbelieve 共回答了14个问题 |采纳率100%解题思路:①求差,就要知道被减数和减数分别是多少.根据题意,被减数是105×[2/3],减数是88÷[11/4],由此列式解答;
②比[9/2]的40%少0.8的数是[9/2]×40%-0.8=1,也就是说1是这个数的[3/4],那么这个数是1÷[3/4],计算即可.①105×[2/3]-88÷[11/4],
=70-32,
=38;
答:差是38.
②([9/2]×40%-0.8)÷[3/4],
=(1.8-0.8)×[4/3],
=1×[4/3],
=[4/3];
答:这个数是[4/3].点评:
本题考点: 分数的四则混合运算;整数、分数、小数、百分数四则混合运算.
考点点评: ①从问题出发,看看要求的是什么,然后从题目中找出解决问题需要的条件,列式解答;
②关键是求出“比[9/2]的40%少0.8”的数是多少,然后根据“已知一个数的几分之几是多少,求这个数”的应用题,用除法计算.1年前查看全部
- (2009•驻马店二模)下列有关化学实验基本操作的叙述,正确的是( )
(2009•驻马店二模)下列有关化学实验基本操作的叙述,正确的是( )
A.为防止药品污染,实验结束后,用剩的白磷可溶解于CS2后倒入垃圾箱
B.除去淀粉溶液中混有的Na2SO4可以用渗析的方法
C.用玻璃棒蘸取待测液后,点在用蒸馏水润湿的pH试纸上,观察颜色变化并与标准比色卡比较测得该溶液的pH
D.酸碱中和滴定实验中,滴定时眼睛注视滴定管内液面的变化 雷音山人1年前1
雷音山人1年前1 -
 秋叶悟桐 共回答了16个问题
秋叶悟桐 共回答了16个问题 |采纳率87.5%解题思路:A、根据白磷有毒、容易发生自燃分析;
B、根据分散系的粒子直径大小判断;
C、根据pH试纸使用不能湿润进行判断;
D、中和滴定操作中,眼睛应该注视着锥形瓶中溶液的颜色变化.A、由于白磷有毒且容易发生自燃,所以为防止发生中毒、火灾等事故,用剩的白磷不能倒入垃圾箱,故A错误;
B、除去淀粉溶液属于胶体,无法透过半透膜,所以可以用渗析的方法分离淀粉和硫酸钠,故B正确;
C、pH试纸不能用蒸馏水湿润,否则原溶液被稀释,影响测定结果,故C错误;
D、酸碱中和滴定实验中,滴定时眼睛注视锥形瓶中溶液的颜色变化,以便及时判断滴定终点,不需要观察滴定管内液面的变化,故D错误;
故选B.点评:
本题考点: 药品的取用;测定溶液pH的方法;物质的分离、提纯的基本方法选择与应用;中和滴定.
考点点评: 本题考查了化学实验的基本操作,涉及了pH的使用方法、中和滴定操作、剩余药品的处理等知识,难度不大,可以根据所学知识完成.1年前查看全部
- (2009•驻马店二模)如图是工业生产硝酸铵的流程.
(2009•驻马店二模)如图是工业生产硝酸铵的流程.

(1)吸收塔C中通入空气的目的是______.A、B、C、D四个容器中的反应,属于氧化还原反应的是______(填字母).
(2)已知:4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ/mol
N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
写出氨高温催化氧化的热化学方程式:4NH3(g)+5O2(g)
4NO(g)+6H2O(g);△H=-905.8KJ/mol催化剂 .△ 4NH3(g)+5O2(g).
4NO(g)+6H2O(g);△H=-905.8KJ/mol催化剂 .△
(3)已知:N2(g)+3H2(g)⇌2NH3(g)△H=-92kJ/mol.为提高氢气的转化率,宜采取的措施有______(填字母).
A.升高温度B.使用催化剂C.增大压强D.循环利用和不断补充氮气
(4)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为17.6%,求此时H2的转化率?(要有完整的计算过程,结果保留三位有效数字) 爱丽娜121年前1
爱丽娜121年前1 -
 pigwings 共回答了16个问题
pigwings 共回答了16个问题 |采纳率87.5%(1)吸收塔中涉及的反应有:2NO+O2═2NO2;3NO2+H2O═2HNO3+NO;4NO2+O2+H2O═4HNO3;为使NO充分氧化而生成硝酸,应通入过量空气;题中涉及的化学反应有:①N2+3H2⇌2NH3②4NH3+5O2
催化剂
.
△4NO+6H2O③2NO+O2═2NO2④3NO2+H2O═2HNO3+NO⑤4NO2+O2+H2O═4HNO3⑥NH3+HNO3═NH4NO3,
其中①②③④⑤属于氧化还原反应,
故答案为:使NO充分氧化(或者“提高NO的转化率”); ABC;
(2)已知:①4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1266.8kJ/mol,
②N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol,
利用盖斯定律①-2×②可得:4NH3(g)+5O2(g)
催化剂
.
△4NO(g)+6H2O(g);△H=-905.8KJ/mol;
故答案为:4NH3(g)+5O2(g)
催化剂
.
△4NO(g)+6H2O(g);△H=-905.8KJ/mol;
(3)为提高氢气的转化率,应是反应向正反应方向移动,则可采取的措施有:增大压强、循环利用和不断补充氮气、及时分离出氨气,
故答案为:CD;
(4)设开始时H2的物质的量为3 mol,平衡时变化量为xmol
3H2 (g)+N2 (g)⇌2NH3(g)
起始量(mol)3 10
变化量(mol)x [1/3x
2
3]x
平衡量(mol) 3-x 1−
1
3x
2
3x
则平衡时NH3的体积分数为:
2
3xmol
4mol−
2
3xmol×100%=17.6%
解得x=0.9
∴H2转化率为:
0.9mol
3mol×100%=30.0%,答:氢气的转化率是30.0%.1年前查看全部
- (2009•驻马店二模)下列实验中,颜色的变化与氧化还原反应有关的是( )
(2009•驻马店二模)下列实验中,颜色的变化与氧化还原反应有关的是( )
A.往紫色石蕊试液中加入盐酸,溶液变红
B.饱和FeCl3溶液在沸水中变成红褐色胶体
C.向FeSO4溶液中滴加NaOH溶液,生成的沉淀由白色变成灰绿色,最后变成红褐色
D.向滴有酚酞的NaOH溶液中通人SO2,溶液褪色 marbry1年前1
marbry1年前1 -
 xhzly 共回答了18个问题
xhzly 共回答了18个问题 |采纳率94.4%解题思路:A.酸遇紫色石蕊变红;
B.铁离子水解生成胶体;
C.发生复分解反应生成氢氧化亚铁,氢氧化亚铁被氧化为红褐色的氢氧化铁;
D.发生复分解反应生成亚硫酸钠和水.A.酸遇紫色石蕊变红,只与酸性有关,故A不选;
B.铁离子水解生成胶体,只与水解有关,故B不选;
C.发生复分解反应生成氢氧化亚铁,氢氧化亚铁被氧化为红褐色的氢氧化铁,涉及了氧化还原反应,故C选;
D.发生复分解反应生成亚硫酸钠和水,NaOH在反应中消耗,则溶液褪色,只与复分解反应和碱溶液的性质有关,故D不选;
故选C.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,明确颜色变化涉及的化学反应是解答的关键,注意酸碱指示剂的变色和反应的实质,题目难度不大.1年前查看全部
- (2014•驻马店模拟)先化简:([1/a+1]+[1/a−1])÷[2aa2−2a+1
 土豆不土1年前1
土豆不土1年前1 -
 alianpin 共回答了14个问题
alianpin 共回答了14个问题 |采纳率92.9%解题思路:原式括号中两项通分并利用同分母分式的加法法则计算,同时利用除法法则变形,约分得到最简结果,找出不等式解集中a的值,代入计算即可求出值.原式=
a−1+a+1
(a+1)(a−1)•
(a−1)2/2a]=[2a
(a+1)(a−1)•
(a−1)2/2a]=[a−1/a+1],
∵a≠-1,a≠1,a≠0,且-1≤a<3,
则当a=2时,原式=[2−1/2+1]=[1/3].点评:
本题考点: 分式的化简求值.
考点点评: 此题考查了分式的化简求值,熟练掌握运算法则是解本题的关键.1年前查看全部
- (2014•驻马店模拟)已知反比例函数y1=kx的图象与一次函数y2=ax+b的图象交于点A(1,4)和点B(m,-2)
 (2014•驻马店模拟)已知反比例函数y1=
(2014•驻马店模拟)已知反比例函数y1=
的图象与一次函数y2=ax+b的图象交于点A(1,4)和点B(m,-2),k x
(1)求这两个函数的关系式;
(2)观察图象,写出使得y1>y2成立的自变量x的取值范围. sara-wang1年前1
sara-wang1年前1 -
 liyanqiaiping 共回答了19个问题
liyanqiaiping 共回答了19个问题 |采纳率89.5%解题思路:(1)将A坐标代入反比例函数解析式中求出k的值,确定出反比例解析式,将B坐标代入反比例解析式中求出m的值,确定出B坐标,将A与B坐标代入一次函数解析式中求出a与b的值,即可确定出一次函数解析式;
(2)利用图象即可得出所求不等式的解集,即为x的范围.(1)∵函数y1=[k/x]的图象过点A(1,4),即4=[k/1],
∴k=4,
∴反比例函数的关系式为y1=[4/x];
又∵点B(m,-2)在y1=[4/x]上,
∴m=-2,
∴B(-2,-2),
又∵一次函数y2=ax+b过A、B两点,
∴依题意,得
a+b=4
−2a+b=−2,
解得
a=2
b=2,
∴一次函数的关系式为y2=2x+2;
(2)根据图象y1>y2成立的自变量x的取值范围为x<-2或0<x<1.点评:
本题考点: 反比例函数与一次函数的交点问题.
考点点评: 此题考查了一次函数与反比例函数的交点问题,涉及的知识有:待定系数法求函数解析式,利用了数形结合的思想,熟练运用待定系数法是解本题的关键.1年前查看全部
- (2011•驻马店二模)化学与生产、生活密切相关,请用方程式表示下列反应原理:
(2011•驻马店二模)化学与生产、生活密切相关,请用方程式表示下列反应原理:
(1)工业上用一氧化碳还原赤铁矿(主要成分Fe2O3)炼铁;
(2)白炽灯的钨丝表面涂少许红磷可延长灯泡使用寿命;
(3)向空气中撒播碘化银(AgI)微粒可进行人工降雨,碘化银在光照条件下会分解为碘(I2)和银. 思念狗1年前1
思念狗1年前1 -
 limeilin爱荆门 共回答了16个问题
limeilin爱荆门 共回答了16个问题 |采纳率81.3%解题思路:首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写即可.(1)工业上用一氧化碳还原氧化铁炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,反应的化学方程式为Fe2O3+3CO
高温
.
2Fe+3CO2.
(2)红磷能与灯泡内残留的氧气反应生成五氧化二磷,可延长灯泡使用寿命,反应的化学方程式为4P+5O2
点燃
.
2P2O5.
(3)碘化银在光照条件下会分解为碘(I2)和银,反应的化学方程式为2AgI
光照
.
2Ag+I2.
故答案为:(1)Fe2O3+3CO
高温
.
2Fe+3CO2;(2)4P+5O2
点燃
.
2P2O5;(3)2AgI
光照
.
2Ag+I2.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.1年前查看全部
- (2012•驻马店二模)A、B、C三种物质转化关系如图所示.
 (2012•驻马店二模)A、B、C三种物质转化关系如图所示.
(2012•驻马店二模)A、B、C三种物质转化关系如图所示.
(1)如果A是紫红色的金属单质,请写出转化关系中发生复分解反应的化学方程式______;
(2)如果B是能做干燥剂的氧化物,写出B吸水后的产物在生活实际中的一种应用______. 柴火妞儿1年前1
柴火妞儿1年前1 -
 六月玫瑰 共回答了11个问题
六月玫瑰 共回答了11个问题 |采纳率90.9%解题思路:(1)依据A是紫红色的金属单质可知A是金属单质铜,据此对ABC之间的转化关系进行分析即可;
(2)B是能做干燥剂的氧化物,所以可猜测B是氧化钙,据此分析即可;(1)A是紫红色的金属单质可知A是金属单质铜,铜与氧气反应可生成氧化铜B,氧化铜与稀硫酸反应可生硫酸铜C,硫酸铜和铁反应可生成铜A;其中发生的复分解反应的方程式为:Cu0+H2S04=CuS04+H20(合理即可);(2)B是...
点评:
本题考点: 物质的相互转化和制备.
考点点评: 本题考查了常见物质间的相互转化,完成此题,可以依据题干提供的信息结合物质间的反应进行.1年前查看全部
- (2014•驻马店模拟)如图,AB是半圆的直径,点D是弧AC的中点,∠ABC=50°,则∠DAB的度数是______.
 啊啦咯1年前0
啊啦咯1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2011•驻马店二模)如图,食醋是厨房中的一种调味品,其中含有少量醋酸.下列关于醋酸的说法不正确的是( )
 (2011•驻马店二模)如图,食醋是厨房中的一种调味品,其中含有少量醋酸.下列关于醋酸的说法不正确的是( )
(2011•驻马店二模)如图,食醋是厨房中的一种调味品,其中含有少量醋酸.下列关于醋酸的说法不正确的是( )
A.醋酸分子式由碳、氢、氧三种元素构成
B.醋酸中碳元素的质量分数为40%
C.醋酸属于有机物
D.每个醋酸分子中含有8个原子核 haicheng_qin1年前0
haicheng_qin1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2012•驻马店二模)小明同学在做中和反应实验时,向盛有氢氧化钠的溶液的烧杯中滴加盐酸后,发现忘了加指示剂.为确定二者
(2012•驻马店二模)小明同学在做中和反应实验时,向盛有氢氧化钠的溶液的烧杯中滴加盐酸后,发现忘了加指示剂.为确定二者是否恰好完全反应,设计了以下两个实验:
(1)从烧杯中取出少量溶液于试管中,向其中滴加酚酞,震荡,溶液显示无色,由此可以得出什么结论?
(2)如果选用一种物质进一步探究,他可以选用什么物质?如果氢氧化钠与稀盐酸不是恰好完全反应,加入试剂后可观察到的现象是什么? xiaoxiao20061年前1
xiaoxiao20061年前1 -
 重临人间 共回答了25个问题
重临人间 共回答了25个问题 |采纳率92%解题思路:(1)根据酚酞在酸、碱性溶液及中性溶液中所显示的颜色进行分析解答.
(2)可以从检验反应后的溶液中是否含酸进行实验设计,可加入石蕊、金属、碳酸盐、金属氧化物等与酸反应产生明显现象的物质,根据是否有气体生成、溶液颜色变化做出判断.(1)根据题意,从烧杯中取出少量溶液于试管中,向其中滴加酚酞,震荡,溶液显示无色;酚酞试液在酸性和中性溶液中均显无色,故可能是氢氧化钠和稀盐酸恰好反应,溶液呈中性;也可能是稀盐酸过量,溶液显酸性.
(2)探究上述烧杯中的溶液是否恰好完全中和,可以从检验反应后的溶液中是否含酸进行着手设计实验,选择的试剂可以是石蕊、金属、碳酸盐溶液、金属氧化物等,如选择的是碳酸钠溶液,若不是恰好完全反应,加入试剂后可观察到的现象是有气泡产生.
故答案为:(1)反应后的溶液呈中性或酸性;
(2)Na2C03溶液;有气泡产生(合理即可).点评:
本题考点: 中和反应及其应用.
考点点评: 本题以中和反应为载体,考查了学生的实验分析能力,熟练掌握酸、碱的化学性质是正确解答本题的关键所在.1年前查看全部
- (2012•驻马店二模)某兴趣小组设计如下实验,其中A.B为体积未膨胀的气球,C为玻璃量管、D为胶头滴管.装置的气密性良
 (2012•驻马店二模)某兴趣小组设计如下实验,其中A.B为体积未膨胀的气球,C为玻璃量管、D为胶头滴管.装置的气密性良好,实验时把滴管中的液(足量)加入到锥形瓶中并轻轻振荡.请根据下列现象推判瓶中可能发生的反应,并用化学方程式表示:
(2012•驻马店二模)某兴趣小组设计如下实验,其中A.B为体积未膨胀的气球,C为玻璃量管、D为胶头滴管.装置的气密性良好,实验时把滴管中的液(足量)加入到锥形瓶中并轻轻振荡.请根据下列现象推判瓶中可能发生的反应,并用化学方程式表示:
(1)如果B气球胀大,A气球无明显变化:______.
(2)如果A气球胀大B气球无明显变化:
发生的复分解反应是:______;化合反应是______. 释天意1年前1
释天意1年前1 -
 一类 共回答了19个问题
一类 共回答了19个问题 |采纳率78.9%解题思路:根据锥形瓶内的气压发生变化是由于锥形瓶内的气体的改变或温度的改变引起的分析,并选出合适的反应.(1)如果B气球胀大,A气球无明显变化,说明是锥形瓶内的气压变小引起的;而气压变小的原因可能是锥形瓶内的气体被消耗或温度的降低.
因为氢氧化钠溶液能吸收二氧化碳气体,使锥形瓶中的压强减小,导致B气球膨胀,A气球无明显变化.化学方程式为:2NaOH+CO2═Na2CO3+H2O
(2)A气球膨胀,B气球无明显现象,说明锥形瓶中的压强增大.其原因可能是气体的增加或温度的升高引起的.
因为碳酸钙与稀盐酸能产生气体且属于复分解反应,会使瓶内的气压增大,导致A气球膨胀,B气球无明显变化方程式为:CaC03+2HCl=CaCl2+CO2↑+H20.
又因为生石灰与水反应放出热量且属于化合反应,会使瓶内的气压增大,导致A气球膨胀,B气球无明显变化方程式为:CaO+H20=Ca(OH)2.
故答案为:(1)2NaOH+C02=Na2CO3+Hz0
(2)CaC03+2HCl=CaCl2+CO2↑+H20
CaO+H20=Ca(OH)2(合理即可)点评:
本题考点: 反应现象和本质的联系.
考点点评: 本题主要考查了如何根据实验现象来判断反应物等方面的内容,可以依据实验的现象进行.1年前查看全部
- (2008•驻马店二模)某研究性学习小组的同学为在实验室再现二氧化硫催化氧化的过程,同时制取少量三氧化硫晶体,并测量反应
(2008•驻马店二模)某研究性学习小组的同学为在实验室再现二氧化硫催化氧化的过程,同时制取少量三氧化硫晶体,并测量反应后混合气体中SO2的含量,设计了如图所示的装置.
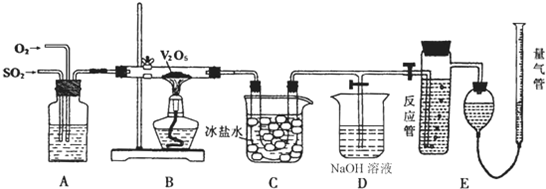
已知:V2O5在450℃左右,活性最好,温度过高或过低都会使催化剂活性下降.
(1)已知3.2g二氧化硫被氧气完全氧化成三氧化硫时,可以放出4.915kJ热量.则该反应的热化学方程式为______.
(2)A装置可用来观察SO2和氧气的进气量.实验时使A中氧气导管冒出的气泡与SO2导管冒出的气泡速率相近,其目的是______.
(3)检查完装置的气密性且加入药品后,开始进行实验.此时首先应该进行的操作是______.
(4)在实验过程中不能持续加热的理由是______.
(5)冰盐水的作用是______.
(6)能用于测定反应后混合气体中SO2含量的是______(填字母)
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液D.氨水、酚酞试液. sennier1年前1
sennier1年前1 -
 elephont 共回答了20个问题
elephont 共回答了20个问题 |采纳率95%解题思路:(1)依据题干数据计算2mol二氧化硫燃烧生成三氧化硫放出的热量,根据热化学方程式书写方法,标注物质聚集状态和对应焓变;
(2)依据化学平衡移动原理,实验时使A中氧气导管冒出的气泡与SO2导管冒出的气泡速率相近,是利用化学平衡移动原理,增大压强浓度提高二氧化硫的转化率;
(3)检查完装置的气密性且加入药品后,开始进行实验.此时首先应该进行的操作是加热,通入气体后发生反应;
(4)依据反应需要的温度和催化剂的活性分析;
(5)分析装置图冰盐水冷却温度得到晶体三氧化硫;
(6)测定硫酸尾气中S02含量,尾气中含有三氧化硫,需要加入与二氧化硫反应的试剂,不与三氧化硫反应,且现象明显.(1)3.2g二氧化硫为0.05mol被氧气完全氧化成三氧化硫时,可以放出4.915kJ热量.2mol二氧化硫被氧气氧化放出热量为196.6KJ,则该反应的热化学方程式为:
2SO2(g)+O2(g)⇌2SO3(g),△H=-196.6kJ/mol;
故答案为:2SO2(g)+O2(g)⇌2SO3(g),△H=-196.6kJ/mol;
(2)实验时使A中氧气导管冒出的气泡与SO2导管冒出的气泡速率相近,依据化学方程式可知氧气过量,根据平衡移动原理,中等压强浓度提高二氧化硫转化率,平衡正向进行;
故答案为:使用过量氧气以提高SO2的转化率;
(3)检查完装置的气密性且加入药品后,开始进行实验.此时首先应该进行的操作是点燃酒精灯加热,反应进行;
故答案为:加热(或点燃酒精灯);
(4)反应是放热反应,温度升高加快反应速率,催化剂在移动温度活性最大,温度过高会使催化剂丧失活性;
故答案为:该反应为放热反应,温度过高催化剂活性降低;
(5)二氧化硫被催化氧化为三氧化硫,利用冰盐水冷却得到三氧化硫晶体;
故答案为:降温,冷却SO3使之成为晶体;
(6)测定硫酸尾气中S02含量,尾气中含有三氧化硫,需要加入与二氧化硫反应的试剂,不与三氧化硫反应,且现象明显;
A、Na0H溶液、酚酞试液和氨水、酚酞试液;和二氧化硫、三氧化硫反应,所以不能准确测定二氧化硫的含量,故A不符合;
B、KMnO4溶液、稀H2SO4和二氧化硫反应,全部反应的现象是到溶液紫红色恰好褪去,故B符合;
C、碘水、淀粉溶液反应,二氧化硫全部反应的现象是蓝色恰好变为无色,故C符合;
D、氨水、酚酞试液,和二氧化硫、三氧化硫反应,所以不能准确测定二氧化硫的含量,故D不符合;
上述高锰酸钾、碘单质和二氧化硫反应,与三氧化硫不反应,所以利用反应,计算被试剂吸收的二氧化硫,得到二氧化硫的含量;
故答案为:BC.点评:
本题考点: 二氧化硫的化学性质.
考点点评: 本题考查了热化学方程式书写,实验验证物质性质的分析判断,物质性质是分析判断的关键,题目难度中等.1年前查看全部
- (2012•驻马店模拟)2011年11月14日晚20时“天宫”与“神八”成功对接,“天宫”与“神八’这次太空中的亲密接触
 (2012•驻马店模拟)2011年11月14日晚20时“天宫”与“神八”成功对接,“天宫”与“神八’这次太空中的亲密接触意味着***成为继美国、俄罗斯后,第三个***掌握航天交会对接技术的***,可谓“一吻定江山”.如图,“天宫”与“神八”对接时,它们以地面为参照物是______的(填“运动”或“静止”),在整个对接过程中“神八”与“天宫-号”通过______进行联系.
(2012•驻马店模拟)2011年11月14日晚20时“天宫”与“神八”成功对接,“天宫”与“神八’这次太空中的亲密接触意味着***成为继美国、俄罗斯后,第三个***掌握航天交会对接技术的***,可谓“一吻定江山”.如图,“天宫”与“神八”对接时,它们以地面为参照物是______的(填“运动”或“静止”),在整个对接过程中“神八”与“天宫-号”通过______进行联系.  ycgd3351年前1
ycgd3351年前1 -
 sarhil 共回答了18个问题
sarhil 共回答了18个问题 |采纳率94.4%解题思路:(1)研究物体的运动情况时,首先要选取一个物体作为标准,这个被选作标准的物体叫做参照物.研究对象的运动情况是怎样的,就看它与参照物的相对位置是否变化.由此来解答第一个空.(2)地面发出的指令通过电磁波传递给空间站.(1)在对接过程中神州八号相对于天宫一号没有发生位置的改变,以天宫一号为参照物,神州八号是静止的;如果以地面为参照物,飞船与地面间的距离越来越远,则飞船是运动的.
(2)电磁波可以在真空中传播,在整个对接过程中“神八”与“天宫-号”通过电磁波进行联系的.
故答案为:运动;电磁波.点评:
本题考点: 运动和静止的相对性;电磁波的传播.
考点点评: 一个物体的运动状态的确定,关键取决于所选取的参照物.所选取的参照物不同,得到的结论也不一定相同.这就是运动和静止的相对性.1年前查看全部
- (2014•驻马店模拟)有三张正面分别写有数字-1,1,2的卡片,它们背面完全相同,现将这三张卡片背面朝上洗匀后随即抽取
(2014•驻马店模拟)有三张正面分别写有数字-1,1,2的卡片,它们背面完全相同,现将这三张卡片背面朝上洗匀后随即抽取一张,以其正面数字作为a的值,然后再从剩余的两张卡片随机抽一张,以其正面的数字作为b的值,则点(a,b)在第二象限的概率为[1/3][1/3].
 jlxxc51年前1
jlxxc51年前1 -
 popeye8352 共回答了23个问题
popeye8352 共回答了23个问题 |采纳率78.3%1年前查看全部
- (2012•驻马店模拟)如图,工人用定滑轮匀速提升重为180N的物体,所用的拉力为200N,在5s内物体升高的高度为2m
 (2012•驻马店模拟)如图,工人用定滑轮匀速提升重为180N的物体,所用的拉力为200N,在5s内物体升高的高度为2m此过程中定滑轮的机械效率是______,有用功的功率是______W.
(2012•驻马店模拟)如图,工人用定滑轮匀速提升重为180N的物体,所用的拉力为200N,在5s内物体升高的高度为2m此过程中定滑轮的机械效率是______,有用功的功率是______W.  liyanmei5211年前1
liyanmei5211年前1 -
 mlitn 共回答了18个问题
mlitn 共回答了18个问题 |采纳率88.9%解题思路:(1)已知物体的重力和升高的高度,则由W有=Gh求出有用功;利用W总=FS求出总功;再利用机械效率公式可求定滑轮的机械效率.
(2)直接利用P=
有用功率.W有 t (1)W有=Gh=180N×2m=360J;W总=FS=200N×2m=400J;
η=
W有
W总×100%=[360J/400J]×100%=90%;
(2)P=
W有
t=[360J/5s]=72W.
故答案为:90%;72.点评:
本题考点: 滑轮(组)的机械效率;功率的计算.
考点点评: 本题考查了有用功、总功、功率及机械效率的计算,清楚有用功、总功的含义是本题的关键.1年前查看全部
- (2012•驻马店模拟)如图所示,电源电压保持不变,闭合开关后,当滑动变阻器的滑片由左向右移动时,下列判断正确的是
 (2012•驻马店模拟)如图所示,电源电压保持不变,闭合开关后,当滑动变阻器的滑片由左向右移动时,下列判断正确的是 ( )
(2012•驻马店模拟)如图所示,电源电压保持不变,闭合开关后,当滑动变阻器的滑片由左向右移动时,下列判断正确的是 ( )
A.小灯泡亮度变暗
B.电压表示数变大
C.滑动变阻器分的电压变小
D.电路消耗的总功率不变 aiwogui1年前1
aiwogui1年前1 -
 xzhy615 共回答了18个问题
xzhy615 共回答了18个问题 |采纳率94.4%解题思路:(1)灯泡与滑动变阻器串联,电压表测滑动变阻器右半部分的电压,电流表测电路电流;
(2)根据滑动变阻器滑片的移动方向判断滑动变阻器接入电路的阻值变化情况,由欧姆定律判断电路电流的变化情况;
(3)由功率公式P=I2R判断灯泡功率变化情况,从而判断灯泡亮度变化情况;
(4)由欧姆定律判断灯泡两端电压变化情况,根据串联欧姆定律判断电压表示数变化情况;
(5)根据功率公式P=UI判断电路总功率的变化情况.(1)当滑动变阻器的滑片由左向右移动时,滑动变阻器接入电路的阻值不变,电路总电阻R不变,
电源电压U不变,电路电流I=[U/R]不变;
(2)灯泡电阻RL不变,电路电流I不变,灯泡功率PL=I2RL不变,灯泡亮度不变,故A错误;
(3)滑动变阻器向右移动时,与电压表并联的滑动变阻器阻值R并变小,电路电流不变,
由U=IR并知,电压表示数变小,故B错误;
(4)电路电流I不变,滑动变阻器接入电路的阻值不变,所以滑动变阻器的分压不变,故C错误;
(5)电路电流I不变,电源电压U不变,电路总功率P=UI不变,故D正确.
故选D.点评:
本题考点: 欧姆定律的应用;电压表的使用;滑动变阻器的使用.
考点点评: 分析清楚电路结构、明确各电路元件的连接方式是正确解题的前提,熟练应用欧姆定律及功率公式是正确解题的关键.1年前查看全部
- (2011•驻马店二模)2010年上海世博会开幕式燃放的焰火五颜六色.其中一种焰火药剂的组成中含有Cu(NO3)2,当火
(2011•驻马店二模)2010年上海世博会开幕式燃放的焰火五颜六色.其中一种焰火药剂的组成中含有Cu(NO3)2,当火药燃烧时发生反应的方程式为:2Cu(NO3)2
2CuO+O2↑+4X↑,则X的化学式为______,反应前后氮元素的化合价由______价变为______价.点燃 . lovechao81年前1
lovechao81年前1 -
 qing_feng-11 共回答了17个问题
qing_feng-11 共回答了17个问题 |采纳率94.1%解题思路:根据化学变化前后原子的种类、数目不变,由反应的化学方程式推断反应中生成物X的分子构成,根据分子的构成确定X物质的化学式;
根据化合物中正负化合价代数和为零来计算氮元素的化合价.(1)由反应的化学方程式2Cu(NO3)2
点燃
.
2CuO+O2↑+4X↑,可得知反应前后各原子的个数为
反应前 反应后
Cu原子 2 2
N原子 4 0
O原子 12 4
根据化学反应前后原子的种类、数目不变,生成物X的4个分子中含有4个N原子和8个O原子,则每个X分子由1个N原子和2个O原子构成,因此,物质X的化学式为NO2;
(2)设中Cu(NO3)2氮元素的化合价为x,+2+2x+(-2)×3×2=0,x=+5;
设NO2中氮元素的化合价为y,y+(-2)×2=0,y=+4;
反应前后氮元素的化合价由+5价变为+4价.
故答案为:NO2;+5,+4.点评:
本题考点: 质量守恒定律及其应用;有关元素化合价的计算.
考点点评: 根据化学变化前后原子的种类、数目不变,由反应的化学方程式,可以推断反应中某物质的分子构成及物质化学式的确定.1年前查看全部
- (2009•驻马店二模)常温下,某水溶液M中存在的离子有:Na+、A-、H+、OH-.根据题意回答下列问题:
(2009•驻马店二模)常温下,某水溶液M中存在的离子有:Na+、A-、H+、OH-.根据题意回答下列问题:
(1)若溶液M由0.1mol•L-1的HA溶液与0.1mol•L-1的NaOH溶液等体积混合而得,则溶液M的pH不可能______7(填“大于”、“小于”或“等于”).
(2)若溶液M的pH>7,则c(Na+)______c(A-)(填“>”、“<”或“=”).
(3)常温下,若溶液M由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,则下列说法中正确的是______(填字母).
A.若溶液M呈中性,则溶液M中c(H+)+c(OH-)=2×10-7 mol•L-1
B.若V1=V2,则溶液M的pH一定等于7
C.若溶液M呈酸性,则V1一定大于V2
D.若溶液M呈碱性,则V1一定小于V2. sosmason1年前1
sosmason1年前1 -
 醉客漫步 共回答了22个问题
醉客漫步 共回答了22个问题 |采纳率95.5%解题思路:(1)根据酸的强弱判断混合溶液的pH大小;
(2)如果溶液M的pH>7,则氢离子浓度小于氢氧根离子浓度,根据电荷守恒分析;
(3)A.若混合溶液呈中性,则氢离子浓度等于氢氧根离子浓度;
B.如果二者体积相等,根据酸的强弱判断混合溶液的酸碱性;
C.如果溶液呈酸性,则溶液可能是酸和盐溶液;
D.如果溶液呈碱性,则溶液可能是碱和盐溶液,也可能只是盐溶液.(1)如果酸是强酸,等浓度等体积的二者混合恰好反应生成强酸强碱盐,混合溶液呈中性,如果酸是弱酸,则生成的盐是强碱弱酸盐,其溶液呈碱性,所以则溶液M的pH不可能小于7,
故答案为:小于;
(2)如果溶液M的pH>7,则氢离子浓度小于氢氧根离子浓度,根据电荷守恒知,c(Na+)>c(A-),
故答案为:>;
(3)A.若混合溶液呈中性,则溶液M中c(H+)=c(OH-)=10-7 mol•L-1,所以溶液M中c(H+)+c(OH-)=2×10-7 mol•L-1,故正确;
B.如果二者体积相等,如果酸是强酸,则混合溶液呈中性,如果酸是弱酸,则混合溶液呈酸性,故错误;
C.如果溶液呈酸性,则溶液是酸和盐溶液,酸是弱酸,酸浓度大于氢氧化钠浓度,所以V1不一定大于V2,故错误;
D.如果溶液呈碱性,则溶液可能是碱和盐溶液,也可能只是盐溶液,则V1一定小于V2,故正确;
故选AD.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查了酸碱混合溶液定性判断,明确酸的强弱是解本题关键,根据混合溶液中的氢离子浓度和氢氧根离子浓度相对大小判断溶液的酸碱性,难度中等.1年前查看全部
- (2008•驻马店二模)化合物A溶于水完全电离,生成的离子为I-、NO3-、H+、Mg2+中的两种,在化合物A的水溶液中
(2008•驻马店二模)化合物A溶于水完全电离,生成的离子为I-、NO3-、H+、Mg2+中的两种,在化合物A的水溶液中一定大量共存的是( )
A.Fe3+、Cl-
B.Fe2+、NH4+
C.Al3+、K+
D.AlO2-、Ca2+ lele_beckham1年前1
lele_beckham1年前1 -
 随风的飞雪 共回答了16个问题
随风的飞雪 共回答了16个问题 |采纳率81.3%解题思路:根据化合物A溶于水完全电离,判断A可能含有的离子,碘离子与镁离子、硝酸根离子与氢离子、碘离子与氢离子、硝酸根离子与镁离子,然后根据离子共存条件,离子之间不发生反应的能够大量共存,据此对各选项进行分析即可.选项中的离子不与I-、NO3-、H+、Mg2+离子发生反应,才能够一定大量共存,
A、铁离子能够氧化碘离子,在溶液中不能够大量共存,故A错误;
B、亚铁离子能够被稀硝酸氧化,在溶液中不能够大量共存,故B错误;
C、铝离子和钾离子不与题干中各离子反应,在溶液中能够大量共存,故C正确;
D、偏铝酸根离子能够与氢离子反应,在溶液中不能够大量共存,故D错误;
故选:C.点评:
本题考点: 离子共存问题.
考点点评: 本题考查了离子共存,该题是高考中的高频题,属于中等难度的试题,侧重对学生基础知识的训练和检验.有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.该题需要明确离子不能大量共存的一般情况,即(1)能发生复分解反应的离子之间;(2)能生成难溶物的离子之间;(3)能发生氧化还原反应的离子之间;(4)能发生络合反应的离子之间(如Fe3+和SCN-);解决离子共存问题时还应该注意题目所隐含的条件.1年前查看全部
- (2012•驻马店模拟)下列数据中,接近实际情况的是( )
(2012•驻马店模拟)下列数据中,接近实际情况的是( )
A.一个成人步行的速度大约是10m/s
B.对人体安全的电压为36V
C.一个初中生的质量大约是50kg
D.家用台灯正常工作时,功率大约是200W 娇气女孩1年前1
娇气女孩1年前1 -
 yeak 共回答了26个问题
yeak 共回答了26个问题 |采纳率84.6%解题思路:首先要对选项中涉及的几种物理量有个初步的了解,对于选项中的单位,可根据需要进行相应的换算或转换,排除与生活实际相差较远的选项,找出符合生活实际的答案.A、人步行的速度一般在1.1m/s左右,达不到10m/s(此速度与优秀百米运动员的速度接近),故A错误;
B、对人体安全的电压是指不高于36V的电压,即小于或等于36V;故B错误;
C、初中生的质量(体重)一般在100斤即50kg左右;故C正确;
D、家用台灯正常工作时的功率一般是十几瓦到几十瓦;达不到200W;故D错误;
故选C.点评:
本题考点: 质量的估测;速度与物体运动;电压;电功率.
考点点评: 此题考查对生活中常见物理量的估测,结合对生活的了解和对物理单位的认识,找出符合实际的选项即可.1年前查看全部
- (2011•驻马店) 解方程x+35x=65 42:35=x:57.
 nanana111年前1
nanana111年前1 -
 gongjue11hao 共回答了22个问题
gongjue11hao 共回答了22个问题 |采纳率100%解题思路:(1)x+[3/5]x=[8/5]x,然后等式的两边再同时除以[8/5]即可;
(2)根据比例的基本性质,两内项之积等于两外项之积,把原式改写成[3/5]x=42×[5/7],然后等式的两边同时除以[3/5]即可.(1)x+[3/5]x=[6/5],
[8/5]x=[6/5],
[8/5]x÷[8/5]=[6/5]÷[8/5],
x=[3/4];
(2)42:
3
5=x:
5
7,
[3/5]x=42×[5/7],
[3/5]x=30,
[3/5]x÷[3/5]=30÷[3/5],
x=50.点评:
本题考点: 方程的解和解方程;解比例.
考点点评: 本题主要考查解方程,根据等式的性质进行解答即可.1年前查看全部
- 驻马店属于哪种气候类型该气候类型有什么特征?用所学知识,说明这种气候对当地农业产生的有利和不利影响
 icem1年前1
icem1年前1 -
 angler1104 共回答了15个问题
angler1104 共回答了15个问题 |采纳率73.3%驻马店位于河南中南部,北接漯河,南临信阳,地处淮河上游的丘陵平原地区.位于北纬32°18' -- 33°35 ' ,东经113°10' -- 115°12'之间,驻马店市地处北亚热带与暖温带的过渡地带,气候温和,雨量充沛,光照充足,年平均气温在14.9--15度之间,年平均降雨量为850--960毫米,西部为浅山丘陵,东部为广阔平原.1年前查看全部
- (2009•驻马店二模)下列反应的离子方程式书写正确的是( )
(2009•驻马店二模)下列反应的离子方程式书写正确的是( )
A.盐酸滴入氨水中:H++OH-=H2O
B.Na2S的水解反应:S2-+2H2O=H2S↑+2OH-
C.在碳酸氢镁溶液中加入足量Ca(OH)2溶液:Mg2++2HCO3-+Ca2++2OH一=MgCO3↓+CaCO3↓+2H2O
D.铜片插入硝酸银溶液中:Cu+2Ag+=Cu2++2Ag 必来敲1年前1
必来敲1年前1 -
 AX125 共回答了30个问题
AX125 共回答了30个问题 |采纳率93.3%解题思路:A.一水合氨在离子反应中应保留化学式;
B.硫离子水解分步进行,以第一步为主;
C.碳酸氢镁完全反应,生成氢氧化镁、碳酸钙、水;
D.反应生成硝酸铜和Ag,遵循电子、电荷守恒.A.盐酸滴入氨水中的离子反应为H++NH3.H2O=H2O+NH4+,故A错误;
B.Na2S的水解反应的离子反应为S2-+H2O=HS-+OH-,故B错误;
C.在碳酸氢镁溶液中加入足量Ca(OH)2溶液的离子反应为Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O,故C错误;
D.铜片插入硝酸银溶液中的离子反应为Cu+2Ag+=Cu2++2Ag,故D正确;
故选D.点评:
本题考点: 离子方程式的书写.
考点点评: 本题考查离子反应方程式的书写,为高考常见题型,明确发生的化学反应为解答的关键,涉及水解、与量有关的离子反应等知识点的考查,注意选项C为易错点,题目难度不大.1年前查看全部
- (2009•驻马店二模)下列实验过程能引起结果偏高的是( )
(2009•驻马店二模)下列实验过程能引起结果偏高的是( )
①配制100g 10%CuSO4溶液,称取10g硫酸铜晶体溶于90g水中
②质量分数为10%和90%的两种硫酸等质量混合配制50%的硫酸溶液
③配制一定物质的量浓度的硫酸溶液时,定容时俯视容量瓶的刻度线.
A.①②
B.②③
C.③
D.① zhenghf11年前1
zhenghf11年前1 -
 icecrown 共回答了22个问题
icecrown 共回答了22个问题 |采纳率90.9%解题思路:①根据10g硫酸铜晶体中含有的硫酸铜质量偏低进行判断;
②根据硫酸质量和质量分数计算出10%和90%的两种硫酸等质量混合后的质量分数;
③根据定容时俯视容量瓶的刻度线,导致配制溶液的偏大进行分析.①由于称取10g硫酸铜晶体,含有的硫酸铜的质量小于10g,配制的硫酸铜的质量分数小于10%,故①错误;
②设质量为m,10%的硫酸溶液和90%的硫酸混合后,配制的硫酸的质量分数为:[10%m+90%m/2m]=50%,故②错误;
③配制一定物质的量浓度的硫酸溶液时,定容时俯视容量瓶的刻度线,导致配制的溶液的体积偏低,溶质的浓度偏大,故③正确;
故选:C.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了实验操作中的误差分析,注意平时多积累误差分析的方法,本题难度不大.1年前查看全部
- 2011驻马店高二期末生物答案
 大唐王子1年前1
大唐王子1年前1 -
 qingchun99 共回答了23个问题
qingchun99 共回答了23个问题 |采纳率87%1.A 心肌细胞要持续周律性收缩舒张
2.C 线粒体无颜色,体积较小不易观察,细胞膜根本看不见.
如果要图,我可以发一个我做实验时拍摄的照片,你就清楚了
3.B 动物细胞没有叶绿体,线粒体是有氧呼吸2,3阶段主要场所
4.C 线粒体是有氧呼吸2,3阶段主要场所.叶绿体合成有机物
5.热水使细胞死亡,细胞膜、液泡膜等失去选择透过性事细胞内物质流出
细胞壁本来就是全透膜,这和细胞壁没有关系1年前查看全部
- (2008•驻马店二模)将一块银白色的金属钠放在空气中会发生一系列的变化:表面迅速变暗→“出汗”→变成白色固体(粉末),
(2008•驻马店二模)将一块银白色的金属钠放在空气中会发生一系列的变化:表面迅速变暗→“出汗”→变成白色固体(粉末),下列有关叙述不正确的是( )
A.表面迅速变暗是因为钠与空气中的氧气反应生成了氧化钠
B.“出汗”是因为生成的氢氧化钠吸收空气中的水蒸气在表面形成了溶液
C.最后变成碳酸钠粉末
D.该过程的所有化学反应均为氧化还原反应 渐近稳定1年前1
渐近稳定1年前1 -
 JoannaMo 共回答了13个问题
JoannaMo 共回答了13个问题 |采纳率92.3%解题思路:A.金属钠在空气中易氧化形成氧化钠,出现变暗现象;
B.氧化钠与空气中的水反应生成氢氧化钠,NaOH具有吸水性;
C.氢氧化钠再与空气中的二氧化碳反应生成碳酸钠和水,最终变成白色粉末为碳酸钠;
D.整个过程中只有Na→Na2O的过程为氧化还原反应.A.因钠很活泼,易被氧化,则金属钠在空气中易氧化形成氧化钠,出现变暗现象,故A正确;
B.氧化钠与空气中的水反应生成氢氧化钠,氢氧化钠吸收空气中的水蒸气在表面形成了溶液,可观察到“出汗”,故B正确;
C.生成的氢氧化钠再与空气中的二氧化碳反应生成碳酸钠的结晶水合物,最终风化变成白色粉末为碳酸钠,故C正确;
D.整个过程中只有Na→Na2O的过程中有元素的化合价变化,属于氧化还原反应,其余均不是氧化还原反应,故D错误;
故选D.点评:
本题考点: 钠的化学性质.
考点点评: 本题考查钠在空气中的一系列变化,明确钠及其化合物的性质是解答本题的关键,注意发生的化学反应及氧化还原反应的判断,题目难度不大.1年前查看全部
大家在问
- 1400*600板式排烟口多少风速,风量
- 2检讨书,关于上课讲话的检讨书
- 3应用麦克劳林公式,按x乘幂展开函数f(x)=(x^2-3x+1)^3.
- 4在公交车站中译英
- 5请问your weekend guide是什么?
- 6如图所示的电器设备在工作中,将机械能转 化为电能的是 [ ] A. B. C. D.
- 7运用需求弹性理论说明“薄利多销”和“谷贱伤农”的含义?
- 8请大神帮我分析一下句子的结构,就是主谓宾,定状补成分,谢谢哈
- 91.填上适合的单位.一个药水瓶的容积是100( ).一只铝锅能盛12( )的水.2.单位换算.4升65毫升=( )升=(
- 102012年“世界水日”的主题是“水与粮食安全”,回答5-6题.
- 11(2013•泰州一模)初春的早晨从河边走,会看到水面上方有一层薄薄的雾气,这是主要是因为河水具有较大的______,致使
- 12we have some toys.(改一般疑问句,并作肯定否定回答)
- 13某生产队挖一条300米长的水渠,第一天挖了全长的1/5,第二天挖了余下的1/4
- 14验钞机能检验人民币的真伪,它的原理是利用了______使荧光物质发光,自行车的尾灯是由______组成的.
- 15物理学科中的压强问题一根管子,直径是50cm,从三楼到四楼的长度是8米,原料是水,算对那个连接器就是接通水管的压强 在线

