冶金工业用于冶金的金属是什么
 地势坤152022-10-04 11:39:541条回答
地势坤152022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 xiaogai123 共回答了19个问题
xiaogai123 共回答了19个问题 |采纳率89.5%- 主要是轻金属,镁,铝,钛等
- 1年前
相关推荐
- 下列关于碳的用途的说法中,错误的是:1石墨在高温下可用作润滑剂;2炭墨可用作冶金工业的原料;
下列关于碳的用途的说法中,错误的是:1石墨在高温下可用作润滑剂;2炭墨可用作冶金工业的原料;
3金刚石可用作钻探机的钻头;4活性炭可用作防毒面具里的吸附剂
 独行盗1年前1
独行盗1年前1 -
 邹优丽 共回答了20个问题
邹优丽 共回答了20个问题 |采纳率90%您好.2是错的.应该是炭黑可用作冶金工业的原料,而不是碳墨.
1.石墨为层状结构,高温下行程液态石墨,层间联系打断,可以与各种表面进行紧密的接触,从而达到润滑效果.
2.炭黑在冶金工业中,常用作还原剂,一般是由炭黑在高温下被氧化成一氧化碳,然后由一氧化碳与被冶炼金属反应生成金属氧化物.
3.金刚石的密度及硬度极大,是自然界中已知的硬度最大的物质,所以,可以做钻机探头.
4.活性炭由于其内部的大量的孔隙,可以吸附空气中的大量有毒分子,从而可以作为防毒面具里的吸附剂.1年前查看全部
- (2014•南通三模)一氧化碳被广泛应用于冶金工业和电子工业.
(2014•南通三模)一氧化碳被广泛应用于冶金工业和电子工业.
(1)高炉炼铁是最为普遍的炼铁方法,相关反应的热化学方程式如下:
4CO(g)+Fe3O4(s)═4CO2(g)+3Fe(s)△H=a kJ•mol-1
CO(g)+3Fe2O3(s)═CO2(g)+2Fe3O4(s)△H=b kJ•mol-1
反应3CO(g)+Fe2O3(s)═3CO2(g)+2Fe(s)的△H=[2a+b/3][2a+b/3]kJ•mol-1(用含a、b 的代数式表示).
(2)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到.
第一步:2CH3OH(g)⇌HCOOCH3(g)+2H2(g)△H>0
第二步:HCOOCH3(g)⇌CH3OH(g)+CO(g)△H>0
①第一步反应的机理可以用图表示: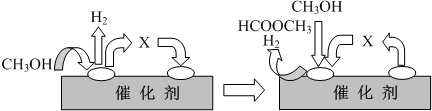
图中中间产物X的结构简式为______.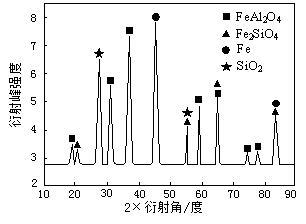
②在工业生产中,为提高CO的产率,可采取的合理措施有______.
(3)为进行相关研究,用CO还原高铝铁矿石,反应后固体物质的X-射线衍射谱图如右图1示(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同).反应后混合物中的一种产物能与盐酸反应生产两种盐,该反应的离子方程式为______.
(4)某催化剂样品(含Ni2O340%,其余为SiO2)通过还原、提纯两步获得镍单质:首先用CO将33.2g样品在加热条件下还原为粗镍;然后在常温下使粗镍中的Ni与CO结合成Ni(CO)4(沸点43℃),并在180℃时使Ni(CO)4重新分解产生镍单质.
上述两步中消耗CO的物质的量之比为______.
(5)为安全起见,工业生产中需对空气中的CO进行监测.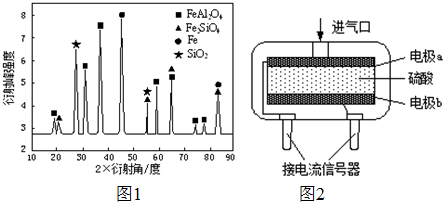
①粉红色的PdCl2溶液可以检验空气中少量的CO.若空气中含CO,则溶液中会产生黑色的Pd沉淀.每生成5.3gPd沉淀,反应转移电子数为______.
②使用电化学一氧化碳气体传感器定量检测空气中CO含量,其结构如右图2示.这种传感器利用原电池原理,则该电池的负极反应式为______. 张ll1年前1
张ll1年前1 -
 zwqzwqzwq 共回答了22个问题
zwqzwqzwq 共回答了22个问题 |采纳率100%解题思路:(1)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(2)①依据分解反应过程和反应机理图示分析判断,中间产物为甲醛;
②反应是气体体积增大的吸热反应,依据化学平衡移动原理分析判断;
(3)反应后混合物中的一种产物能与盐酸反应生产两种盐,依据图示中物质组成分析可知是FeAl2O4,反应生成铁盐和铝盐;
(4)依据反应的化学方程式定量关系分析计算;
(5)①依据生成Pd质量,结合PdCl2~Pd~2e-,计算分析;
②依据原电池原理分析,测定一氧化碳气体含量,使一氧化碳发生氧化还原反应生成二氧化碳,原电池的负极是失电子发生氧化反应,据此书写负极电极反应.(1)①4CO(g)+Fe3O4(s)═4CO2(g)+3Fe(s)△H=a kJ•mol-1
②CO(g)+3Fe2O3(s)═CO2(g)+2Fe3O4(s)△H=b kJ•mol-1
依据盖斯定律[2×①+②/3]得到反应热化学方程式为:3CO(g)+Fe2O3(s)═3CO2(g)+2Fe(s)的△H=[2a+b/3]KJ/mol,
故答案为:[2a+b/3];
(2)①依据图示和分解反应过程,结合原子守恒分析,甲醇去氢后得到的是甲醛,
故答案为:HCHO;
②第二步:HCOOCH3(g)⇌CH3OH(g)+CO(g)△H>0,反应是气体体积增大的吸热反应,依据平衡移动原理可知提高一氧化碳产率,应使平衡正向进行,升温,减压实现,
故答案为:升高温度,降低压强;
(3)反应后混合物中的一种产物能与盐酸反应生产两种盐,依据图示中物质组成分析可知是FeAl2O4,反应生成铁盐和铝盐,反应的离子方程式为FeAl2O4+8H+=Fe2++2Al3++4H2O,故答案为:FeAl2O4+8H+=Fe2++2Al3++4H2O;
(4)首先用CO将33.2g样品在加热条件下还原为粗镍;然后在常温下使粗镍中的Ni与CO结合成Ni(CO)4(沸点43℃),并在180℃时使Ni(CO)4重新分解产生镍单质,反应的化学方程式为:Ni2O3+3CO=2Ni+3CO2,Ni+4CO=Ni(CO)4,Ni(CO)4,
△
.
Ni+4CO,两步中消耗CO的物质的量之比为3:8,
故答案为:3:8;
(5)①粉红色的PdCl2溶液可以检验空气中少量的CO.若空气中含CO,则溶液中会产生黑色的Pd沉淀.每生成5.3gPd沉淀,物质的量=[5.3mol/106g/mol]=0.05mol,依据PdCl2~Pd~2e-,转移电子数为0.05mol×2×NA=0.1NA,
故答案为:0.1NA ;
②测定一氧化碳气体含量,使一氧化碳发生氧化还原反应生成二氧化碳,原电池的负极是失电子发生氧化反应,酸性介质中负极电极反应为CO+H2O-2e-=CO2+2H+,
故答案为:CO+H2O-2e-=CO2+2H+.点评:
本题考点: 用盖斯定律进行有关反应热的计算;氧化还原反应的电子转移数目计算;原电池和电解池的工作原理;化学平衡的影响因素.
考点点评: 本题考查了热化学方程式书写和盖斯定律计算应用,图象分析方法,原电池原理的应用,原子守恒,电子守恒的反应过程分析是解题关键,题目难度中等.1年前查看全部
- 在冶金工业上,常用电解法得到Na、Mg、Al等金属,其原因主要是……( ) A.这些金属的化合物熔点低 B.它们都是轻金
在冶金工业上,常用电解法得到Na、Mg、Al等金属,其原因主要是……( )
A.这些金属的化合物熔点低 B.它们都是轻金属 C.它们的性质很活泼 D.此方法成本低  liliantsr1年前1
liliantsr1年前1 -
 shaday320 共回答了21个问题
shaday320 共回答了21个问题 |采纳率90.5%C
某些活泼金属或某些活泼非金属因从化合物中还原或氧化制取很难,故采用电解法。例如:(条件都是电解)
2NaCl=2Na+Cl 2 ↑
MgCl 2 =Mg+Cl 2 ↑
2Al 2 O 3 =4Al+3O 2 ↑
2NaCl+2H 2 O=2NaOH+H 2 ↑+Cl 2 ↑
2KHF 2 =2KF+H 2 ↑+F 2 ↑1年前查看全部
- 一氧化碳的主要化学性质是:性和 性.他的主要用途是作 和在冶金工业作 剂.
 一地在九1年前1
一地在九1年前1 -
 sxgmm 共回答了21个问题
sxgmm 共回答了21个问题 |采纳率95.2%可燃性和还原性.他的主要用途是作燃料 和在冶金工业作还原剂.1年前查看全部
- 一氧化碳为什么能用于冶金工业
 语过留痕1年前1
语过留痕1年前1 -
 神奇力量 共回答了8个问题
神奇力量 共回答了8个问题 |采纳率100%因为CO中的C是+2价,具有强还原性,而金属矿大多数是金属化合物,具有氧化性,所以它们能 发生氧化还原反应,CO能将金属矿(大多数是金属化合物)中的金属还原出来,所以一氧化碳能用于冶金工业中的还原剂.
nCO + 2M2On =高温= 4M + nCO2 这里M是金属, n是金属化合物中的化合价1年前查看全部
- 在冶金工业中高炉炼铁的反应方程式
 wgw321年前1
wgw321年前1 -
 路过的好心人 共回答了17个问题
路过的好心人 共回答了17个问题 |采纳率82.4%高炉炼铁生产时从炉顶装入铁矿石、焦炭、造渣用熔剂(石灰石),从位于炉子下部沿炉周的风口吹入经预热的空气.在高温下焦炭(有的高炉也喷吹煤粉、重油、天然气等辅助燃料)中的碳同鼓入空气中的氧燃烧生成的一氧化碳和氢气,在炉内上升过程中除去铁矿石中的氧,从而还原得到铁.
以赤铁矿,焦碳为例,主反应为:
2C + O2 =高温= 2CO
3CO + Fe2O3 =高温= 2Fe + 3CO21年前查看全部
- 制油墨或油漆需用_;碳的化学性质不活泼,常作_;碳具有还原性,冶金工业常作_;CO+CO2高温生成物_.
 鑀_羊羊1年前1
鑀_羊羊1年前1 -
 xingdaxyz 共回答了14个问题
xingdaxyz 共回答了14个问题 |采纳率92.9%制油墨或油漆需用 含碳有机物;
碳的化学性质不活泼,常作 惰性电极;
碳具有还原性,冶金工业常作 还原剂;
CO+CO2高温生成物 CO和CO2不反应,C和CO2高温生成CO1年前查看全部
- 事物都具有两面性.如:CO可作冶金工业原料,却对人体健康有害;O2可用于急救病人,维持生命活动需要,却参与钢铁的锈蚀过程
事物都具有两面性.如:CO可作冶金工业原料,却对人体健康有害;O2可用于急救病人,维持生命活动需要,却参与钢铁的锈蚀过程.
(1)写出高炉炼铁中CO还原氧化铁的化学反应方程式:Fe2O3+3CO
2Fe+3CO2高温 .Fe2O3+3CO;
2Fe+3CO2高温 .
(2)金属材料包括纯金属以及它们的合金,黄铜(含铜和锌)、生铁都属于______.
钢和生铁由于______元素含量的不同,使得钢和生铁的坚韧性有较大差异.
(3)将黄铜和生铁分别放人足量的稀盐酸中,浸泡后都有残留固体,其中一种固体一定含______,另一种固体一定含______.
(4)铁浸泡在盐酸中发生反应的化学方程式为______,该反应的基本类型是______.
(5)食品包装中,有一些是用铁粉做双吸剂,铁粉既可以防腐又可以保持食品干燥,是因为铁粉能吸收空气中的______和______. hy101年前1
hy101年前1 -
 想说不敢说 共回答了22个问题
想说不敢说 共回答了22个问题 |采纳率95.5%解题思路:(1)工业上用一氧化碳还原氧化铁炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,写出反应的化学方程式即可;
(2)根据黄铜和生铁的组成分析解答;根据生铁和钢的成分分析性能不同的原因.
(3)根据黄铜和生铁的组成及氢前金属可与盐酸反应生成氢气、碳不与盐酸反应分析解答;
(4)据铁和盐酸反应原理书写方程式,并据反应特点判断反应类型;
(5)铁在有水和氧气并存时易生锈.(1)工业上用一氧化碳还原氧化铁炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,反应的化学方程式为Fe2O3+3CO
高温
.
2Fe+3CO2.
(2)黄铜(含铜和锌)、生铁含铁与碳,二者均属于合金;生铁是含碳量为2%~4.3%的铁合金,而钢则是含碳量为0.03%~2%的铁合金.所以,钢和生铁都是铁与碳元素形成的合金,由于该元素含量的不同,使得钢和生铁的坚韧性有较大差异.
(3)铜排在金属活动性顺序表中氢的后面,不与盐酸反应,故放入足量稀盐酸反应后有剩余;生铁中的碳与酸不反应,故放入足量稀盐酸反应后有剩余;
(4)生铁中的铁与稀盐酸反应生成氯化亚铁和氢气,反应的化学方程式为Fe+2HCl=FeCl2+H2↑,该反应由一种单质和一种化合物反应生成另一种单质和化合物,属于置换反应;
(5)铁粉在与水和氧气同时接触时易生锈,利用铁的这点性质,可以作食品双吸剂,故填:水,氧气.
故答案为:(1)3CO+Fe2O3
高温
.
2Fe+3CO2;
(2)合金;碳(或铁)
(3)铜碳
(4)Fe+2HCl=FeCl2+H2↑; 置换反应
(5)氧气(O2);水(H2O)点评:
本题考点: 铁的冶炼;合金与合金的性质;金属的化学性质;生铁和钢;金属锈蚀的条件及其防护;反应类型的判定;书写化学方程式、文字表达式、电离方程式.
考点点评: 了解金属的化学性质、反应类型的判断、合金的相关知识、工业上炼铁的反应原理、一氧化碳的毒性、铁锈蚀的条件、生铁和钢的区别等是正确解答本题的关键,才能依据题意进行正确的分析和解答.1年前查看全部
- 下列物质的用途与其依据的性质不符合的是( ) A.氧气用于急救病人--氧气能供给呼吸 B.一氧化碳用于冶金工业--一氧
下列物质的用途与其依据的性质不符合的是( ) A.氧气用于急救病人--氧气能供给呼吸 B.一氧化碳用于冶金工业--一氧化碳难溶于水 C.石墨常用作电极--石墨具有导电性 D.炭黑常用来制作碳素墨水--碳在常温下化学性质稳定  他乡遇故乡1年前1
他乡遇故乡1年前1 -
 春秋无水 共回答了18个问题
春秋无水 共回答了18个问题 |采纳率72.2%A、氧气能供给呼吸,可用于急救病人,故A正确;
B、一氧化碳用于冶炼金属是因为一氧化碳具有还原性,故B错;
C、石墨具有导电性,常用作电极材料,故C正确;
D、因炭黑的主要成分是碳,而碳在常温下性质稳定,所以常用来制碳素墨水,故D正确;
故选B.1年前查看全部
- 下列关于碳及其化合物的说法,正确的是( )A.碳和一氧化碳的还原性,可用于冶金工业B.与金刚石、石
下列关于碳及其化合物的说法,正确的是( )A.碳和一氧化碳的还原性,可用于冶金工业B.与金刚石、石
下列关于碳及其化合物的说法,正确的是( )
A.碳和一氧化碳的还原性,可用于冶金工业
B.与金刚石、石墨一样,活性炭是碳的另一种单质
C.二氧化碳和一氧化碳都可以使动物死亡,所以都有毒性
D.CO2中混有少量的CO,可通过点燃混合气体的方法把CO转化为CO2
 liliang3331年前1
liliang3331年前1 -
 大姐头混的 共回答了17个问题
大姐头混的 共回答了17个问题 |采纳率70.6%A、碳和一氧化碳均具有还原性,可用于冶金工业,故选项说法正确.
B、金刚石、石墨是碳的单质;活性炭的主要成分是碳,含有其它杂质,属于混合物,故选项说法错误.
C、二氧化碳和一氧化碳都可以使动物死亡,分别是因为二氧化碳不能供给呼吸、一氧化碳有毒,故选项说法错误.
D、除去二氧化碳中的一氧化碳不能够通点燃,这是因为当二氧化碳(不能燃烧、不能支持燃烧)大量存在时,少量的一氧化碳是不会燃烧的,故选项说法错误.
故选:A.1年前查看全部
- (2010•德阳模拟)已知图A-J均为中学化学中常见物质,其中反应①在冶金工业上有重要用途,框图中部分产物已经略去.请回
(2010•德阳模拟)已知图A-J均为中学化学中常见物质,其中反应①在冶金工业上有重要用途,框图中部分产物已经略去.请回答下列问题:

(1)E的电子式为______.
(2)反应①的化学方程式是2Al+Fe2O3
2Fe+Al2O3高温 .2Al+Fe2O3.
2Fe+Al2O3高温 .
(3)反应⑥的离子方程式是______.按上图所示制取白色沉淀J,当生成1mol J时,则反应⑤中消耗HCl的物质的量为______mol.
(4)以B、C、NaOH溶液为原料构成原电池,则该电池负极的电极反应式为:______. ie05111年前1
ie05111年前1 -
 ywk3 共回答了27个问题
ywk3 共回答了27个问题 |采纳率88.9%解题思路:红褐色沉淀G为Fe(OH)3,则F为FeCl3,E为FeCl2,C为Fe,反应①为铝热反应,A为Fe2O3,B为Al,D为Al2O3,H为AlCl3,I为NaAlO2,J为Al(OH)3,结合对应物质的性质以及题目要求解答该题.红褐色沉淀G为Fe(OH)3,则F为FeCl3,E为FeCl2,C为Fe,反应①为铝热反应,A为Fe2O3,B为Al,D为Al2O3,H为AlCl3,I为NaAlO2,J为Al(OH)3,
(1)由以上分析可知E为FeCl2,电子式为 ,
,
故答案为: ;
;
(2)反应①为铝热反应,方程式为2Al+Fe2O3
高温
.
2Fe+Al2O3,故答案为:2Al+Fe2O3
高温
.
2Fe+Al2O3;
(3)反应⑥为NaAlO2、Al(OH)3互促水解反应生成氢氧化铝,反应的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓,生成1molAl(OH)3,则需0.25molAl3+,应需要0.75molHCl,
故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;0.75;
(4)以Al、Fe、NaOH溶液为原料构成原电池,则该电池负极的电极反应式为Al+4OH--3e-=AlO2-+2H2O,
故答案为:Al+4OH--3e-=AlO2-+2H2O.点评:
本题考点: 无机物的推断;常见金属元素的单质及其化合物的综合应用.
考点点评: 本题考查无机物的推断,侧重于学生的分析能力和计算能力的考查,为高考常见题型和高频考点,注意把握物质的特性以及用途,为推断题目的突破口,明确物质的种类为解答该题的关键,难度中等,注意物质的性质的学习.1年前查看全部
- 下列几种与碳单质有关的物质中,在冶金工业方面使用最广的是A活性炭B炭黑C焦黑D石墨
 hello_HW1年前1
hello_HW1年前1 -
 orangexiao000 共回答了18个问题
orangexiao000 共回答了18个问题 |采纳率100%C 焦炭 用来还原金属1年前查看全部
- 下列关于碳及其化合物的说法,正确的是( ) A.碳和一氧化碳的还原性,可用于冶金工业
下列关于碳及其化合物的说法,正确的是()
A.碳和一氧化碳的还原性,可用于冶金工业 B.与金刚石、石墨一样,活性炭是碳的另一种单质 C.二氧化碳和一氧化碳都可以使动物死亡,所以都有毒性 D.CO 2 中混有少量的CO,可通过点燃混合气体的方法把CO转化为CO 2  dj19881年前1
dj19881年前1 -
 hanzuhua 共回答了20个问题
hanzuhua 共回答了20个问题 |采纳率95%A
1年前查看全部
- 下列物质的用途中,利用其化学性质的是( ) A.焦炭用于冶金工业 B.氢气用于填充气球 C.活性炭用于吸附色素 D.干
下列物质的用途中,利用其化学性质的是( ) A.焦炭用于冶金工业 B.氢气用于填充气球 C.活性炭用于吸附色素 D.干冰用作致冷剂  天香191年前1
天香191年前1 -
 TalRasha 共回答了14个问题
TalRasha 共回答了14个问题 |采纳率100%A、焦炭用于冶金工业,是利用了焦炭的还原性,发生了化学变化,故A正确;
B、氢气用于填充气球,是利用其密度比空气小,是物理性质,故B错误;
C、活性炭能吸附色素,是利用了其吸附作用,没有生成新物质,故C错误;
D、干冰用作制冷剂,是利用干冰升华带走热量制冷,没有生成新物质,是物理性质,故D错误.
故选A.1年前查看全部
- 事物都具有两面性.如:CO可作冶金工业原料,却对人体健康有害;O2可用于急救病人,维持生命活动需要,却参与钢铁的锈蚀过程
事物都具有两面性.如:CO可作冶金工业原料,却对人体健康有害;O2可用于急救病人,维持生命活动需要,却参与钢铁的锈蚀过程.
(1)写出高炉炼铁中CO还原氧化铁的化学反应方程式:Fe2O3+3CO
2Fe+3CO2高温 .Fe2O3+3CO;煤气中毒是因为CO与血液中______结合,造成人体缺氧.
2Fe+3CO2高温 .
(2)钢铁制品在______中易生锈;钢和生铁都是铁与______元素形成的合金,由于该元素含量的不同,使得钢和生铁的坚韧性有较大差异.根据铁生锈的条件,自行车支架采取的防锈措施是______.
(3)某同学为了验证镁、铁、铜的活动性顺序,他选择了打磨过的铁丝,你认为他还需要先的另外两种溶液是______溶液和______溶液.请根据选定的试剂写出上述实验中发生反应的一个化学方程式______. 爱的猛多1年前1
爱的猛多1年前1 -
 林花谢了春红 共回答了22个问题
林花谢了春红 共回答了22个问题 |采纳率81.8%解题思路:(1)工业上用一氧化碳还原氧化铁炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,写出反应的化学方程式即可;根据一氧化碳中毒的机理进行分析解答.
(2)铁在空气中锈蚀,实际上是铁跟空气中的氧气和水共同作用的结果.根据锈蚀的条件来分析防锈措施.
(3)根据金属与盐溶液反应的规律,结合“三取中”的常用验证金属活动性的方法,可取铁丝与铜、镁的盐溶液进行反应.(1)工业上用一氧化碳还原氧化铁炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,反应的化学方程式为Fe2O3+3CO
高温
.
2Fe+3CO2.一氧化碳能与人体血液中的血红蛋白结合,使血红蛋白不能很好地与氧气结合,从而使人体缺氧而造成“煤气中毒”.
(2)铁在空气中锈蚀,实际上是铁跟空气中的氧气和水共同作用的结果,则钢铁制品在潮湿的空气中易生锈;生铁是含碳量为2%~4.3%的铁合金,而钢则是含碳量为0.03%~2%的铁合金,钢和生铁都是铁与碳元素形成的合金,生铁和钢的主要区别是含碳量不同.自行车架可以用喷漆的方法来防锈.
(3)可把打磨过的铁丝分别插入氯化镁溶液、硫酸铜溶液中,铁丝能置换出硫酸铜中的铜却不能置换氯化镁中的镁,从而得到三种金属的活动性顺序为:镁>铁>铜;铁和硫酸铜反应生成硫酸亚铁和铜,反应的化学方程式是Fe+CuSO4=FeSO4+Cu.
故答案为:(1)Fe2O3+3CO
高温
.
2Fe+3CO2;血红蛋白;(2)潮湿的空气;碳;喷漆;(3)氯化镁;硫酸铜;Fe+CuSO4=FeSO4+Cu.点评:
本题考点: 铁的冶炼;一氧化碳的毒性;金属活动性顺序及其应用;生铁和钢;金属锈蚀的条件及其防护;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,掌握工业上炼铁的反应原理、一氧化碳的毒性、铁锈蚀的条件、生铁和钢的区别等是正确解答本题的关键.验证三种金属活动性强弱关系时,通常采取“三取中”即:取中间金属单质与两端的金属的盐溶液反应或取中间金属的盐溶液与两端金属的单质反应.1年前查看全部
- 氢气是一种热值高的清洁能源,也是重要的化工原料,它具有像碳单质和一氧化碳一样的还原性,也可以用于冶金工业.
 氢气是一种热值高的清洁能源,也是重要的化工原料,它具有像碳单质和一氧化碳一样的还原性,也可以用于冶金工业.
氢气是一种热值高的清洁能源,也是重要的化工原料,它具有像碳单质和一氧化碳一样的还原性,也可以用于冶金工业.
(1)实验室现有一瓶纯净的氢气和一小段的光亮的红色铜丝.某同学用坩埚钳夹住铜丝的一端,将铜丝的a处放在酒精灯火焰上加热一段时间,之后迅速将热铜丝伸入装有氢气的集气瓶中,实验过程如图所示.请你推测实验中铜丝a处的颜色的变化情况______,该实验能证明氢气具有什么化学性质?______.
(2)写出在加热的条件,H2与二氧化锗(GeO2)反应制备金属锗的化学方程式:2H2+GeO2
Ge+2H2O△ .2H2+GeO2;
Ge+2H2O△ .
(3)如何大量、廉价地制备氢气是各国正努力研究的课题.日本科学家最近开发出一种含镍氧化物半导体粉末,将少量这种粉末放入水中,用波长为420nm的可见光照射,能够不断地将水分解成氢气和氧气.
在上述过程中,这种氧化物粉末的作用是______;写出该反应的化学方程式2KClO3
2KCl+3O2↑催化剂 .光照 2KClO3.
2KCl+3O2↑催化剂 .光照  8985171年前1
8985171年前1 -
 美丽心情靠自己 共回答了19个问题
美丽心情靠自己 共回答了19个问题 |采纳率94.7%解题思路:(1)本题时考查氢气的还原性,做氢气还原氧化铜的实验.
根据将铜丝的a处放在酒精灯上加热,会生成氧化铜,迅速将热铜丝伸入装有氢气的集气瓶中,氧化铜被氢气还原为铜进行解答根据在该反应中,氢气得氧,被氧化,说明验证氢气具有还原性进行解答.
(2)书写化学方程式时必须根据题意找出反应物、生成物和反应条件,书写时必须遵守质量守恒定律、依据客观事实.
(3)考虑氧化物粉末的作用是起催化作用;书写化学方程式时必须遵守质量守恒定律、依据客观事实.(1)光亮的红色铜丝,将铜丝的a处放在酒精灯上加热,铜与氧气反应生成氧化铜,迅速将热铜丝伸入装有氢气的集气瓶中,氢气与氧化铜反应,生成铜.故答案为:实验I中铜丝a处表面颜色由光亮的红色逐渐变黑色;实验II中铜丝a处表面颜色逐渐由黑色变成光亮的红色;在反应中氢气得氧,被氧化,说明验证氢气具有还原性.故答案为:还原.
(2)根据质量守恒定律中元素种类不变的特点可知:氢气与三氧化二锗在加热条件下反应除生成锗外,还生成水.该反应的化学方程式为:2H2+GeO2
△
.
Ge+2H2O.
(3)根据题意,该反应是利用水的分解生成氢气和氧气,也就是说含镍氧化物未参加反应只是起到了催化作用.水在含镍氧化物的催化作用和光照下反应生成氢气和氧气.该反应的化学方程式为:2KClO3
催化剂
.
光照2KCl+3O2↑.
故答案为:
(1)先变黑后变红、还原性;
(2)2H2+GeO2
△
.
Ge+2H2O;
(3)起催化作用、2KClO3
催化剂
.
光照2KCl+3O2↑点评:
本题考点: 氢气的化学性质与燃烧实验;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题有一定难度,直接考查氢气还原氧化铜的实验.主要考查同学们根据新信息灵活运用所学化学方程式的书写方法进行书写化学方程式的能力.1年前查看全部
- 在冶金工业上,均不能用通常还原机制的的金属是( ) A.Na Mg Al B.Na K Zn C.Fe Cu Ag D.
在冶金工业上,均不能用通常还原机制的的金属是( ) A.Na Mg Al B.Na K Zn C.Fe Cu Ag D.Na Ca K
老师说答案选A 我也不知道是否正确 想听听你的意见!
 XM沦海笑1年前1
XM沦海笑1年前1 -
 刘成1 共回答了25个问题
刘成1 共回答了25个问题 |采纳率84%全不对吧.
A:Na、Al常用电解法制备,Mg可采用还原法制备(C高温还原MgO)或电解法(电解熔融MgCl2)
B:K、Zn采用还原法制备
C:显然都可用还原法制备
D:Na、Ca用电解法制备,K采用还原法制备
若说不能用通常还原机制(我的理解,就是化学还原法)制备,那么ABCD都不对1年前查看全部
- (1999•杭州)在高温条件下,碳具有______性,所以常用来做冶金工业上的______剂.
 江雪函1年前1
江雪函1年前1 -
 鑫森淼炎圭 共回答了16个问题
鑫森淼炎圭 共回答了16个问题 |采纳率87.5%解题思路:碳的化学性质不活泼,在通常情况下一般不能和其它物质发生化学反应,这是单质碳的化学性质之一,但在高温条件下,碳具有还原性,常用来做冶金工业上的还原剂.碳的化学性质不活泼,在通常情况下一般不能和其它物质发生化学反应,但在高温条件下,碳具有还原性,常用来做冶金工业上的还原剂.如:炼铁 2C+Fe3O4
高温
.
3Fe+2CO2;3C+2Fe2O3
高温
.
4Fe+3CO2;
故答案为:还原性;还原剂.点评:
本题考点: 碳的化学性质.
考点点评: 本题主要考查物质的性质和用途,物质具有多种性质,解答时应该理解物质的用途是由物质的哪种性质决定的.1年前查看全部
- 甲乙丙三种物质一共只含两种元素,甲是冶金工业常用的还原剂,丙是甲在空气中燃烧的生成物之一,但不是酸酐
甲乙丙三种物质一共只含两种元素,甲是冶金工业常用的还原剂,丙是甲在空气中燃烧的生成物之一,但不是酸酐
乙和丙在一定条件下也会反应,该反应的化学式() love11251年前1
love11251年前1 -
 火红天使 共回答了28个问题
火红天使 共回答了28个问题 |采纳率89.3%甲是碳,丙是一氧化碳.甲乙丙三种物质一共只含两种元素,那么乙就有可能是氧气或者二氧化碳.乙和丙在一定条件下也会反应,那么乙只能是氧气.
2CO+O2=点燃=2CO21年前查看全部
- (2005•柳州)柳州钢铁厂利用卧式离心机对冶金工业污水进行处理,每天可分离出300多吨含有氧化铁的污泥作为烧结矿原料.
(2005•柳州)柳州钢铁厂利用卧式离心机对冶金工业污水进行处理,每天可分离出300多吨含有氧化铁的污泥作为烧结矿原料.请你计算:
(1)某课外探究小组欲测定此污泥的成分,要配制10%的稀硫酸490g,需98%的浓硫酸多少克?
(2)若测得污泥中氧化铁的质量分数为60%,按每天分离出300t污泥计算,理论上可炼成纯铁多少吨?(炼铁的化学方程式为Fe2O3+3CO═2Fe+3CO2;假设污泥中的其它成分不含铁.) CFO20081年前1
CFO20081年前1 -
 谢谢了啊 共回答了20个问题
谢谢了啊 共回答了20个问题 |采纳率90%解题思路:(1)根据浓溶液和稀溶液中溶质质量不变列等式求解;
(2)利用化学方程式根据氧化铁的质量求出铁的质量.(1)设需要98%的浓硫酸的质量为X
490g×10%=X×98%
X=50g
(2)设理论上可炼成纯铁的质量为y
Fe2O3+3CO
高温
.
2Fe+3CO2
160 112
300t×60% y
[160/300t×60%=
112
y]
y=126t
答:(1)需98%浓硫酸50g.(2)理论上可炼成纯铁126t.点评:
本题考点: 含杂质物质的化学反应的有关计算;有关溶质质量分数的简单计算.
考点点评: 此题主要考查化学方程式的有关计算,完成此题,可以依据物质间反应的化学方程式求出所需物质的质量,然后求出所需不同物质的成本进行比较即可.1年前查看全部
- (14 分) 一氧化碳被广泛应用于冶金工业和电子工业。
(14 分) 一氧化碳被广泛应用于冶金工业和电子工业。
⑴高炉炼铁是最为普遍的炼铁方法,相关反应的热化学方程式如下:
4CO(g)+Fe 3 O 4 (s)=4CO 2 (g)+3Fe(s)△H="a" kJ·mol -1
CO(g)+3Fe 2 O 3 (s)=CO 2 (g)+2Fe 3 O 4 (s)△H="b" kJ·mol -1
反应3CO(g)+Fe 2 O 3 (s)=3CO 2 (g)+2Fe(s)的△H= kJ·mol -1 (用含a、b 的代数式表示)。
⑵电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH 3 OH(g) HCOOCH 3 (g)+2H 2 (g)△H>0
HCOOCH 3 (g)+2H 2 (g)△H>0
第二步:HCOOCH 3 (g) CH 3 OH(g) +CO(g) △H>0
CH 3 OH(g) +CO(g) △H>0
①第一步反应的机理可以用下图表示: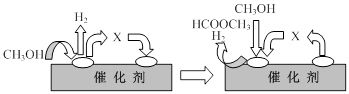
图中中间产物X的结构简式为 。
②在工业生产中,为提高CO的产率,可采取的合理措施有 。
⑶为进行相关研究,用CO还原高铝铁矿石,反应后固体物质的X—射线衍射谱图如图所示(X—射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。反应后混合物中的一种产物能与盐酸反应生产两种盐,该反应的离子方程式为 。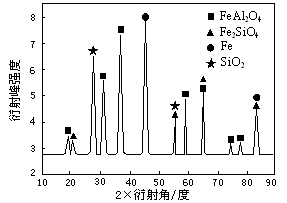
⑷某催化剂样品(含Ni 2 O 3 40%,其余为SiO 2 )通过还原、提纯两步获得镍单质:首先用CO将33.2 g样品在加热条件下还原为粗镍;然后在常温下使粗镍中的Ni与CO结合成Ni(CO) 4 (沸点43 ℃),并在180 ℃时使Ni(CO) 4 重新分解产生镍单质。
上述两步中消耗CO的物质的量之比为 。
⑸为安全起见,工业生产中需对空气中的CO进行监测。
①粉红色的PdCl 2 溶液可以检验空气中少量的CO。若空气中含CO,则溶液中会产生黑色的Pd沉淀。每生成5.3gPd沉淀,反应转移电子数为 。
②使用电化学一氧化碳气体传感器定量检测空气中CO含量,其结构如图所示。这种传感器利用原电池原理,则该电池的负极反应式为 。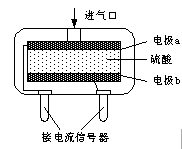
 乐乐_小鱼儿1年前1
乐乐_小鱼儿1年前1 -
 耀眼Dê瞬间 共回答了16个问题
耀眼Dê瞬间 共回答了16个问题 |采纳率75%⑴(2a+b)/3 ⑵①HCHO ②升高温度,降低压强
⑶FeAl 2 O 4 +8H + =Fe 2+ +2Al 3+ +4H 2 O ⑷3:8
⑸①0.1mol(或0.1N A ) ②CO+H 2 O-2e - =CO 2 +2H + (每空2分,共14分)
1年前查看全部
- 某元素有两种常见氧化物,其中有一种是冶金工业常见的还原剂,这种元素是什么
某元素有两种常见氧化物,其中有一种是冶金工业常见的还原剂,这种元素是什么
可以肯定不是N,S,Cu,Fe,Na 此元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点高还是低 为什么 不会下雪的城市1年前1
不会下雪的城市1年前1 -
 ljdzm 共回答了18个问题
ljdzm 共回答了18个问题 |采纳率77.8%是C,低.因为CO2是分子晶体熔化时破坏的是分子间作用力,而SiO2是原子晶体,熔化时破坏的是共价键,共价键的作用远大于分子间作用力,所以CO2的低.1年前查看全部
- 读某区域图,回答下列问题。 小题1:甲城市最具发展优势工业是 A.棉纺织工业 B.冶金工业 C.电子工业 D.机械制造工
读某区域图,回答下列问题。

小题1:甲城市最具发展优势工业是
小题2:图中乙地农业生产的主要限制条件是A.棉纺织工业 B.冶金工业 C.电子工业 D.机械制造工业 A.灌溉不便 B.地形起伏大 C.土地盐碱化 D.光照少  索取手册1年前1
索取手册1年前1 -
 wxk327 共回答了24个问题
wxk327 共回答了24个问题 |采纳率95.8%小题1:B
小题2:C
1年前查看全部
- (2013•资阳)事物都具有两面性.如:CO可作冶金工业原料,却对人体健康有害;O2可用于急救病人,维持生命活动需要,却
(2013•资阳)事物都具有两面性.如:CO可作冶金工业原料,却对人体健康有害;O2可用于急救病人,维持生命活动需要,却参与钢铁的锈蚀过程.
(1)写出高炉炼铁中CO还原氧化铁的化学反应方程式:Fe2O3+3CO
2Fe+3CO2高温 .Fe2O3+3CO;煤气中毒是因为CO与血液中______结合,造成人体缺氧.
2Fe+3CO2高温 .
(2)钢铁制品在______中易生锈;钢和生铁都是铁与______元素形成的合金,由于该元素含量的不同,使得钢和生铁的坚韧性有较大差异. wsq20461年前1
wsq20461年前1 -
 keke200709 共回答了25个问题
keke200709 共回答了25个问题 |采纳率92%解题思路:(1)工业上用一氧化碳还原氧化铁炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,写出反应的化学方程式即可;根据一氧化碳中毒的机理进行分析解答.
(2)铁在空气中锈蚀,实际上是铁跟空气中的氧气和水共同作用的结果.(1)工业上用一氧化碳还原氧化铁炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,反应的化学方程式为Fe2O3+3CO
高温
.
2Fe+3CO2.
一氧化碳能与人体血液中的血红蛋白结合,使血红蛋白不能很好地与氧气结合,从而使人体缺氧而造成“煤气中毒”.
(2)铁在空气中锈蚀,实际上是铁跟空气中的氧气和水共同作用的结果,则钢铁制品在潮湿的空气中易生锈;
生铁是含碳量为2%~4.3%的铁合金,而钢则是含碳量为0.03%~2%的铁合金,钢和生铁都是铁与碳元素形成的合金,生铁和钢的主要区别是含碳量不同.
故答案为:(1)Fe2O3+3CO
高温
.
2Fe+3CO2;血红蛋白;(2)潮湿的空气;碳.点评:
本题考点: 铁的冶炼;一氧化碳的毒性;生铁和钢;金属锈蚀的条件及其防护;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,掌握工业上炼铁的反应原理、一氧化碳的毒性、铁锈蚀的条件、生铁和钢的区别等是正确解答本题的关键.1年前查看全部
- 下列事实跟胶体无关的是 A.医学上血液透析 B.冶金工业上的选矿 C.石油原油的脱水 D.粗盐潮解变湿
下列事实跟胶体无关的是 A.医学上血液透析 B.冶金工业上的选矿 C.石油原油的脱水 D.粗盐潮解变湿
求解释ABC各是什么原理,先给跪了. ss11081年前1
ss11081年前1 -
 llin045 共回答了27个问题
llin045 共回答了27个问题 |采纳率96.3%A.血液透析. 透析仪的作用其实就是一张半透膜,它利用了胶体不能通过半透膜但是溶液离子可以通过半透膜的特点来工作,半透膜的一边流过血液,另一半为浓度低的透析液,那样血液中的有毒物质会以离子或者溶液的形式通过半透膜,但血液不会.
B.选矿,胶体有三种,气溶胶,固溶胶和液溶胶,矿石其实就是固溶胶,工业上通过对矿石的颜色,硬度,含量来选矿.
c.原油脱水,百度是这样说的:原油的脱盐、脱水
又称预处理.从油田送往炼油厂的原油往往含盐(主要是氯化物)、带水(溶于油或呈乳化状态),可导致设备的腐蚀,在设备内壁结垢和影响成品油的组成,需在加工前脱除.常用的办法是加破乳剂和水,使油中的水集聚,并从油中分出,而盐份溶于水中,再加以高压电场配合,使形成的较大水滴顺利除去. 里面运用了聚沉,说明石油脱水也是跟胶体有关.1年前查看全部
- 下列说法不正确的是( )A.一些纳米材料的制备,冶金工业中的选矿,石油原油的脱水,塑料、橡胶及合成纤维等的制造过程都会
下列说法不正确的是( )
A.一些纳米材料的制备,冶金工业中的选矿,石油原油的脱水,塑料、橡胶及合成纤维等的制造过程都会用到胶体
B.植物油、脂肪、矿物油、人造奶油的主要成分都是高级脂肪酸甘油酯
C.首先在实验室制得金属钠的科学家是戴维,同时他还制得了金属镁
D.氢气是21世纪极有前途的新型能源,科学家可以利用蓝绿藻等低等植物和微生物在阳光作用下使水分解产生氢气从而利用氢能 ZHZB1年前1
ZHZB1年前1 -
 笑颜蓝淼 共回答了17个问题
笑颜蓝淼 共回答了17个问题 |采纳率100%解题思路:A.分散质粒子直径在1nm~100nm之间的分散系属于胶体;
B.矿物油中的主要成分是烃类;
C.首先在实验室制得金属钠的科学家是戴维;
D.氢气燃烧放出大量的热量,且燃烧产物是水没有污染.A.纳米材料的制备,冶金工业中的选矿,石油原油的脱水,塑料、橡胶及合成纤维等的制造过程都会用到胶体,故A正确;
B.矿物油中的主要成分是烃类,不是高级脂肪酸甘油酯,故B错误;
C.首先制得金属钠的科学家是戴维,同时他还制得了金属镁,故C正确;
D.氢气燃烧放出大量的热量,且燃烧产物是水没有污染,所以氢气是21世纪极有前途的新型能源,科学家可以利用蓝绿藻等低等植物和微生物在阳光作用下使水分解产生氢气从而利用氢能,故D正确.
故选B.点评:
本题考点: 油脂的性质、组成与结构;纳米材料;清洁能源.
考点点评: 本题考查胶体、矿物油、化学史和能源,题目难度不大,侧重基础知识的考查.1年前查看全部
- 金属的分类按冶金工业分为?按密度大小分为?按金属元素在地壳中的分布及应用分为?
 let39291年前1
let39291年前1 -
 ngcheckfu 共回答了21个问题
ngcheckfu 共回答了21个问题 |采纳率81%有色和黑色(钢铁公司)
轻金属和重金属(以4.5为界)
常量和稀有1年前查看全部
- 事物都具有两面性。如:CO可作冶金工业原料,却对人体健康有害;O 2 可用于急救病人,维持生命活动需要,却参与钢铁的锈蚀
事物都具有两面性。如:CO可作冶金工业原料,却对人体健康有害;O 2 可用于急救病人,维持生命活动需要,却参与钢铁的锈蚀过程。
(1)写出高炉炼铁中CO还原氧化铁的化学反应方程式: ;
(2)金属材料包括纯金属以及它们的合金,黄铜(含铜和锌)、生铁都属于 。钢和生铁由于 元素含量的不同,使得钢和生铁的坚韧性有较大差异。
(3)将黄铜和生铁分别放人足量的稀盐酸中,浸泡后都有残留固体,其中一种固体一定含 ,另一种固体一定含 。
(4)铁浸泡在盐酸中发生反应的化学方程式为 ,该反应的基本类型是 。
(5)食品包装中,有一些是用铁粉做双吸剂,铁粉既可以防腐又可以保持食品干燥,是因为铁粉能吸收空气中的 和 。 luyabc1年前0
luyabc1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 下面说法正确的是()A:O2能跟所有的物质发生氧化反应 B:CO和C都具有还原性,可用于冶金工业 C:香烟的
 77934091年前1
77934091年前1 -
 饭困 共回答了15个问题
饭困 共回答了15个问题 |采纳率93.3%A错误,有些惰性物质不能被氧化
B正确1年前查看全部
- 冶金工业上常用电解熔融MgCl2而不用电解MgO的方法制取镁,其原因是( )
冶金工业上常用电解熔融MgCl2而不用电解MgO的方法制取镁,其原因是( )
A. 熔融的MgO不导电
B. MgO分子间作用力很大
C. MgO熔点高
D. MgO属原子晶体 hero901321年前1
hero901321年前1 -
 terri2001 共回答了17个问题
terri2001 共回答了17个问题 |采纳率76.5%解题思路:氯化镁、MgO都属于离子晶体,在熔融状态下都电离出阴阳离子而导电,但氯化镁的熔点小于氧化镁,据此分析解答.镁为活泼金属,工业上采用电解熔融氯化镁的方法冶炼镁,而不采用电解氧化镁的方法冶炼镁,氯化镁的熔点低于氧化镁,如果电解氧化镁会浪费大量能源,所以用电解熔融氯化镁的方法冶炼镁,故选C.
点评:
本题考点: 电解原理.
考点点评: 本题考查了金属的冶炼,根据金属活泼性强弱确定金属冶炼方法,再结合离子晶体熔点高低确定电解的物质,题目难度不大.1年前查看全部
- 事物都具有两面性.如:CO可作冶金工业原料,却对人体健康有害;O2可用于急救病人,维持生命活动需要,却参与钢铁的锈蚀过程
事物都具有两面性.如:CO可作冶金工业原料,却对人体健康有害;O2可用于急救病人,维持生命活动需要,却参与钢铁的锈蚀过程.
(1)写出高炉炼铁中CO还原氧化铁的化学反应方程式:Fe2O3+3CO
2Fe+3CO2高温 .Fe2O3+3CO;煤气中毒是因为CO与血液中______结合,造成人体缺氧,所以高炉废气______(填“能”或“不能”)直接排入空气.
2Fe+3CO2高温 .
(2)钢铁制品易生锈,我们可以采取的防锈措施是______;钢和生铁都是铁与______元素形成的合金,由于该元素含量的不同,使得钢和生铁的坚韧性有较大差异. 沉静的思念1年前1
沉静的思念1年前1 -
 寄主植物 共回答了22个问题
寄主植物 共回答了22个问题 |采纳率95.5%解题思路:(1)根据炼铁的原理及高炉气中含有一氧化碳分析回答;
(2)根据铁生锈的条件分析防锈的措施,根据生铁和钢的成分分析性能不同的原因.(1)高炉炼铁中CO还原氧化铁的化学反应方程式是:Fe2O3+3CO
高温
.
2Fe+3CO2;煤气中毒是因为CO与血液中血红蛋白结合,从而使人体缺氧而造成“煤气中毒”.由于高炉废气中含有一氧化碳,所以,高炉气不能直接排入空气.
(2)钢铁制品与氧气、水接触易生锈,我们可以采取的防锈措施是刷漆;生铁是含碳量为2%~4.3%的铁合金,而钢则是含碳量为0.03%~2%的铁合金.所以,钢和生铁都是铁与碳元素形成的合金,由于该元素含量的不同,使得钢和生铁的坚韧性有较大差异.
故答为:(1)Fe2O3+3CO
高温
.
2Fe+3CO2、血红蛋白、不能;(2)刷漆等;碳.点评:
本题考点: 一氧化碳的化学性质;一氧化碳的毒性;生铁和钢;金属锈蚀的条件及其防护.
考点点评: 本题难度不大,掌握工业上炼铁的反应原理、一氧化碳的毒性、铁锈蚀的条件、生铁和钢的区别等是正确解答本题的关键1年前查看全部
大家在问
- 1关于消防”一次灭火用水量“的疑惑!
- 2but,however,though等连词在句中的位置及标点符号?
- 3容积的计算方法与体积的计算方法是相同的.这道判断题是对是错?
- 4以元宵节为话题写一篇表达亲情的作文700字
- 5有道数学题,甲每3天去一次图书馆,乙每4天去一次,上个星期5一起去了,问下一个星期几又再次相遇?
- 6小学一年级看图写话:看报
- 7求语言直白点的,因为书上写的什么物质的量什么的听不明白.实在不行举个例子表示一下.
- 8塞下曲六首其一 李白翻译
- 9下列属于仿生技术的是( )A.乌龟的铁甲和薄壳建筑B.萤火虫和冷光C.人脑与智能化的电脑和机器人D.以上都是
- 10小谜语What table can tell you what to do?怎么解谜底timetable,为什么,没想通
- 11太阳能电池板的主要作用,还有太阳能电池板和什么连接才可直接使用的,通过什么来将其连接起来
- 12电压U,在串联电路和并联电路中各有什么特点?
- 131.They are happy 改为一般疑问句,并作肯定回答 2.He is a tall boy 改为一般疑问句 3
- 14围绕"换个角度看问题"的内涵,请仿例句写一句话.
- 15Why did you argue __________ him? A.to B.on C.by
