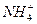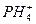碘化烷是无机物还是有机物,为什么能和乙醇钠反应
 米大吧2022-10-04 11:39:541条回答
米大吧2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 chris和cris 共回答了28个问题
chris和cris 共回答了28个问题 |采纳率92.9%- 当然是有机物
反应的机理是亲核取代,需要在堿性溶剂中进行,经过乙氧负离子对碘代烷的进攻,乙氧基取代了碘原子,碘就变成了离子. - 1年前
相关推荐
- 为什么 3氯气+6碘化亚铁=2氯化铁+4碘化铁 这个化学方程式中碘化铁不可能有
 3964079941年前4
3964079941年前4 -
 l5l5qcki 共回答了20个问题
l5l5qcki 共回答了20个问题 |采纳率95%Fe3+能氧化I-,所以FeI3不可能存在.
方程式:2 Fe3+ + 2 I- = 2 Fe2+ + I21年前查看全部
- 红药水跟碘酒用在一起,会生成剧毒物质,碘化亚汞嘛?
红药水跟碘酒用在一起,会生成剧毒物质,碘化亚汞嘛?
主要成份是Hg2Cl2(氯化亚汞),反应方程式 风雨飘零_1年前1
风雨飘零_1年前1 -
 迷失的bluelue 共回答了20个问题
迷失的bluelue 共回答了20个问题 |采纳率100%照常理推测:
Hg2Cl2+I2=Hg2I2(碘化亚汞)+Cl21年前查看全部
- 为什么四氯化碳是液体,甲烷和四氟化碳是气体,四碘化碳是固体?
 风宸1年前1
风宸1年前1 -
 Orchidyan 共回答了20个问题
Orchidyan 共回答了20个问题 |采纳率100%C连的分别是H、F、Cl和I,这四种元素原子核外电子以H最少,I最多,吸引力自是不同,吸引力越大,原子间距离越近,就分别是气体、液体和固体啦.1年前查看全部
- 丙酮碘化反应的速率方程如何设计实验?
 nightmaretop1年前1
nightmaretop1年前1 -
 liumx523 共回答了15个问题
liumx523 共回答了15个问题 |采纳率100%一、实验目的
1)握用孤立法确定反应级数的方法.
2)测定酸催化作用下丙酮碘化反应的速率常数.
3)通过本实验加深对复杂反应特征的理解.
4)掌握光度计和反应-吸收样品池的使用方法.
5)掌握721型分光光度计的使用和校正方法,实验数据的作图处理方法.
二、实验原理:
丙酮碘化的方程式为:
CH3COCH3+I→CH3COCH2I+H﹢+I﹣
该反应是以H+作为催化剂,同时反应自身会生成 ,所以此反应是一个自动催化反应,并且为一个复杂反应,分两步进行:
CH3COCH3+H﹢→CH3COCH=CH2……………………Ⅰ
此反应是丙酮的烯醇化反应,反应可逆并进行的很慢,是控速反应.
CH3COH=CH2+I2→CH3COCH2I+H﹢+I﹣……………………Ⅱ
此反应是烯醇的碘化反应,反应快速并能进行到底.
总反应的速率方程为:
﹣dCI2/dt=kCACH﹢
CI2,CA,CH+,分别为碘,丙酮,酸的浓度;k为总反应速率常数.如果丙酮和酸相对于碘是过量的,则可认为在反应过程中丙酮和酸的浓度基本保持不变,同时,在酸的浓度不太大时,丙酮碘化反应对是个零级反应.对上式进行积分得:
﹣CI2=kCACH﹢t + B
因为碘在可见光区有宽的吸收带,而在此吸收带中,盐酸,丙酮,碘化丙酮和碘化钾溶液均没有明显的吸收,所以可以采用分光光度法直接测量碘浓度的变化.
A=﹣kεLCACH﹢-B
上式中的 εL可通过测定一定浓度的碘溶液的吸光度A带入式中求得.做A-t图,直线的斜率可求出丙酮碘化反应速率常数K值.
有两个以上温度下的速率常数就可以根据阿仑尼乌斯公式估算反应的活化能Ea得值.
ln(k2/k1)= Ea/R(1/T1-1/T2)
三、实验仪器:
721型分光光度计1套,比色管(50mL)3只,超级恒温槽1套,带有恒温夹层的比色皿2个.移液管.
碘溶液(0.05mol·dm-3);标准盐酸溶液(2mol·dm-3);丙酮溶液(2mol·dm-3),碘溶液(0.005mol·dm-3).
四、实验步骤:
1)准备工作
1.开启恒温水浴,控制温度为25℃.
2.测εL值:调光度计波长为590mn,在恒温比色皿中分别注入0.005M碘溶液 和蒸馏水,用蒸馏水调吸光度零点,测吸光度,平行测量三次.30℃时同上.
3.反应液的配制:分别移取5ml碘溶液(0.05M)和5ml酸溶液(2.000M)于25ml比色管中,加大约10ml水,再取10ml丙酮溶液(2.00M)于50ml比色管中,加适量水.(碘溶液和丙酮溶液的体积加在一起不超过50ML)在第三支比色管中注入25ml水,三管同时放入恒温水浴(25℃)中恒温10分钟.30℃同上.
2)测量工作
快速将恒温的碘、酸混合液倾入丙酮溶液中,用恒温水洗涤盛碘酸之比色管,使反应液的总体积为 50ml.将反应液迅速注入2cm比色皿中,每次用蒸馏水调吸光度零点后,测其吸光度值.25℃,每2分钟测一次.记录数据.30℃时1分钟记录一次数据.
五、数据处理
根据数据做回归直线为:
斜率=-反应速率常数*摩尔吸光系数*反应物浓度.
所以可得 反应速率常数K(25℃)=2.236*10-6
同25℃时,可通过斜率计算30℃时的反应速率常数
反应速率常数为5.66*10-6
根据:ln(k2/k1)= Ea/R(1/T1-1/T2)
可得 Ea=131KJ/mol.
六、注意事项:
1)温度影响反应速率常数,实验时体系始终要恒温.
2)实验所需溶液均要准确配制.
⑶混合反应溶液时要在恒温槽中进行,操作必须迅速准确.、实验证明:丙酮卤化时,无论实验中使用那种卤素元素,在某固定温度下,反应的速率常数相同,且反应活化能也相近.1年前查看全部
- 将固体NH4I(碘化氨)置于密闭容器中,在一定温度下发生下列反应
将固体NH4I(碘化氨)置于密闭容器中,在一定温度下发生下列反应
1.NH4I(s)==NH3(g)+HI(g)
2.2HI(g)==H2(g)+I2(g)
达到平衡时 c(H2)=0.5mol/L c(HI)=4mol/L 则此温度下反应1的平衡常数为? dreamxjy1年前3
dreamxjy1年前3 -
 南都王莹 共回答了19个问题
南都王莹 共回答了19个问题 |采纳率84.2%NH4I为固体,基本不影响平衡,反应量可任意.由反应2及c(H2)=0.5得,由NH4I转化的HI共5mol/L,由比例关系,NH3,.5mol/L,
反应1的平衡常数为NH4I;a(a>0),NH3:5,HI:41年前查看全部
- 能发生碘化反应的化合物有哪些呢?
 幻次元1年前3
幻次元1年前3 -
 320小破孩儿 共回答了14个问题
320小破孩儿 共回答了14个问题 |采纳率100%碘化反应是含有-CO-CH3结构的物质所特有的反应
R-CO-CH3+3I2----R-CO-CI3+3HI
R-CO-CI3+NaOH----R-COONa+CHI3↓
CHI3是淡黄色沉淀,这个也就是碘仿反应
由于碘的氢氧化钠溶液中含有IO-,具有一定的氧化性,可以把R-CH(OH)-CH3结构氧化成R-CO-CH3的结构,所以R-CH(OH)-CH3也能发生碘仿反应
所以是具有-CO-CH3或-CH(OH)=CH3结构的物质可以发生碘仿反应1年前查看全部
- 丙酮碘化实验为什么可以用分光光度法测定
 dordor03131年前1
dordor03131年前1 -
 happysde 共回答了23个问题
happysde 共回答了23个问题 |采纳率91.3%由于碘在可见光区有一个较宽的吸收带,所以可以利用分光光度计来测量丙酮碘化过程中碘的浓度随时间的变化规律,从而求出反应的速率常数……1年前查看全部
- 某烃C3H6(A)在低温时与氯作用生成C3H6Cl2(B),在高温时则生成C3H5Cl (C),使(C)与碘化乙基镁作用
某烃C3H6(A)在低温时与氯作用生成C3H6Cl2(B),在高温时则生成C3H5Cl (C),使(C)与碘化乙基镁作用得C5H10(D)
试推测出由(A)~(D)的结构式 hyjm991年前2
hyjm991年前2 -
 知青部落 共回答了14个问题
知青部落 共回答了14个问题 |采纳率92.9%A不饱和度有1,所以可能有一个双键(丙烯),或者形成一个环(环丙烷),但是可以发生加成,所以A是丙烯CH2=CH-CH3
B是Cl-CH2-CHCl-CH3
C是CH2=CH-CH2-Cl
D是CH2=CH-CH2-CH2-CH31年前查看全部
- 下列物质不能使湿润的淀粉碘化钾试纸变蓝的是什么 a 碘水 b 碘酒 c溴水 d 碘化纳
下列物质不能使湿润的淀粉碘化钾试纸变蓝的是什么 a 碘水 b 碘酒 c溴水 d 碘化纳
问 湿润的淀粉碘化钾试纸不是本来就是蓝色的吗 还有 为什么答案选d? 雪灵1年前2
雪灵1年前2 -
 蓝橘子2005 共回答了19个问题
蓝橘子2005 共回答了19个问题 |采纳率94.7%D
变蓝的实质是:淀粉遇到碘单质(I2)发生反应变蓝(注意不是碘离子I-),因此湿润的淀粉碘化钾试纸不是蓝色的,碘化钾中的碘是碘离子,不能使淀粉变蓝.
使湿润的淀粉碘化钾试纸变蓝的原理是:
(1)利用KI中I-有较强的还原性的性质,遇溴水(选项c),氯水,酸性高锰酸钾等氧化性较强的试剂时就可将弱氧化性的碘化钾氧化,置换出碘,会生成I2单质,遇淀粉变蓝
(2)选项(a 碘水 b 碘酒)溶液中含有碘单质(I2)与淀粉碘化钾试纸上的淀粉作用变蓝.
关键要有碘单质存在或生成!
a 碘水含有碘单质(I2)
b 碘酒含有碘单质(I2)
c溴水 可将碘化钾中的碘离子氧化为碘单质(I2)
d 碘化钠只含碘离子I-且不反应,无碘单质(I2)不能使湿润的淀粉碘化钾试纸变蓝1年前查看全部
- 丙酮碘化反应中碘的浓度为什么远小于盐酸以及丙酮的浓度
丙酮碘化反应中碘的浓度为什么远小于盐酸以及丙酮的浓度
具体点可以么............................. 月儿笑在掌心1年前1
月儿笑在掌心1年前1 -
 电脑遥控器 共回答了26个问题
电脑遥控器 共回答了26个问题 |采纳率76.9%多了就会是多取代!所以要控制浓度1年前查看全部
- 为什么室温下甲烷为气体,四氯化碳为液体,而四碘化碳为固体?
 偶不在线1年前4
偶不在线1年前4 -
 我心如帆 共回答了22个问题
我心如帆 共回答了22个问题 |采纳率90.9%楼上全是扯淡
分子量增大,分子间作用力增强1年前查看全部
- Vc能否把碘还原成碘化Vc?
 西塞男人1年前2
西塞男人1年前2 -
 xiaoxu121 共回答了19个问题
xiaoxu121 共回答了19个问题 |采纳率73.7%Vc的结构:
用I2氧化只是把双键上连的两个羟基氧化成酮基,同时双键变成单键.1年前查看全部
- 化学的物质鉴别四瓶未知液体,只知他们是 苯 苯酚 碘化纳 乙醇选用一种试剂鉴别他们 并写出鉴别现象
 时态睡毡1年前1
时态睡毡1年前1 -
 050518 共回答了19个问题
050518 共回答了19个问题 |采纳率89.5%加入溴水
苯 :苯层变红棕色,在上层.
苯酚:有三溴苯酚白色沉淀.
碘化纳:溶液变紫色 (有I2生成)
乙醇:与溴水混溶,不分层.1年前查看全部
- 求5个离子方程式.1溴化亚铁通入少量氯气.2溴化亚铁通入足量氯气.3溴化亚铁和氯气3:4.4碘化亚铁通入少量氯气.5碘化
求5个离子方程式.1溴化亚铁通入少量氯气.2溴化亚铁通入足量氯气.3溴化亚铁和氯气3:4.4碘化亚铁通入少量氯气.5碘化亚铁通入足量氯气.
 柔雨清风1年前2
柔雨清风1年前2 -
 沉默2 共回答了11个问题
沉默2 共回答了11个问题 |采纳率81.8%①2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
② 2Fe2+ + 4Br- + 3Cl2 = 2Fe3+ + 2Br2 + 6Cl-
③ 3Fe2+ + 2Br- + 4Cl2 = 3Fe3+ + Br2 + 8Cl-
④2I- + Cl2 = I2 + 2Cl-
⑤ 2Fe2+ + 4I- + 3Cl2 = 2Fe3+ + 2I2 + 6Cl-1年前查看全部
- 谁有在不同温度下丙酮碘化反应的速率常数?希望各位多多支持,
谁有在不同温度下丙酮碘化反应的速率常数?希望各位多多支持,
我现在没有条件进行实验,可以给现成的不同温度下的丙酮碘化反应的速率常数吗?劳驾了 dodorickey1年前1
dodorickey1年前1 -
 xgc510088 共回答了20个问题
xgc510088 共回答了20个问题 |采纳率90%丙酮碘化反应速率常数的测定
实验目的:
1.掌握用孤立法确定反应级数的方法;
2.测定酸催化作用下丙酮碘化反应的速率常数;
3.通过本实验加深对复杂反应特征的理解;
4.掌握光度计和反应-吸收样品池的使用方法.
实验原理:
丙酮碘化的方程式为:CH3COCH3 + I2 → CH3COCH2I + H+ + I-
该反应是以作为催化剂,同时反应自身会生成 ,所以此反应是一个自动催化反应,并且为一个复杂反应,分两步进行:
CH3COCH3 + H+ → CH3COCH=CH2
此反应是丙酮的烯醇化反应,反应可逆并进行的很慢,是一个速控步.
CH3COH=CH2 + I2 → CH3COCH2I + H+ + I-
此反应是烯醇的碘化反应,反应快速并能进行到底.
总反应的速率方程为:
-dCI2/dt = k CA CH+
分别为碘,丙酮,酸的浓度;k为总反应速率常数.如果丙酮和酸相对于碘是过量的,则可认为在反应过程中丙酮和酸的浓度基本保持不变,同时,在酸的浓度不太大时,丙酮碘化反应对是个零级反应.对上式进行积分得:
-CI2=kCACH+t + B
因为碘在可见光区有宽的吸收带,而在此吸收带中,盐酸,丙酮,碘化丙酮和碘化钾溶液均没有明显的吸收,所以可以采用分光光度法直接测量碘浓度的变化.
A=-kε LCACH+ t - B
上式中的 εL可通过测定一定浓度的碘溶液的吸光度A带入式中求得.做A-t图,直线的斜率可求出丙酮碘化反应速率常数K值.
有两个以上温度下的速率常数就可以根据阿仑尼乌斯公式估算反应的活化能Ea得值.
ln(k2/k1)= Ea/R *(1/T1-1/T2)
实验仪器和试剂:
721型分光光度计1套;比色管 (50mL)3只;超级恒温槽1套; 带有恒温夹层的比色皿1个;移液管(10mL)3只;停表1块
0.005mol/L和0.05mol/L碘溶液 ; 2.00mol/L标准盐酸溶液; 2.00mol/L丙酮溶液
实验步骤:
1.准备
1> 开启恒温水浴,控制温度为35℃(或30℃(另一组做)).
2> 反应溶液的配制:分别移取5ml碘溶液(0.05M)和5ml酸溶液(2.000M)于25ml比色管中,加入约10ml水,再取10ml丙酮溶液(2.000M)于50ml比色管中,加入约10ml水,在第三支比色管中注入25ml水,三管同时放入恒温水浴中恒温10分钟.
3> 测εL值:调光度计“λ”按纽使波长为590nm,调节“0”按纽使指针指向左边零位置,在恒温比色皿中分别注入0.005M碘溶液 和蒸馏水,放入仪器中(外侧放蒸馏水,内侧放碘液).拉动拉杆使光路对准用蒸馏水调吸光度零点(即关闭仪器入口,使指针指向满刻度),然后再拉动拉杆使光路对准样品池,测吸光度,平行测量三次.
2.测量
快速将恒温的碘、酸混合液倾入丙酮溶液中,用恒温水洗涤盛碘酸之比色管,使反应液的总体积为 50ml.将反应液迅速注入2cm比色皿中,每次用蒸馏水调吸光度零点后,测其吸光度值.35℃时,每30秒测一次;(30℃时,每1分钟测一次).
实验数据:
1〉 T=35℃,λ=590nm
(1)测 值:
C=0.005M 1 2 3 平均
A 0.51 0.535 0.54 0.528
(2)测斜率:
时间/min 0 0.5 1 1.5 2 2.5 3 3.5 4 4.5 5 5.5
A 0.42 0.405 0.39 0.38 0.365 0.35 0.34 0.32 0.30 0.285 0.27 0.25
由表(1)知:A=εL c εL=A/c=0.528/0.005=105.6
由表(2)知:Y= - 0.03052x + 0.42353
-kε LCACH+ = -0.03052 (CA =0.4mol/L ; CH+=0.2 mol/L; εL=105.6)
由该式解得 :k2 = 3.613 × 10-3
2〉T=30℃,λ=590nm
(1)测 值
0.005mol/L碘溶液(含4%KI)吸光度 平均值 εL
0.338 0.336 67.200
0.336
0.334
(2)测斜率
t/min 0 1 2 3 4 5
A 0.291 0.260 0.250 0.220 0.205 0.205
t/min 6 7 8 9 10 11
A 0.195 0.175 0.120 0.110 0.095 0.070
由表(1):得 =0.336/0.005=67.200
由表(2):Y= - 0.01922x + 0.28869
- =- 0.01922 (CA =0.4mol/L ; CH+=0.2 mol/L; εL=67.2)
即 =3.575×10-3
3〉求Ea:
由ln(k2/k1)= Ea/R *(1/T1-1/T2)得:
ln(3.613 × 10-3/3.575×10-3)= Ea/8.314 *(1/303.15-1/308.15)
解得 Ea = 1.642kJ/mol
实验注意事项:
⑴ 温度影响反应速率常数,实验时体系始终要恒温.
⑵ 实验所需溶液均要准确配制.
⑶ 混合反应溶液时要在恒温槽中进行,操作必须迅速准确.、实验证明:丙酮卤化时,无论实验中使用那种卤素元素,在某固定温度下,反应的速率常数相同,且反应活化能也相近aww1年前查看全部
- 将固体NH4I(碘化氨)置于密闭容器中,在一定温度下发生下列反应
将固体NH4I(碘化氨)置于密闭容器中,在一定温度下发生下列反应
1.NH4I(s)==NH3(g)+HI(g)
2.2HI(g)==H2(g)+I2(g)
达到平衡时 c(H2)=0.5mol/L c(HI)=4mol/L 则此温度下反应1的平衡常数为?
可以推导出有5MOL的HI NH3生成,还有1MOL的HI反应,但是1的平衡常数为什么可以用4*5=20?在1MOL的HI反应的同时(HI被消耗)1反应不会正向进行吗? yykss1年前2
yykss1年前2 -
 lzxx 共回答了24个问题
lzxx 共回答了24个问题 |采纳率87.5%不用管什么反应1正向,然后2正向,消耗HI,然后反应1再正向,2再消耗HI
既然题目说了,平衡了,就直接用平衡时候的浓度
不用纠结1 2 怎么配合好然后平衡的,反应它自己会平衡的,不用担心
只需要知道平衡时候的浓度
K=4*5=201年前查看全部
- 有关碘化铁(三价的)的问题碘化铁(三价的)为什么在水溶液中不存在?虽然说三价铁的氧化性大于碘离子,会将碘离子氧化成碘单质
有关碘化铁(三价的)的问题
碘化铁(三价的)为什么在水溶液中不存在?
虽然说三价铁的氧化性大于碘离子,会将碘离子氧化成碘单质.
但是银离子的氧化性比三价铁的氧化性更强,为什么碘化银存在?
不要说碘化银不溶于水,没有绝对不溶于水的物质,在水溶液中的银离子为什么不会将碘离子氧化成碘单质呢?使c(Ag+)和c(I-)的浓度降低,是反应不停地进行? 860202001年前3
860202001年前3 -
 看我D 共回答了15个问题
看我D 共回答了15个问题 |采纳率86.7%你说得没错,没有绝对不溶于水的物质,但是AgI溶解度相当低,就算里面的离子发生了反映你也不会察觉.另外,既然你知道没有绝对不溶的物质,就应该知道银和碘单质一样能极少量溶于水.其实这个问题应该用化学反应动力学来解释,但我不知道你学过没有…………1年前查看全部
- 八碘化三铁与碳酸钾反应方程式
 我爱你晓燕1年前1
我爱你晓燕1年前1 -
 asb218 共回答了21个问题
asb218 共回答了21个问题 |采纳率90.5%Fe3I8+4K2CO3+4H2O=Fe(OH)2+2Fe(OH)3+4CO2+8KI1年前查看全部
- 甲状腺可以将氨基酸和碘合成碘化甲状腺球蛋白,其过程如图所示.下面叙述错误的是( )
甲状腺可以将氨基酸和碘合成碘化甲状腺球蛋白,其过程如图所示.下面叙述错误的是( )

A.①是将氨基酸组装成蛋白质的场所
B.与c过程有关的细胞器是③②⑥
C.细胞内的碘浓度远远高于血浆中的碘深度,这表明a是主动运输过程
D.若含18O的氨基酸在细胞内产生的H218O,则水中的18O来自于氨基酸的羧基 coconini1年前1
coconini1年前1 -
 hh2166 共回答了22个问题
hh2166 共回答了22个问题 |采纳率90.9%解题思路:分析图解:图中a表示碘离子经过主动运输的方式进入细胞,b表示蛋白质合成中的翻译过程,c是蛋白质的分泌过程.图二中①是核糖体、②是高尔基体、③是内质网、⑤是线粒体、⑥是囊泡、⑦是核膜.A、氨基酸在①核糖体中发生脱水缩合过程,形成蛋白质,A正确;B、蛋白质进入③内质网腔内盘曲折叠形成甲状腺球蛋白,在②高尔基体腔进行碘化,高尔基体膜“出芽”形成⑥膜泡,膜泡与细胞膜融合,蛋白质最终由细胞膜...
点评:
本题考点: 细胞器之间的协调配合;细胞器中其他器官的主要功能;物质跨膜运输的方式及其异同.
考点点评: 本题难度适中,考查了分泌蛋白的合成过程以及主动运输的有关知识,意在考查考生的识图能力,并能够识记相关基础知识.1年前查看全部
- 碘化膦(PH 4 I)是一种白色晶体。根据你所学的知识,判断下列关于碘化膦的叙述错误的是(
碘化膦(PH 4 I)是一种白色晶体。根据你所学的知识,判断下列关于碘化膦的叙述错误的是( )
A.它是离子晶体,稳定,高温也不分解 B.它的水溶液显酸性 C.能和强碱反应放出气体PH 3 D.该物质中含有共价键和离子键  Infiltrator1年前1
Infiltrator1年前1 -
 风致雪痕 共回答了20个问题
风致雪痕 共回答了20个问题 |采纳率100%1年前查看全部
- 您好…请问一下:四氯化硅、四氟化硅、四碘化硅分别是分子晶体、原子晶体还是离子晶体?
您好…请问一下:四氯化硅、四氟化硅、四碘化硅分别是分子晶体、原子晶体还是离子晶体?
还有个问题就是:哺乳动物成熟的红细胞有哪些特性? 郁闷卡夫卡1年前3
郁闷卡夫卡1年前3 -
 颓废荒原 共回答了16个问题
颓废荒原 共回答了16个问题 |采纳率81.3%四氯化硅(无色透明状液体)、四氟化硅(气体)、四碘化硅都是分子晶体.成熟红细胞无细胞核,而且也无线粒体、核蛋白体等细胞器,不能进行核酸和蛋白质的生物合成,也不能进行有氧氧化,血糖是其唯一的能源.1年前查看全部
- 一道高中化学电子转移题2 Cu(IO3)2(碘酸铜) +24 KI(碘化钾)+12 H2SO4(硫酸)=2 CuI(碘化
一道高中化学电子转移题
2 Cu(IO3)2(碘酸铜) +24 KI(碘化钾)+12 H2SO4(硫酸)=2 CuI(碘化铜)+13 I2(碘单质)
+K2SO4(硫酸钾)+12 H2O(水)
1摩尔氧化剂在反映中得到电子是
A10摩尔
B11摩尔
C12摩尔
D13摩尔 eggstars1年前2
eggstars1年前2 -
 尾鱼 共回答了18个问题
尾鱼 共回答了18个问题 |采纳率77.8%B11摩尔
碘酸铜碘正五价,变成碘0价,1mol碘酸铜中碘酸根有2mol,而有2mol碘酸铜参加反应,电子转移到碘单质中,碘单质是双原子分子,所以转移了5*2*2=20mol的电子.而碘酸铜中的铜是正二价,变成正一价.所以转移了2*1=2mol电子.则一共转移22mol电子.
而一共有2mol氧化剂.所以,1摩尔氧化剂在反映中得到电子是11摩尔.1年前查看全部
- 丙酮碘化反应数率常数中为什么将酸和碘倒入盛有丙酮的容量瓶中没有立即计时
 vir3741年前1
vir3741年前1 -
 雪奴 共回答了22个问题
雪奴 共回答了22个问题 |采纳率95.5%因为所要得到的是一个积分值,不是确定的某一时刻的值,需要的是一段时间内浓度的变化,而不是该时间点的浓度的准确值,因此对在从哪个时间开始计时并没有要求,只要没有反应完全就都可以...1年前查看全部
- 碘单质能和硫化氢反应吗?有碘化铁、溴化铁吗?
 江念鱼1年前2
江念鱼1年前2 -
 青蛇青蛇 共回答了18个问题
青蛇青蛇 共回答了18个问题 |采纳率88.9%I2 + H2S == S + 2HI
有溴化铁,没有碘化铁,因为氧化性:
Br2 〉 Fe3+ 〉 I21年前查看全部
- 溴化铁与碘化纳的离子反应方程式
 小宝贝箉1年前3
小宝贝箉1年前3 -
 smowman 共回答了12个问题
smowman 共回答了12个问题 |采纳率83.3%2Fe(3+)+2I(-)=2Fe(2+)+I21年前查看全部
- 2.24g铁与100ml稀硝酸充分反应,产生气体为NO铁、硝酸均无剩余.反应后的溶液中加入50ml0.2mol/L的碘化
2.24g铁与100ml稀硝酸充分反应,产生气体为NO铁、硝酸均无剩余.反应后的溶液中加入50ml0.2mol/L的碘化钾溶液,恰好将溶液中的Fe³+全部还原.求原硝酸溶液的物质的量的浓度.
 sgs12011年前1
sgs12011年前1 -
 scr79 共回答了14个问题
scr79 共回答了14个问题 |采纳率85.7%∵n(Fe)=m/M=2.24/56=0.04mol
又∵Fe(3+)=n(e(-))=n(I(-))=n(KI)=CV=0.2x50x10^-3=1x10^-2mol
∴n(Fe(2+))=0.04-0.01=0.03mol
∴n(Fe)与硝酸反应=0.01+0.02=0.03mol,(Fe+2Fe(3+)====3Fe(2+))
∴n(HNO3)=3n(Fe(NO3)3)+n(NO)=0.09+1/3n(e(-))=0.09+1/3x0.09=0.12mol
∴C(HNO3)=n/V=1.2mol/L1年前查看全部
- 实验室用白磷(P4)和四碘化二磷(P2I4)与水共同反应来制备碘化磷(PH4I).同时还生成磷酸,下面叙述正确的是
实验室用白磷(P4)和四碘化二磷(P2I4)与水共同反应来制备碘化磷(PH4I).同时还生成磷酸,下面叙述正确的是
A:方程式中P2I4和PH4I的系数比为1:4
B:水在反应中为氧化剂
C:生成的磷酸是还原产物
D:反应过程中无电子得失和偏移
回答时请附上该反应配平后的化学方程式 天高云淡5121年前1
天高云淡5121年前1 -
 喜欢飞不变 共回答了13个问题
喜欢飞不变 共回答了13个问题 |采纳率84.6%A
13P4+10P2I4+128H20=32H3PO4+40PH4I1年前查看全部
- 实验室中用浓硫酸制取氯化氢和氟化氢,为什么不能用浓硫酸制取溴化氢、碘化…
 ww9999991年前1
ww9999991年前1 -
 司徒dd 共回答了22个问题
司徒dd 共回答了22个问题 |采纳率100%浓硫酸除了有酸性、吸水性、脱水性还有强氧化性.
所以不能用来制取有较强还原性的物质.
溴化氢、碘化氢、硫化氢都有较强的还原性,
就算制出来了,也会立刻被氧化成溴单质、碘单质、硫单质甚至更高化合价的物质.
制取溴化氢、碘化氢可以用浓磷酸,
制取硫化氢可以用稀硫酸,
这些酸的氧化性很弱,可以生成想要的气体.
浓硫酸不能制取溴化氢、碘化氢、硫化氢会发生强烈的氧化还原反应
浓硫酸有酸性、吸水性、脱水性.在加热时,还表现强氧化性.
用浓硫酸制取氯化氢是用不挥发性强酸制取挥发性强酸的典型例子.在制取过程中,需要加热.1年前查看全部
- 测定丙酮碘化反应级数所采用的动力学方法是什么啊.
 zhuiri200011年前1
zhuiri200011年前1 -
 yuheng555 共回答了13个问题
yuheng555 共回答了13个问题 |采纳率76.9%固定一种反应物的浓度不变,改变另一种,看速度变多少.速度可以用分光光度法检测I2浓度来判断.最终发现速度跟I2浓度无关,跟H+和丙酮浓度成正比.1年前查看全部
- 碘化什么有毒
 sea011年前2
sea011年前2 -
 竹有千千结 共回答了18个问题
竹有千千结 共回答了18个问题 |采纳率94.4%任何碘化物量大了都对人有毒性,比如碘化钾,摄入量过大肯定要死人,但是微量的碘化钾却是医学上治疗碘缺乏症的良药.1年前查看全部
- 一题化学计算题 向KI溶液中加入AgNO3溶液,直到反应完全,结果反应后溶液的质量恰好等于原碘化
一题化学计算题 向KI溶液中加入AgNO3溶液,直到反应完全,结果反应后溶液的质量恰好等于原碘化
钾溶液的质量,求该硝酸银溶液的质量分数.(计算题哦~~~)答案是:72.3%
想要的是具体过程哦~~~ 将军兵临城下1年前1
将军兵临城下1年前1 -
 臭豆腐isbc 共回答了19个问题
臭豆腐isbc 共回答了19个问题 |采纳率84.2%KI+AgNO3=KNO3+AgI(沉淀)
由于反应后溶液的质量恰好等于反应前原KI溶液的质量
所以AgI(沉淀)的质量跟加入的AgNO3溶液的质量相等
AgNO3质量分数为 AgNO3的式量/AgI的式量=(108+14+48)/(108+127)=72.34%
2.
设KI溶液的质量为m克,所加AgNO3溶液为n克,AgNO3溶液中的溶质的质量分数为x.则有
n+m-{nx/M(AgNO3) *M(AgI)}=m
化简的
x=M(AgNO3)/M(AgI)=169.87/234.77=72.3%
3.
KI+AgNO3=AI+KNO3 AI为生成的沉淀.因为反应后溶液的质量恰好等于原KI溶液的质量,所以加入的AgNO3溶液的质量等于生成的沉淀AI的质量.(这个明白吧?质量守恒定律!)
所以可以知道硝酸银溶液的质量(方程式中生成沉淀AI的质量.可以用它的相对原子质量235计算),其中溶质的质量(方程式中AgNO3的质量.可以用它的相对原子质量170计算)
所以溶质的质量分数为170/235=72.34%1年前查看全部
- 下列离子方程式正确的是( )A.氧化铁溶于氢碘酸:Fe2O3+6H+═2Fe3++3H2OB.在AgCl沉淀中加入碘化
下列离子方程式正确的是( )
A.氧化铁溶于氢碘酸:Fe2O3+6H+═2Fe3++3H2O
B.在AgCl沉淀中加入碘化钾溶液:AgCl(s)+I-(aq)═AgI (s)+Cl-(aq)
C.铜与浓硫酸共热:Cu+4H++SO42-
Cu2++SO2↑+2H2O△ .
D.电解氯化镁溶液:2Cl-+2H2O
Cl2↑+H2↑+2OH-直流电 . zhangyibao1年前1
zhangyibao1年前1 -
 他已不在人世 共回答了15个问题
他已不在人世 共回答了15个问题 |采纳率93.3%解题思路:A、三价铁具有氧化性能氧化碘离子;
B、根据沉淀的转化来分析;
C、浓硫酸不能拆;
D、忽略了Mg2+与OH-的反应.A、氧化铁可溶于氢碘酸,三价铁具有氧化性能氧化碘离子,反应的离子方程式为:Fe2O3+2I-+6H+=2Fe2++3H2O+I2;故A错误;
B、由于AgI的溶解度小于AgCl的溶解度,故AgCl可以转化为AgI,反应的离子方程式为:AgCl(s)+I-(aq)═AgI (s)+Cl-(aq),故B正确;
C、浓硫酸不能拆,故离子方程式应为::Cu+2H2SO4(浓)
△
.
Cu2++SO42-+SO2↑+2H2O,故C错误;
D、电解氯化镁溶液的化学方程式:MgCl2+2H2O
电解
.
Cl2↑+H2↑+Mg(OH)2↓,故离子方程式为:Mg2++2Cl-+2H2O
电解
.
Cl2↑+H2↑+Mg(OH)2↓,故D错误.
故选B.点评:
本题考点: 离子方程式的书写.
考点点评: 本题考查的了离子方程式书写的正误判断,应从是否遗漏反应、物质的拆分是否正确等角度来判断.1年前查看全部
- 碘化砹(AtI)可发生下列反应:①2AtI+2Mg=MgI2+MgAt2;②AtI+2NH3(I)=NH4I+AtNH2
碘化砹(AtI)可发生下列反应:①2AtI+2Mg=MgI2+MgAt2;②AtI+2NH3(I)=NH4I+AtNH2,对上述两个反应的有关说法正确的是( )
A.这两个反应都是氧化还原反应
B.反应①MgAt2既是氧化产物,又是还原产物
C.反应②中AtI既是氧化剂,又是还原剂
D.MgAt2的还原性弱于MgI2的还原性
请说明原因 娃哈哈hwe71年前3
娃哈哈hwe71年前3 -
 心痛的无法呼吸 共回答了18个问题
心痛的无法呼吸 共回答了18个问题 |采纳率88.9%答案是B
A,第一个反应是氧化还原,第二个反应各个元素都没有变价,所以不是氧化还原
B,AtI当做氧化剂,被还原之后生成MgAt2,是还原产物;Mg当还原剂,被氧化之后生成MgI2和MgAt2,所以这两个都是氧化产物.因此MgAt2既是氧化产物有是还原产物.
C,反应2不是氧化还原何来氧化剂还原剂呢?
D,根据氟氯溴碘砹,I的氧化性比At大,所以碘离子的还原性比砹离子的小,所以MgAt2的还原性强于MgI2
综上所述,选B1年前查看全部
- 在丙酮碘化反应的速率方程的实验中,中间的操作时间对实验结果有无影响?
 gps37211年前3
gps37211年前3 -
 远之唇角上扬 共回答了13个问题
远之唇角上扬 共回答了13个问题 |采纳率84.6%我也在找,找到了给个信,1年前查看全部
- 碘化铁,碘化镁,碘化铜是否溶于水?
 tonyholly1年前1
tonyholly1年前1 -
 ooppqq2008 共回答了19个问题
ooppqq2008 共回答了19个问题 |采纳率94.7%碘化铁:易溶于水
碘化镁:易溶于水1年前查看全部
- 碘化溴和碘化钾反应最好标出电子转移和数目
 夜郎0011年前1
夜郎0011年前1 -
 一品掮客 共回答了16个问题
一品掮客 共回答了16个问题 |采纳率93.8%IBr+KI=KBr+I2,溴化碘的碘从碘化钾的碘得到一个电子.1年前查看全部
- 碘化砹与液氨水反应的化学价态变化
碘化砹与液氨水反应的化学价态变化
这个反应是不是自身氧化反应.如果是,氧化剂,还原剂.氧化产物、还原产物还有它们的价态怎么变的.我是高三一轮复习.分不多. 生涩狐狸1年前1
生涩狐狸1年前1 -
 tsdola 共回答了17个问题
tsdola 共回答了17个问题 |采纳率94.1%此化合物碘负一价 砹正一价 反应好象不变价 应该不算1年前查看全部
- 在卤素反应中 为啥加四氯化碳是为了验证什么吗?为啥可以说明氯可以把溴和碘分别从溴化物和碘化物中置换出来;溴可以把碘从碘化
在卤素反应中 为啥加四氯化碳
是为了验证什么吗?
为啥可以说明氯可以把溴和碘分别从溴化物和碘化物中置换出来;溴可以把碘从碘化物中置换出来 garnnet101年前1
garnnet101年前1 -
 汽车引擎 共回答了14个问题
汽车引擎 共回答了14个问题 |采纳率92.9%氯是比较活泼的卤素 可以置换不活泼的卤素
氯溴碘的顺序
为了萃取反应中生成的卤素 根据颜色的不同判断游离的卤素单质是什么1年前查看全部
- 碘化氨是共价化合物吗
 谭给1年前2
谭给1年前2 -
 cs_watch 共回答了20个问题
cs_watch 共回答了20个问题 |采纳率90%不是.它是离子化合物.一般非金属化合物为共价化合物.但是铵根离子是很特殊的,它组成的化合物为离子化合物.1年前查看全部
- 为什么碘代烷不能从烷烃直接碘化获得?
 错乱法师1年前3
错乱法师1年前3 -
 jiandan12 共回答了17个问题
jiandan12 共回答了17个问题 |采纳率82.4%加热或者光照只会让碘代烷分解脱去碘,而不会让碘取代氢,比如CH3I+HI—光照—>CH4 +I2,和氯代的过程恰好相反,因为键能C-I1年前查看全部
- 氮碘化硫,有没有这种东西?SIN
氮碘化硫,有没有这种东西?SIN
硫+4加,碘-1价,氮-3价.有没有这种东西? 帅哥老谭1年前2
帅哥老谭1年前2 -
 思詩吉吉 共回答了17个问题
思詩吉吉 共回答了17个问题 |采纳率94.1%不可能
根据化学原子结构知识,处于中心原子的氧化性必须是最低,也就是碘必须在中间,显正价
如果这种物质存在,那也应该是碘+5价,硫—2价,氮-3价1年前查看全部
- 2.24g铁与100ml稀硝酸充分反应,产生气体为NO铁、硝酸均无剩余。反应后的溶液中加入50ml0.2mol/L的碘化
2.24g铁与100ml稀硝酸充分反应,产生气体为NO铁、硝酸均无剩余。反应后的溶液中加入50ml0.2mol/L的碘化钾溶液,恰好将溶液中的Fe³+全部还原。求原硝酸溶液的物质的量的浓度。
 qtianyuq1年前1
qtianyuq1年前1 -
 成天昆 共回答了25个问题
成天昆 共回答了25个问题 |采纳率16%∵n(Fe)=m/M=2.24/56=0.04mol 又∵Fe(3+)=n(e(-))=n(I(-))=n(KI)=CV=0.2x50x10^-3=1x10^-2mol ∴n(Fe(2+))=0.04-0.01=0.03mol ∴n(Fe)与硝酸反应=0.01+0.02=0.03mol,(Fe+2Fe(3+)====3Fe(2+)) ∴n(HNO3)=3n(Fe(NO3)3...1年前查看全部
- 卤素灯和氙气灯有啥区别据介绍,卤素灯,是在灯泡内渗入少量的的惰性气碘,从灯丝蒸发出来的钨原子与碘原子相遇反应,生成碘化钨
卤素灯和氙气灯有啥区别
据介绍,卤素灯,是在灯泡内渗入少量的的惰性气碘,从灯丝蒸发出来的钨原子与碘原子相遇反应,生成碘化钨化合物,当碘化钨化合物一接触白热化的灯丝(温度超过1450℃),又会分解还原为钨和碘,钨又重新归队回到灯丝中去,碘则重新进入气体中.如此循环不已,灯丝几乎不会烧断,灯泡也不会发黑,所以它要比传统的白炽前照灯寿命更长,亮度更大.现在的汽车普遍采用的都是这种前照灯.氙气灯,英文简称是hid.它所发出的光照亮度是普通卤素灯的两倍,而能耗仅为其三分之二,使用寿命可达普通卤素灯的十倍.氙气灯极大地增加了驾驶的安全性与舒适性,还有助于缓解人们夜间行驶的紧张与疲劳.驾车者可在第一时间内发现危险,从而获得足够的反应时间,很大程度减少了夜间事故发生率.目前***推出的全新奥迪、帕萨特、别克君威、马自达等豪华款均配备了氙气前照灯.从市场上看,氙气前照灯将会成为市场的主流.[groupid=1185]fjzznjwmc群组[/groupid] elba1年前1
elba1年前1 -
 adslgg 共回答了21个问题
adslgg 共回答了21个问题 |采纳率100%氙气灯,英文简称是HID.它所发出的光照亮度是普通卤素灯的两倍,而能耗仅为其三分之二,使用寿命可达普通卤素灯的十倍.查看原帖1年前查看全部
大家在问
- 1写出一个方程,使他的解是(1)3(2)1(3)-1
- 2验证绿叶在光下合成淀粉的实验熄灭酒精灯后,为什么在盖灭火焰后要将灯帽再抬起一下?
- 3我就在你的旁边英文怎么说
- 4计算机组成原理 补码计算设某机字长为8位,X=-0.00111,要求用补码求下列机器数(1)[X/2]补(2)[x/4]
- 5long x=-123456L long 可以写成 long int 么
- 6解下列方程. x-55%=18 13%x-19=17 (2.5+240%)x=14.7.
- 7怎样制作不倒翁 作文
- 8用名称或化学用语填空:(1)3个镁离子______;+2价的铜元素+2Cu+2Cu;(2)写出下列微粒符号中“2”的含义
- 9李明同学所在的课外活动小组进行了一次“探究教室内的温度与哪些因素有关”的活动.
- 10一次函数y=-2x+6的图象不经过的象限是?
- 115米40%等于4米的( ) 一袋大米,吃了总数的10分之1,还剩45千克,这代大米有( )千克
- 12“你做得远不能让人满意”的英文
- 13介绍英语老师60词王老师 男的 有点胖 比较高 很壮 短头发 戴眼镜 英语很流利 40多岁 很幽默 在课堂上 和同学做游
- 1418世纪启蒙思想家把苏格拉底是为他们的先驱和战友,只要是因为苏格拉底
- 15初三英语:翻译5句话.急!用定语从句 1.他是我所知道的最仔细的男孩2.我丢失了一块我父亲给我的手表3.告诉我消息的那个