徐光宪的原子核外电子排布规律近似表达式n+0.7i中i是什么意思
 坠缘2022-10-04 11:39:541条回答
坠缘2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 影弄月 共回答了20个问题
影弄月 共回答了20个问题 |采纳率95%- 原子核外电子排布 1、Pauli不相容原理:每个轨道最多只能容纳两个电子,且自旋相反配对 2、能量最低原理:电子尽可能占据能量最低的轨道 3、Hund规则:简并轨道(能级相同的轨道)只有被电子逐一自旋平行地占据后,才能容纳第二个电子 另外:等价轨道在全充满、半充满或全空的状态是比较稳定的,亦即下列电子结构是比较稳定的: 全充满---p6或d10 或f14 半充满----p3或d5或f7 全空-----p0 或d0或 f0 还有少数元素(如某些原子序数较大的过渡元素和镧系、锕系中的某些元素)的电子排布更为复杂,既不符合鲍林能级图的排布顺序,也不符合全充满、半充满及全空的规律.而这些元素的核外电子排布是由光谱实验结构得出的,我们应该尊重光谱实验事实. 对于核外电子排布规律,只要掌握一般规律,注意少数例外即可. 处于稳定状态的原子,核外电子将尽可能地按能量最低原理排布,另外,由于电子不可能都挤在一起,它们还要遵守保里不相容原理和洪特规则,一般而言,在这三条规则的指导下,可以推导出元素原子的核外电子排布情况,在中学阶段要求的前36号元素里,没有例外的情况发生. 1.最低能量原理 电子在原子核外排布时,要尽可能使电子的能量最低.怎样才能使电子的能量最低呢?比方说,我们站在地面上,不会觉得有什么危险;如果我们站在20层楼的顶上,再往下看时我们心理感到害怕.这是因为物体在越高处具有的势能越高,物体总有从高处往低处的一种趋势,就像自由落体一样,我们从来没有见过物体会自动从地面上升到空中,物体要从地面到空中,必须要有外加力的作用.电子本身就是一种物质,也具有同样的性质,即它在一般情况下总想处于一种较为安全(或稳定)的一种状态(基态),也就是能量最低时的状态.当有外加作用时,电子也是可以吸收能量到能量较高的状态(激发态),但是它总有时时刻刻想回到基态的趋势.一般来说,离核较近的电子具有较低的能量,随着电子层数的增加,电子的能量越来越大;同一层中,各亚层的能量是按s、p、d、f的次序增高的.这两种作用的总结果可以得出电子在原子核外排布时遵守下列次序:1s、2s、2p、3s、3p、4s、3d、4p…… 2.保里不相容原理 我们已经知道,一个电子的运动状态要从4个方面来进行描述,即它所处的电子层、电子亚层、电子云的伸展方向以及电子的自旋方向.在同一个原子中没有也不可能有运动状态完全相同的两个电子存在,这就是保里不相容原理所告诉大家的.根据这个规则,如果两个电子处于同一轨道,那么,这两个电子的自旋方向必定相反.也就是说,每一个轨道中只能容纳两个自旋方向相反的电子.这一点好像我们坐电梯,每个人相当于一个电子,每一个电梯相当于一个轨道,假设电梯足够小,每一个电梯最多只能同时供两个人乘坐,而且乘坐时必须一个人头朝上,另一个人倒立着(为了充分利用空间).根据保里不相容原理,我们得知:s亚层只有1个轨道,可以容纳两个自旋相反的电子;p亚层有3个轨道,总共可以容纳6个电子;d亚层有5个轨道,总共可以容纳10个电子.我们还得知:第一电子层(K层)中只有1s亚层,最多容纳两个电子;第二电子层(L层)中包括2s和2p两个亚层,总共可以容纳8个电子;第3电子层(M层)中包括3s、3p、3d三个亚层,总共可以容纳18个电子……第n层总共可以容纳2n2个电子. 3.洪特规则 从光谱实验结果总结出来的洪特规则有两方面的含义:一是电子在原子核外排布时,将尽可能分占不同的轨道,且自旋平行;洪特规则的第二个含义是对于同一个电子亚层,当电子排布处于 全满(s2、p6、d10、f14) 半满(s1、p3、d5、f7) 全空(s0、p0、d0、f0)时比较稳定.这类似于我们坐电梯的情况中,要么电梯是空的,要么电梯里都有一个人,要么电梯里都挤满了两个人,大家都觉得比较均等,谁也不抱怨谁;如果有的电梯里挤满了两个人,而有的电梯里只有一个人,或有的电梯里有一个人,而有的电梯里没有人,则必然有人产生抱怨情绪,我们称之为不稳定状态. 二、核外电子排布的方法 对于某元素原子的核外电子排布情况,先确定该原子的核外电子数(即原子序数、质子数、核电荷数),如24号元素铬,其原子核外总共有24个电子,然后将这24个电子从能量最低的1s亚层依次
谢谢你认真地看完我的答案,如果我的答案对你有帮助请采纳并评价原创与能解决 - 1年前
相关推荐
- 我国著名化学家徐光宪因在稀土元素等研究领域做出杰出贡献,荣获2008年度“国家最高科学技术奖”.铈(Ce)是一种常见的稀
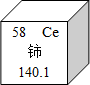 我国著名化学家徐光宪因在稀土元素等研究领域做出杰出贡献,荣获2008年度“国家最高科学技术奖”.铈(Ce)是一种常见的稀土元素,下列关于铈的说法正确的是______
我国著名化学家徐光宪因在稀土元素等研究领域做出杰出贡献,荣获2008年度“国家最高科学技术奖”.铈(Ce)是一种常见的稀土元素,下列关于铈的说法正确的是______
A.中子数是58B.相对原子质量58
C.铈元素是金属元素D.______. 索啦1年前1
索啦1年前1 -
 zxs130 共回答了17个问题
zxs130 共回答了17个问题 |采纳率88.2%解题思路:根据元素周期表中一格提供的信息,原子序数=核外电子数=质子数=58,相对原子质量及化学元素汉字名称的偏旁可辨别元素的种类,金属元素名称一般有“金”字旁进行解答.A、根据元素周期表中一格提供的信息,相对原子质量=质子数+中子数,而原子序数=核外电子数=质子数=58,所以其中子数为:140-58=82;故A错误;
B、根据元素周期表中一格提供的信息,相对原子质量为140.1,故B错误;
C、根据化学元素汉字名称的偏旁可辨别元素的种类,金属元素名称一般有“钅”字旁;可知铈元素是金属元素;故C正确;
D、根据元素周期表中一格提供的信息,质子数为58.
故答案为:C;质子数为58.点评:
本题考点: 元素周期表的特点及其应用.
考点点评: 本题考查学生根据元素周期表中一格提供的信息及辨别元素的种类的方法,进行分析解题的能力.1年前查看全部
- 著名化学家徐光宪获得了2008年度国家最高科学技术奖,他的研究成果使稀土元素的分离变得更加简单.稀土元素包括镧(La)与
著名化学家徐光宪获得了2008年度国家最高科学技术奖,他的研究成果使稀土元素的分离变得更加简单.稀土元素包括镧(La)与钇(Y)等17种元素,被称作当代的“工业味精”.镧、钇原子的本质区别是( )
A.电子数不同
B.中子数不同
C.质子数不同
D.相对原子质量不同 brian144d1年前1
brian144d1年前1 -
 lsj96221 共回答了16个问题
lsj96221 共回答了16个问题 |采纳率81.3%元素是具有相同核电荷数的一类原子的总称,质子数决定元素种类,因此不同元素间的本质区别是质子数不同;
故选C1年前查看全部
- (00d0•云南)4国著名化学家徐光宪因在稀土元素等研究领域做出了杰出贡献,荣获000q年度“国家最高科学技术奖”.铈(
(00d0•云南)4国著名化学家徐光宪因在稀土元素等研究领域做出了杰出贡献,荣获000q年度“国家最高科学技术奖”.铈(1e)是一种常见的稀土元素,铈元素的原子序数是5q,下列关于铈的说法正确的是( )
A.相对原子质量为58
B.中子数为58
C.相对原子质量为140.1g
D.质子数为58 雨叶菡萏1年前1
雨叶菡萏1年前1 -
 jeffrey463 共回答了13个问题
jeffrey463 共回答了13个问题 |采纳率92.3%解题思路:根据原子中:原子序数=核电荷数=核内质子数=核外电子数、相对原子质量=质子数+中子数,结合题意进行分析解答.因为原子0:原子序数=核电荷数=核内质子数=核外电子数,由题意铈元素的原子序数是o8,故其核内质子数和核外电子数均为o8;根据相对原子质量=质子数+0子数,由于无0子数的相关信息,无法确定相对原子质量.
A、相对原子质量=质子数+0子数,由于不知0子数,无法确定相对原子质量,故选项说法错误.
k、由题意,无0子数的相关信息,不能确定其0子数,故选项说法错误.
9、相对原子质量单位是“m”,不是“克”,故选项说法错误.
D、因为原子0:原子序数=核电荷数=核内质子数,由题意铈元素的原子序数是o8,其质子数为o8,故选项说法正确.
故选:D.点评:
本题考点: 原子的有关数量计算.
考点点评: 本题难度不大,解题的关键是掌握并灵活运用原子中原子序数=核电荷数=核内质子数=核外电子数、相对原子质量=质子数+中子数.1年前查看全部
- 我国著名化学家徐光宪因在稀土元素等研究领域做出杰出贡献,荣获2008年度“国家最高科学技术奖”.铈(Ce)是一种常见的稀
 我国著名化学家徐光宪因在稀土元素等研究领域做出杰出贡献,荣获2008年度“国家最高科学技术奖”.铈(Ce)是一种常见的稀土元素,下列关于铈的说法错误的是( )
我国著名化学家徐光宪因在稀土元素等研究领域做出杰出贡献,荣获2008年度“国家最高科学技术奖”.铈(Ce)是一种常见的稀土元素,下列关于铈的说法错误的是( )
A.原子序数是58
B.相对原子质量是140.1
C.质子数为58
D.饰元素是非金属元素 income591年前1
income591年前1 -
 1rrlawyer1 共回答了15个问题
1rrlawyer1 共回答了15个问题 |采纳率86.7%解题思路:根据化学元素汉字名称的偏旁可辨别元素的种类,金属元素名称一般有“金”字旁;
及元素周期表中所提供的信息,原子序数=核外电子数=质子数,元素符号、名称及相对原子质量,进行解答.A、根据元素周期表中所提供的信息,铈元素的原子序数为58;故A说法正确;
B、根据元素周期表中所提供的信息,铈元素的相对原子质量是140.1;故B说法正确;
C、铈元素的质子数为58,故C说法正确;
D、根据化学元素汉字名称的偏旁可辨别元素的种类,金属元素名称一般有“金”字旁;铈元素是金属元素;故D说法错误;
故选:D.点评:
本题考点: 元素周期表的特点及其应用.
考点点评: 本题考查学生对周期表中所提供的信息的理解与在解题中灵活应用的能力.1年前查看全部
- 我国著名化学家徐光宪因在稀土元素等研究领域做出杰出贡献,荣获2008年度“国家最高科学技术奖”.铈(Ce)是一种常见的稀
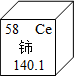 我国著名化学家徐光宪因在稀土元素等研究领域做出杰出贡献,荣获2008年度“国家最高科学技术奖”.铈(Ce)是一种常见的稀土元素,根据右上图提供信息,下列关于铈的说法错误的是( )
我国著名化学家徐光宪因在稀土元素等研究领域做出杰出贡献,荣获2008年度“国家最高科学技术奖”.铈(Ce)是一种常见的稀土元素,根据右上图提供信息,下列关于铈的说法错误的是( )
A.铈元素是非金属元素
B.相对原子质量是140.1
C.质子数为58
D.原子序数是58 hyacinthba1年前1
hyacinthba1年前1 -
 warmail 共回答了20个问题
warmail 共回答了20个问题 |采纳率75%解题思路:根据元素周期表中一格提供的信息,原子序数=核外电子数=质子数=58,相对原子质量及化学元素汉字名称的偏旁可辨别元素的种类,金属元素名称一般有“金”字旁;进行解答.A、根据化学元素汉字名称的偏旁可辨别元素的种类,金属元素名称一般有“金”字旁,可知铈元素是金属元素,故A说法错误;
B、根据元素周期表中一格提供的信息,相对原子质量为140.1,故B说法正确.
C、根据元素周期表中一格提供的信息,原子序数=核外电子数=质子数=58,故C说法正确;
D、根据元素周期表中一格提供的信息,原子序数=核外电子数=质子数=58,故D说法正确.
故选A.点评:
本题考点: 元素周期表的特点及其应用;原子的定义与构成;原子的有关数量计算;元素的简单分类.
考点点评: 本题考查学生根据元素周期表中一格提供的信息及辨别元素的种类的方法,进行分析解题的能力.1年前查看全部
- 我国著名化学家徐光宪因在稀土元素等研究领域做出杰出贡献,荣获2008年度“国家最高科学技术奖”.铈(Ce)是一种常见的稀
我国著名化学家徐光宪因在稀土元素等研究领域做出杰出贡献,荣获2008年度“国家最高科学技术奖”.铈(Ce)是一种常见的稀土元素,根据右上图提供信息,下列关于铈的说法错误的是( ) A.铈元素是非金属元素 B.相对原子质量是140.1 C.质子数为58 D.原子序数是58 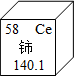
 止损1年前1
止损1年前1 -
 birdcj 共回答了13个问题
birdcj 共回答了13个问题 |采纳率84.6%A、根据化学元素汉字名称的偏旁可辨别元素的种类,金属元素名称一般有“金”字旁,可知铈元素是金属元素,故A说法错误;
B、根据元素周期表中一格提供的信息,相对原子质量为140.1,故B说法正确.
C、根据元素周期表中一格提供的信息,原子序数=核外电子数=质子数=58,故C说法正确;
D、根据元素周期表中一格提供的信息,原子序数=核外电子数=质子数=58,故D说法正确.
故选A.1年前查看全部
- (2013•内江三模)著名化学家徐光宪获得国家最高科学技术奖,以表彰他在稀土萃取理论方面作出的贡献.已知:金属铈(稀土元
(2013•内江三模)著名化学家徐光宪获得国家最高科学技术奖,以表彰他在稀土萃取理论方面作出的贡献.已知:金属铈(稀土元素)在空气中易氧化变暗,受热时燃烧,遇水很快反应.(注:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+>I2.)下列说法正确的是( )
A.铈溶于氢碘酸的化学方程式可表示为:Ce+4HI
CeI4+2H2↑高温 .
B.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+═Ce3++2Fe3+
C.在一定条件下,电解熔融状态的CeO2制Ce,在阴极获得铈
D.四种核素13658Ce、13858Ce、14058Ce、14258Ce,它们互称为同素异形体 雍天1年前1
雍天1年前1 -
 白云追雪 共回答了22个问题
白云追雪 共回答了22个问题 |采纳率90.9%解题思路:A、铈离子具有氧化性,碘离子具有还原性,二者可以发生氧化还原反应;
B、根据氧化性是Ce4+>Fe3+,结合离子反应遵循电荷守恒来回答;
C、根据电解池的工作原理来回答;
D、同素异形体是同种元素组成的性质不同的单质间的互称.A、金属铈可以和强酸HI酸反应生成盐和水,但是铈离子具有氧化性,碘离子具有还原性,二者可以继续发生氧化还原反应,故A错误;
B、氧化性是Ce4+>Fe3+,所以用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+═Ce3++Fe3+,故B错误;
C、电解熔融状态的CeO2,电解池中在阴极是铈离子发生得电子得还原反应,即在阴极获得铈,故C正确;
D、同素异形体是同种元素组成的性质不同的单质间的互称,13658Ce、13858Ce、14058Ce、14258Ce属于四种原子,它们互为同位素,故D错误.
故选C.点评:
本题考点: 氧化性、还原性强弱的比较;同素异形体;金属冶炼的一般原理.
考点点评: 本意是一道关于氧化还原反应的综合知识题目,可以根据教材知识来回答,题目难度中等.1年前查看全部
- 高中化学竞赛结构题原子簇化学是当前化学中最饶有兴趣而又极其活跃的领域之一.当前比较全面的定义是由徐光宪、江元生等人提出的
高中化学竞赛结构题
原子簇化学是当前化学中最饶有兴趣而又极其活跃的领域之一.当前比较全面的定义是由徐光宪、江元生等人提出的:凡以3个或3个以上原子直接键合构成的多面体或笼为核心,连接外围原子或基团而形成的结构单元称原子簇.分子式为CnHn的多面体碳烷是典型的主族簇合物,下面是已经报道的碳烷多面体,请归纳总键数为[(3n/2)+n]=5n/2 ;若多面体边数为l,则总键数用n和l表示为多少(4n-l)
请问总键数怎么求出来的那两个答案 fnaqiuyi1年前4
fnaqiuyi1年前4 -
 lyc_1 共回答了14个问题
lyc_1 共回答了14个问题 |采纳率100%1、总键数:现就一CnHn为例 CnHn中的某一个C原子有4个键 H原子一个键,C原子的一个键是必须跟H原子链接,可知此碳原子有一个碳-氢键;C原子的其他三个键是跟其他碳原子链接,此碳原子只有3/2个碳-碳键.CnHn中有n个此类碳原子 所以就有(1+3/2)n个键即5n/2个键.
2、CnHn中的键都是有碳与碳、碳与氢构成的,每个碳原子都有4根键其中三根键是与其他碳共有的,另一根是碳与氢的;多面体边数L其实就是指的碳跟碳之间的键,CnHn中含有n个C原子,碳原子就有4n个键,其中4n个键中重复计算了碳跟碳之间的键,去除碳跟碳之间的键L ,所以CnHn中含有总键数为4n-L1年前查看全部
- 著名化学家徐光宪,因为在稀土萃取领域取得了卓越成就而获得“国家最高科学技术奖”,被誉为“稀土界的袁隆平”。已知:稀土金属
著名化学家徐光宪,因为在稀土萃取领域取得了卓越成就而获得“国家最高科学技术奖”,被誉为“稀土界的袁隆平”。已知:稀土金属铈(Ce)在空气中易氧化变暗,受热时燃烧,遇水很快反应。(注:铈常见的化合价为+3和+4;氧化性:Ce 4+ >Fe 3+ 。)下列说法正确的是 [ ]A.四种核素  ,它们互称为同素异形体
,它们互称为同素异形体
B.铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI === CeI 4 + 2H 2 ↑
C.在一定条件下,电解熔融状态的CeO 2 制Ce,在阴极获得铈
D.用Ce(SO 4 ) 2 溶液滴定硫酸亚铁溶液,其离子方程式为:Ce 4+ + 2Fe 2+ === Ce 3+ + 2Fe 3+ z1231231231年前1
z1231231231年前1 -
 tttxf 共回答了16个问题
tttxf 共回答了16个问题 |采纳率81.3%C1年前查看全部
- (2009•安徽)我国著名化学家徐光宪因在稀土元素等研究领域做出杰出贡献,荣获2008年度“国家最高科学技术奖”.铈(C
 (2009•安徽)我国著名化学家徐光宪因在稀土元素等研究领域做出杰出贡献,荣获2008年度“国家最高科学技术奖”.铈(Ce)是一种常见的稀土元素,下列关于铈的说法错误的是( )
(2009•安徽)我国著名化学家徐光宪因在稀土元素等研究领域做出杰出贡献,荣获2008年度“国家最高科学技术奖”.铈(Ce)是一种常见的稀土元素,下列关于铈的说法错误的是( )
A.原子序数是58
B.铈元素是非金属元素
C.质子数为58
D.相对原子质量是140.1 obln4f4t_i7_7_8e1年前1
obln4f4t_i7_7_8e1年前1 -
 漂流度 共回答了18个问题
漂流度 共回答了18个问题 |采纳率94.4%解题思路:根据元素周期表中一格提供的信息,原子序数=核外电子数=质子数=58,相对原子质量及化学元素汉字名称的偏旁可辨别元素的种类,金属元素名称一般有“金”字旁;进行解答.A、根据元素周期表中一格提供的信息,原子序数=核外电子数=质子数=58;故A说法正确;B、根据化学元素汉字名称的偏旁可辨别元素的种类,金属元素名称一般有“金”字旁;可知铈元素是金属元素;故B说法错误;C、根据元...
点评:
本题考点: 元素周期表的特点及其应用;原子的定义与构成;元素的简单分类.
考点点评: 本题考查学生根据元素周期表中一格提供的信息及辨别元素的种类的方法,进行分析解题的能力.1年前查看全部
- 我国著名的化学家徐光宪先胜因在稀土金属等研究领域做出杰出贡献,荣获了2008年度“国家最高科学技术奖”. 14
我国著名的化学家徐光宪先胜因在稀土金属等研究领域做出杰出贡献,荣获了2008年度“国家最高科学技术奖”.
Ce是地壳中含量最高的稀土金属铈元素.下列关于14058
Ce的说法错误的是( )14058
A.质量数为140
B.中子数为82
C.质子数为58
D.核外电子数为198 libai51381年前1
libai51381年前1 -
 laofeng 共回答了21个问题
laofeng 共回答了21个问题 |采纳率90.5%解题思路:
Ce中质子数为58,质量数为140,依据质量数A=质子数Z+中子数N,可求出中子数,依据核外电子数=质子数=原子序数=核电荷数可知核外电子数.14058A、
14058Ce中Ce的左上角代表质量数,因此
14058Ce的质量数为140,故A正确;
B、
14058Ce中Ce的左上角代表质量数为140,左下角为质子数为58,依据质量数A=质子数Z+中子数N可知:中子数N=140-58=82,故B正确;
C、
14058Ce中Ce的左下角为质子数,因此
14058Ce的质子数为58,故C正确;
D、依据核外电子数=质子数可知,核外电子数为58,故D错误;
故选:D.点评:
本题考点: 核素.
考点点评: 本题考查核素的表示方法和关系式:质量数A=质子数Z+中子数N、核外电子数=质子数=原子序数=核电荷数的应用,难度不大.1年前查看全部
- 能级交错问题徐光宪提出的公式 N + 0.7L 法则是否有一个适用范围?因为按此公式可得出8g>5s 而实际上8g
 仗剑漂零1年前1
仗剑漂零1年前1 -
 粟黍 共回答了16个问题
粟黍 共回答了16个问题 |采纳率87.5%这个公式仅仅是个数字总结出来的..没有什么实际的意义..所以会得出上面的结论
要算能级的话 还是根据那个nS1年前查看全部
- (2010•益阳)我国著名化学家徐光宪在稀土元素等研究领域作出杰出贡献,荣获2008年度“国家最高科学技术奖“.铈(Ce
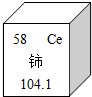 (2010•益阳)我国著名化学家徐光宪在稀土元素等研究领域作出杰出贡献,荣获2008年度“国家最高科学技术奖“.铈(Ce)是一种常见的稀土元素,它在元素周期表中如图所示.下列关于铈的说法错误的是( )
(2010•益阳)我国著名化学家徐光宪在稀土元素等研究领域作出杰出贡献,荣获2008年度“国家最高科学技术奖“.铈(Ce)是一种常见的稀土元素,它在元素周期表中如图所示.下列关于铈的说法错误的是( )
A.铈元素是非金属元素
B.铈元素的原子序数为58
C.铈原子的核外电子数为58
D.铈原子的相对原子质量为l40.1 jinhaiandefeng1年前1
jinhaiandefeng1年前1 -
 放飞的孤独 共回答了27个问题
放飞的孤独 共回答了27个问题 |采纳率85.2%解题思路:根据铈是一种常见的稀土元素,它在元素周期表中的一个小格中的信息可知其名称、元素符号、原子序数、相对原子质量等信息来解答.A、因该元素的名称为铈,其偏旁为“金”,则属于金属元素,故A说法错误;
B、由信息可知,原子序数为58,故B说法正确;
C、因原子中原子序数等于质子数等于核外电子数,则铈原子的核外电子数为58,故C说法正确;
D、由信息可知,该原子的相对原子质量为140.1,故D说法正确;
故选A.点评:
本题考点: 元素周期表的特点及其应用.
考点点评: 本题考查学生利用元素周期表中的信息来分析解答问题,明确周期表中的一个小格中的符号及不同位置的数字的意义是解答的关键.1年前查看全部
- 我国著名化学家徐光宪因在稀土元素等研究领域做出杰出贡献,荣获2008年度“国家最高科学技术奖”.铈(Ce)是一种常见的稀
 我国著名化学家徐光宪因在稀土元素等研究领域做出杰出贡献,荣获2008年度“国家最高科学技术奖”.铈(Ce)是一种常见的稀土元素,下列关于铈的说法正确的是( )
我国著名化学家徐光宪因在稀土元素等研究领域做出杰出贡献,荣获2008年度“国家最高科学技术奖”.铈(Ce)是一种常见的稀土元素,下列关于铈的说法正确的是( )
A.中子数是58
B.相对原子质量58
C.铈元素是非金属元素
D.核外电子数是58 雪飞哥哥1年前1
雪飞哥哥1年前1 -
 amanda张 共回答了18个问题
amanda张 共回答了18个问题 |采纳率88.9%解题思路:(1)要求函数f(x)的解析式,只需找到关于a,b,c的三个方程,解方程组即可.由题意可由f(1)=3,且f(x)在R上为奇函数得.
(2)先用等差数列前n项和公式求Sn,得,Sn=
,这时不等式3(n+1) 2
<mn Sn
可化为mn+1 Sn+1
<mn 3(n+1) 2
,在用作差法解不等式即可.mn+1 3(n+2) 2
(3)分别用构造法和累加法求数列{an},{bn}的通项公式,再代入g(n)=
,然后假设存在k∈N,使g(k+1)=2g(k)成立,分k为奇数和偶数时求k的值.
n,(n为奇数)1 a bn,(n为偶数) (1)由题意的,f(1)=a+b-c=3,f(-x)=f(x)对任意x∈R都成立,得f(x)=3x.
(2)Sn=f(
1
n)+f(
2
n)+f(
3
n)+…+f(
n
n)=3(
1
n+
2
n+
3
n+…+
n
n)=
3
2(1+n),
∵
mn
Sn<
mn+1
Sn+1化为
mn
3(n+1)
2<
mn+1
3(n+2)
2,即
2
3mn(
1
n+1−
m
n+2)<0对任意n∈N+恒成立,显然m≤0不成立.
当m>0时,mn>0,
∴
1
n+1−
m
n+2<0对任意n∈N+恒成立,
∴m>
n+2
n+1对任意n∈N+恒成立.而
n+2
n+1的最大值为
3
2,
∴m>
3
2.
(3)由a1=1,an+1=
f(an)
2f(an)+3,可得
1
an+1−
1
an=2,
∴数列{
1
an}是首项为1,公差为2的等差数列,∴
1
an=2n-1.
由b1=1,bn+1−bn=
1
an,用累加法可得bn=(n-1)2+1,
∴g(n)=
1
an,(n为奇数)
bn,(n为偶数)=
2n−1(n为奇数)
(n−1)2+1(n为偶数),
当k为奇数时,g(k+1)=2g(k),(k+1-1)2+1=2(2k+1)得,k=1或k=3.
当k为偶数时,2k2-6k+3=0无偶数解.
综上,存在k=1或k=3满足条件.点评:
本题考点: 数列与函数的综合;奇函数.
考点点评: 本题是数列,函数,不等式的综合应用,考查面广,须认真审题,找到个知识点的突破口.1年前查看全部
- A.由徐光宪院士发起,院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、CH3COO
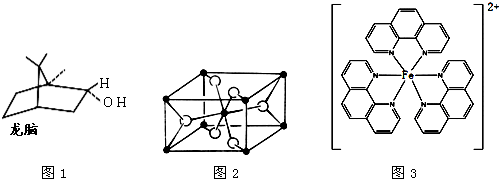
A.由徐光宪院士发起,院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星.
(1)下列说法正确的是______.
(a)BF3和NH3都是含有极性键的非极性分子
(b)CO2、HCN分子中都含有两个σ键和两个π键
(c)H2S、O3分子都是直线形
(d)一种双环单萜龙脑(如图1)分子中有4个手性碳原子
(2)NO是人体中的信号分子,有关说法正确的______.
(a)第一电离能N大于O(b)电负性O大于N
(c)NO+的结构为:N≡O+
(d)N、O元素在周期表中都处于p区
(3)TiO2的天然晶体中,最稳定的一种晶体结构如图2,白球表示:______原子.
(4)二茂铁(C5H5)2Fe是Fe2+与环戊二烯基形成的一类配合物,其中Fe2+在基态时核外电子排布式为:______;实验室测定铁的含量可用配位剂邻二氮菲(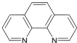 ),它能与Fe2+形成红色配合物(如图3),该配离子中Fe2+配位数为______.
),它能与Fe2+形成红色配合物(如图3),该配离子中Fe2+配位数为______.
(5)乙酸熔沸点很高,是由于存在以分子间氢键缔合的二聚体(含一个环状结构),请画出这二聚体的结构:______. 小梦帆1年前1
小梦帆1年前1 -
 tenderlh 共回答了16个问题
tenderlh 共回答了16个问题 |采纳率93.8%解题思路:(1)(a)不同非金属元素之间存在极性键,正负电荷重心重合的分子是非极性分子;
(b)1个单键是1个σ键,1个双键中含有1个σ键和1个π键,1个三键中含有1个σ键和2个π键;
(c)根据价层电子对互斥理论确定微粒的空间构型;
(d)根据手性碳原子连接4个不同的原子或原子团;
(2)a.同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素;
b.同周期,自左而右,元素电负性逐渐增大;
c.氮气分子和是等电子体,等电子体结构相似,以氮气分子的结构书写NO+的结构;
d.根据价层电子排布可以确定元素的位置;
(3)利用均摊法计算各种原子个数,再结合化学式判断;
(4)铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变为Fe2+,根据构造原理写出Fe2+基态离子核外电子排布式;含有孤电子对的原子和含有空轨道的离子间能形成配位键;
(5)在二个乙酸分子间中,羧基上的氢原子与另一个乙酸分子中碳氧双键上氧原子形成氢键.(1)(a)BF3和NH3都是含有极性键,但前者是平面形分子,正负电荷重心重合,为非极性分子,而后者是三角锥形分子,正负电荷重心不重合,属于极性分子,故(a)错误;
(b)CO2、HCN分子的结构式分别是:O=C=O、H-C≡N,所以CO2含有2个σ键和2个π键,HCN分子中中含有2个σ键和2个π键,故(b)正确;
(c)H2S、O3分子中价层电子对都为3,中心原子采取SP3杂化,都是V形分子,故(c)错误;
(d)一种双环单萜龙脑(如图1)分子中有3个手性碳原子,故(d)错误;
故选:(b);
(2)a.同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素,所以第一电离能N大于O,故a正确;
b.同周期,自左而右,元素电负性逐渐增大,所以电负性O大于N,故b正确;
c.氮气分子和是等电子体,等电子体结构相似,以氮气分子的结构书写NO+的结构,故c正确;
d.N、O元素的价层电子排布分别为2s22p3,2s22p4,在周期表中都处于p区,故d正确;
故选:abcd;
(3)白球个数=2+4×[1/2]=4,黑球个数=1+8×[1/8],所以白球和黑球个数比为2:1,根据二氧化硅的化学式知,白球表示氧原子;
故答案为:氧;
(4)铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变为Fe2+,根据构造原理知,该离子核外电子排布式为[Ar]3d6;该配合物中铁是中心离子,提供空轨道,氮原子提供孤电子对,根据图知其配位键个数是6;
故答案为:[Ar]3d6;6;
(5)二个乙酸分子间中,羧基上的氢原子与另一个乙酸分子中碳氧双键上氧原子形成氢键,所以其氢键表示为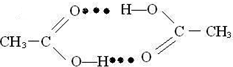 ,
,
故答案为: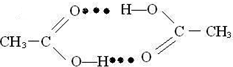 ;
;点评:
本题考点: 极性键和非极性键;共价键的形成及共价键的主要类型;配合物的成键情况;晶胞的计算.
考点点评: 本题考查较综合,涉及分子极性的判断、化学键类型、核外电子排布式的书写等知识点,难点是氢键的书写,明确哪些元素的原子能形成氢键,难度中等.1年前查看全部
- 我国著名化学家徐光宪因在稀土元素等研究领域做出杰出贡献,荣获2008年度“国家最高科学技术奖”。铈(Ce)是一种常见的稀
我国著名化学家徐光宪因在稀土元素等研究领域做出杰出贡献,荣获2008年度“国家最高科学技术奖”。铈(Ce)是一种常见的稀土元素,下列关于铈的说法错误的是 
[ ]
A.原子序数是58
B.相对原子质量是140.1
C.质子数为58
D.铈元素是非金属元素 mafanmafan1年前1
mafanmafan1年前1 -
 于添添 共回答了24个问题
于添添 共回答了24个问题 |采纳率87.5%D1年前查看全部
- 获得国家最高科学技术奖的徐光宪院士在接受采访时谦逊的说:“我获奖的工作都是我的学生和研究团队完成的,我只是这个集体的代表
获得国家最高科学技术奖的徐光宪院士在接受采访时谦逊的说:“我获奖的工作都是我的学生和研究团队完成的,我只是这个集体的代表。”这告诉我们 []A.集体利益和个人利益在基本上是冲突的
B.简单的个人力量相加,可以形成强大的集体
C.团结的集体能使个人能力得到充分发挥
D.集体能离开个人,但个人离不开集体 chenchen781年前1
chenchen781年前1 -
 布哈斯赫 共回答了16个问题
布哈斯赫 共回答了16个问题 |采纳率100%C1年前查看全部
- 我国著名化学家徐光宪因在稀土元素等研究领域做出杰出贡献,荣获2008年度“国家最高科学技术奖”.铈(Ce)是一种常见的稀
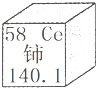 我国著名化学家徐光宪因在稀土元素等研究领域做出杰出贡献,荣获2008年度“国家最高科学技术奖”.铈(Ce)是一种常见的稀土元素,下列关于铈的说法正确的是( )
我国著名化学家徐光宪因在稀土元素等研究领域做出杰出贡献,荣获2008年度“国家最高科学技术奖”.铈(Ce)是一种常见的稀土元素,下列关于铈的说法正确的是( )
A.中子数是58
B.相对原子质量58
C.铈元素是金属元素 cjw65919291年前1
cjw65919291年前1 -
 davidccnu 共回答了24个问题
davidccnu 共回答了24个问题 |采纳率79.2%解题思路:根据元素周期表中一格提供的信息,原子序数=核外电子数=质子数=58,相对原子质量及化学元素汉字名称的偏旁可辨别元素的种类,金属元素名称一般有“金”字旁;进行解答.A、根据元素周期表中一格提供的信息,相对原子质量=质子数+中子数,而原子序数=核外电子数=质子数=58,所以其中子数为:140-58=82;故A说法错误;
B、根据元素周期表中一格提供的信息,相对原子质量为140.1,故B错误;
C、根据化学元素汉字名称的偏旁可辨别元素的种类,金属元素名称一般有“钅”字旁;可知铈元素是金属元素;故C说法正确.
故选C.点评:
本题考点: 元素周期表的特点及其应用.
考点点评: 本题考查学生根据元素周期表中一格提供的信息及辨别元素的种类的方法,进行分析解题的能力.1年前查看全部
- 曾获得国家最高科学技术奖的徐光宪院士在接受采访时说:“我获奖的工作都是我的学生和研究团队完成的,我只是这个集体的代表。”
曾获得国家最高科学技术奖的徐光宪院士在接受采访时说:“我获奖的工作都是我的学生和研究团队完成的,我只是这个集体的代表。”这告诉我们( )
A.集体利益和个人利益在根本上是冲突的 B.简单的个人力量相加,可以形成强大的集体 C.集体能离开个人,但个人离不开集体 D.依靠集体,个人能力才能得到更充分的发挥  cic5174108851年前1
cic5174108851年前1 -
 lzmy 共回答了18个问题
lzmy 共回答了18个问题 |采纳率94.4%D
1年前查看全部
- (2014•重庆模拟)著名化学家徐光宪获得2008年度“国家最高科学技术奖”,以表彰他在稀土萃取理论方面作出的贡献.稀土
(2014•重庆模拟)著名化学家徐光宪获得2008年度“国家最高科学技术奖”,以表彰他在稀土萃取理论方面作出的贡献.稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应.已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+. 下列说法正确的是( )
A.铈(Ce)元素在自然界中主要以单质形式存在
B.铈溶于氢碘酸的化学方程式可表示为:Ce+4HI=CeI4+2H2↑
C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+
D.四种稳定的核素
Ce、13658
Ce、13858
Ce、14058
Ce,它们互称为同位素14258 城市恶狼1年前1
城市恶狼1年前1 -
 birdy0401 共回答了13个问题
birdy0401 共回答了13个问题 |采纳率100%解题思路:A、金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应分析;
B、铈离子具有氧化性,碘离子具有还原性,二者可以发生氧化还原反应;
C、根据氧化性是Ce4+>Fe3+,结合离子反应遵循电荷守恒来回答;
D、具有相同质子数,不同中子数的不同原子互为同位素.A、属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应;铈(Ce)元素在自然界中主要以化合物形式存在,故A错误;
B、金属铈可以和强酸HI酸反应生成盐和水,但是铈离子具有氧化性,碘离子具有还原性,二者可以继续发生氧化还原反应,故B错误;
C、氧化性是Ce4+>Fe3+,所以用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+═Ce3++Fe3+,故C错误;
D、核素13658Ce、13858Ce、14058Ce、14258Ce,是具有相同质子数,不同中子数的不同原子,它们互称为同位素,故D正确;
故选D.点评:
本题考点: 氧化性、还原性强弱的比较;同位素及其应用.
考点点评: 本意是一道关于氧化还原反应的综合知识题目,可以根据教材知识来回答,题目难度中等.1年前查看全部
- 著名化学家徐光宪,因为在稀土萃取领域取得了卓越成就而获得“国家最高科学技术奖”,被誉为“稀土界的袁隆平”.已知:稀土金属
著名化学家徐光宪,因为在稀土萃取领域取得了卓越成就而获得“国家最高科学技术奖”,被誉为“稀土界的袁隆平”.已知:稀土金属铈(Ce)在空气中易氧化变暗,受热时燃烧,遇水很快反应.(注:铈常见的化合价为+3和+4;氧化性:Ce4+>Fe3+.)下列说法正确的是( )
A.四种核素
Ce、13658
Ce、13858
Ce、14058
Ce,它们互称为同素异形体14258
B.铈溶于氢碘酸的化学方程式可表示为:Ce+4HI═CeI4+2H2↑
C.在一定条件下,电解熔融状态的CeO2制Ce,在阴极获得铈
D.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+═Ce3++2Fe3+ 童_心1年前1
童_心1年前1 -
 湖南hao123 共回答了15个问题
湖南hao123 共回答了15个问题 |采纳率80%解题思路:A、根据同素异形体和同位素概念的区别来回答;
B、根据氧化还原反应的有个关知识来回答;
C、根据电解池的工作原理来判断;
D、根据电荷守恒来判断离子方程式的正误.A、同素异形体是同种元素组成的不同单质间的互称,四种核素
13658Ce、
13858Ce、
14058Ce、
14258Ce,它们互称为同位素,故A错误;
B、Ce4+有氧化性,碘离子具有还原性,二者不能共存于一个溶液中,故B错误;
C、电解熔融状态的CeO2时,在阴极上是Ce4+得电子生成单质铈的过程,即在阴极获得铈,故C正确;
D、根据氧化性:Ce4+>Fe3+来判断反应能发生,应该为:Ce4++Fe2+═Ce3++Fe3+,故D错误.
故选C.点评:
本题考点: 电解原理;同素异形体;氧化还原反应.
考点点评: 本题是一道信息给予题,考查学生分析和解决问题的能力,难度不大.1年前查看全部
- 我国著名化学家徐光宪因在稀土元素等研究领域做出杰出贡献,荣获2008年度“国家最高科学技术奖”.铈(Ce)是一种常见的稀
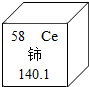 我国著名化学家徐光宪因在稀土元素等研究领域做出杰出贡献,荣获2008年度“国家最高科学技术奖”.铈(Ce)是一种常见的稀土元素,下列关于铈的说法错误的是( )
我国著名化学家徐光宪因在稀土元素等研究领域做出杰出贡献,荣获2008年度“国家最高科学技术奖”.铈(Ce)是一种常见的稀土元素,下列关于铈的说法错误的是( )
A.中子数是58
B.相对原子质量是140.1
C.质子数为58
D.铈元素是金属元素 人在路上tt1年前1
人在路上tt1年前1 -
 蚩蚩尤尤 共回答了14个问题
蚩蚩尤尤 共回答了14个问题 |采纳率92.9%解题思路:根据元素周期表中一格提供的信息,原子序数=核外电子数=质子数=58,相对原子质量及化学元素汉字名称的偏旁可辨别元素的种类,金属元素名称一般有“金”字旁;进行解答.A.根据元素周期表中一格提供的信息,原子序数=核外电子数=质子数=58,而不是中子数,故错误;
B.根据元素周期表中一格提供的信息,相对原子质量为140.1,故正确;
C.根据元素周期表中一格提供的信息,原子序数=核外电子数=质子数=58,故正确;
D.根据化学元素汉字名称的偏旁可辨别元素的种类,金属元素名称一般有“金”字旁,可知铈元素是金属元素,故错误.
故选A.点评:
本题考点: 元素周期表的特点及其应用.
考点点评: 本题考查学生根据元素周期表中一格提供的信息及辨别元素的种类的方法,进行分析解题的能力.1年前查看全部
大家在问
- 1what are your classmates doing?
- 2yeh是不是美俚中“你”的意思
- 3二次函数中如何求k值已知抛物线y=x方-2(k+1)+16的顶点在x轴上则k=多少
- 4已知有理数a,b满足|a+1/2|+|b-1/2|=0求(3/a-7*b)/(a*b)的值
- 5什么电阻可以直接连在220v的家用电上吗?
- 6听下面一段话,回答1个问题。1. What does the girl collect? A. Coins.
- 7(理科)一条题目上来,多少分钟内不会做怎么办?
- 8A man went to an insurance office to buy insurance for himse
- 9黑格尔认为:“世界的发展是绝对精神的自我运动。”这种观点的错误,在于否认 A.事物的运动是绝对的 B.思维是运动的 C.
- 10解方程.2x-[4/5]×10=4.2[5/8]÷x=[1/16][2/3]x+[1/2]x=4224×[3/8]-3x
- 11是漂荡还是飘荡今天在默写《与朱元思书》第一段时发现“从流飘荡”一句。当时我就犯嘀咕,到底是飘荡还是漂荡呢?在网上我也没发
- 12我们应该尊敬父母和老师,虽然有时他们对我们很严厉 英语翻译
- 13一根铁丝刚好围成一个边长9厘米的正方形如果用这根铁丝围成一个长7厘米宽5厘米的长方形这根铁丝还剩多少厘
- 14氧元素质量相同的SO2和SO3的质量比为( )
- 15为了纪念对物理学作出杰出贡献的物理学家,有些物理量就用他们的名字作为单位.图中的五位物理学家,______的名字被用作电
