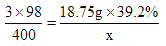废铁回炉,在高炉中变成滚烫的铁水 属于什么物态变化?
 没熟的椰子2022-10-04 11:39:541条回答
没熟的椰子2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 狂人时尚 共回答了14个问题
狂人时尚 共回答了14个问题 |采纳率100%- 熔化,固态变液态的过程.
- 1年前
相关推荐
- 某兴趣小组对生锈废铁锅中铁的含量进行了测定.生锈的铁锅中除Fe、Fe2O3外,还含有碳、硅、锰等元素(除Fe、Fe2O3
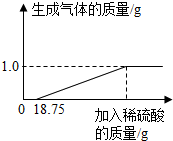 某兴趣小组对生锈废铁锅中铁的含量进行了测定.生锈的铁锅中除Fe、Fe2O3外,还含有碳、硅、锰等元素(除Fe、Fe2O3以外的物质都不与稀硫酸反应).兴趣小组的同学称取40g废铁锅片放入特制容器中,缓慢加入39.2%的稀硫酸,直到恰好反应完全停止加入稀硫酸(假设硫酸先与表面的铁锈发生反应),实验数据如图所示.
某兴趣小组对生锈废铁锅中铁的含量进行了测定.生锈的铁锅中除Fe、Fe2O3外,还含有碳、硅、锰等元素(除Fe、Fe2O3以外的物质都不与稀硫酸反应).兴趣小组的同学称取40g废铁锅片放入特制容器中,缓慢加入39.2%的稀硫酸,直到恰好反应完全停止加入稀硫酸(假设硫酸先与表面的铁锈发生反应),实验数据如图所示.
(1)废铁锅片中铁单质的质量分数为______.
(2)所得溶液中所含溶质的化学式为______,请计算溶液中硫酸铁的质量为______g(请写出计算过程). poloma1年前1
poloma1年前1 -
 臭闹闹 共回答了16个问题
臭闹闹 共回答了16个问题 |采纳率81.3%解题思路:(1)观察图示,分析生成的氢气的质量,根据铁与盐酸反应的方程式,由氢气的质量求出铁的质量,再计算出铁单质的质量分数.
(2)由于废铁中含有铁和氧化铁,根据铁和氧化铁与盐酸的反应,分析溶液中的溶质;根据图示,分析与氧化铁反应的盐酸的质量,根据盐酸与氧化铁反应的方程式求出生成的硫酸铁的质量.解(1)由图可知,稀硫酸与铁反应生成氢气的质量为1g,
设废铁锅中铁的质量为x.
Fe+H2SO4═FeSO4+H2↑
56 2
x 1 g
[56/2=
x
1g],解得x=28g.
废铁锅中铁单质的质量分数为[28g/40g]×100%=70%.
(2)废铁锅中只有Fe和Fe2O3能与稀硫酸反应,并且稀硫酸恰好完全反应,所以溶液中的溶质是稀硫酸与Fe反应产生的FeSO4以及稀硫酸与Fe2O3反应产生的Fe2(SO4)3.
由题意及图可以看出,与Fe2O3反应的纯硫酸的质量为:18.75g×39.2%=7.35g,
设反应生成硫酸铁的质量为y.
Fe2O3+3H2SO4═Fe2(SO4)3+3H2O
294 400
7.35 g y
[294/400=
7.35g
y] 解得y=10g.
故答为:(1)70%;
(2)FeSO4、Fe2(SO4)3;10.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题的难度稍大,解答本题本题的关键是:根据反应的方程式,理解图的意义,像找出有关的数据进行解题.1年前查看全部
- 某兴趣小组对生锈废铁锅中铁的含量进行了测定.生锈的铁锅中除Fe、Fe2O3外,还含有碳、硅、锰等元素(除Fe、Fe2O3
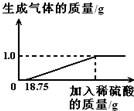 某兴趣小组对生锈废铁锅中铁的含量进行了测定.生锈的铁锅中除Fe、Fe2O3外,还含有碳、硅、锰等元素(除Fe、Fe2O3以外的物质都不与稀硫酸反应).兴趣小组的同学称取33g废铁锅片放入特制容器中,缓慢加入39.2%的稀硫酸,直到反应完全(假设硫酸先与表面的铁锈发生反应),实验数据如图所示.
某兴趣小组对生锈废铁锅中铁的含量进行了测定.生锈的铁锅中除Fe、Fe2O3外,还含有碳、硅、锰等元素(除Fe、Fe2O3以外的物质都不与稀硫酸反应).兴趣小组的同学称取33g废铁锅片放入特制容器中,缓慢加入39.2%的稀硫酸,直到反应完全(假设硫酸先与表面的铁锈发生反应),实验数据如图所示.
(1)从化学元素与人体健康的角度考虑,我们应选用铁锅还是铝锅,为什么______.
(2)废铁锅片中铁单质的质量分数为______.(结果保留到0.1%)
(3)所得溶液中所含溶质的化学式为______,计算溶液中硫酸铁的质量.(要求写出计算过程) maiyonghuan1年前1
maiyonghuan1年前1 -
 是其所非 共回答了16个问题
是其所非 共回答了16个问题 |采纳率100%解题思路:(1)人体缺乏铁元素时易患缺铁性贫血;
(2)铁和稀硫酸反应生成硫酸亚铁和氢气,氧化铁和稀硫酸反应生成硫酸铁和水;
根据生成氢气的质量可以计算铁的质量,根据和氧化铁反应的稀硫酸的质量可以计算生成硫酸铁的质量.(1)从化学元素与人体健康的角度考虑,我们应选用铁锅,因为使用铁锅能够为人体提供铁元素,防止缺铁性贫血.
故填:铁锅,因为使用铁锅能够为人体提供铁元素.
(2)设铁的质量为x,
Fe+H2SO4═FeSO4+H2↑,
56 2
x 1.0g
[56/x]=[2/1.0g],
x=28g,
废铁锅片中铁单质的质量分数为:[28g/33g]×100%=84.8%,
故填:84.8%;
(3)所得溶液中所含溶质有硫酸铁和硫酸亚铁,化学式分别为Fe2(SO4)3、FeSO4;
故填:Fe2(SO4)3、FeSO4.
设生成硫酸铁的质量为y,
Fe2O3+3H2SO4═Fe2(SO4)3+3H2O,
294 400
18.75g×39.2%y
[294/18.75g×39.2%]=[400/y],
y=10g,
答:溶液中硫酸铁的质量是10g.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.1年前查看全部
- 废铁和废钢有什么区别?
 匪兵227号1年前3
匪兵227号1年前3 -
 食指戒 共回答了12个问题
食指戒 共回答了12个问题 |采纳率100%首先要从钢和铁的性质上来说 钢和铁的化学元素符号都是Fe 主要区别是里面的含碳量的不同 生铁一般指含碳量在2-4.3% 钢的含碳量一般指在0.05%以内 废铁和废钢只是使用过的废品而已 其中的化学性质并没有改变 它们之间的区别也主要是含碳量1年前查看全部
- 关于电与磁的问题电和磁之间有怎么样的关系呢?在奇妙的电磁世界.指南针的指针为何都是朝向南?如何利用电磁搬运很重的废铁?电
关于电与磁的问题
电和磁之间有怎么样的关系呢?在奇妙的电磁世界.
指南针的指针为何都是朝向南?
如何利用电磁搬运很重的废铁?
电磁作用对我们的日常生活有哪些影响?
举出生活中有关电磁应用的例子.
thanks!无论你没有回答 或回答了 意然悠然1年前2
意然悠然1年前2 -
 青叶小瓣 共回答了19个问题
青叶小瓣 共回答了19个问题 |采纳率94.7%电和磁之间有怎么样的关系呢?
电可生磁(奥斯特实验),磁可生电(楞次定律)
指南针的指针为何都是朝向南?
因为地磁北极在地理南极附近,地磁南极在地理北极附近,又因为同名磁极相斥,异名磁极相吸,所以指南针的指针总是朝南(但在很久以前指南针是指北的!因为那时地磁场与现在相反……)
如何利用电磁搬运很重的废铁?
将导线缠绕在磁铁上制成电磁铁,电磁铁可以具有很强的磁性,用它来吸引废铁,很重的废铁就很容易搬运啦!
电磁作用对我们的日常生活有哪些影响?
影响很多呀!比如说无线电波用于通信,无线电就是电磁波.有一些设备的开关就是利用电磁铁的磁性在通电时有,断电时无制成的.
举出生活中有关电磁应用的例子.
刚才说的,电磁铁的应用:开关、起重机;电磁波的应用:无线电波用于通信、微波用于微波炉、红外线用于遥控;还有发电机、电动机等等.
(都是自己打的,希望楼主采纳!)1年前查看全部
- 由废铁制备FeCl2的主要过程如下:
由废铁制备FeCl2的主要过程如下:
Ⅰ.按如图所示过程制备FeCl3•6H2O
废铁
FeCl2溶液盐酸 ①
FeCl3溶液稀硝酸、盐酸 ②
FeCl3•6H2O晶体③
(1)用离子方程式表示过程②中稀硝酸的作用______,在该过程中要不断向溶液中补充盐酸,目的是______.
Ⅱ.由FeCl3•6H2O制得干燥FeCl2的过程如下:
ⅰ.向盛有FeCl3•6H2O的容器中加入SOCl2液体,加热,获得无水FeCl3
ⅱ.将无水FeCl3置于反应管中,通入①中产生的气体一段时间后加热,生成FeCl2
ⅲ.收集FeCl2,保存备用
(2)SOCl2与水接触会迅速产生白雾和SO2.加热分解FeCl3•6H2O不能得到无水FeCl3,而步骤ⅰ中可得到无水FeCl3,结合必要化学方程式及必要的文字说明解释得到无水FeCl3的原因______.
(3)过程ⅱ中产生FeCl2的化学方程式是2FeCl3+H2
2FeCl2+2HCl△ .2FeCl3+H2.
2FeCl2+2HCl△ .
Ⅲ.FeCl2的包装上贴有安全注意事项,部分内容如下:
(4)FeCl2在潮湿的空气中受热可生成氯化铁、氧化铁等,反应的化学方程式是品 名 氯化亚铁 理化特性 白色,遇空气易变成黄色,易吸水,有腐蚀性… 注意事项 避免接触空气、碱等;聚乙烯塑料桶包装;避免受热 4FeCl2+H2O+O2
2FeCl3+Fe2O3+2HCl△ .4FeCl2+H2O+O2.
2FeCl3+Fe2O3+2HCl△ . 伽楠1年前1
伽楠1年前1 -
 yajia796 共回答了21个问题
yajia796 共回答了21个问题 |采纳率90.5%解题思路:(1)硝酸根离子在有氢离子条件下才能氧化亚铁离子为铁离子;加入盐酸,补充H+使NO3-继续氧化Fe2+直至NO3-完全消耗既不产生Fe(NO3)3又不引入其他杂质;
(2)根据反应方程式及勒夏特列原理进行分析;
(3)氯化铁与氢气反应生成氯化亚铁的反应方程式;
(4)写出氯化亚铁受热与氧气反应生成氯化铁、氧化铁的化学方程式.(1)稀硝酸能够将亚铁离子氧化成铁离子,反应的离子方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;在该过程中要不断向溶液中补充盐酸,可以补充H+使NO3-继续氧化Fe2+直至NO3-完全消耗既不产生Fe(NO3)3又不引入其他杂质,
故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;补充H+使NO3-继续氧化Fe2+直至NO3-完全消耗既不产生Fe(NO3)3又不引入其他杂质;
(2)加入向盛有FeCl3•6H2O的容器中加入SOCl2,加热后发生了反应:6SOCl2+FeCl3•6H2O═FeCl3+12HCl↑+6SO2↑,反应中生成了氯化氢,抑制了铁离子的水解,
故答案为:6SOCl2+FeCl3•6H2O═FeCl3+12HCl↑+6SO2↑,生成的HCl会抑制FeCl3的水解得到无水FeCl3;
(3)氯化铁与氢气反应生成氯化亚铁,反应的化学方程式为:2FeCl3+H2
△
.
2FeCl2+2HCl,故答案为:2FeCl3+H2
△
.
2FeCl2+2HCl;
(4)氯化亚铁在加热条件下,与氧气反应生成氯化铁、氧化铁,反应的化学方程式为4FeCl2+H2O+O2
△
.
2FeCl3+Fe2O3+2HCl,
故答案为:4FeCl2+H2O+O2
△
.
2FeCl3+Fe2O3+2HCl.点评:
本题考点: 铁盐和亚铁盐的相互转变;硝酸的化学性质;氯、溴、碘及其化合物的综合应用.
考点点评: 本题借助废铁制备FeCl2的方法,考查了电子式的书写、离子方程式、化学方程式的书写等知识,涉及的内容较多,综合性较强,充分考查了学生的分析理解能力,灵活应用所学知识能力,本题难度中等.1年前查看全部
- 一堆废铁怎样才能准确地估计它有多重
 荣达岂不伟1年前1
荣达岂不伟1年前1 -
 ladana 共回答了18个问题
ladana 共回答了18个问题 |采纳率100%准确的说出他的重量不太可能,只能估算!最好还是上称称一下为好!
如果你想卖废铁最好等等 现在废铁的价格开始回升了 每公斤2元(以前1.5)
家里有地方放就留着 没地方就只能割肉了 哈哈 希望回答能给予你帮助!1年前查看全部
- 数学题 下面每立方厘米的铁的质量为7.8g,现有质量为46.8kg的废铁快,把他融化后铸成铁琔,已知铁琔的外形为长方体,
数学题 下面
每立方厘米的铁的质量为7.8g,现有质量为46.8kg的废铁快,把他融化后铸成铁琔,已知铁琔的外形为长方体,其长和宽分别为15和10cm,他的高为多少cm? 暖暖恋爱1年前3
暖暖恋爱1年前3 -
 北极水果 共回答了16个问题
北极水果 共回答了16个问题 |采纳率87.5%46800÷7.8÷(15×10)=40厘米
答高是40厘米1年前查看全部
- 把一把锁锯成两半,虽然劳动时间增加了,可是它只能当废铁低价销售。这说明 [
把一把锁锯成两半,虽然劳动时间增加了,可是它只能当废铁低价销售。这说明 [ ]A.商品的使用价值是价值的物质承担者
B.商品的价值不一定由劳动时间决定
C.个别劳动时间的变化也会引起商品价值量的改变
D.商品的使用价值离不开价值 martin_shu1年前1
martin_shu1年前1 -
 来自地狱的声音 共回答了16个问题
来自地狱的声音 共回答了16个问题 |采纳率100%A1年前查看全部
- △ABC是一块等腰三角形的废铁料,已知∠BAC为锐角,量得底边BC=6dm,底边BC边上的高为4dm,利用它裁一块边长为
△ABC是一块等腰三角形的废铁料,已知∠BAC为锐角,量得底边BC=6dm,底边BC边上的高为4dm,利用它裁一块边长为30CM的矩形 矩形的一边与三角形一边重合,另两个顶点分别在三角形的另两边上.要求4种,是不是底边2种良药各一种啊
 DarkMag1年前1
DarkMag1年前1 -
 笠翁古旧书店 共回答了13个问题
笠翁古旧书店 共回答了13个问题 |采纳率84.6%是的是的1年前查看全部
- 防锈和回收废旧金属都是保护金属资源的重要途径.为测定一种待回收的废铁中铁的锈蚀程度,某同学取该部分锈蚀的铁片样品(仅由铁
防锈和回收废旧金属都是保护金属资源的重要途径.为测定一种待回收的废铁中铁的锈蚀程度,某同学取该部分锈蚀的铁片样品(仅由铁和氧化铁组成),测得其中氧元素的含量为12%,则样品中已被锈蚀的铁元素占原金属铁的质量分数约为( )
A. 28%
B. 31.8%
C. 46.7%
D. 70% 罗斯特0011年前1
罗斯特0011年前1 -
 mei168 共回答了16个问题
mei168 共回答了16个问题 |采纳率87.5%解题思路:根据氧化铁中氧的质量分数可以计算该样品中氧化铁的质量;然后由氧化铁中铁的质量分数可以求得氧化铁中铁在质量;最后根据[氧化铁中铁的质量/铁的质量]×100%即可求得结果.设该锈蚀的铁片样品(仅由铁和氧化铁组成)的质量为x.则
氧化铁的质量=[12%x
16×3/56×2+16×3×100%]=40%x;
被腐蚀的铁的质量=[56×2/56×2+16×3]×100%×40%x,
所以该样品中已被锈蚀的铁元素占原金属铁的质量分数为:
56×2
56×2+16×3×100%×40%x
x−12%x×100%≈31.8%;
故选:B.点评:
本题考点: 物质组成的综合计算;元素的质量分数计算.
考点点评: 本题主要考查学生运用化学式和元素的质量分数公式进行计算的能力.样品中已被锈蚀的铁元素就是氧化铁中铁元素的质量.1年前查看全部
- 如图1△ABC是一块等腰三角形的废铁料,已知∠ABC为锐角,量得底边BC=6dm,底边BC边上的高位4dm,利用它裁
如图1△ABC是一块等腰三角形的废铁料,已知∠ABC为锐角,量得底边BC=6dm,底边BC边上的高位4dm,利用它裁
一块一边长为3dm的矩形.要求使矩形的一边落在△ABC的一边上,而矩形的另两个顶点分别在△ABC的另两边上,由于在操作时,同学马兵不小心将铁片弄坏,量得EB=3.1dmAD=2dm,此时马兵不只如何是好,聪明的同学,请你帮助马兵探索,还能裁剪的符合条件及要求的矩形吗?若能,请求出该举行的面积,若不能.请说明理由 lzf8088621年前2
lzf8088621年前2 -
 高人起名爱低调 共回答了20个问题
高人起名爱低调 共回答了20个问题 |采纳率95%1)因为矩形的一条边长为30cm,而另一条边长的不确定的,所以这样的矩形的截法有不同的四种如图3所示.
(2)先对△ABC作一个剖析:
①在△ABC中,AB=AC,BC=60cm,作AF⊥BC于F,则有BF=CF=30cm,AF=40cm,易知AB=AC=50cm,
②再作CH⊥AB于H,由AF•BC=CH•AB,得CH=48cm.
在截法一中,设PN=xcm,由PQ//BC,得(40-x)/40=30/60 ,解得x=20cm,即所截得的矩形MNPQ的另一边长为20cm,即PN=20cm;
在截法二中,设PN=ycm,由PQ//AB,得(48-y)/48=30/50 ,解得y=19.2cm,即所截得矩形MNPQ的另一条边长为19.2cm,即PN=19.2cm.
在截法三中,设PN=zcm,由PN//BC,得z/60=(40-30)/40;解得z=15cm,即所截得矩形MNPQ的另一边长为15cm,即PN=15cm.
在截法四中,设PN=kcm,由PN//AB,得k/50=(48-30)/48 ,解得k=18.75cm,即所截得矩形MNPQ的另一边长为18.75cm.即PN=18.75cm.
(3)若铁片受损,使得AD=15cm,EC=41cm,但仍然由第三种截法可以截得符合条件和要求的矩形.
①在原截法一中;因为CM=45cm,EC=41cm,CM>EC,所以无法截取;
②在原截法二中:因为AP>PN=19.2cm,AD=15cm,所以AP>AD,所以无法截取;
③在原截法四中,作CH⊥AB于H,BH=根号(60^2-48^2)=36 (cm),而BD=50-15=35(cm),所以BH>BD,所以无法截取.
④在原截法三中:作AF⊥BC于F,交PN于0,因为PN=15cm,根据对称性:OP=ON=FQ=FM= cm,
在Rt△AOP中,AP=根号[10^2+(15/2)^2]=25/2(cm) ,
所以AP=12.5cm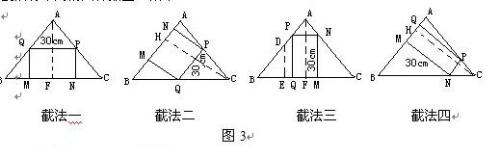 1年前查看全部
1年前查看全部
- 防锈和回收废旧金属都是保护金属资源的重要途径.为测定一种待回收的废铁中铁的锈蚀程度,某同学取该部分锈蚀的铁片样品(仅由铁
防锈和回收废旧金属都是保护金属资源的重要途径.为测定一种待回收的废铁中铁的锈蚀程度,某同学取该部分锈蚀的铁片样品(仅由铁和氧化铁组成),测得其中氧元素的含量为12%,则样品中已被锈蚀的铁元素占原金属铁的质量分数约为( )
A. 28%
B. 31.8%
C. 46.7%
D. 70% bossii1年前1
bossii1年前1 -
 figodai 共回答了20个问题
figodai 共回答了20个问题 |采纳率75%解题思路:根据氧化铁中氧的质量分数可以计算该样品中氧化铁的质量;然后由氧化铁中铁的质量分数可以求得氧化铁中铁在质量;最后根据[氧化铁中铁的质量/铁的质量]×100%即可求得结果.设该锈蚀的铁片样品(仅由铁和氧化铁组成)的质量为x.则
氧化铁的质量=[12%x
16×3/56×2+16×3×100%]=40%x;
被腐蚀的铁的质量=[56×2/56×2+16×3]×100%×40%x,
所以该样品中已被锈蚀的铁元素占原金属铁的质量分数为:
56×2
56×2+16×3×100%×40%x
x−12%x×100%≈31.8%;
故选:B.点评:
本题考点: 物质组成的综合计算;元素的质量分数计算.
考点点评: 本题主要考查学生运用化学式和元素的质量分数公式进行计算的能力.样品中已被锈蚀的铁元素就是氧化铁中铁元素的质量.1年前查看全部
- 防锈和回收废旧金属都是保护金属资源的重要途径.为测定一种待回收的废铁中铁的锈蚀程度,某同学取该部分锈蚀的铁片样品(仅由铁
防锈和回收废旧金属都是保护金属资源的重要途径.为测定一种待回收的废铁中铁的锈蚀程度,某同学取该部分锈蚀的铁片样品(仅由铁和氧化铁组成),测得其中氧元素的含量为12%,则样品中已被锈蚀的铁元素占原金属铁的质量分数约为( )
A. 28%
B. 31.8%
C. 46.7%
D. 70% 愤怒的单细胞青年1年前1
愤怒的单细胞青年1年前1 -
 bruce319 共回答了23个问题
bruce319 共回答了23个问题 |采纳率95.7%解题思路:根据氧化铁中氧的质量分数可以计算该样品中氧化铁的质量;然后由氧化铁中铁的质量分数可以求得氧化铁中铁在质量;最后根据[氧化铁中铁的质量/铁的质量]×100%即可求得结果.设该锈蚀的铁片样品(仅由铁和氧化铁组成)的质量为x.则
氧化铁的质量=[12%x
16×3/56×2+16×3×100%]=40%x;
被腐蚀的铁的质量=[56×2/56×2+16×3]×100%×40%x,
所以该样品中已被锈蚀的铁元素占原金属铁的质量分数为:
56×2
56×2+16×3×100%×40%x
x−12%x×100%≈31.8%;
故选:B.点评:
本题考点: 物质组成的综合计算;元素的质量分数计算.
考点点评: 本题主要考查学生运用化学式和元素的质量分数公式进行计算的能力.样品中已被锈蚀的铁元素就是氧化铁中铁元素的质量.1年前查看全部
- 防锈和回收废旧金属都是保护金属资源的重要途径.为测定一种待回收的废铁中铁的锈蚀程度,某同学取该部分锈蚀的铁片样品(仅由铁
防锈和回收废旧金属都是保护金属资源的重要途径.为测定一种待回收的废铁中铁的锈蚀程度,某同学取该部分锈蚀的铁片样品(仅由铁和氧化铁组成),测得其中氧元素的含量为12%,则样品中已被锈蚀的铁元素占原金属铁的质量分数约为( )
A. 28%
B. 31.8%
C. 46.7%
D. 70% 钵里1年前1
钵里1年前1 -
 dyp_2008 共回答了21个问题
dyp_2008 共回答了21个问题 |采纳率95.2%解题思路:根据氧化铁中氧的质量分数可以计算该样品中氧化铁的质量;然后由氧化铁中铁的质量分数可以求得氧化铁中铁在质量;最后根据[氧化铁中铁的质量/铁的质量]×100%即可求得结果.设该锈蚀的铁片样品(仅由铁和氧化铁组成)的质量为x.则
氧化铁的质量=[12%x
16×3/56×2+16×3×100%]=40%x;
被腐蚀的铁的质量=[56×2/56×2+16×3]×100%×40%x,
所以该样品中已被锈蚀的铁元素占原金属铁的质量分数为:
56×2
56×2+16×3×100%×40%x
x−12%x×100%≈31.8%;
故选:B.点评:
本题考点: 物质组成的综合计算;元素的质量分数计算.
考点点评: 本题主要考查学生运用化学式和元素的质量分数公式进行计算的能力.样品中已被锈蚀的铁元素就是氧化铁中铁元素的质量.1年前查看全部
- 英语翻译摘要:金属打包机主要应用于回收加工行业及冶金行业,将各种金属边角料、钢刨花屑、废钢、废铁、废铝等金属原料挤压成长
英语翻译
摘要:金属打包机主要应用于回收加工行业及冶金行业,将各种金属边角料、钢刨花屑、废钢、废铁、废铝等金属原料挤压成长方体、圆柱体等各种形状的合格炉料.便于储藏、运输及回炉再利用.本文在分析了金属打包机的工作原理、工艺过程和***外发展现状的基础上,深入研究了金属打包机的工作原理.根据工作要求过设计液压系统原理图,对液压系统的元器件进行了选型、液压泵站的设计及plc电气控制系统的设计.
谷歌翻译参考:
metal baler is mainly used in recycling and processing industry and metallurgical industry.the various metal scrap,scrap steel shavings,scrap steel,scrap metal,scrap metal and other raw materials extruded into a variety of shapes rectangular,cylindrical and other qualified charging.easy to store,transport and re-use of recycled.this paper analyzes the principle of the process and status of the work,at home and abroad metal baler development on the basis of in-depth study of the metal baler works.according to the work requirements over the design of the hydraulic system schematic of the hydraulic system components were designed selection,design and pump station plc electrical control systems.
觉得谷歌翻译不对劲,自己能力又不足!感激不尽 x平角裤1年前1
x平角裤1年前1 -
 梦娴静雪 共回答了17个问题
梦娴静雪 共回答了17个问题 |采纳率100%用google只能英译中然后猜意思
Metal baler is mainly used in recycling and processing industry and metallurgical industry,extruding various metal scrap,scrap steel shavings,scrap steel,scrap metal,scrap metal and other raw materials into rectangular,cylindrical and other qualified shapes of charging,which are easy to store,transport and re-use of recycled.This paper analyzes not only the principle of the process and status of the work,domestic and abroad metal baler development,but also study of the metal baler works.According to the requirements over the design of the hydraulic system schematic of the hydraulic system components,it also do designed selection,design of pump station and PLC electrical control systems.
我就是把语法该对了,具体的专业词汇google应该没错1年前查看全部
- 80g废铁(除铁外物质不溶于水不与稀硫酸反应)和430ml20%的稀硫酸溶液(密度1.14g/cm^3
80g废铁(除铁外物质不溶于水不与稀硫酸反应)和430ml20%的稀硫酸溶液(密度1.14g/cm^3
(1)稀硫酸溶质的质量(2)废铁屑铁的质量
(3)恰好完全反应所得后溶液中溶质的质量分数 aichezu1年前1
aichezu1年前1 -
 怎么回忆 共回答了21个问题
怎么回忆 共回答了21个问题 |采纳率90.5%(1) 430ml 稀硫酸,质量为 430×1.14=490.2g,其溶质的质量为490.2×20%=98.04g≈98g
(2)恰好反应:
Fe + H2SO4 ==== FeSO4 + H2(气体) 设,反应消耗Fe X克,反应后得到FeSO4 Y克,氢气Z克
56 98 152 2
X 98 Y Z
X=56 Y=152 Z=2
所以,反应后,溶液的重质量为 56+490.2-2=544.2g
此时,FeSO4溶质的质量分数为 152÷544.2×100%=27.93%
因杂质 (80-56)g,不溶于水,也不与硫酸反应,所以排除在溶液体系之外
计算时,必须将杂质的量从溶液中减去.
回答满意请采纳~1年前查看全部
- 某兴趣小组对生锈废铁锅中铁的含量进行了测定。生锈的铁锅中除Fe、Fe 2 O 3 外,还含有碳、硅、锰等元素(除Fe、F
某兴趣小组对生锈废铁锅中铁的含量进行了测定。生锈的铁锅中除Fe、Fe 2 O 3 外,还含有碳、硅、锰等元素(除Fe、Fe 2 O 3 以外的物质都不与稀硫酸反应)。兴趣小组的同学称取33g废铁锅片放入特制容器中,缓慢加入39.2%的稀硫酸,直到反应完全(假设硫酸先与表面的铁锈发生反应),实验数据如图所示。 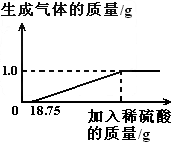
(1)从化学元素与人体健康的角度考虑,我们应选用铁锅还是铝锅_______,为什么________。
(2)废铁锅片中铁单质的质量分数为__________。(结果保留到0.1%)
(3)所得溶液中所含溶质的化学式为___________,计算溶液中硫酸铁的质量。(要求写出计算过程) 俘虏你1年前1
俘虏你1年前1 -
 枫叶飘落006 共回答了20个问题
枫叶飘落006 共回答了20个问题 |采纳率85%1年前查看全部
- 三角形ABC是一块等腰三角形的废铁料,量的底边BC=60cm,底边上的高为40cm,用它裁一块长为30cm的矩形(要求矩
三角形ABC是一块等腰三角形的废铁料,量的底边BC=60cm,底边上的高为40cm,用它裁一块长为30cm的矩形(要求矩形的一边与三角形ABC的一边重合,另两个顶点在三角形ABC的另两边上)试问有多少种解法?画出图形,并计算矩形面积.
 long_en1年前0
long_en1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 某兴趣小组对生锈废铁锅中铁的含量进行了测定.生锈的铁锅中除Fe、Fe2O3外,还含有碳、硅、锰等元素(除Fe、Fe2O3
某兴趣小组对生锈废铁锅中铁的含量进行了测定.生锈的铁锅中除Fe、Fe2O3外,还含有碳、硅、锰等元素(除Fe、Fe2O3以外的物质都不与稀硫酸反应).兴趣小组的同学称取33g废铁锅片放入特制容器中,缓慢加入39.2%的稀硫酸,直到反应完全(假设硫酸先与表面的铁锈发生反应),实验数据如图所示.

(1)从化学元素与人体健康的角度考虑,我们应选用铁锅还是铝锅______,因为______.
(2)废铁锅片中铁单质的质量分数为______.(结果保留到0.1%)
(3)所得溶液中所含溶质的化学式为______,计算溶液中硫酸铁的质量.(要求写出计算过程) 98206061年前1
98206061年前1 -
 waitingmen 共回答了15个问题
waitingmen 共回答了15个问题 |采纳率100%解题思路:(1)铝元素有毒,对人体有害,而铁是人体必需额微量元素,可以据此解答;
(2)根据生成气体的质量可以求算出铁的质量,进而求算出铁的质量分数;
(3)铁锈的主要成分为氧化铁,氧化铁和铁都能和稀硫酸反应,铁和硫酸反应生成硫酸亚铁,而氧化铁和硫酸反应生成硫酸铁;分析图中坐标系可以知道氧化铁消耗硫酸的质量为18.75g,可以据此求算出硫酸铁的质量.(1)铁是人体必需的微量元素,而铝是不必需元素,而且铝元素对人体有害,所以从化学元素与人体健康的角度考虑,我们应选用铁锅;
(2)设废铁锅片中铁单质的质量为x
Fe+H2SO4 =FeSO4+H2↑
562
x 1.0g
[56/x=
2
1.0g]
解得:x=28g
废铁锅片中铁单质的质量分数为:[28g/33g]×100%=84.8%;
(3)铁锈的主要成分为氧化铁,氧化铁和铁都能和稀硫酸反应,铁和硫酸反应生成硫酸亚铁,而氧化铁和硫酸反应生成硫酸铁;所以在反应后的溶液中含有的溶质为:Fe2(SO4)3、FeSO4;
根据图中信息可以知道,和氧化铁反应的硫酸的质量为:18.75g×39.2%=7.35g;
设生成Fe2(SO4)3的质量为y
Fe2O3+3H2SO4═Fe2(SO4)3+3H2O
294400
7.35gy
[294/400=
7.35g
y]
解得:y=10g
答:溶液中硫酸铁的质量为10g.
故答案为:(1)铁锅;铁是人体必需的微量元素,而铝是不必需元素,而且铝元素对人体有害;
(2)84.8%;
(3)Fe2(SO4)3、FeSO4;10g.点评:
本题考点: 根据化学反应方程式的计算;人体的元素组成与元素对人体健康的重要作用.
考点点评: 要想解答好这类题目,首先,要理解和熟记根据化学反应方程式的计算步骤和格式,以及与之相关的知识等.然后,根据所给的问题情景,结合所学的相关知识和技能,细致地分析题意,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.1年前查看全部
- 防锈和回收废旧金属都是保护金属资源的重要途径.为测定一种待回收的废铁中铁的锈蚀程度,某同学取该部分锈蚀的铁片样品(仅由铁
防锈和回收废旧金属都是保护金属资源的重要途径.为测定一种待回收的废铁中铁的锈蚀程度,某同学取该部分锈蚀的铁片样品(仅由铁和氧化铁组成),测得其中氧元素的含量为12%,则样品中已被锈蚀的铁元素占原金属铁的质量分数约为( )
A. 28%
B. 31.8%
C. 46.7%
D. 70% 坏文文1年前1
坏文文1年前1 -
 true20060710 共回答了21个问题
true20060710 共回答了21个问题 |采纳率81%解题思路:根据氧化铁中氧的质量分数可以计算该样品中氧化铁的质量;然后由氧化铁中铁的质量分数可以求得氧化铁中铁在质量;最后根据[氧化铁中铁的质量/铁的质量]×100%即可求得结果.设该锈蚀的铁片样品(仅由铁和氧化铁组成)的质量为x.则
氧化铁的质量=[12%x
16×3/56×2+16×3×100%]=40%x;
被腐蚀的铁的质量=[56×2/56×2+16×3]×100%×40%x,
所以该样品中已被锈蚀的铁元素占原金属铁的质量分数为:
56×2
56×2+16×3×100%×40%x
x−12%x×100%≈31.8%;
故选:B.点评:
本题考点: 物质组成的综合计算;元素的质量分数计算.
考点点评: 本题主要考查学生运用化学式和元素的质量分数公式进行计算的能力.样品中已被锈蚀的铁元素就是氧化铁中铁元素的质量.1年前查看全部
- 如图(1),△ABC是一块等腰三角形的废铁料
如图(1),△ABC是一块等腰三角形的废铁料
如图1△ABC是一块等腰三角形的废铁料,已知∠BAC为锐角,量得底边BC=6dm,底边BC边上的高位4dm,利用它裁一块一边长为3dm的矩形.(要求使矩形的一边落在△ABC的一边上,而矩形的另两个顶点分别在△ABC的另两边上).
(1)请你设计两种不同的裁法,分别画出两种裁法的示意图, 并求出所裁得的矩形的另一边长.
(2)由于在操作时,同学马兵不小心将铁片弄坏(见图2中阴影部分),量得EB=4.1dm,AD=1.5dm,此时马兵不知如何是好,聪明的同学,请你帮助马兵探索,还能裁剪的符合条件及要求的矩形吗?若能,请求出该矩形的面积,若不能.请说明理由!

 english_kn1年前1
english_kn1年前1 -
 sc8606 共回答了19个问题
sc8606 共回答了19个问题 |采纳率89.5%1)因为矩形的一条边长为30cm,而另一条边长的不确定的,所以这样的矩形的截法有不同的四种如图3所示.
(2)先对△ABC作一个剖析:
①在△ABC中,AB=AC,BC=60cm,作AF⊥BC于F,则有BF=CF=30cm,AF=40cm,易知AB=AC=50cm,
②再作CH⊥AB于H,由AF•BC=CH•AB,得CH=48cm.
在截法一中,设PN=xcm,由PQ//BC,得(40-x)/40=30/60 ,解得x=20cm,即所截得的矩形MNPQ的另一边长为20cm,即PN=20cm;
在截法二中,设PN=ycm,由PQ//AB,得(48-y)/48=30/50 ,解得y=19.2cm,即所截得矩形MNPQ的另一条边长为19.2cm,即PN=19.2cm.
在截法三中,设PN=zcm,由PN//BC,得z/60=(40-30)/40;解得z=15cm,即所截得矩形MNPQ的另一边长为15cm,即PN=15cm.
在截法四中,设PN=kcm,由PN//AB,得k/50=(48-30)/48 ,解得k=18.75cm,即所截得矩形MNPQ的另一边长为18.75cm.即PN=18.75cm.
(3)若铁片受损,使得AD=15cm,EC=41cm,但仍然由第三种截法可以截得符合条件和要求的矩形.
①在原截法一中;因为CM=45cm,EC=41cm,CM>EC,所以无法截取;
②在原截法二中:因为AP>PN=19.2cm,AD=15cm,所以AP>AD,所以无法截取;
③在原截法四中,作CH⊥AB于H,BH=根号(60^2-48^2)=36 (cm),而BD=50-15=35(cm),所以BH>BD,所以无法截取.
④在原截法三中:作AF⊥BC于F,交PN于0,因为PN=15cm,根据对称性:OP=ON=FQ=FM= cm,
在Rt△AOP中,AP=根号[10^2+(15/2)^2]=25/2(cm) ,
所以AP=12.5cm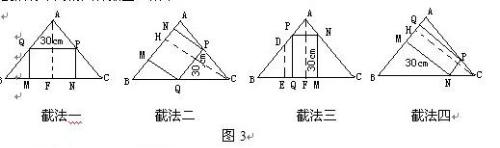 1年前查看全部
1年前查看全部
- 典范英语七《废铁人与神奇飞行器》的主要内容
典范英语七《废铁人与神奇飞行器》的主要内容
中文,配上英文的就更好了.8月10日就要交稿了, kgb10506l1年前1
kgb10506l1年前1 -
 我的大蒜 共回答了19个问题
我的大蒜 共回答了19个问题 |采纳率78.9%Summary:After working so hard to help Winston build the incredible flying machine,Scrapman is disappointed that he won't be allowed to fly in it.Then,when Winston can't get the flying machine off the ground and goes home,Scrapman (who has just taught himself how to read and is feeling very confident) tries the machine.Scrapman is able to fly,but he doesn't know how to get back down until his friend Emma helps.Main Characters:Winston,Scrapman,Emma,Scrapcat,Patch.
故事梗概:他们非常努力地帮助温斯顿建立了令人难以置信的飞行器之后,Scrapman非常失望他的不被允许开这台飞行器.然后,当温斯顿从地面上开着飞行器回到家的时候,Scrapman(刚刚自己学会了怎么阅读这台机器的使用说明,并且感到很自信)也尝试这台机器.Scrapman也学会飞了,但是他不知道如何爬下来,直到他的朋友艾玛帮助了他.主要人物:温斯顿,Scrapman,爱玛,Scrapcat,Patch.1年前查看全部
- (2012•东营)某兴趣小组对生锈废铁锅中铁的含量进行了测定.生锈的铁锅中除Fe、Fe2O3外,还含有碳、硅、锰等元素(
 (2012•东营)某兴趣小组对生锈废铁锅中铁的含量进行了测定.生锈的铁锅中除Fe、Fe2O3外,还含有碳、硅、锰等元素(除Fe、Fe2O3以外的物质都不与稀硫酸反应).兴趣小组的同学称取33g废铁锅片放入特制容器中,缓慢加入39.2%的稀硫酸,直到反应完全(假设硫酸先与表面的铁锈发生反应),实验数据如图所示.
(2012•东营)某兴趣小组对生锈废铁锅中铁的含量进行了测定.生锈的铁锅中除Fe、Fe2O3外,还含有碳、硅、锰等元素(除Fe、Fe2O3以外的物质都不与稀硫酸反应).兴趣小组的同学称取33g废铁锅片放入特制容器中,缓慢加入39.2%的稀硫酸,直到反应完全(假设硫酸先与表面的铁锈发生反应),实验数据如图所示.
(1)从化学元素与人体健康的角度考虑,我们应选用铁锅还是铝锅______,因为______.
(2)废铁锅片中铁单质的质量分数为______.(结果保留到0.1%)
(3)所得溶液中所含溶质的化学式为______,计算溶液中硫酸铁的质量.(要求写出计算过程) vv地耳1年前1
vv地耳1年前1 -
 梦游不归人 共回答了23个问题
梦游不归人 共回答了23个问题 |采纳率95.7%解题思路:(1)铝元素有毒,对人体有害,而铁是人体必需额微量元素,可以据此解答;
(2)根据生成气体的质量可以求算出铁的质量,进而求算出铁的质量分数;
(3)铁锈的主要成分为氧化铁,氧化铁和铁都能和稀硫酸反应,铁和硫酸反应生成硫酸亚铁,而氧化铁和硫酸反应生成硫酸铁;分析图中坐标系可以知道氧化铁消耗硫酸的质量为18.75g,可以据此求算出硫酸铁的质量.(1)铁是人体必需的微量元素,而铝是不必需元素,而且铝元素对人体有害,所以从化学元素与人体健康的角度考虑,我们应选用铁锅;
(2)设废铁锅片中铁单质的质量为x
Fe+H2SO4 =FeSO4+H2↑
562
x 1.0g
[56/x=
2
1.0g]
解得:x=28g
废铁锅片中铁单质的质量分数为:[28g/33g]×100%=84.8%;
(3)铁锈的主要成分为氧化铁,氧化铁和铁都能和稀硫酸反应,铁和硫酸反应生成硫酸亚铁,而氧化铁和硫酸反应生成硫酸铁;所以在反应后的溶液中含有的溶质为:Fe2(SO4)3、FeSO4;
根据图中信息可以知道,和氧化铁反应的硫酸的质量为:18.75g×39.2%=7.35g;
设生成Fe2(SO4)3的质量为y
Fe2O3+3H2SO4═Fe2(SO4)3+3H2O
294400
7.35gy
[294/400=
7.35g
y]
解得:y=10g
答:溶液中硫酸铁的质量为10g.
故答案为:(1)铁锅;铁是人体必需的微量元素,而铝是不必需元素,而且铝元素对人体有害;
(2)84.8%;
(3)Fe2(SO4)3、FeSO4;10g.点评:
本题考点: 根据化学反应方程式的计算;人体的元素组成与元素对人体健康的重要作用.
考点点评: 要想解答好这类题目,首先,要理解和熟记根据化学反应方程式的计算步骤和格式,以及与之相关的知识等.然后,根据所给的问题情景,结合所学的相关知识和技能,细致地分析题意,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.1年前查看全部
- 某兴趣小组对生锈废铁锅中铁的含量进行了测定.生锈的铁锅中除Fe、Fe2O3外,还含有碳、硅、锰等元素(除Fe、Fe2O3
某兴趣小组对生锈废铁锅中铁的含量进行了测定.生锈的铁锅中除Fe、Fe2O3外,还含有碳、硅、锰等元素(除Fe、Fe2O3以外的物质都不与稀硫酸反应).兴趣小组的同学称取33g废铁锅片放入特制容器中,缓慢加入39.2%的稀硫酸,直到反应完全(假设硫酸先与表面的铁锈发生反应)
所得溶液中所含溶质的化学式为
怎么想的这一题? xxld5201年前3
xxld5201年前3 -
 mickey952 共回答了18个问题
mickey952 共回答了18个问题 |采纳率83.3%Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
160 400
Fe+ Fe2(SO4)3= 3FeSO4
56 400
Fe + H2SO4 = FeSO4 + H2↑
因为硫酸先与表面的铁锈发生反应,当铁锈与硫酸完全反应后,铁先与硫酸铁反应生成硫酸亚铁,只有硫酸铁完全反应后铁才能与稀硫酸反应.
(如果你是高中学生你就会明白:还原剂与多种氧化剂反应时,先和氧化性强的物质反应,再和强氧化性弱的反应,Fe^3+氧化性>H^+氧化性)
当铁与氧化铁的质量比<56:160=7:20时,
所得溶液中所含溶质的化学式为:Fe2(SO4)3、FeSO4或Fe2(SO4)3、FeSO4和H2SO4
当铁与氧化铁的质量比≥56:160=7:20时,
所得溶液中所含溶质的化学式为:FeSO4或FeSO4和H2SO41年前查看全部
- 改变原子核里质子的数量就能改变物质吗 比如废铁变金子!
 凄美影子1年前2
凄美影子1年前2 -
 仰天望 共回答了22个问题
仰天望 共回答了22个问题 |采纳率100%理论上是可以人工合成的
但成本比开采金矿还高
元素周期表中后面几个元素都是人工在实验室合成的1年前查看全部
- 大伯卖废铁得240元,有2.5.10元面值的人民币共50张,2元.5元面值一样多,10元有几张
 chengfeng1111年前1
chengfeng1111年前1 -
 晦气 共回答了23个问题
晦气 共回答了23个问题 |采纳率91.3%设10元的有X张,依据题意得到:
2*[(50-X)/2]+5*[(50-X)/2]+10X=240
简化后得到
50-X+125-2.5X+10X=240
经过计算后得到
X=10
即10元的有10张,2元和5元的各20张1年前查看全部
- .防锈和回收废旧金属都是保护金属资源的重要途径.为测定一种待回收的废铁中铁的锈蚀程度,某同学取该部
.防锈和回收废旧金属都是保护金属资源的重要途径.为测定一种待回收的废铁中铁的锈蚀程度,某同学取该部
分锈蚀的铁片样品(仅由铁和氧化铁组成),测得其中氧元素的含量为15%,则样品中已被锈蚀的铁元素占原金属铁的质量分数约为( )
过程
 XX_Hotel1年前1
XX_Hotel1年前1 -
 cactus0711 共回答了20个问题
cactus0711 共回答了20个问题 |采纳率95%设物质质量为100克,则氧元素质量为15克,氧化铁中铁:氧=112:48=7:3,所以氧化铁中铁元素的质量为35克,则铁单质质量为100-15-35=50
则已被锈蚀的铁元素占原金属铁的质量分数约为35/(50+35)=41.2%
亲,有其他题目请另外发问,此问题有疑问,以上都是本人自己纯手工做的,有错误,请指出.我是诚心的想帮你,若满意请点击在下答案旁的"好评",互相探讨,互相理解,请不要随意给差评,1年前查看全部
- 甲乙两组少先队捡废铁,乙组比甲组多捡20千克.甲组有14人,平均每人捡30千克,乙
 windodi1年前1
windodi1年前1 -
 yangyangxiaoxiao 共回答了18个问题
yangyangxiaoxiao 共回答了18个问题 |采纳率83.3%问题都看不见1年前查看全部
- (2013•沐川县二模)某兴趣小组对生锈废铁锅中铁的含量进行了测定.生锈的铁锅中除Fe、Fe2O3外,还含有碳、硅、锰等
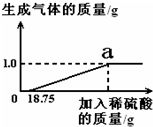 (2013•沐川县二模)某兴趣小组对生锈废铁锅中铁的含量进行了测定.生锈的铁锅中除Fe、Fe2O3外,还含有碳、硅、锰等元素(除Fe、Fe2O3以外的物质都不与稀硫酸反应).兴趣小组的同学称取33g废铁锅片放入特制容器中,缓慢加入39.2%的稀硫酸,直到反应完全(假设硫酸先与表面的铁锈发生反应),实验数据如图所示.计算:
(2013•沐川县二模)某兴趣小组对生锈废铁锅中铁的含量进行了测定.生锈的铁锅中除Fe、Fe2O3外,还含有碳、硅、锰等元素(除Fe、Fe2O3以外的物质都不与稀硫酸反应).兴趣小组的同学称取33g废铁锅片放入特制容器中,缓慢加入39.2%的稀硫酸,直到反应完全(假设硫酸先与表面的铁锈发生反应),实验数据如图所示.计算:
(1)废铁锅片中铁单质的质量分数.
(2)反应完全(图中a点)时,溶液中硫酸亚铁溶质的质量分数. ryanolas1年前1
ryanolas1年前1 -
 谢雨欣 共回答了14个问题
谢雨欣 共回答了14个问题 |采纳率92.9%解题思路:根据生成氢气的质量可以计算铁的质量和生成的硫酸亚铁的质量,进一步可以计算废铁锅片中铁单质的质量分数和反应完全(图中a点)时,溶液中硫酸亚铁溶质的质量分数.(1)设铁的质量为x,生成的硫酸亚铁的质量为y,硫酸的质量为m,
Fe+H2SO4═FeSO4+H2↑,
5698152 2
xmy 1.0g
[56/x]=[98/m]=[152/y]=[2/1.0g],
x=28g,y=76g,m=49g,
废铁锅片中铁单质的质量分数为:[28g/33g]×100%=84.8%,
答:废铁锅片中铁单质的质量分数为84.8%.
(2)设氧化铁的质量为z,
Fe2O3+3H2SO4═Fe2(SO4)3+3H2O,
160294
z18.75g×39.2%
[160/z]=[294/18.75g×39.2%],
z=4g,
与铁反应的稀硫酸的质量为:49g÷39.2%=125g,
反应完全(图中a点)时,溶液的质量为:28g+4g+18.75g+125g-1.0g=174.75g,
溶液中硫酸亚铁溶质的质量分数为:[76g/174.75g]×100%=43.5%,
答:溶液中硫酸亚铁溶质的质量分数为43.5%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.1年前查看全部
- 防锈和回收废旧金属都是保护金属资源的重要途径.为测定一种待回收的废铁中铁的锈蚀程度,某同学取该部分锈蚀的铁片样品(仅由铁
防锈和回收废旧金属都是保护金属资源的重要途径.为测定一种待回收的废铁中铁的锈蚀程度,某同学取该部分锈蚀的铁片样品(仅由铁和氧化铁组成),测得其中氧元素的含量为12%,则样品中已被锈蚀的铁元素占原金属铁的质量分数约为( )
A. 28%
B. 31.8%
C. 46.7%
D. 70% xueyin3691年前1
xueyin3691年前1 -
 彼岸非花 共回答了19个问题
彼岸非花 共回答了19个问题 |采纳率94.7%解题思路:根据氧化铁中氧的质量分数可以计算该样品中氧化铁的质量;然后由氧化铁中铁的质量分数可以求得氧化铁中铁在质量;最后根据[氧化铁中铁的质量/铁的质量]×100%即可求得结果.设该锈蚀的铁片样品(仅由铁和氧化铁组成)的质量为x.则
氧化铁的质量=[12%x
16×3/56×2+16×3×100%]=40%x;
被腐蚀的铁的质量=[56×2/56×2+16×3]×100%×40%x,
所以该样品中已被锈蚀的铁元素占原金属铁的质量分数为:
56×2
56×2+16×3×100%×40%x
x−12%x×100%≈31.8%;
故选:B.点评:
本题考点: 物质组成的综合计算;元素的质量分数计算.
考点点评: 本题主要考查学生运用化学式和元素的质量分数公式进行计算的能力.样品中已被锈蚀的铁元素就是氧化铁中铁元素的质量.1年前查看全部
- (2012•哈尔滨)防锈和回收废旧金属都是保护金属资源的重要途径.为测定一种待回收的废铁中铁的锈蚀程度,某同学取该部分锈
(2012•哈尔滨)防锈和回收废旧金属都是保护金属资源的重要途径.为测定一种待回收的废铁中铁的锈蚀程度,某同学取该部分锈蚀的铁片样品(仅由铁和氧化铁组成),测得其中氧元素的含量为12%,则样品中已被锈蚀的铁元素占原金属铁的质量分数约为( )
A.28%
B.31.8%
C.46.7%
D.70% 麦哈拓1年前1
麦哈拓1年前1 -
 zhaozj0128 共回答了17个问题
zhaozj0128 共回答了17个问题 |采纳率88.2%解题思路:根据氧化铁中氧的质量分数可以计算该样品中氧化铁的质量;然后由氧化铁中铁的质量分数可以求得氧化铁中铁在质量;最后根据[氧化铁中铁的质量/铁的质量]×100%即可求得结果.设该锈蚀的铁片样品(仅由铁和氧化铁组成)的质量为x.则
氧化铁的质量=[12%x
16×3/56×2+16×3×100%]=40%x;
被腐蚀的铁的质量=[56×2/56×2+16×3]×100%×40%x,
所以该样品中已被锈蚀的铁元素占原金属铁的质量分数为:
56×2
56×2+16×3×100%×40%x
x−12%x×100%≈31.8%;
故选:B.点评:
本题考点: 物质组成的综合计算;元素的质量分数计算.
考点点评: 本题主要考查学生运用化学式和元素的质量分数公式进行计算的能力.样品中已被锈蚀的铁元素就是氧化铁中铁元素的质量.1年前查看全部
- 把一把锁锯成两半,虽然劳动时间增加了,可是它只能当废铁低价销售。这说明( ) A.商品
把一把锁锯成两半,虽然劳动时间增加了,可是它只能当废铁低价销售。这说明()
A.商品的使用价值是价值的物质承担者 B.商品的价值不一定由劳动时间决定 C.个别劳动时间的变化也会引起商品价值量的改变 D.商品的使用价值离不开价值  yukeyue1年前1
yukeyue1年前1 -
 checkup2005 共回答了24个问题
checkup2005 共回答了24个问题 |采纳率83.3%A
锁被锯成两半后,它就不再具有锁的功能,随着其使用价值的丧失,锁的价值也就不存在了,变成废铁的锁只能按废铁的价值出售了。1年前查看全部
- 由废铁制备FeCl 2 的主要过程如下:
由废铁制备FeCl 2 的主要过程如下:
Ⅰ.按下图所示过程制备FeCl 3 •6H 2 O
(1)①中产生气体的电子式是 。
(2)用离子方程式表示过程②中稀硝酸的作用 ,在该过程中要不断向溶液中补充盐酸,目的是 。
Ⅱ.由FeCl 3 • 6H 2 O制得干燥FeCl 2 的过程如下:
ⅰ.向盛有FeCl 3 • 6H 2 O的容器中加入SOCl 2 ,加热,获得无水FeCl 3
ⅱ.将无水FeCl 3 置于反应管中,通入①中产生的气体一段时间后加热,生成FeCl 2
ⅲ.收集FeCl 2 ,保存备用
(3) SOCl 2 与水接触会迅速产生白雾和SO 2 。加热分解FeCl 3 • 6H 2 O不能得到无水FeCl 3 ,而步骤ⅰ中可得到无水FeCl 3 ,结合必要化学方程式解释得到无水FeCl 3 的原因 。
(4)过程ⅱ中产生FeCl 2 的化学方程式是 。
Ⅲ.FeCl 2 的包装上贴有安全注意事项,部分内容如下:品 名 氯化亚铁 理化特性 白色,遇空气易变成黄色,易吸水,有腐蚀性…… 注意事项 避免接触空气、碱等;聚乙烯塑料桶包装;避免受热
(5)下列说法正确的是 。
a.密闭保存、远离火源
b.可以与强氧化剂共同存放、运输
c.不宜用铁制容器包装而要用聚乙烯塑料桶包装
(6)FeCl 2 在空气中受热可生成氯化铁、氧化铁等,反应的化学方程式是 。 maimmhjx1年前1
maimmhjx1年前1 -
 天山美雪 共回答了13个问题
天山美雪 共回答了13个问题 |采纳率84.6%(1) (1分)
(1分)
(2)3Fe 2+ + NO 3 - + 4H + ="3" Fe 3+ + NO↑+ 2H 2 O (2分)
补充H + ,使NO 3 - 继续氧化Fe 2+ ,直至NO 3 - 完全消耗,既不产生Fe(NO 3 ) 3 ,又不引入其他杂质(2分)
(3) 6SOCl 2 + FeCl 3 •6H 2 O = FeCl 3 + 12HCl↑+ 6SO 2 ↑,生成的HCl会抑制FeCl 3 的水解,得到无水FeCl 3 (2分)
(4)2FeCl 3 + H 2 △ 2FeCl 2 + 2HCl(2分)
(5)a c (1分)
(6)4FeCl 2 + H 2 O + O 2 △ 2FeCl 3 + Fe 2 O 3 + 2HCl(2分)
<>1年前查看全部
- 一班64人,共拾600千克;二班50人,共拾490千克.平均每人拾废铁多少千克?
 qiuyanjin1年前5
qiuyanjin1年前5 -
 忆鸿 共回答了14个问题
忆鸿 共回答了14个问题 |采纳率85.7%(600+490)/(64+50)=1090/114≈9.56(千克)1年前查看全部
- 同学拾废铁990千克,已知男生平均每人拾27千克,女生平均每人拾18千克,全班平均每人拾22千克,这个班男女生各多少个?
 啊鸿1年前2
啊鸿1年前2 -
 江涛涛1 共回答了16个问题
江涛涛1 共回答了16个问题 |采纳率81.3%这个班的总人数
=990/22
=45人
设这个班有男生X人,则有女生45-X人
27X+18(45-X)=990
9X=180
X=20
45-X
=45-20
=25
这个班男女生分别有20个和25个1年前查看全部
- 六年级三个班拾废铁,一班拾54千克,二班拾的是一班的6分之5,二班拾的是三班的4分之3,三班拾废铁多少千
 亲亲我的梦儿1年前6
亲亲我的梦儿1年前6 -
 古代xx人 共回答了25个问题
古代xx人 共回答了25个问题 |采纳率84%54X5/6÷3/4
=45÷3/4
=60千克1年前查看全部
- 工人师傅从一块正方形废铁片上剪下4个圆冲击垫圈,要求每个圆的面积是4πr的平方,求废铁片的边长至少为多少
 没谱没谱1年前2
没谱没谱1年前2 -
 87218322 共回答了19个问题
87218322 共回答了19个问题 |采纳率100%圆的面积是 πR² = 4πr²,所以圆的半径 R=2r.
则正方形的边长,至少为2个圆的直径,即4R,也就是8r.(这里r只是一个代数,不是半径)1年前查看全部
- 如图所示,工人师傅从一块正方形铁片上剪下四个圆做冲击垫圈,要求每个圆的面积为4π平方厘米,求废铁片的边长为多少?
 yayakeke2141年前1
yayakeke2141年前1 -
 fotolo的爷爷 共回答了22个问题
fotolo的爷爷 共回答了22个问题 |采纳率90.9%16π+4*2*41年前查看全部
- 在一个直径26厘米的圆里剪一个最大的正方形,正方形的面积是多少?他比周围的废铁多几平方厘米?
 helpingfirst1年前3
helpingfirst1年前3 -
 未卜先知之浮云 共回答了19个问题
未卜先知之浮云 共回答了19个问题 |采纳率100%正方形的斜边=直径=26
正方形的边长=b/根号2=26/根号2 (a平方+a平方=b平方,2a平方=b平方)
正方形的面积=a*a=26*26/2=338平方厘米
余下废铁面积=圆面积-正方形面积=派r平方-a*a
=3.14*13*13-338=192.66
所以正方形面积-余下废铁面积=338-192.66=145.34平方厘米
即正方形面积比周围的废铁多145.34平方厘米.1年前查看全部
- 某班同学拾废铁990克男生均每人拾27千克女生均每人拾18千克全班均每人拾22千,这个班男女个多人不能用方程
某班同学拾废铁990克男生均每人拾27千克女生均每人拾18千克全班均每人拾22千,这个班男女个多人不能用方程
是990千克 崔公子1年前5
崔公子1年前5 -
 ltf7746 共回答了12个问题
ltf7746 共回答了12个问题 |采纳率100%某班同学拾废铁990千克.男生均每人拾27千克女生均每人拾18千克全班均每人拾22千,这个班男女个多人?
这个班共有:990÷22=45人
若都是女生,则拾废铁:45×18=810千克
男生:(990-810)÷(27-18)=20人
女生:45-20=25人1年前查看全部
- 小红和班里27名同学一起收集废铁,两周共收集784千克废铁,平均每人每天收集多少千克废铁?
 xuesheng1681年前3
xuesheng1681年前3 -
 sup_zf 共回答了24个问题
sup_zf 共回答了24个问题 |采纳率87.5%解题思路:一共有27+1=28人,两周是14天;先用784千克除以14天就是27人每天收集多少千克,然后再除以28人就是平均每人每天收集多少千克.两周=14天;
784÷14÷(27+1),
=56÷28,
=2(千克);
答:平均每人每天收集2千克.点评:
本题考点: 整数的除法及应用.
考点点评: 根据除法平均分的意义列出除法算式求解,注意总人数是28人不是27人.1年前查看全部
- 某班同学拾废铁990千克.已知男生平均每人拾27千克,女生平均每人拾18千克,全班平均每人拾22千克
某班同学拾废铁990千克.已知男生平均每人拾27千克,女生平均每人拾18千克,全班平均每人拾22千克
.这个班男、女生各多少人?
用方程解 hjxyp1年前2
hjxyp1年前2 -
 bluemood123 共回答了21个问题
bluemood123 共回答了21个问题 |采纳率95.2%设有男生x人,则女生人数为(990/22-x)=(45-x)人
27x+(45-x)×18=990
9x=180
x=20
45-x=25人
答:有男生20人、女生25人.1年前查看全部
- 把少量废铁粉溶于过量稀硫酸中,过滤,除去杂质,在滤液中加入适量硝酸,再加入过量的氨水,有红褐色沉淀生成.过滤,加热沉淀物
把少量废铁粉溶于过量稀硫酸中,过滤,除去杂质,在滤液中加入适量硝酸,再加入过量的氨水,有红褐色沉淀生成.过滤,加热沉淀物至质量不再发生变化,得到红棕色的残渣.上述沉淀和残渣分别是( )
A. Fe(OH)3;Fe2O3
B. Fe(OH)2;FeO
C. Fe(OH)2、Fe(OH)3;Fe3O4
D. Fe2O3;Fe(OH)3 LY-海宏1年前1
LY-海宏1年前1 -
 甜葡萄0314 共回答了13个问题
甜葡萄0314 共回答了13个问题 |采纳率92.3%解题思路:红褐色沉淀生成为Fe(OH)3,Fe(OH)3不稳定,在加热时分解生成红棕色的Fe2O3.有关转化关系为Fe
H2SO4
Fe2+
HNO3
Fe3+
氨水
Fe(OH)3
加热
Fe2O3,
红褐色沉淀生成为Fe(OH)3,Fe(OH)3不稳定,在加热时分解生成红棕色的Fe2O3,而Fe(OH)2为白色沉淀,
FeO和Fe3O4都为黑色物质.
故选A.点评:
本题考点: 铁的化学性质;铁的氧化物和氢氧化物.
考点点评: 本题考查铁及铁的化合物的性质,题目难度不大,注意相关基础知识的积累.1年前查看全部
- 初中化学 写理由实验室的废液需经处理才能排放,为减弱含有硫酸的废液的酸性,不能选用的物质是____(填字母序号)A.废铁
初中化学 写理由
实验室的废液需经处理才能排放,为减弱含有硫酸的废液的酸性,不能选用的物质是____(填字母序号)
A.废铁钉 B熟石灰 C二氧化碳 D碳酸钠 子龙801年前3
子龙801年前3 -
 bayhzh 共回答了15个问题
bayhzh 共回答了15个问题 |采纳率86.7%C
CO2是酸性氧化物 不与稀酸反应
A:Fe+H2SO4=FeSO4+H2/ 酸的通性 与活泼金属置换反应
B:Ca(oH)2+H2SO4=CaSO4+2H2O酸的通性 与碱中和反应
D:Na2CO3+H2SO4=Na2SO4+H2O+CO2氢例子与碳酸根离子不可共存1年前查看全部
- 防锈和回收废旧金属都是保护金属资源的重要途径.为测定一种待回收的废铁中铁的锈蚀程度,某同学取该部分锈蚀的铁片样品(仅由铁
防锈和回收废旧金属都是保护金属资源的重要途径.为测定一种待回收的废铁中铁的锈蚀程度,某同学取该部分锈蚀的铁片样品(仅由铁和氧化铁组成),测得其中氧元素的含量为12%,则样品中已被锈蚀的铁元素占原金属铁的质量分数约为( )
A. 28%
B. 31.8%
C. 46.7%
D. 70% duoojiuu1年前1
duoojiuu1年前1 -
 雪丽hh 共回答了15个问题
雪丽hh 共回答了15个问题 |采纳率93.3%解题思路:根据氧化铁中氧的质量分数可以计算该样品中氧化铁的质量;然后由氧化铁中铁的质量分数可以求得氧化铁中铁在质量;最后根据[氧化铁中铁的质量/铁的质量]×100%即可求得结果.设该锈蚀的铁片样品(仅由铁和氧化铁组成)的质量为x.则
氧化铁的质量=[12%x
16×3/56×2+16×3×100%]=40%x;
被腐蚀的铁的质量=[56×2/56×2+16×3]×100%×40%x,
所以该样品中已被锈蚀的铁元素占原金属铁的质量分数为:
56×2
56×2+16×3×100%×40%x
x−12%x×100%≈31.8%;
故选:B.点评:
本题考点: 物质组成的综合计算;元素的质量分数计算.
考点点评: 本题主要考查学生运用化学式和元素的质量分数公式进行计算的能力.样品中已被锈蚀的铁元素就是氧化铁中铁元素的质量.1年前查看全部
- 求典范英语七“废铁人与神奇飞行器”的中文翻译
 人不如姑1年前1
人不如姑1年前1 -
 yuanyingjun 共回答了17个问题
yuanyingjun 共回答了17个问题 |采纳率88.2%Summary:After working so hard to help Winston build the incredible flying machine,Scrapman is disappointed that he won't be allowed to fly in it.Then,when Winston can't get the flying machine off the ground and goes home,Scrapman (who has just taught himself how to read and is feeling very confident) tries the machine.Scrapman is able to fly,but he doesn't know how to get back down until his friend Emma helps.Main Characters:Winston,Scrapman,Emma,Scrapcat,Patch.故事梗概:他们非常努力地帮助温斯顿建立了令人难以置信的飞行器之后,Scrapman非常失望他的不被允许开这台飞行器.然后,当温斯顿从地面上开着飞行器回到家的时候,Scrapman(刚刚自己学会了怎么阅读这台机器的使用说明,并且感到很自信)也尝试这台机器.Scrapman也学会飞了,但是他不知道如何爬下来,直到他的朋友艾玛帮助了他.主要人物:温斯顿,Scrapman,爱玛,Scrapcat,Patch.1年前查看全部
- 铁和稀盐酸(HCl)反应生成氯化亚铁和氢气,有人用8克的废铁(铁中含有杂质,杂质不参加反应)与足量的稀盐酸
铁和稀盐酸(HCl)反应生成氯化亚铁和氢气,有人用8克的废铁(铁中含有杂质,杂质不参加反应)与足量的稀盐酸
反应,生成氢气0.2克,求废铁中铁的质量分数. uu花开淡如百合1年前1
uu花开淡如百合1年前1 -
 Sailorh 共回答了18个问题
Sailorh 共回答了18个问题 |采纳率94.4%设废铁中铁的质量为x.
Fe+2HCl=FeCl2+H2↑
56 2
x 0.2g
56/x=2/0.2
x=5.6g
铁的质量分数=5.6/8*100%=70%
答:废铁中铁的质量分数是70%1年前查看全部
- (2014•抚州二模)某兴趣小组对生锈废铁锅中铁的含量进行了测定.生锈的铁锅中除Fe、Fe2O3外,还含有碳、硅、锰等元
 (2014•抚州二模)某兴趣小组对生锈废铁锅中铁的含量进行了测定.生锈的铁锅中除Fe、Fe2O3外,还含有碳、硅、锰等元素(除Fe、Fe2O3以外的物质都不与稀硫酸反应).兴趣小组的同学称取33g废铁锅片放入特制容器中,缓慢加入39.2%的稀硫酸,直到反应完全(假设硫酸先与表面的铁锈发生反应),实验数据如图所示.
(2014•抚州二模)某兴趣小组对生锈废铁锅中铁的含量进行了测定.生锈的铁锅中除Fe、Fe2O3外,还含有碳、硅、锰等元素(除Fe、Fe2O3以外的物质都不与稀硫酸反应).兴趣小组的同学称取33g废铁锅片放入特制容器中,缓慢加入39.2%的稀硫酸,直到反应完全(假设硫酸先与表面的铁锈发生反应),实验数据如图所示.
(1)从化学元素与人体健康的角度考虑,我们应选用铁锅还是铝锅?______,为什么?______.
(2)废铁锅片中铁单质的质量分数为______.(结果保留到0.1%)
(3)所得溶液中所含溶质的化学式为______.
(4)计算溶液中硫酸铁的质量.(要求写出计算过程) shirly40801年前1
shirly40801年前1 -
 乃几嘎 共回答了22个问题
乃几嘎 共回答了22个问题 |采纳率95.5%解题思路:铁元素是人体必需的营养元素之一,使用铁锅可以为人体提供铁元素,从而促进人体健康;
氧化铁和稀硫酸反应生成硫酸铁和水,铁和稀硫酸反应生成硫酸亚铁和氢气;
根据稀硫酸的质量、生成氢气的质量可以计算铁、硫酸铁的质量,进一步可以计算废铁锅片中铁单质的质量分数和溶液中硫酸铁的质量.(1)从化学元素与人体健康的角度考虑,我们应选用铁锅,这是因为使用铁锅能够为人体提供铁元素,从而促进人体健康.
故填:铁锅;能够为人体补充铁元素.
(2)设铁的质量为x,
由图中可知,生成氢气的质量是1.0g,
Fe+H2SO4═FeSO4+H2↑,
56 2
x 1.0g
[56/x]=[2/1.0g],
x=28g,
废铁锅片中铁单质的质量分数为:[28g/33g]×100%=84.8%,
答:废铁锅片中铁单质的质量分数为84.8%.
(3)所得溶液中所含溶质是硫酸亚铁和硫酸铁,化学式分别是FeSO4、Fe2(SO4)3.
故填:FeSO4、Fe2(SO4)3.
(4)设溶液中硫酸铁的质量为y,
Fe2O3+3H2SO4═Fe2(SO4)3+3H2O,
294 400
18.75g×39.2% y
[294/18.75g×39.2%]=[400/y],
y=10g,
答:溶液中硫酸铁的质量为10g.点评:
本题考点: 根据化学反应方程式的计算;人体的元素组成与元素对人体健康的重要作用.
考点点评: 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.1年前查看全部
大家在问
- 1英语试题一、用所给单词的适当形式填空.1.Where_____your uncle____(work)?-He____(
- 2你能在如图的正方形中画一个面积最大的圆吗?如果剪去这个最大的圆,剩下部分的面积是多少?
- 3袋鼠英语怎么拼kuai
- 4黑()升(),反义词
- 5怎样证明1/2+1/3+1/4+…1/n>In[(n+2)/2],
- 6半径为R的均匀球面,总电荷为Q,设无穷远处的电势为0,则距离球心为r的P点处的电场强度的大小和电势
- 7grow fujian 用被动语态造句
- 8一套运动装标价200元,按标价的八折销售,则这套运动装的实际售价为______元.
- 9(2012•庐阳区一模)小丽午餐时买了一份清炒菠菜和一份豆腐肉片汤,但同学告诉她菠菜不能与豆腐同食,会产生结石.小丽对此
- 10can you help me?=_______________=__________________
- 11化简分式x²-1分之x²+x
- 12水是生命之源、万物之基,是人类宝贵的自然资源,我们每个人都要关心水、爱护水、节约用水.
- 13英语翻译今年想和你一起看烟花.
- 14“走过桥”应该怎么翻译?go across the bridge 还是go over the bridge?请顺便讲讲这
- 15概率论与统计计算题设正态总体X的方差为1,据来自X的容量为100