核外电子排布式和轨道表示式是表示原子核外电子排布的两种不同方式.请你比较这两种表示方式的共同点和不同点.
 甜x柠x檬2022-10-04 11:39:541条回答
甜x柠x檬2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 婉约幽蓝 共回答了19个问题
婉约幽蓝 共回答了19个问题 |采纳率94.7%- 相同点:两个都可以表示各个轨道的电子数,并反映各轨道的能力高低
不同点:轨道表示式还可以表示电子在轨道内的自旋方向! - 1年前
相关推荐
- 下列原子的核外电子排布式(或轨道表示式)中,哪一种状态的能量较低?
下列原子的核外电子排布式(或轨道表示式)中,哪一种状态的能量较低?
(1)氮原子: ( )
( )
(2)钠原子:A.3s 1 B.3p 1 ( )
(3)铬原子:A.3d 5 4s 1
B.3d 4 4s 2 ( )
(4)碳原子: ( )
( )  米可多多1年前1
米可多多1年前1 -
 少欲知足 共回答了21个问题
少欲知足 共回答了21个问题 |采纳率81%(1)B
(2)A
(3)A
(4)A1年前查看全部
- 钾原子的核外电子排布式为1s2 2s2 2p6 3s2 3p6 4s1,但在绘制其电子排布图时,3d能级是否应该绘上?原
钾原子的核外电子排布式为1s2 2s2 2p6 3s2 3p6 4s1,但在绘制其电子排布图时,3d能级是否应该绘上?原想:3d能级比4s能级能量高,不用绘制,但又想到无论是书写电子排布式还是电子排布图都要把3d放回4s能级之前,所以产生这个疑虑.我是一名即将升高二的学生,对这个问题有疑虑,希望知道答案的您帮助我解决,
 吾爱吾心dd1年前1
吾爱吾心dd1年前1 -
 125490480 共回答了14个问题
125490480 共回答了14个问题 |采纳率100%不用画,我们开始的时候老师要写上是为了让我们记住4s1的前面有一个3d能级且这个能级是空的好更更好的记住他的结构,但到后来这种没有任何电子的能级为了书写简便就省略了,后来就不画了,也就是说3d6画完直接画4s1.1年前查看全部
- 为什么亚铁离子的核外电子排布式是3d6而不是3d5 4s1
 zhenghaisen79101年前1
zhenghaisen79101年前1 -
 nuomi1111 共回答了23个问题
nuomi1111 共回答了23个问题 |采纳率73.9%你从这么去想吧,亚铁离子易被氧化,而如果是你说的3d54s1,那3d轨道就是半充满达稳定结构,所以和其易被氧化的化学性质不吻合,故只能是4s轨道上2个电子全部失去呈3d6,另外这也可以解释亚铁离子呈绿色~【平の楽^.^小平平】1年前查看全部
- 下列核外电子排布式表示的粒子,无法确定是离子还是原子的是
下列核外电子排布式表示的粒子,无法确定是离子还是原子的是
A、k层为2 B、k层为2,l层为6 C、k层为2,l层为8,m层为8
D、k层为2,l层为8,m层为2
原因 校草25岁生日快乐1年前2
校草25岁生日快乐1年前2 -
 sunday_pk 共回答了21个问题
sunday_pk 共回答了21个问题 |采纳率100%短周期元素形成的简单离子的最外层电子均为8电子(k层为2电子)
因此无法确定是离子还是原子的是最外层为8电子的(k层为2电子)
k层为2时,可能为He、H-、Li+、Be2+
k层为2,l层为8,m层为8,可能为S2-、Cl-、Ar、K+、Ca2+1年前查看全部
- 按要求完成下列各小题(1)、写出钙的核外电子排布式
按要求完成下列各小题
(1)、写出钙的核外电子排布式
(2)、画出氟的价电子轨道表示式
(3)、写出含有一个手性碳原子的分子
(4)、写出甲烷中σ 键的具体类型(即参与成键的原子轨道)
键的具体类型(即参与成键的原子轨道)  leef_0011年前1
leef_0011年前1 -
 mwg1212 共回答了26个问题
mwg1212 共回答了26个问题 |采纳率80.8%1年前查看全部
- 不同元素的同能级可以比较吗?比如:元素电子排布 氩原子与硫离子的核外电子排布式都是1s2 2s2 2p6 3s2 3p6
不同元素的同能级可以比较吗?
比如:元素电子排布 氩原子与硫离子的核外电子排布式都是1s2 2s2 2p6 3s2 3p6 两粒子1s能级上的能量可以比较吗? 懂事_611年前3
懂事_611年前3 -
 睁着眼做梦 共回答了19个问题
睁着眼做梦 共回答了19个问题 |采纳率100%氩原子的1s轨道能量低,因二者受到的核电荷的影响不同,氩的核电荷多,对1s电子引力大,引力势能低(负值更大),电子相应的动能也会小些(可用波尔理论粗略解释),电子间的排斥能相当,故氩原子的1s轨道电子总能量较低.
欢迎进一步讨论.1年前查看全部
- (2014•长宁区一模)氮元素核外电子排布式为:______,原子核外共有______种不同能级的电子,氮原子核外电子云
(2014•长宁区一模)氮元素核外电子排布式为:______,原子核外共有______种不同能级的电子,氮原子核外电子云有______ 种不同的伸展方向,有______ 种不同运动状态的电子.
 wscuss1年前0
wscuss1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 不看元素周期表,填写下表:元素符号核电荷数基态原子的核外电子排布式(可写简化式)周期表中的位置Na11_________
不看元素周期表,填写下表:
元素符号 核电荷数 基态原子的核外电子排布式(可写简化式) 周期表中的位置 Na 11 ______ ______ ______ ______ As 33 ______ ______ ______ ______ Ti 22 ______ ______ ______ ______ Cr 24 ______ ______ ______ ______ Rb 37 ______ ______ ______ ______ ______ ______ 1s22s22p63s23p63d104s24p1 第四 ⅢA p  wxy_12201年前1
wxy_12201年前1 -
 hxwhxw 共回答了22个问题
hxwhxw 共回答了22个问题 |采纳率86.4%解题思路:核电荷数=原子序数,由原子序数可知电子排布,或由电子排布确定原子序数,电子排布中电子层数=周期数、最外层电子数=组序数,由价电子可知元素的分区,以此来解答.Na的原子序数为11,电子排布为1s22s22p63s1,位于第三周期第IA族,最后填充s电子,为s区元素,
As的原子序数为33,电子排布为1s22s22p63s23p63d104s24p3,位于第四周期第VA族,最后填充排p电子,为p区元素,
Ti的原子序数为22,电子排布为1s22s22p63s23p63d24s2,位于第四周期第ⅣB族,最后填充d电子,为d区元素,
Cr的原子序数为24,电子排布为1s22s22p63s23p63d54s1,位于第四周期第ⅥB族,最后填充d电子,为d区元素,
Rb的原子序数为37,电子排布为1s22s22p63s23p63d104s24p65s1,位于第五周期第IA族,最后填充s电子,为s区元素,
1s22s22p63s23p63d104s24p1可知原子序数为31,为Ga元素,位于第四周期第ⅢA族,最后填充p电子,为p区元素,
故答案为:
元素符号核电荷数基态原子的核外电子排布式(可写简化式)周期表中的位置
1s22s22p63s1第三ⅠAs
1s22s22p63s23p63d104s24p3第四VAp
1s22s22p63s23p63d24s2第四ⅣBd
1s22s22p63s23p63d54s1第四ⅥBd
1s22s22p63s23p63d104s24p65s1第五IAs
Ga31.点评:
本题考点: 元素周期表的结构及其应用;原子核外电子排布.
考点点评: 本题考查元素周期表的结构与应用,为高频考点,把握原子的电子排布与元素的位置关系为解答的关键,注重基础知识的考查,Cr的电子排布书写为解答的易错点,注意半满为稳定状态,题目难度不大.1年前查看全部
- 氧离子的核外电子排布式
 liqu_31年前3
liqu_31年前3 -
 静听--爱海涛涛 共回答了17个问题
静听--爱海涛涛 共回答了17个问题 |采纳率100%1s2 2s22p61年前查看全部
- 化学中各种式子比如原子结构式,电子式……电子式,核外电子排布式等,的示意图
 零七北漂族1年前3
零七北漂族1年前3 -
 wwl2006 共回答了22个问题
wwl2006 共回答了22个问题 |采纳率100%分子式
http://baike.baidu.com/view/292167.htm
结构式
http://baike.baidu.com/view/816146.htm
结构简式
http://baike.baidu.com/view/801003.htm
示性式
http://baike.baidu.com/view/1267788.htm
实验式
http://baike.baidu.com/view/932636.htm
电子式
http://baike.baidu.com/view/525657.htm
电子排布式
http://baike.baidu.com/view/907730.htm
轨道表示式
http://baike.baidu.com/view/907809.htm
PS:实验式、分子式、结构式、示性式统称化学式
楼主到底要哪种物质的什么式啊?
希望我的回答对你有帮助,采纳吧O(∩_∩)O!1年前查看全部
- 现有四种元素的基态原子的核外电子排布式如下:
现有四种元素的基态原子的核外电子排布式如下:
①1s 2 2s 2 2p 6 3s 2 3p 4 ②1s 2 2s 2 2p 6 3s 2 3p 3 ③1s 2 2s 2 2p 3 ④1s 2 2s 2 2p 5
则下列有关比较中正确的是 ( )A.第一电离能:④>③>②>① B.原子半径:④>③>②>① C.电负性:④>③>②>① D.最高正化合价:④>③=②>①  deadhellman1年前1
deadhellman1年前1 -
 xujin217 共回答了17个问题
xujin217 共回答了17个问题 |采纳率94.1%A
1年前查看全部
- (1)写出EU(63号),TE(52号)元素原子的核外电子排布式
(1)写出EU(63号),TE(52号)元素原子的核外电子排布式
(2)若原子核外出现5g和6h亚层,请预测第九,十周期最后一种元素的原子序数和它们的电子排布,写出他们的核外电子的排布式
是用核外电子排布式:如 ____11NA 1S2 2S2 2P6 3S1 jennybaby19841年前3
jennybaby19841年前3 -
 傍晚田野 共回答了22个问题
傍晚田野 共回答了22个问题 |采纳率86.4%(1)Eu:+63,2,8,18,25,18,2Te:+52,2,8,18,18,6(2)这两种原子肯定都是0族(稀有气体)第九周期0族元素原子核外电子排布:+218,2,8,18,32,50,50,32,18,8外围电子排布:9s2 9p6第十周期0族元素原子:核外电子排布...1年前查看全部
- 元素周期表中的第24和27号化学元素的原子结构示意图,轨道表示式和核外电子排布式怎么画?
 疯子帝hh1年前0
疯子帝hh1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- Cu2+核外电子排布式中,价电子排布为什么是3d9,而不是3d7 4s2,
Cu2+核外电子排布式中,价电子排布为什么是3d9,而不是3d7 4s2,
根据洪特规则,能量最低原则,不是应该先排能量较低的4s轨道吗? 8ll98481年前1
8ll98481年前1 -
 wohenkuaile 共回答了18个问题
wohenkuaile 共回答了18个问题 |采纳率88.9%失电子是从最外层开始的,和那个无关,记住,只是失电子1年前查看全部
- (2012•菏泽二模)(1)Fe2+在基态时,核外电子排布式为______.
(2012•菏泽二模)(1)Fe2+在基态时,核外电子排布式为______.
(2)羟胺(NH2OH)中采用sp3杂化的原子有______,羟胺熔沸点较高,是因为分子间存在较强的______.
(3)Fe2+与邻啡罗啉形成的配合物(形成过程如图1)中,配位数为______.
(4)铁能与氮形成一种磁性材料,其晶胞结构如图2,则该磁性材料的化学式为______.
 飘来飘去121年前1
飘来飘去121年前1 -
 粗野狂人 共回答了16个问题
粗野狂人 共回答了16个问题 |采纳率93.8%解题思路:(1)铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变成亚铁离子,根据构造原理写出亚铁离子核外电子排布式;
(2)根据价层电子对互斥理论确定羟胺NH2OH中存在sp3杂化的原子,存在氢键的物质熔沸点升高;
(3)配位数就是在配位个体中与一个形成体成键的配位原子的总数;
(4)利用均摊法确定其化学式.(1)铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变成亚铁离子,Fe2+在基态时,核外电子排布式为:[Ar]3d6,故答案为:[Ar]3d6;
(2)羟胺分子中,价层电子对为4的原子有N、O原子,所以采用sp3杂化的原子有N、O原子,羟胺存在氢键,导致羟胺的熔沸点较高,故答案为:N、O,氢键;
(3)配位数就是在配位个体中与一个形成体成键的配位原子的总数,所以Fe2+与邻啡罗啉形成的配合物(形成过程如图1)中,配位数为6,故答案为:6;
(4)铁原子个数=8×
1
8+6×
1
2=4,氮原子个数是1,所以其化学式为Fe4N,故答案为:Fe4N.点评:
本题考点: 原子核外电子排布;配合物的成键情况;晶胞的计算;原子轨道杂化方式及杂化类型判断.
考点点评: 本题涉及化学式的确定、配位数的判断、杂化方式的判断等知识点,这些都是考试热点,难点是配位数的确定,根据概念来确定即可,难度中等.1年前查看全部
- 3p亚层有一个空轨道的原子 和 核外电子排布式是 1S2 2S2 2P6 3S2 3P6 4S2
3p亚层有一个空轨道的原子 和 核外电子排布式是 1S2 2S2 2P6 3S2 3P6 4S2
的原子 是不是一定是同一个原子 li2005tiange1年前2
li2005tiange1年前2 -
 wiyi21 共回答了26个问题
wiyi21 共回答了26个问题 |采纳率96.2%不是.
3p亚层有一个空轨道的原子价电子应该是3S2 3P2 即第三周期第四主族的元素硅
核外电子排布式是 1S2 2S2 2P6 3S2 3P6 4S2
的原子是第四周期第二主族的元素钙1年前查看全部
- 核外电子排布式( 我承认我菜…… )为什么会有能级交错 我没准备看太懂然后就是N层32个的话 那4f排到哪 5p和5d之
核外电子排布式
( 我承认我菜…… )
为什么会有能级交错 我没准备看太懂
然后就是N层32个的话 那4f排到哪 5p和5d之间?
比如82号Pb = 2 8 18 32 18 4
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p2 (没改顺序凑合看吧)? 烈火中生存1年前1
烈火中生存1年前1 -
 江晓南 共回答了19个问题
江晓南 共回答了19个问题 |采纳率89.5%不用懂.要解的.
5d之前1年前查看全部
- 银离子和碘离子的核外电子排布式一楼的:是排布式,不是分布图。1s22s22p63s23p6...二楼的:是离子,不是原子
银离子和碘离子的核外电子排布式
一楼的:是排布式,不是分布图。1s22s22p63s23p6...
二楼的:是离子,不是原子。 拈花何必惹草1年前4
拈花何必惹草1年前4 -
 上升了 共回答了16个问题
上升了 共回答了16个问题 |采纳率87.5%离子那就是得/失电子了呗……
Ag:4d10 5s1——失一个电子,这个5s1失掉了,所以就是4d10(前面的价电子都一样,见2L)
I:4d10 5s2 5p5——得一个电子,变成I-,最外层是5p6,满了.1年前查看全部
- 1-36号元素核外电子排布式
 水韵irr1年前3
水韵irr1年前3 -
 Ida0325 共回答了16个问题
Ida0325 共回答了16个问题 |采纳率100%这个非常简单的,一般规律每层电子层最多容纳2n^2电子,如K层容纳2个电子,L层容纳8个电子等等.依照规律很容易写出来,以钾元素为离子,为19号元素,共有19个电子,电子层排布为2,8,8,1.1年前查看全部
- 在二维空间里,钠原子的核外电子排布式
在二维空间里,钠原子的核外电子排布式
这是一道自主招生的题.如果是三维空间是不是就要写出伸展方向? shabi2501年前2
shabi2501年前2 -
 望网-Albert 共回答了16个问题
望网-Albert 共回答了16个问题 |采纳率75%Na 2 8 1
就是在纸上写出这个,三维空间的就是要描述具体的轨道形状了1年前查看全部
- (16分)(Ⅰ)某元素的原子序数为33,写出该元素原子的核外电子排布式
(16分)(Ⅰ)某元素的原子序数为33,写出该元素原子的核外电子排布式 ,此元素的原子中被电子占据的轨道有 个,有 个能级(能量不同的轨道);
(Ⅱ)有五种元素A、B、C、D、E,A 2+ 的电子层结构为1S 2 2S 2 2P 6 3S 2 3P 6 3d 5 ,B原子的M层为最外层且有两个未成对电子,C原子的L电子层的P轨道上有一个空轨道,D原子的L电子层的P轨道上只有一对成对电子,E原子的M电子层的P轨道半充满。写出A---E各元素的符号:A 、B 、C 、D 、E 何其远1年前0
何其远1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 在元素周期表Kr 之前的某元素,当失去3个电子后l=2的轨道上恰好达到半充满,则该元素基态核外电子排布式为?该元素符号为
在元素周期表Kr 之前的某元素,当失去3个电子后l=2的轨道上恰好达到半充满,则该元素基态核外电子排布式为?该元素符号为?
 绝对ww关系1年前2
绝对ww关系1年前2 -
 chenming_ 共回答了29个问题
chenming_ 共回答了29个问题 |采纳率96.6%1s2 2s2 2p6 3s2 3p6 3d6 4s2,Fe.铁,l=2是d轨道,半充满是5个电子,Kr之前只有3d轨道,失去三个电子,反过来加上三个,2+2+6+2+6+5+3=26.所以是铁.1年前查看全部
- 铜离子的核外电子排布式怎么写?电子排布图怎么画?
铜离子的核外电子排布式怎么写?电子排布图怎么画?
基态原子和离子的电子排布式之间有什么规律没有? gf10971年前2
gf10971年前2 -
 荷露83 共回答了18个问题
荷露83 共回答了18个问题 |采纳率83.3%它的排布是1S2 2S2 2P6 3S2 3P6 3d9
核外电子排布:2,8,17
主要是看离子的价态,电子从最外层一个一个失去1年前查看全部
- 化学问题写出Na Ca两种元素的核外电子排布式和轨道表示式 配图
 八月的波斯菊1年前1
八月的波斯菊1年前1 -
 婴不宁 共回答了18个问题
婴不宁 共回答了18个问题 |采纳率83.3%1年前查看全部
- 原题:某原子的最外层电子数比次外层电子数少2个,该原子最外层电子数是K层的3倍,该原子的核外电子排布式为?
原题:某原子的最外层电子数比次外层电子数少2个,该原子最外层电子数是K层的3倍,该原子的核外电子排布式为?
按原题不是只能知道最外层电子数是6,K层是2,次外层是8么,为什么答案说这道题是硫而不是铬、锗等?
是不是和考纲只要求我们背1〜20有关啊? applone1年前7
applone1年前7 -
 孤独爱 共回答了27个问题
孤独爱 共回答了27个问题 |采纳率92.6%因为2+8+6=16,S的原子序数是161年前查看全部
- 常考的核外电子排布式有哪些?
 曦儿0001年前3
曦儿0001年前3 -
 livr_27 共回答了2个问题
livr_27 共回答了2个问题 |采纳率铜,铝,铁,氧,氮……记不起来了1年前查看全部
- 碳原子的sp杂化 sp2杂化的核外电子排布式是怎样的?
碳原子的sp杂化 sp2杂化的核外电子排布式是怎样的?
sp3是1s2 2s1 2px1 2py1 2pz1 也要这种格式
 xiongng1年前1
xiongng1年前1 -
 滨滨的和尚 共回答了17个问题
滨滨的和尚 共回答了17个问题 |采纳率100%C的sp杂化后 形成新的轨道 sp杂化是1s2 sp sp p(x) p(y)其中两个p的取向并不是确定的 所以括号里的两个取向任意的两个sp轨道中各有一个电子 p轨道中各有一个电子 sp2杂化是 1s2 sp sp sp p其中电子的个数和轨道的去向同上 希望对楼主有帮助如果有问题可以再问1年前查看全部
- 某元素的原子序数为16(1)写出该原子的核外电子排布式及其价层电子构型;(2)指出该元素在周期表中的位置(周期、族、分区
某元素的原子序数为16
(1)写出该原子的核外电子排布式及其价层电子构型;
(2)指出该元素在周期表中的位置(周期、族、分区),其最高氧化数?
(3)指出该元素的电子层、能级组、轨道各有多少个?价电子数为多少?
尽量清楚点 谢谢 环境与我1年前3
环境与我1年前3 -
 煞冰 共回答了19个问题
煞冰 共回答了19个问题 |采纳率94.7%1、核外电子排布:-2-8-6,是元素硫(元素S)
价层电子结构:3s2-3p4
2、位置:第三周期,第6主族,分区指的是什么?(非金属?)
最高价氧化物:三氧化硫,SO3
3、电子层:3层
能级组:3(一般为轨道数)
轨道:3
价电子数:6(最外层电子数)1年前查看全部
- XYZW是原子序数依次增大的短周期元素,且互不同族,其中只有一种为金属,X的核外电子排布式为nsn npn,
XYZW是原子序数依次增大的短周期元素,且互不同族,其中只有一种为金属,X的核外电子排布式为nsn npn,
Z的最外层电子数是其电子层数的2倍,Y原子与Z原子的最外层电子数之和为9,且Y和W单质都可与烧碱溶液反应,求XYZW是什么元素 donmike1年前1
donmike1年前1 -
 wcnijcbdhs 共回答了15个问题
wcnijcbdhs 共回答了15个问题 |采纳率100%Z很容易确定是S(不可能是C,否则Y不存在)
继而得Y为Al
X只能是2s2 2p2,所以是C
W在S之后且为短周期,还能与NaOH反应,只能是Cl1年前查看全部
- 我想问下如何求一个元素的核外电子排布式?比如铁是2 8 14 2 . 铜是2-8-18-1 ,这是怎么求出的?
 guanguang1年前2
guanguang1年前2 -
 1234大大 共回答了16个问题
1234大大 共回答了16个问题 |采纳率93.8%铁原子核外共有26个电子.它的电子排布式是1s2 2s2 2p6 3s2 3p6 3d6 4s2.核外有4个电子层,K层有2个电子,L层有8个电子,M层有14个电子,N层有2个电子.
铜原子核外共有29个电子.它的电子排布式是1S2 2S2 2P6 3S2 3P6 3d(10) 4s(1),即第三层轨道的亚层排到d亚层有10个电子,第四层轨道的亚层排到s亚层有1个电子,其他之前的亚层都满了,因而铜原子核外电子依次为2、8、18、1个.1年前查看全部
- (12分)(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的核外电子排布式
(12分)
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的核外电子排布式 。
(2)富勒烯衍生物由于具有良好的光电性能。富勒烯(C 60 )的结构如图1,分子中碳原子轨道的杂化类型为 ;1 mol C 60 分子中σ键的数目为 。科学家把C 60 和K掺杂在一起制造出的化合物具有超导性能,其晶胞如图2所示。该化合物中的K原子和C 60 分子的个数比为 。
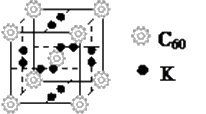
图1 图2
图2
(3)砷化镓是人工合成的新型半导体材料,其晶体结构与金刚石相似。
①GaAs晶体中,每个As与 个Ga相连。
②第一电离能:As Se(填“>”、“<”或“=”)。
(4)Na 3 AsO 4 可作杀虫剂。AsO 4 3- 的空间构型为 ,与其互为等电子体的一种分子为 。 mary蹄儿1年前1
mary蹄儿1年前1 -
 jiepi2000 共回答了17个问题
jiepi2000 共回答了17个问题 |采纳率76.5%(12分)
(1)[Ar]3d 8 4s 2 (2分)
(2)sp 2 (2分) 90mol(2分) 3:1(2分)
(3)①4 (1分) ②>(1分)
(4)正四面体形(1分) CCl 4 (1分)(或其他合理答案)
1年前查看全部
- 正3价锰离子核外电子排布式为什么是1s2 2s2 2p6 3s2 3p6 3d4而不是1s2 2s2 2p6 3s2 3
正3价锰离子核外电子排布式
为什么是1s2 2s2 2p6 3s2 3p6 3d4
而不是1s2 2s2 2p6 3s2 3p6 3d2 4s2?
按照能量最低原理不是应该先排4s层再排3d吗? 烟燃一怒1年前3
烟燃一怒1年前3 -
 ivy3001 共回答了17个问题
ivy3001 共回答了17个问题 |采纳率88.2%失去电子,和电子排布,是没有直接关系的.
先失去最外层的两个电子, 在吸引电子能力更强的时候,再失去次外层的一个电子1年前查看全部
- 氮是地球上极为丰富的元素。 (1)Li 3 N晶体中氮以N 3- 存在,基态N 3- 的核外电子排布式为 &
氮是地球上极为丰富的元素。

(1)Li 3 N晶体中氮以N 3- 存在,基态N 3- 的核外电子排布式为 。
(2)X + 中所有电子正好充满K、L、M三个电子层,它与N 3- 形成的晶体结构如图所示。X的元素符号是 ,与同一个N 3- 相连的X + 有 个。 feliciawu1年前1
feliciawu1年前1 -
 wjzt 共回答了19个问题
wjzt 共回答了19个问题 |采纳率84.2%(每空1分)(1) 1s 2 2s 2 2p 6 (2) Cu , 6
1年前查看全部
- 溴的核外电子排布式是什么
 FelicaFei1年前2
FelicaFei1年前2 -
 月点点 共回答了12个问题
月点点 共回答了12个问题 |采纳率91.7%电子排布2 8 18 7
核外电子排布式1S2 2S2 2p6 3S2 3p6 3d10 4S2 4p51年前查看全部
- 某元素的+2价离子的核外电子排布式为:1s22s22p63s23p6,则此元素在周期表中第______周期,第_____
某元素的+2价离子的核外电子排布式为:1s22s22p63s23p6,则此元素在周期表中第______周期,第______族,元素符号为 ______.
 muzilee11年前1
muzilee11年前1 -
 555123 共回答了12个问题
555123 共回答了12个问题 |采纳率100%数一下该离子的核外电子数:=2+8+8 = 18
所以,该元素的质子数:= 18 + 2 = 20
因此,该元素在第 4 周期,第 II 主族,元素符号为 Ca1年前查看全部
- 基态13Al的核外电子排布式为A.1s2 2s2 2p6 3s3 B.1s2 2s2 2p6 3s2 3p1C.1s2
基态13Al的核外电子排布式为
A.1s2 2s2 2p6 3s3
B.1s2 2s2 2p6 3s2 3p1
C.1s2 2s2 2p6 3s1 3p2
D.1s2 2s2 2p6 3p3 只爱ZJ1年前1
只爱ZJ1年前1 -
 88505 共回答了22个问题
88505 共回答了22个问题 |采纳率86.4%B.1s2 2s2 2p6 3s2 3p11年前查看全部
- 比如硫离子和硫原子的核外电子排布式,我知道硫原子的核外电子排布式是1S2 2S2 2P6 3S2 3P4,
比如硫离子和硫原子的核外电子排布式,我知道硫原子的核外电子排布式是1S2 2S2 2P6 3S2 3P4,
那么硫离子的核外电子排布式有什么区别吗? 我是猫也1年前2
我是猫也1年前2 -
 倩倩hao 共回答了17个问题
倩倩hao 共回答了17个问题 |采纳率82.4%只用把3P4改为3P6即可1年前查看全部
- 凡是单原子形成的离子,一定具有稀有气体元素原子的核外电子排布式?对还错?错的话请举反列!
 资深儿童1年前2
资深儿童1年前2 -
 蘅_7 共回答了17个问题
蘅_7 共回答了17个问题 |采纳率88.2%错,Fe2+电子排布为2/8/141年前查看全部
- 下列核外电子排布式表示的原子中,原子半径最大的是
下列核外电子排布式表示的原子中,原子半径最大的是
A 1S^2 2S^2 2P^6 3S^2 3P^4
B 1S^2 2S^2 2P^6 3S^2 3P^6 4S^2
C 1S^2 2S^2 2P^6 3S^2 3P^6 3D^10 4S^2 4P^3
D 1S^2 2S^2 2P^6 3S^2 3P^6 3D^10 4S^2 4P^5 我爱小凤凰1年前1
我爱小凤凰1年前1 -
 PSYUAN 共回答了16个问题
PSYUAN 共回答了16个问题 |采纳率75%A是S,B是Ca,C是As,D是Br
同主族元素从上到下原子半径依次增大
同周期元素从左到右原子半径依次减小
所以半径Ca〉As〉Se>S>Br
选择B1年前查看全部
- 元素周期表前30号元素的核外电子排布式
 S已仔细7阅读1年前2
S已仔细7阅读1年前2 -
 一定会19 共回答了17个问题
一定会19 共回答了17个问题 |采纳率94.1%钙以前是按原子序数分别按顺序填2,8,8,2,钙以后是2,8,8(+1——8)2,(1——n)1年前查看全部
- (1)元素的第一电离能Al Si(填“>”或“<”)。(2)基态Mn 2+ 的核外电子排布式为
(1)元素的第一电离能Al Si(填“>”或“<”)。(2)基态Mn 2+ 的核外电子排布式为(1)元素的第一电离能Al Si(填“>”或“<”)。
(2)基态Mn 2+ 的核外电子排布式为 。
(3)硅烷(Si n H 2n+2 )的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是 。
(4)硼砂是含结晶水的四硼酸钠,其阴离子X m- (含B、O、H三种元素)的球棍模型如图所示:
①在X m- 中,硼原子轨道的杂化类型有 ;配位键存在于 原子之间(填原子的数字标号);m= (填数字)。
②硼砂晶体由Na + 、X m- 和H 2 O构成,它们之间存在的作用力有 (填序号)。
A、离子键 B、共价键 C、金属键 D、范德华力 E、氢键
 柳承敏1年前1
柳承敏1年前1 -
 womendezuguo2008 共回答了16个问题
womendezuguo2008 共回答了16个问题 |采纳率93.8%(1)<
(2)1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 ([Ar]3d 5 )
(3)硅烷的相对分子质量越大,分子间作用力越强
(4)①sp 2 、sp 3 ;4、5(或5,4) ;2②ADE
(1)同一周期元素自左向右第一电离能有增大趋势,故第一电离能Al<Si
(2)Mn是25号元素,其电子排布式为1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 2 ,故Mn 2+ 的电子排布式为1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 。
(3)硅烷形成的晶体是分子晶体,相对分子质量越大,分子间作用力越强,沸点越高。
(4)①由球棍模型可以看出,黑球为B原子,灰球为O原子,小黑球为H原子。2号B原子形成3个键,采取sp 2 杂化,4号B原子形成4个键,采取sp 3 杂化;4号B原子三个sp 3 杂化轨道与除5号外三个O原子形成σ键后还有一个空轨道,而5号O原子能提供孤电子对而形成配位键;由图示可以看出该结构可以表示为[B 4 H 4 O 9 ] m - ,其中B为+3价,O为-2价,H为+1价,根据化合价可知m=2。
②在晶体中Na + 与X m+ 之间为离子键,H 2 O分子间存在范德华力,而该阴离子能与水分子形成氢键。1年前查看全部
- 关于化学的问题1.第46号元素钯的核外电子排布式是1s2 2s2p6 3s2p6d10 4s2p6d10,这么看,它最外
关于化学的问题
1.第46号元素钯的核外电子排布式是1s2 2s2p6 3s2p6d10 4s2p6d10,这么看,它最外层是18个电子,而它属第五周期,但从这来看,它只有4个电子层,或如果它有5个电子层,那它最外层0个电子?谁能解释一下.还有,原子的电子最外层最少有几个电子?
2.为什么离子最外层电子数可以超过8个,而原子不可以,而且像铁离子最外层有13个电子,它如何能稳定?
可否详细一些,而且问什么钯原子电子排布是怎么一回事? langmanba1年前2
langmanba1年前2 -
 13657379 共回答了21个问题
13657379 共回答了21个问题 |采纳率90.5%1最少1个
2那样的就是什么晶体结构什么的 就是共有的了1年前查看全部
- Mn原子的核外电子排布式为:1S2 2S2 2P6 3S2 3P6 3d5 4S2 Mn2+的核外电子排布式为什么为:
Mn原子的核外电子排布式为:1S2 2S2 2P6 3S2 3P6 3d5 4S2 Mn2+的核外电子排布式为什么为:
Mn原子的核外电子排布式为:1S2 2S2 2P6 3S2 3P6 3d5 4S2 Mn2+的核外电子排布式为什么为:1S2 2S2 2P6 3S2 3P6 3d5呢,电子能量排布不是先4S,后3d吗,在书写时才把3d写在前面吗,那失去电子应先失去3d上的电子呀 charles6671年前3
charles6671年前3 -
 o0淡然0o 共回答了17个问题
o0淡然0o 共回答了17个问题 |采纳率88.2%电子在排布的时候,是有能级交错的现象.但是失去电子一定是从最外层开始,也就是Mn必须从4s上失去.
为什麼?因为虽然3d能级高,但毕竟不是最外层,你可以想象一下,电子要从次外层克服最外层电子的斥力而失去,这该需要多大的能量.而最外层失去是不会受到斥力作用的,需要的能量低自然就比你失去3d电子方便快捷.1年前查看全部
大家在问
- 1it’s near the school.(改为否定句)
- 2As I soon learnt, he was English himself.这里的as是作的什么成分?
- 3某人驾驶一辆夏利牌小轿车从杭州驶向上海.先以36千米/小时的速度,从杭
- 4小明以同一个打点定时器测量小车拉动纸带甲、乙、丙、丁的运动速度,每次车子都是自右向左运动,四段纸带的长度都相同.打出的纸
- 5小学英语阅读理解题及答案20篇我要小学英语阅读理解20篇,有答案的加30分,没答案的什么都不给,而且要20篇.
- 6二十年后的我500字 要深刻要写老师的1.20年后的我是一个养花专家,为了让花园的花开得灿烂、娇艳,我尽心尽力,费尽心机
- 7Spellit,please意思是什么?
- 81.一个圆柱形游泳池,水池内壁和底面都要贴上瓷砖,水池底面直径8米,池深1.8米,贴瓷砖的面积是多少平方米?若每次放水时
- 9they'd like to ____ for about there months A.leave B.go C.co
- 10以下的英语句子有何不同?关于What happen……
- 11中华少年的主要内容内容简短一点
- 12在目前的中学生中,存在这样的消费现象:“吃喝向广告看齐;服装向名牌看齐;人情向父母看齐。”上述现象是 A.正确的,因为消
- 13一个圆柱形物体,高是4m,底面直径6m,表面积和体积格是多少?
- 14What is under your
- 15tan150度等于多少,怎么算?


