PM2.5(可入肺颗粒物)污染跟冬季燃煤密切相关,燃煤还同时排放大量的CO 2 、SO 2 和NO x
 jackylujie2022-10-04 11:39:541条回答
jackylujie2022-10-04 11:39:541条回答| PM2.5(可入肺颗粒物)污染跟冬季燃煤密切相关,燃煤还同时排放大量的CO 2 、SO 2 和NO x (1)最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO 2 从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。 ①已知在常温常压下: 2CH 3 OH(l)+3O 2 (g) = 2CO 2 (g)+4H 2 O(g) ∆H = -1275.6 kJ/mol 2CO(g)+O 2 (g)=2CO 2 (g)∆H = -566.0 kJ/mol H 2 O(g)=H 2 O(1) ∆H = -44.0 kJ/mol 则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________________。 ②以甲醇和氧气反应制成的燃料电池如图所示,该电池工作过程中O 2 应从______(填“c”或“b”)口通入,电池负极反应式为__________________。 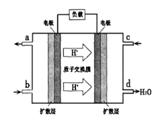 ③25℃时,将甲醇燃烧生成的足量CO 2 通入到浓度为0.lmol·L -1 ,NaOH溶液中,所得溶液的pH=8,溶液中离子浓度由大到小的顺序是_________________。 (2)已知在一定条件下,NO与NO 2 存在下列反应:NO(g)+NO 2 (g)=N 2 O 3 (g),ΔH<0若该反应在绝热、恒容的密闭体系中进行,下列示意图能说明t l 时刻达到平衡状态的是____________。 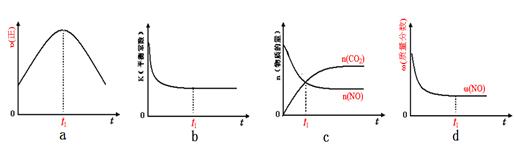 (3)在一个固定容积为5L的密闭容器中充入0.20molSO 2 和0.l0molO 2 ,半分钟后达到平衡,测得容器中含SO 3 0.18mol,则v(O 2 )=__________,若继续通入0.20mo1SO 2 和0.lmolO 2 ,则平衡____________移动(填“向正反应方向”、“向逆反应方向”或“不”)。 (4)在一定条件下,NO 2 可以被NH 3 还原为N 2 来消除NO 2 对环境造成的污染。25℃时,将NH 3 溶于水得l00mL 0.lmol·L - 的氨水,测得pH=11,则该条件下NH 3 ·H 2 O的电离平衡常数约为___________。 |

已提交,审核后显示!提交回复
共1条回复
 圈圈是我 共回答了19个问题
圈圈是我 共回答了19个问题 |采纳率84.2%- (16分)
(1) ①CH 3 OH(l)+O 2 (g)=CO(g)+2H 2 O(l) △H=-442.8kJ·mol -1 (2分);
②c (2分) CH 3 OH+ H 2 O-6e - =CO 2 ↑+6H + (2分);
③c(Na + )> c(HCO- 3)> c(OH - )> c(H + )> c(CO2- 3) (2分);
(2) bd (2分)
(3) 0.036mol·L -1 ·min -1 或0.0006mol·L -1 ·s -1 (2分);向正反应方向(2分);
(4) 1.01×10 -5 (2分)
- 1年前
相关推荐
- 第二个空PM2.5(可入肺颗粒物)污染跟冬季燃煤密切相关,燃煤还同时排放大量的SO2和NOx.(3)500℃时,在催化剂
第二个空
PM2.5(可入肺颗粒物)污染跟冬季燃煤密切相关,燃煤还同时排放大量的SO2和NOx.(3)500℃时,在催化剂存在条件下,分别将2 mol SO2和lmol O2置于恒压容器I和恒容容器Ⅱ中(两容器起始容积相同),充分反应,二者均达到平衡后:①两容器中SO3的体积分数关系是I ________Ⅱ(填">"," winy2121年前1
winy2121年前1 -
 轮回之间 共回答了19个问题
轮回之间 共回答了19个问题 |采纳率94.7%2SO2+O2﹤=﹥2SO3
开始 2mol 1mol 0
转化 2x x 2x
平衡2mol-2x 1mol-x 2x
根据压强之比等于物质的量之比得:
(2mol-2x+1mol-x+2x)/(2mol+1mol)=(1-30%)
x=0.9mol
SO2的转化率=2*0.9mol/2mol*100%=90%
分析:平衡时容器Ⅱ中的压强减小了30%,说明气体的物质的量就减少30%,则平衡是气体的物质的量就应是原混合气体的物质的量1-30%.
希望我的回答能对你的学习有帮助!1年前查看全部
- (2014•潍坊模拟)空气质量指数PM2.5(单位:μg/m3)表示每立方米空气中可入肺颗粒物的含量,这个值越高,代表空
 (2014•潍坊模拟)空气质量指数PM2.5(单位:μg/m3)表示每立方米空气中可入肺颗粒物的含量,这个值越高,代表空气污染越严重.PM2.5的浓度与空气质量类别的关系如下表所示:
(2014•潍坊模拟)空气质量指数PM2.5(单位:μg/m3)表示每立方米空气中可入肺颗粒物的含量,这个值越高,代表空气污染越严重.PM2.5的浓度与空气质量类别的关系如下表所示:
从甲城市2013年9月份的30天中随机抽取15天的PM2.5日均浓度指数数据茎叶图如图所示.PM2.5日均浓度 0~35 35~75 75~115 115~150 150~250 >250 空气质量类别 优 良 轻度污染 中度污染 重度污染 严重污染
(1)试估计甲城市在2013年9月份30天的空气质量类别为优或良的天数;
(2)在甲城市这15个监测数据中任取2个,设X为空气质量类别为优或良的天数,求X的分布列及数学期望. 任舞1年前1
任舞1年前1 -
 落堇下世 共回答了15个问题
落堇下世 共回答了15个问题 |采纳率80%解题思路:(1)由茎叶图求出甲城市在2013年9月份随机抽取的15天中的空气质量类别为优或良的天数,由此能估计甲城市在2013年9月份30天的空气质量类别为优或良的天数.
(2)由题意知X的取值为0,1,2,分别求出相对应的概率,从而能求出X的分布列及数学期望.(1)由茎叶图知:甲城市在2013年9月份随机抽取的15天中的空气质量类别为优或良的天数为5天.…(1分)
所以可估计甲城市在2013年9月份30天的空气质量类别为优或良的天数为10天.…(2分)
(2)由题意知X的取值为0,1,2,…(3分)
因为P(X=0)=
C05
C210
C215=
3
7,…(5分)
P(X=1)=
C15
C110
C215=
10
21,…(7分)
P(X=2)=
C25
C010
C215=
2
21.…(9分)
所以X的分布列为:
X 0 1 2
P [3/7] [10/21] [2/21]所以数学期望EX=0×[3/7]+1×[10/21]+2×[2/21]=[2/3].…(12分)点评:
本题考点: 离散型随机变量的期望与方差;茎叶图.
考点点评: 本题考查茎叶图的应用,考查离散型随机变量的分布列和数学期望的求法,是历年高考的必考题型,是中档题.1年前查看全部
- (2014•山东模拟)空气质量指数PM2.5(单位:μg/m3)表示每立方米空气中可入肺颗粒物的含量,这个值越高,解代表
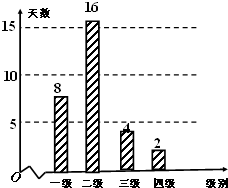 (2014•山东模拟)空气质量指数PM2.5(单位:μg/m3)表示每立方米空气中可入肺颗粒物的含量,这个值越高,解代表空气污染越严重:
(2014•山东模拟)空气质量指数PM2.5(单位:μg/m3)表示每立方米空气中可入肺颗粒物的含量,这个值越高,解代表空气污染越严重:
某市2012年3月8日-4月7日(30天)对空气质量指数PM2.5进行检测,获得数据后整理得到如图条形图:PM2.5日均浓度 0~35 35~75 75~115 115~150 150~250 >250 空气质量级别 一级 二级 三级 四级 五级 六级 空气质量类别 优 良 轻度污染 中度污染 重度污染 严重污染
(1)估计该城市一个月内空气质量类别为良的概率;
(2)从空气质量级别为三级和四级的数据中任取2个,求至少有一天空气质量类别为中度污染的概率. ssfei1年前1
ssfei1年前1 -
 feiash 共回答了30个问题
feiash 共回答了30个问题 |采纳率86.7%解题思路:(1)由条形统计图可知,空气质量类别为良的天数为16天,从而可求此次监测结果中空气质量类别为良的概率;
(2)样本中空气质量级别为三级的有4天,设其编号为a,b,c,d.样本中空气质量级别为四级的有2天,设其编号为e,f.列举出基本事件及符合条件的事件,根据概率公式求出相应的概率即可.(1)由条形统计图可知,空气质量类别为良的天数为16天,
所以此次监测结果中空气质量类别为良的概率为[16/30=
8
15].…(4分)
(2)样本中空气质量级别为三级的有4天,设其编号为a,b,c,d.
样本中空气质量级别为四级的有2天,设其编号为e,f.则基本事件有:
(a,b),(a,c),(a,d),(a,e),(a,f),(b,c),
(b,d),(b,e),(b,f),(c,d),(c,e),(c,f),
(d,e),(d,f),(e,f),共15个.
其中至少有一天空气质量类别为中度污染的有9个,
∴至少有一天空气质量类别为中度污染的概率为[9/15=
3
5].点评:
本题考点: 列举法计算基本事件数及事件发生的概率;分布的意义和作用.
考点点评: 本题考查条形图,考查学生的阅读能力,考查列举法计算基本事件数及事件发生的概率,属于基础题.1年前查看全部
- (2014•浙江模拟)PM2.5(可入肺颗粒物)污染跟工业燃煤密切相关,燃煤还同时排放大量的SO2和NOX.旋转喷雾干燥
(2014•浙江模拟)PM2.5(可入肺颗粒物)污染跟工业燃煤密切相关,燃煤还同时排放大量的SO2和NOX.旋转喷雾干燥法是去除燃煤烟气中二氧化硫的方法之一,工艺流程如下图所示:
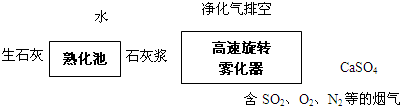
(1)写出高速旋转雾化器中发生反应的化学方程式______.
(2)在一定条件下,SO2可被氧气氧化,每生成8g SO3气体,放出9.83kJ的热量.写出该反应的s热化学方程式______.
(3)500℃时,在催化剂存在条件下,分别将2mol SO2和1mol O2置于恒压容器I和恒容容器Ⅱ中(两容器起始容积相同),充分反应,二者均达到平衡后:
①两容器中SO3的体积分数关系是I______Ⅱ(填“>”、“<”或“=”).若测得容器Ⅱ中的压强减小了30%,则该容器中SO2的转化率为______.
②t1时刻分别向两容器的平衡体系中加入2mol SO3,则两容器中SO3的体积分数随时间变化曲线图正确的是______(填序号).
(4)NOx可用强碱溶液吸收产生硝酸盐.在酸性条件下,FeSO4溶液能将NO3-还原为NO,NO能与多余的FeSO4溶液作用生成棕色物质,这是检验NO3-的特征反应.写出该过程中产生NO反应的离子方程式______. 温柔uu儿1年前1
温柔uu儿1年前1 -
 我爱朱点点 共回答了23个问题
我爱朱点点 共回答了23个问题 |采纳率95.7%(1)高速旋转雾化器中涉及反应为二氧化硫、氧气和氢氧化钙反应生成硫酸钙,反应的方程式为2SO2+2Ca(OH)2+O2=2CaSO4+2H2O,
故答案为:2SO2+2Ca(OH)2+O2=2CaSO4+2H2O;
(2)在一定条件下,SO2可被氧气氧化,每生成8g 即0.1molSO3气体,放出9.83kJ的热量,则生成2molSO3气体放出的热量为196.6kJ,则反应的热化学方程式为:2SO2(g)+O2(g)⇌2SO3(g);△H=-196.6kJ/molKJ•mol-1;
故答案为:2SO2(g)+O2(g)=2SO3(g)△=-196.6kJ/mol;
(3)①对于反应:2SO2(g)+O2(g)⇌2SO3(g),恒容容器相当于恒压容器的基础上加大压强,化学平衡正向移动,SO3的体积分数增大,所以Ⅰ>Ⅱ;将2mol SO2和1mol O2置于恒容容器II中,设容器中SO2的变化量为x,
2SO2(g)+O2(g)⇌2SO3(g)
初始量:2 1 0
变化量:x 0.5x x
平衡量:2-x 1-0.5x x
容器II中的压强减小了30%,即[3/2−x+1−0.5x+x]=[1/1−30%],解得x=1.8mol,
所以二氧化硫的转化率=[1.8mol/2mol]×100%=90%,
故答案为:>;90%;
②恒压容器I和恒容容器Ⅱ中,分别向两容器的平衡体系中加入2mol SO3,平衡逆向进行,气体的物质的量增大,恒压容器I的体积增大,恒容容器Ⅱ的体积不变压强增大,则容器Ⅱ的反应速率快达到平衡所用时间短,压强大平衡向生成SO3向进行,则容器Ⅱ中SO3含量高,所以图A符合,
故答案为:A;
(4)酸性条件下,亚铁离子和硝酸根离子反应生成铁离子、一氧化氮和水,离子反应方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,
故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.1年前查看全部
- (2014•茂名一模)空气质量指数PM2.5(单位:μg/m3)表示每立方米空气中可入肺颗粒物的含量,这个值越高,就代表
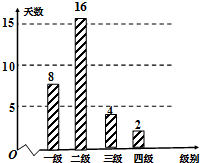 (2014•茂名一模)空气质量指数PM2.5(单位:μg/m3)表示每立方米空气中可入肺颗粒物的含量,这个值越高,就代表空气污染越严重:
(2014•茂名一模)空气质量指数PM2.5(单位:μg/m3)表示每立方米空气中可入肺颗粒物的含量,这个值越高,就代表空气污染越严重:
某市2013年12月1日-12月30日(30天)对空气质量指数PM2.5进行监测,获得数据后得到如图条形图.PM2.5日均浓度 0~35 35~75 75~115 115~150 150~250 >250 空气质量级别 一级 二级 三级 四级 五级 六级 空气质量类别 优 良 轻度污染 中度污染 重度污染 严重污染
(1)估计该城市一个月内空气质量类别为优的概率;
(2)从空气质量级别为三级和四级的数据中任取2个,求恰好有一天空气质量类别为中度污染的概率. 小到中雨1年前1
小到中雨1年前1 -
 wuxiaorong1818 共回答了13个问题
wuxiaorong1818 共回答了13个问题 |采纳率100%解题思路:(1)由条形统计图可知,空气质量类别为优的天数为8天,从而可求此次监测结果中空气质量类别为良的概率;
(2)样本中空气质量级别为三级的有4天,设其编号为a1,a2,a3,a4;样本中空气质量级别为四级的有2天,设其编号为b1,b2.列举出基本事件及符合条件的事件,根据概率公式求出相应的概率即可.(1)由条形统计图可知,空气质量类别为优的天数为8天,
所以此次监测结果中空气质量类别为优的概率为[8/30=
4
15].
(2)样本中空气质量级别为三级的有4天,
设其编号为a1,a2,a3,a4;
样本中空气质量级别为四级的有2天,
设其编号为b1,b2.
则基本事件有:(a1,a2),(a1,a3),(a1,a4),(a1,b1),(a1,b2);
(a2,a3),(a2,a4),(a2,b1),(a2,b2);
(a3,a4),(a3,b1),(a3,b2);
(a4,b1),(a4,b2);
(b1,b2).共15个.
其中恰好有1天空气质量类别为中度污染的情况为:
(a1,b1),(a1,b2),(a2,b1),(a2,b2),(a3,b1),(a3,b2),(a4,b1),(a4,b2)共8个.
所以恰好有1天空气质量类别为中度污染的概率为[8/15].点评:
本题考点: 古典概型及其概率计算公式;频率分布直方图.
考点点评: 本题考查条形图,考查学生的阅读能力,考查列举法计算基本事件数及事件发生的概率,属于基础题.1年前查看全部
- 近期,雾霾天气频频发生,PM2.5(可入肺颗粒物)与PM10(可吸入颗料物)这两个此前不被人熟知的词最近一直被许多人提及
近期,雾霾天气频频发生,PM2.5(可入肺颗粒物)与PM10(可吸入颗料物)这两个此前不被人熟知的词最近一直被许多人提及,环境保护越来越受到人们的关注。作为一名青少年,我们如何尽可能自己的微薄之力来保护环境,请以学生会的名义发出一个倡议。
要点;
1、环保受到人们更多的关注;
2、环境的现状;
3、应采取的措施。
提示:雾霾天气:Dust-haze weather
注意:词数120词左右(格式已给出,不计入总词数)。
My fellow students,
The Students’Union liu9502141年前1
liu9502141年前1 -
 雪莲守护者 共回答了19个问题
雪莲守护者 共回答了19个问题 |采纳率94.7%不唯一
One possible version:
Recently , the Dust-haze weather hit the north of China over and over again, which had a great effect on people’s life and health. As a result, people are becoming more and more concerned about our environment. As we all know, it’s the development of industry and heavy traffic jams that have caused air pollution. So as a teenager, I think we should take some measures to protect our environment.
On one hand, we’d better launch a campaign to raise people’s awareness of environmental protection. Also we can hold a speech contest about protecting environment to stress the importance of living a low- carbon life. On the other hand, do what we can to influence people around us to go to work or school on foot or by bike. As far as I’m concerned, every small step we take really counts. So please remember: together, individuals can make a difference.
1年前查看全部
- (2l1l•江东区模拟)“PM2.p”指数是空气c可入肺颗粒物的含量,是空气质量的指标之2.下表为A市1-12月“PM2
(2l1l•江东区模拟)“PM2.p”指数是空气c可入肺颗粒物的含量,是空气质量的指标之2.下表为A市1-12月“PM2.p月平均指数”(单位:微克/立方米)
(1)求这126月“PM2.p月平均指数”的众数、c位数、平均数;PM2.p指数 2l ll 4l 41 4l pl 月数 2 4 l 1 1 1
(2)根据《环境空气质量标准》,宜居城市的标准之2是“PM2.p年平均指数少于lp微克/立方米”,请你判断A市是否为宜居城市? 赤臂大战1年前1
赤臂大战1年前1 -
 lihaitie 共回答了27个问题
lihaitie 共回答了27个问题 |采纳率92.6%解题思路:(1)利用众数、中位数及平均数的定义进行计算即可;
(2)求出平均数,与标准比对即可得出答案.(1)将数据从小到大排列为:2左,2左,3左,3左,3左,3左,地左,地左,地左,地1,地3,地3,5左,
众数是3左,中位数是地左,平均数=[1/12]×(2左×2+3左×地+地左×3+地1+地3+5左)=3地.5微克/立方米.
(2)∵P32.5年平均值小于35微克/立方米,
∴A城市宜居.点评:
本题考点: 众数;统计表;加权平均数.
考点点评: 本题考查了众数、中位数及平均数的知识,掌握各部分的定义是关键,中位数是将一组数据从小到大(或从大到小)重新排列后,最中间的那个数(最中间两个数的平均数),叫做这组数据的中位数,如果中位数的概念掌握得不好,不把数据按要求重新排列,就会出错.1年前查看全部
- 燃煤能排放大量的CO2、SO2和NOX,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关.SO2、CO、CO2、NOx
燃煤能排放大量的CO2、SO2和NOX,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关.SO2、CO、CO2、NOx是对环境影响较大的种气体,对它们的合理控制和治理是优化我们生存环境的有效途径.
(1)利用电化学原理将SO2、NO2化为重要化工原料,装置如图1所示: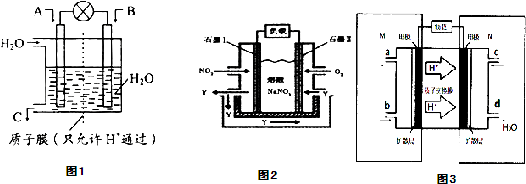
①若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为:______
②以NO2、O2、熔融NaNO3组成的燃料电池装置如图2所示,在使用过程中石墨I电极反应生成一种氧化物Y,有关电极反应可表示为______.
(2)有一种用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-a kJ•mol-1;
CH3OH(g)=CH3OH(l)△H=-b kJ•mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-c kJ•mol-1;
H2O(g)=H2O(l)△H=-d kJ•mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:CH3OH(l)+[3/2]O2(g)═CO2(g)+2H2O(l)△H=-([3/2]c+2d-a-b)kJ•mol-1CH3OH(l)+[3/2]O2(g)═CO2(g)+2H2O(l)△H=-([3/2]c+2d-a-b)kJ•mol-1.
(3)甲醇燃料电池原理如图3所示.
用上述电池做电源,用图4装置电解饱和食盐水(电极均为惰性电极),假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______(忽略溶液体积变化).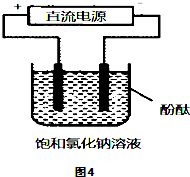
(4)500℃时,在催化剂存在条件下,分别将2mol SO2和1mol O2置于恒压容器I和恒容容器II中(两容器起始容积相同),充分反应,二者均达到平衡后:两容器中SO3的体积分数关系是I______Ⅱ(填“>”、“<”或“=”).若测得容器II中的压强减小了30%,则该容器中SO2的转化率为______.
(5)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)⇌N2(g)+CO2 (g)△H.某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
①T1℃时,该反应的平衡常数K=______(保留两位小数).
浓度/mol•L-1
时间/minNO N2 CO2 0 0.100 0 0 10 0.058 0.021 0.021 20 0.040 0.030 0.030 30 0.040 0.030 0.030 40 0.032 0.034 0.017 50 0.032 0.034 0.017
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是______. kgbgentleman1年前1
kgbgentleman1年前1 -
 a5459656z 共回答了18个问题
a5459656z 共回答了18个问题 |采纳率83.3%解题思路:(1)①SO2在负极失去电子转化为SO42-,根据电极反应式的书写方法来回答;
②燃料电池的负极上发生燃料失去电子的氧化反应;
(2)燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量,根据盖斯定律机孙化学反应的焓变;
(3)整个电路中转移电子的数目相等,可以根据电子转移的数目相同来列出已知物质和未知物质之间关系式,然后通过关系来求解;
(4)根据压强对化学平衡移动的影响知识来回答,反应体系中,压强之比等于物质的量之比,根据三行式计算转化率;
(5)①当20-30min时,各物质的物质的量不变,则该反应达到平衡状态,根据K=
计算;c(CO2)•c(N2) c2(NO)
②根据表中数值知,NO、二氧化碳的浓度减小,氮气的浓度增大,说明改变条件是分离出二氧化碳物质.(1)SO2在负极失去电子转化为SO42-,故其电极反应为:SO2+2H2O-2e-=SO42-+4H+,
故答案为:SO2+2H2O-2e-=SO42-+4H+;
②燃料电池的负极上发生燃料失去电子的氧化反应,即NO2+NO3--e-=N2O5,故答案为:NO2+NO3--e-=N2O5;
(2)甲醇的燃烧热是1mol可燃物甲醇完全燃烧生成稳定氧化物二氧化碳和水蒸气时放出的热量,
已知:①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-a kJ•mol-1;
②CH3OH(g)=CH3OH(l)△H=-b kJ•mol-1;
③2H2(g)+O2(g)=2H2O(g)△H=-c kJ•mol-1;
④H2O(g)=H2O(l)△H=-d kJ•mol-1,
根据盖斯定律,反应CH3OH(l)+[3/2]O2(g)═CO2(g)+2H2O(l)可以是a+b-[3/2]c-2d得到的,所以CH3OH(l)+[3/2]O2(g)═CO2(g)+2H2O(l)△H=-([3/2]c+2d-a-b)kJ•mol-1,故答案为:CH3OH(l)+[3/2]O2(g)═CO2(g)+2H2O(l)△H=-([3/2]c+2d-a-b)kJ•mol-1;
(3)用惰性电极,电解饱和食盐水总的电极反应式为2Cl-+2H2O
通电
.
H2↑+Cl2↑+2OH-,pH值变为13时,pOH=1,C(OH-)=10-1mol/L,n(OH-)=10-1mol/L×300mL×10-3L/mL=0.03mol,由方程式CH3OH-6e-+H2O=CO2+6H+,2Cl-+2H2O
通电
.
H2↑+Cl2↑+2OH-
可知 CH3OH~6e-~6OH-
32g 6mol
m(CH3OH)0.03mol
则m(CH3OH)=32g×0.03mol×[1/6]mol=0.16g,故答案为:0.16g;
(4)对于反应:2SO2(g)+O2(g)⇌2SO3(g),恒容容器相当于恒压容器的基础上加大压强,化学平衡正向移动,SO3的体积分数增大,所以Ⅰ>Ⅱ,将2mol SO2和1mol O2置于恒容容器II中,设容器中SO2的变化量为x,
2SO2(g)+O2(g)⇌2SO3(g)
初始量:2 1 0
变化量:x 0.5x x
平衡量:2-x1-0.5x x
容器II中的压强减小了30%,即[3/2−x+1−0.5x+x]=[1/1−30%],解得x=1.8mol,所以二氧化硫的转化率=[1.8mol/2mol]×100%=90%,故答案为:>;90%;
(5)①当20-30min时,各物质的物质的量不变,则该反应达到平衡状态,K=
c(CO2)•c(N2)
c2(NO)=
0.03×0.03
0.042点评:
本题考点: 化学电源新型电池;热化学方程式;化学平衡建立的过程;化学平衡的计算.
考点点评: 本题考查了化学平衡常数、化学平衡移动的影响因素、原电池等,侧重考查学生对数据的分析处理,题目综合性强,难度大.1年前查看全部
- (2013•济宁二模)PM2.5(可入肺颗粒物)污染跟冬季燃煤密切相关,燃煤还同时排放大量的Cq、Sq和Noxo
(2013•济宁二模)PM2.5(可入肺颗粒物)污染跟冬季燃煤密切相关,燃煤还同时排放大量的Cq、Sq和Noxo
(1)最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇.
①已知在常温常压下:
2CH3OH(1)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
H2O(g)═H2O(l)△H=-44.0kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为______.
②以甲醇和氧气反应制成的燃料电池如图1所示,该电池工作过程中O2应从______(填“c”或“b”)口通入,电池负极反应式为______.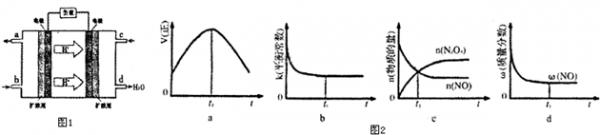
③25℃时,将甲醇燃烧生成的足量CO2通入到浓度为0.1mol•L-1 NaOH溶液中,所得溶液的pH=8,溶液中离子浓度由大到小的顺序是______.
(2)已知在一定条件下,NO与NO2存在下列反应:NO(g)+NO2(g)═N2O3(g),△H<0若该反应在绝热、恒容的密闭体系中进行,图2示意图能说明tl时刻达到平衡状态的是______.
(3)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10mol O2,半分钟后达到平衡,测得容器中含SO3 0.18mol,则v(O2)=______,若继续通入0.20mol SO2和0.1mol O2,则平衡______移动(填“向正反应方向”、“向逆反应方向”或“不”).
(4)在一定条件下,NO2可以被NH3还原为N2来消除NO2对环境造成的污染.25℃时,将NH3溶于水得100mL 0.1mol•L-1的氨水,测得pH=11,则该条件下NH3•H2O的电离平衡常数约为______. zx0312zx1年前1
zx0312zx1年前1 -
 any664 共回答了16个问题
any664 共回答了16个问题 |采纳率81.3%解题思路:(1)①依据热化学方程式和 盖斯定律计算所需热化学方程式;
②依据原电池图示可知氢离子移向电极为正极,氧气应从正极通入,负极是甲醇燃料失电子在酸性环境中生成二氧化碳;
③将甲醇燃烧生成的足量CO2通入到浓度为0.1mol•L-1 NaOH溶液中,所得溶液的pH=8,判断市场的是碳酸氢钠溶液,依据碳酸氢钠溶液中离子浓度大小分析比较;
(2)可逆反应达到平衡状态,一定满足正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行判断;当反应前后改变的物理量不变时,该可逆反应达到平衡状态;
(3)化学反应速率的定义求出氧气的速率;根据影响化学平衡的因素来判断平衡移动方向;
(4)根据氨水电离生成等量的铵根离子和氢氧根离子,求出平衡时各离子的浓度,在利用电离度、电离平衡常数的公式求解;(1)①a、2CH3OH(1)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
b、2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
c、H2O(g)═H2O(l)△H=-44.0kJ/mol
依据盖斯定律计算a-b+c×4得到甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8KJ/mol;
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8KJ/mol;
②依据原电池图示可知氢离子移向电极为正极,氧气应从正极通入,c口是氧气通入的一端,负极是甲醇燃料失电子在酸性环境中生成二氧化碳,电极反应为:CH3OH-6e-+H2O=CO2+6H+;
故答案为:c,CH3OH-6e-+H2O=CO2+6H+;
③25℃时,将甲醇燃烧生成的足量CO2通入到浓度为0.1mol•L-1 NaOH溶液中,所得溶液的pH=8,判断溶液在为碳酸氢钠,碳酸氢根离子水解溶液呈碱性,溶液中离子浓度由大到小的顺序是:c(Na+)>C(HCO3-)>c(OH-)>c(H+)>c(CO32-);
故答案为:c(Na+)>C(HCO3-)>c(OH-)>c(H+)>c(CO32-);
(2)NO(g)+NO2(g)═N2O3(g),△H<0,若该反应在绝热、恒容的密闭体系中进行,是气体体积减小的放热反应;
a、t1时正反应速率仍然在变化,说明没有达到平衡状态,故a错误;
b、t1时平衡常数不再变化,正逆反应速率相等,说明达到了平衡状态,故b正确;
c、t1时三氧化二氮和一氧化氮的物质的量还在变化,说明正逆反应速率不相等,反应没有达到平衡状态,故c错误;
d、t1时一氧化氮的质量分数不再变化,表明正逆反应速率相等,达到了平衡状态,故d正确;
故选bd;
(3)当生成0.18molSO3时,参加反应的氧气的物质的量为x,
2SO2+O2⇌2SO3
1 2
x 0.18mol
x=0.09mol
v(O2)=
0.09mol
5L
0.5min=0.036mol.L-1•min-1;
继续通入0.20mol SO2和0.10mol O2,容器内压强增大,平衡向气体体积减小的方向移动,即向正反应方向移动;
故答案为:0.036mol.L-1•min-1;向正反应方向移动;
(4)氨水溶液pH=11,则C(H+)═10-11 mol•L-1,C(0H-)═10-3mol•L-1,
NH3•H2O⇌NH4++OH-
起始(mol•L-1) 0.1 0 0
反应(mol•L-1) 10-3 10-3 10-3
平衡(mol•L-1) 0.1-10-310-3 10-3
所以NH3•H2O的电离平衡常数为Kb=
10−3×10−3
0.1−10−3=1.01×10-5mol•L-1;
故答案为:1.01×10-5mol•L-1;点评:
本题考点: 热化学方程式;化学电源新型电池;化学平衡常数的含义;化学平衡的影响因素;化学平衡状态的判断;离子浓度大小的比较.
考点点评: 本题考查了热化学方程式和盖斯定律计算应用,原电池原理和电极反应书写,化学平衡状态判断,反应速率计算,注意弱电解质电离平衡常数的计算应用,掌握基础是关键,题目难度中等.1年前查看全部
- PM2.5(可入肺颗粒物)污染跟冬季燃煤密切相关,燃煤还同时排放大量的SO2和NOx.旋转喷雾干燥法是去除燃煤烟气中二氧
PM2.5(可入肺颗粒物)污染跟冬季燃煤密切相关,燃煤还同时排放大量的SO2和NOx.旋转喷雾干燥法是去除燃煤烟气中二氧化硫的方法之一,工艺流程如下图所示:
(1)写出高速旋转雾化器中发生反应的化学方程式:______________.
(2)在一定条件下,SO2气体可被氧气氧化,每生成8 g SO3气体,放出9.83 kJ的热量.写出该反应的热化学方程式 _____________.
(3)500℃时,在催化剂存在条件下,分别将2 mol SO2和lmol O2置于恒压容器I和恒容容器Ⅱ中(两容器起始容积相同),充分反应,二者均达到平衡后:
①两容器中SO3的体积分数关系是I ________Ⅱ(填“>”、“ lihao198707111年前1
lihao198707111年前1 -
 xiaozi1216 共回答了14个问题
xiaozi1216 共回答了14个问题 |采纳率85.7%(1)应该是Ca(OH)2+so2==caso3+h2o 2caso3+o2==caso4
(2)2so2(g)+o2(g)==2so3(g) ΔH=-196.6KJ/mol 8g so3为0.1mol 即1molso3 放出98.3kj 方程式so3前系数为2,所以x2得196.6kj/mol 发热,ΔH1年前查看全部
- 下图为北方某城市的PM2.5(指环境空气中直径小于等于 2.5 微米的颗粒物,也称细颗粒物或可入肺颗粒物)月平均浓度统计
下图为北方某城市的PM2.5(指环境空气中直径小于等于 2.5 微米的颗粒物,也称细颗粒物或可入肺颗粒物)月平均浓度统计图。读图回答各小题。

小题1:该城市夏季PM2.5浓度较低的形成原因不包括
小题2:下列关于PM2.5过高对大气环境的影响说法正确的有A.夏季降水丰富,空气湿润 B.植被更加茂密,滞尘作用大 C.大气运动强烈,污染物易扩散 D.工矿企业排污少
①利于水汽凝结②削弱太阳辐射,温差加大③污染大气
④降低能见度⑤导致酸雨增多A.①②④ B.①③④ C.②③⑤ D.③④⑤  bianyinlan1年前1
bianyinlan1年前1 -
 oofan 共回答了25个问题
oofan 共回答了25个问题 |采纳率76%小题1:D
小题2:B
1年前查看全部
大家在问
- 1(-2)3 X 0.5 — (-1.6)2 ÷ (-2)2 ;
- 2英语翻译All types of ants live in very large groups.They usually
- 3故乡中希望本是无所谓有,.也便成了路的赏析
- 4求“硝酸的性质”笔记,要求物理性质,化学方程式注意点.
- 5愚公移山一文中的“增不若孀妻弱子”与前文中那一句相呼应
- 6二元函数的极值
- 7mistake-correcting exercises是什么意思?
- 815克盐放入135克水中,放置一段时间后,盐水重量变为120克,这时盐水的浓度是多少?浓度比原来提高了百分之几?
- 91.将一把刻度均匀的刻度尺插入盛有水的玻璃杯中,从杯口向下看尺在水中的部分,尺的粗细和刻度的疏密情况变化是_,产生这种变
- 10以下的数字包括加,减,等于都是由火柴组成的.任意的移动两根火柴使其成为一道正确的算术题:7-11=4
- 11正方形ABCD,E是AB上的一点,F是BC上的一点,则EDF=45度,过D作DP垂直于EF于P,求证AB=DP
- 12书是面包——( ) 书是源泉——( ) 书是益友——( ) 书是良药——( )26063
- 13如图所示,已知铁棍AB的下端B点与其正下方的P点相距h=0.8m,某时刻,剪断A端细绳,铁棍开始自由下落,其通过P点的时
- 14已知方程2x²+(k-9)x+(k²+3k+4)有两个相等的实数根,求k值,并求出方程的解.
- 15锻打矛头/装饰花件用英语怎么写?
