高铁电池反应:放电3Zn+2K2FeO4+8H2O======3Zn(OH)2+2Fe(OH)3+4KOH充电请把放电时
 来婷2022-10-04 11:39:541条回答
来婷2022-10-04 11:39:541条回答放电
3Zn+2K2FeO4+8H2O======3Zn(OH)2+2Fe(OH)3+4KOH
充电
请把放电时正负极的电极反应式写一下,

已提交,审核后显示!提交回复
共1条回复
 LL飞舟 共回答了17个问题
LL飞舟 共回答了17个问题 |采纳率88.2%- Zn+2OH(-)-2e---->Zn(OH)2
- 1年前
相关推荐
- 高铁酸钾(K2FeO4)可用于制造高铁电池,总反应式为:3Zn+2K2FeO4+8H2o==3Zn(OH)2+2Fe(O
高铁酸钾(K2FeO4)可用于制造高铁电池,总反应式为:3Zn+2K2FeO4+8H2o==3Zn(OH)2+2Fe(OH)3+4KOH 求该电池放电正极反应,
 fggfeh1年前2
fggfeh1年前2 -
 我系咖啡豆 共回答了20个问题
我系咖啡豆 共回答了20个问题 |采纳率95%2FeO4 2- + 6e- + 4H2O ==== 2Fe(OH)3 + 2OH-1年前查看全部
- 高铁电池是电动汽车首选的电池之一,该电池的工作原理为:3Zn+2K2FeO4+8H2O放电充电3Zn(OH)2+2Fe(
高铁电池是电动汽车首选的电池之一,该电池的工作原理为:3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH,下列关于该电池放电时的说法中正确的是( )放电 充电
A.高铁电池产生的电流从负极经外电路到达正极
B.正极反应式为Zn+2OH--2e-═Zn(OH)2
C.负极pH减小,正极pH增大,电解液pH增大
D.每氧化1mol高铁酸钾转移3mol电子 cvaoidfupaoisdu1年前1
cvaoidfupaoisdu1年前1 -
 k1ocs0fc 共回答了18个问题
k1ocs0fc 共回答了18个问题 |采纳率88.9%解题思路:根据电池反应式知,Zn元素化合价由0价变为+2价,所以Zn作负极,放电时,负极反应式为Zn+2OH--2e-═Zn(OH)2,正极反应式为FeO42-+4H2O+3e-=Fe(OH)3+5OH-,充电时阳极、阴极电极反应式与正负极电极反应式正好相反,放电时,电流方向与电子流动方向相反,据此分析解答.A.放电时,Zn作负极,高铁电池产生的电流从正极经外电路到达负极,故A错误;
B.正极上电极反应式为FeO42-+4H2O+3e-=Fe(OH)3+5OH-,故B错误;
C.负极反应式为Zn+2OH--2e-═Zn(OH)2,正极反应式为FeO42-+4H2O+3e-=Fe(OH)3+5OH-,所以负极pH减小、正极pH增大,根据电池反应式知,电解液pH增大,故C正确;
D.高铁酸钾中Fe元素化合价由+6价变为+3价,所以高铁酸钾在反应中被还原,故D错误;
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池和电解池原理,根据元素化合价与电池电极的关系是解本题关键,书写电极反应式是学习难点,也是考试热点,要熟练掌握书写方法,题目难度中等.1年前查看全部
- 高铁电池是一种新型碱性可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K
高铁电池是一种新型碱性可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K 2 FeO 4 +8H 2 O  3Zn(OH) 2 +2Fe(OH) 3 +4KOH,下列叙述不正确的是 [ ]
3Zn(OH) 2 +2Fe(OH) 3 +4KOH,下列叙述不正确的是 [ ]A.放电时负极反应为:Zn-2e - +2OH - =Zn(OH) 2
B.充电时阳极反应为:Fe(OH) 3 -3e - +5OH - =FeO 4 2- +4H 2 O
C.放电时每转移3 mol电子,正极有1 mol K 2 FeO 4 被氧化
D.放电时正极附近溶液的碱性增强 jafsun11年前1
jafsun11年前1 -
 爱情是儿戏 共回答了18个问题
爱情是儿戏 共回答了18个问题 |采纳率100%C1年前查看全部
- 高铁电池是新型可充电电池,与普通高能电池相比,该电池放电时能长时间保持稳定的电压.高铁电池放电的化学方程式为:
高铁电池是新型可充电电池,与普通高能电池相比,该电池放电时能长时间保持稳定的电压.高铁电池放电的化学方程式为:
3Zn+2K 2 FeO 4 +8H 2 O=3Zn(OH) 2 +2Fe(OH) 3 +4KOH.下列叙述中错误的是( )A.该反应实现了化学能向电能的转化 B.放电过程中锌元素的化合价降低 C.高铁电池能减少汞等重金属污染 D.放电过程中溶液的pH逐渐升高  wozuiaini_121年前1
wozuiaini_121年前1 -
 tzreben 共回答了10个问题
tzreben 共回答了10个问题 |采纳率80%A.高铁电池放电时时化学能转化为电能的装置,故A正确;
B.放电时,Zn被氧化,化合价升高,故B错误;
C.高铁电池不含汞等重金属,可减少污染,故C正确;
D.放电时,生成KOH,溶液pH升高,故D正确.
故选B.1年前查看全部
- (2014•徐州三模)高铁电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应式为3Zn+2K2FeO4+8
(2014•徐州三模)高铁电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应式为3Zn+2K2FeO4+8H2O═3Zn(OH)2+2Fe(OH)3+4KOH.下列叙述正确的是( )
A.放电时,负极反应式为3Zn-6e-+6OH-═3Zn(OH)2
B.放电时,正极区溶液的pH减小
C.充电时,每转移3mol电子,阳极有1mol Fe(OH)3被还原
D.充电时,电池的锌电极接电源的正极 兰克1年前1
兰克1年前1 -
 生命不是一场奇遇 共回答了21个问题
生命不是一场奇遇 共回答了21个问题 |采纳率81%解题思路:根据电池的总反应可知,高铁电池放电时必定是锌在负极失去电子,电极反应式为3Zn-6e-+6OH-═3Zn(OH)2,高铁酸钾在正极得到电子,电极反应式为FeO42+4H2O+3e-=Fe(OH)3+5OH-,根据电极反应式可判断电子转移的物质的量与反应物之间的关系,充电时,阳极上氢氧化铁转化成高铁酸钾,电极反应式为Fe(OH)3+5OH-=FeO42+4H2O+3e-,阳极消耗OH-离子,碱性要减弱,以此解答该题.A.放电时,Zn失去电子,发生3Zn-6e-+6OH-═3Zn(OH)2,故A正确;
B.正极反应式为FeO42+4H2O+3e-=Fe(OH)3+5OH-,pH增大,故B错误;
C.充电时,铁离子失去电子,发生Fe(OH)3转化为FeO42-的反应,电极反应为Fe(OH)3-3e-+5OH-=FeO42-+4H2O,每转移3mol电子,阳极有1mol Fe(OH)3被氧化,故C错误;
D.充电时,电池的负极与与电源的负极相连,故D错误.
故选A.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查电解池与原电池,明确电极反应中放电为原电池、充电为电解池为解答本题的关键,题目难度不大.1年前查看全部
- 高铁电池的总反应为:3Zn+2K 2 FeO 4 +8H 2 O
高铁电池的总反应为:3Zn+2K 2 FeO 4 +8H 2 O 
3Zn(OH) 2 +2Fe(OH) 3 +4KOH 下列叙述错误的是( )A.放电时每转移6mol电子,负极有2mol K 2 FeO 4 被还原 B.充电时阴极反应为:Zn(OH) 2 +2e-=Zn+2OH - C.放电时正极反应为:FeO 4 2- +3e-+4H 2 O=Fe(OH) 3 +5OH - D.充电时阳极附近溶液的碱性增强  衾衾宝贝1年前1
衾衾宝贝1年前1 -
 Relationship 共回答了21个问题
Relationship 共回答了21个问题 |采纳率90.5%A、高铁电池放电时,锌元素的化合价升高,每转移6mol电子,在正极上有2mol K 2 FeO 4 被还原,故A错误;
B、充电时阴极3Zn(OH) 2 发生得电子得还原反应,即Zn(OH) 2 +2e-=Zn+2OH - ,故B正确;
C、放电时正极K 2 FeO 4 发生得电子的还原反应,即FeO 4 2- +3e - +4H 2 O=Fe(OH) 3 +5OH - ,故C正确;
D、充电时阳极附近2Fe(OH) 3 发生失电子的氧化反应,即Fe(OH) 3 +5OH - -3e - =FeO 4 2- +4H 2 O,消耗氢氧根离子,所以碱性减弱,故D错误.
故选AD.1年前查看全部
- 高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn +2K 2
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn +2K 2 FeO 4 +8H 2 O  3Zn(OH) 2 +2Fe(OH) 3 + 4KOH,下列叙述不正确的是[ ]
3Zn(OH) 2 +2Fe(OH) 3 + 4KOH,下列叙述不正确的是[ ]A.放电时负极反应为:Zn - 2e - + 2OH - = Zn(OH) 2
B.充电时阳极反应为:Fe(OH) 3 - 3e - + 5OH - = FeO 4 2- + 4H 2 O
C.放电时每转移3mol电子,正极有1mol K 2 FeO 4 被氧化
D.放电时正极附近溶液的碱性增强 mikery0071年前1
mikery0071年前1 -
 F91yeah 共回答了14个问题
F91yeah 共回答了14个问题 |采纳率92.9%C1年前查看全部
- 高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为 3Zn+2K 2
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为 3Zn+2K 2 FeO 4 +8H 2 O  3Zn(OH) 2 +2Fe(OH) 3 +4KOH下列叙述不正确的是[ ]
3Zn(OH) 2 +2Fe(OH) 3 +4KOH下列叙述不正确的是[ ]A.放电时负极反应为:Zn-2e - +2OH - = Zn(OH) 2
B.充电时阳极反应为:Fe(OH) 3 -3e - +5OH - = FeO+4H 2 O
C.放电时每转移3 mol电子,正极有1mol K 2 FeO 4 被氧化
D.放电时正极附近溶液的碱性增强 一个眼神玩tt你1年前1
一个眼神玩tt你1年前1 -
 xd818001 共回答了16个问题
xd818001 共回答了16个问题 |采纳率87.5%C1年前查看全部
- 高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn+2K 2 FeO 4 +8H 2 O 3Zn(OH) 2 +2Fe(OH) 3 +4KOH
3Zn(OH) 2 +2Fe(OH) 3 +4KOH
下列叙述不正确的是()A.放电时负极反应为:Zn-2e - +2OH - =Zn(OH) 2 B.放电时正极反应为:FeO 4 2- +4H 2 O+3e - =Fe(OH) 3 +5OH - C.放电时每转移3 mol电子,正极有1 mol K 2 FeO 4 被氧化 D.放电时正极附近溶液的碱性增强  米臭臭1年前1
米臭臭1年前1 -
 夏语ly 共回答了19个问题
夏语ly 共回答了19个问题 |采纳率94.7%C
高铁电池放电时为原电池,依据原电池工作原理,放电时负极反应式为Zn-2e - +2OH - =Zn(OH) 2 ,用总式减去负极反应式即得正极反应式为:FeO 4 2- +4H 2 O+3e - =Fe(OH) 3 +5OH - ,放电时每转移3 mol电子,正极有1 mol K 2 FeO 4 被还原。1年前查看全部
- 高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为: 3Zn + 2
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为: 3Zn + 2K 2 FeO 4 + 8H 2 O  3Zn(OH) 2 + 2Fe(OH) 3 + 4KOH 。下列叙述不正确的是 [ ]
3Zn(OH) 2 + 2Fe(OH) 3 + 4KOH 。下列叙述不正确的是 [ ]A.放电时锌做负极
B.充电时氢氧化铁被氧化
C.充电时电池的正极和电源的正极相连
D.放电时每转移3 mole - ,有2mol FeO 4 2- 被还原 teddy_0091年前1
teddy_0091年前1 -
 有水忘川 共回答了21个问题
有水忘川 共回答了21个问题 |采纳率95.2%D1年前查看全部
- 目前,新能源不断被利用到现代的汽车中,高铁电池技术就是科研机构着力研究的一个方向。
目前,新能源不断被利用到现代的汽车中,高铁电池技术就是科研机构着力研究的一个方向。
(1)高铁酸钾-锌电池(碱性介质)是一种典型的高铁电池,则该种电池负极材料是 。
(2)工业上常采用NaClO氧化法生产高铁酸钾(K 2 FeO 4 ),K 2 FeO 4 在碱性环境中稳定,在中兴和酸性条件下不稳定。反应原理为:
Ⅰ在碱性条件下,利用NaClO氧化Fe(NO 3 ) 3 制得Na 2 FeO 4
3NaClO + 2Fe(NO 3 ) 3 + 10NaOH=2Na 2 FeO 4 ↓+ 3NaCl + 6NaNO 3 + 5H 2 O
Ⅱ Na 2 FeO 4 与KOH反应生成K 2 FeO 4 :Na 2 FeO 4 + 2KOH=K 2 FeO 4 + 2NaOH
主要的生产流程如下:
①写出反应①的离子方程式 。
②流程图中“转化”(反应③)是在某低温下进行的,说明此温度下K sp (K 2 FeO 4 ) K sp (Na 2 FeO 4 )(填“>”或“<”或“=”)。
(3)已知K 2 FeO 4 在水溶液中可以发生:4FeO 4 2— +10H 2 O 4Fe(OH) 3 ↓+8OH — +3O 2 ↑,则K 2 FeO 4 可以在水处理中的作用是 。
4Fe(OH) 3 ↓+8OH — +3O 2 ↑,则K 2 FeO 4 可以在水处理中的作用是 。
(4)FeO 4 2— 在水溶液中的存在形态图如图所示。
①若向pH=10的这种溶液中加硫酸至pH=2,HFeO 4 - 的分布分数的变化情况是 。
②若向pH=6的这种溶液中滴加KOH溶液,则溶液中含铁元素的微粒中, 转化为 (填化学式)。 佐霖佑舍1年前1
佐霖佑舍1年前1 -
 fg9326 共回答了23个问题
fg9326 共回答了23个问题 |采纳率95.7%(1)Zn(1分);
(2)①Cl 2 +2OH — =Cl — +ClO — +H 2 O(2分)②<(2分);
(3)杀菌消毒(1分),净化(1分);
(4)①先变大,后变小(2分)②HFeO 4 - 转化为FeO 4 2— (2分)。
1年前查看全部
- 高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K 2
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K 2 FeO 4 +8H 2 O
 3Zn(OH) 2 +2Fe(OH) 3 +4KOH,下列叙述正确的是( )
3Zn(OH) 2 +2Fe(OH) 3 +4KOH,下列叙述正确的是( )A.充电时阳极反应为Zn-2e - +2OH - =Zn(OH) 2 B.充电时OH - 向阳极移动 C.放电时每转移3 mol e - 正极有1 mol K 2 FeO 4 被氧化 D.充电时,电源的正极应与电池的Zn(OH) 2 极相连  理性ll1年前1
理性ll1年前1 -
 MaiZi_nn 共回答了14个问题
MaiZi_nn 共回答了14个问题 |采纳率100%B
A项,通过总反应可以判断该反应为放电时负极发生的反应;B项,充电时阴离子向电解池的阳极移动;C项,正极得电子,化合价降低,被还原;D项,电池的Zn(OH) 2 极充电时为阴极,应与电源的负极相连。
点拨:本题考查蓄电池,考查考生书写电极反应式的能力。难度中等。1年前查看全部
- 目前,新能源不断被利用到现代的汽车中,高铁电池技术就是科研机构着力研究的一个方向.
目前,新能源不断被利用到现代的汽车中,高铁电池技术就是科研机构着力研究的一个方向.
(1)高铁酸钾-锌电池(碱性介质)是一种典型的高铁电池,则该种电池负极材料是______.
(2)工业上常采用NaClO氧化法生产高铁酸钾(K 2 FeO 4 ),K 2 FeO 4 在碱性环境中稳定,在中兴和酸性条件下不稳定.反应原理为:
Ⅰ.在碱性条件下,利用NaClO氧化Fe(NO 3 ) 3 制得Na 2 FeO 4 :3NaClO+2Fe(NO 3 ) 3 +10NaOH=2Na 2 FeO 4 ↓+3NaCl+6NaNO 3 +5H 2 O
Ⅱ.Na 2 FeO 4 与KOH反应生成K 2 FeO 4 :Na 2 FeO 4 +2KOH=K 2 FeO 4 +2NaOH
主要的生产流程如下:
(2)①写出反应①的离子方程式______
②流程图中“转化”(反应③)是在某低温下进行的,说明此温度下K sp (K 2 FeO 4 )______K sp (Na 2 FeO 4 )(填“>”或“<”或“=”).
(3)已知K 2 FeO 4 在水溶液中可以发生:4FeO 4 2- +10H 2 O⇌4Fe(OH) 3 ↓+8OH - +3O 2 ↑,则K 2 FeO 4 可以在水处理中的作用是______.
(4)FeO 4 2- 在水溶液中的存在形态图如下图所示.
①若向pH=10的这种溶液中加硫酸至pH=2,HFeO 4 - 的分布分数的变化情况是______.
②若向pH=6的这种溶液中滴加KOH溶液,则溶液中含铁元素的微粒中,______转化为______(填化学式). zhxm511314211年前1
zhxm511314211年前1 -
 66444333 共回答了20个问题
66444333 共回答了20个问题 |采纳率90%(1)该原电池中,锌易失电子发生氧化反应而作负极,故答案为:Zn;(2)①氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,离子反应方程式为:Cl 2 +2OH - =Cl - +ClO - +H 2 O,故答案为:Cl 2 +2OH - =Cl - +Cl...1年前查看全部
- 高铁电池为什么是高能电池?因为高铁酸根中铁元素以正六价存在,所以高铁电池是一种高能电池吗?
 yx497849091年前2
yx497849091年前2 -
 未知de旅途 共回答了14个问题
未知de旅途 共回答了14个问题 |采纳率92.9%高能电池是具有高比能量的电池,电池比能量是单位质量反应物所能提供的电能.
高铁酸根氧化性很好,而且被还原时降三价.电池最多所能提供的能量=UQ;
U为电压,Q为容量,就是电池上标的mAh(毫安时,国际单位制中应该用AS,安秒,也就是C,库伦),
Q=neF,F为法拉第常数,是一个常数,e为一个电子的电量,也是常数,n是1mol反应物能转移的电子物质的量,高铁酸根就是3mol.综上所述,比能量=UneF(忽略电池快用光时电压下降),U和n越大,比能量越大.同一负极材料时,高铁酸根电池的U和n都比较高,所以高铁电池是高能电池.1年前查看全部
- 高铁电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应式为3Zn+2K 2 FeO 4 +8H 2 O==
高铁电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应式为3Zn+2K 2 FeO 4 +8H 2 O===3Zn(OH) 2 +2Fe(OH) 3 +4KOH。下列叙述正确的是( )
A.放电时,负极反应式为3Zn-6e - +6OH - ===3Zn(OH) 2 B.放电时,正极区溶液的pH减小 C.充电时,每转移3 mol电子,阳极有1 mol Fe(OH) 3 被还原 D.充电时,电池的锌电极接电源的正极  victory05321年前1
victory05321年前1 -
 maomi_wh 共回答了24个问题
maomi_wh 共回答了24个问题 |采纳率100%A
1年前查看全部
- 高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:
3Zn+2K 2 FeO 4 +8H 2 O═3Zn(OH) 2 +2Fe(OH) 3 +4KOH
下列叙述不正确的是( )A.放电时负极反应为:3Zn-6e - +6OH - ═3Zn(OH) 2 B.放电时正极反应为:2FeO 4 2- +6e - +8H 2 O═2Fe(OH) 3 +10OH - C.放电时每转移3mol电子,正极有1molK 2 FeO 4 被还原 D.放电时正极附近溶液的碱性减弱  skittlema1年前1
skittlema1年前1 -
 aicocoyiwannian 共回答了17个问题
aicocoyiwannian 共回答了17个问题 |采纳率82.4%A.放电时,Zn被氧化,生成Zn(OH) 2 ,电极反应式为3Zn-6e - +6OH - ═3Zn(OH) 2 ,故A正确;
B.K 2 FeO 4 为电池的正极,发生还原反应,生成Fe(OH) 3 ,电极反应式为2FeO 4 2- +6e - +8H 2 O═2Fe(OH) 3 +10OH - ,故B正确;
C.放电时,Fe化合价由+6价降低为+3价,则放电时每转移3mol电子,正极有1molK 2 FeO 4 被还原,故C正确;
D.放电时,正极生成OH - ,溶液碱性增强,故D错误.
故选D.1年前查看全部
- (2011•泰州一模)高铁电池是一种新型可充电电池,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:
(2011•泰州一模)高铁电池是一种新型可充电电池,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:
3Zn(OH)2+4KOH+2Fe(OH)3
3Zn+2K2FeO4+8H2O,下列判断正确的是( )充电 .放电
A.充电时阳极反应为:2FeO42-+8H2O-6e-=2Fe(OH)3+10OH-
B.充电时阴极附近溶液的pH变大
C.放电时,负极材料为Zn
D.放电时,每转移0.2 mol电子,正极的质量减少6.5 g 104pooldog1年前1
104pooldog1年前1 -
 ymzba 共回答了12个问题
ymzba 共回答了12个问题 |采纳率100%解题思路:根据电池的总反应可知,高铁电池放电时必定是锌在负极失去电子,电极反应式为Zn-2e-+2OH-=Zn(OH)2,
高铁酸钠在正极得到电子,电极反应式为FeO42+4H2O+3e-=Fe(OH)3+5OH-,
根据电极反应式可判断电子转移的物质的量与反应物之间的关系,
充电时,阳极上氢氧化铁转化成高铁酸钠,电极反应式为Fe(OH)3+5OH-=FeO42+4H2O+3e-,阳极消耗OH-离子,碱性要减弱.A、充电时,阳极上氢氧化铁转化成高铁酸钠,电极反应式为Fe(OH)3+5OH-=FeO42+4H2O+3e-,故A错误;
B、充电时阴极电极反应为:Zn(OH)2+2e-=Zn+2OH-,附近溶液的pH变大,故B正确;
C、根据电池的总反应可知,高铁电池放电时必定是锌在负极失去电子,电极反应式为Zn-2e-+2OH-=Zn(OH)2,故C正确;
D、放电时正极反应为FeO42+4H2O+3e-=Fe(OH)3+5OH-,无质量变化,故D错误;
故选BC.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池和电解池原理的分析判断,电极反应的书写方法和电极反应特征是解题关键,题目难度中等.1年前查看全部
- (2009•镇江)高铁电池是新型可充电电池,与普通高能电池相比,该电池放电时能长时间保持稳定的电压.高铁电池放电的化学方
(2009•镇江)高铁电池是新型可充电电池,与普通高能电池相比,该电池放电时能长时间保持稳定的电压.高铁电池放电的化学方程式为:3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH.下列叙述中错误的是( )
A.该反应实现了化学能向电能的转化
B.放电过程中锌元素的化合价降低
C.高铁电池能减少汞等重金属污染
D.放电过程中溶液的pH逐渐升高 wyiqun3651年前1
wyiqun3651年前1 -
 Merrill1011 共回答了16个问题
Merrill1011 共回答了16个问题 |采纳率87.5%解题思路:根据电池放电是将化学能转化为电能的过程,由题给化学方程式可知,高铁电池放电时,锌元素的化合价升高,生成强碱KOH等,所以溶液的pH增大,进行解答本题.A、根据电池放电是将化学能转化为电能的过程,所以该反应实现了化学能向电能的转化,故A正确;B、根据由题中化学方程式可知:高铁电池放电时,锌元素的化合价升高,故B错误;C、根据高铁电池放电的化学方程式可知不...
点评:
本题考点: 常见元素与常见原子团的化合价;废弃金属对环境的污染;溶液的酸碱性与pH值的关系;物质发生化学变化时的能量变化.
考点点评: 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.1年前查看全部
- 已知可充电高铁电池的反应为3Zn +2K 2 FeO 4 +8H 2 O 3Zn(OH) 2 +2Fe(OH) 3 +4
已知可充电高铁电池的反应为3Zn +2K 2 FeO 4 +8H 2 O 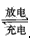 3Zn(OH) 2 +2Fe(OH) 3 +4KOH,下列叙述不正确的是 [ ]
3Zn(OH) 2 +2Fe(OH) 3 +4KOH,下列叙述不正确的是 [ ]A.该电池的负极材料是Zn(OH) 2
B.放电时正极反应:FeO 4 2- +4H 2 O+3e - ==Fe(OH) 3 +5OH -
C.该电池在放电过程中碱性增强
D.该电池使用的介质为氢氧化钾溶液 这个世界是qq的1年前1
这个世界是qq的1年前1 -
 关关林林 共回答了19个问题
关关林林 共回答了19个问题 |采纳率78.9%A1年前查看全部
- 高铁电池是一种新型可充电电池,该电池能长时间保持稳定的放电电压。高铁电池的总反应为: 下列判断正确的是 A.充电时阳极反
高铁电池是一种新型可充电电池,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
 下列判断正确的是
下列判断正确的是A.充电时阳极反应为:2FeO 4 2 - +8H 2 O-6e - =2Fe(OH) 3 +10OH - B.充电时阴极附近溶液的pH变大 C.放电时,负极材料为Zn D.放电时,每转移0.2 mol电子,正极的质量减少6.5 g  landed1年前1
landed1年前1 -
 lzgui 共回答了15个问题
lzgui 共回答了15个问题 |采纳率93.3%BC
该电池放电时,电极反应式为:
负极:3Zn-6e - +6OH - =3Zn(OH) 2
正极:2FeO 4 2- +6e - +8H 2 O=2Fe(OH) 3 +10OH -
该电池充电时,电极反应式为:
阴极:3Zn(OH) 2 +6e - =3Zn+6OH -
阳极:2Fe(OH) 3 +10OH - -6e - =2FeO 4 2- +8H 2 O1年前查看全部
大家在问
- 1ostrich怎么读
- 2在三角形ABC中,∠B=α,∠C=β,求三角形各边长,△ABC的面积
- 3小军,小红,小波三人数学测验的平均成绩是90分,如果加上赵平四个人的干均成绩是88分,赵平考了几分。填空题
- 4Gifts for My Parents 英语作文求写,70词
- 5请问;10-1又25分之6-3又25分之19等于多少【过程】
- 6He asksme ( ) the girl with her English
- 7电子仪器按其功能可分为几分类
- 8地面上的越洋无线通信借助大气层的哪一层反射电波?
- 9正项数列{an},a1等于1,an的平方=4an,求an的通项公式
- 10我很喜欢你的舞蹈用英语怎么说
- 11我叫文静英语怎么写
- 12跪求两篇英语作文 1、my favourite sport---running 2、my middle school
- 13f(x)=0.5sin^2x+cos^2x+根号3除以4乘以sin2x
- 14If your call's not too urgent,do you mind_____mine first?
- 15已知∠MON=90°,线段AB长为6cm,AB两端分别在OM、ON上滑动,以AB为边作正方形ABC
