8GNaoh中所含中子数_ _GNh3中所含质子数与36gh2o中质子数相同 31.6gKmno4
 eathey2022-10-04 11:39:541条回答
eathey2022-10-04 11:39:541条回答中氧原子个数与_gH2o中氧原子个数相同

已提交,审核后显示!提交回复
共1条回复
 白路原 共回答了24个问题
白路原 共回答了24个问题 |采纳率87.5%- 8g NAOH 含中子8/40=0.2MOL ( 12 + 16 + 1)*0.2=5.8
NH3 含中子数 7+3=10 5.8/10=0.58MOL NH3
H2O 36/18=2MOL 中子数(16+2)*2=36
KMNO4 含中子数20+30+16*4=114 114*X=36 X=0.31MOLKMNO4 - 1年前
相关推荐
- 有A、B、C、D、E五种微粒:①A微粒核内有14个中子,核外M电子层上有2个电子;②B微粒得到2个电子后,其电子层结构与
有A、B、C、D、E五种微粒:
①A微粒核内有14个中子,核外M电子层上有2个电子;
②B微粒得到2个电子后,其电子层结构与Ne相同;
③C微粒带有一个单位的正电荷,核电荷数为11;
④D微粒核外有18个电子,当失去1个电子时呈电中性;
⑤E微粒不带电,其质量数为1.
依次写出A、B、C、D、E各微粒的符号
______、______、______、______、______. 招亲不招福1年前1
招亲不招福1年前1 -
 砂锅大的拳头 共回答了21个问题
砂锅大的拳头 共回答了21个问题 |采纳率81%解题思路:①根据原子核外电子排布及质量数判断核素;
②根据原子核外电子排布判断元素;
③根据电子数、核电荷数、电荷数的关系判断元素;
④根据电子数、核电荷数、电荷数的关系判断元素;
⑤根据质子数、中子数、质量数的关系判断元素.①由“核外M电子层上有2个电子”知,该元素的核外电子排布为2、8、2,;质子数为12,质量数为26;所以是质子数为12,质量数为26的镁元素;
②Ne的核外电子数是10,B微粒得到2个电子后,其电子层结构与Ne相同,所以B是O元素;
③C的核电荷数为11,C微粒带有一个单位的正电荷,核电荷数=原子序数,所以C是钠离子;
④由题意知,该元素的原子核外有17个电子,原子的核外电子数=核内质子数=原子序数,所以D是氯离子;
⑤由题意知,E是质子数为1,中子数为0,质量数为1的H元素.
故答案为:2612Mg;O;Na+;Cl-;11H.点评:
本题考点: 原子核外电子排布;质量数与质子数、中子数之间的相互关系.
考点点评: 本题考查了原子核外电子排布及质子数、中子数、质量数的相互关系等知识点,侧重考查学生对这些知识点的掌握情况.1年前查看全部
- 已知A、B、C、D四种元素,A是地壳中含量最多的金属元素,B元素的原子核内没有中子,C元素的原子第二层电子数是第一层2倍
已知A、B、C、D四种元素,A是地壳中含量最多的金属元素,B元素的原子核内没有中子,C元素的原子第二层电子数是第一层2倍,D元素的原子得到2个电子后,其电子层结构和氖原子相同.
(1)写出下列元素符号AAlAlBHHCCCDOO;
(2)B与C形成化合物的化学式可能是COCO也可能是CO2CO2. p9h61年前1
p9h61年前1 -
 摩卡-加冰的 共回答了15个问题
摩卡-加冰的 共回答了15个问题 |采纳率93.3%(1)铝是地壳中含量最多的金属元素,因此A是铝元素;B元素的原子核内没有中子,因此B是氢元素;C元素的原子第二层电子数是第一层2倍,因此C是碳元素;D元素的原子得到2个电子后,其电子层结构和氖原子相同,因此D是氧元素;注意写元素符号.故答案为:A:AlB:HC:CD:O
(2)B是氢元素,C是碳元素,因此B与C形成的化合物是一氧化碳和二氧化碳,故答案为:COCO21年前
51年前查看全部
- (2014•宝鸡一模)静止的氮核 147N被速度为v0的中子 10n击中生成碳核 126C
(2014•宝鸡一模)静止的氮核
N被速度为v0的中子147
n击中生成碳核10
C和另一种原子核甲,已知126
C与甲核的速度方向与碰撞前中子的速度方向一致,碰后碳核126
C与甲核的动量之比为l:1.126
(1)写出核反应方程式.
(2)求
C与甲核的速度各是多大?126 guixi1年前1
guixi1年前1 -
 waynelee0925 共回答了20个问题
waynelee0925 共回答了20个问题 |采纳率90%解题思路:(1)在核反应中质量数与核电荷数守恒,根据质量数与核电荷数守恒,写出核反应方程式.
(2)在核反应过程中,系统动量守恒定律可以求出原子核的速度.(1)根据质量数与核电荷数守恒可知,
甲核的核电荷数是1,质量数是3,甲核是氚核,
核反应方程式为:
147N+
10n→
126C+
31H;
(2)设中子质量为m0,
126C核质量mC,甲核质量为m甲,
由动量守恒得:m0v0=mC vC+m甲v甲,
即:m0v0=12 m0 vC+3m0v甲,
又因为
126C与甲核动量比为1:l,
所以m0 vC=m甲v甲,
即12 m0 vC=3 m0v甲,
联立以上两个方程,得:vC=
v0
24,v甲=
v0
6.
答:(1)核反应方程式是:
147N+
10n→
126C+
31H;
(2)
126C的速度是
v0
24,甲核的速度是
v0
6.点评:
本题考点: 动量守恒定律;原子核的人工转变.
考点点评: 本题主要考查了守恒定律在近代物理中的应用,通过该题体会能量守恒和动量守恒使用的广泛性.1年前查看全部
- 由于热中子的德布罗意波长与晶体中原子间距相近,已知中子质量m=1.67×10^-27kg,普朗克常量h=6.63×10^
由于热中子的德布罗意波长与晶体中原子间距相近,已知中子质量m=1.67×10^-27kg,普朗克常量h=6.63×10^-34J/s,则德布罗意波长为λ=1.82×10^-10的热中子的动能约为
A 4×10^-17J B 4×10^-21J C 4×10^-22J D 4×10^-25J cb5khja1年前3
cb5khja1年前3 -
 爱上飞鸟的鱼123 共回答了17个问题
爱上飞鸟的鱼123 共回答了17个问题 |采纳率94.1%p=h/λ=3.68x10^-24N.s
因为p=mv;Ek=1/2mv2(平方)
所以Ek=P2(平方)/(2m)=4x10^-21J
答案:B1年前查看全部
- (2005•江苏)在中子衍射技术中,常利用热中子研究晶体的结构,因为热中子的德布罗意波长与晶体中原子间距相近.已知中子质
(2005•江苏)在中子衍射技术中,常利用热中子研究晶体的结构,因为热中子的德布罗意波长与晶体中原子间距相近.已知中子质量m=1.67x10-27kg,普朗克常量h=6.63x10-34J•s,可以估算德布罗意波长λ=1.82x10-10m的热中子动能的数量级为( )
A.10-17J
B.10-19J
C.10-21J
D.10-24J uhkc1年前1
uhkc1年前1 -
 huliwen 共回答了20个问题
huliwen 共回答了20个问题 |采纳率90%由德布罗意波公式λ=[h/p]得P=[h/λ]
而P=mv,则v=[h/λm]=
6.63×10−34
1.82×10−10×1.67×10−27m/s=2.18×103m/s
所以E=
1
2mv2=
1
2×1.67×10−27×(2.18×103)2J=3.97×10-21J
因此热中子的动能的数量级 10-21J
故选:C1年前查看全部
- 铀经过多次α,β衰变形成稳定的铅的过程中,有6个中子转变成质子?
铀经过多次α,β衰变形成稳定的铅的过程中,有6个中子转变成质子?
这句话对吗?最好写出核反应方程 天天成成1年前1
天天成成1年前1 -
 上海小坏宝贝 共回答了14个问题
上海小坏宝贝 共回答了14个问题 |采纳率78.6%U(92,235),Pb(82,207) α衰变次数 (235-207)/4=7,
β衰变次数(2*7-(92-82)=4 有4个中子转变成质子1年前查看全部
- 某元素R的核内含有N个中子,R的质量数为A,在其与氢化合时,R呈-n价,则Wg的气态氢化物中所含的电子的物质的量为(
某元素R的核内含有N个中子,R的质量数为A,在其与氢化合时,R呈-n价,则Wg的气态氢化物中所含的电子的物质的量为( ) A.
(A-N)molW A B.
(A-N+n)molW A+1 C.
(A-N+n)molW A+n D.
(A-N-n)molW A+n  最后的沙发1年前1
最后的沙发1年前1 -
 xiaobai417 共回答了16个问题
xiaobai417 共回答了16个问题 |采纳率87.5%元素R原子中含有电子数=质子数=质量数-中子数=A-N,形成氢化物是R得到n个电子,呈-n价,R离子中电子数为A-N+n,氢化物的相对分子质量为A+n,W g氢化物的物质的量为 W A+n mol,故氢化物中电子...1年前查看全部
- 如果电子和中子结合,会发生什么?
 60分万岁1年前2
60分万岁1年前2 -
 铲铲队的ss 共回答了24个问题
铲铲队的ss 共回答了24个问题 |采纳率83.3%不知道楼主知不知道反物质?一般来说,让中子和电子结合,这是很难的…但值得注意的是,电子坠毁在质子上,就变成了中子,β衰变中子释放一个电子变成质子…所以,电子和中子结果就是带负电的质子,也就是反质子….反物质在这个充满物质的世界里太难存在了…因为一旦相遇,就会湮灭.比如电子和正电子湮灭变成两个γ光子.楼主明白了?手机党,打字不宜哦,如果觉得有帮助,1年前查看全部
- 关于铵根离子质子数的问题我想知道下铵根离子有多少个质子,中子跟电子?分别怎么算?
 庄不会1年前2
庄不会1年前2 -
 5212711 共回答了17个问题
5212711 共回答了17个问题 |采纳率94.1%不管是原子分子还是离子 原子的质子数不变 永远等于核电荷数,即原子序数
所以质子数还是7+4=11 但由于带一个单位正电荷(失去了一个电子),所以电子数为11-1=10
中子也不会变化 一般来看 H中子数为0 N中子数为7 所以 铵根中子数为7
如果还有疑问 百度HI找我 详谈1年前查看全部
- 下列说法正确的是a原子不能在分.b原子核都是由质子和中子构成的.c相对原子质量只是一个比值没有单位.
下列说法正确的是a原子不能在分.b原子核都是由质子和中子构成的.c相对原子质量只是一个比值没有单位.
d原子可以直接构成分子也可以直接构成物质.好像c和d都是对的 但只有一个答案? 36697751年前3
36697751年前3 -
 爱我你怕了吗 共回答了16个问题
爱我你怕了吗 共回答了16个问题 |采纳率81.3%A、错误.化学变化中原子不能再分.
B、错误.氢原子核没有中子
C、正确.相对原子质量只是一个比值,没有单位.有时候认为单位是 1
D、正确.比如氧原子构成了氧分子,铁元素直接构成了金属铁
选择CD.要是单选就选D
但化学有时候会有双选题的1年前查看全部
- 质子数与中子数相等的物质rt属于短周期的元素,质子数与中子数相等的物质
 癫疯对决1年前1
癫疯对决1年前1 -
 Y977144809 共回答了23个问题
Y977144809 共回答了23个问题 |采纳率95.7%氢的同位素:氘1年前查看全部
- 物理问题关于求质子中子的碳原子有六个电子,它的质量是氢原子质量的12倍,碳原子中有?个质子,个中子
 daji12121年前1
daji12121年前1 -
 maytange 共回答了17个问题
maytange 共回答了17个问题 |采纳率76.5%都是61年前查看全部
- 已知一个碳原子(含6个中子和6个质子)的质量是1.993×10-26 Kg,又知一个氧原子的质量为2.657×10-26
已知一个碳原子(含6个中子和6个质子)的质量是1.993×10-26 Kg,又知一个氧原子的质量为2.657×10-26 Kg,则氧原子的相对原子质量的计算表达式为是______.
 怎么生存1年前0
怎么生存1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 核电荷数,质子数,中子数,核电荷数关系
 芝麻开花遍地香11年前4
芝麻开花遍地香11年前4 -
 258369147 共回答了15个问题
258369147 共回答了15个问题 |采纳率86.7%核电荷数=质子数=相对原子质量-中子数=核外电子数1年前查看全部
- 在①分子 ②原子 ③原子核 ④质子 ⑤中子 ⑥电子 等粒子中
在①分子 ②原子 ③原子核 ④质子 ⑤中子 ⑥电子 等粒子中,找出符合下列条件的粒
子的序号,填在相应的横线上.
(1)能直接构成纯净物的是______
(2)能保持物质化学性质的是______
(3)质量与氢原子质量近似相等的是______
(4)在同一原子中数目相等的是______
(5)化学反应中的最小粒子是______
(6)带正电荷的是______
(7)不显电性的是______
(8)质量最小的是______. 453453441年前1
453453441年前1 -
 fushundaxu 共回答了19个问题
fushundaxu 共回答了19个问题 |采纳率84.2%解题思路:已知分子、原子、离子是构成物质的基本微粒;分子是保持物质化学性质的最小粒子;原子是化学变化中最小的粒子;原子是由原子核和核外电子组成,原子核由质子和中子组成(质子带正电,中子不带电).原子核带正电,电子带负电,两者的带电量相同,一正一负,所以整个原子显示的是电中性.(1)根据分子、原子、离子是构成物质的基本微粒;所以能构成纯净物的是 分子、原子;故答案为:①②
(2)根据分子是保持物质化学性质的一种粒子;所以能保持物质化学性质的是分子;由原子构成的物质,原子是构成物质的最小粒子,故答案为:①②
(3)一个质子的质量与氢原子质量近似相等,中子的质量和质子的质量相近,故填:④⑤
(4)在同一原子中质子数和电子数的数目相等,故填:④⑥
(5)化学反应中的最小粒子是原子,故填:②
(6)根据质子带正电,原子核带正电,可知带正电荷的是质子、原子核,故填:③④
(7)分子、原子、中子都不显电性,故填 ①②⑤
(8)因为电子的质量非常小,仅相当于质子或中子质量的[1/1836],故质量最小的是电子,故填:⑥点评:
本题考点: 分子、原子、离子、元素与物质之间的关系;原子的定义与构成.
考点点评: 本题只要正确区分分子、原子、原子核、质子、中子和电子等粒子的性质及是否带电荷、带什么电荷以及他们之间的质量关系,就可以顺利答出此题,是一道基础题.1年前查看全部
- 下列各核反应方程中,符号“X”表示中子的是 [ ] A.
下列各核反应方程中,符号“X”表示中子的是 [ ]A. 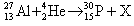
B.
C.
D.
 luoyong02131年前1
luoyong02131年前1 -
 咋就丢了 共回答了27个问题
咋就丢了 共回答了27个问题 |采纳率81.5%A1年前查看全部
- 在其他能源中,核能具有能量大、地区适应性强的优势.在核电站中,核反应堆释放的核能转化为电能.核反应堆的工作原理是利用中子
在其他能源中,核能具有能量大、地区适应性强的优势.在核电站中,核反应堆释放的核能转化为电能.核反应堆的工作原理是利用中子轰击重核发生裂变反应,释放出大量核能.其核反应方程为:
U+235 92
n→1 0
Ba+141 56
Kr+aX是反应堆中发生的许多核反应中的一种,n为中子,X为待求粒子,a为X的个数,则X为______,a=______.以mu、mBa、mKr分别表示92 36
U、235 92
n、1 0
Ba、141 56
Kr核的质量,mn、mp分别表示中子、质子的质量,c为光在真空中传播的速度,则在上述核反应过程中放出的核能△E=______.92 36  kennyq1年前1
kennyq1年前1 -
 cxzhouwenjun 共回答了18个问题
cxzhouwenjun 共回答了18个问题 |采纳率88.9%解题思路:根据电荷数守恒、质量数守恒得出aX的电荷数和质量数,从而确定a的个数和X为何种粒子.根据爱因斯坦质能方程求出释放的核能.根据电荷数守恒、质量数守恒,知aX的电荷数为0,质量数为3,知X的电荷数为0,质量数为1,为中子,a=3.
根据爱因斯坦质能方程得,释放的核能△E=△mc2=(mu-mBa-mKr-2mn)c2.
故答案为:中子,3,(mu-mBa-mKr-2mn)c2点评:
本题考点: 爱因斯坦质能方程;裂变反应和聚变反应.
考点点评: 本题考查了核反应方程和爱因斯坦质能方程的基本运用,比较简单,要加强训练,才能熟练.1年前查看全部
- 下列关于近代物理知识的说法正确的是 A.发生 衰变时,生成核与原来的原子核相比,中子数减少了2个 B. 射线是原子核外的
下列关于近代物理知识的说法正确的是
A.发生  衰变时,生成核与原来的原子核相比,中子数减少了2个
衰变时,生成核与原来的原子核相比,中子数减少了2个B.  射线是原子核外的电子电离形成的电子流,它具有较强的穿透能力
射线是原子核外的电子电离形成的电子流,它具有较强的穿透能力C.含有l0个原子核的放射性元素,经过一个半衰期,一定有5个原子核发生衰变 D.氢原子的核外电子由较高能级跃迁到较低能级时,要释放一定频率的光子,同时氢原子的电势能减小,电子的动能增大  爱快乐1年前1
爱快乐1年前1 -
 cliky 共回答了19个问题
cliky 共回答了19个问题 |采纳率84.2%1年前查看全部
- 用中子( 0 1 n)轰击铝27( 13 27 Al),产生钠24( 11 24 Na)和X;钠24具有放射性,它衰变后
用中子( 0 1 n)轰击铝27( 13 27 Al),产生钠24( 11 24 Na)和X;钠24具有放射性,它衰变后变成镁24( 12 24 Mg)和Y.则X和Y分别是( ) A.α粒子和电子 B.α粒子和正电子 C.电子和α粒子 D.质子和正电子  想起什么1年前1
想起什么1年前1 -
 furious 共回答了19个问题
furious 共回答了19个问题 |采纳率94.7%根据质量数和电荷数守恒有:
1 0 n+ 27 13 AL→ 24 11 Na+ 4 2 He
24 11 Na→ 24 12 Mg+ 0 -1 e
故x和y分别是α粒子和电子,故A正确,BCD错误.
故选A.1年前查看全部
- 某元素的一种同位素R的质量数为A,含有N个中子.此同位素R可与质量数为18的O形成化合物R2O3,则WgR2O3中含
某元素的一种同位素R的质量数为A,含有N个中子.此同位素R可与质量数为18的O形成化合物R2O3,则WgR2O3中含
有质子-------mol,含有中子---------mol 我知言1年前1
我知言1年前1 -
 平宝宝 共回答了14个问题
平宝宝 共回答了14个问题 |采纳率85.7%因为元素R的质量数为A,所以R2O3的相对分子质量为A*2+18*3=A*2+54.所以WgR2O3的物质的量为W/(2A+54)mol.R的质量数为A,中子数为N,所以质子数为(A-N).
一个R2O3(分子)中含有中子2N+3*10=2N+30个.所以WgR2O3含有的中子数为(2N+30)*W/(2A+54)mol.
一个R2O3(分子)中含有质子2(A-N)+3*8=2(A-N)+24.所以WgR2O3含有的质子数为(2(A-N)+24)*W/(2A+54)mol.1年前查看全部
- 关于阿伏伽德罗常数的疑问阿伏伽德罗综合应用的“物质组成方面”中的易错点:特殊物质中所含微粒(分子·原子·电子·质子·中子
关于阿伏伽德罗常数的疑问
阿伏伽德罗综合应用的“物质组成方面”中的易错点:
特殊物质中所含微粒(分子·原子·电子·质子·中子等)的数目:如Ne,D2O,18O2,H37Cl,-OH,OH-等.
到底这是要注意哪里? tzm2911年前2
tzm2911年前2 -
 lpt_lpq 共回答了11个问题
lpt_lpq 共回答了11个问题 |采纳率81.8%它是想说明有些特殊但相像的物质中所含微粒(分子·原子·电子·质子·中子等)的数目是不同的.
比如:
D2O(重水)和H2O(普通水)
18O2(氧的同位素)和O2(普通的氧)
-OH(羟基)和OH-(氢氧根)
这些相似的物质中所含微粒的数目是不同的,答题时注意区分(易错点)1年前查看全部
- 关于夸克的问题夸克踞离越远~其相互作用力越大,夸克踞离越近~其相互作用力越小...质子中子组成原子..夸克组成质子中子.
关于夸克的问题
夸克踞离越远~其相互作用力越大,夸克踞离越近~其相互作用力越小...
质子中子组成原子..夸克组成质子中子.
设一原子含质子中子若干~则不同质子中子中含有的夸克会因踞离近..相互作用力很小
但我们能分开质子中子~却无法分开夸克.
相邻的质子与中子之间应该会因为各自都含有夸克而不能分开~
那为啥我们能分开质子中子~却无法分开夸克. 红了眼眶1年前1
红了眼眶1年前1 -
 050128 共回答了13个问题
050128 共回答了13个问题 |采纳率100%楼上的有点胡搅蛮缠,夸克跟四维空间没有任何对应关系,跟广义相对论的联系也不大.夸克包含六种(由轻到重分别记为:上夸克u、下夸克d、奇异夸克s、粲夸克c、底夸克b 和顶夸克t),每一种夸克包含三种色,再加上对应的反...1年前查看全部
- 关于爱因斯坦的质能方程知识浅薄,忘大家莫笑.E=mc方,中子轰击原子能产生那么大的能量,假如我扔一块石头把玻璃打碎,为什
关于爱因斯坦的质能方程
知识浅薄,忘大家莫笑.E=mc方,中子轰击原子能产生那么大的能量,假如我扔一块石头把玻璃打碎,为什么产生的能量却那么小 愤怒的左拳1年前1
愤怒的左拳1年前1 -
 旷野柔风吹 共回答了18个问题
旷野柔风吹 共回答了18个问题 |采纳率94.4%在广义相对论之前,我们认为质量和能量是分别守衡的.
就是说,物质无论怎么运动,发生什么变化,其质量不变;
宇宙的总能量和总质量一样,也是一定的,能量可以由一种形式转化为另一种形式,变化前物质的总能量必定等于变化后的能量之和量.
爱因斯坦的质能方程就是打破这两个小平衡而得到一个大平衡.
即,物质的质量和能量之间可以互相换算;
在有的变化中(比如核反应),物质的质量减少能释放出能量,反之,能量也可以转化成质量.
这个结论是又狭义相对论推理出来的.1年前查看全部
- 科学家最近发现2种粒子:一种是由四个中子构成的粒子,这种粒子称为“四中子”、另一种是由四个氧原子构成的分子(O 4 )。
科学家最近发现2种粒子:一种是由四个中子构成的粒子,这种粒子称为“四中子”、另一种是由四个氧原子构成的分子(O 4 )。下列有关这两种粒子的说法不正确的是
A.“四中子”不显电性 B.“四中子”的质量数为4 C.O 4 与O 2 互为同位素 D.O 4 与O 2 都具有氧化性  紫薄米1年前1
紫薄米1年前1 -
 wwwcom77 共回答了15个问题
wwwcom77 共回答了15个问题 |采纳率86.7%C
A、中子不带电;B、中子的质量数近似等于1;C、不正确,应为同素异形体;D、正确。1年前查看全部
- 分子、原子、原子核、电子、质子、中子、夸克,按从小到大排列的正确的是( )
分子、原子、原子核、电子、质子、中子、夸克,按从小到大排列的正确的是( )
A. 分子、原子、原子核、质子、夸克
B. 原子核、原子、中子、质子、分子
C. 夸克、质子、原子核、原子、分子
D. 夸克、中子、原子、原子核、分子 猫鱼catfish1年前1
猫鱼catfish1年前1 -
 Fan_Wei 共回答了23个问题
Fan_Wei 共回答了23个问题 |采纳率100%解题思路:物体由物质组成的,物质由分子组成的;分子由原子组成,原子由位于中心的原子核和核外电子组成;原子核由质子和中子组成,质子由夸克组成.根据质量的大小,微粒由小到大依次为:夸克、质子、原子核、原子、分子.
故选C.点评:
本题考点: 物理常识.
考点点评: 此题考查分子、原子等微粒的质量大小及组成关系,属基本的物理常识.1年前查看全部
- 在“分子、原子、原子核、质子、中子、电子”等粒子中,找出符合下列条件的粒子:
在“分子、原子、原子核、质子、中子、电子”等粒子中,找出符合下列条件的粒子:
质量和氢原子质量相等的是_______,质量最小的是__________.
2、一个水分子由2个氢原子和1个氧原子构成,氧原子有8个质子,氢原子的构成最简单.那么1个水分子种的之子总数为:
A、1 B、3 C、8 D、10 miss_fantastic1年前1
miss_fantastic1年前1 -
 zjbjzhc 共回答了27个问题
zjbjzhc 共回答了27个问题 |采纳率92.6%1.第1个空有2个答案 ( 质子,中子); 因为质子质量等于中子的质量
第2个空:(电子)
2.( D )
氧原子8个+2个氢原子=10个1年前查看全部
- 不显电性的一组微粒是( )A.原子、中子、电子B.原子核、原子、分子C.中子、电子、原子D.中子、分子、原子
 wjt001年前1
wjt001年前1 -
 benny1230 共回答了19个问题
benny1230 共回答了19个问题 |采纳率94.7%解题思路:分子和原子对外不显电性,原子是由原子核和核外电子组成的,原子核带正电,电子带负电,原子核是由质子和中子组成的,质子带正电,中子不带电.分子和原子都不显电性,但是组成原子的原子核带正电,其中原子核是由带正电的质子和不带电的中子组成的.
故选D.点评:
本题考点: 分子、原子、离子、元素与物质之间的关系;原子的定义与构成.
考点点评: 本题考查了学生对物质内部结构以及带电情况的了解,是一道基础性的题目,相对比较简单.1年前查看全部
- (2014•四川模拟)某植物种子中子叶的颜色有D、d和H、h两对基因控制,将两粒绿色子叶的种子甲、乙种植后,分别与纯合的
(2014•四川模拟)某植物种子中子叶的颜色有D、d和H、h两对基因控制,将两粒绿色子叶的种子甲、乙种植后,分别与纯合的黄色子叶植株进行杂交获得大量种子(F1),这些种子的子叶全部为黄色.然后再进行如下实验:
实验Ⅰ:甲的F1全部自花传粉,所得后代性状及比例为:黄色:绿色=9:7
实验Ⅱ:乙的F1全部与基因型为ddhh的个体相交,所得后代性状及比例为:黄色:绿色=3:5
请回答下列问题:
(1)实验Ⅱ中,不同植株的花进行异花传粉时,接受花粉的植株叫______,花粉成熟前需要对母本做的人工操作有______.
(2)纯合的绿色子叶个体的基因型有______种;甲的基因型为______;乙的基因型为______.
(3)若让甲的F1基因型ddhh的个体相交,其后代的性状及比例为______,实验II后代的绿色子叶种子中,纯合子所占比例为[1/5][1/5].
(4)遗传学家在研究该植物减数分裂时,发现处于某一时期的细胞(仅研究两对 染色体),大多数如图1所示,少数出现了如图2所示的“十字形“图象.(注:图中 每条染色体只表示了一条染色单体)
①图1所示细胞处于______期,该细胞能产生的胚子基因型是______.
②图2中发生的变异______.研究发现,该植物配子中出现基因缺失时不能存活,若不考虑交叉互换,则如图2所示细胞产生的配子基因型有______种. dragon7526321年前1
dragon7526321年前1 -
 三江平原 共回答了19个问题
三江平原 共回答了19个问题 |采纳率89.5%解题思路:本题属于基因的自由组合定律及其变式的基本应用,熟练掌握两对相对性状的遗传F2代分离比是解答此题钥匙.掌握变异的各种本质区别和对减数分裂图象的认识.(1)杂交试验中接受花粉的叫母本,的母本的操作有三步:去雄、套袋、授粉.故答案为:母本;去雄;套袋.
(2 从F2代的分离比可知道,这是自由组合定律变式的应用(9:3:3:1分离比的应用),后代中只有双显性状表达黄色,单显和双隐都是绿色,7个绿色中纯合子分别是DDhh、ddHH、和ddhh三种,甲的绿色应该双隐个体即是ddhh.乙的F1测交后代是黄:绿=3:5,所以可知乙的F1应该有两种基因型,乙的绿色应该是单杂个体Ddhh或ddHh中的一种.
(3)甲的F1自交产生的子二代分离比为9黄:7绿可知只有双显才表达黄色,单显和双隐个体都表达绿色,因此它的F1测交后代就有两种表现型黄:绿=1:3.如果乙是Ddhh 则F1就有DDHh 和DdHh两种基因型而且比例相同,和bbhh测交后代只有bbhh是绿色纯合.
(4)该问中图示两图为同一时期两种图象,题目中明确是两对,着丝点也是两对,可以说明这是联会时期,尽管没有表达出四分体.根据同源染色体分离非同源染色体自由组合,图一产生的配子基因型就应该是:AbeF、ABEF、ABeF、AbEF.图二显示联会时期出现十字交叉现象,本质是因为由于染色体易位后联会出的特出现象.图二细胞减数分裂分裂时联会的同源染色体分离,然后自由组合的结果是.ABbF、ABEF、AebF、AeEF其中ABbF、AeEF基因缺失死亡,存活两种基因型的配子;还可能出现的组合是AABe、AbeF、ABEF、bEFF其中AABe、bEFF两种基因缺失,也有两种基因型配子;所以图2细胞分裂不论哪种组合方式只有两种能存活的配子.
故答案为:(1)母本 去雄套袋(2)3 ddhh Ddhh或ddHh (3)黄:绿=1:3 [1/5] (4)①减数分裂第一次分裂前期 AbeF、ABEF、ABeF、AbEF
②染色体结构变异(易位) 2点评:
本题考点: 基因的自由组合规律的实质及应用;染色体结构变异的基本类型.
考点点评: 比较容易出错的题目,该题由简入繁层层深入,要对自由组合定律的本质以及对自由组合定律变式的应用有相当的了解,才能解答完整此题,最后一问只要知道十字交叉现象的原因即可.1年前查看全部
- 在①分子 ②原子 ③质子 ④电子 ⑤离子 ⑥原子核 ⑦中子 ⑧元素中,选择合适的概念填空:
在①分子 ②原子 ③质子 ④电子 ⑤离子 ⑥原子核 ⑦中子 ⑧元素中,选择合适的概念填空:
(1)构成物质的基本粒子是______、______、______,______是化学变化中的最小微粒,它是由______和______构成的;
(2)元素的种类由______数决定;质量很小,可以忽略的粒子是______;原子的质量由______数和______数决定;
(3)钠原子和钠离子因具有相同的______数,故属于同种______;
(4)氯化钠是由钠______和氯______构成的;
(5)带电的基本粒子是______. 变冷的咖啡1年前1
变冷的咖啡1年前1 -
 大大富翁 共回答了17个问题
大大富翁 共回答了17个问题 |采纳率94.1%解题思路:(1)根据构成物质的微粒有分子、原子、离子以及原子的结构进行解答;
(2)根据元素的种类由质子数决定以及电子的质量很小进行解答;
(3)根据钠原子和钠离子因具有相同的质子数进行解答;
(4)根据氯化钠是由钠离子和氯离子构成进行解答;
(5)根据微粒的带电情况进行解答.(1)构成物质的微粒有分子、原子、离子;原子是化学变化中的最小微粒,它是由核外电子和原子核构成的;
(2)元素的种类由质子数决定,电子的质量很小,所以原子的质量由质子数和中子数决定;
(3)钠原子和钠离子因具有相同的质子数,故属于同种元素;
(4)氯化钠是由钠离子和氯离子构成;
(5)分子、原子、中子不带电,而质子和原子核带正电,电子带负电,离子也带有电荷.
故答案为:(1)分子;原子;离子;原子;原子核;核外电子;
(2)质子;电子;质子;中子;
(3)质子;元素;
(4)离子;离子;
(5)质子、电子、离子、原子核.点评:
本题考点: 分子、原子、离子、元素与物质之间的关系;原子的定义与构成;元素的概念.
考点点评: 本题难度不大,主要考查了构成物质的微观粒子方面的知识,掌握常见物质的粒子构成、原子的概念、构成等是正确解答本题的关键.1年前查看全部
- 在分子、原子、原子核、质子、中子、电子等粒子中,找出符合下列条件的粒子,并填在相应的横线上.
在分子、原子、原子核、质子、中子、电子等粒子中,找出符合下列条件的粒子,并填在相应的横线上.
⑴ 有些物质由()构成,如氧气等,有些物质则由()构成如铁等
⑵ 能保持氧气的化学性质的是氧(),能保持铁的化学性质的是铁()
⑶ 化学变化中最小的粒子是()
⑷ 带正电荷的是(),带负电荷的是(),不显电性的是()
⑸ 质量与一个氢原子质量约相等的是()
⑹ 在同一个原子中数目一定相等的是() 醉亦醒1年前4
醉亦醒1年前4 -
 wishmerill 共回答了14个问题
wishmerill 共回答了14个问题 |采纳率92.9%1、 有些物质由(分子)构成,如氧气等,
有些物质则由(原子)构成如铁等
2、 能保持氧气的化学性质的是氧(分子),
能保持铁的化学性质的是铁(原子)
3、 化学变化中最小的粒子是(原子)
4、 带正电荷的是(质子、原子核),
带负电荷的是(电子),
不显电性的是(原子、分子、中子).
5、 质量与一个氢原子质量约相等的是(质子)
6、 在同一个原子中数目一定相等的是(质子与电子)1年前查看全部
- 在分子,原子,质子,中子,电子,原子核中 能直接构成物质微粒; 能保持物质化学性质;
 不可能不爱你1年前1
不可能不爱你1年前1 -
 c122039 共回答了23个问题
c122039 共回答了23个问题 |采纳率95.7%分子,原子能直接构成物质,离子也行
分子,原子能保持物质的化学性质,后面的不行,因为原子是保持物质化学性质的最小粒子1年前查看全部
- 一个元素的质子数和中子数相等吗?
一个元素的质子数和中子数相等吗?
我纠正,是“一个原子的质子数和中子数是否相等?”
好象“不一定”居多。但8楼的说是相等的。谁能给我最最准确的答案? 风雨同竹1年前13
风雨同竹1年前13 -
 黑鸭子96 共回答了16个问题
黑鸭子96 共回答了16个问题 |采纳率75%有些元素原子的质子数和中子数是相同的,多数都在元素周期表的前面,比如碳,氮,氧,硅,磷等.还有许多元素的质子数和中子数并不相同,中子数比质子数多,表现在元素周期表上就是 原子量>2*原子序号 的元素了,多的部分就是多出的中子的质量.比如钠,质子数为11,中子数为12,所以原子量为23.
还有的元素的不同原子质子数相同,但是中子数不同,也就是所说的同位素,比如碳(C)就有C8到C19共十二种同位素.它们的质子数都是6,而中子数则各不相同.1年前查看全部
- 下列有关化学用语表示正确的是 A. 的结构示意图: B.原子核内有10个中子,8个质子的原子: C. 离子的电离方程式:
下列有关化学用语表示正确的是
A.  的结构示意图:
的结构示意图:
B.原子核内有10个中子,8个质子的原子: 
C. 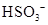 离子的电离方程式:
离子的电离方程式:
D.2g  在25℃ 101kpa下燃烧,生成液态的水放出285.8
在25℃ 101kpa下燃烧,生成液态的水放出285.8 U的热量,则该反应的热化学方程式为:
U的热量,则该反应的热化学方程式为:
 yoyoyan_198301061年前1
yoyoyan_198301061年前1 -
 gtdx 共回答了15个问题
gtdx 共回答了15个问题 |采纳率86.7%1年前查看全部
- 同种物质的原子的中子数是不是固定不变的?
 冷月傲清风1年前3
冷月傲清风1年前3 -
 zhiyan8205 共回答了21个问题
zhiyan8205 共回答了21个问题 |采纳率85.7%不是的,同素异形体就是中子数不变的.1年前查看全部
- 核能正广泛地被全世界开发和使用中核电站中核燃料和在中子的撞击下原子核发生 23题!
 晓云儿1年前1
晓云儿1年前1 -
 包包背着洋娃娃 共回答了25个问题
包包背着洋娃娃 共回答了25个问题 |采纳率88%准确点说:
核变化是原子核在变化,核反应将产生新的原子核(并非产生原子).
化学变化是原子与分子在变化,它们将形成新的原子或者分子,整个过程中原子核不变化.
好吧,貌似这答案有点长,所以概况起来我认为可以这样写:化学变化会生成新的化学分子或者原子,而核变化则会生成新的原子核(或新元素).
从严谨的角度来看再强调一次,是生成新的原子核,而不是新的原子.因为核反应的产物都是不带电子的裸原子核和高能γ射线(能量),整个过程也不需要电子的“任何帮助”,完全是由原子核内的质子与中子在执行核反应的过程.1年前查看全部
- 一些中子和质子结合在一起(原子核)为何要放出能量?
一些中子和质子结合在一起(原子核)为何要放出能量?
那为什么有些原子核(也是一堆质子中子)有足够能量靠近后不做功放出能量?
三楼答者,我再问一步,为啥有质量亏损
如果是因为强相互作用使核子放出能量,那如果有两个在铁后的原子核,让它们靠近为啥不放出能量?(强相互作用哪去了?) 千叶百合子1年前4
千叶百合子1年前4 -
 haojie83 共回答了19个问题
haojie83 共回答了19个问题 |采纳率89.5%用经典的图像来看:结合在一起后强相互作用做功,其势能转化为核的动能,然后通过辐射(放出光子)或者与其他粒子碰撞放出能量,使得核稳定存在.
用量子图像来看:结合在一起后强相互作用做功,使得核处于激发态(不是最稳定的),然后然后通过辐射(放出光子)或者与其他粒子碰撞放出能量跃迁到基态,根据质能关系从而有质量亏损.
关于问题补充:从因果关系来说应该是因为直接合成的核不稳定的激发态,需要放出能量,从而有质量亏损.
当然我们也可以反过来通过质量亏损来计算所放出的能量.
除了强相互作用外,还有电磁相互作用.而核都带正电,所以把核靠近是要提供相当大的能量来实现的.只有强相互作用放出的能量大于需要的能量才有实用价值,比如在实验室也可以实现让铁核与其他核融合形成金子,真正的点石成金,不过估计会入不敷出:).而铁核估计就是能量收支平衡点.具体还是那句话,需要强相互作用理论计算.这个就不是我所了解的了.btw,把质子结合到一起同样要先提供能量抵抗电场斥力再放出能量,比如氢弹.1年前查看全部
- 中子衰变速度与温度有关系吗?如题那中子衰变速度与什么有关,
 xx新西兰1年前3
xx新西兰1年前3 -
 ufwfn 共回答了10个问题
ufwfn 共回答了10个问题 |采纳率100%严格说来,当温度足够高(10^12K),还是有关系的.这时候中子动能足够高,热运动可以使中子发生非弹性碰撞.所以不要以为温度跟核子反应一定无关,那只是“常温”(从几K到几百万K)下才成立的.
简单来说,中子衰变速率不受任何影响.这个速率表征了从一个态到另一个态跃迁几率,是不变的.上面说的温度的影响也只是在说温度高到一定程度也许中子都不存在,这个其实不是衰变速率了,这个叫散射截面(cross-section)1年前查看全部
- 下列说法中正确的是( ) A.β衰变说明原子核里有电子 B.某原子核经过一次α衰变和两次β衰变后,核内中子数减少4个
下列说法中正确的是( ) A.β衰变说明原子核里有电子 B.某原子核经过一次α衰变和两次β衰变后,核内中子数减少4个 C.放射性物质的温度升高,其半衰期将缩短 D. 238 92 U→ 90 234 Th+ 2 4 He是核裂变反应方程  一翦秋泓1年前1
一翦秋泓1年前1 -
 wcdsy 共回答了21个问题
wcdsy 共回答了21个问题 |采纳率95.2%A、原子核里虽然没有电子,但是核内的中子可以转化成质子和电子,产生的电子从核内发射出来,这就是β衰变,故A错误.
B、某原子核经过一次α衰变电荷数减小2,质量数减小4,再经过两次β衰变后,质量数不变,电荷数要增加2,所以整个过程质量数减小4,电荷数不变,所以核内中子数减少4个.故B正确.
C、半衰期的长短是由原子核内部本身的因素决定的,与原子所处的物理、化学状态无关,放射性物质的温度升高,其半衰期将不变.故C错误.
D、 238 92 U→ 90 234 Th+ 2 4 He是α衰变,故D错误.
故选B.1年前查看全部
- 子罕说宝中子罕置诸其里的诸是什么意思?
 芭比红果1年前1
芭比红果1年前1 -
 末日博士008 共回答了17个问题
末日博士008 共回答了17个问题 |采纳率70.6%诸:它,指这块玉.1年前查看全部
- 已知一种碳原子(含6个质子和6个中子的碳原子)的质量是1.993×10-26KG,若镁的相对原子质量是24.035,那么
已知一种碳原子(含6个质子和6个中子的碳原子)的质量是1.993×10-26KG,若镁的相对原子质量是24.035,那么
已知一种碳原子(含6个质子和6个中子的碳原子)的质量是1.993×10-26KG,若镁的相对原子质量是24.035,那么一个镁原子的实际质量为多少? yp199005161年前3
yp199005161年前3 -
 wendy100 共回答了15个问题
wendy100 共回答了15个问题 |采纳率86.7%此C的相对原子数是12
m=1.993×10-26KG
12/1.993×10-26KG=24.035/m(Mg)
m=3.986×10-26KG1年前查看全部
- 铜-63的中子数、质子数、核电荷数?
铜-63的中子数、质子数、核电荷数?
貌似我这个练习题上的一个答案是:中子数是29诶? VIIdays1年前1
VIIdays1年前1 -
 背着蛋壳 共回答了18个问题
背着蛋壳 共回答了18个问题 |采纳率100%质子数是29,中子数是63-29=34,核电荷数是291年前查看全部
- 有几个化学题1 科学家发现一种新元素,它的原子核内有111个质子161个中子则该元素原子核外电子数是2 空气中含量最多的
有几个化学题
1 科学家发现一种新元素,它的原子核内有111个质子161个中子则该元素原子核外电子数是
2 空气中含量最多的元素 用元素符号表示
3 人体中含量最多的元素 用元素符号表示
4 地壳中含量最多的元素
5 计算硝酸铵中各元素的质量比 湘非州1年前5
湘非州1年前5 -
 hrjyz 共回答了25个问题
hrjyz 共回答了25个问题 |采纳率92%1、核外电子数=质子数=111
2、空气中含量最多的是氮元素,元素符号 N
3、人体中含量最多的是氧元素,元素符号 O
4、地壳中含量最多的是氧元素,元素符号 O
5、硝酸铵化学式:NH4NO3
氮元素:氧元素:氢元素=14×2:16×3:1×4=7:12:11年前查看全部
- 子思荐苟变中子思在文中的重要的用才观点是( ),你如何理解?
 lioulangzhe1年前1
lioulangzhe1年前1 -
 395003677 共回答了14个问题
395003677 共回答了14个问题 |采纳率78.6%用才观点是:取其所长,弃其所短
我认为要重视任用人才,不能因为小小的错误而埋没人才,如果想用人才的话,就必须要懂得扬长避短的道理.1年前查看全部
- α粒子散射实验结果能不能表明原子核由带正电的质子和不带电的中子组成?
 xiaoding20031年前1
xiaoding20031年前1 -
 edisonrei13 共回答了16个问题
edisonrei13 共回答了16个问题 |采纳率100%因为α粒子散射后,有小部分被反射了,所以可以证明原子中有一个质量很大、体积很小的带正电的粒子(即质子).就命名为原子核.中子是不带电的,后面知道的,但不能证明.1年前查看全部
- 中子和强子谁大
 风中观雨1年前1
风中观雨1年前1 -
 不再任性了 共回答了21个问题
不再任性了 共回答了21个问题 |采纳率95.2%1964年,美国科学家盖尔曼.提出了关于强子结构的夸克模型.强子是粒子分类系统的一个概念,质子、中子都属于强子这一类.1年前查看全部
- 一道化学选择题,已知R3+离子核外有a个电子,b个中子.表示R原子符号正确的是这道
 海边的鱼儿1年前2
海边的鱼儿1年前2 -
 起范的十一只猫 共回答了11个问题
起范的十一只猫 共回答了11个问题 |采纳率100%首先判断其离子中带电子状态.带2个正电荷的A阳离子比带2个负电荷的B阴离子少8个电子,正电荷是原子失电子形成的,相反,负电荷是原子得电子形成的,因此带2个正电荷的A阳离子就是A原子失去2个电子形成的,而带2个负电荷的B阴离子是B原子得到2个电子形成的.A原子有n个电子(这个你应该懂得为什么),假设B原子有x个电子.那么,带2个正电荷的A阳离子所带电子数为n-2,而带2个负电荷的B阴离子所带电子数为n+2,而这两个离子带电子数之间有个数量关系
n-2+8=x+2 易得x=n+4 也就是说B的原子序数为n+4(原因同上面A原子电子数为n)
因此选A.1年前查看全部
- 某+2价金属元素的氯化物汇中含氯64%,又知其原子核内质子数等于中子数,求该金属元素的相对原子质量及其氯化物的化学式
 羊咩咩20031年前1
羊咩咩20031年前1 -
 消失的鼠子 共回答了18个问题
消失的鼠子 共回答了18个问题 |采纳率83.3%M/71=36/64 解M=40 20号元素-CaCl21年前查看全部
- 锆(Zr)的一种氧化物是耐高温的新型陶瓷材料,经测定,锆原子核内有51个中子,核外有40个电子,其氯化物的相对分子质量为
锆(Zr)的一种氧化物是耐高温的新型陶瓷材料,经测定,锆原子核内有51个中子,核外有40个电子,其氯化物的相对分子质量为233,若锆的氯化物和氧化物中锆的化合价相同.则氧化物的化学式为( )
A. Zr2O
B. ZrO
C. Zr2O3
D. ZrO2 溪里鱼1年前1
溪里鱼1年前1 -
 安眠花宝 共回答了20个问题
安眠花宝 共回答了20个问题 |采纳率90%解题思路:就原子来说,质子数=原子序数=核外电子数,质子数+中子数=相对原子质量.首先计算出锆原子的相对原子质量,然后根据氯化物的相对分子质量为233,可以算出锆元素的化合价,最后写出氧化物的化学式.就原子来说,质子数=原子序数=核外电子数,质子数+中子数=相对原子质量.根据题目信息可知,锆原子核内有51个中子,核外有40个电子,所以质子有40个,相对原子质量=51+40=91.
设锆元素的化合价为+X,其氯化物的化学式为:ZrClx,
∵锆的氯化物的相对分子质量为233.
∴91+35.5X=233
得:X=4
∵在锆的氧化物中锆的化合价是+4价,氧元素的化合价是-2价.
∴氧化物的化学式为:ZrO2,故选D.点评:
本题考点: 有关化学式的计算和推断;常见元素与常见原子团的化合价;化合价规律和原则.
考点点评: 掌握相对原子质量和质子、中子之间的关系式,学会根据化合价书写物质的化学式.1年前查看全部
- 试说明分子原子原子核质子中子电子正离子负离子
试说明分子原子原子核质子中子电子正离子负离子
其中哪几种带电粒子能参与导电形成电流?它们的运动方向和规定的电流方向有什么关系? F12TT1年前2
F12TT1年前2 -
 杨敏君 共回答了18个问题
杨敏君 共回答了18个问题 |采纳率94.4%1、通常所说的导线中的电流是由电子参与形成的.其方向与电子运动方向相反.
2、阴阳离子也可以形成电流,不过这主要发生在电池中.在电池中阴阳离子在正负极之间发生对流,电流方向为阳离子的流向,也是阴离子流动方向的相反方向.
3、若用电解液导电,则电流流向同2中情况.1年前查看全部
大家在问
- 1把下列句子整理成一段通顺的话当龙卷风越过浅海时,把小鱼卷上天空 .他觉得奇怪 ,鱼一向生活在江河湖海里的 .这里既没有江
- 2rail 和track的区别2者均作‘铁轨,轨道’讲时,
- 3说一个家庭Greens谓语是复数还是单数?
- 4骨在运动中起什么作用骨在运动中起( ) A.杠杆作用 B.动力作用 C.支点作用 D.支持作用
- 5英语翻译孔子是中国教育史上第一个将毕生精力从事教育事业的教育家,是我国古代最伟大的教育家,其教育思想与当前素质教育有很多
- 6总价除以数量等与什么
- 7“希望小学和和平小学举行乒乓球比赛的一局比分是14比12,这这局比赛平均每队得13分.
- 8双曲线其标准方程.没教过 做不来1.与X^2+(y-1)^2=1和X^2+(y-1)^2=4都外切2.与(X+3)^2+
- 9一.在三角形ABC中,a,b,c分别是角A,B,C的对边,且(a+b+c)(b+c-a)=3bc
- 10has a copy of .printed的意思
- 11(3分)下图是人的心脏结构示意图,请据图回答问题
- 12What are the links between health risks and environmental po
- 13β-环糊精包葛根素用什么溶剂溶?我知道可溶于水.我在做实验,用乙醇做过溶剂,但不行,所以我现在想要除了这两个以外的答案.
- 14请问 ceremony 这个单词如何记忆
- 15本大题共4小题,共27分。阅读下面的作品,完成小题。







