4p亚层中轨道的主量子数是?角量子数是?亚层的轨道最多可以有?种空间取向,最多可容纳__个电子.
 生命中的碧海蓝天2022-10-04 11:39:541条回答
生命中的碧海蓝天2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 ziningshuixi 共回答了15个问题
ziningshuixi 共回答了15个问题 |采纳率93.3%- 4 ; 1; 3 (z x y); 6
- 1年前
相关推荐
- 高二化学中 价电子什么意思 还有亚层怎么理解?谢谢了 急急急!
 limi2501年前7
limi2501年前7 -
 xystring 共回答了14个问题
xystring 共回答了14个问题 |采纳率100%价电子可以说是原子中最外层的电子,更准确的说是能够形成化合价的最外层电子数,即容易发生电子得失的外层电子数,因为有时候有些原子失去最外层电子后还会继续失去电子,不过这种情况一般很少发生,只要记住几个特例就行了.
至于电子亚层,根据原子轨道能级的相对高低,可划分为若干个电子层,K、L、M、N、O、P、Q….同一电子层又可以划分为若干个电子亚层,如s、p、d、f等.每个电子亚层包含若干个原子轨道.所以电子亚层是在电子层下更为围观层面的部分,这个是有关化合价的.1年前查看全部
- 在多电子原子中,同一电子亚层的轨道被称为简并轨道,它们具有________的能量.
 淡水河边1231年前1
淡水河边1231年前1 -
 appleapplell 共回答了18个问题
appleapplell 共回答了18个问题 |采纳率88.9%简并轨道具有 相同 能量.1年前查看全部
- 当主量子数是4时,请指出包含的亚层和各亚层的轨道数.
 哂然1年前1
哂然1年前1 -
 糖果婴儿 共回答了21个问题
糖果婴儿 共回答了21个问题 |采纳率85.7%当主量子数n=1,有一个亚层 s,轨道数为1;当n=2有两个亚层,即2s、2p,轨道数为4;当n=3有三个亚层,即3s、3p、3d,轨道数为9.当n=4有4s、4p、4d、4f四个亚层,轨道数为16.
各亚层的轨道数为n的平方个.1年前查看全部
- 3p亚层有一个空轨道的原子 和 核外电子排布式是 1S2 2S2 2P6 3S2 3P6 4S2
3p亚层有一个空轨道的原子 和 核外电子排布式是 1S2 2S2 2P6 3S2 3P6 4S2
的原子 是不是一定是同一个原子 li2005tiange1年前2
li2005tiange1年前2 -
 wiyi21 共回答了26个问题
wiyi21 共回答了26个问题 |采纳率96.2%不是.
3p亚层有一个空轨道的原子价电子应该是3S2 3P2 即第三周期第四主族的元素硅
核外电子排布式是 1S2 2S2 2P6 3S2 3P6 4S2
的原子是第四周期第二主族的元素钙1年前查看全部
- 什么是s亚层(化学)?谢谢
 panzhiyun11年前2
panzhiyun11年前2 -
 坤行者 共回答了18个问题
坤行者 共回答了18个问题 |采纳率83.3%相同电子层中电子能量有微小差别,电子云形状也不相同,可把一个电子层分为几个亚层.在同一电子层中,电子的能量有差异,电子云的形状也不相同.因此电子层还可分成一个或n个电子亚层.s亚层(x=0)的电子云形状为球形对称.1年前查看全部
- 1s<2s<2p<······亚层前加个数字是什么意思,
1s<2s<2p<······亚层前加个数字是什么意思,
第五层有几亚层?六呢?七呢?是不是从四层以后都是spdf呢? guanggan0011年前1
guanggan0011年前1 -
 tby2016 共回答了22个问题
tby2016 共回答了22个问题 |采纳率86.4%在这里指的是主层数,比如,C的电子排布为2、4,写成电子精细排布就为1S2 2S2 2P2(大写字母后面的数字理应写在右上角,但条件如此,望LZ见谅).表示第一主层里有一个S轨道,填充了2个电子,第二主层里有四个电子,有2个填充在S亚层里,2个填充在P亚层里.
希望能对您有所帮助,1年前查看全部
- N电子层的S亚层和P亚层中只有一个不成对电子的元素有哪些?
 苹果脸的小妞1年前1
苹果脸的小妞1年前1 -
 allqzc 共回答了23个问题
allqzc 共回答了23个问题 |采纳率78.3%K Sc V Mn Co
可能是 不确定.1年前查看全部
- 1.处于同一电子层的两个电子为什么能两一定相同,而不是可能相同呢?不是电子层还要分亚层的吗?那么电子分别在同电子层的S.
1.处于同一电子层的两个电子为什么能两一定相同,而不是可能相同呢?不是电子层还要分亚层的吗?那么电子分别在同电子层的S.P.D.F.上,不是F大,
2.原子序数越大,相对原子质量越大,为什么是错的呢?
你说的有些没听过诶。
相对原子质量接近于质子数和中子数之和那不就是质量数吗?不是越来越大吗? luvgirl1年前2
luvgirl1年前2 -
 winrar1026 共回答了16个问题
winrar1026 共回答了16个问题 |采纳率81.3%你说的两个电子是在一个亚层上.一个轨道上只有自旋相反的电子.他们的前三个量子数都相同,只有自旋量子数互为相反数.所以能量相同,因为自旋量子数和能量没有关系的.
还有你说的S P D F什么的,还要分的,因为S上只有一个轨道 所以两电子能量相同
而P还分三个轨道的,P1 P2 P3他们的能量也不同,仅仅是主量子数相同而已,所以具体到每个轨道上能量又是有差别的.
而且有的情况下,S和P上的电子能量相等,甚至还要大.这些都是大学的内容.我不清楚你现在上的是什么学校.具体你能理解多少就多少了.不明白可以去为老师,当面说是比较清楚的.
原子序数和相对原子量是没有特定关系的,因为两者标准不一样.前者是原子自身核电荷数定的,后者是它的质量相对于碳12讲的.
还有一个看法就是相对原子质量接近于质子数和中子数之和,他们的差别就在于有时中子数过大.对于同位素最明显的.1年前查看全部
- 各亚层的轨道数是根据_____确定的,每个轨道上只能容纳____个电子,而且自旋方向____.
 我快乐你快乐1年前3
我快乐你快乐1年前3 -
 南山青竹 共回答了26个问题
南山青竹 共回答了26个问题 |采纳率92.3%各亚层的轨道数是根据(磁量子数)确定的,每个轨道上只能容纳(2)个电子,而且自旋方向(相反).1年前查看全部
- 电子亚层为什么氯原子最外两个亚层的电子排布是3s2 3p5,而不是3s1 3p6?后者s层为半满,p层为全满,这样能量不
电子亚层
为什么氯原子最外两个亚层的电子排布是3s2 3p5,而不是3s1 3p6?后者s层为半满,p层为全满,这样能量不是更小嘛? 还有一年99881年前1
还有一年99881年前1 -
 我听不见彩虹 共回答了16个问题
我听不见彩虹 共回答了16个问题 |采纳率93.8%电子填充各亚层的顺序是先3s层再3p层,也就是说在3s层已经填满的前提下才会填充3p层.而且所谓的半充满这样的变动是与比其能级高的s层之间的调整,而不是比自己低的s层.半充满全充满的实质是使能量更低,故高能级的电子可以降到低轨道,若氯原子亚层排列变成3s1 3p6,实际上是低轨道的跃迁到了高轨道,能量反而升高了1年前查看全部
- 化学中的电子在电子亚层:s,p,d,f的电子排布分布情况!
化学中的电子在电子亚层:s,p,d,f的电子排布分布情况!
是原子结构…
是先后,先排哪层,后排哪层, X1122101年前1
X1122101年前1 -
 名字比密码还难想 共回答了15个问题
名字比密码还难想 共回答了15个问题 |采纳率73.3%亚层s、p、d、f分别有1、3、5、7个原子轨道,每个轨道最多可容纳2个电子,能量由低到高排布.按洪特规则和能量最低原理填充电子,先填充s轨道,填满后再填充p轨道,依次往上填充.由于p、d、f轨道各有3个、5个、7个能量相等的轨道,所以填充时,先分占各个轨道.如p亚层,若电子数不足五个,先分占三个p轨道(是三个电子就各占一个p轨道,并且取相同方向自旋).d亚层只是把轨道数增加到5个,其它和p类似.同一轨道中有两个电子时,取相反方向自旋.1年前查看全部
- Z原子 l电子层的P亚层上有一条空轨道
Z原子 l电子层的P亚层上有一条空轨道
Z是什么 有没有结构单元是正四面体 付弓1年前1
付弓1年前1 -
 丑芽儿 共回答了19个问题
丑芽儿 共回答了19个问题 |采纳率94.7%电子层K,L,M,N…即第二周期P区元素,有一条空轨道说明电子数为2,为碳元素.剩下的就不难了吧?金刚石1年前查看全部
- 如何判断每一周期能够容纳多少元素?老师说第八周期有50个元素,因为有s,p,d,f,g五个亚层
如何判断每一周期能够容纳多少元素?老师说第八周期有50个元素,因为有s,p,d,f,g五个亚层
为什么是5个亚层,这是怎么判断有几个亚层的? haijin811年前1
haijin811年前1 -
 li4miss 共回答了20个问题
li4miss 共回答了20个问题 |采纳率90%2n-1层 2n^2个
2n层 2(n+1)^2个、
你可以查下元素周期表各周期元素数的推算1年前查看全部
- 电子云正负号s亚层的为+p、d等都分+、-,这个符号有什么意义呢?只知道在形成共价键时要对称性匹配
 ylcxj1年前2
ylcxj1年前2 -
 浪迹nn的孤鹰 共回答了15个问题
浪迹nn的孤鹰 共回答了15个问题 |采纳率80%+ .-表示电子云的“波性”相反,+区的函数取正值,-区的函数取负值
+与+叠加时,波的振幅将增大,-与-叠加时,波的振幅也增大,+与-叠加波的振幅将减小.1年前查看全部
- 什么叫亚层?
 zhywyywmy1年前2
zhywyywmy1年前2 -
 950126 共回答了15个问题
950126 共回答了15个问题 |采纳率100%电子状态由4个量子数决定:
主量子数n:对应电子层
角量子数I:对应电子亚层,I取值范围是0~n-1,共n个值
磁量子数m:对应亚层的轨道,m取值范围是-I~+I,共2I+1个值.
自旋量子数ms:对应电子的自旋方向,ms的值为+1/2或者-1/2.
打个比方,像一个住宅楼,有若干层(电子层),每层有若干个单元(电子亚层),
每个单元有若干房间(轨道),每个房间可以住男女(自旋)个一个人(电子).
亚层的符号为s,p,d,f,g……
对应I=0,1,2,3,4……
3d亚层的3就是主量子数n,d是I=2的亚层的符号.
即第三层的第三个亚层.d轨道数为2*2+1=5,最多容纳电子数为2*5=101年前查看全部
- 化学问问711.对于M电子层上有4个电子的元素原子,下列说法正确的是( )A.最外层电子构型是3s23p4B.3p亚层中
化学问问7
11.对于M电子层上有4个电子的元素原子,下列说法正确的是( )
A.最外层电子构型是3s23p4
B.3p亚层中没有空轨道
C.核外电子占有8个轨道
D.最外层成对电子数大于不成对电子数
答案:C. 但是不知道为什么这样选,希望大家帮帮忙,真的很急~ Agumpt1年前1
Agumpt1年前1 -
 gasgsadu 共回答了11个问题
gasgsadu 共回答了11个问题 |采纳率81.8%k,有一个s轨道
l,有一个s轨道,2个p轨道
m电子层上四个电子各占一个轨道,自旋方向一致,所以,占的是4个轨道
c对1年前查看全部
- 4p轨道的主量子数为?角量子数为?该亚层的轨道最多可以有?种空间取向,最多可容纳?电子
4p轨道的主量子数为?角量子数为?该亚层的轨道最多可以有?种空间取向,最多可容纳?电子
为什么呢?怎样知道的呢?方法 ldtlz1年前1
ldtlz1年前1 -
 树下听风 共回答了21个问题
树下听风 共回答了21个问题 |采纳率95.2%主量子数为4,角量子数为1,3种空间取向,容纳6个电子
主量子数N=4,即电子层数.
角量子数即S轨道I=0,P轨道I=1,以此类推.
因为P轨道有x,y,z三种空间取向,而每种取向可容纳2种自旋方向相反的电子.
(1)主量子数n
n相同的电子为一个电子层,电子近乎在同样的空间范围内运动,故称主量子数.当n=1,2,3,4,5,6,7 电子层符号分别为K,L,M,N,O,P,Q.当主量子数增大,电子出现离核的平均距离也相应增大,电子的能量增加.例如氢原子中电子的能量完全由主量子数n决定:E=-13.6(eV)/n^2
(2)角量子数l
角量子数l确定原子轨道的形状并在多电子原子中和主量子数一起决定电子的能级.电子绕核运动,不仅具有一定的能量,而且也有一定的角动量M,它的大小同原子轨道的形状有密切关系.例如M=0时,即l=0时说明原子中电子运动情况同角度无关,即原子轨道的轨道是球形对称的;如l=1时,其原子轨道呈哑铃形分布;如l=2时,则呈花瓣形分布.
对于给定的n值,量子力学证明l只能取小于n的正整数:l=0,1,2,3……(n-1)
即S轨道I=0,P轨道I=1,以此类推.
(3)磁量子数m
磁量子数m决定原子轨道在空间的取向.某种形状的原子轨道,可以在空间取不同方向的伸展方向,从而得到几个空间取向不同的原子轨道.这是根据线状光谱在磁场中还能发生分裂,显示出微小的能量差别的现象得出的结果.
磁量子数可以取值:m=0,+/-1,+/-2……+/-l
(4)自旋量子数ms
直接从Schrödinger方程得不到第四个量子数——自旋量子数ms,它是根据后来的理论和实验要求引入的.精密观察强磁场存在下的原子光谱,发现大多数谱线其实由靠得很近的两条谱线组成.这是因为电子在核外运动,还可以取数值相同,方向相反的两种运动状态,通常用↑和↓表示.1年前查看全部
- 每个亚层最多多少电子有什么规律,是不是依次加4
 岳书1年前3
岳书1年前3 -
 xss111111 共回答了18个问题
xss111111 共回答了18个问题 |采纳率83.3%s亚层2个 1*2
p亚层6个 3*2
d亚层10个 5*2
f亚层14个 7*2
亚层对应角量子数l,s:0/p:1/d:2/f:3,
对应的磁量子数m(m=0,+/-1,+/-2……+/-l)取值数量为s:1/p:3/d:5/f:7,代表不计自旋的轨道数.算上同轨道最多容纳自旋量子数相反的两个电子就得到电子亚层所能容纳的电子数了.
全文引用:
为了描述原子中电子的运动规律,Schrödinger提出了一种波动方程,现在我们称为Schrödinger方程.这个偏微分方程的数学解很多,但从物理意义看,这些数学解不一定都是合理的.为了得到原子中电子运动状态合理的解,必须引用只能取某些整数值的三个参数,称它们为量子数(下面第四个也是,但不是从Schrödinger方程求出的).
(1)主量子数n
n相同的电子为一个电子层,电子近乎在同样的空间范围内运动,故称主量子数.当n=1,2,3,4,5,6,7 电子层符号分别为K,L,M,N,O,P,Q.当主量子数增大,电子出现离核的平均距离也相应增大,电子的能量增加.例如氢原子中电子的能量完全由主量子数n决定:E=-13.6(eV)/n^2
(2)角量子数l
角量子数l确定原子轨道的形状并在多电子原子中和主量子数一起决定电子的能级.电子绕核运动,不仅具有一定的能量,而且也有一定的角动量M,它的大小同原子轨道的形状有密切关系.例如M=0时,即l=0时说明原子中电子运动情况同角度无关,即原子轨道的轨道是球形对称的;如l=1时,其原子轨道呈哑铃形分布;如l=2时,则呈花瓣形分布.
对于给定的n值,量子力学证明l只能取小于n的正整数:l=0,1,2,3……(n-1)
(3)磁量子数m
磁量子数m决定原子轨道在空间的取向.某种形状的原子轨道,可以在空间取不同方向的伸展方向,从而得到几个空间取向不同的原子轨道.这是根据线状光谱在磁场中还能发生分裂,显示出微小的能量差别的现象得出的结果.
磁量子数可以取值:m=0,+/-1,+/-2……+/-l
(4)自旋量子数ms
直接从Schrödinger方程得不到第四个量子数——自旋量子数ms,它是根据后来的理论和实验要求引入的.精密观察强磁场存在下的原子光谱,发现大多数谱线其实由靠得很近的两条谱线组成.这是因为电子在核外运动,还可以取数值相同,方向相反的两种运动状态,通常用↑和↓表示.1年前查看全部
- 关于硫原子核外电子的叙述错误的是( ) A.排布在K、L、M三个电子层上 B.3p亚层上有2个空轨道 C.共有16种不
关于硫原子核外电子的叙述错误的是( ) A.排布在K、L、M三个电子层上 B.3p亚层上有2个空轨道 C.共有16种不同的运动状态 D.共有5种不同的能量  jiangjizhi1年前1
jiangjizhi1年前1 -
 ieemodh 共回答了14个问题
ieemodh 共回答了14个问题 |采纳率100%A、原子在核外的排布:先排K层2个,再排L层8个,最后排M层是6个,故A正确;
B、3p亚层上共有3个轨道,每个轨道排布两个电子,硫原子的电子排布式为1s 2 2s 2 2p 6 3s 2 3p 4 ,3p亚层上有2个轨道只有一个单电子,无空轨道,故B错误;
C、硫原子的电子排布式为1s 2 2s 2 2p 6 3s 2 3p 4 ,每个轨道中电子的自旋方向相反,则硫原子核外的16个电子的运动状态各不相同,故C正确;
D、硫原子的电子排布式为1s 2 2s 2 2p 6 3s 2 3p 4 ,共有5个轨道上排布电子,共有5种不同的能量,故D正确.
故选B.1年前查看全部
- 关于核外电子排布的一些问题1、4个量子数到底是什么?有什么意义2、亚层上的电子是怎么回事?3、如果给你一个原子,怎么写他
关于核外电子排布的一些问题
1、4个量子数到底是什么?有什么意义
2、亚层上的电子是怎么回事?
3、如果给你一个原子,怎么写他的电子排布式.s亚层最多2个,p6,d10,f14,
然后 1s 2s 2p 3s.是依次填满么...然后再考虑洪特规则那些?
刚接触这些 不太懂 = =高手勿见怪 san4100421年前1
san4100421年前1 -
 dragonhp 共回答了16个问题
dragonhp 共回答了16个问题 |采纳率81.3%4个量子数就是接薛方程得到的合理解,用以描述电子运动的
亚层电子就是非由外到内第二层.亚层电子就是那上面的电子.有的元素反应时会涉及亚层电子变化.
电子轨道排法不是你那样的,因为涉及轨道能级交错问题:是按1s 2s 2p 3s 3p 4s 3d 4p 5 s 4d 5p 6s 4f 5d 6p ……的顺序排的.楼主如果对化学有兴趣,可以百度Hi我,大家一起探讨1年前查看全部
- 电子层各亚层轨道数是有什么确定的,最多容纳的电子数是由什么确定的
 我个吗呀1年前1
我个吗呀1年前1 -
 hjqsvc 共回答了13个问题
hjqsvc 共回答了13个问题 |采纳率69.2%你可以看看老师定的那个奥赛书
希望采纳1年前查看全部
- 题中写道 假设自旋量子数不存在 泡利不相容原理有效 试推出前四个电子层及各亚层可容纳的最高电子数 在第三电子层中 4S轨
题中写道 假设自旋量子数不存在 泡利不相容原理有效 试推出前四个电子层及各亚层可容纳的最高电子数 在第三电子层中 4S轨道尚未建立 不可能建立3D轨道 第四电子层中 5S轨道尚未建立 不可能建立4F 4D轨道 所以KLMN 依次又 1 4 4 9个电子 为什么说4S未建立不能建立3D轨道 给不给自旋量子数与这有什么关系?
 新人初到1年前1
新人初到1年前1 -
 冰薄荷 共回答了20个问题
冰薄荷 共回答了20个问题 |采纳率90%保里原理实际上说,一个原子中不能有全同电子.存在自旋的区别时,每个轨道可以容纳2电子(自旋不同),四个电子层分别充满电子就对应于稀有气体原子He,Ne,Ar,Kr.现在假定电子不存在两种不同自旋,则每个轨道只能容纳一个电子(如果有两个或更多的话,它们的量子数全部相同,违反保里原理).那么对应的每一层电子数都减半.
为什么说4S未建立不能建立3D轨道 给不给自旋量子数与这有什么关系?没有关系
不过答案的说法并不准确,应该说成对于最外层是M层时,3d轨道不会被填充(假定3s,3p都被填充后还有电子没有被填充,那么他将先填于4s轨道,而不是先填3d,这样这个原子就有4层电子了,而不是我们开始说的最外层是M层了).这个情况在真实原子(存在自旋)中也同样存在.无论有无电子填充,原子中各个轨道都是存在的,不能说成所谓建立未建立,答案的表述存在严重概念错误.
1 4 4 9的答案也是不对的.分述如下:
仅有一层:K 1s1 (1)
有两层:K 1s1,L:2s1,2p3 (1,4)
有三层:K 1s1,L:2s1,2p3,M:3s1,3p3 (1,4,4)
有四层:K 1s1,L:2s1,2p3,M:3s1,3p3,3d5,N:4s1,4p3.(1,4,9,4)1年前查看全部
- 每个层电子层与其层中有那几种亚层.例子:K层只有S亚层 L层有……一直到Q电子层
每个层电子层与其层中有那几种亚层.例子:K层只有S亚层 L层有……一直到Q电子层
例子:K层只有S亚层
L层有……一直到Q电子层 远远而来1年前1
远远而来1年前1 -
 zx1986love 共回答了21个问题
zx1986love 共回答了21个问题 |采纳率95.2%K s 2 2
L s p 2 6 8
M s p d 2 6 10 18
N s p d f 2 6 10 14 32
O s p d f (g) 2 6 10 14 32
P s p d (f)(g) 2 6 10 18
Q s p (d) (f)(g) 2 6 8
括号内的轨道,实际上没有填充电子1年前查看全部
- 每一个亚层之间有两个电子,那这电子之间有排斥力那么他们是怎样偶合在一起的?
 susancan1年前1
susancan1年前1 -
 千年等上36回 共回答了20个问题
千年等上36回 共回答了20个问题 |采纳率85%不要用宏观的眼光对待这个问题.电子出现的亚层不是宏观意义上的“轨道”,而是抽象的概率分布的空间区域,可以由电子在某个给定的状态下的波函数解得.根据量子力学的测不准原理,无法同时精确预言一个微观粒子的位置和动量,所以这样地分析亚层中的两个电子之间直接的作用是没有意义的.1年前查看全部
- 铁元素失电子过程,为什么先失去第四层两个电子后失去3d亚层轨道上的一个电子
 85656061年前2
85656061年前2 -
 lingao0898 共回答了14个问题
lingao0898 共回答了14个问题 |采纳率92.9%基本上所有元素都是先失掉最外层电子,然后是内层.这不考虑能量最低原理.1年前查看全部
- 处在2p亚层上仅有的两个电子自旋方向相同
处在2p亚层上仅有的两个电子自旋方向相同
这句话对的还是错的?注意是仅有的 l57581年前3
l57581年前3 -
 darksun_2007 共回答了21个问题
darksun_2007 共回答了21个问题 |采纳率95.2%正确,因为根据洪特规则,电子总是填入不同的等价轨道,而且自旋方向相同,所以2p2 的两个电子是分占不同的2 p轨道,而且自旋方向相同1年前查看全部
- spd原子轨道杂化——pcl5p价层电子组态3s2 3p3,形成pcl5分子的过程中,3s2的电子一个激发到3d亚层,然
spd原子轨道杂化——pcl5
p价层电子组态3s2 3p3,形成pcl5分子的过程中,3s2的电子一个激发到3d亚层,然后3s 3p 3d发生杂化.p作为20号以前元素,能级应该还是3s 3p 4s 3d,电子为何不激发到4S上呢? 远来远三1年前4
远来远三1年前4 -
 otccc 共回答了21个问题
otccc 共回答了21个问题 |采纳率95.2%能级排序是3s 3p 4s 3d,前提是轨道上有电子.但是p在3p轨道上没有电子,能级排序是3d 4s1年前查看全部
- 电子在各亚层中的排布为什么4s比3d靠前?
电子在各亚层中的排布为什么4s比3d靠前?
有这么句话(在百科里的)
“这两种作用的总结果可以得出电子在原子核外排布时遵守下列次序:1s、2s、2p、3s、3p、4s、3d、4p…… ”
查表知3d在M层,4s在N层.难道4s比3d能量小吗?为什么,按理说是3d在4s前呀?
对化学0基础.若问题可笑,强不要见怪】 kuandou1年前1
kuandou1年前1 -
 徐子陵天火 共回答了14个问题
徐子陵天火 共回答了14个问题 |采纳率92.9%对,4s能量就是比3d小
能量=n+0.7L
这个n就是层数,
4s层的L=0,3d层的L=2,所以4s的能量为4,3d的能量为4.4
所以4s比较稳定1年前查看全部
- 为什么电子所处的亚层不同,它的几率分布形状(轨迹)就不同?
为什么电子所处的亚层不同,它的几率分布形状(轨迹)就不同?
有些电子运动轨迹是对称球,而有些是哑铃型,造成这种不同的根本原因是什么? 一个殇人1年前2
一个殇人1年前2 -
 话兜兜 共回答了7个问题
话兜兜 共回答了7个问题 |采纳率85.7%根本考虑应该还是 电子与原子核之间力的问题
力改变了电子运动状态
.不过微观的话 ,貌似不可以使用经典理学解释吧.忽略我的吧
能量却是在微观宏观都实用的哈1年前查看全部
- 关于核外电子运动状态的问题有说法“某电子层中所含亚层数等于该电子层的层数”如K层有1个亚层(s);L层2个亚层(s,p)
关于核外电子运动状态的问题
有说法“某电子层中所含亚层数等于该电子层的层数”如K层有1个亚层(s);L层2个亚层(s,p);M层3个亚层(s,p,d);N层4个亚层(s,p,d,f)……但是O层以后一直到第七周期Q层都只有4个亚层s、p、d、f了,这是为什么呢?虽然我知道目前直到第七周期填满也不需要g亚层,因为四个亚层已经够用了,但是这不就不符合这种说法了吗?
而且根据元素周期表,第三周期并没有排到d亚层,最后一个元素Ar也只有到3p6,虽然我也知道这是因为能级交错的关系3d的能量比4s高,所以要先排满4s才能轮到3d,那这样不就不符合“M层有3个亚层”这种说法了吗?
求解释~~~~~~~急! duanduanup1年前2
duanduanup1年前2 -
 哭吧DA男人 共回答了13个问题
哭吧DA男人 共回答了13个问题 |采纳率92.3%标准说法是,主量子数n可取值1,2,3,4,5……对应的角动量字数l可取值0,1,2,3,4……n-1.电子层数即主量子数,亚层即角动量数.你所说的那些亚层都存在着,只是没有电子.第三周期确实没有排到d亚层,但不能否认d亚层的存在,在某些激发态的第三周期粒子中存在d电子的.1年前查看全部
- 电子排布表达式在用轨道表示式画电子分布得时候亚层d会不会出现?比如说:Cu得轨道表达式具体该怎么画?
 徐雪芳1年前3
徐雪芳1年前3 -
 注定成灰 共回答了15个问题
注定成灰 共回答了15个问题 |采纳率100%不需要区分亚层.
Cu 2 8 18 11年前查看全部
- 氮原子为什么不稳定?氮原子的核外电子排布是:1s22s23px3py3pzp亚层处在半满状态,为什么不稳定呢?
 rikku81年前2
rikku81年前2 -
 LOVE婷婷LOVE 共回答了22个问题
LOVE婷婷LOVE 共回答了22个问题 |采纳率86.4%氮原子是七号元素,第一层电子数是二,第二层电子数是五,也就是最外层电子数是五,所以他
容易与其他电子结合形成八个电子的稳定状态,所以比较活泼1年前查看全部
- 原子结构和核外电子排布2、现代原子结构理论认为,在同一电子层上,可有s、p、d、f、g、h……等亚层,各亚层分别有1、3
原子结构和核外电子排布
2、现代原子结构理论认为,在同一电子层上,可有s、p、d、f、g、h……等亚层,各亚层分别有1、3、5……个轨道.试根据电子填入轨道的顺序预测:
(1)第8周期只有____________种元素.
(1)根据电子的填充特点:(n-3)g(n-2)f(n-1)d n s n p,可知在第8周期中,含有s、p、d、f、g,其填充的元素种数为:1×2+3×2+5×2+7×2+9×2=50(种).
这个根据电子的填充特点:(n-3)g(n-2)f(n-1)d n s n
我做题都是根据那个原子轨道近似能级图,结果那个图最上面是7S就结束了,根本就不存在8能级, 伊休仇1年前1
伊休仇1年前1 -
 ii之仙 共回答了15个问题
ii之仙 共回答了15个问题 |采纳率93.3%现在元素周期表也到7,说8是一种推测,一种假设.
其实,就是把所有轨道排满需要多少个电子.
s层只有1个轨道,能排1*2个电子;p层能排3*2个电子;d层能排5*2个电子;f:7*2;g:9*2.
至于你说的填充特点,其实是这么回事.以第七周期为例,是[Rn]5f6d7s7p,这时主量子数n=7,n-2=5;n-1=6.你只要学过的东西类推就行了.1年前查看全部
- 有关电子亚层的为什么41号元素Nb最外层是4d25s1而其上面元素的23号元素V最外层是3d34s2,这样一来不是有点不
有关电子亚层的
为什么41号元素Nb最外层是4d25s1
而其上面元素的23号元素V最外层是3d34s2,
这样一来不是有点不对劲了吗
还有洪特原则说的什么半充满是针对什么来讲的 打得好有奖哦~ spirit07151年前1
spirit07151年前1 -
 向左看 共回答了26个问题
向左看 共回答了26个问题 |采纳率96.2%规则是规则,规则是经验,而实际的电子是用光谱测得的.规则只是大体的方向,偶尔有那么一两个非主流的……像钯还是d10呢……1年前查看全部
- 某原子的3d亚层中有1个电子时,则其N层的电子总数可能是 ( )
某原子的3d亚层中有1个电子时,则其N层的电子总数可能是 ( )
能级交错现象! 网络互换1年前2
网络互换1年前2 -
 咖啡爱情_zz 共回答了13个问题
咖啡爱情_zz 共回答了13个问题 |采纳率100%2个1年前查看全部
- 关于主量子数和角量子数的问题4p轨道的主量子数为( ),角量子数为( ),该亚层的轨道最多可以有( )种空间取向,最多可
关于主量子数和角量子数的问题
4p轨道的主量子数为( ),角量子数为( ),该亚层的轨道最多可以有( )种空间取向,最多可容纳( )个电子.
这种类型的题怎么做,若果不是4p 而是3d结果是多少? 雪兆春1年前1
雪兆春1年前1 -
 落下雨 共回答了23个问题
落下雨 共回答了23个问题 |采纳率78.3%原子4p轨道:主量子数n=4,角动量量子数l=1,该亚层(l=1)最多可有3种空间取向(即对应的磁量子数):m={-1,0,1},
现在算最多可容纳的电子数:
前三层是满壳层,n=1:2x1^2=2; n=2:2x2^2=8; n=3:2x3^2=18,乘以2的系数对应的是考虑电子(费米子)在处于同一量子态时两种可能的自旋.
第四层到l=1可以容纳2x(1+3)=8个电子,总计2+8+18+8=36个电子.
如果3d轨道:主量子数n=3,角动量量子数l=2,该亚层上(l=2)最多可由5种空间取向:m={-2,-1,0,1,2}
前两层满壳层,共有2+8=10个电子,第三层到l=2可以容纳2x(1+3+5)=18个电子(所以也是满壳层,l最大为n-1).
所以该原子最多有10+18=28个电子.
轨道角量子数用s,p,d,f..标记,从0开始记.所以p对应l=1,d对应l=2.
找本原子物理学,或者量子力学,或者量子化学,那种导论版的,都有介绍.1年前查看全部
- 基态35Br原子的4P亚层中有1个成单电子,该电子的量子数值为:n= l= m= ms=
 东郭子1年前1
东郭子1年前1 -
 w夜夜笙歌 共回答了18个问题
w夜夜笙歌 共回答了18个问题 |采纳率88.9%4P亚层:n=4 l=1
m=0,+1,-1
ms=+1/2 或-1/2
因此基态35Br原子的4P亚层中有1个成单电子:
n=4 l=1 m=0 ms=+1/2 或-1/2
n=4 l=1 m=+1 ms=+1/2 或-1/2
n=4 l=1 m=-1 ms=+1/2 或-1/2
六选择一,自选1年前查看全部
- A、B、C、D、E五种元素,其中A、B、C属同一周期,A原子最外层的p亚层的电子数等于其次外层的的电子总数;B原子最外层
A、B、C、D、E五种元素,其中A、B、C属同一周期,A原子最外层的p亚层的电子数等于其次外层的的电子总数;B原子最外层中有2个不成对电子;D、E原子核内各自质子数和中子数相等;B元素可分别与A、C、D、E形成RB2型化合物,并知在DB2与EB2中,D与B的质量比为7:8,E与B的质量比为1:1.根据以上条件,推断A、B、C、D、E的元素符号.
哪位帮我看一下吧.
A是C
B是O
应该没错吧.
另外三个.不清楚啊.
很急丫.唉.谢谢~~ 洪华1年前1
洪华1年前1 -
 chaoshenme 共回答了17个问题
chaoshenme 共回答了17个问题 |采纳率88.2%A是C
B是O
这两个很好推,根据D、E原子核内各自质子数和中子数相等可以得出只有Si 和 S了 再根据B元素可分别与A、C、D、E形成RB2型化合物,并知在DB2与EB2中,D与B的质量比为7:8,E与B的质量比为1:1可以得出D和E
最后A、B、C属同一周期且B元素可分别与C形成RB2型化合物那么在第二周期的也只有N和C了所以
A是C
B是O
C是N
D是Si
E是S1年前查看全部
- D元素的正三价离子的3d亚层为半充满,D是?
 黑麦核桃20061年前1
黑麦核桃20061年前1 -
 茉优高高 共回答了20个问题
茉优高高 共回答了20个问题 |采纳率95%Fe
Fe原子的电子排布式是:1s2 2s2 2p6 3s2 3p6 3d6 4s2
Fe3+的电子排布式是:1s2 2s2 2p6 3s2 3p6 3d51年前查看全部
- ※现代原子结构理论认为,在同一电子层上,可有s、p、d、f、g、h……等亚层,各亚层分别有1、3、5、……个轨道.试根据
※现代原子结构理论认为,在同一电子层上,可有s、p、d、f、g、h……等亚层,各亚层分别有1、3、5、……个轨道.试根据电子填入轨道的顺序预测: (2)原子核外出现第一个6f电子的元素的原子序数是 --------- ; (3)根据“稳定岛”假说,第114号元素是一种稳定同位素,半衰期很长,可能在自然界都可以找到.试推测第114号元素属于 -------周期,---------- 族元素,原子的外围电子构型是---------- (求高人解答要过程)
 xionghaox1年前1
xionghaox1年前1 -
 wen1020531 共回答了13个问题
wen1020531 共回答了13个问题 |采纳率100%(2)6f:8s 6f 7d 8p;
因此可以推出是118 + 3 = 121;
但考虑到8s2 6f1的稳定性不如8s2 6f0 7d1(洪特规则特例,f轨道全空稳定,参见第六、第七周期电子排布),因此真正填充第1个6f电子的是122号元素.
(3)第七周期 IVA族(C族)7s2 7p2 (第七周期排满是118,114 = 118-4 = IVA)1年前查看全部
- 已知元素的原子序数怎么求它的位置和电子构型(亚层那个)
 kongzhongyouyu1年前1
kongzhongyouyu1年前1 -
 anleywang 共回答了19个问题
anleywang 共回答了19个问题 |采纳率94.7%先把主要电子层推出来,有规律的 次外的亚层就凑吧1年前查看全部
- 原子结构和核外电子排布2、现代原子结构理论认为,在同一电子层上,可有s、p、d、f、g、h……等亚层,各亚层分别有1、3
原子结构和核外电子排布
2、现代原子结构理论认为,在同一电子层上,可有s、p、d、f、g、h……等亚层,各亚层分别有1、3、5……个轨道.试根据电子填入轨道的顺序预测:
(1)第8周期只有____________种元素.
(1)根据电子的填充特点:(n-3)g(n-2)f(n-1)d n s n p,可知在第8周期中,含有s、p、d、f、g,其填充的元素种数为:1×2+3×2+5×2+7×2+9×2=50(种).
这个根据电子的填充特点:(n-3)g(n-2)f(n-1)d n s n
我做题都是根据那个原子轨道近似能级图,结果那个图最上面是7S就结束了,根本就不存在8能级, junjune1年前2
junjune1年前2 -
 jesshpa 共回答了14个问题
jesshpa 共回答了14个问题 |采纳率92.9%是不存在8能级或者尚未发现,不然还要你预测么?
(n-3)g (n-2)f (n-1)d ns np的意思是:举例来说,第八能级,n
=8,外层电子排布为:5g 6f 7d 8s 8p,不过一般以ns轨道开始,np轨道结束,记作8s5g6f7d8p1年前查看全部
- 正六价的铁的电子排布是什么样?各个亚层有多少电子
正六价的铁的电子排布是什么样?各个亚层有多少电子
各个亚层有多少电子? lily09_811年前1
lily09_811年前1 -
 想做新娘 共回答了14个问题
想做新娘 共回答了14个问题 |采纳率92.9%铁还有正六价的,不太清楚,我只知道铁有+2 +3价1年前查看全部
- 某元素正三价离子的3d亚层为半充满、则该元素符号为?
 521y1年前4
521y1年前4 -
 sdatfqwetwqe 共回答了16个问题
sdatfqwetwqe 共回答了16个问题 |采纳率100%根据构造原理电子先排满4s轨道再排在3d轨道,即有4S2.原子失电子从最外层开始,失去4s的两个电子后必定再失去3d上的一个电子,故该元素原子的电子排布式为:1s2 2s2 2p6 3s2 3p6 3d6 4s2,原子序数为26,是铁元素.1年前查看全部
- 推断下列元素的原子序数 1.最外层电子层为4s24p5 2.最外层电子层为4s1,次外电子层的d亚层仅有5个电子?
 clayuu1年前1
clayuu1年前1 -
 rhy9 共回答了24个问题
rhy9 共回答了24个问题 |采纳率95.8%1.最外层电子层为4s24p5 溴 35号
2.最外层电子层为4s1 铬 24号1年前查看全部
- 1:第一电子层(K层)中只有1s亚层,最多容纳两个电子;第二电子层(L层)中包括2s和2p两个亚层,总共可以容纳8个电子
1:第一电子层(K层)中只有1s亚层,最多容纳两个电子;第二电子层(L层)中包括2s和2p两个亚层,总共可以容纳8个电子 这里2s是表示2个s轨道吗?还是表示L层的s轨道所以叫2s.p轨道同问.
 pixi1年前0
pixi1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 【物质结构与性质】(1)甲、乙两种元素是同一周期的相邻元素,甲元素是形成有机物的主要元素,乙元素的p亚层上有3个电子.①
【物质结构与性质】
(1)甲、乙两种元素是同一周期的相邻元素,甲元素是形成有机物的主要元素,乙元素的p亚层上有3个电子.
①写出甲元素的电子排布式______,下列各化合物分子中甲元素的原子杂化方式全部相同的是______(填序号).
a.H 2 C=CH-C≡CH
b.CH 2 =C(CH 3 )-CH 2 -CH 3
c.C(CH 2 OH) 4
d.
e.
f.
②甲、乙元素可形成硬度大于金刚石的一种化合物,该化合物属于______晶体,其化学式为______.
(2)人们一直致力于人工固氮的研究以获得廉价的氮肥.科学家先后提出并合成得到固氮酶的多种模拟物.其中一类是含Mo、Fe、S原子的类立方体结构,如图所示.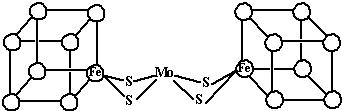
图中左右两边对称,各含一个近似为立方体的结构.每个立方体含有4个Fe原子、4个S原子,它们位于立方体的8个顶点,且原子间只有一种化学键.上述一个立方体中4个Fe原子所在的顶点连接所构成的空间几何体为______. 辛牙牙1年前1
辛牙牙1年前1 -
 toyota 共回答了20个问题
toyota 共回答了20个问题 |采纳率75%(1)甲、乙两种元素是同一周期的相邻元素,甲元素是形成有机物的主要元素,则甲是C元素,乙元素的p亚层上有3个电子,则乙是N元素.
①甲是C元素,其原子核外有6个电子,根据构造原理知其基态原子核外电子排布式为1s 2 2s 2 2p 2 ;
a.H 2 C=CH-C≡CH中形成碳碳双键的碳原子含有3个σ键且不含孤电子对,所以采用sp 2 杂化,形成碳碳三键的碳原子含有2个σ键且不含孤电子对,所以采用sp杂化,故错误;
b.CH 2 =C(CH 3 )-CH 2 -CH 3 中甲基和亚甲基上的碳原子含有4个σ键且不含孤电子对,所以采用sp 3 杂化,形成碳碳双键的碳原子含有3个σ键且不含孤电子对,所以采用sp 2 杂化,故错误;
c.C(CH 2 OH) 4 中所有碳原子都含有4个σ键且不含孤电子对,所以采用sp 3 杂化,故正确;
d.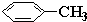 中甲基上的碳原子含有4个σ键且不含孤电子对,所以采用sp 3 杂化,苯环上的碳原子含有
中甲基上的碳原子含有4个σ键且不含孤电子对,所以采用sp 3 杂化,苯环上的碳原子含有
3个σ键且不含孤电子对,所以采用sp 2 杂化,故错误;
e.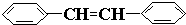 中苯环上的碳原子、形成碳碳双键的碳原子都含有3个σ键且不含孤电子对,所以采用sp 2 杂化,故正确;
中苯环上的碳原子、形成碳碳双键的碳原子都含有3个σ键且不含孤电子对,所以采用sp 2 杂化,故正确;
f.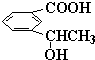 中苯环上的碳原子含有3个σ键且不含孤电子对,所以采用sp 2 杂化,甲基上碳原子含有4个σ键且不含孤电子对,所以采用sp 3 杂化,故错误;
中苯环上的碳原子含有3个σ键且不含孤电子对,所以采用sp 2 杂化,甲基上碳原子含有4个σ键且不含孤电子对,所以采用sp 3 杂化,故错误;
故选ce;
故答案为:1s 2 2s 2 2p 2 ;ce;
②原子晶体的硬度较大,碳和氮形成的化合物硬度较大,所以属于原子晶体,碳元素的非金属性小于氮元素,所以碳显正价,氮元素显负价,在该化合物中,碳元素显+4价,N元素显-3价,所以其化学式为C 3 N 4 ,
故答案为:原子晶体;C 3 N 4 ;
(2)由信息可知,小正方体中4个铁原子应在互不相邻的顶点上,且这四个顶点连接构成正四面体,
故答案为:正四面体.1年前查看全部
- 化学大神帮忙!一道选择题第三周期元素的原子,其最外层3p亚层上有一个未成对电子,它的最高价氧化物对应的水化物的酸根离子是
化学大神帮忙!一道选择题
第三周期元素的原子,其最外层3p亚层上有一个未成对电子,它的最高价氧化物对应的水化物的酸根离子是( )
A. RO5- B.RO3- C.RO4 2- D.RO4-
应该怎么算丫. wmt20581年前2
wmt20581年前2 -
 睡在添崖 共回答了17个问题
睡在添崖 共回答了17个问题 |采纳率94.1%第3周期,则表示它第1.2层排满.1s22s22p6现在已经有10个电子了,3p有一个未成对电子,那就是说3s满了.不然不会往3p排的.那又加3s2,有12个电子了.
3p亚层有3个空轨道.那么它的3p层可以是3p1,3p3,3p5.这样3种情况.
如果是3p1.那么就是13号元素,铝.铝的最高价氧化物对应的水化物是偏铝酸跟.AlO2-.没有符合的.
如果是3P3,那么就是磷,磷的最高价氧化物对应的水化物是磷酸根,PO4 3-
没有符合的.
如果是3P5,那么就是氯,最高价氧化物对应的水化物是高氯酸,酸根写作ClO4-
D符合.
没有直接算的.只能一个一个去推测排除.1年前查看全部
- 金属活泼顺序与亚层电子有关么?是副族的金属看亚层的不饱和度还是能量高低排序么?那当最外层电子数目和所在层数一样的时候.是
金属活泼顺序与亚层电子有关么?
是副族的金属看亚层的不饱和度还是能量高低排序么?那当最外层电子数目和所在层数一样的时候.是有亚层易失去还是没有亚层?我觉得亚层***核的引力应该更活泼..可是镁比铁活泼..但是镁和铁只差在亚层了.. albertyyp1年前1
albertyyp1年前1 -
 FFFDDD000 共回答了14个问题
FFFDDD000 共回答了14个问题 |采纳率92.9%上高中的时候,初中的知识全忘光了,上大学的时候,高中以前的东西又都丢了……T-T1年前查看全部
大家在问
- 12.I can still remember the sitting -room ____ my mother and
- 21+3+5单数+到99=
- 3过量的二氧化炭和氢氧化钙怎么反应
- 4物理题目-求卫星运行周期卫星轨道半径r=3R(R地球半径)已知地球表面加速度为g,问卫星的运行周期!
- 5merry christmas everybody什么意思
- 6What's your favorite f______.根据首字母填空
- 75me的定义 求各位帮忙解答!感谢!
- 8甲乙两人原来邮票张数比是3比5,甲又集邮40张,乙又集邮50张.这时甲的邮票张数是乙的2/3,甲乙原来各有?
- 9把下列句子组成一段语意连贯的文字,排序最恰当的一项是 [ ] ①黑格尔和
- 10that\'s it 和that\'s that有什么区别?
- 11小明测量植物油密度时,按下列顺序进行了操作:①用天平测出空烧杯的质量m1;②向烧杯中倒入适量植物油,测出烧杯与植物油的总
- 12时间长了,凹透镜可以让纸燃烧吗?
- 13《三颗枸杞豆》与《从百草园到三味书屋》中的乐园有什么不同?
- 14各猜一个体育项目.1.八大行星连成线.( )2.越近越近再跃进.( )3.举身赴清池.( )
- 15二次函数y=ax2+bx+c(a≠0)的图象经过点A(3,0),B(2,-3),并且以x=1为对称轴.
