氢镍电池放电时正极溶液的ph如何变化
 buyb2022-10-04 11:39:541条回答
buyb2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 linhuabo 共回答了24个问题
linhuabo 共回答了24个问题 |采纳率95.8%- 正极溶液的ph增大,正极反应为NiO(OH)+H2O+e-==Ni(OH)2+OH-
- 1年前
相关推荐
- (2012•天津模拟)甲醇是一种可再生能源,用途广泛,一种由甲醇、氧气以及强碱溶液制成的新型手机电池,容量达氢镍电池或锂
(2012•天津模拟)甲醇是一种可再生能源,用途广泛,一种由甲醇、氧气以及强碱溶液制成的新型手机电池,容量达氢镍电池或锂电池的10倍.回答下列有关问题:
(1)工业上有一种生产甲醇的反应:
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1
在某温度下,容积均为1L的A、B两个容器中,按不同方式投入反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:
①从反应开始至达到平衡时,A中用CO2来表示的平均反应速率为______.容器 A B 反应物投入量 1mol CO2(g)和3mol H2(g) 1mol CH3OH(g)和1mol H2O(g) CH3OH(g)浓度(mol•L-1) c1 c2 反应能量变化 放出29.4kJ 吸收akJ
②该温度下,反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) 的化学平衡常数的值为______.
③a=______.
④下列措施中能使n(CH3OH)/n(CO2)增大的是______.
A.升高温度B.充入氢气
C.将水蒸气从体系中分离D.用更有效的催化剂
(2)某同学设计了一个甲醇燃料电池,并用该电池电解200mL一定浓度的NaCl与CuSO4混合溶液,其装置如图1:
①写出甲中通入甲醇一极的电极反应式______.
②图2中曲线Ⅰ、Ⅱ分别表示乙中两极所得气体的体积随时间变化的关系(气体体积已换算成标准状况下的体积),写出电解开始时铁极上的电极反应式______;
t1后石墨电极上的电极反应式______;计算在t2时所得溶液的pH为(忽略电解前后溶液体积的变化)______. 君扬舟流1年前1
君扬舟流1年前1 -
 taopanri 共回答了21个问题
taopanri 共回答了21个问题 |采纳率76.2%解题思路:(1)①先根据反应中能量变化求出参加反应的CO2的物质的量,然后再根据v=[△c/△t]求出CO2的平均反应速率;
②首先计算出平衡时各物质的浓度,根据K=
计算;c(CH3OH)•c(H20) c(CO2)•c3(H2)
③恒温恒容下,容器A与容器B为等效平衡,平衡时对应组分的物质的量、浓度相等,二者起始物质的量等于各物质的化学计量数,放出热量与吸收热量之和等于反应热数值;
④要使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动;
(2)①甲醇发生氧化反应,在碱性条件下生成碳酸根与水;
②图1中原电池通入甲醇的为负极,乙中石墨电极为阳极、铁电极为阴极,开始Cl-在阳极放电生成氯气,阴极Cu2+放电生成Cu:Cu2++2e-=Cu,故图2中Ⅰ表示阴极产生的气体,Ⅱ表示阳极产生的气体,t1前电极反应式为:阳极2Cl--4e-=Cl2↑,阴极2Cu2++4e-=2Cu,t1~t2电极反应式为:阳极4OH--4e-=O2↑+2H2O,阴极2Cu2++4e-=2Cu,t2点后电极反应式为:阳极4OH--4e-=O2↑+2H2O,阴极4H++4e-=2H2↑,所以t1~t2 阳极上生成氧气,根据氧气的量计算氢氧根离子的物质的量,水电离出等物质的量的氢离子和氢氧根离子,根据公式计算得出C(H+),从而得出溶液的pH.(1)①1mol二氧化碳完全反应放出49.0kJ热量,当放出29.4kJ热量时,则参加反应的n(CO2)=[29.4kJ×1mol/49.0kJ]=0.6mol,CO2的平均反应速率v=[△c/△t]=
△n
V
△t=
0.6mol
1L
10S=0.06mol/(L•S),故答案为:0.06mol/(L•S);
②CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
初始(mol/L) 1 3 0 0
转化(mol/L) 0.6 1.8 0.6 0.6
平衡(mol/L) 0.4 1.2 0.6 0.6
根据K=
c(CH3OH)•c(H20)
c(CO2)•c3(H2)=[ 0.6 × 0.6
0.4×1.23=0.12,
故答案为:0.12;
③恒温恒容下,容器A与容器B为等效平衡,平衡时对应组分的物质的量、浓度相等,二者起始物质的量等于各物质的化学计量数,放出热量与吸收热量之和等于反应热数值,则吸收的热量=反应热-放出的热量=49.0kJ-29.4kJ=19.6kJ,
故答案为:19.6;
④要使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动,
A.因正反应放热,升高温度,平衡向逆反应方向移动,则n(CH3OH)/n(CO2)减小,故A错误;
B.充入氢气,平衡向正反应方法移动,n(CH3OH)/n(CO2)增大,.故B正确;
C.将水蒸气从体系中分离,平衡向正反应方法移动,n(CH3OH)/n(CO2)增大,故C正确;
D.用更有效的催化剂,平衡不移动,则n(CH3OH)/n(CO2)不变,故D错误.
故答案为:BC;
(2)①甲醇燃料电池中,在碱性条件下,甲醇失电子生成碳酸根与水,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
②图1中乙中石墨电极为阳极、铁电极为阴极,开始Cl-在阳极放电生成氯气,阴极Cu2+放电生成Cu:Cu2++2e-=Cu;故图2中Ⅰ表示阴极产生的气体,Ⅱ表示阳极产生的气体,t1前电极反应式为:阳极2Cl--4e-=Cl2↑,t1~t2电极反应式为:阳极4OH--4e-=O2↑+2H2O,t2点后电极反应式为:阳极4OH--4e-=O2↑+2H2O,所以在t1后,石墨电极上的电极反应式为4OH--4e-=O2↑+2H2O;t1~t2电极反应式为:阳极4OH--4e-=O2↑+2H2O,阴极2Cu2++4e-=2Cu,t2点后电极反应式为:阳极4OH--4e-=O2↑+2H2O,阴极4H++4e-=2H2↑,所以t1~t2 阳极上生成氧气,t1~t2Ⅱ产生的气体体积=0.336L-0.224L=0.112L,阳极上生成112mL氧气需要n(OH-)=
0.112L×4mol/22.4L]=0.02mol,水电离出等物质的量的氢离子和氢氧根离子,所以n(H+)=0.02mol,c(H+)=[0.02mol/0.2L]=0.1mol/L,所以溶液的pH=1,
故答案为:Cu2++2e-=Cu;4OH--4e-=O2↑+2H2O;1.点评:
本题考点: 反应速率的定量表示方法;原电池和电解池的工作原理;化学平衡常数的含义;化学平衡的影响因素.
考点点评: 本题考查了化学平衡的有关计算、电解池原理等知识点,电解硫酸铜和氯化钠混合溶液时,明确离子的放电顺序是解本题的关键,难度较大.1年前查看全部
- 氢镍电池的总反应式是什么?谁做正极,谁做负极?
 hhysxm1年前1
hhysxm1年前1 -
 lystan 共回答了22个问题
lystan 共回答了22个问题 |采纳率90.9%镍氢电池采用与镍镉电池相同的Ni氧化物作为正极,储氢金属作为负极,碱液(主要为KOH)作为电解液,镍氢电池充电时,正极发生反应如下:
Ni(OH)2 –e-+ OH- → NiOOH + H2O
负极反应:MHn + ne- → M + n/2H2
放电时,正极:NiOOH + H2O + e- → Ni(OH)2 + OH-
负极:M + n/2H2 → MHn + ne- .1年前查看全部
- 氢镍电池的总反应式是H2+2NiO(OH) 放电充电 2Ni(OH)2.根据此反应判断,下列叙述中不
氢镍电池的总反应式是H2+2NiO(OH)
2Ni(OH)2.根据此反应判断,下列叙述中不正确的是( )放电 充电
A.放电时,电池负极周围溶液的pH不断增大
B.电池充电时,镍元素在阳极被氧化
C.电池放电时,H2是负极
D.电池充电时,H2在阴极生成 zhqi86861年前1
zhqi86861年前1 -
 zangwenhe 共回答了12个问题
zangwenhe 共回答了12个问题 |采纳率91.7%解题思路:A.放电时,负极上失电子发生氧化反应,根据参加反应的离子判断低;
B.充电时,镍元素化合价由+2价变为+3价;
C.原电池放电,负极上物质失电子化合价升高;
D.充电时,电池负极为电解池阴极,阴极上得电子发生还原反应,与原电池负极反应式正好相反.A.放电时,负极上氢气失电子发生氧化反应,电极反应式为H2+2OH--2e-=2H2O,氢氧根离子参加反应导致氢氧根离子浓度减小,溶液的pH减小,故A错误;
B.充电时,镍元素化合价由+2价变为+3价,失电子化合价升高而被氧化,则镍元素在阳极被氧化,故B正确;
C.放电时,负极上物质失电子化合价升高,则H2是负极,故C正确;
D.充电时,电池负极的电极反应式与原电池负极反应式相反,所以该电极反应式为2H2O+2e-═H2+2OH-,即H2在阴极生成,故D正确;
故选A.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了新型化学电源,根据元素化合价变化结合能量转化方式来分析解答,难点是电极反应式的书写,注意结合电解质溶液酸碱性酸性,为学习难点,题目难度不大.1年前查看全部
- 摩托罗拉公司研发了一种由甲醇、氧气以及强碱作电解质溶液的新型手机电池,容量达氢镍电池或锂电池的十倍,可连续使用一个月才充
摩托罗拉公司研发了一种由甲醇、氧气以及强碱作电解质溶液的新型手机电池,容量达氢镍电池或锂电池的十倍,可连续使用一个月才充电一次。其电池反应为:2CH 3 OH+3O 2 +4OH -
 2CO 3 2 - +6H 2 O,则下列说法不正确的是 ( )
2CO 3 2 - +6H 2 O,则下列说法不正确的是 ( )A.充电时,电能转化为化学能 B.充电时,电解质溶液的pH逐渐增大 C.放电时,CH 3 OH参与反应的电极为负极,发生还原反应 D.放电时,负极的电极反应为:CH 3 OH+8OH - -6e - ===CO 3 2 - +6H 2 O  全海涛1年前1
全海涛1年前1 -
 lvdefahong 共回答了17个问题
lvdefahong 共回答了17个问题 |采纳率88.2%C
1年前查看全部
- 如图所示的锂离子电池主要利用碳的还原和氧化进行工作,比传统的镉镍电池、氢镍电池性能更优越。则下列叙述正确的是
如图所示的锂离子电池主要利用碳的还原和氧化进行工作,比传统的镉镍电池、氢镍电池性能更优越。则下列叙述正确的是
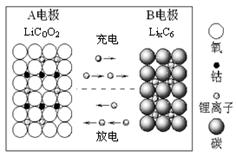
A 充电过程中,B极被氧化
B 该电池充放电的总反应式为:LiCoO 2 +C 6 Li 1 - x CoO 2 +Li x C 6
Li 1 - x CoO 2 +Li x C 6
C 放电时A极是负极,C 6 X - 发生氧化反应
D 放电时B极是负极, Li发生氧化反应 树的看月亮的人1年前1
树的看月亮的人1年前1 -
 宇昂6 共回答了21个问题
宇昂6 共回答了21个问题 |采纳率81%B
根据装置图可知,充电时电子向B极移动,B极是阴极,发生还原反应,选项A不正确。放电时电子向A极移动,所以A极是正极,B极是负极,Li x C 6 发生氧化反应,所以选项CD都是错误的,答案选B。1年前查看全部
- 甲醇的用途广泛,摩托罗拉公司也开发出一种由甲醇、氧气以及强碱做电解质溶液的新型手机电池,容量达氢镍电池或锂电池的10倍,
甲醇的用途广泛,摩托罗拉公司也开发出一种由甲醇、氧气以及强碱做电解质溶液的新型手机电池,容量达氢镍电池或锂电池的10倍,可连续使用一个月才充一次电.请完成下列与甲醇有关的问题.
(1)工业上有一种生产甲醇的反应为:
CO2(g)+3H2(g)CH3OH(g)+H2O(g);△H=-49.0kJ▪mol-1
在温度和容积相同的A、B两个容器中,按不同方式投入反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:
①从反应开始到达到平衡时,A中用CO2来表示的平均反应速率为______.容器 A B 反应物投入量 1mol CO2(g)和3mol H2(g) 1mol CH3OH(g)和3mol H2O(g) CH3OH(g)浓度(mol•L-1) c1 c2 反应能量变化 放出29.4kJ 吸收akJ
②A中达到平衡时CO2的转化率为______.③a=______.
某同学设计了一个甲醇燃料电池,并用该电池电解200mL-定浓度NaCl与CuSO4混合溶液,其装置如图:
①写出甲中通入甲醇这一极的电极反应式______
②理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式______;在t2时所得溶液的pH为______.(假设溶液体积不变) 冰伊人1年前1
冰伊人1年前1 -
 海豚听风 共回答了21个问题
海豚听风 共回答了21个问题 |采纳率85.7%解题思路:(1)①根据甲醇的浓度计算二氧化碳的浓度变化量,再根据v=[△c/△t]计算用CO2来表示的平均反应速率;
②根据反应放出的热量计算参加反应的二氧化碳的物质的量,再利用转化率定义计算;
③恒温恒容下,容器A与容器B为等效平衡,平衡时对应组分的物质的量、浓度相等,二者起始物质的量等于各物质的化学计量数,放出热量与吸收热量之和等于反应热数值;
(2)①甲醇发生氧化反应,在碱性条件下生成碳酸根与水;
②原电池通入甲醇的为负极,乙中石墨电极为阳极、铁电极为阴极,开始Cl-在阳极放电生成氯气,阴极Cu2+放电生成Cu,故图丙中Ⅰ表示阴极产生的气体,Ⅱ表示阳极产生的气体,t1前电极反应式为:阳极2Cl--4e-=Cl2↑,阴极2Cu2++4e-=2Cu,t1~t2电极反应式为:阳极4OH--4e-=O2↑+2H2O,阴极2Cu2++4e-=2Cu,t2点后电极反应式为:阳极4OH--4e-=O2↑+2H2O,阴极4H++4e-=2H2↑,所以t1~t2 阳极上生成氧气,根据氧气的量计算氢氧根离子的物质的量,水电离出等物质的量的氢离子和氢氧根离子,根据公式计算得出C(H+),从而得出溶液的pH.(1)①该反应中甲醇的v=[△c/△t]=
c1
10mol/(L.s)=0.1c1 mol/(L.s)或v=[△c/△t]=
c2
10smol/(L.s)=0.1mol/(L.s),二氧化碳和甲醇的计量数相同,所以其反应速率相同,即甲醇的反应速率为0.1c1mol/(L•S) 或0.1c2mol/(L•S),
故答案为:0.1c1mol/(L•S) 或0.1c2mol/(L•S);
②1mol二氧化碳完全反应放出49.0kJ热量,当放出29.4kJ热量时,则参加反应的n(CO2)=[29.4kJ×1mol/49.0kJ]=0.6mol,所以二氧化碳的转化率=[0.6mol/1mol×100%=60%,
故答案为:60%;
③恒温恒容下,容器A与容器B为等效平衡,平衡时对应组分的物质的量、浓度相等,二者起始物质的量等于各物质的化学计量数,放出热量与吸收热量之和等于反应热数值,则吸收的热量=反应热-放出的热量=49.0kJ-29.4kJ=19.6kJ,
故答案为:19.6;
(2)①甲醇燃料电池中,在碱性条件下,甲醇失电子生成碳酸根与水,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
②乙中石墨电极为阳极、铁电极为阴极,开始Cl-在阳极放电生成氯气,阴极Cu2+放电生成Cu,故图丙中Ⅰ表示阴极产生的气体,Ⅱ表示阳极产生的气体,t1前电极反应式为:阳极2Cl--4e-=Cl2↑,t1~t2电极反应式为:阳极4OH--4e-=O2↑+2H2O,t2点后电极反应式为:阳极4OH--4e-=O2↑+2H2O,所以在t1后,石墨电极上的电极反应式为4OH--4e-=O2↑+2H2O;
t1~t2电极反应式为:阳极4OH--4e-=O2↑+2H2O,阴极2Cu2++4e-=2Cu,t2点后电极反应式为:阳极4OH--4e-=O2↑+2H2O,阴极4H++4e-=2H2↑,所以t1~t2 阳极上生成氧气,t1~t2Ⅱ产生的气体体积=0.336L-0.224L=0.112L,阳极上生成112mL氧气需要n(OH-)=
0.112L×4mol
22.4L]=0.02mol,水电离出等物质的量的氢离子和氢氧根离子,所以n(H+)=0.02mol,c(H+)=[0.02mol/0.2L]=0.1mol/L,所以溶液的pH=1,
故答案为:4OH--4e-=O2↑+2H2O;1.点评:
本题考点: 化学平衡的计算;电极反应和电池反应方程式.
考点点评: 本题考查了化学平衡的有关计算、电解池原理等知识点,电解硫酸铜和氯化钠混合溶液时,明确离子的放电顺序是解本题的关键,难度较大.1年前查看全部
- 氢镍电池的总反应式 负极的反应式 正极的反应式
 tfeng891年前1
tfeng891年前1 -
 opq69 共回答了10个问题
opq69 共回答了10个问题 |采纳率90%镍氢电池采用与镍镉电池相同的Ni氧化物作为正极,储氢金属作为负极,碱液(主要为KOH)作为电解液,镍氢电池充电时,正极发生反应如下:
Ni(OH)2 –e-+ OH- → NiOOH + H2O
负极反应:MHn + ne- → M + n/2H2
放电时,正极:NiOOH + H2O + e- → Ni(OH)2 + OH-
负极:M + n/2H2 → MHn + ne- .1年前查看全部
- 原电池怎么看正负极PH变化?比如氢镍电池放电时负极附近的PH值怎么变化?有人说氢镍电池使用氢氧化镍为正极活性物质,贮氢合
原电池怎么看正负极PH变化?
比如氢镍电池放电时负极附近的PH值怎么变化?有人说
氢镍电池使用氢氧化镍为正极活性物质,贮氢合金作负极活性物质,氢氧化钾水溶液作电解液.
放电时,负极氢气失电子,氢氧根向负极移动,所以PH变大
但氢氧根被消耗不是应该减小吗?
做的一道题上答案也写的变大,但那题太盗版,不可信 六字真言1年前1
六字真言1年前1 -
 wa-kao 共回答了17个问题
wa-kao 共回答了17个问题 |采纳率94.1%负极:H2 + 2e- + 2OH- = 2H2O
正极:NiOOH + H2O - 2e- = Ni(OH)2 + 2 OH-
根据放电原理,可以看出:负极上消耗氢氧氢氧根离子而正极上生成氢氧根离子,所以负极周围溶液pH变小,正极周围溶液pH变大;另外负极上也生成水,也会使溶液中氢氧根离子浓度减小,溶液pH变小,而正极上消耗水,也会使氢氧根离子溶液增大,溶液pH变大.1年前查看全部
大家在问
- 1周记:我的老师 作文
- 2赏析一下这段文章 渐渐地天空变成了浅蓝色,越来越浅.转眼间天边出现了一道红霞,慢慢扩大了它的范围,加强了它的光亮.我知
- 3十七.句型转换 1.I like English best ,how about you (同义句转换) I like
- 4you're my end and my beginning
- 5上个周末 我的家人和我去了乡下 英语
- 6疑问句中Are Have Do的用法
- 7you have to do __cleaning at home?a)a b)the
- 8ixviiiiixvi翻译一下是什么意思
- 9晚上有大雾预示着第二天会出现什么天气?
- 10(2013•南昌二模)如图所示,在光滑水平面上,质量为m的小球B连接着一个轻质弹簧,弹簧与小球 均
- 11求杜甫的一首诗它的意思及思想感情.
- 12叶公好龙的阅读问题叶公好龙开头是“古时候有个叶公,非常喜欢龙”结尾是“原来他喜欢的不是龙,而是似龙而非龙的东西”这样写起
- 13设f(x)=x/(e^-2+x^2),g(x)=(e^x)/x对任意x1若有恒成立,则正数k的取值范围
- 14辩证唯物与客观唯心主义的区别?
- 15如图,已知角a0b=4分之一角a0d,角A0c=2分之1角A0D,且角Boc=15度,则角A0D
