0.1mol/l稀盐酸的PH值 为多少水电离出h+为多少
 haokang052022-10-04 11:39:540条回答
haokang052022-10-04 11:39:540条回答
0.1mol/l稀盐酸的PH值 为多少水电离出h+为多少
是在25的温度下
是在25的温度下

已提交,审核后显示!提交回复
共0条回复
相关推荐
- 将0、4克氢氧化钠和1、06克碳酸钠混合并配成溶液,向溶液中加入0·1mol/l稀盐酸,下图能正确表示盐酸体积和二氧化碳
将0、4克氢氧化钠和1、06克碳酸钠混合并配成溶液,向溶液中加入0·1mol/l稀盐酸,下图能正确表示盐酸体积和二氧化碳的物质的量的关系的是( )
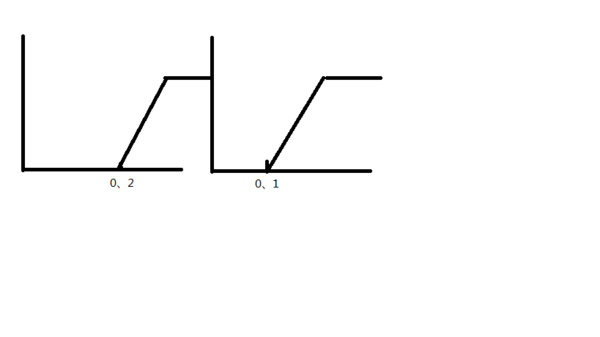
 都市猫猫1年前3
都市猫猫1年前3 -
 xbq321 共回答了18个问题
xbq321 共回答了18个问题 |采纳率94.4%选第二个,氢氧化钠与盐酸1比1反应,氢氧化钠0.1mol,所以消耗盐酸0.1mol1年前查看全部
- 、将0.4gNAOH和1.06gNA2CO3混合并配成溶液,向溶液中滴加0.1mol/L稀盐酸 .下列图像能正确
、将0.4gNAOH和1.06gNA2CO3混合并配成溶液,向溶液中滴加0.1mol/L稀盐酸 .下列图像能正确
将0.4gNAOH和1.06gNA2CO3混合并配成溶液,向溶液中滴加0.1mol/L稀盐酸 .下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是
疑问:
老师评讲这道题的时候说了个什么,稀盐酸滴入到NaOH(记不清了也许是Na2CO3)的反应和NaOH(也许是Na2CO3)滴入到稀盐酸中的反应方程式不一样?到底哪里不一样了?为什么不一样?知道这个有什么用?
我和同学后来又去问老师,老师说什么方程式不影响,到底上面我说的那个知识点和这道题有什么关系?怎么用上去?
最好能顺带解析一下这道题,没错我是个白痴,没错,就把我当作一个白痴来告诉我吧感激不尽!》. zuoren081年前1
zuoren081年前1 -
 断蓝K 共回答了18个问题
断蓝K 共回答了18个问题 |采纳率88.9%稀盐酸滴入到Na2CO3的反应和Na2CO3滴入到稀盐酸中的反应方程式不一样.
稀盐酸滴入到Na2CO3,盐酸不足, Na2CO3 + HCl ===NaHCO3 + NaCl
Na2CO3滴入到稀盐酸,盐酸足量, Na2CO3 +2HCl ===2NaCl + CO2 + H2O
2. 用稀盐酸滴定时,产生CO2的量是不会变化,所以不影响Na2CO3质量计算.1年前查看全部
- 浓盐酸怎么稀释成0.1mol/l稀盐酸?
 qq51811011101年前3
qq51811011101年前3 -
 danver603 共回答了17个问题
danver603 共回答了17个问题 |采纳率88.2%一般市售浓盐酸的浓度是12 mol/L,所以按1:120(体积比)稀释即可获得0.1 mol/L的稀盐酸.1年前查看全部
- 将100g含碳酸钙80%的石灰石与足量2mol/L稀盐酸反应制取CO2气体
将100g含碳酸钙80%的石灰石与足量2mol/L稀盐酸反应制取CO2气体
(1)在标准状况下,生成CO2体积为多少?
(2)反映中消耗的稀盐酸体积是多少?
(3)将生成的气体通入足量的澄清石灰水中,生成的沉淀质量是多少? 老鼠眼香肠嘴1年前1
老鼠眼香肠嘴1年前1 -
 於志芳 共回答了16个问题
於志芳 共回答了16个问题 |采纳率100%CaCO3+2HCl=CaCl2+CO2+H2O
100 2 22.4
100*80% 2X Y
X=0.8升
Y=17.92升
生成碳酸钙沉淀的质量=100*80%=80克1年前查看全部
- 请问37%盐酸如何配置100ml的2mol/L稀盐酸
 Pacific20011年前1
Pacific20011年前1 -
 呢喃的火花921 共回答了19个问题
呢喃的火花921 共回答了19个问题 |采纳率100%貌似差一个盐酸的密度,否则的话下列的方法有些不大常规
1.计算:所需盐酸质量,0.1*2*36.5/0.37=19.7g
2.称量:用天平测得19.7g盐酸(可以用烧杯称,如果已知密度就直接用量筒量就可以了).用玻璃棒引流加入到100ML不漏水的容量瓶中
3.洗涤:洗涤玻璃棒,烧杯,将洗涤液也转入容量瓶中
4.定容:用玻璃棒引流至刻度线一下1-2厘米,在用胶头滴管定容至刻度线使凹液面最低处与平视视线相平
5.摇匀:将容量瓶上下摇匀,贴上标签1年前查看全部
- 一块表面已被氧化生成氧化钠的金属钠,起质量为2.38g,溶于水,再用2mol/L稀盐酸50ml恰好中和,求:(1)生成氧
一块表面已被氧化生成氧化钠的金属钠,起质量为2.38g,溶于水,再用2mol/L稀盐酸50ml恰好中和,求:(1)生成氧化钠的质量(2)钠被氧化的百分率
 爱警mm1年前5
爱警mm1年前5 -
 带血的白玫瑰 共回答了24个问题
带血的白玫瑰 共回答了24个问题 |采纳率87.5%2Na+H2O=2NaOH+H2 2Na2O+H2O=2NaOH 设金属钠X摩尔、氧化钠Y摩尔,
NaOH+HCl=NaCl+H2O,所以消耗盐酸为2*0.05=0.1mol
所以结合以上反应,0.1=X+Y;同时钠的分子量为23,氧化钠为62,所以
23*X+62*Y=2.38,所以计算出X=0.098mol ,Y=0.002mol,所以生成的氧化钠质量为62*0.002=0.124克,钠被氧化的百分率为
(0.002*46)/(0.002*46+0.098*23)=3.92%1年前查看全部
- 现在又镁 铝合金5.1克完全溶于500ml2mol/L稀盐酸(足量)中 在标准状况下共收集到氢气5.6L 计算 (1)这
现在又镁 铝合金5.1克完全溶于500ml2mol/L稀盐酸(足量)中 在标准状况下共收集到氢气5.6L 计算 (1)这种合
 狸芝1年前1
狸芝1年前1 -
 ring3025 共回答了21个问题
ring3025 共回答了21个问题 |采纳率66.7%设镁X摩尔 铝Y摩尔
24X+27Y=5.1
X+1.5Y=5.6/22.4
X=0.1 Y=0.1
都是0.1摩尔
镁2.4克 铝2.7克
那么镁2.4/5.1=47% 2.7/5.1=53%
假设反应后溶液体积仍为500ml 求生成的氯化镁 氯化铝及剩余盐酸的浓度
根据原子守恒
Mg + 2HCL ==MgCL2+ H2
1 2 1
0.1 0.2 0.1
2AL+ 6HCL===2ALCL3+3H2
2 6 2
0.1 0.3 0.1
所以氯化镁为0.1摩尔 氯化铝0.1摩尔
剩余盐酸的物质的量2*0.5-0.2-0.3=0.5摩尔
0.5/0.5=1mol/L1年前查看全部
- 现有镁,铝合金5.1g完全溶于500mol/L稀盐酸(足量)中,在标准状况下共收集到氢气5.6L,计算; 1,这种合金的
现有镁,铝合金5.1g完全溶于500mol/L稀盐酸(足量)中,在标准状况下共收集到氢气5.6L,计算; 1,这种合金的百
 好想有一天1年前1
好想有一天1年前1 -
 j5886 共回答了19个问题
j5886 共回答了19个问题 |采纳率89.5%设镁为x mol,铝为y mol
根据生成氢气的关系,镁生成氢气为x mol,铝为1.5y mol
24x+27y=5.1g
x+1.5y=0.5/2
解得x=0.1 mol,y=0.1mol
(1)m(Al)=0.1*27=2.7g
(2)m(Mg)=0.1*24=2.4g
第二种就是设质量,镁x g铝y g
Mg+HCl==MgCl2+H2
24.2
x.2x/24
2Al+6HCl====2AlCl3+3H2
54.6
y.6Y/54
x+y=5.1
2x/24 +6y/54=0.5
解得x=2.4g,y=2.7g1年前查看全部
大家在问
- 1囤粮读dun还是tun
- 2已知向量a=(√3,-1),b=(1/2,√3/2)
- 3意大利语发音问题buon giorno 再见 arrivederci 这两个词中的R都是怎么发音的?特别是arrived
- 4用直接开平方法解方程①4(x-2)²-25=0②二分之一(2y+2)=3
- 5在画线段的垂直平分线时,为什么要选取半径大于1/2?
- 6In the after-class activities,the students had plenty of____
- 7在敲响古刹里的大钟时,有的同学发现停止了对大钟的撞击后,大钟仍“余音未绝”,分析其原因是( )
- 8100千克花生可以榨油42千克,那么25万吨的花生可以榨油多少万吨?如果榨油21吨,需要多少吨花生?
- 9用英语问感觉怎么样三种句式
- 10有理数里面有什么数
- 11(2013•南平模拟)下列关于水的说法正确的是( )
- 12如图,在三角形ABC中,AB=AC,M为BC中点,MG垂直AB,MD垂直AC,DE垂直AB,GF垂直AC,垂足分别为G,
- 13反义词:偏僻、冷落、稀疏
- 14《单纯女孩遇到浪漫王子》《1》 作文
- 15beneficial是否等于of benefit
