调味品 孜然 ,
 爱得可真了2022-10-04 11:39:540条回答
爱得可真了2022-10-04 11:39:540条回答
已提交,审核后显示!提交回复
共0条回复
相关推荐
- 民以食为天,下列关于厨房调味品的说法正确的是( )A.食醋和料酒的主要成分都是有机酸B.食盐和味精
民以食为天,下列关于厨房调味品的说法正确的是( )A.食醋和料酒的主要成分都是有机酸B.食盐和味精
民以食为天,下列关于厨房调味品的说法正确的是( )
A.食醋和料酒的主要成分都是有机酸
B.食盐和味精的成分中都含有钠离子
C.食用油和人造奶油都是油酸甘油酯
D.蔗糖和石碱都是可溶于水的电解质
 酱油世家1年前1
酱油世家1年前1 -
 拂尘心暗然 共回答了17个问题
拂尘心暗然 共回答了17个问题 |采纳率100%A.食醋的主要成分是醋酸,醋酸为有机酸,但是料酒的主要成分为乙醇,乙醇属于醇类,不属于有机酸,故A错误;
B.食盐为氯化钠,味精是谷氨酸钠,二者都含有钠离子,故B正确;
C.食用油为油酸甘油酯,其烃基中含有不饱和碳碳双键,而人造奶油为饱和高级脂肪酸甘油酯,故C错误;
D.石碱为电解质,而蔗糖在水溶液和熔融状态下都不导电,蔗糖为非电解质,故D错误;
故选B.1年前查看全部
- 食醋是家庭常用的调味品。某兴趣小组同学为探究食醋中醋酸(乙酸)的质量分数设计并进行了如下实验:取10%的氢氧化钠溶液(密
食醋是家庭常用的调味品。某兴趣小组同学为探究食醋中醋酸(乙酸)的质量分数设计并进行了如下实验:取10%的氢氧化钠溶液(密度为1.2g/mL)逐滴加入到100g食醋中,当滴入25mL该氢氧化钠溶液时正好完全中和。已知反应化学方程式如下:
CH 3 COOH + NaOH → CH 3 COONa + H 2 O,请你完成探究实验中的相关计算:
⑴实验中消耗的25mL氢氧化钠溶液中溶质的物质的量是多少?
⑵食醋中醋酸的质量分数是多少? 小强兄弟1年前1
小强兄弟1年前1 -
 尘莫 共回答了12个问题
尘莫 共回答了12个问题 |采纳率66.7%(1)25mL×1.2g/mL×10% = 3g 3/40 = 0.075mol
(2)设食醋中醋酸的质量分数为X。
CH 3 COOH+NaOH=CH 3 COONa+H 2 O
60 1 mol
100g×X 0.075mol
X = 0.045
答:实验中消耗的25mL氢氧化钠溶液中溶质质量为3g,溶质的物质的量为0.075mol。食醋中醋酸的质量分数是0.045或4.5% 。
1年前查看全部
- (2013•四川模拟)有A~F六种无色的液体,已知液体E有咸味,其溶质可作为调味品,其余分别是稀盐酸、碳酸钠溶液、氢氧化
(2013•四川模拟)有A~F六种无色的液体,已知液体E有咸味,其溶质可作为调味品,其余分别是稀盐酸、碳酸钠溶液、氢氧化钠溶液、氢氧化钙溶液、水中的某一种,请根据下面实验现象回答问题.
Ⅰ.将少量A分别滴入适量的B、C、D、F中,均没有明显现象;
Ⅱ.将少量B分别滴入适量的A、C、D、F中,C中有气泡出现,其余均没有明显现象;
Ⅲ.将少量D分别滴入适量的A、B、C、F中,均没有明显现象.
(1)液体E中的溶质是______.
(2)写出B滴入C中发生反应的化学方程式______.
(3)根据实验现象能判断出的液体是______.
(4)将少量C分别滴入适量的A、B、D、F中,写出观察到的现象______.
(5)对还没有确定的液体,下列几种鉴别方法中,正确的是______(填序号).
A.分别滴加稀盐酸B.分别滴加澄清石灰水C.分别滴加紫色石蕊溶液D.分别滴加无色酚酞溶液. 除了自己还能信谁1年前1
除了自己还能信谁1年前1 -
 信不信由你LT 共回答了15个问题
信不信由你LT 共回答了15个问题 |采纳率93.3%解题思路:根据物质的性质进行分析,根据题干提供的信息直接得出有关物质的化学式,然后根据提供的实验现象逐步得出其他物质的化学式,液体E有咸味,其溶质可作为调味品,可知E是食盐,根据Ⅰ可知A可能为水或氢氧化钠,根据Ⅱ,B与C混合产生气泡,则B与C的反应为碳酸钠与盐酸的反应,且B与其他物质混合无现象,则B为盐酸,C为碳酸钠,根据Ⅲ,则D可能为水或氢氧化钠,F为氢氧化钙.(1)液体E有咸味,其溶质可作为调味品,可知E是食盐,所以本题答案为:NaCl;
(2)根据Ⅱ,B与C混合产生气泡,则B与C的反应为碳酸钠与盐酸的反应,所以本题答案为:Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(3)根据Ⅰ可知A可能为水或氢氧化钠,B与C混合产生气泡,则B与C的反应为碳酸钠与盐酸的反应,且B与其他物质混合无现象,则B为盐酸,C为碳酸钠,根据Ⅲ,则D可能为水或氢氧化钠,F为氢氧化钙,所以本题答案为:B为HCl;C为Na2CO3;F为Ca(OH)2;
(4)C为碳酸钠,能与B盐酸反应生成二氧化碳,能与F氢氧化钙反应生成碳酸钙沉淀,AD为水或氢氧化钠,与碳酸钠混合无现象,所以本题答案为:B中有气泡产生,F中生成白色沉淀,A、D中无明显现象;
(5)要确定水和氢氧化钠,可以根据其性质的差异进行,氢氧化钠显碱性,能使石蕊变蓝,使酚酞变红,所以本题答案为:CD.点评:
本题考点: 酸、碱、盐的鉴别;反应现象和本质的联系;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题为文字叙述型物质推断题,完成此题,关键是找准解题突破口,直接得出有关物质的化学式,然后根据实验现象逐步推导得出其他物质的化学式.1年前查看全部
- 有人说他只是其他人生活中的调味品,自己不重要吗?
 王二憨1年前1
王二憨1年前1 -
 hh在哪里 共回答了24个问题
hh在哪里 共回答了24个问题 |采纳率95.8%这是自怨自艾的说法,妄自菲薄呢!是在对身边的人失望之余,说的丧气话.
是不是受了什么打击和伤害,怀疑自己的存在,不信任周围的人了.1年前查看全部
- 食醋是家中常用的调味品 请观察家中的一瓶食醋 记录你观察到的物理性质 设计实验验证食醋的一条化学性质
 细细穗儿1年前1
细细穗儿1年前1 -
 暧意 共回答了22个问题
暧意 共回答了22个问题 |采纳率95.5%化学性质:与茶壶内的茶垢反应,证明食醋是酸性
物理性质:液体,特殊气味,有色,沸点117.9度,容点16.6度1年前查看全部
- 已知a是石油裂解的主要产物,d是家庭日常生活中常用的一种调味品的主要成分,d是具有果香味的有机物.
已知a是石油裂解的主要产物,d是家庭日常生活中常用的一种调味品的主要成分,d是具有果香味的有机物.
⒈d的名称,a的结构简式?⒉a和b的反应类型?⒊b和d和浓硫酸反应的化学方程式? sprite1l1年前1
sprite1l1年前1 -
 待从头 共回答了16个问题
待从头 共回答了16个问题 |采纳率93.8%1:d是乙酸乙酯 a H2C=CH2 乙烯
2:b 是乙酸,加成反应
3:b+d +浓硫酸不反应1年前查看全部
- M是一种碱性的盐,且由三种元素组成.M\A\B\C\是四种不同类别的化合物.MB的产物是常用的调味品
M是一种碱性的盐,且由三种元素组成.MABC是四种不同类别的化合物.MB的产物是常用的调味品
 CM反应产物是一种建筑材料的主要成分,问M-c的化学方程式和其反应类型,M-B的化学方程式,A物质的用途
CM反应产物是一种建筑材料的主要成分,问M-c的化学方程式和其反应类型,M-B的化学方程式,A物质的用途  站起来继续走1年前1
站起来继续走1年前1 -
 风雨拽拽 共回答了31个问题
风雨拽拽 共回答了31个问题 |采纳率96.8%常用调味品是NaCl,M是碳酸钠,CM的产物是碳酸钙.因此,MC:Na2CO3+CaOH2=2Na OH+Ca CO3.复分解.mb2 HCl +Na 2CO3=2Na Cl+CO2+H2O.aCO2,灭火剂.纯手打,1年前查看全部
- (2014•泰安一模)物质M是一种日常生活中不可缺少的调味品.已知C可在D中燃烧发出苍白色火焰.M与其他物质的转化关系如
(2014•泰安一模)物质M是一种日常生活中不可缺少的调味品.已知C可在D中燃烧发出苍白色火焰.M与其他物质的转化关系如图甲所示(部分产物已略去):

(1)写出用惰性电极电解M溶液的离子方程式2Cl-+2H2O
2OH-+H2↑+Cl2↑电解 .2Cl-+2H2O.
2OH-+H2↑+Cl2↑电解 .
(2)若A是一种酸性氧化物,且可用于制造玻璃,则G的化学式是______.
(3)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是______.
(4)若A是一种盐,A溶液与B溶液混合产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,则由A转化成E的离子方程式是______.
(5)若A是一种溶液,只可能含有H+,NH4+,Mg2+,Fe3+,Al3+,CO32-,SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图乙所示.由此可知,该溶液中肯定含有的离子及其浓度之比为______. 南方李锦记1年前1
南方李锦记1年前1 -
 銀冰 共回答了22个问题
銀冰 共回答了22个问题 |采纳率86.4%解题思路:(1)C可在D中燃烧发出苍白色火焰,为氢气与氯气反应生成HCl,可推知C为H2、D为Cl2、F为HCl,M是日常生活中不可缺少的调味品,由转化关系可知,M的溶液电解生成氢气、氯气与B,可推知M为NaCl、B为NaOH,
(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,则A为SiO2,E为Na2SiO3,与F溶液反应得到G为H2SiO3;
(3)若A是一种常见金属单质,且与NaOH溶液能够反应,则A为Al,E为NaAlO2,则将过量的HCl溶液逐滴加入NaAlO2溶液中,先生成氢氧化铝,而后氢氧化铝溶解;
(4)若A是一种盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,可推知A中含有Fe2+,E为Fe(OH)3,G为FeCl3;
(5)由图可知,开始加入NaOH没有沉淀和气体产生,则一定有H+,一定没有CO32-,后来有沉淀产生且最后消失,则一定没有Mg2+、Fe3+,一定含有Al3+;中间段沉淀的质量不变,应为NH4++OH-=NH3•H2O的反应,则含有NH4+,由电荷守恒可知一定含有SO42-,根据各阶段消耗的NaOH体积结合离子方程式计算n(H+):n(Al3+):n(NH4+)之比,再结合电荷守恒计算与n(SO42-)的比例关系,据此计算.(1)C可在D中燃烧发出苍白色火焰,为氢气与氯气反应生成HCl,可推知C为H2、D为Cl2、F为HCl,M是日常生活中不可缺少的调味品,由转化关系可知,M的溶液电解生成氢气、氯气与B,可推知M为NaCl、B为NaOH,用惰性电极电解M溶液的离子方程式为2Cl-+2H2O
电解
.
2OH-+H2↑+Cl2↑,
故答案为:2Cl-+2H2O
电解
.
2OH-+H2↑+Cl2↑;
(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,则A为SiO2,E为Na2SiO3,与F溶液反应可以得到G为H2SiO3,
故答案为:H2SiO3;
(3)若A是一种常见金属单质,且与NaOH溶液能够反应,则A为Al,E为NaAlO2,则将过量的HCl溶液逐滴加入NaAlO2溶液中,先生成氢氧化铝,而后氢氧化铝溶解,故看到的现象为:溶液中逐渐有白色絮状沉淀生成,且不断增加;然后又由多到少,最后消失,
故答案为:溶液中逐渐有白色絮状沉淀生成,且不断增加;然后又由多到少,最后消失;
(4)若A是一种盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,可推知A中含有Fe2+,E为Fe(OH)3,G为FeCl3,则由A转化成E的离子方程式是:4Fe2++8OH-+O2+2H2O=4Fe(OH)3↓,
故答案为:4Fe2++8OH-+O2+2H2O=4Fe(OH)3↓;
(5)由图可知,开始加入NaOH没有沉淀和气体产生,则一定有H+,一定没有CO32-,后来有沉淀产生且最后消失,则一定没有Mg2+、Fe3+,一定含有Al3+;中间段沉淀的质量不变,应为NH4++OH-=NH3•H2O的反应,则含有NH4+,由电荷守恒可知一定含有SO42-,
发生反应H++OH-=H2O,氢离子消耗NaOH溶液的体积为1积,
发生反应Al3++3OH-=Al(OH)3↓,铝离子消耗NaOH溶液的体积为3体积,
发生反应NH4++OH-=NH3•H2O,铵根消耗氢氧化钠为2体积,
则n(H+):n(Al3+):n(NH4+)=1:1:2,由电荷守恒可知,n(H+):n(Al3+):n(NH4+):n(SO42-)=1:1:2:3,故c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3,
故答案为:c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3.点评:
本题考点: 无机物的推断;铁的氧化物和氢氧化物.
考点点评: 本题考查无机物推断等,题目涉及元素化合物较多,需要学生全面掌握据基础知识,(5)中根据图象中的平台确定含有铵根离子是关键,注意离子方程式与电荷守恒的应用,难度中等.1年前查看全部
- 化学期末复习1.3,下列说法错误的是:A.乙醇和乙酸都是常用调味品的主要成分.B,乙醇和乙酸的沸点和熔点都比C2H6,C
化学期末复习1.3,下列说法错误的是:A.乙醇和乙酸都是常用调味品的主要成分.B,乙醇和乙酸的沸点和熔点都比C2H6,C2H4的沸点和熔点高.请帮忙详解AB项,另外,关于B项,怎么比较有机物的沸点和熔点,不仅仅是烃,还包括烃的衍生物,
 g8y4k4u1年前4
g8y4k4u1年前4 -
 xiaomu82 共回答了14个问题
xiaomu82 共回答了14个问题 |采纳率92.9%A.乙醇即酒精,平常喝的酒都含有酒精,乙酸即醋酸,生活中的醋都含有醋酸.正确
B.先了解底下的,显然是正确的
熔、沸点取决于有机物分子间作用力的大小,而分子间作用力与分子的结构(有无支键、有无极性基 团、饱和程度)、分子量等有关.主要分为下面四个情况:
1.组成和结构相似的物质,分子量越大,其分子间作用力就越大.所以有机物中的同系物随分子中碳原子个数增加,熔、沸点升高.在通常状况下分子中含四个碳原子以下的烷烃、烯烃、炔烃是气体,含四个碳原子以上的是液体,含更多碳原子的是固体.
2.分子式相同时,直键分子间的作用力要比带支键分子间的作用力大,支键越多,排列越不规则,分子间作用力越小.如:分子间作用力:正戊烷>异戊烷>新戊烷.沸点:30.07℃>27.9℃>9.5℃
3.分子中元素种类和碳原子个数相同时,分子中有不饱和键的物质熔、沸点要低些.如:C2H6 C2H4 硬脂酸 油酸 熔点:-88.63℃>-103.7℃ 69.5℃>14.0℃
4.分子量相近时,极性分子间作用力大于非极性分子间的作用力.分子中极性基团越多,分子间作用力越大.如:分子间作用力:C2H5OH>CH3OCH3 C2H5Cl>CH3CH2CH3 沸 点:78.5℃>34.51℃ 12.27℃>0.5℃1年前查看全部
- 仿写句子.急用,“如果把坎坷看作一种调味品,你就会觉得坎坷的生活也有滋味.如果把艰难看做一笔宝贵的财富,就会丰富我们的阅
仿写句子.急用,
“如果把坎坷看作一种调味品,你就会觉得坎坷的生活也有滋味.如果把艰难看做一笔宝贵的财富,就会丰富我们的阅历,丰富我们的人生底蕴.”就这句仿写, 7508crm1年前1
7508crm1年前1 -
 rrar 共回答了15个问题
rrar 共回答了15个问题 |采纳率86.7%如果把坎坷看作一种调味品,你就会觉得坎坷的生活也有滋味.如果把艰难看做一笔宝贵的财富,就会丰富我们的阅历,丰富我们的人生底蕴.
如果把人生悲剧看作一道门槛,过了之后你会觉得生活豁然开朗.如果把三思当作一种习惯,就会使我们的行事更加小心,增加事情的成功率1年前查看全部
- (2011•上海模拟)食醋是家庭常用的调味品.某兴趣小组同学为探究食醋中醋酸(乙酸)的质量分数设计并进行了如下实验:取1
(2011•上海模拟)食醋是家庭常用的调味品.某兴趣小组同学为探究食醋中醋酸(乙酸)的质量分数设计并进行了如下实验:取10%的氢氧化钠溶液(密度为1.2g/mL)逐滴加入到100g食醋中,当滴入25mL该氢氧化钠溶液时正好完全中和.已知反应化学方程式如下:CH3COOH+NaOH→CH3COONa+H2O,请你完成探究实验中的相关计算:
(1)实验中消耗的25mL氢氧化钠溶液中溶质的质量是多少?
(2)食醋中醋酸的质量分数是多少? rabbitroby1年前0
rabbitroby1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 氯化钠既是重要的调味品,又是重要的工业原料.
氯化钠既是重要的调味品,又是重要的工业原料.
①实验室里有一小袋粗盐,其中含有较多的可溶性杂质(MgCl 2 、CaCl 2 等)和泥沙等不溶性杂质,要初步提纯这袋粗盐需要经过的步骤是溶解、过滤和______.若要计算提纯后所得精盐的产率.必须用的仪器是______.
②工业上用给饱和食盐水通电的方法可制得一种碱R和氢气、氯气,化学方程式为:
2NaCl+2H 2 O
2R+H 2 ↑+Cl 2 ↑,其中R的化学式为______,若反应中消耗了58.5g氯化钠,则理论上可得到R的质量为______g.通电 .  玻璃奶瓶1年前1
玻璃奶瓶1年前1 -
 冷寒江 共回答了22个问题
冷寒江 共回答了22个问题 |采纳率95.5%①经过过滤后,氯化钠都在溶液中,要得到氯化钠晶体,就需要蒸发溶剂使晶体析出,故答案为:蒸发;
要称量固体的质量就需要用到天平,故答案为:天平,
②根据反应前后的原子个数保持不变,故答案为:NaOH;
由方程式可知,氢氧化钠和氯化钠进行中和反应时,是按照40:58.5的比例关系进行反应的,故答案为:40.1年前查看全部
- 味精是烹饪中不可缺少的调味品,其主要成分为谷氨酸钠(化学式为C5H8NO4Na),著名的“莲花”牌味精,其谷氨酸钠的含量
味精是烹饪中不可缺少的调味品,其主要成分为谷氨酸钠(化学式为C5H8NO4Na),著名的“莲花”牌味精,其谷氨酸钠的含量可达85%以上,请回答:
(1)谷氨酸钠的相对分子质量为______;
(2)一袋包装为50克的“莲花”牌味精中,谷氨酸钠的质量不少于______克. 爱君无悔1年前1
爱君无悔1年前1 -
 hh依归 共回答了18个问题
hh依归 共回答了18个问题 |采纳率83.3%解题思路:根据谷氨酸钠的化学式为C5H8NO4Na:(1)根据相对分子质量的计算方法计算即可;
(2)根据谷氨酸钠的含量为85%以上计算即可.(1)因为谷氨酸钠的化学式为C5H8NO4Na,所以谷氨酸钠的相对分子质量=12×5+1×8+14×1+16×4+23×1=169,
故答案为:169.
(2)因为“莲花”牌味精中谷氨酸钠的含量为85%以上,50g“莲花”牌味精中所以谷氨酸钠的质量≥50×85%=42.5g,
故答案为:42.5.点评:
本题考点: 相对分子质量的概念及其计算;物质组成的综合计算.
考点点评: 本题主要考查了相对分子质量的计算,化合物相对分子质量等于化合物中所有元素分子质量之和.1年前查看全部
- 1.食醋是常用的调味品,某同学欲探究食醋中醋酸的质量分数,进行了下面的实验:取20g烧碱放人180g水中,制
 tigermp1年前1
tigermp1年前1 -
 迷途的小豺狼 共回答了23个问题
迷途的小豺狼 共回答了23个问题 |采纳率95.7%(1)50mL氢氧化钠溶液中溶质质量为:
50mL×1.1g/mL×10%= 5.5g (2分)
(2)设食醋中醋酸的质量为X
CH3COOH+NaOH=CH3COONa+H2O
60 40
X 5.5g (1分)
60/X=40/5.5g (1分)
X=8.25g (1分)
则食醋中醋酸的质量分数为:
8.25g/200g×100%=4.1% (2分)
答:略1年前查看全部
- :随着经济的蓬勃发展,消费者消费观念的变化,人们生活水品平的提高,调味品得到了
 totenwang11年前3
totenwang11年前3 -
 风吹过的记忆 共回答了16个问题
风吹过的记忆 共回答了16个问题 |采纳率100%With the thriving of ecnomy, people's consumption concept is changed, the standard of living
is also improved, meanwhile, the flavouring is...1年前查看全部
- 食醋是厨房中的一种调味品,其中含有少量醋酸,其分子结构如图所示.下列有关醋酸的说法正确的是( )
 食醋是厨房中的一种调味品,其中含有少量醋酸,其分子结构如图所示.下列有关醋酸的说法正确的是( )
食醋是厨房中的一种调味品,其中含有少量醋酸,其分子结构如图所示.下列有关醋酸的说法正确的是( )
A.醋酸是由2个碳原子、4个氢原子和2个氧原子构成的
B.醋酸中碳元素的质量分数为40%
C.醋酸中氢元素、氧元素的质量比为2:1
D.醋酸分子中有32个质子 haidao11711年前0
haidao11711年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 调味品是属酸还是碱性的?
 0idyll01年前1
0idyll01年前1 -
 huahualiu1986 共回答了14个问题
huahualiu1986 共回答了14个问题 |采纳率92.9%醋是PH值小于7的酸性物质,但作为食品他确是碱性的.酸性物质和酸性食品是两个概念.世界的真实面目并不总是你从它表面感知到的那样,比如我们熟知的酸醋.酸醋的学名叫乙酸,分子式为CH3COOH.在被人体吸收代谢之前,它是不折不扣的酸性物质.所谓酸性物质,根据阿瑞尼士( S.Arrhenius) 的酸碱学说,是指该物质水溶液中游离出,或与水作用后产生的氢离子(H+)数量 比氢氧根离子(OH-)数量多的物质.反之,如果OH-的数量占主导量,则该物质为碱性.酸醋溶解于水后,产生的H+离子占据了主导量,此时它呈酸性.如果用酸碱指标pH值衡量,氢离子(H+)数量越多,pH值越低;(OH-)数量多,则pH值越高.一般而言,所有酸味的物质都是酸性物质.然而自然界的造化是神奇的.这种奇妙的造化最集中地体现在生命的新陈代谢上.大自然将宇宙中最复杂的化学反应给予了生命,于是自然态下原本单一的判断标准在生命体那里变得不再单一,这是化学反应变成高级的生命反应的过程.当酸醋从化学领域步入食物营养领域之后,酸醋成了碱性食品.酸/碱物质和酸性/碱性食品是两对不同的概念.酸性/碱性食品的酸碱度与进入人体之前的物质酸碱度没有必然的联系.判断食物的酸性和碱性,主要看食物中所含的碱性元素、酸性元素和有机酸在人体内代谢后的结果.通常,简单的判定方法为:凡含氯、硫、磷等非金属元素较高的食物,因其被摄入人体后最终的代谢产物呈酸性,多为酸性食物; 含钙、钾、钠、镁等金属元素较高的食物,因其被摄入人体后最终代谢产物呈碱性,多为碱性食物.英国学者克里比斯曾发现了“克氏循环”(因此克里比斯获1953年诺贝尔化学奖).在这循环中,进入人体的醋酸在一系列■促反应中与乳酸、柠檬酸与焦性葡萄糖酸结合(反应),放出二氧化碳和水,而二氧化碳则由肺部排出,因此减低了血液中的碳酸成分,使体液呈弱碱性.人们在服用醋2小时后,尿液将变清澈.醋还能使人对任何食品都感到味美,这也是人类适量服用醋可消除疲劳、提高预防疾病的能力、长保健康的原因.其他碱性食物进入人体之后对人体体液的趋碱性贡献也大致类同于这个原理.随著人体体液酸碱度与健康知识的普及,人们日益意识到维持体液弱碱性的重要性.人体健康的体液pH值呈弱碱性,为7.35左右(主要指血液).如果低于7.2,人体就处在亚健康状态,也极有可能得各种严重疾病——心脑血管病、骨质疏松、肾结石、关节炎、痛风、高血压、癌症、高脂血症等等——人体的酸化是百病之源.所以那些能够维持人体体液弱碱的食/饮品受到了人们的关注.然而食物的口味往往局限了人们的判断,很多人都把酸醋归结为酸性食品而不敢过多食用.其实和其他碱性食品一样,酸醋的保健作用是非常明显的.此外和酸醋一样,酸味的水果也往往会被人们误解为酸性食品.其实几乎所有水果经过人体代谢最终对体液的贡献都呈碱性.其他碱性食品和饮品还有蔬菜、牛奶以及优质的天然的水.在人们误将部分酸味食品当作酸性食品的同时,人们也在错误地把一部分酸性食/饮品归类为有益健康的碱/饮性食品,比如皮蛋和矿物质水.皮蛋在被人体吸收代谢之前是碱性的.但是进入人体之后,在消化系统的作用下,它被分解、氧化成许多带有硫、磷元素的酸性物质.这些酸性物质堆积在人体体液中,使体液变酸,诱发各种疾病.矿物质水是最近非常流行的一种饮用水,因为其名字上的取巧,人们往往错误地把它和矿泉水等同起来.矿物质水和矿泉水是两个各项指标相差很大的饮用水.矿泉水和天然水一样,因为含有人体所需的各种天然矿物质,因此它是弱碱性饮品.但矿物质水标榜的金属矿物质与我们平常概念中的矿物质是有很大区别.优质天然水中含有的金属矿物质是水在自然状态下,通过缓慢的溶解、诱导、富集岩石和土壤中的矿物元素,使之达到一个均衡的弱碱水平.这是一个人工难以模拟的自然态过程.但是矿物质水并非以天然的水源为原料,其是在纯净水(即经过反渗透等加工手段后去除了水中其他所有物质的饮用水)基础上添加人工矿化液制成的.纯净水本身是一种酸性饮品.这决定了矿物质水先天就有酸性的成分.其次,作为一种人工水,它含有的金属矿物质并不天然,而是通过添加人工矿化液,如硫酸制成的.这些矿化液中含有大量的氯、硫、磷等非金属元素,它们的含量远比金属元素多.进入人体后,它产生的酸性废物远比碱性物质多,会使人体趋酸.因此矿物质水在食品营养领域最终的归宿是酸性饮品,而非我们平常理解的因为有矿物质所以是碱性饮品.酸性食/饮品除了矿物质水和纯净水之外,还有肉类、碳酸饮料等.1年前查看全部
- 食盐是常见的调味品,同时它还是一种重要的化工原料.某场利用食盐可用来制取氢氧化钠、氢气和氯气等
食盐是常见的调味品,同时它还是一种重要的化工原料.某场利用食盐可用来制取氢氧化钠、氢气和氯气等
化学方程式为:2NaCl 2H2O 通电 Cl2(气体符号) H2(气体符号) 2NaOH若该厂每天用于生产的氯气钠的质量1.17t.问:(1)该厂每天最多可生产的氢氧化钠的质量是多少吨?(2)该厂每天最多能生产的氯气的质量是多少吨?氯气在该条件下的体积是多少升?(氯气在该条件下的密度为3.17g/l) 冰点gg1年前1
冰点gg1年前1 -
 其华 共回答了13个问题
其华 共回答了13个问题 |采纳率100%2NaCl + 2H2O =通电=Cl2↑+H2↑+2NaOH
117 71 80
11.7t x y
117/11.7t=71/x=80/y
x=7.1t
y=8t
(1)该厂每天最多可生产的氢氧化钠的质量是8吨
(2)该厂每天最多能生产的氯气的质量是7.1吨
氯气在该条件下的体积是7.1*10^6g/(3.17g/L)=2.24*10^6 升1年前查看全部
- 食盐是调味品还是食品添加剂
 admintor1年前3
admintor1年前3 -
 一枚糠果 共回答了14个问题
一枚糠果 共回答了14个问题 |采纳率92.9%食盐是调味品1年前查看全部
- 翻译:我要两茶匙调味品.
 wkgd1年前1
wkgd1年前1 -
 Brouo 共回答了19个问题
Brouo 共回答了19个问题 |采纳率89.5%I need two teaspoons of relish(或condiment).1年前查看全部
- 请用化学式或化学符号填空:空气中含量最多的气体是______;“固体酒精”的主要成分是______;食盐常用调味品和防腐
请用化学式或化学符号填空:空气中含量最多的气体是______;“固体酒精”的主要成分是______;食盐常用调味品和防腐剂,其主要成分含有的微粒是______;焙制糕点所用发酵粉主要成分之一的盐是______.
 8o3n1年前1
8o3n1年前1 -
 wsgcfzdm 共回答了19个问题
wsgcfzdm 共回答了19个问题 |采纳率94.7%解题思路:首先根据题意确定物质或粒子符号的化学名称,然后根据书写化学式、粒子符号的方法和步骤进行书写即可.空气中含量最多的气体是氮气,其化学式为:N2.
“固体酒精”的主要成分是酒精,其化学式为:C2H5OH.
食盐常用调味品和防腐剂,其主要成分是氯化钠,氯化钠是由钠离子和氯离子构成的,其离子符号分别为:Na+、Cl-.
碳酸氢钠是焙制糕点所用发酵粉主要成分之一,其化学式为:NaHCO3.
故答案为:N2;C2H5OH;Na+、Cl-;NaHCO3.点评:
本题考点: 化学式的书写及意义;化学符号及其周围数字的意义.
考点点评: 本题难度不大,熟练掌握常见物质的性质、用途、组成、构成及化学式、离子符号的书写是正确解答此类题的关键所在.1年前查看全部
- 酱油是我们日常生活中常用的调味品.小明用手提起一瓶酱油,凭经验感觉它密度要比水大,但到底是多大?于是他用一架天平、一个空
酱油是我们日常生活中常用的调味品.小明用手提起一瓶酱油,凭经验感觉它密度要比水大,但到底是多大?于是他用一架天平、一个空玻璃瓶和水(密度用ρ水表示)测出出了酱油的密度.
(1)小明的实验步骤如下,请完成③中的实验操作并用相关字母表示出所测的物理量;
①用调好的天平测出空玻璃瓶的质量m0;
②再用天平测出瓶子盛满水后的总质量m1;
③______.
(2)则酱油密度的表达式是ρ酱油=
ρ水m2−m0 m1−m0 .
ρ水m2−m0 m1−m0
(3)小明反思自己的测量过程后认为:即使上述实验过程中使用的天平非常精确,测量值也会略小于真实值.他做出这样猜想的理由是______. 渔途想民1年前1
渔途想民1年前1 -
 左边看右边看 共回答了19个问题
左边看右边看 共回答了19个问题 |采纳率89.5%解题思路:(1)根据密度公式ρ=mv可知,要求酱油的密度,需知道酱油的质量和体积,利用水的质量和密度可知瓶的容积,因此只需测量出满瓶酱油的质量即可;(2)利用密度公式ρ=mv写出酱油密度的表达式;(3)将杯中水倒出时,会有一些水残留在酱油瓶中,测出酱油的质量不准确,计算出的密度也就出现了误差.(1)已知空瓶的质量和装满水的总质量,则一瓶水的质量:m水=m1-m0,瓶的容积:v=
m1−m0
ρ水,因此还需将瓶中水倒掉,用天平测出瓶子装满酱油后的总质量m2;
(2)酱油的质量为:m2-m0,则酱油密度的表达式:ρ酱油=
m2−m0
m1−m0ρ水.
(3)将杯中水倒出时,由于瓶子粘水,所以会造成酱油的质量m2偏小.
故答案为:(1)倒掉水,用天平测出瓶子装满酱油后的总质量m2;(2)
m2−m0
m1−m0ρ水;(3)由于瓶子粘水,造成m2的测量结果偏小.点评:
本题考点: 液体密度的测量.
考点点评: 此题主要考查液体密度的测量方法以及如何减小误差,为了减小误差,测量时要注意部分酱油残留在瓶壁上.1年前查看全部
- 将下列四种家庭常用的调味品分别放入足量水中,不能形成溶液的是( )
将下列四种家庭常用的调味品分别放入足量水中,不能形成溶液的是( )
A.花生油
B.味精
C.食盐
D.蔗糖 天飞1年前1
天飞1年前1 -
 shadowfoxx 共回答了13个问题
shadowfoxx 共回答了13个问题 |采纳率92.3%解题思路:一种或几种物质分散到另一种物质中,形成均一的、稳定的混合物叫做溶液,它的基本特征是均一性和稳定性;只有被分散的物质在水中是可溶的,二者混合后才会形成溶液.A、花生油不溶于水,不能和水形成均一、稳定的混合物,即不能够形成溶液,故选项正确.
B、味精易溶于水,形成均一、稳定的混合物,属于溶液,故选项错误.
C、食盐易溶于水,形成均一、稳定的混合物,属于溶液,故选项错误.
D、蔗糖易溶于水,形成均一、稳定的混合物,属于溶液,故选项错误.
故选:A.点评:
本题考点: 溶液的概念、组成及其特点.
考点点评: 本题难度不大,掌握溶液的本质特征、各种物质的水溶性方面的知识是解答本题的关键.1年前查看全部
- 化学中什么是厨房用的调味品
 ribila1年前1
ribila1年前1 -
 拉风的小懒猪 共回答了18个问题
拉风的小懒猪 共回答了18个问题 |采纳率83.3%食盐,食醋,料酒,淀粉,味精,苏打1年前查看全部
- abcdefghix都是初中化学中常见的物质,已知d是一种生活中重要的调味品,efg无色无味的气体
 michelle6210001年前2
michelle6210001年前2 -
 zdedudella 共回答了17个问题
zdedudella 共回答了17个问题 |采纳率88.2%1) A B C D E F G H I X
Na2CO3(可对换)HCl H2O NaCl CO2 O2 H2 Fe CaCO3 Fe304
(2)Na2CO3 + 2HCl = 2NaCl + CO2(气标)+ H2O ;
4 H2 + Fe304 =高温= 3Fe + 4 H2O1年前查看全部
- (201k•永安市质检)将家庭中常用的四种调味品分别放入水中,不能形成溶液的是( )
(201k•永安市质检)将家庭中常用的四种调味品分别放入水中,不能形成溶液的是( )
A.花生油
B.蔗糖
C.醋
D.食盐 uu无被俘qq1年前1
uu无被俘qq1年前1 -
 Wanna851103 共回答了17个问题
Wanna851103 共回答了17个问题 |采纳率82.4%解题思路:一种或几种物质分散到另一种物质中,形成均一的、稳定的混合物叫做溶液,它的基本特征是均一性和稳定性;只有被分散的物质在水中是可溶的,二者混合后才会形成溶液.A、花生油不溶于水,不能和水形成均一、稳定的混合物,即不能够形成溶液,故选项正确.
B、蔗糖易溶于水,形成均一、稳定的混合物,属于溶液,故选项错误.
C、醋易溶于水,形成均一、稳定的混合物,属于溶液,故选项错误.
D、食盐易溶于水,形成均一、稳定的混合物,属于溶液,故选项错误.
故选A.点评:
本题考点: 溶液的概念、组成及其特点.
考点点评: 本题难度不大,掌握溶液的本质特征、各种物质的水溶性方面的知识是解答本题的关键.1年前查看全部
- 白醋是我们日常生活中常用的调味品,白醋中含有3%~5%的醋酸(CH 3 COOH).某化学研究小组围绕白醋开展了下列探究
白醋是我们日常生活中常用的调味品,白醋中含有3%~5%的醋酸(CH 3 COOH).某化学研究小组围绕白醋开展了下列探究.
Ⅰ.探究白醋的性质.
请完成表格内的相关内容:(可选择的试剂:白醋、镁条、碳酸钠粉末、5%的氢氧化钠溶液、酚酞试液、石蕊试液)
Ⅱ.探究影响化学反应快慢的因素.序号 实验方案 现象 结论 方案一 取少量白醋于试管中,加入紫色石蕊试液 ______ 白醋呈酸性 方案二 ______ ______ 白醋能于碱反应 方案三 ______ ______ ______
该小组同学根据酸的性质想到,白醋也能与铁锈反应.于是他们将生锈的铁钉放入白醋中,没有看到明显现象,老师提示这可能是因反应太慢造成的,于是他们对影响白醋与铁锈反应快慢的因素展开了探究.
【猜想】影响白醋与铁锈反应快慢的因素可能有:温度、铁锈的表面积大小、______等.
【探究过程】实验用品:5%的醋酸溶液、10%的醋酸溶液、20%的醋酸溶液、锈蚀程度相同的铁钉数枚、酒精灯、大试管等.
实验1.实验方案:如图,向三支试管中分别加入10mL不同浓度的醋酸溶液,然后同时放入锈蚀程度相同的铁钉1枚,观察现象.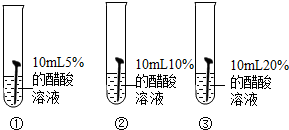
现象:试管①中看不到明显现象;试管②中铁锈消失较慢;试管③中铁锈很快消失.
结论:______.
实验2.实验方案:(请用简要文字说明)______.
结论:升高温度,白醋与铁锈反应能加快.
【总结反思】依据实验室制氧气的原理,______也是影响化学反应快慢的因素. CTO07581年前1
CTO07581年前1 -
 xlhwb8989 共回答了18个问题
xlhwb8989 共回答了18个问题 |采纳率88.9%Ⅰ.白醋里面含有醋酸,所以具有酸的共性,能使紫色的石蕊试液变红色,能与氢氧化钠发生中和反应从而使溶液中的碱性消失,根据提供的药品可以验证白醋与金属镁的反应也可以验证与碳酸钠粉末的反应都会有气泡产生;
Ⅱ.影响白醋与铁锈反应快慢的因素可能有:温度、铁锈的表面积大小、白醋的浓度(或含量)等.
由“试管①中看不到明显现象;试管②中铁锈消失较慢;试管③中铁锈很快消失.”可见醋酸浓度(或溶质质量分数)越大,白醋与铁锈反应越快(或浓度能影响反应快慢);
要想证明:升高温度,白醋与铁锈反应能加快.需要控制变量:温度,方案可以为:取两支试管,分别放入锈蚀程度相同的铁钉,同时加入等体积等浓度的白醋溶液,将其中一支试管加热,观察现象;
依据实验室制氧气的原理,催化剂也是影响化学反应快慢的因素.
故答案为:Ⅰ.
序号 实验方案 现象 结论
方案一 取少量白醋于试管中,加入紫色石蕊试液 紫色石蕊试液变 白醋呈酸性
方案二 取少量底油酚酞试液的氢氧化钠溶液于试管中,逐滴加入白 红色逐渐消 白醋能于碱反应
方案三 取一小段镁条于试管中,加入少量白 有气泡产 白醋能与金属反 Ⅱ.【猜想】白醋的浓度(或含量)
【探究过程】
实验1.结论:醋酸浓度(或溶质质量分数)越大,白醋与铁锈反应越快(或浓度能影响反应快慢)(能体现出浓度对反应快慢的影响即可)
实验2.实验方案:
取两支试管,分别放入锈蚀程度相同的铁钉,同时加入等体积等浓度的白醋溶液,将其中一支试管加热,观察现象
【总结反思】催化剂.1年前查看全部
- 下列与生活密切相关的化学知识中,说法正确的是( ) A.可用亚硝酸钠代替食盐作调味品 B.可用灼烧法区分羊毛和合成纤维
下列与生活密切相关的化学知识中,说法正确的是( ) A.可用亚硝酸钠代替食盐作调味品 B.可用灼烧法区分羊毛和合成纤维 C.只能通过吃药的方法补充钙元素 D.蔬菜和水果不能为人类提供营养素  黑姑娘1年前1
黑姑娘1年前1 -
 女儿媚 共回答了21个问题
女儿媚 共回答了21个问题 |采纳率85.7%A、亚硝酸钠有咸味,但它有毒,不能代替食盐作调味品,故选项说法错误.
B、用燃烧法鉴别合成维和羊毛,羊毛燃烧有烧焦羽毛的气味,合成纤维燃烧基本是无味的,故选项说法正确.
C、牛奶、肉类食品等食物中含有丰富的钙元素,故也可以从牛奶、肉类食品等食物中得到所需的钙元素,故选项说法错误.
D、蔬菜和水果中含有丰富的维生素,能为人类提供营养素;故选项说法错误.
故选B.1年前查看全部
- 下列有关物质用途的叙述中,不正确的是( ) A.食盐作调味品 B.氧气用于急救病人 C.碳酸氢钠作发酵剂 D.氢氧化钠
下列有关物质用途的叙述中,不正确的是( ) A.食盐作调味品 B.氧气用于急救病人 C.碳酸氢钠作发酵剂 D.氢氧化钠用于泡发鱿鱼等水产品  tqhal1年前1
tqhal1年前1 -
 mogeli 共回答了21个问题
mogeli 共回答了21个问题 |采纳率85.7%A、食盐的主要成分是氯化钠,它有咸味,可作调味品,所以正确.
B、氧气能供给呼吸,从而用于急救病人,所以正确.
C、碳酸氢钠能与面粉发酵产生的酸反应生成二氧化碳气体,也能受热分解产生二氧化碳气体,使食品疏松多孔,所以正确.
D、氢氧化钠有强腐蚀性,不能食用,所以错误.
故选D.1年前查看全部
- 某课外小组对日常生活中不可缺少的调味品M进行探究.已知C可在D中燃烧发出苍白色火焰.M与其他物质的转化关系如图1所示(部
某课外小组对日常生活中不可缺少的调味品M进行探究.已知C可在D中燃烧发出苍白色火焰.M与其他物质的转化关系如图1所示(部分产物已略去):

(1)写出用惰性电极电解M溶液的离子方程式2Cl-+2H2O
2OH-+H2↑+Cl2↑电解 .2Cl-+2H2O.
2OH-+H2↑+Cl2↑电解 .
(2)写出F的电子式______.
(3)若A是一种常见的酸性氧化物,且可用于制造玻璃,E溶液与F溶液反应可以制备一种胶体,则E溶液的俗称是______.
(4)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是______.
(5)若A是一种不稳定的盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,向G溶液中加入苯酚溶液后显紫色,则由A转化成E的离子方程式是______.
(6)若A是一种化肥.实验室可用A和B反应制取气体E,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露,写出E与D反应的化学方程式是______.
(7)若A是一种溶液,只可能含有H+、NH4+、Mg2+、Fe3+、Al3+、CO32-、SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图2所示,由此可知,该溶液中肯定含有的离子及其浓度之比为______. gaoliang09221年前1
gaoliang09221年前1 -
 太空监狱 共回答了20个问题
太空监狱 共回答了20个问题 |采纳率95%解题思路:(1)(2)C可在D中燃烧发出苍白色火焰,为氢气与氯气反应生成HCl,可推知C为H2、D为Cl2、F为HCl,M是日常生活中不可缺少的调味品,由转化关系可知,M的溶液电解生成氢气、氯气与B,可推知M为NaCl、B为NaOH,
(3)若A是一种常见的酸性氧化物,且可用于制造玻璃,则A为SiO2,E为Na2SiO3,与F溶液反应可以制备G为H2SiO3,;
(4)若A是一种常见金属单质,且与NaOH溶液能够反应,则A为Al,E为NaAlO2,则将过量的HCl溶液逐滴加入NaAlO2溶液中,先生成氢氧化铝,而后氢氧化铝溶解;
(5)若A是一种不稳定的盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,可推知A中含有Fe2+,E为Fe(OH)3,G为FeCl3;
(6)若A是一种化肥,实验室可用A和NaOH反应制取气体E,则E为NH3、A为铵盐,E与氯气相遇均冒白烟,且利用E与氯气的反应检验输送氯气的管道是否泄露,则氨气与氯气反应生成氯化铵,同时生成氮气;
(7)由图可知,开始加入NaOH没有沉淀和气体产生,则一定有H+,一定没有CO32-,后来有沉淀产生且最后消失,则一定没有Mg2+、Fe3+,一定含有Al3+;中间段沉淀的质量不变,应为NH4++OH-=NH3•H2O的反应,则含有NH4+,由电荷守恒可知一定含有SO42-,根据各阶段消耗的NaOH体积结合离子方程式计算n(H+):n(Al3+):n(NH4+)之比,再结合电荷守恒计算与n(SO42-)的比例关系,据此计算.(1)C可在D中燃烧发出苍白色火焰,为氢气与氯气反应生成HCl,可推知C为H2、D为Cl2、F为HCl,M是日常生活中不可缺少的调味品,由转化关系可知,M的溶液电解生成氢气、氯气与B,可推知M为NaCl、B为NaOH,用惰性电极电解M溶液的离子方程式为:2Cl-+2H2O
电解
.
2OH-+H2↑+Cl2↑,
故答案为:2Cl-+2H2O
电解
.
2OH-+H2↑+Cl2↑;
(2)F为HCl,分子中H原子与Cl原子之间形成1对共用电子对,其电子式为: ,
,
故答案为: ;
;
(3)若A是一种常见的酸性氧化物,且可用于制造玻璃,则A为SiO2,E为Na2SiO3,与F溶液反应可以制备G为H2SiO3,E的溶液俗称水玻璃,
故答案为:水玻璃;
(4)若A是一种常见金属单质,且与NaOH溶液能够反应,则A为Al,E为NaAlO2,则将过量的HCl溶液逐滴加入NaAlO2溶液中,先生成氢氧化铝,而后氢氧化铝溶解,故看到的现象为:溶液中逐渐有白色絮状沉淀生成,且不断增加;然后又由多到少,最后消失,
故答案为:溶液中逐渐有白色絮状沉淀生成,且不断增加;然后又由多到少,最后消失;
(5)若A是一种不稳定的盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,可推知A中含有Fe2+,E为Fe(OH)3,G为FeCl3,则由A转化成E的离子方程式是:4Fe2++8OH-+O2+2H2O=4Fe(OH)3↓,
故答案为:4Fe2++8OH-+O2+2H2O=4Fe(OH)3↓;
(6)若A是一种化肥,实验室可用A和NaOH反应制取气体E,则E为NH3、A为铵盐,E与氯气相遇均冒白烟,且利用E与氯气的反应检验输送氯气的管道是否泄露,则氨气与氯气反应生成氯化铵,同时生成氮气,反应方程式为:3Cl2+8NH3=N2+6NH4Cl,
故答案为:3Cl2+8NH3=N2+6NH4Cl;
(7)由图可知,开始加入NaOH没有沉淀和气体产生,则一定有H+,一定没有CO32-,后来有沉淀产生且最后消失,则一定没有Mg2+、Fe3+,一定含有Al3+;中间段沉淀的质量不变,应为NH4++OH-=NH3•H2O的反应,则含有NH4+,由电荷守恒可知一定含有SO42-,
发生反应H++OH-=H2O,氢离子消耗NaOH溶液的体积为1积,
发生反应Al3++3OH-=Al(OH)3↓,铝离子消耗NaOH溶液的体积为3体积,
发生反应NH4++OH-=NH3•H2O,铵根消耗氢氧化钠为2体积,
则n(H+):n(Al3+):n(NH4+)=1:1:2,由电荷守恒可知,n(H+):n(Al3+):n(NH4+):n(SO42-)=1:1:2:3,故c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3,
故答案为:c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3.点评:
本题考点: 无机物的推断.
考点点评: 本题考查无机物推断等,题目涉及元素化合物较多,需要学生全面掌握据基础知识,(7)中根据图象中的平台确定含有铵根离子是根据,注意离子方程式与电荷守恒的应用,难度中等.1年前查看全部
- 味精的主要成分为谷氨酸钠(化学式为C5H8NO4Na).因增加食品的鲜味、促进食欲而成为家庭常用的调味品.济宁市味精厂生
味精的主要成分为谷氨酸钠(化学式为C5H8NO4Na).因增加食品的鲜味、促进食欲而成为家庭常用的调味品.济宁市味精厂生产的“菱花”牌味精,其谷氨酸钠的含量可达85%以上.请回答:
(1)谷氨酸钠的相对分子质量是______;
(2)一袋包装为50g的“菱花”牌味精中,含谷氨酸钠的质量不少于______克. yashica1年前1
yashica1年前1 -
 在昼为影 共回答了21个问题
在昼为影 共回答了21个问题 |采纳率81%解题思路:(1)根据谷氨酸钠的化学式C5H8NO4Na可知,谷氨酸钠的相对分子质量=(碳的相对原子质量×碳原子个数)+(氢的相对原子质量×氢原子个数)+(氮的相对原子质量×氮原子个数)+(氧的相对原子质量×氧原子个数)+(钠的相对原子质量×钠原子个数);
(2)根据“味精质量×味精中谷氨酸钠的含量”计算即可.(1)根据谷氨酸钠的化学式C5H8NO4Na可知,谷氨酸钠的相对分子质量=12×5+8+14+16×4+23=169;
(2)50g×85%=42.5g.
故答案为:(1)189;(2)42.5g.点评:
本题考点: 化合物中某元素的质量计算;有关化学式的计算和推断.
考点点评: 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.1年前查看全部
- (2011•泰安)将家庭中常用的四种调味品分别放入水中,不能形成溶液的是( )
(2011•泰安)将家庭中常用的四种调味品分别放入水中,不能形成溶液的是( )
A.醋
B.蔗糖
C.花生油
D.食盐 lin12791年前1
lin12791年前1 -
 lyb123 共回答了12个问题
lyb123 共回答了12个问题 |采纳率83.3%解题思路:根据溶液的定义来判断本题,知道溶液的特点,悬浊液、乳浊液和溶液的区别.溶液的特点:均一性、稳定性、属于混合物,在外界条件不变时放多长时间也不会有物质析出,醋、蔗糖、食盐都属于均一、稳定的溶液,花生油不溶于水,与水混合形成的是乳浊液.
故选:C.点评:
本题考点: 悬浊液、乳浊液的概念及其与溶液的区别.
考点点评: 通过回答本题知道了溶液的特点尤其是均一性、稳定性;悬浊液和乳浊液都是不均一、不稳定的混合物.1年前查看全部
- 将下列四种家庭常用的调味品分别放入水中,不能形成溶液的是.
将下列四种家庭常用的调味品分别放入水中,不能形成溶液的是.
A.醋酸
B.蔗糖
C.食盐
D.香油 xlxan1年前1
xlxan1年前1 -
 邪之瞳 共回答了22个问题
邪之瞳 共回答了22个问题 |采纳率90.9%答案D
【分析】 本题以生活中常用的调味品为背景,考查溶液、悬浊液、乳浊液的区别.选项A、B、C中的物质均溶于水,且形成的液体具有均一性、稳定性,属于溶液.只有选项D中的物质不溶于水,搅拌后与水形成乳浊液.故正确选项为D.1年前查看全部
- 氯化钠用途广泛,不但是重要的调味品,又是重要的工业原料.
氯化钠用途广泛,不但是重要的调味品,又是重要的工业原料.
(1)通过晾晒海水或煮盐井水、盐湖水等均可得到含有较多杂质的氯化钠晶体:粗盐,这种方法属于______(填“物理”或“化学”) 变化.粗盐经过______、过滤、______可得到初步提纯.
(2)钠与氯气反应时,每个钠原子______(填“得到”或“失去”)1个电子形成钠离子(Na+),每个氯原子______(填“得到”或“失去”)1个电子形成氯离子(Cl-),Na+与Cl-由于静电作用而结合成NaCl. zz军161年前1
zz军161年前1 -
 孙金伟 共回答了20个问题
孙金伟 共回答了20个问题 |采纳率90%解题思路:根据已有的知识进行分析,粗盐提纯需经过溶解、过滤、蒸发等操作,金属原子易失去电子形成阳离子,非金属原子易得到电子形成阴离子.(1)从海水中得到粗盐晶体是物理变化,粗盐提纯需经过溶解、过滤、蒸发等操作,所以本题答案为:物理,溶解,蒸发;
(2)钠原子易失去电子,氯原子易得到电子,所以本题答案为:失去,得到.点评:
本题考点: 海水晒盐的原理和过程;原子和离子的相互转化.
考点点评: 本题考查了粗盐提纯的知识及原子和离子的转化,完成此题,可以依据已有的知识进行.1年前查看全部
- 亚硝酸钠(NaNO2)和食盐(NaCl)是两种不同的物质,食盐是日常调味品
亚硝酸钠(NaNO2)和食盐(NaCl)是两种不同的物质,食盐是日常调味品
从元素组成的角度和相对分子质量的角度分析它们的区别 shmily我是有有1年前1
shmily我是有有1年前1 -
 lanjing_0308 共回答了18个问题
lanjing_0308 共回答了18个问题 |采纳率94.4%氯化钠属于中性盐可以做食盐
亚硝酸钠具有氧化性不能作为食盐具有致癌作用.1年前查看全部
- 1.下列说法错误的是( )A.乙醇和乙酸都是常用的调味品的主要成分B.乙醇和乙酸的沸点和熔点都比乙烷、乙烯的沸点和熔点高
1.下列说法错误的是( )
A.乙醇和乙酸都是常用的调味品的主要成分
B.乙醇和乙酸的沸点和熔点都比乙烷、乙烯的沸点和熔点高
C.乙醇和乙酸都能发生氧化反应
D.乙醇和乙酸之间能发生酯化反应,酯化反应和皂化反应互为逆反应
(我就是想知道为什么不选择C呢?)
2.某有机样品3.1g完全燃烧,燃烧后的混合物通入过量的澄清石灰水,石灰水共增重7.1g ,经过过滤得到10g 沉淀.该有机样品可能是( )
A.乙二醇 B.乙醇 C.乙醛 D.甲醇和丙三醇的混合物 未激活471年前1
未激活471年前1 -
 心鉴mm 共回答了23个问题
心鉴mm 共回答了23个问题 |采纳率87%1,选D
为什么不选择C,原因是:点燃和02反应生成CO2和H2O也是氧化反应的
2,有机样品完全燃烧后的产品只有二氧化碳和水.
所以通过石灰水后,石灰水里增重的重量就是水和二氧化碳.
由沉淀有10克可以 通过二氧化碳和氢氧化钙反应生成碳酸钙的反应方程式
可以得出二氧化碳有0.1摩,
可以算出二氧化碳有4.4克,
从而算出水有2.7克.
现在可以用有机物碳元素守恒和氢元素守恒算出碳有0.1摩,氢有0.3摩,从而由有机物剩下的质量算出氧元素有0.1摩.
所以有机物的最简式为CH3O.
乙二醇符合那个最简式,
甲醇和丙三醇如果一比一混合也符合这个最简式.
所以选AD1年前查看全部
- 仿写:如果把坎坷看着一种调味品,你就会感到坎坷的生活也有汁有味
 庆倒斑ii821年前1
庆倒斑ii821年前1 -
 我不是牛魔王 共回答了19个问题
我不是牛魔王 共回答了19个问题 |采纳率94.7%如果把人脸看成一道风景,你就会觉得所谓的风景也有好有坏!1年前查看全部
- 花生油、盐、酱、醋是厨房中常用的调味品,将它们分别与足量水充分混合后,形成的混合物属于溶液的是( )
花生油、盐、酱、醋是厨房中常用的调味品,将它们分别与足量水充分混合后,形成的混合物属于溶液的是( )
①花生油②食盐③面酱④白醋A.①③ B.②③ C.①④ D.②④  想念_小鱼1年前1
想念_小鱼1年前1 -
 hechao111 共回答了20个问题
hechao111 共回答了20个问题 |采纳率100%能形成均一、稳定的混合物才是溶液,与水能形成溶液的物质一定是能溶于水的物质;花生油、面酱不溶于水,与水混合不能形成均一、稳定的混合物,而食盐、白醋都可溶于水,与水混合则能形成均一稳定的混合物.
故选D1年前查看全部
- 夏天,很多人都爱吃拌黄瓜,细心的同学会发现虽然拌黄瓜时加了盐和醋及其他一些调味品,黄瓜的外表面是有味的,但黄瓜果肉内却是
夏天,很多人都爱吃拌黄瓜,细心的同学会发现虽然拌黄瓜时加了盐和醋及其他一些调味品,黄瓜的外表面是有味的,但黄瓜果肉内却是淡的.这是因为( )
A. 拌的时间短
B. 细胞壁阻止盐进入细胞内
C. 细胞膜有选择透过性
D. 盐溶在醋中,无法进入细胞内 从不吃1年前1
从不吃1年前1 -
 海蓝色爱情 共回答了17个问题
海蓝色爱情 共回答了17个问题 |采纳率94.1%解题思路:细胞膜是由蛋白质和脂质构成的,细胞膜的结构特点是具有一定的流动性,功能特点是具有选择透过性.A、拌的时间短的话,外面应该也没有味道,A错误;
B、细胞壁是全透性的,不会阻止盐进入细胞内,B错误;
C、细胞膜有选择透过性,醋使细胞膜丧失选择透过性,盐可以进入细胞,所以外面是有味的,但是里面的细胞膜还没有丧失选择透过性,所以里面没有味道,C正确;
D、盐溶在醋中,但是醋不影响盐进入细胞内,D错误.
故选:C.点评:
本题考点: 生物膜的功能特性
考点点评: 本题以腌制黄瓜为例,考查了细胞膜的功能特点:选择透过性,理解细胞膜的功能特点,并能解决生活中的事例,是本题的基本要求.1年前查看全部
- 米醋是家庭常用的调味品 某同学通过上网查询 得知米醋的有效成分是醋酸 (化学式为
 传奇英雄加里波第1年前1
传奇英雄加里波第1年前1 -
 秋叶飘如雪 共回答了19个问题
秋叶飘如雪 共回答了19个问题 |采纳率84.2%2CH3COOH+Na2CO3=2CH3COONa+CO2+H2O
120 106 44
x 5.3g y
120/x=106/5.3g=44/y
x=6g
y=2.2g
(1)放出二氧化碳2.2克
(2)醋中醋酸的质量分数 6g/180g*100%=3.3%1年前查看全部
- 氯化钠是日常生活中的调味品,下列性质可以证明其中一定存在离子键的是
氯化钠是日常生活中的调味品,下列性质可以证明其中一定存在离子键的是
A具有较高的熔点 B熔融状态能导电
C 水溶液能导电 D 常温下易溶于水
why 137845931年前2
137845931年前2 -
 yangjunrong76 共回答了17个问题
yangjunrong76 共回答了17个问题 |采纳率100%B熔融状态能导电1年前查看全部
- 将下列四种家庭常用的调味品分别放入足量水中,不能形成溶液的是( )
将下列四种家庭常用的调味品分别放入足量水中,不能形成溶液的是( )
A. 芝麻油
B. 味精
C. 食盐
D. 白醋 WJ__JW1年前1
WJ__JW1年前1 -
 童_心 共回答了15个问题
童_心 共回答了15个问题 |采纳率80%解题思路:一种或几种物质分散到另一种物质中,形成均一的、稳定的混合物叫做溶液,它的基本特征是均一性和稳定性;只有被分散的物质在水中是可溶的,二者混合后才会形成溶液.A、芝麻油不溶于水,不能和水形成均一、稳定的混合物,即不能够形成溶液,故选项正确.
B、味精易溶于水,形成均一、稳定的混合物,属于溶液,故选项错误.
C、食盐易溶于水,形成均一、稳定的混合物,属于溶液,故选项错误.
D、白醋易溶于水,形成均一、稳定的混合物,属于溶液,故选项错误.
故选:A.点评:
本题考点: 溶液的概念、组成及其特点.
考点点评: 本题难度不大,掌握溶液的本质特征、各种物质的水溶性方面的知识是解答本题的关键.1年前查看全部
- (2011•房山区一模)①氧气用于气焊 ②食盐用作调味品 ③干冰用作制冷剂④小苏打用于治
(2011•房山区一模)①氧气用于气焊②食盐用作调味品 ③干冰用作制冷剂④小苏打用于治胃酸⑤用稀硫酸除去铁钉表面的铁锈下列物质的用途利用了其化学性质的是( )
A.只有①⑤
B.只有①③
C.只有②③⑤
D.只有①④⑤ volition231年前1
volition231年前1 -
 TT影子 共回答了22个问题
TT影子 共回答了22个问题 |采纳率90.9%解题思路:物质的化学性质是指在化学变化中表现出来的性质,物质的物理性质是指不需要通过化学变化表现出来的性质.①氧气用于气焊,是利用了氧气的助燃性,需要通过化学变化才表现出来,属于化学性质;
②食盐作调味品,没有发生化学变化,属于物理性质;
③干冰用作制冷剂,没有发生化学变化,属于物理性质;
④小苏打用于治胃病,与胃酸发生了反应生成新物质,属于化学性质;
⑤用稀硫酸除去铁钉表面的铁锈,有新物质生成,发生了化学变化,属于化学性质;
故①④⑤利用了化学性质;
故选D.点评:
本题考点: 化学性质与物理性质的差别及应用.
考点点评: 本题主要考查物质化学性质和物理性质的区别,理解物理性质和化学性质的本质区别----是否通过化学变化表现出来,需要通过化学变化表现出来的性质就化学性质,不需要化学变化就表现出来的就是物理性质.1年前查看全部
- 日常生活中,人们为了方便,常根据事物的差异性和相似性,把事物分门别类地整理,这个过程叫做分类.右图是对超市中部分调味品进
 日常生活中,人们为了方便,常根据事物的差异性和相似性,把事物分门别类地整理,这个过程叫做分类.右图是对超市中部分调味品进行分类的一个例子.请你参照如图分类的形式,根据所学知识,对酵母菌、大肠杆菌、海带、大豆、菠菜、蝴蝶、金鱼、家鼠等生物分类.
日常生活中,人们为了方便,常根据事物的差异性和相似性,把事物分门别类地整理,这个过程叫做分类.右图是对超市中部分调味品进行分类的一个例子.请你参照如图分类的形式,根据所学知识,对酵母菌、大肠杆菌、海带、大豆、菠菜、蝴蝶、金鱼、家鼠等生物分类.  kuerbaby1年前1
kuerbaby1年前1 -
 灰尘在跳舞 共回答了19个问题
灰尘在跳舞 共回答了19个问题 |采纳率73.7%解题思路:此题考查生物的分类.解答时可以从生物分类的依据方面来切入.生物包括植物(分为孢子植物和种子植物)、动物(无脊椎动物和脊椎动物)和微生物(分为真菌、细菌和病毒).
酵母菌是一种单细胞真菌,在有氧和无氧环境下都能生存,属于兼性厌氧菌.
大肠埃希氏菌通常称为大肠杆菌,1885年由Theodor Escherich发现,分布在自然界,大多数是不致病的,主要附生在人或动物的肠道里,为正常菌群,少数的大肠杆菌具有毒性,可引起疾病..
海带属于植物中的孢子植物中的藻类植物.
大豆、菠菜属于植物中的种子植物中的被子植物.
蝴蝶属于动物中的无脊椎动物中的昆虫.
金鱼属于动物中的脊椎动物中的鱼类.
家鼠属于动物中的脊椎动物中的哺乳类.
故答案为:
点评:
本题考点: 生物的分类及分类单位.
考点点评: 关键是理解不同生物分类类别.1年前查看全部
- (2014•陵县一模)大蒜是常见的调味品之一,大蒜中含有的大蒜素(化学式为C6H10S3)具有消毒杀菌作用.请计算:
(2014•陵县一模)大蒜是常见的调味品之一,大蒜中含有的大蒜素(化学式为C6H10S3)具有消毒杀菌作用.请计算:
(1)大蒜素中碳、氢两种元素的质量比.
(2)大蒜素中硫元素的质量分数. toguoqing1年前1
toguoqing1年前1 -
 注个名字好麻烦 共回答了15个问题
注个名字好麻烦 共回答了15个问题 |采纳率93.3%解题思路:(1)根据元素的质量比等于相对原子质量与原子个数乘积之比来分析;
(2)根据化合物中,元素的质量分数=
×100%来分析.相对原子质量×原子个数 相对分子质量 (1)大蒜素C6H10S3中,碳、氢两种元素的质量比为:(12×6):(1×10)=72:10=36:5;
(2)大蒜素中,硫元素的质量分数为:
32×3
12×6+1×10+32×3×100%≈53.9%.
故答案为:(1)36:5;
(2)53.9%.点评:
本题考点: 元素质量比的计算;元素的质量分数计算.
考点点评: 考查了根据化学式的相关计算,难度不大.1年前查看全部
- (2006•中山模拟)味精是烹制菜肴时常用的调味品,其主要成分是谷氨酸钠.谷氨酸钠有鲜味,易溶于水.小明发现某品牌味精包
(2006•中山模拟)味精是烹制菜肴时常用的调味品,其主要成分是谷氨酸钠.谷氨酸钠有鲜味,易溶于水.小明发现某品牌味精包装上标注:“谷氨酸钠含量≥80%,NaCl含量≤20%”,他想测定此味精中NaCl的含量.
查资料:NaCl+AgNO3=AgCl↓+NaNO3,谷氨酸钠的存在不影响NaCl性质.
实验过程:
①称取该味精样品5.0g,并溶于蒸馏水;②加入过量的硝酸银溶液;③过滤;④用蒸馏水反复洗涤沉淀物多次;⑤将沉淀物烘干、称量,测得固体质量为2.87g.
根据上述实验步骤回答下列有关问题:
(1)过滤操作所需要的仪器除烧杯、铁架台(带铁圈)、玻璃棒外,还需要的玻璃仪器是______;
(2)此样品中NaCl的质量分数为______,是否符合其包装上标注的标准?______.
应用:最近专家否认了“味精致癌”的说法.实验表明,味精在100℃加热半小时,只有0.3%的味精(谷氨酸钠)生成焦谷氨酸钠(有毒),其对人体的影响甚微.对此下列认识正确的是______.
A.谷氨酸钠受热不发生化学变化
B.谷氨酸钠在加热下生成焦谷氨酸钠是物理变化
C.大量食用味精不利于身体健康
D.研究问题的一种有效方法是通过实验. henson3251年前1
henson3251年前1 -
 dinolovek 共回答了21个问题
dinolovek 共回答了21个问题 |采纳率85.7%解题思路:(1)进行过滤操作最重要的一步就是过滤,需要的仪器较多烧杯(两只)、铁架台(带铁圈)、玻璃棒、漏斗、胶头滴管、洗瓶(塑料)等;
(2)根据生成的氯化银的质量计算出氯化钠的质量,进而求出质量分数,然后进行判断;
应用:根据所给的信息进行判断作出正确的判断.(1)要使液体与固体分离,用过滤的方法进行,缺少的仪器是漏斗(2)设调料味精中混有的氯化钠的质量为x NaCl+AgNO3=AgCl↓+NaNO3 58.514...
点评:
本题考点: 味精中食盐含量的探究;含杂质物质的化学反应的有关计算;酸、碱、盐的鉴别;根据化学反应方程式的计算.
考点点评: 进行解题是我们必须培养的能力,熟练的利用化学方程式根据已知的物质的质量计算求出其它物质的质量.1年前查看全部
- (2004•南宁)下列调味品中,与水充分混合后不能形成溶液的是( )
(2004•南宁)下列调味品中,与水充分混合后不能形成溶液的是( )
A.食用油
B.食盐
C.味精
D.蔗糖 铁衣远戍1年前1
铁衣远戍1年前1 -
 真_有借有还 共回答了15个问题
真_有借有还 共回答了15个问题 |采纳率86.7%解题思路:溶液是均一、稳定的混合物;溶液的本质特征是均一性、稳定性,属于混合物.A、食用油溶于水形成的是乳浊液,不均一、不稳定,不具有溶液特点;
B、食盐溶于水形成的液体,均一、稳定,属于溶液;
C、味精溶于水形成的液体,均一、稳定,属于溶液;
D、蔗糖溶于水形成的液体,均一、稳定,属于溶液;
故选A.点评:
本题考点: 溶液的概念、组成及其特点.
考点点评: 该题主要考查溶液的形成,在判断能否形成溶液时,可以结合生活经验、物质的溶解性、溶液的定义和特征进行判断,其中了解物质的溶解性是解题的关键.1年前查看全部
- 油、盐、酱、醋是厨房中常见的调味品,下列常见的调味品与水混合,能形成溶液的是( )
油、盐、酱、醋是厨房中常见的调味品,下列常见的调味品与水混合,能形成溶液的是( )
①花生油②食盐③面酱④白醋.A.①③ B.①④ C.②③ D.②④  changjinying1年前1
changjinying1年前1 -
 yxustrong 共回答了22个问题
yxustrong 共回答了22个问题 |采纳率86.4%①花生油不溶于水,不能和水形成均一、稳定的混合物,即不能够形成溶液.
②食盐易溶于水,形成均一、稳定的混合物,属于溶液.
③面酱不溶于水,不能和水形成均一、稳定的混合物,即不能够形成溶液.
④白醋易溶于水,形成均一、稳定的混合物,属于溶液.
故②④与水混合能形成溶液.
故选D.1年前查看全部
- 食醋是调味品,其中含有醋酸(C2H4O2),下列关于醋酸的叙述不正的是( )
食醋是调味品,其中含有醋酸(C2H4O2),下列关于醋酸的叙述不正的是( )
A.碳、氢、氧元素的质量比为6:1:8
B.醋酸分子中含有氧分子
C.属于有机物
D.醋酸分子中碳、氢、氧原子个数比为1:2:1 南深北广1年前1
南深北广1年前1 -
 wtopia 共回答了17个问题
wtopia 共回答了17个问题 |采纳率100%解题思路:A、根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行计算判断.
B、根据分子是由原子构成的进行分析判断.
C、根据有机物的概念来判断.
D、根据醋酸化学式的含义进行分析判断.A、醋酸中碳、氢、氧元素的质量比为(12×2):(1×4):(16×2)=6:1:8,故选项说法正确.
B、分子是由原子构成的,醋酸分子中含有氧原子,不含氧分子,故选项说法错误.
C、醋酸是由碳、氢、氧三种元素组成的化合物,属于有机物,故选项说法正确.
D、由醋酸的化学式可知,一个醋酸分子是由2个碳原子、4个氢原子和2个氧原子构成的,则醋酸分子中碳、氢、氧原子个数比为1:2:1,故选项说法正确.
故选:B.点评:
本题考点: 化学式的书写及意义;有机物与无机物的区别;元素质量比的计算.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用有机物的概念、化学式的含义与有关计算进行分析问题、解决问题的能力.1年前查看全部
大家在问
- 1新兴商场进了两批电吹风卖的钱都是500,同进价比,第一批赚了25%,第二批赔了25%
- 2求(arctanx)/(x^2*(1+x^2))的不定积分
- 3已知当x=-2时,分式 无意义,x=4时,此分式的值为0,则a+b=
- 4电动势,电流和电压的参考方向(正方向)和数值正负的意义!
- 5把多项式﹣3+2ab的平方+a的三次方b-4a的平方b的三次方按a的升幂排列和b的降幂
- 6如图所示,在水平向右的匀强电场E和水平向里的匀强磁场B并存的空间中,有一个足够长的水平光滑绝缘面MN.面上O点处放置一个
- 7(2005•盐城三模)康普顿效应证实了光子不仅具有能量,也有动量.如图给出了光子与静止电子碰撞后,电子的运动方向,则碰后
- 8已知x-2y=8,若x>4,则y的最小整数为n=______.
- 9《夸父逐日》包含的一个成语是什么?
- 10设f(x)是定义在区间[-1,1]上的偶函数,当x∈[-1,0]时,f(x)=g(2-x),且当x∈[2,3]时,g(x
- 11六年级男生收集了145节废旧电池,女生比男生多收集20%。六年级学生一共收集废旧电池多少节。这题怎么做?
- 12出发点是什么意思
- 13烷烃,乙醇,烯烃分别和氢溴酸反应生成的物质的名称和反应时的条件.
- 14我不知道什么时候英语单词在语句中要用到复数,或加s.请详解,谢谢,
- 15苏七块 苏七块苏大夫本名苏金散,民国初年在小白楼一带,开所行医,正骨拿环,天津卫挂头牌.连洋人赛马,折胳膊断腿,也来求他
