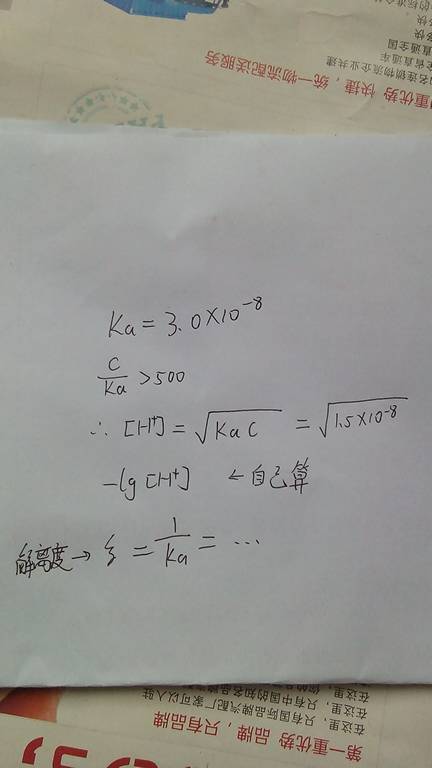解离度问题~某一元弱酸的Ka=1*10^-7,0.10mol/L的该酸溶液的解离度?
 alibe2022-10-04 11:39:541条回答
alibe2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 修罗神 共回答了15个问题
修罗神 共回答了15个问题 |采纳率93.3%- Ka=X2/0.1
X=10^-4
该酸溶液的解离度=X/0.1=0.001=0.1% - 1年前
相关推荐
- (2)如果在1L 0.10mol/L的HAc溶液中加入0.10mol固体NaAc,溶液的[H+]和解离度x各为多少?已知
(2)如果在1L 0.10mol/L的HAc溶液中加入0.10mol固体NaAc,溶液的[H+]和解离度x各为多少?已知HAc的Ka=1.76*10-5
 晴晴天空淡淡风1年前2
晴晴天空淡淡风1年前2 -
 ljj131254 共回答了15个问题
ljj131254 共回答了15个问题 |采纳率86.7%设平衡时[H+]=χ,HAc = H- + Ac+
起始相对浓度:0.1 0 0.1
平衡相对浓度:0.1-χ χ 0.1 + χ
Ka= (0.1+x)x / (0.1-x) = 1.76*10-5
因为0.1/Ka>400,加上同离子效应使平衡向左移动,所以0.1 + χ≈0.1;0.1-χ≈0.1,
代入上式得:Ka = 0.1x / 0.1 = x
即:[H]+=1.76*10-5 mol/L
解离度=1.76*10-5 / 0.1 ×100%=0.0176%
同离子效应使HAc的解离度大幅下降1年前查看全部
- 大一基础化学0.5mol/kg弱酸HA的水溶液、凝固点为–1.04°C、该算的解离度是多少?还有算渗透压的时候、公式里的
大一基础化学
0.5mol/kg弱酸HA的水溶液、凝固点为–1.04°C、该算的解离度是多少?还有算渗透压的时候、公式里的浓度是指渗透浓度么?
求回答•﹏• 恋恋天地1年前1
恋恋天地1年前1 -
 lailinxin 共回答了25个问题
lailinxin 共回答了25个问题 |采纳率84%1、拉乌尔定律
△t = b kf
2、求溶质质量摩尔浓度
--------------------HA = H+ + A-
初(mol/kg) 0.5 0 0
平(mol/kg) 0.5 - 0.5α 0.5α 0.5α
b(总)= 0.5 - 0.5α + 0.5α + 0.5α = 0.5 + 0.5α
3、求电离度 α
查得:kf = 1.86 K•Kg/mol
△t = b kf
1.04 = ( 0.5 + 0.5 α )*1.86
α = 11.83%
算渗透压的时候,公式里的浓度是指渗透浓度1年前查看全部
- 0.1mol每升的 醋酸溶液,酸的解离平衡常数0.00005,则醋酸的解离度是……
 wei0070080091年前1
wei0070080091年前1 -
 9ww66 共回答了18个问题
9ww66 共回答了18个问题 |采纳率88.9%设解离度为a,则根据方程式有[0.1a]^2/0.1(1-a)=0.00005;
因为a很小,所以1-a≈1,解得a=0.0005开根号1年前查看全部
- 在室温下0.100mol/LNH3•H2O的解离度为1.34%,计算NH3•H2O的Kb和溶液的
在室温下0.100mol/LNH3•H2O的解离度为1.34%,计算NH3•H2O的Kb和溶液的pH.
 certificate1年前1
certificate1年前1 -
 天上下着小雪 共回答了19个问题
天上下着小雪 共回答了19个问题 |采纳率94.7%根据离解率得kb=c(OH-)c(NH4+)/c(NH3*H2O)=(0.1mol/LX1.34%)(0.1mol/LX1.34%)/[0.1-(0.1mol/LX1.34%)]=0.0000017956/0.09866≈1.82X10^-5,kw/c(OH-)≈7.46x10^-12,PH=-lgc(H+)=-lg[kw/c(OH-)]≈12-lg7.46≈12-0.87≈11.131年前查看全部
- 0.01mol·L-1HAc溶液的解离度为4.2%,求该溶液的〔H+〕
 普通帖一般不回1年前1
普通帖一般不回1年前1 -
 rrrfe 共回答了14个问题
rrrfe 共回答了14个问题 |采纳率78.6%〔H+〕=0.01*4.2%=0.000421年前查看全部
- 《新大学化学》第二章 课后习题 计算下列溶液中的b(H+)、b(Ac-)和(1)、(2)的解离度a(1)0.050mol
《新大学化学》第二章 课后习题
计算下列溶液中的b(H+)、b(Ac-)和(1)、(2)的解离度a
(1)0.050mol*kg^-1 HAc溶液
(2)0.10mol*kg^-1 HAc溶液中加入等质量的0.05mol*kg^-1 KAc溶液
(3)0.10mol*kg^-1 HAc溶液中加入等质量的0.05mol*kg^-1 HCl溶液
(4)0.10mol*kg^-1 HAc溶液中加入等质量的0.05mol*kg^-1 NaOH溶液
在18°C时,PbSO4 的溶度积为1.82*10^-8 ,试求在这个温度PbSO4在0.1mol*kg^-1 K2SO4溶液中的溶解度
在18°C时,AgBr 的溶度积为5.35*10^-13 ,在纯水中AgBr的溶解度是多少?在0.10mol/kg的NaBr溶液中AgBr的溶解度是多少?
通过计算说明
(1)在100g 0.15mol/kg的K[Ag(CN)2]溶液中加入50g 0.10mol/kg的 KI溶液,是否有AgI沉淀产生?
(2)在上述混合溶液中加入50g 0.20mol/kg 的KCN溶液,是否有AgI沉淀产生?
请在半小时内回复答案, yuanhai1年前1
yuanhai1年前1 -
 s60693 共回答了20个问题
s60693 共回答了20个问题 |采纳率90%47、要有酸的离解常数才能计算.
50、PbSO4=Pb2++SO42-
X X 0.1 0.1X=1.82*10^-8,X=1.82 *10^-7,溶解度S= 303*1.82 *10^-*100/1000=5.51 *10^-6 .
51、纯水中AgBr=Ag++Br-
X X X X^2=5.35*10^-13 溶解度S=188*7.31*10^-7*100/1000=1.37*10^-5;
在0.10mol/kg的NaBr溶液中AgBr=Ag++Br-
X X 0.1,0.1X=5.35*10^-13,溶解度S=188*5.35*10^-12*100/1000=1*10^-10
52、要有离解常数才能计算.1年前查看全部
- 计算0.5mol.l的HClO溶液的PH值及解离度
 jeson231年前1
jeson231年前1 -
 长翅膀的雪人 共回答了18个问题
长翅膀的雪人 共回答了18个问题 |采纳率94.4%1年前查看全部
- 取5mol/LHAc溶液20mL加水到1000mL,求此溶液中H+浓度、HAc解离度及PH值(已知HAc的Ka=1.8×
取5mol/LHAc溶液20mL加水到1000mL,求此溶液中H+浓度、HAc解离度及PH值(已知HAc的Ka=1.8×10-5)
 zys_3651年前2
zys_3651年前2 -
 fle2o 共回答了17个问题
fle2o 共回答了17个问题 |采纳率94.1%5mol/L×20÷1000=0.1mol/L
HAc ≒ H+ + Ac-
Ka=c(H+)*c(Ac-)÷c(HAc)=1.8×10^-5
设由水电离出H+不计,电离的HAc计算时也忽略
则c(H+)=1.34×10^-3mol/L PH=2.873
电离度=1.34×10^-3÷0.1×100%=1.34%1年前查看全部
- 两种方法测定HAc解离度和解离常数的原理有何不同
 oslin1年前1
oslin1年前1 -
 火箭粑粑 共回答了23个问题
火箭粑粑 共回答了23个问题 |采纳率95.7%一种是通过测定电导率得到电离度,再得到电离平衡常数.
二是先测得PH值,得到氢离子浓度,再得到电离度和电离平衡常数.1年前查看全部
- 1.设0.10mol.L 氢氧酸(NCN)溶液的解离度为0.0079%,试求此时溶液的PH和HCN的标准解离常数Ka2.
1.设0.10mol.L 氢氧酸(NCN)溶液的解离度为0.0079%,试求此时溶液的PH和HCN的标准解离常数Ka2.在100ML0.0200mol.L MVNcl2中,加入容度为0.0100mol.L氨水100ML,计算在氨水中含有多少克NH4CL时才不侄生成Mn(OH)2沉淀(设溶液混合时无体积效应)?可以写起步骤来吗 可以在画图那里把过程写出来 然后截图我看吗?
 augurwang1年前1
augurwang1年前1 -
 天赤 共回答了18个问题
天赤 共回答了18个问题 |采纳率94.4%(1) HCN=H++CN- 0.10~X~~XX=0.10*0.0079%=0.0000079mol.LPH=lg(0.0000079)(自己算)Ka=(0.0000079)2/(0.10-0.0000079)=(0.0000079)^2/0.10(自己算)(2)条件不足,Mn(OH)2的溶度积常数未给出!1年前查看全部
- 关于无机化学上册的习题 解题步骤中的解离度公式是怎么来的?就是解离度公式是怎么列出来的?求教
 yesongqin11年前1
yesongqin11年前1 -
 jyuanqing 共回答了15个问题
jyuanqing 共回答了15个问题 |采纳率93.3%这样 NO2 是由 四氧化二氮分解来的, 如果有b的二氧化氮,那就有b/2的四氧化二氮分解了,加上剩下的a,那原来一共有四氧化二氮b/2+a,反应掉的又b/2 所以解离度式子就是你看到的那个了1年前查看全部
- 某浓度为0.10mol/L的一元弱酸溶液,其pH为2.77,求这一弱酸的解离常数及该条件下的解离度.
 马志勇1年前1
马志勇1年前1 -
 ww中的宝贝 共回答了29个问题
ww中的宝贝 共回答了29个问题 |采纳率86.2%设该一元弱酸为HA,解离常数为K
pH=2.77,[H+]=10^(-2.77)=0.0017(mol/L)
HA=H+ + A-
0.1-0.0017 0.0017 0.0017
K=0.0017²/(0.1-0.0017)=2.93×10-5
解离度α=0.0017/0.1=1.7%1年前查看全部
- 解离度计算题光气的分解反应COCL2(g)=co(g)+cl2(g)在373时标准平衡常数K=8.80*10-9求在37
解离度计算题
光气的分解反应COCL2(g)=co(g)+cl2(g)在373时标准平衡常数K=8.80*10-9求在373K平衡后总压力P总=202.6KPA光气的解离度?
求的是COCL2的解离度? 陌生人的痛1年前1
陌生人的痛1年前1 -
 乖乖_乖 共回答了24个问题
乖乖_乖 共回答了24个问题 |采纳率79.2%假设起始光气的压强为n,CO和Cl2的分压为0.
-----COCL2(g)=co(g)+cl2(g)
起始:n----------------0------0
转化:nX--------------nX-----nX
平衡:n-nX-----------nX-------nX
总压=n-nX+nX+nX=n+nX=202.6KPa
平衡常数K=(nX)^2/(n-nX)=8.80*10-91年前查看全部
- 已知K(HAC)=1.75*10的负五次方,常温下浓度为0.1mol/l的HAC溶液,其解离度为
 jitgr1年前1
jitgr1年前1 -
 cigarlee 共回答了16个问题
cigarlee 共回答了16个问题 |采纳率87.5%溶液中c(H+)和c(Ac-)浓度相等,根据公式K=c(H+)×c(A-)÷c(HAc) 所以c(H+)2=c(A-)2=1.76^10-5÷0.1 c(H+)=1.32×10^-2 所以电离度=1.32×10^-2÷0.1×100%=13.2%1年前查看全部
- 氨水中氨分子减少,解离度变化?大学的普通化学
 火柴02011年前1
火柴02011年前1 -
 叶子上冰 共回答了16个问题
叶子上冰 共回答了16个问题 |采纳率93.8%根据NH3==NH4+ +OH- (可逆)
NH3减少 平衡向左 解离度减弱1年前查看全部
- 某一元弱酸溶液浓度为0.1mol/L其PH值为2.77,求这一弱酸的解离常数及该条件下的解离度.
 saintgeorge1年前1
saintgeorge1年前1 -
 fl521126 共回答了24个问题
fl521126 共回答了24个问题 |采纳率91.7%PH值为2.77,氢离子的浓度为1.7*10(-3)次方,那么解离度为1.7*10(-3)/0.1=0.017,解离常数为0.017的平方*0.1=0.0000289
用的是稀释定律1年前查看全部
- 一定温度下,醋酸的解离度和解离常数变化吗?
一定温度下,醋酸的解离度和解离常数变化吗?
如题.数值是多少 ppyangcheng1年前3
ppyangcheng1年前3 -
 wanshi216 共回答了21个问题
wanshi216 共回答了21个问题 |采纳率95.2%在一定温度下,醋酸的解离度随着浓度的变化而变化,浓度增大,解离度变小;浓度减小,解离度增大.解离常数不变化.
在25℃时,解离常数K=1.75*10^-51年前查看全部
- .计算0.1mol/LNH3·H2O溶液的pH和解离度α,已知NH3·H2O的Kb= 1.76×10-5
 zhangjuan04291年前1
zhangjuan04291年前1 -
 真曦 共回答了30个问题
真曦 共回答了30个问题 |采纳率90%0.1 mol/L的 NH3溶液中,[OH-] = √ (cKb) = √[0.1 * 1.74 ×10^(-5)] = 1.32 ×10^(-3)
pH = 14 - pOH = 14 + lg[OH-] = 14 + lg [1.32 ×10^(-3)] = 11.12
α = 已经解离的NH3 / 未解离的NH3 = [OH-] / c(NH3) = 1.32 ×10^(-3) ÷ 0.1 * 100% = 1.32 %1年前查看全部
- 改变乙酸溶液的温度,乙酸的解离度和解离常数有无变化,为什么?
 hefei33661年前1
hefei33661年前1 -
 鲛小泪 共回答了14个问题
鲛小泪 共回答了14个问题 |采纳率85.7%有变化,解离度是解离常数的函数,解离常数又是温度的函数,所以温度变解离常数变解离度变1年前查看全部
- 25摄氐度时,0.1mol/LHAc溶液解离度为1.34%,计算该溶液中HAc浓度是多少?
25摄氐度时,0.1mol/LHAc溶液解离度为1.34%,计算该溶液中HAc浓度是多少?
怎么算列出工式. andy_hyf1年前1
andy_hyf1年前1 -
 星雨莲 共回答了20个问题
星雨莲 共回答了20个问题 |采纳率95%c(HAc)=0.1×(1-1.34%)=0.09866mol/L1年前查看全部
- 相同浓度的 HCN、HAc,苯甲酸,正确的说法是A解离度相同 B解离常数相同 C(H+)相同 D以上说法均错误
 adasg0gh0h0j001年前2
adasg0gh0h0j001年前2 -
 石磨 共回答了18个问题
石磨 共回答了18个问题 |采纳率88.9%选D,不同酸的解离度、解离常数、c(H+)均是不同的.1年前查看全部
- 同离子效应对弱电解质的解离度及难溶强电解质的溶解度各有什么影响
 大危危1年前3
大危危1年前3 -
 特洛伊嗨嗨 共回答了27个问题
特洛伊嗨嗨 共回答了27个问题 |采纳率81.5%相当于增加产物浓度,平衡逆向移动,即抑制弱电解质的解离度、使难溶强电解质的溶解度减小.1年前查看全部
- 0.1mol/L的某一有机酸的钠盐溶液,其pH=10.0,该同浓度弱酸的解离度为
 1荷叶1年前1
1荷叶1年前1 -
 hua0103 共回答了16个问题
hua0103 共回答了16个问题 |采纳率87.5%pH=10,则c(OH-)=0.0001mol/L,c(H+)=10^-10mol/L,设该弱酸为HA,则由正负电荷守恒可知有c(Na+)+c(H+)=c(OH-)+c(A-),c(Na+)=0.1mol/L,远大于c(H+),因此可知溶液中c(A-)=0.0999mol/L,由于c(A-)+c(HA)=c(Na+),可知水解产...1年前查看全部
- (1)0.10mol/L HAc溶液的[H+]和解离度X
 子非鱼6301年前1
子非鱼6301年前1 -
 一级认证丑男 共回答了16个问题
一级认证丑男 共回答了16个问题 |采纳率93.8%由于0.1 mol/L,浓度较大,水的电离可以忽略.用最简式计算就行.
HAc = H+ + Ac- Ka = 1.76*10-5
0.1 x x
所以x^2 ÷0.1 = 1.76*10-5
x=1.33 × 10^-3 mol
[H+]=1.33 × 10^-3 mol/L
解离度 = 1.33 × 10^-3 ÷0.1 =1.33 %1年前查看全部
- 如果改变温度,对HAc的解离度和解离常数有何影响?急需!
 依舞儿1年前1
依舞儿1年前1 -
 AdolphZhou 共回答了18个问题
AdolphZhou 共回答了18个问题 |采纳率100%电离过程一般都是吸热的,加热会让转化率提高,K增大,降温则相反.1年前查看全部
- 已知某温度下0.01mol·L-1HAC溶液的解离度为4.2%,求此溶液的【H+】和PH
 谢韵婷1年前1
谢韵婷1年前1 -
 tianxi671 共回答了19个问题
tianxi671 共回答了19个问题 |采纳率100%[H+]=0.01*4.2%=0.00042mol/L
PH=-lg0.00042=4-lg4.2=4-0.6=3.41年前查看全部
- 将弱电解质水溶液稀释其解离度增大,该弱电解质所电离出的离子浓度变化
 joeguo1年前1
joeguo1年前1 -
 huangbangtang 共回答了18个问题
huangbangtang 共回答了18个问题 |采纳率94.4%弱电解质水溶液在稀释后,它所电离的离子浓度都减小.稀释后虽然平衡右移,但根据勒夏特列原理,右移只是减弱离子浓度减少的程度,但不能改变离子浓度减少的事实.所以离子浓度还是比稀释前减小了.1年前查看全部
- 0.01mol每升醋酸解离度0.042求醋酸的解离常数和氢离子浓度
 枫红秋山1年前1
枫红秋山1年前1 -
 坏ww 共回答了17个问题
坏ww 共回答了17个问题 |采纳率94.1%溶液中H+浓度为0.01*0.042=0.00042mol/L
K=c(H+)*c(CH3COO-)/c(CH3COOH)=0.00042^2/(0.01-0.01*0.042)=1.84*10^(-5)1年前查看全部
- 请问小麦面筋蛋白酶解的时候怎么求水解度,其中a一氨基解离度怎么求?
 oibook1年前1
oibook1年前1 -
 tiankf 共回答了13个问题
tiankf 共回答了13个问题 |采纳率92.3%蛋白质酶解程度的测定都是测a-氨基的量,通过反应前后a-氨基的量的变化再除以总的肽键数来得到.其中a-氨基的测定一般是让它先跟某个显色物质反应,然后通过测定一定波长的吸光度.选用一定的标准氨基酸如L-亮氨酸,L-赖氨酸等,做出这个标准氨基酸跟显色物质反应的标准曲线.结合上面的吸光度和标准曲线再得出 以标准氨基酸为参照的a-氨基浓度.
测出来的a-氨基浓度值是一个当量值,不是一个绝对值,它是以某种标准氨基酸为参照得出来的.
总的肽键数一般是酸充分水解后得出,一般常用的蛋白质都已经有数据得出来了,查查资料就知道了.1年前查看全部
- 1、在NH3溶液中,欲使NH3的解离度和溶液的pH值都减小,则应加入
1、在NH3溶液中,欲使NH3的解离度和溶液的pH值都减小,则应加入
A.NaOH溶液
B.HCl溶液
C.NaCl固体
D.NH4Cl固体
2、0.01 mol·L-1 磷酸溶液中PO43-的平衡浓度为(H3PO4的Ka1=7.52×10-3、Ka2=6.23×10-8、Ka3=4.79×10-13)
A.5.24×10-21
B.4.79×10-18
C.3.44×10-13
D.6.23×10-8
3、HAc在下列溶剂中酸性最大的是、
A.液态氟化氢
B.盐酸
C.水
D.液氨
4、要使0.10 mol ·L-1 H2S溶液中的[S 2— ]浓度为1.0×10—20 mol·L-1,则需控制H2S溶液中的H+浓度为(已知H2S:Ka1 = 8.91×10-8,Ka2 = 1.0×10-14 )
A.8.91×10-3 mol ·L-1
B.0.094 mol·L-1
C.0.30 mol ·L-1
D.9.4×10-5 mol·L-1
5、已知醋酸的解离常数为1.74×10 -5,则0.10 mol·L-1 NaAc溶液的pH值为
A.8.88
B.5.12
C.11.12
D.2.88
就5个基础题哦.帮帮忙做下. 一根小骨头1年前1
一根小骨头1年前1 -
 youihi 共回答了19个问题
youihi 共回答了19个问题 |采纳率84.2%D
B
D
B
A1年前查看全部
- 无机化学化学平衡常数可以用解离度表示吗
 hujian471年前1
hujian471年前1 -
 大米MM 共回答了14个问题
大米MM 共回答了14个问题 |采纳率85.7%当为沉淀溶解平衡时AB型 Ksp={s}*{s};A2B型:Ksp=4*{s}的立方1年前查看全部
- 室温下,0.2mol•L-1 HCOOH(甲酸)溶液的解离度为3.2%,计算甲酸的解离常数和该溶液中H+的浓度?
 hdw761年前1
hdw761年前1 -
 十年以后了 共回答了16个问题
十年以后了 共回答了16个问题 |采纳率87.5%解题思路:根据HCOOH(甲酸)溶液的电离度求出氢离子浓度和甲酸根离子的浓度,再根据Ka=
计算.c(HCOO−)•c(H+) c(HCOOH) 室温下,0.2mol•L-1 HCOOH(甲酸)溶液的电离度为3.2%,则甲酸电离电离出来的c(H+)=c(HCOO-)=0.2×3.2%=6.4×10-3mol•L-1,
则Ka=
c(HCOO−)•c(H+)
c(HCOOH)=
(6.4×10−3)2
0.2−6.4×10−3≈0.2048;
答:甲酸的电离常数为0.2048;该溶液中H+的浓度为6.4×10-3mol•L-1.点评:
本题考点: 弱电解质在水溶液中的电离平衡.
考点点评: 本题考查了弱酸的电离常数的计算,题目难度不大,侧重于对电离常数表达式的应用的考查.1年前查看全部
- 乙酸的解离度越小解离常数怎么变化?
 退潮之海1年前1
退潮之海1年前1 -
 wiseliefer 共回答了16个问题
wiseliefer 共回答了16个问题 |采纳率87.5%不变,解离常数只与温度的变化有关.醋酸的电离与温度有关,醋酸电离需要吸收热量,温度越高,醋酸的电离程度越大,电离常数也随之增大.1年前查看全部
- 设0.01mol*dm-3的氢氰酸溶液的解离度为0.010%,求该温度时,HCN的解离常数?
 川水流1年前1
川水流1年前1 -
 拉弓不射箭 共回答了27个问题
拉弓不射箭 共回答了27个问题 |采纳率88.9%K=Cα^2/(1-α)=0.01*(1*10^-4)^2=1*10^-10
1-α近似等于11年前查看全部
- 当溶液浓度相等时.下列物质的解离度最大的是()
当溶液浓度相等时.下列物质的解离度最大的是()
A.NH4Cl B.HAc C.NaCl D.NH3·H2O das0f0g0001年前1
das0f0g0001年前1 -
 luobacl 共回答了11个问题
luobacl 共回答了11个问题 |采纳率81.8%选A,B和D电离不完全并抑制水的电离,C完全电离但不会影响水的电离.A电离完全并促进水的电离.(盐类水解促进水的电离,氯化铵是强酸弱碱盐)1年前查看全部
- 以PH法测定醋酸的标准电离常数和解离度,应采用怎样的测定顺序?为什么?
 candychouchou1年前1
candychouchou1年前1 -
 媛媛0418 共回答了20个问题
媛媛0418 共回答了20个问题 |采纳率95%先测定pH,然后测定浓度
Ka=[H+][CH3COO-]/[CH3COOH]1年前查看全部
- 在氨水中加入NaCl时,氨水的解离度和溶液的PH值变化?
 专为HC图片来1年前4
专为HC图片来1年前4 -
 oo幽香 共回答了15个问题
oo幽香 共回答了15个问题 |采纳率86.7%氨水的解离度将会增加,这是弱电解质的盐效应,即在弱电解质溶液中加入其他强电解质会使弱电解质溶液解离度增大.所以OH-浓度也增大,导致PH增大.1年前查看全部
- 在HAC溶液中加入NaAc,HAc解离度和PH值分别将
在HAC溶液中加入NaAc,HAc解离度和PH值分别将
1.增大,降低
2.降低,增大
3.降低,降低
4.增大,增大 treetree3301年前4
treetree3301年前4 -
 阿咪可 共回答了21个问题
阿咪可 共回答了21个问题 |采纳率100%按这道题目的意思的话HAC应该是弱电解质,那加入NaAc,等于加入了AC-,HAC的解离是可逆反应,所以反应向逆反应方向进行,HAC解离度降低,水电离出来的H+与AC-结合,所以OH-多出,PH增大,答案应该是21年前查看全部
- 某弱碱性药物pKa=8.4,在血浆中(血浆pH=7.4)其解离度应该怎么求?
 双生_鬼马1年前1
双生_鬼马1年前1 -
 35540398 共回答了20个问题
35540398 共回答了20个问题 |采纳率85%这道题目很简单的 由血浆PH=7.4求的血浆中OH根的浓度为10^(-6.6) 由碱性药物PKa=8.4求的PKb=14-8.4=5.6 AOH= A + OH [A][OH]/([AOH]-[A])=PKb 这里的[AOH]为原来药物的的浓度; [A]为已解离得浓度;[OH]为血浆中OH浓度 ,代入式中得 [A]/([AOH]-[A])=10然后把式子左右分子分母调换即[AOH]/[A]-1=10 ,[AOH]/[A]=11 由解离度定义的 已解离/原来的 [A]/[AOH]=1/11
还有一种方法 PKa=PH+log(未解离浓度/已解离浓度) 8.4=7.4+log(未解离/已解离),未解离/已解离=10 已解离/(未解离+已解离)=1/(10+1)=1/11
望采纳 自己做的 不是百度上的1年前查看全部
- 某一元弱酸的Ka=1*10^-7,0.10mol/L的该酸溶液的解离度?
 wangtu1年前1
wangtu1年前1 -
 zhaoyanhepan 共回答了14个问题
zhaoyanhepan 共回答了14个问题 |采纳率85.7%Ka=X2/0.1
X=10^-4
该酸溶液的解离度=X/0.1=0.001=0.1%1年前查看全部
- 某一元弱酸溶液浓度为0.1mol/L其PH值为2.77,求这一弱酸的解离常数及该条件下的解离度.
 就在水中央1年前1
就在水中央1年前1 -
 桑拉 共回答了18个问题
桑拉 共回答了18个问题 |采纳率83.3%[H+]=根号(Ka·c)
知道这个公式就好求了,不过这不是大学内容吗?1年前查看全部
- 氯化镁 氯化铝 氯化钾 氯化锂 氯化钠 等盐的表观解离度数据?
 为什么没激活1年前1
为什么没激活1年前1 -
 poiuhh 共回答了18个问题
poiuhh 共回答了18个问题 |采纳率94.4%这些盐在水中的解离度基本上是100%.1年前查看全部
- 解离度计算题光气的分解反应COCL2(g)=co(g)+cl2(g)在373时标准平衡常数K=8.80*10-9求在37
解离度计算题
光气的分解反应COCL2(g)=co(g)+cl2(g)在373时标准平衡常数K=8.80*10-9求在373K平衡后总压力P总=202.6KPA光气的解离度? pankeyao1年前1
pankeyao1年前1 -
 只爱奕 共回答了17个问题
只爱奕 共回答了17个问题 |采纳率94.1%假设起始光气的压强为n,CO和Cl2的分压为0.
-----COCL2(g)=co(g)+cl2(g)
起始:n----------------0------0
转化:nX--------------nX-----nX
平衡:n-nX-----------nX-------nX
总压=n-nX+nX+nX=n+nX=202.6KPa
平衡常数K=(nX)^2/(n-nX)=8.80*10-91年前查看全部
- 醋酸解离度和解离常数的测定这个实验中[H+]怎么算?
 褐眸浅唇1年前1
褐眸浅唇1年前1 -
 03210 共回答了12个问题
03210 共回答了12个问题 |采纳率100%[H+]就是氢离子浓度呀,直接测pH就出来了不是么1年前查看全部
- 在氨水中加入氯化氨,氨水的解离度,解离常数分别怎么变化
 aha68501年前1
aha68501年前1 -
 maladuo 共回答了15个问题
maladuo 共回答了15个问题 |采纳率93.3%电离度减小
电离常数不变1年前查看全部
- 与解离度和浓度有关的问题.常温下,某一元弱酸的解离度为8%,溶液中氢离子浓度为0.008mol/L,该溶液的浓度为?
 未激活3891年前1
未激活3891年前1 -
 gw1a 共回答了22个问题
gw1a 共回答了22个问题 |采纳率95.5%该溶液的浓度为0.008/8%=0.1mol/L1年前查看全部
- 在298k时一元弱酸0.01摩尔每升溶液ph=4求该弱酸的Ka 该浓度下酸的解离度
在298k时一元弱酸0.01摩尔每升溶液ph=4求该弱酸的Ka 该浓度下酸的解离度
在298k时一元弱酸0.01摩尔每升溶液ph=4求该弱酸的Ka 该浓度下酸的解离度 王豫湘1年前1
王豫湘1年前1 -
 刘海ee不砍樵 共回答了15个问题
刘海ee不砍樵 共回答了15个问题 |采纳率86.7%pH=4 c(H+)=10^-4 mol/L
Ka=c(H+)^2/0.01=10^-61年前查看全部
- 原题如下在HAc溶液中加入下列物质时,使HAc的解离度增大的是 ( )(A)NaAc (B) HCl (C)NH3•H2
原题如下
在HAc溶液中加入下列物质时,使HAc的解离度增大的是 ( )
(A)NaAc (B) HCl (C)NH3•H2O (D) NaCl
但是我怎么看都觉得D是对的啊 盐离子效应难道不考虑?
对的啊 我没说C不对啊 我只是想问D为什么不对
注:这是大学题 wy845151年前4
wy845151年前4 -
 bkafcy 共回答了15个问题
bkafcy 共回答了15个问题 |采纳率80%C正确的原因很显然 向弱酸溶液中加入碱 可使算得电离平衡右移 从而促进酸电离
盐离子效应的要求是加入的盐要与原弱电解质有相同离子
并且盐离子效应是抑制弱电解质电离的效应
它其实只是一个平衡移动的特例而已 并不用特意记忆 只要理解平衡移动的规律就可以了
所以并不需要死记过多的名词 有时候反而会迷惑自己1年前查看全部
- 室温下,0.20 mol.L-1HCOOH的解离度为3.2%,则HCOOH的解离常数为
室温下,0.20 mol.L-1HCOOH的解离度为3.2%,则HCOOH的解离常数为
A.2.0×10-4
B.1.3×10-3
C.6.4×10-3
D.6.4×10-4 734fasdf1年前1
734fasdf1年前1 -
 一切为你我的宝贝 共回答了13个问题
一切为你我的宝贝 共回答了13个问题 |采纳率84.6%K=[H+][HCOO-]/[HCOOH]
A1年前查看全部
大家在问
- 1与解离度和浓度有关的问题.常温下,某一元弱酸的解离度为8%,溶液中氢离子浓度为0.008mol/L,该溶液的浓度为?
- 2诗中有人生哲理的句子诗词都可以~要多
- 3下面这句话后半句如何断句?I would prefer to move into a single room next
- 4加速运动中的受力光滑斜面上放一滑块,以一水平力推斜面,使整个斜面做加速运动,可以使滑块不沿斜面滑动.为什么无摩擦可以不滑
- 5目前许多游客喜欢乘蓄电池观光游览车游西湖.游览车不仅具有低音、无污染的绿色环保功能,
- 6星星发亮是为了让每一个人有一天都能找到属于自己的星星
- 7把长12cm,宽10cm,高8cm,的长方体豆腐切成两个小长方体,切口面积最大是( )平方厘米.
- 8在c#中 RemoveAt Remove用法区别
- 9含有“名”字开头第三个字也是“名”字的四字词语
- 10关于remove各种词性的用法the___ men中间应该用什么.另外其他词性怎么用也副上.
- 11i don't know you dumped me on that day i will make what,
- 12cad施工图中“A=1005.00/B=241.312”A,B分别代表什么?
- 13求解一道大学有机化学的反应题,附题如下.
- 14中国新民主主义革命反对官僚资本主义,并非因为它是资本主义,而是因为它具有 ( )
- 15把自己看作独一无二的香花自己欣赏意思的四字词语.