在500mL0.2mol/L的稀硝酸加1.92入克铜片,让其充分反应.试求:产生气体在标况下占的体积;溶液中氢离...
 urchinqxy2022-10-04 11:39:542条回答
urchinqxy2022-10-04 11:39:542条回答在500mL0.2mol/L的稀硝酸加1.92入克铜片,让其充分反应.试求:产生气体在标况下占的体积;溶液中氢离子物质的量浓度;NO3物质量浓度.

已提交,审核后显示!提交回复
共2条回复
 QQ昵称改了 共回答了18个问题
QQ昵称改了 共回答了18个问题 |采纳率94.4%- 3Cu + 8HNO3==Cu(NO3)2 +2NO + 4H2O
3 8 2
0.03 0.1 X 硝酸过量,故X=0.02mol V=0.448L 剩余硝酸0.02mol,H+浓度0.04mol/L - 1年前
 温_馨 共回答了547个问题
温_馨 共回答了547个问题 |采纳率- 稀HNO3:3Cu+8HNO3=3Cu(NO3)2+2NO+4H2O
0.03 0.1 (过量) 0.02 (mol)
V= 0.02*22.4L=0.448L
HNO3过量了0。1-0.08=0.02mol
H+:0.02*1000/500=0.04mol/L
NO3-: (0.1-0.02)*1000/500=0.16mol/L - 1年前
相关推荐
- (1)欲配制500mL0.2mol/LNa2CO3溶液,回答下列问题:
(1)欲配制500mL0.2mol/LNa2CO3溶液,回答下列问题:
(1)应称取______g Na2CO3•10H2O.
(2)配制该溶液所用的仪器有______.
(3)下列操作使所配溶液浓度偏低的是______
A、容量瓶未干燥即用来配制溶液B、往容量瓶转移溶液时有少量液体溅出
C、未洗涤溶解固体的烧杯 D、定容时,仰视刻度线
(二)某化学小组在实验室用下图提供的仪器制备溴乙烷.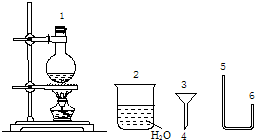
已知:
①反应原理:NaBr+H2SO4(较浓)
NaHSO4+HBr△ .
HBr+C2H5OH
C2H5Br+H2O△
②反应物用量:NaBr(S)25g,无水乙醇15mL,浓H2SO430mL,水15mL
③溴乙烷和乙醇的部分物理性质如表
回答下列问题:密度/g•mL-1 沸点/℃ 溶解性 溴乙烷 1.461 38 难溶于水 乙醇 0.789 78 易溶于水
(4)连接上述仪器的顺序是:1接______接______接( 4 )接( 3 )接______(填数字).你认为反应后溴乙烷在______(填“烧瓶”或“烧杯”)中
(5)由于浓硫酸具有强氧化性,反应产生副产物,使粗制溴乙烷常呈黄色,该副产物是______(写化学式),除去该杂质的试剂和方法是______,为了减少该副产物的生成,本实验采取了______的措施. 请记得自己1年前1
请记得自己1年前1 -
 297458228 共回答了12个问题
297458228 共回答了12个问题 |采纳率91.7%解题思路:(一)(1)根据m=nM=CVM计算Na2CO3•10H2O的质量;
(2)根据操作步骤选取实验仪器;
(3)根据c=[n/V] 分析操作对溶质的物质的量或对溶液的体积的影响判断;
(二)(4)根据反应装置→导气装置→尾气处理装置连接仪器;根据溴乙烷的性质分析;
(5)浓硫酸有强氧化性,能把溴化氢氧化生成溴;根据溴的性质选择试剂、除杂方法、减少副产物生成的措施.(一)(1)m=nM=CVM=0.2mol/L×0.5L×286g/mol=28.6g,故答案为:28.6;
(2)配制步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,一般天平称量固体,把氯化钠倒入烧杯进行溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器有玻璃棒、天平、药匙、烧杯、胶头滴管、500mL容量瓶,
故答案为:托盘天平、500mL容量瓶、烧杯、量筒、玻璃棒、胶头滴管;
(3)A、容量瓶未干燥即用来配制溶液,对溶质的物质的量和溶液的体积无影响,所以配制的溶液浓度无影响;
B、往容量瓶转移溶液时有少量液体溅出,导致溶质的物质的量偏小,配制的溶液浓度偏低;
C、未洗涤溶解固体的烧杯,导致溶质的物质的量偏小,配制的溶液浓度偏低;
D、定容时,仰视刻度线,导致溶液的体积偏大,所以配制溶液的浓度偏低;
故选BCD;
(二)(4)根据反应装置→导气装置→尾气处理装置连接仪器,所以连接顺序是1接 6接 5接 4 接3 接 2;
溴乙烷的沸点较低,加热条件下能挥发从导管中流出,且溴乙烷不溶于水,所以会从烧杯中析出.
故答案为:6;5;2;烧杯;
(5)浓硫酸有强氧化性,能把溴化氢氧化生成溴,溴的溶解使粗制溴乙烷常呈黄色;溴能和氢氧化钠反应生成可溶性盐,所以可用氢氧化钠溶于除杂,然后分液除去溴;为了减少该副产物的生成,本实验采取了反应物中加入水,稀释浓硫酸,降低其氧化性,减少副产品溴的生成,
故答案为:Br2;NaOH溶液,分液取下层;反应物中加入水,稀释浓硫酸,降低其氧化性,减少副产品溴的生成.点评:
本题考点: 配制一定物质的量浓度的溶液;乙醇的化学性质;制备实验方案的设计.
考点点评: 本题考查了一定物质的量浓度溶液的配制等知识点,难度不大,审题时注意写化学式的不能写名称,要求写名称的不能写化学式.1年前查看全部
- 现用质量分数为98%、密度为1.84g/cm3的浓硫酸来配制500mL0.2mol/L的稀硫酸.经计算,需浓硫酸的体积为
现用质量分数为98%、密度为1.84g/cm3的浓硫酸来配制500mL0.2mol/L的稀硫酸.经计算,需浓硫酸的体积为________.现有①10mL ②50mL ③100mL三种规格的量筒,应选用的量筒是_______(填代号).
 只帅给你看1年前1
只帅给你看1年前1 -
 ling2738 共回答了21个问题
ling2738 共回答了21个问题 |采纳率95.2%设需要的体积为V
则
0.98*V*1.84=0.2*0.5*98
解得
V=5.43毫升
①10mL1年前查看全部
- (9分)(1)请填写下列空白处:实验室里要配制500mL0.2mol/L的硫酸钠溶液。实验步骤大致有: A.在天平上称出
(9分)(1)请填写下列空白处:实验室里要配制500mL0.2mol/L的硫酸钠溶液。实验步骤大致有:
E、将瓶塞塞紧,充分摇匀。A.在天平上称出___________g硫酸钠固体,把它放在烧杯里,用适量的蒸馏水溶解。 B.把得到的溶液小心地沿着__________注入________mL的容量瓶中。 C.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液也小心转入容量瓶中。 D.继续向容量瓶中加蒸馏水至液面距刻度l~2cm处,改用_______________小心滴加蒸馏水至溶液凹液面底部与刻度线水平相切。
F、将配好的溶液倒入试剂瓶中,贴上标签,并洗涤容量瓶。
(2) 下列情况会使所配溶液浓度偏高的是___________(填序号)。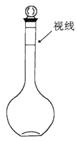
a、某同学定容时观察液面的情况如上图所示
b、没有进行上述的操作步骤C
c、加蒸馏水时,不慎超过了刻度线
d、所用砝码生锈
e、容量瓶用前内壁沾有水珠 妖族小鬼1年前1
妖族小鬼1年前1 -
 长发安迪 共回答了22个问题
长发安迪 共回答了22个问题 |采纳率86.4%(9分)(1)A、14.2 B、玻璃棒 500 D、胶头滴管(2)ad
略1年前查看全部
- 在500mL0.2mol/L的稀硝酸中入1.92铜片,让其充分反应.试求 ①产生的气体在标准状况下
在500mL0.2mol/L的稀硝酸中入1.92铜片,让其充分反应.试求 ①产生的气体在标准状况下
在500mL0.2mol/L的稀硝酸中入1.92铜片,让其充分反应.试求
①产生的气体在标准状况下的体积
②溶液中氢离子的物质的量浓度是多少
③硝酸根的物质的量浓度是多少④若要使溶液中的铜离子全部转化为氢氧化铜沉淀,应加入0.2mol/L的NaoH溶液多少毫升
 rwxbear1年前1
rwxbear1年前1 -
 小123指 共回答了26个问题
小123指 共回答了26个问题 |采纳率92.3%1、
稀HNO3:3Cu + 8HNO3==3Cu(NO3)2+2NO+4H2O
0.03 0.1 (过量) 0.02 (mol)
V= 0.02*22.4L=0.448L
2、
HNO3过量了0.1-0.08=0.02mol
H+:0.02*1000/500=0.04mol/L
NO3-:(0.1-0.02)*1000/500=0.16mol/L
3、
Cu有0.03mol,沉淀需要OH- 0.06mol,还有中和过量的HNO3要OH—0.02mol
所以总共要OH-0.08mol
故应加入的0.2mol/LNaOH溶液是400ml1年前查看全部
- 配置500mL0.2mol/L的碳酸钠溶液,定容时仰视刻度线会导致溶液浓度偏高还是偏低?
 user0620061年前3
user0620061年前3 -
 透过网看你 共回答了17个问题
透过网看你 共回答了17个问题 |采纳率82.4%在定容时仰视,视线点在实际刻度的上方,导致读得的体积值偏大,体积偏大,导致浓度偏小.1年前查看全部
- 现用98%的浓H 2 SO 4 (密度为1.84g/cm 3 )来配制500mL0.2mol/L的稀H 2 SO 4 .
现用98%的浓H 2 SO 4 (密度为1.84g/cm 3 )来配制500mL0.2mol/L的稀H 2 SO 4 .请回答下列问题:
(1)经计算,需浓H 2 SO 4 的体积为______mL.(保留一位小数)
(2)现给出下列仪器(配制过程中可能用到):①100mL量筒 ②10mL量筒 ③250mL烧杯 ④托盘天平 ⑤500mL容量瓶 ⑥胶头滴管 ⑦玻璃棒
按正确操作必需使用仪器的先后顺序排列正确的是______
A.④③⑦⑤⑥B.②⑤⑦⑥C.①③⑤⑥⑦D.②⑥③⑦⑤⑥
(3)写出浓硫酸稀释操作的要点______
(4)对所配制的稀H 2 SO 4 进行测定,发现浓度大于0.2mol/L.请你分析下列哪些操作会引起所配浓度偏大(填写字母)______.
A.用量筒量取浓硫酸时,仰视量筒的刻度
B.容量瓶未干燥即用来配制溶液
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容;
D.往容量瓶转移时,有少量液体溅出
E.烧杯未进行洗涤
F.在容量瓶中定容时俯视容量瓶刻度线
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线. liushilin3281年前1
liushilin3281年前1 -
 xiamixiami 共回答了14个问题
xiamixiami 共回答了14个问题 |采纳率78.6%(1)浓H 2 SO 4 的物质的量浓度c=
1000×1.84×98%
98 mol/L=18.4mol/L,根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=500mL×0.2mol/L,解得:x≈5.4,所以应量取的浓硫酸体积是5.4mL.
故答案为:5.4mL.
(2)配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,用10mL量筒量取(用到胶头滴管)称量,在烧杯中稀释,并用玻璃棒搅拌,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使用仪器的先后顺序排列是②⑥③⑦⑤⑥
故选:D.
(3)浓硫酸稀释操作为:将浓硫酸沿烧杯壁慢慢加入装有水的烧杯中,并用玻璃棒搅拌.
故答案为:将浓硫酸沿烧杯壁慢慢加入装有水的烧杯中,并用玻璃棒搅拌.
(4)A.用量筒量取浓硫酸时,仰视量筒的刻度,浓硫酸的体积偏大,故溶液浓度偏大;
B.最后需要定容,容量瓶不干燥,含有少量蒸馏水,对溶液浓度无影响;
C.溶液具有热胀冷缩的性质,浓硫酸稀释放出大量热,未冷却到室温,趁热将溶液到入容量瓶,并配成了溶液,会导致溶液体积偏小,溶液浓度偏大;
D.往容量瓶转移时,有少量液体溅出,导致硫酸的物质的量减小,溶液浓度偏低;
E.烧杯未进行洗涤,少量硫酸沾在烧杯壁与玻璃棒上,硫酸的实际物质的量减小,溶液浓度偏低;
F.在容量瓶中定容时俯视容量瓶刻度线,使溶液的体积偏低,所以溶液浓度偏大;
G.摇匀后液面下降,一部分溶液留在瓶塞与瓶口之间,再加蒸馏水至刻度线,导致溶液体积偏大,所以溶液浓度偏低.
偏大的是 ACF;偏低的是DEG;没有影响的是B.
故选:ACF1年前查看全部
- 欲配制500mL0.2mol/L的碳酸钠溶液,回答下列问题:
欲配制500mL0.2mol/L的碳酸钠溶液,回答下列问题:
(1)所需主要仪器有______其中容量瓶上标有刻线、______和______.
(2)通过计算可知,应用托盘天平称取______g碳酸钠.
(3)称量的操作顺序为(填序号)______
A、调天平零点B、游码回零C、向小烧杯中加入碳酸钠D、称量空烧杯
E、向右盘加砝码并把游码移到所需位置F、将砝码回盒G、记录称量结果
(4)若砝码和药品位置放颠倒(假设称量时未用烧杯),天平平衡时,实际称得碳酸钠的质量是______g.
(5)下列操作使所配溶液浓度偏高的是______.
A.称取28.6gNa 2 CO 3 •10H 2 O进行配制 B.称量时用了生锈的砝码
C.往容量瓶转移溶液时,有少量液体溅出 D.碳酸钠中含有不溶性杂质
E.未洗涤溶解碳酸钠的烧杯F.定容时,仰视刻度线
G.小烧杯洗净后未干燥即用来称量 H.容量瓶未干燥即用来配制溶液. 冰在世1年前1
冰在世1年前1 -
 wo1232000 共回答了16个问题
wo1232000 共回答了16个问题 |采纳率87.5%(1)操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,用托盘天平称量,用药匙取药品,在烧杯中溶解(可用量筒加水),用玻璃棒搅拌,加速溶解,恢复到室温后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.
所用仪器有托盘天平、500mL容量瓶、烧杯、玻璃棒、胶头滴管、药匙等.
容量瓶上标有刻线、温度、容量,
故答案为:托盘天平、500mL容量瓶、烧杯、玻璃棒、胶头滴管、药匙;温度;容量;
(2)需碳酸钠的物质的量为0.5L×0.2mol•L -1 =0.1mol,需碳酸钠的质量为0.1mol×106g/mol=10.6g,故答案为:10.6;
(3)称量的操作顺序为:游码回零,调天平零点,称量空烧杯,记录称量结果,向右盘加砝码并把游码移到所需位置,向小烧杯中加入碳酸钠,将砝码回盒,
故答案为:BADGECF;
(4)砝码和药品位置放颠倒(假设称量时未用烧杯),实际称得碳酸钠的质量10.0g-0.6g=9.4g,故答案为:9.4;
(5)A.需碳酸钠的物质的量为0.1mol,若用Na 2 CO 3 •10H 2 O配制,需要Na 2 CO 3 •10H 2 O的质量为0.1mol×286g/mol=28.6g,无影响,故A不选;
B.用了生锈的砝码,砝码的实际质量增大,称量的碳酸钠的实际质量增大,所配溶液的浓度偏高,故B选;
C.往容量瓶转移溶液时,有少量液体溅出,移入容量瓶的碳酸钠的实际质量减小,所配溶液的浓度偏低,故C不选;
D.碳酸钠中含有不溶性杂质,称量的碳酸钠的实际质量减小,所配溶液的浓度偏低,故D不选;
E.未洗涤溶解碳酸钠的烧杯,烧杯壁上沾有少量的碳酸钠,移入容量瓶的碳酸钠的实际质量减小,所配溶液的浓度偏低,故E不选;
F.定容时,仰视刻度线,所配溶液的体积偏大,溶液浓度偏低,故F不选;
G.小烧杯洗净后未干燥即用来称量,称量的碳酸钠的实际质量减小,所配溶液的浓度偏低,故G不选;
H.配制需加水定容,容量瓶未干燥即用来配制溶液,对所配溶液浓度无影响,故H不选.
故选B.1年前查看全部
- 欲配制500mL0.2mol/L的碳酸钠溶液,回答下列问题:
欲配制500mL0.2mol/L的碳酸钠溶液,回答下列问题:
(1)所需主要仪器有______其中容量瓶上标有刻线、______和______.
(2)通过计算可知,应用托盘天平称取______g碳酸钠.
(3)称量的操作顺序为(填序号)______
A、调天平零点B、游码回零C、向小烧杯中加入碳酸钠D、称量空烧杯
E、向右盘加砝码并把游码移到所需位置F、将砝码回盒G、记录称量结果
(4)若砝码和药品位置放颠倒(假设称量时未用烧杯),天平平衡时,实际称得碳酸钠的质量是______g.
(5)下列操作使所配溶液浓度偏高的是______.
A.称取28.6gNa2CO3•10H2O进行配制 B.称量时用了生锈的砝码
C.往容量瓶转移溶液时,有少量液体溅出 D.碳酸钠中含有不溶性杂质
E.未洗涤溶解碳酸钠的烧杯F.定容时,仰视刻度线
G.小烧杯洗净后未干燥即用来称量 H.容量瓶未干燥即用来配制溶液. 完酷子弟1年前1
完酷子弟1年前1 -
 qfop 共回答了13个问题
qfop 共回答了13个问题 |采纳率84.6%解题思路:(1)根据配制溶液的实验操作过程选择所用仪器.容量瓶上标有刻线、温度、容量;
(2)根据n=cv计算碳酸钠的物质的量,再根据m=nM计算所需碳酸钠的质量;
(3)根据称量的实验操作过程与天平的使用解答;
(4)天平平衡原理为:m(左盘)=m(右盘)+游码读数,据此计算;
(5)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=[n/V]分析判断.(1)操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,用托盘天平称量,用药匙取药品,在烧杯中溶解(可用量筒加水),用玻璃棒搅拌,加速溶解,恢复到室温后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.
所用仪器有托盘天平、500mL容量瓶、烧杯、玻璃棒、胶头滴管、药匙等.
容量瓶上标有刻线、温度、容量,
故答案为:托盘天平、500mL容量瓶、烧杯、玻璃棒、胶头滴管、药匙;温度;容量;
(2)需碳酸钠的物质的量为0.5L×0.2mol•L-1=0.1mol,需碳酸钠的质量为0.1mol×106g/mol=10.6g,故答案为:10.6;
(3)称量的操作顺序为:游码回零,调天平零点,称量空烧杯,记录称量结果,向右盘加砝码并把游码移到所需位置,向小烧杯中加入碳酸钠,将砝码回盒,
故答案为:BADGECF;
(4)砝码和药品位置放颠倒(假设称量时未用烧杯),实际称得碳酸钠的质量10.0g-0.6g=9.4g,故答案为:9.4;
(5)A.需碳酸钠的物质的量为0.1mol,若用Na2CO3•10H2O配制,需要Na2CO3•10H2O的质量为0.1mol×286g/mol=28.6g,无影响,故A不选;
B.用了生锈的砝码,砝码的实际质量增大,称量的碳酸钠的实际质量增大,所配溶液的浓度偏高,故B选;
C.往容量瓶转移溶液时,有少量液体溅出,移入容量瓶的碳酸钠的实际质量减小,所配溶液的浓度偏低,故C不选;
D.碳酸钠中含有不溶性杂质,称量的碳酸钠的实际质量减小,所配溶液的浓度偏低,故D不选;
E.未洗涤溶解碳酸钠的烧杯,烧杯壁上沾有少量的碳酸钠,移入容量瓶的碳酸钠的实际质量减小,所配溶液的浓度偏低,故E不选;
F.定容时,仰视刻度线,所配溶液的体积偏大,溶液浓度偏低,故F不选;
G.小烧杯洗净后未干燥即用来称量,称量的碳酸钠的实际质量减小,所配溶液的浓度偏低,故G不选;
H.配制需加水定容,容量瓶未干燥即用来配制溶液,对所配溶液浓度无影响,故H不选.
故选B.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了一定物质的量浓度溶液的配制,比较基础,注意从c=[n/V]理解配制原理,把握整个配制过程.1年前查看全部
- 配置500mL0.2mol/L的Na2CO3溶液需称取?
配置500mL0.2mol/L的Na2CO3溶液需称取?
配置500mL0.2mol/L的Na2CO3溶液需称取碳酸钠晶体(Na2CO3*10H2O)____g,在烧杯中用适量的蒸馏水溶解,冷却后,把溶液沿_____小心地注入______中,并用少量的蒸馏水洗涤烧杯_______次,洗涤液也注入_______;振荡,使溶液充分混合,然后继续往______中小心加蒸馏水,直到液面接近刻度_________cm处,改用_________加蒸馏水,使溶液的__________恰好与_________为止,盖好瓶塞,再反复上下颠倒摇匀,即得500mL0.2mol/L的NaCO3溶液 greysolo1年前1
greysolo1年前1 -
 振寰博客 共回答了12个问题
振寰博客 共回答了12个问题 |采纳率100%0.2×0.5=0.01mol
<106+18×10>×0.01=2.86g
玻璃棒
容量瓶
2-3
容量瓶
容量瓶
?你弄错了吧 应该是500ml
胶头滴管
凹液面
500ml液面相平1年前查看全部
- 现用18.4mol/L的浓H2SO4来配制500mL0.2mol/L的稀H2SO4.可供选择的仪器有:①玻璃棒;②烧瓶;
现用18.4mol/L的浓H2SO4来配制500mL0.2mol/L的稀H2SO4.可供选择的仪器有:①玻璃棒;②烧瓶;③烧杯;④胶头滴管;⑤量筒;⑥托盘天平;⑦药匙.请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时不需要使用的有______ (填代号),除上述仪器外,还缺少的一种主要仪器是______.
(2)经计算,需浓H2SO4的体积为______,量取浓硫酸时应选用______ (选填①10mL、②50mL、③100mL三种规格)的量筒.
(3)将所配制的稀H2SO4进行测定,发现浓度大于0.2mol/L.请你分析下列哪些操作会引起所配浓度偏大(填写字母)______.
A.用量筒量取浓硫酸时,仰视量筒的刻度;
B.容量瓶未干燥即用来配制溶液;
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容;
D.往容量瓶转移时,有少量液体溅出;
E.烧杯未进行洗涤;
F.在容量瓶中定容时俯视容量瓶刻度线;
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线. offerapple19781年前1
offerapple19781年前1 -
 天真的缪斯 共回答了12个问题
天真的缪斯 共回答了12个问题 |采纳率83.3%解题思路:(1)根据配制一定物质的量浓度的溶液的操作步骤选择使用的仪器;(2)根据稀释定律C浓V浓=C稀V稀来计算并根据需要的浓硫酸的体积来选择合适的量筒;(3)根据C=nV,通过判断不当操作对溶质的物质的量n和溶液体积V的影响来分析误差.(1)配制溶液的操作步骤:首先计算出需要的药品的体积,然后用量筒量取,后放入烧杯中稀释,同时用玻璃棒搅拌,待溶液冷却至室温后,用玻璃杯引流移液至500ml容量瓶,然后洗涤烧杯和玻璃棒2至3次,将洗涤液也注入容量瓶,然后向容量瓶中注水,至液面离刻度线1至2CM时,改用胶头滴管逐滴加入,至凹液面与刻度线相切,然后摇匀、装瓶.用到的仪器有:托盘天平、烧杯、玻璃棒、500ml容量瓶、胶头滴管.故不需要的有:②⑥⑦,还缺少的一种主要仪器是:500ml容量瓶.故答案为:②⑥⑦;500ml容量瓶;
(2)设需要的浓硫酸的体积为VmL,根据稀释定律C浓V浓=C稀V稀可知:18.4mol/L×Vml=500mL×0.2mol/L
解得V=5.4mL.根据容量瓶的选用规则是“大而近”,故选用10ml的量筒.故答案为:5.4mL;①;
(3)A.用量筒量取浓硫酸时,仰视量筒的刻度会导致所取的浓硫酸的量偏多,故能引起所配浓度偏大,故A选;
B.只要最后定容时凹液面与刻度线相切即可,至于水是事先就有的还是后来加入的,对浓度无影响,故B不选;
C.NaOH在烧杯中溶解后,未冷却就转移到容量瓶中并定容,待溶液冷却后体积偏小,则浓度偏大,故C选;
D.往容量瓶转移时,有少量液体溅出,会导致溶质的损失,则溶液浓度偏小,故D不选;
E.烧杯未进行洗涤,会导致溶质的损失,则溶液浓度偏小,故E不选;
F.在容量瓶中定容时俯视容量瓶刻度线,会导致溶液体积偏小,则浓度偏大,故F选;
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线是正常的,再加水至刻度线会导致浓度偏小,故G不选.
故选ACF.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了一定物质的量浓度溶液的配制过程中涉及到的仪器的选择、计算、误差分析等问题,难度不大.1年前查看全部
- 配制500mL0.2mol/L的硫酸铜溶液需要硫酸铜晶体多少克?
 一维1年前1
一维1年前1 -
 山一山 共回答了16个问题
山一山 共回答了16个问题 |采纳率93.8%硫酸铜晶体分子式是:5水硫酸铜,分子量为:250,配制500mL0.2mol/L中硫酸铜的量是0.5*0.2=0.1MOL,所以,需要250*0.1=25克所以需要硫酸铜晶体25克1年前查看全部
- 实验室要配制500mL0.2mol/L NaOH 溶液,请回答下列问题:
实验室要配制500mL0.2mol/L NaOH 溶液,请回答下列问题:
(1)配制过程中不需要使用的化学仪器有______(填字母)
A.烧杯B.500mL容量瓶C.漏斗D.胶头滴管E.玻璃棒
(2)用托盘天平称取NaOH固体,其质量为______.
(3)下列操作步骤的正确顺序是______(填序号)
①称取一定质量的NaOH固体,放入烧杯中,用适量蒸馏水溶解;
②加蒸馏水至液面距容量瓶颈刻度线下1-2cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③待冷却至室温后,将溶液转入500mL容量瓶中;
④盖好瓶盖,反复上下颠倒,摇匀;
⑤用少量的蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转入容量瓶中.
(4)如果实验过程中缺少步骤⑤,会使配制出的NaOH溶液的物质的量浓度______(填“偏高”、“偏低”或“不变”) federal_agent1年前1
federal_agent1年前1 -
 胡楚元 共回答了26个问题
胡楚元 共回答了26个问题 |采纳率80.8%解题思路:(1)根据仪器的作用选取仪器;
(2)根据m=CVM计算溶质的质量;
(3)实验操作的步骤:计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作进行排序;
(4)根据c=[n/V]分析操作对溶质的物质的量或对溶液的体积的影响判断.(1)溶液配制过程中需要烧杯溶解固体,需要500mL容量瓶配制溶液,需要胶头滴管定容,需要玻璃棒搅拌和引流,所以没有用到的是漏斗,故选C;
(2)m=CVM=0.2mol/L×0.5L×40g/mol=4.0g,故答案为:4.0g;
(3)实验操作的步骤:计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作进行排序,所以其排列顺序为:①③⑤②④,故答案为:①③⑤②④;
(4)因洗涤液中含有溶质,未将洗涤液转入容量瓶,溶质的质量减少,浓度偏低,故答案为:偏低.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查一定物质的量浓度溶液的配制,难度不大,注意根据c=[n/V]分析操作对溶质的物质的量或对溶液的体积的影响判断,为易错点.1年前查看全部
大家在问
- 1昨天下午,下了一整天雨 修改病句
- 2当今世界三大环境问题是酸雨、臭氧层衰竭和温室效应,其中形成酸雨的主要原因是人们向空气中大量排放了有害气体,它们主要是(
- 3停车场上,大汽车的量数是小汽车的4倍,大汽车比小汽车多60辆,大小汽车各有多少辆?
- 4大多数的生物物种在森林中生活还是在海洋中生活
- 5实验是学习化学的一条重要途径,下列实验操作中正确的是( )
- 6(2013•焦作一模)常温下,浓度均为0.1mol/L的6种溶液pH如下:
- 7已知圆C:x²+y²-4x+6y-12=0,过点A(﹣1,0)的弦长的最大值为M,最小值是N,则M
- 8(2008•溧水县二模)小明同学建设自己的家庭小实验室时收集了下列物质.请你按要求选择合适物质的序号填空:
- 9江城子中所用典故的寓意
- 10你想告诉你的同学,你的妈妈正在客厅擦窗户.
- 112:0.25的比值是( ),如果后项乘4,要使比值不变,前项应该( ),前项和后项都除以0.25除以0:25 比值是
- 12某人从学校门口A处开始散步,先向南走了60m,再向东走了80m到达C处,最后又向北走了100m,到达D处,求:
- 13《永远不能忘记的事情》表达了人们对鲁迅先生的什么之情
- 141为什么食品填充材料要密度小的 2在产品的包装中,常在四周采用填充物防震,便于运输,为什么这种物质密度小?
- 15Aunt Wang is not here now.She has ____ to Shanghai and will
