若850℃时,反应CaCO3(s) CaO(s) + CO2(g) = 0.498,则平衡时CO2分压为
 21世纪末的ll2022-10-04 11:39:541条回答
21世纪末的ll2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 66731822 共回答了10个问题
66731822 共回答了10个问题 |采纳率100%- 49.8kp 因为那个 k= 0.498 而CaCO3(s) CaO(s) 都是固体 所以 就是有k+ p(CO2)/p(大气压)=0.498 所以求的CO2分压为49.8kp
- 1年前
相关推荐
- 8.在一个密闭容器中充入1molCO2和3molH2,在850℃时气体混合物达到下式所示平衡:
8.在一个密闭容器中充入1molCO2和3molH2,在850℃时气体混合物达到下式所示平衡:
CO2+H2====(可逆符号)CO+H2O.已知达到平衡时生成0.75molCO,当H2改为9mol时,在上述条件下平衡时生成CO与水蒸气物质的量之和可能是
A.1.2mol B.1.5mol
C.1.8mol D.2.5mol
希望能写出过程 招远宋家镇1年前1
招远宋家镇1年前1 -
 bhhfi 共回答了19个问题
bhhfi 共回答了19个问题 |采纳率78.9%c
3molH2的反应平衡状态下,CO与水蒸汽之和为0.75*2=1.5mol
将氢气加到9mol,反应向正方向移动,所以产物的和应大于1.5mol,但是参加反应的CO2只有1mol,生成的CO和水蒸气的和最多只有2mol,所以
1.5mol1年前查看全部
- Ⅰ.(4分)在一体积为10L密闭的容器中,通入一定量的CO和H 2 O(g),在850℃时发生如下反应:CO(g)+H
Ⅰ.(4分)在一体积为10L密闭的容器中,通入一定量的CO和H 2 O(g),在850℃时发生如下反应:CO(g)+H 2 O(g)
 CO 2 (g)+H 2 (g) △H<0
CO 2 (g)+H 2 (g) △H<0
(1)CO和H 2 O浓度变化如图,则0~4 min的平均反应速率ν(CO)=_______ mol/(L·min),此时该反应的平衡常数为 。
(2)当下列哪些物理量不再发生变化时,表明上述反应已达到平衡状态的是 。
E.ν(CO)与ν(CO 2 )的比值A.混合气体的压强 B.混合气体的密度 C.CO的物质的量浓度 D.密闭容器中放出热量
Ⅱ.(6分)亚氯酸钠(NaClO 2 )是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO 2 的主要流程如下。
(3)配平Ⅰ中反应方程式 ClO 3 - + H + + SO 3 2- == ClO 2 ↑+ SO 4 2- +
(4)A的化学式是 ,。生成气体a的电极反应式 。 闲逛了1年前1
闲逛了1年前1 -
 bjsd2008 共回答了15个问题
bjsd2008 共回答了15个问题 |采纳率80%Ⅰ.(4分)(1)0.03;(1分)1(1分)(2)CD (2分)
Ⅱ.(6分)(3) 2 ClO 3 - + 2 H + + 1 SO 3 2- == 2 ClO 2 ↑+ 1 SO 4 2- + 1 H 2 O (2分)
(4)NaOH;(2分))4OH - —4e - =2H 2 O+O 2 ↑(2分)
1年前查看全部
- 在一体积为10 L的容器中,通入一定量的CO和H 2 O,在850℃时发生如下反应:
在一体积为10 L的容器中,通入一定量的CO和H 2 O,在850℃时发生如下反应:
CO(g)+H 2 O(g) CO 2 (g)+H 2( g)△H<0。
CO 2 (g)+H 2( g)△H<0。
(1)CO和H 2 O浓度变化如图,则在该温度下,该反应的平衡常数K= 。
0~4 min的平均反应速率v(CO)= mol·L -1 ·min -1 。若降低温度,该反应的K值将 ,该反应的化学反应速率将 (填“增大”“减小”或“不变”)。
(2)在相同容器中发生上述反应,当温度高于850℃时,容器内各物质的浓度变化如下表。时间(min) CO H 2 O CO 2 H 2 0 0.200 0.300 0 0 2 0.138 0.238 0.062 0.062 3 c1 c2 c3 c3 4 c1 c2 c3 c3 5 0.116 0.216 0.084 6 0.096 0.266 0.104
①表中3 min~4 min之间反应处于 状态;c l 数值 0.08 mol·L -1 (填大于、小于或等于)。
②反应在4 min~5 min之间,平衡向逆方向移动,可能的原因是
a.增加水蒸气 b.降低温度&nbs可能相似的问题你能帮帮他们吗
Copyright © 2022 YULUCN.COM - 雨露学习互助 - 17 q. 0.033 s. - webmaster@yulucn.com feicui5251年前1
feicui5251年前1 -
 处处迷茫 共回答了18个问题
处处迷茫 共回答了18个问题 |采纳率94.4%(1)10.03增大减小 (2)①平衡大于②d ...1年前查看全部
- 已知反应:CO(g)+H2O(g)⇌CO2(g)+H2(g),△H<0,在850℃,K=1,
已知反应:CO(g)+H2O(g)⇌CO2(g)+H2(g),△H<0,在850℃,K=1,
(1)若升高到950℃,达到平衡时K______1(填“大于”、“小于”或“等于”)
(2)在850℃,若向一容积可变的密闭容器中同时充入1molCO、3molH2O、1molCO2和xmol的H2:
①当x=5时,上述平衡向______(填“正反应”或“逆反应”)方向进行
②若要使上述反应开始时向正反应方向进行,则x的取值为______
③当x=5mol和x=6mol,上述反应达到平衡后,H2的体积分数分别为a%和b%,则a%______b%(填“大于”、“小于”或“等于”). jianghao781年前1
jianghao781年前1 -
 浮浮0418 共回答了14个问题
浮浮0418 共回答了14个问题 |采纳率85.7%解题思路:(1)对于放热反应,升高温度,平衡常数减小;
(2)①反应混合物各物质的量系数相同都为1,利用物质的量代替浓度,计算浓度商Qc,根据浓度商Qc与平衡常数k的关系判断.Qc>k平衡向逆反应进行,Qc=k反应处于平衡状态,Qc<k平衡向正反应进行;
②用x表示出浓度商Qc,平衡向正反应移动,应满足浓度商Qc<k,据此计算判断;
③增大一种生产物(氢气)的体积分数,平衡向逆反应方向移动,平衡移动的结果是降低这种增大的幅度,故平衡后氢气的体积分数还是大于原来的.解(1)该反应是一个放热反应,升高温度,平衡常数减小,所以K<1,故答案为:小于;
(2))①此时的浓度商Qc=[1×5/1×3]=1.67,大于平衡常数1,故平衡向逆反应方向移动,故答案为:逆反应;
②平衡向正反应方向移动,浓度商小于平衡常数,即[1×x/1×3]<1,解得x<3.0,所以0≤x<3,
故答案为:0≤x<3.0;
③加入6mol氢气所到达的平衡,可以等效为在加入5mol氢气到达平衡后再加入1mol氢气,增大一种生产物(氢气)的体积分数,平衡向逆反应方向移动,平衡移动的结果是降低这种增大的幅度,但平衡后氢气的体积分数还是大于原来的,故得H2的体积分数分别为a%<b%,
故答案为:小于.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查平衡常数的计算与运用难度中等,注意化学平衡常数只与温度有关,温度不变,化学平衡常数不变.1年前查看全部
- 机械加工问题.1.现有三块形状、尺寸完全相同的钢试样,经过850℃加热保温后在水中冷却,然后分别再放入200℃、400℃
机械加工问题.
1.现有三块形状、尺寸完全相同的钢试样,经过850℃加热保温后在水中冷却,然后分别再放入200℃、400℃、600℃的炉中重新加热保温,经过相同的时间后取出冷至室温.问:(1)三块试样进行了什么热处理操作?(2)比较三块试样的硬度高低.
2.现有三块形状、尺寸完全相同的40Cr钢试样,经过860℃加热保温后取出,分别放入下列介质中冷却:a.炉中,b.空气中,c.水中.指出这三种热处理工艺的名称,并比较最终三块试样的硬度高低. 绿色笔丁1年前1
绿色笔丁1年前1 -
 luojian909 共回答了15个问题
luojian909 共回答了15个问题 |采纳率86.7%1(1)低温回火,中温回火,高温回火.(2)硬度1>2>3
2(1)退火,正火,淬火.(2)硬度11年前查看全部
- (1)在固定体积的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
(1)在固定体积的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:

CO(g)+H2O(g)⇌CO2(g)+H2 (g)△H<0
①此反应的平衡常数表达式K=c(CO)c(H2O) c(CO2)c(H2) c(CO)c(H2O) c(CO2)c(H2)
②该温度下,根据如图计算此反应的平衡常数K=______.升高温度后K值将______(填“增大、减小或不变”)
(2)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表. t1℃时物质浓度(mol/L)的变化
①表中3min-4min之间反应处于______状态; C2_______0.18mol/L (填“大于、小于或等于”).时间(min) CO H2O CO2 H2 0 0.200 0.300 0 0 2 0.138 0.238 0.062 0.062 3 C1 C2 C3 C3 4 C1 C2 C3 C3 5 0.116 0.216 0.084 6 0.096 0.266 0.104
②反应在4min-5min间,平衡向逆方向移动,从以下选项选出可能的原因是______(单选).表中5min-6min之间数值发生变化,可能的原因是______(单选).
a.使用催化剂b.增加氢气浓度c.增加水蒸气d.降低温度. 白色的阿弟1年前1
白色的阿弟1年前1 -
 wq52331314 共回答了12个问题
wq52331314 共回答了12个问题 |采纳率91.7%解题思路:(1)①平衡常数等于生成物浓度系数次幂之积与反应物浓度系数次幂之积之比,由此写出平衡常数表达式;
②根据平衡常数表达式计算K,并根据温度平衡的影响进而判断平衡常数的变化;
(2)①根据3min-4min之间各物质的浓度变化情况可判断是否达到平衡,根据温度对平衡移动的影响分析;
②根据浓度、压强、温度对平衡移动的影响分析;(1)①平衡常数等于生成物浓度系数次幂之积与反应物浓度系数次幂之积之比,即K=
c(CO)c(H2O)
c(CO2)c(H2),故答案为:
c(CO)c(H2O)
c(CO2)c(H2);
②用三段式法计算:
CO(g)十H2O(g) CO2(g)十H2 (g)
CO2(g)十H2 (g)
起始:0.20mol/L 0.30mol/L 0 0
转化:0.12mol/L 0.12mol/L 0.12mol/L 0.12mol/L
平衡:0.08mol/L 0.18mol/L 0.12mol/L0.12mol/L
则K=
c(CO2)×c(H2)
c(CO)×c(H2O)=[0.12mol/L×0.12mol/L/0.08mol/L×0.18mol/L]=1
由于该反应是放热反应,升高温度平衡逆向移动,故平衡常K数减小;
故答案为:1;减小;
(2)①表中3min-4min之间各物质的浓度不变,故反应达到平衡状态;由于是放热反应,温度升高到t1,化学平衡向逆反应方向移动,水的物质的量浓度比850℃是的大,即C2数值应大于0.18 mol/L,故答案为:平衡;大于;
②反应在4min-5min间,平衡向逆方向移动可能是升高温度、增大生成物浓度、减少反应物浓度等因素引起,催化剂对平衡没有影响,故选b;
在5min-6min之间,CO浓度减少,H2O浓度增大,CO2浓度增大,所以只有增加水蒸气,使化学平衡向正反应方向移动.故选c.点评:
本题考点: 物质的量或浓度随时间的变化曲线;化学平衡常数的含义;化学平衡的影响因素.
考点点评: 本题综合考查化学平衡常数、平衡的有关计算和判断等问题,题目难度中等,解题的难点是从图表和图象中获取相关信息,本题能较好的考查学生的能力.1年前查看全部
- 在一体积为10L的容器中,通入一定量的CO和H 2 O,在850℃时发生如下反应:CO(g)十H 2 O(g)⇌CO 2
在一体积为10L的容器中,通入一定量的CO和H 2 O,在850℃时发生如下反应:CO(g)十H 2 O(g)⇌CO 2 (g)十H 2 (g),CO和H 2 O浓度变化如图,
(1)该反应的平衡常数表达式为K=______;时间(min) CO H 2 O CO 2 H 2 0 0.200 0.300 0 0 2 0.138 0.238 0.062 0.062 3 C 1 C 2 C 3 C 3 4 C 1 C 2 C 3 C 3 5 0.116 0.216 0.084 6 0.096 0.266 0.104
(2)已知上述反应为放热反应,则其反应热△H______零(填“大于”、“小于”或“等于”);升高温度,其平衡常数值______(填“增大”、“减小”或“不变”);
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表.
①表中3min-4min之间反应处于______状态;C 1 数值______0.08mol/L (填大于、小于或等于).
②反应在4min-5min间,平衡向逆反应方向移动,可能的原因是______(单选),表中5min-6min之间数值发生变化,可能的原因是______(单选).
a.增加水蒸气 b.降低温度
c.使用催化剂 d.增加氢气浓度.
 sybbsky1年前1
sybbsky1年前1 -
 cpim2004 共回答了11个问题
cpim2004 共回答了11个问题 |采纳率81.8%(1)可逆反应CO(g)十H 2 O(g)⇌CO 2 (g)十H 2 (g)的平衡常数k=
c(C O 2 )•c( H 2 )
c(CO)•c( H 2 O) ,
故答案为:
c(C O 2 )•c( H 2 )
c(CO)•c( H 2 O) ;
(2)放热反应的△H<0,该反应正反应是放热反应,升高温度平衡向逆反应移动,故平衡常数减小,
故答案为:小于,减小;
(3)①由表中数据可知,3min、4min时都应个组分的浓度相同,故处于平衡状态,
该反应正反应是放热反应,升高温度平衡向逆反应移动,故该温度下平衡时CO的浓度比原平衡850℃大,
故答案为:平衡,大于;
②反应中△c(CO)=△c(H 2 O)=△c(CO 2 )=△c(H 2 ),由表中数据可知,5min时与开始相比CO、H 2 O、CO 2 的浓度变化之比为1:1:1,平衡向逆反应移动,故可能升高温度、降低压强或增大氢气的浓度,故选d;
表中5min-6min之间,CO浓度降低0.02mol/L、H 2 O的浓度增大0.05mol/L、CO 2 的浓度增大0.02mol/L,故应该是增大水蒸气的浓度,故选a,
故答案为:d,a.1年前查看全部
- 在一体积为10 L的容器中,通入一定量的CO和H 2 O,在850℃时发生如下反应: CO(g)+H 2 O(
在一体积为10 L的容器中,通入一定量的CO和H 2 O,在850℃时发生如下反应: CO(g)+H 2 O(g)  CO 2 (g)+H 2 (g) ΔH<0
CO 2 (g)+H 2 (g) ΔH<0
(1)CO和H 2 O浓度变化如下图,则0~4 min的平均反应速率v(CO)=________mol/(L·min).

(2)t 1 ℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表.
①表中3 min~4 min 之间反应处于________状态;c1________0.08 mol/L(填“>”“<”或“=”).
②反应在4 min~5 min间,平衡向逆方向移动,可能的原因是________(单选),表中5 min~6 min之间数值发生变化,可能的原因是________(单选).
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度 蓝冰跑道1年前1
蓝冰跑道1年前1 -
 65025208 共回答了14个问题
65025208 共回答了14个问题 |采纳率92.9%(1)0.03
(2)①平衡 ;> ;②d ;a1年前查看全部
- CO2和H2的混合气体加热到850℃时,可建立下列平衡:CO2(g)+H2(g)⇌CO(g)+H2O(g)在一定温度下,
CO2和H2的混合气体加热到850℃时,可建立下列平衡:CO2(g)+H2(g)⇌CO(g)+H2O(g)在一定温度下,反应平衡时有90%的氢气变成水,且c(CO2)•c(H2)=c(CO)•c(H2O),则原混合气体中CO2和H2分子数之比是( )
A. 1:1
B. 5:1
C. 9:1
D. 1:10 荒原牧羊人1年前2
荒原牧羊人1年前2 -
 子夜明灯 共回答了25个问题
子夜明灯 共回答了25个问题 |采纳率72%解题思路:设出氢气、二氧化碳的物质的量,然后依据化学平衡的三段式列式,结合题干条件中氢气转化率计算出达到平衡时各组分的物质的量浓度,
由于c(CO2)•c(H2)=c(CO)•c(H2O),说明平衡常数等于1,列式计算出x:y即可.设原混合气体中CO2和H2的物质的量分别为x、y,体积为1L,在一定温度下,平衡有90%的H2变成了H2O消耗氢气0.9y,则
CO2(g)+H2(g)⇌CO(g)+H2O(g)
起始量(mol/L) x y 0 0
变化量(mol/L)0.9y 0.9y 0.9y 0.9y
平衡量(mol/L)x-0.9y 0.1y 0.9y 0.9y
依据c(CO2)•c(H2)=c(CO)•c(H2O)
得到:(x-0.9y)×0.1y=0.9y×0.9y
计算得到x:y=9:1
故选C.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查了化学平衡的计算应用,掌握平衡常数含义、平衡三段式计算分析是解题关键,题目难度中等.1年前查看全部
- 埋弧焊对接焊缝,钢板厚度为1.5mm,焊接后850℃加热11min后对焊缝组织会有什么影响?优化还是恶化?
 wgy5551年前1
wgy5551年前1 -
 747love747 共回答了16个问题
747love747 共回答了16个问题 |采纳率87.5%一般说来应该是有所优化,原因如下:
你所说的情况是典型的焊后热处理行为,主要是为了消除因焊接而产生的焊接残余应力(焊接引起焊件不均匀的温度分布,焊缝金属的热胀冷缩等原因造成).
而将焊件高温加热后,材料在高温下会产生一定程度的软化(屈服强度降低),从而使焊件内的应力再次分配(应力高的地方产生塑性流动,弹性变形逐渐减少,塑性变形逐渐增加而使应力降低
),很大程度上减少了焊缝的残余应力,提高的焊缝组织强度.1年前查看全部
- 现有反应:CO(g)+H 2 O(g) CO 2 (g)+H 2 (g),其△H<0,在850℃时,Kc=1。
现有反应:CO(g)+H 2 O(g)  CO 2 (g)+H 2 (g),其△H<0,在850℃时,Kc=1。
CO 2 (g)+H 2 (g),其△H<0,在850℃时,Kc=1。
(1)若升高温度到950℃时,达到平衡时Kc______1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容器可变的密闭容器中同时充入1.0molCO,3.0molH 2 O,1.0molCO 2 和xmolH 2 ,则:
①当x=5.0时,上述平衡向__________(填“正反应”或“逆反应”)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是____________。
(3)在850℃时,若设x=5.0和x=6.0,其它物质的投料不变,当上述反应达到平衡后,测得H 2 的体积分数分别为a%和b%,则a________b(填“大于”、“小于”或“等于”)。 三野天1年前1
三野天1年前1 -
 dd思君不可忘 共回答了24个问题
dd思君不可忘 共回答了24个问题 |采纳率95.8%(1)小于
(2)①逆反应;② 0≤ x<3.0
(3)小于1年前查看全部
- 指出下列句子所用的说明方法。①如果在850℃的温度下把斯石英加热30分钟,它将变成普通沙子。( ) ②位于南极中心部
指出下列句子所用的说明方法。
①如果在850℃的温度下把斯石英加热30分钟,它将变成普通沙子。( )
②位于南极中心部位的南极洲是全球的大冰箱。( )
③这种被压扁的沙子因此被称为“斯石英”。( ) 雾中童话1年前1
雾中童话1年前1 -
 30992142 共回答了14个问题
30992142 共回答了14个问题 |采纳率85.7%①列数字
②打比方
③作诠释1年前查看全部
- (1)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)⇌CO2(g
 (1)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)⇌CO2(g)+H2(g);△H<0
(1)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)⇌CO2(g)+H2(g);△H<0
CO和H2O浓度变化如图,则0~4min的平均反应速率v(H2O)=______mol/(L•min);此时,CO的转化率为______.
(2)该反应的化学平衡常数K=______.
T℃时物质浓度(mol/L)的变化
(3)T℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表.时间(min) CO H2O CO2 H2 0 0.200 0.300 0 0 2 0.138 0.238 0.062 0.062 3 C1 C2 C3 C3 4 C1 C2 C3 C3 5 0.116 0.216 0.084 6 0.096 0.266 0.104
①表中______之间反应处于平衡状态;C1数值______0.08mol/L (填大于、小于或等于).
②反应在4min-5min间,平衡向逆方向移动,可能的原因是______(单选),表中5min-6min之间数值发生变化,可能的原因是______(单选).
a.加入水蒸气b.降低温度c.使用催化剂d.加入氢气. dj24561年前1
dj24561年前1 -
 xiong78 共回答了20个问题
xiong78 共回答了20个问题 |采纳率90%解题思路:(1)根据υ=[△c/△t]计算反应速率;先计算出反应消耗的CO的浓度,再根据转化率公式计算;
(2)分别计算各物质的平衡浓度,根据平衡常数表达式计算K;
(3)①表中3min-4min之间各物质的浓度不变,850℃达到平衡,c(CO)=0.08mol/L,该反应为放热反应,升高温度逆向移动;
②反应在4min~5min,平衡向逆方向移动,根据平衡移动原理,结合选项判断;
由表中数据可知,5min~6minCO的浓度降低,CO2浓度增大,浓度变化都是0.02mol/L,说明平衡向正反应移动,再结合水的浓度变化进行判断.(1)υ(H2O)=[△c/△t]=[0.3mol/L−0.18mol/L/4min]=0.03mol/(L•min);
0~4min时,消耗的CO的浓度为:0.20mol/L-0.08mol/L=0.12mol/L,则CO的转化率为[0.12/0.20]×100%=60%;
故答案为:0.03mol/(L•min);60%;
(2)用三段式法计算:
CO(g) 十 H2O(g) CO2(g)十 H2 (g)
CO2(g)十 H2 (g)
起始:0.20mol/L 0.30mol/L 0 0
转化:0.12mol/L 0.12mol/L 0.12mol/L 0.12mol/L
平衡:0.08mol/L 0.18mol/L 0.12mol/L 0.12mol/L
则K=
c(CO2)×c(H2)
c(CO)×c(H2O)=[0.12mol/L×0.12mol/L/0.08mol/L×0.18mol/L]=1,
故答案为:1;
(3)①在高于850℃时发生反应,化学反应速率加快,一定在4min前达到化学平衡.另外从表中可看出反应在3min和4min时的各物质浓度相同,故3min-4min之间反应应处于平衡状态.由于是放热反应,温度升高,化学平衡向逆反应方向移动,C1数值应大于0.08 mol/L.
故答案为:3-4min;大于;
②反应在4min-5min间,平衡向逆方向移动可能是升高温度、增大生成物浓度、减少反应物浓度等因素引起,故选d.表中5min-6min之间CO浓度减少,H2O浓度增大,CO2浓度增大,只有增加水蒸气,使化学平衡向正反应方向移动,故选a;
故答案为:d;a.点评:
本题考点: 物质的量或浓度随时间的变化曲线;反应速率的定量表示方法;化学平衡的影响因素;化学平衡的计算.
考点点评: 本题综合考查化学平衡常数、平衡的有关计算和判断等问题,题目难度较大,将图表信息和图象信息相结合来分析是解答的关键,较好的考查学生的能力.1年前查看全部
- (2007•福田区模拟)850℃时反应A(g)+B(g)C(g)+D(g)△H<0,该温度下平衡常数K=l.t℃时,在一
(2007•福田区模拟)850℃时反应A(g)+B(g)
 C(g)+D(g)△H<0,该温度下平衡常数K=l.t℃时,在一定体积的容器中,通入一定量的A和B发生化学反应,各物质浓度随时间变化如下表:t℃时物质的浓度(mol•L-1)变化
C(g)+D(g)△H<0,该温度下平衡常数K=l.t℃时,在一定体积的容器中,通入一定量的A和B发生化学反应,各物质浓度随时间变化如下表:t℃时物质的浓度(mol•L-1)变化
(1)计算t℃该化学反应的平衡常数:时间/min A B C D 0 0.200 0.300 0 0 2 0.138 0.238 0.062 0.062 3 0.100 0.200 0.100 0.100 4 0.100 0.200 0.100 0.100 5 0.116 0.216 0.084 6 0.096 0.266 0.104 [1/2][1/2]
(2)t℃______850℃(填大于、小于或等于).判断依据是______
(3)反应在4min~5min之间,平衡______(填“向左”、“向右”或“不”)移动,可能的原因是______
a.增加A的浓度b.增加D的浓度c.加压d.使用催化剂
(4)某温度下反应C(g)+D(g)⇌A(g)+B(g)的平衡浓度符合c(C)•c(D)=2c(A)•c(B),则此时的温度______850℃(填大于、小于或等于). 李帅风1年前1
李帅风1年前1 -
 z94615 共回答了22个问题
z94615 共回答了22个问题 |采纳率95.5%解题思路:850℃时平衡常数K=l,
由表中数据可知,反应进行到3min时,达到平衡状态,此时k=[0.100×0.100/0.100×0.200]=[1/2],
反应在4min~5min之间,A、B浓度比3min时大,而C的浓度比3min时小,说明平衡向逆反应方向移动,
A(g)+B(g) C(g)+D(g)△H<0,
C(g)+D(g)△H<0,
则C(g)+D(g)⇌A(g)+B(g)△H>0,升高温度平衡向正反应方向移动,850℃时平衡常数K=l,
某温度下平衡浓度符合c(C)•c(D)=2c(A)•c(B),则k=2,说明温度大于850℃.(1)由表中数据可知,反应进行到3min时,达到平衡状态,此时k=0.100×0.1000.100×0.200=12,故答案为:12;(2)反应放热,温度升高平衡向逆反应方向移动,平衡常数减小,则t℃大于850℃,故答案为:大于;反应放...
点评:
本题考点: 用化学平衡常数进行计算;化学平衡的影响因素.
考点点评: 本题考查化学平衡移动以及化学平衡常数的计算,题目难度中等,本题注意把握平衡常数的意义,答题中注意化学平衡常数的变化与温度的关系.1年前查看全部
- (1)现有反应:CO(g)+H 2 O(g)⇌CO 2 (g)+H 2 (g)△H>0.在850℃时,K=1.此温度下
(1)现有反应:CO(g)+H 2 O(g)⇌CO 2 (g)+H 2 (g)△H>0.在850℃时,K=1.此温度下,若向一容积可变的密闭容器中同时充入1.0mol CO,3.0mol H 2 O,1.0mol CO 2 和xmol H 2 ,则:
①当x=5.0时,上述反应向______方向进行.
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是______.
③在850℃时,若设x=5.0和x=6.0,其他物质的投料不变,当上述反应达到平衡后,测得H 2 的体积分数分别为a%、b%,则a______b(填“大于”“小于”或“等于”).
(2)CO 2 在自然界循环时可与CaCO 3 反应,CaCO 3 是一种难溶物质,它的Ksp=2.8×10 -9 .CaCl 2 溶液与Na 2 CO 3 溶液混合可形成CaCO 3 沉淀,现将等体积的CaCl 2 溶液与Na 2 CO 3 溶液混合,若Na 2 CO 3 溶液的浓度为2×10 -4 mo1/L,则生成沉淀所需CaCl 2 溶液的最小浓度为______. jinyingguanggao1年前1
jinyingguanggao1年前1 -
 JOJO_123 共回答了13个问题
JOJO_123 共回答了13个问题 |采纳率92.3%(1)①此时的浓度商Q c =
1×5
1×3 =1.67,大于平衡常数1,故平衡向逆反应方向移动,故答案为:逆反应;
②平衡向正反应方向移动,浓度商小于平衡常数,即
1×x
1×3 <1,解得x<3,所以0≤x<3,故答案为:0≤x<3;
③加入6mol氢气所到达的平衡,可以等效为在加入5mol氢气到达平衡后再加入1mol氢气,增大一种生产物(氢气)的体积分数,平衡向逆反应方向移动,平衡移动的结果是降低这种增大的幅度,但平衡后氢气的体积分数还是大于原来的,故得H 2 的体积分数分别为a%<b%,故答案为:小于;
(2)Na 2 CO 3 溶液的浓度为2×10 -4 mo1/L,等体积混合后溶液中c(CO 3 2- )=
1
2 ×2×10 -4 mo1/L=1×10 -4 mo1/L,根据Ksp=c(CO 3 2- )•c(Ca 2+ )=2.8×10 -9 可知,c(Ca 2+ )=
2.8 ×10 -9
1 ×10 -4 mol/L=2.8×10 -5 mol/L,原溶液CaCl 2 溶液的最小浓度为混合溶液中c(Ca 2+ )的2倍,故原溶液CaCl 2 溶液的最小浓度为2×2.8×10 -5 mol/L=5.6×10 -5 mol/L.
故答案为:5.6×10 -5 mol/L.1年前查看全部
- 在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)⇌CO2(g)+H
 在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)⇌CO2(g)+H2 (g),△H<0.CO和H2O浓度变化如图,下列叙述错误的是( )
在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)⇌CO2(g)+H2 (g),△H<0.CO和H2O浓度变化如图,下列叙述错误的是( )
A.0一4min的平均反应速率υ(CO2)为0.03mol/(L•min)
B.850℃时,平衡常数K=1
C.850℃时,若向该容器中充入1.0 mol CO、1.0 molH2O,则CO的平衡转化率不变
D.容器中气体密度不变不能判断该反应已经达到化学平衡状态 tinawang11061年前1
tinawang11061年前1 -
 宋中 共回答了12个问题
宋中 共回答了12个问题 |采纳率83.3%解题思路:A、根据v=[△c/△t]来计算CO的化学反应速率,根据物质的速率之比等于系数之比来回答;
B、根据850℃时,根据平衡常数K=
来计算;c(CO2)•c(H2) c(CO)•c(H2O)
C、850℃时,若向该容器中充入1.0 mol CO、1.0 molH2O,转化率减小;
D、根据密度是质量和容器体积的比值来判断是否达到了平衡.A、根据图示内容,v(CO)=[△c/△t]=
(0.2−0.08)mol/L
4min=0.03mol/(L•min),所以平均反应速率υ(CO2)为0.03mol/(L•min),故A正确;
B、CO(g)+H2O(g)⇌CO2(g)+H2 (g),
初始浓度:0.2 0.3 0 0
变化浓度:0.12 0.12 0.12 0.12
平衡浓度:0.08 0.18 0.12 0.12
根据850℃时,平衡常数K=
c(CO2)•c(H2)
c(CO)•c(H2O)=[0.12×0.12/0.08×0.18]=1,故B正确;
C、两种反应物,加入一种物质,会提高另一种物质的转化率,本身转化率减小,850°C达到平衡时,通入CO,CO转化率将减小,故C错误;
D、密度是质量和容器体积的比值,反应前后质量是守恒的,体积不变,所以密度始终不变,当密度不变了,不一定是平衡状态,故D正确.
故选C.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查了化学平衡常数的意义和计算应用,转化率的分析判断,掌握平衡常数的计算和判断方法,平衡移动原理是解题关键,题目难度中等.1年前查看全部
- 在1 L的密闭容器中,充入1 mo1CO和1 mo1 H 2 O (g),于850℃时进行化学反应:CO(g) + H
在1 L的密闭容器中,充入1 mo1CO和1 mo1 H 2 O (g),于850℃时进行化学反应:CO(g) + H 2 O (g)
 CO 2 (g) + H 2 (g) △H<0,达平衡时,有50%的CO转化为CO 2 。在相同温度下,将1 mo1CO和4 mo1 H 2 O (g)充入同样的容器中,记录0~8分钟内测得容器内各物质的物质的量如下表。t分钟时为改变条件后达平衡时所测得的数据。下列说法正确的是
CO 2 (g) + H 2 (g) △H<0,达平衡时,有50%的CO转化为CO 2 。在相同温度下,将1 mo1CO和4 mo1 H 2 O (g)充入同样的容器中,记录0~8分钟内测得容器内各物质的物质的量如下表。t分钟时为改变条件后达平衡时所测得的数据。下列说法正确的是
时间/min n (CO)/ mo1 n (H 2 O)/mo1 n (CO 2 )/ mo1 n (H 2 )/ mo1 0 1 4 0 0 4 0.25 3.25 0.75 0.75 6 n 1 n 2 n 3 n 4 8 n 1 n 2 n 3 n 4 t 0.15 3.15 0.85 0.85 A.前4 min,用CO表示的化学反应速率为 v (CO)=0.25mol/(L·min) B.反应在第4 min时处于化学平衡状态 C.8分钟时,混合气体中CO 2 的体积分数为16% D.t分钟时,反应所处的温度高于850℃  iraina08291年前1
iraina08291年前1 -
 小心下雨啊 共回答了14个问题
小心下雨啊 共回答了14个问题 |采纳率71.4%C
本题关键词为温度不变,平衡常数不变 ,K=1。1年前查看全部
- 现有反应:CO(g)+H2OCO2(g)+H2(g);ΔH<0.在850℃时,K=1.在850℃时向一容积可变的密闭容器
现有反应:CO(g)+H2OCO2(g)+H2(g);ΔH<0.在850℃时,K=1.在850℃时向一容积可变的密闭容器中同时充入1.0molCO和3.0molH2O,1.0molCO2和xmolH2,若当x=5.0和6.0且反应达到平衡时,测得H2的体积分数分别为a%和b%,则a______b(填“>”、“<”或“=”)
【注:本题节选自一个大题中的一个小问,不一定每个条件都有用~】 60ejhfdjhng1年前1
60ejhfdjhng1年前1 -
 Insect_Die 共回答了17个问题
Insect_Die 共回答了17个问题 |采纳率94.1%应填1年前查看全部
- 在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)十H2O(g)⇌CO2(g)十H
 在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)十H2O(g)⇌CO2(g)十H2 (g),CO和H2O浓度变化如图,
在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)十H2O(g)⇌CO2(g)十H2 (g),CO和H2O浓度变化如图,
(1)该反应的平衡常数表达式为K=时间(min) CO H2O CO2 H2 0 0.200 0.300 0 0 2 0.138 0.238 0.062 0.062 3 C1 C2 C3 C3 4 C1 C2 C3 C3 5 0.116 0.216 0.084 6 0.096 0.266 0.104 c(CO2)•c(H2) c(CO)•c(H2O) ;c(CO2)•c(H2) c(CO)•c(H2O)
(2)已知上述反应为放热反应,则其反应热△H______零(填“大于”、“小于”或“等于”);升高温度,其平衡常数值______(填“增大”、“减小”或“不变”);
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表.
①表中3min-4min之间反应处于______状态;C1数值______0.08mol/L (填大于、小于或等于).
②反应在4min-5min间,平衡向逆反应方向移动,可能的原因是______(单选),表中5min-6min之间数值发生变化,可能的原因是______(单选).
a.增加水蒸气 b.降低温度
c.使用催化剂 d.增加氢气浓度. wawa5251年前1
wawa5251年前1 -
 天水风流 共回答了23个问题
天水风流 共回答了23个问题 |采纳率91.3%解题思路:(1)化学平衡常数,是指在一定温度下,可逆反应都达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写;
(2)放热反应的△H<0,该反应正反应是放热反应,升高温度平衡向逆反应移动,故平衡常数减小;
(3)①由表中数据可知,3min、4min时都应个组分的浓度相同,故处于平衡状态;
该反应正反应是放热反应,升高温度平衡向逆反应移动,故该温度下平衡时CO的浓度比原平衡850℃大;
②反应中△c(CO)=△c(H2O)=△c(CO2)=△c(H2),由表中数据可知,5min时与开始相比CO、H2O、CO2的浓度变化之比为1:1:1,平衡向逆反应移动,故可能升高温度、降低压强或增大氢气的浓度;
表中5min-6min之间,CO浓度降低0.02mol/L、H2O的浓度增大0.05mol/L、CO2的浓度增大0.02mol/L,故应该是增大水蒸气的浓度.(1)可逆反应CO(g)十H2O(g)⇌CO2(g)十H2 (g)的平衡常数k=
c(CO2)•c(H2)
c(CO)•c(H2O),
故答案为:
c(CO2)•c(H2)
c(CO)•c(H2O);
(2)放热反应的△H<0,该反应正反应是放热反应,升高温度平衡向逆反应移动,故平衡常数减小,
故答案为:小于,减小;
(3)①由表中数据可知,3min、4min时都应个组分的浓度相同,故处于平衡状态,
该反应正反应是放热反应,升高温度平衡向逆反应移动,故该温度下平衡时CO的浓度比原平衡850℃大,
故答案为:平衡,大于;
②反应中△c(CO)=△c(H2O)=△c(CO2)=△c(H2),由表中数据可知,5min时与开始相比CO、H2O、CO2的浓度变化之比为1:1:1,平衡向逆反应移动,故可能升高温度、降低压强或增大氢气的浓度,故选d;
表中5min-6min之间,CO浓度降低0.02mol/L、H2O的浓度增大0.05mol/L、CO2的浓度增大0.02mol/L,故应该是增大水蒸气的浓度,故选a,
故答案为:d,a.点评:
本题考点: 物质的量或浓度随时间的变化曲线;化学平衡的影响因素.
考点点评: 考查化学平衡常数及影响因素、影响化学平衡的因素、化学平衡图象等,难度中等,(3)中注意分析各物质的浓度变化量关系,确定概念改变的条件.1年前查看全部
- (1)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
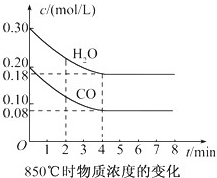 (1)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
(1)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g)十H2O(g)⇌CO2(g)十H2(g)△H<0;
CO和H2O浓度变化如图,则 0-4min的平均反应速率v(CO)=______ mol/(L•min)
(2)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.
t1℃时物质浓度(mol/L)的变化:
①表中3min-4min之间反应处于平衡状态;C1数值______0.08mol/L(填大于、小于或等于).时间/min CO H2O CO2 H2 0 0.200 0.300 0 0 2 0.138 0.238 0.062 0.062 3 C1 c2 c3 c3 4 C1 c2 c3 c3 5 0.116 0.216 0.084 6 0.096 0.266 0.104
②反应在4min-5min时,平衡向逆反应方向移动,可能的原因是______(单选),表中5min-6min之间数值发生变化,可能的原因是______(单选).
A.增加水蒸气 B.降低温度 C.使用催化剂D.增加氢气浓度. yubaosz1年前1
yubaosz1年前1 -
 睛和夺取 共回答了20个问题
睛和夺取 共回答了20个问题 |采纳率90%解题思路:(1)根据v=[△c/△t]计算v(CO);
(2)①表中3min-4min之间各物质的浓度不变,850℃达到平衡,c(CO)=0.08mol/L,该反应为放热反应,升高温度逆向移动;
②反应在4min~5min,平衡向逆方向移动,根据平衡移动原理,结合选项判断;
由表中数据可知,5min~6minCO的浓度降低,CO2浓度增大,浓度变化都是0.02mol/L,说明平衡向正反应移动,再结合水的浓度变化进行判断.(1)由图可知,0-4min内△c(CO)=0.2mol/L-0.08mol/L=0.12mol/L,则v(CO)=[0.12mol/L/4min]=0.03mol•(L•min)-1,
故答案为:0.03;
(1)①由表中数据可知,3min、4min时,反应混合物对应物质的浓度不变,处于与平衡状态,由图可知850℃平衡时CO的浓度为0.8mol/L,该反应正反应是放热反应,升高温度平衡向逆反应移动,达新平衡时CO的浓度大于0.08mol/L,
故答案为:大于;
②反应在4min~5min,平衡向逆方向移动,增大水蒸气的浓度,平衡向正反应移动,降低温度平衡向正反应移动,使用催化剂平衡不移动,增大氢气的浓度,平衡向逆反应移动,故4min~5min改变条件为增大氢气的浓度,
由表中数据可知,5min~6minCO的浓度降低,CO2浓度增大,浓度变化都是0.02mol/L,说明平衡向正反应移动,而水的浓度增大0.05mol/L,应是增大水蒸气的浓度,
故答案为:D,A.点评:
本题考点: 化学平衡的影响因素;反应速率的定量表示方法;物质的量或浓度随时间的变化曲线.
考点点评: 本题考查化学反应速率计算、化学平衡影响因素等,综合图表信息来分析是解答的关键,较好的考查学生分析解决问题的能力,难度中等,(2)③中注意分析浓度变化判断改变条件.1年前查看全部
- 病句修改:因为在850℃的温度下把斯石英加热30分钟,它就将变成普通的沙子.
 日出揭杆而起1年前1
日出揭杆而起1年前1 -
 gemlmkj 共回答了14个问题
gemlmkj 共回答了14个问题 |采纳率78.6%把因为改为只要,搭配不当1年前查看全部
- 已知850℃时,CO(g)+H 2 O(g) CO 2 (g)+H 2 (g)的K=1。850℃时,若在容积为2L的密闭
已知850℃时,CO(g)+H 2 O(g)
 CO 2 (g)+H 2 (g)的K=1。850℃时,若在容积为2L的密闭容器中同时充入1.0mol CO,3.0mol H 2 O,1.0mol CO 2 和xmol H 2 。
CO 2 (g)+H 2 (g)的K=1。850℃时,若在容积为2L的密闭容器中同时充入1.0mol CO,3.0mol H 2 O,1.0mol CO 2 和xmol H 2 。
(1)当x=5.0时,判断化学反应进行的方向。
(2)若要使上述反应开始时向正反应方向进行,则x应满足的条件是什么?
(3)若x=5.0,当上述反应达到平衡后,计算H 2 的体积分数。 lgliuqingjun1年前1
lgliuqingjun1年前1 -
 piziwang813 共回答了22个问题
piziwang813 共回答了22个问题 |采纳率100%(1)逆向进行(2)0≥x>3(2)0.48
略1年前查看全部
- (1)现有反应:CO(g)+H2O(g)⇌CO2(g)+H2(g)△H>0.在850℃时,K=1.此温度下,若向一容积
(1)现有反应:CO(g)+H2O(g)⇌CO2(g)+H2(g)△H>0.在850℃时,K=1.此温度下,若向一容积可变的密闭容器中同时充入1.0mol CO,3.0mol H2O,1.0mol CO2和xmol H2,则:
①当x=5.0时,上述反应向______方向进行.
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是______.
③在850℃时,若设x=5.0和x=6.0,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a______b(填“大于”“小于”或“等于”).
(2)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,它的Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为______. 付香香1年前1
付香香1年前1 -
 妖孽冰 共回答了21个问题
妖孽冰 共回答了21个问题 |采纳率85.7%解题思路:(1)①反应混合物各物质的量系数相同都为1,利用物质的量代替浓度,计算浓度商Qc,根据浓度商Qc与平衡常数k的关系判断.Qc>k平衡向逆反应进行,Qc=k反应处于平衡状态,Qc<k平衡向正反应进行;
②用x表示出浓度商Qc,平衡向正反应移动,应满足浓度商Qc<k,据此计算判断;
③增大一种生产物(氢气)的体积分数,平衡向逆反应方向移动,平衡移动的结果是降低这种增大的幅度,故平衡后氢气的体积分数还是大于原来的;
(2)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=1×10-4mol/L,根据Ksp=c(CO32-)•c(Ca2+)计算沉淀时混合溶液中c(Ca2+),原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍.(1)①此时的浓度商Qc=[1×5/1×3]=1.67,大于平衡常数1,故平衡向逆反应方向移动,故答案为:逆反应;
②平衡向正反应方向移动,浓度商小于平衡常数,即[1×x/1×3]<1,解得x<3,所以0≤x<3,故答案为:0≤x<3;
③加入6mol氢气所到达的平衡,可以等效为在加入5mol氢气到达平衡后再加入1mol氢气,增大一种生产物(氢气)的体积分数,平衡向逆反应方向移动,平衡移动的结果是降低这种增大的幅度,但平衡后氢气的体积分数还是大于原来的,故得H2的体积分数分别为a%<b%,故答案为:小于;
(2)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=[1/2]×2×10-4mol/L=1×10-4mol/L,根据Ksp=c(CO32-)•c(Ca2+)=2.8×10-9可知,c(Ca2+)=
2.8×10−9
1×10−4mol/L=2.8×10-5mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×2.8×10-5mol/L=5.6×10-5mol/L.
故答案为:5.6×10-5mol/L.点评:
本题考点: 化学平衡的计算;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查平衡常数的计算与运用、溶度积的有关计算等,难度中等,注意化学平衡常数只与温度有关,与反应物浓度、是否使用催化剂无关,温度不变,化学平衡常数不变,(2)中计算为易错点,溶液忽略混合后溶液的浓度发生变化.1年前查看全部
- CO2和H2的混合气体加热到850℃时,可建立下列平衡:CO2(g)+H2(g)⇌CO(g)+H2O(g)在一定温度下,
CO2和H2的混合气体加热到850℃时,可建立下列平衡:CO2(g)+H2(g)⇌CO(g)+H2O(g)在一定温度下,反应平衡时有90%的氢气变成水,且c(CO2)•c(H2)=c(CO)•c(H2O),则原混合气体中CO2和H2分子数之比是( )
A. 1:1
B. 5:1
C. 9:1
D. 1:10 海参刺身1年前1
海参刺身1年前1 -
 fuji4011 共回答了14个问题
fuji4011 共回答了14个问题 |采纳率92.9%解题思路:设出氢气、二氧化碳的物质的量,然后依据化学平衡的三段式列式,结合题干条件中氢气转化率计算出达到平衡时各组分的物质的量浓度,
由于c(CO2)•c(H2)=c(CO)•c(H2O),说明平衡常数等于1,列式计算出x:y即可.设原混合气体中CO2和H2的物质的量分别为x、y,体积为1L,在一定温度下,平衡有90%的H2变成了H2O消耗氢气0.9y,则
CO2(g)+H2(g)⇌CO(g)+H2O(g)
起始量(mol/L) x y 0 0
变化量(mol/L)0.9y 0.9y 0.9y 0.9y
平衡量(mol/L)x-0.9y 0.1y 0.9y 0.9y
依据c(CO2)•c(H2)=c(CO)•c(H2O)
得到:(x-0.9y)×0.1y=0.9y×0.9y
计算得到x:y=9:1
故选C.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查了化学平衡的计算应用,掌握平衡常数含义、平衡三段式计算分析是解题关键,题目难度中等.1年前查看全部
- 在1L的密闭容器中,充入1molCO和1molH2O (g),于850℃时进行化学反应:CO(g)+H2O
在1L的密闭容器中,充入1molCO和1molH2O (g),于850℃时进行化学反应:CO(g)+H2O (g)⇌CO2(g)+H2(g)△H<0,达平衡时,有50%的CO转化为CO2.在相同温度下,将1molCO和4molH2O(g)充入同样的容器中,记录0~8分钟内测得容器内各物质的物质的量如下表.下列说法正确的是( )
时间/min n(CO)/mol n(H2O)/mol n(CO2)/mol n(H2)/mol 0 1 4 0 0 4 0.25 3.25 0.75 0.75 6 n1 n2 n3 n4 8 n1 n2 n3 n4
A.前4min,用CO表示的化学反应速率为v(CO)=0.25mol/(L•min)
B.反应在第4 min时处于化学平衡状态
C.8分钟时,混合气体中CO2的体积分数为16%
D.若初始条件相同,绝热下进行上述反应,6 min时n(CO)>n1 caoyudehome1年前0
caoyudehome1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 求一句科技英语的汉译英.由图可见,“在600℃时该材料的收缩率是850℃时的72%” 双引号中的部分应该怎么样翻译成准确
求一句科技英语的汉译英
.由图可见,“在600℃时该材料的收缩率是850℃时的72%” 双引号中的部分应该怎么样翻译成准确的科技英语?
背景是一个材料在烧结过程中发生收缩,当850℃时达到最大收缩值,此时材料的收缩率为A%,这句想表达的意思就是升温到600℃时材料已经收缩到了最大收缩值的72%,也就是收缩率是(72*A)%
求各路高手指点. WindChild1年前3
WindChild1年前3 -
 62962423 共回答了20个问题
62962423 共回答了20个问题 |采纳率90%在600℃时该材料的收缩率是850℃时的72% .
The shrinkage of this material is 72% when under the temperature 600 ℃ as much as that when under the temperature 850 ℃.1年前查看全部
- 已知850℃时,CO(g)+H2O(g)⇌CO2(g)+H2(g)的K=1.850℃时,若在容积为2L的密闭容器中同时充
已知850℃时,CO(g)+H2O(g)⇌CO2(g)+H2(g)的K=1.850℃时,若在容积为2L的密闭容器中同时充入1.0mol CO,3.0mol H2O,1.0mol CO2和xmol H2.
(1)当x=5.0时,判断化学反应进行的方向.
(2)若要使上述反应开始时向正反应方向进行,则x应满足的条件是什么?
(3)若x=5.0,当上述反应达到平衡后,计算H2的体积分数. woaiswim1年前1
woaiswim1年前1 -
 slang868 共回答了22个问题
slang868 共回答了22个问题 |采纳率90.9%解题思路:(1)反应前后气体的体积不变,用物质的量代替浓度计算此时浓度商Qc,与平衡常数比较判断反应进行方向;
(2)反应开始时向正反应方向进行,则浓度商Qc小于平衡常数,据此列方程计算;
(3)根据平衡移动方向,设某一组分转的物质的量为amol,利用三段式表示出平衡时各组成的物质的量,再根据平衡常数列方程计算a的值,计算平衡时氢气的物质的量,根据体积分数定义计算.(1)反应前后气体的体积不变,用物质的量代替浓度计算此时浓度商Qc=[1×5/1×3]=1.7>1,故反应向逆反应进行,
答:反应向逆反应进行.
(2)反应开始时向正反应方向进行,则浓度商Qc小于平衡常数,故[1×x/1×3]<1,解答x<3,
答:应满足x<3.
(3)令平衡时转化的氢气为amol,则:
CO(g)+H2O(g)⇌CO2(g)+H2(g)
开始(mol):1 3 1 5
变化(mol):a aa a
平衡(mol):1+a 3+a 1-a5-a
故
(1−a)×(5−a)
(1+a)×(3+a)=1,解得a=0.2
故平衡时氢气的体积分数为[5−0.2/1+3+1+5]=0.48,
答:平衡时氢气的体积发生为0.48.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡的计算与运用,难度中等,注意掌握平衡常数的书写与用途.1年前查看全部
- 在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)十H2O(g)⇌CO2(g)十H
 在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)十H2O(g)⇌CO2(g)十H2 (g)△H=Q KJ•mol-1 (Q>0)CO和H2O浓度变化如图,则0~4min的平均反应速率v(CO)=______mol/(L•min)
在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)十H2O(g)⇌CO2(g)十H2 (g)△H=Q KJ•mol-1 (Q>0)CO和H2O浓度变化如图,则0~4min的平均反应速率v(CO)=______mol/(L•min)  好评1231年前1
好评1231年前1 -
 lurongkai 共回答了22个问题
lurongkai 共回答了22个问题 |采纳率90.9%解题思路:根据v=[△c/△t]进行计算.由图象可知:0~4min的v(CO)=[0.20mol/L−0.08mol/L/4min]=0.03mol/(L•min),
故答案为:0.03.点评:
本题考点: 反应速率的定量表示方法.
考点点评: 本题考查化学反应速率的相关计算,把握化学反应速率的数学表达式为解答的关键,难度不大.1年前查看全部
- 把质量为0.1千克,温度为20℃的铁钉加热到850℃,铁钉需要吸收热量是:(C铁=462焦/
把质量为0.1千克,温度为20℃的铁钉加热到850℃,铁钉需要吸收热量是:(C铁=462焦/
把质量为0.1千克,温度为20℃的铁钉加热到850℃,铁钉需要吸收热量是:(C铁=462焦/(千克•℃))[ ]
A.3834.6焦耳 B.383460焦耳 C.38346焦耳 D.383.46焦耳 lxwgdmz1年前1
lxwgdmz1年前1 -
 万里似长空 共回答了15个问题
万里似长空 共回答了15个问题 |采纳率93.3%Q放=Cm(t初-t末)=0.1*462*(850-20)=38346焦耳
答案是C.1年前查看全部
- 在一体积为10 L的密闭容器中,通入一定量的CO和H 2 O,在850℃时发生如下反应:
在一体积为10 L的密闭容器中,通入一定量的CO和H 2 O,在850℃时发生如下反应:
CO(g)+H 2 O(g) CO 2 (g)+H 2 (g) △H<0。CO和H 2 O浓度变化如图
CO 2 (g)+H 2 (g) △H<0。CO和H 2 O浓度变化如图
(1)0~4 min的平均反应速率v(CO)____mol/(L·min)。
(2)850℃时,平衡常数K=____。
(3)850℃时,若向该容器中充入1.0 mol CO、3.0 mol H 2 O,则CO的平衡转化率为_______。
(4)能判断该反应达到化学平衡状态的依据是____(填选项序号)。
a.容器中压强不变
b.混合气体中c(CO)不变
c.v正(H 2 )=v逆(H 2 O)
d.c(CO 2 )=c(CO)
e.容器中气体密度不变
f.1 mol H-H键断裂的同时断裂2 mol H-O键 maotou5551年前1
maotou5551年前1 -
 aa1500 共回答了18个问题
aa1500 共回答了18个问题 |采纳率94.4%(1)0.0.3
(2)1
(3)75%
(4)bcf1年前查看全部
- 在体积为10L的容器中,通入一定量的CO和H2O,在850℃发生如下反应
 在体积为10L的容器中,通入一定量的CO和H2O,在850℃发生如下反应
在体积为10L的容器中,通入一定量的CO和H2O,在850℃发生如下反应
CO(g)+H2O(g)⇌CO2(g)+H2(g)△H<0.
CO和H2O浓度变化如图所示;在t℃(高于850℃)时,在相同容器发生上述反应,容器内各物质的浓度如下表:下列叙述不正确的是( )时间(min) CO H2O CO2 H2 0 0.200 0.300 0 0 2 0.138 0.238 0.062 0.062 3 C1 C2 C3 C3 4 C1 C2 C3 C3 5 0.116 0.216 0.084 C
A.由图可知,0~4 min间平均反应速率v(CO)=0.03mol/(L•min)
B.表中3~4 min之间反应处于平衡状态
C.表中3~4 min之间,C1数值小于0.08 mol/L
D.表中反应在4~5min间,平衡向逆方向移动的原因可能是增大H2的浓度 ouxiaqinqin1年前1
ouxiaqinqin1年前1 -
 韩少爷的kk 共回答了22个问题
韩少爷的kk 共回答了22个问题 |采纳率90.9%解题思路:A、由图可知在0-4min,△c=0.2mol/L-0.08mol/L=0.12mol/L,结合v(CO)=[△c/△t]计算;
B、表中3min-4min之间各物质的浓度不变,达到平衡状态,据此判断;
C、升高温度逆向移动,c(CO)>0.08mol/L,据此判断;
D、根据4min-5min之间,各物质的浓度变化判断改变的条件.A、由图可知在0-4min,△c=0.2mol/L-0.08mol/L=0.12mol/L,则v(CO)=[△c/△t]=[0.12mol/L/4min]=0.03mol•(L•min)-1,故A正确;
B、表中3min-4min之间各物质的浓度不变,达到平衡状态,故B正确;
C、升高温度逆向移动,c(CO)>0.08mol/L,故C错误;
D、C1>0.08mol/L,则C3<0.12mol/L,C2>0.18mol/L,4min-5min之间,平衡向逆方向移动,二氧化碳的浓度降低,一氧化碳和水蒸气的浓度都增大,所以改变的条件是增大氢气的浓度,故D正确;
故选C.点评:
本题考点: 物质的量或浓度随时间的变化曲线.
考点点评: 本题考查化学反应速率及化学平衡,明确表格中数据分析是解答本题的关键,注重学生能力的考查,题目难度不大1年前查看全部
- 在体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
 在体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
在体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g)十H2O(g)⇌CO2(g)十H2 (g)△H<0,CO和H2O浓度变化如图,
(1)3min-4min之间反应处于______状态(填平衡、不平衡);
(2)要使反应在8min后,平衡向逆方向移动,可采取的措施是______,要使反应在8min后,反应速率降低,平衡向正方向移动,可采取的措施是______.(填a,b,c,d)
a.增加水蒸气b.降低温度 c.使用催化剂d.增加氢气浓度
(3)求出850℃时,该反应的平衡常数和CO的平衡转化率(写出详细计算过程) iarfbw1年前1
iarfbw1年前1 -
 又见黄昏晓 共回答了17个问题
又见黄昏晓 共回答了17个问题 |采纳率94.1%解题思路:(1)根据3min-4min之间,CO和H2O浓度还在变化,未达平衡状态;
(2)根据外界条件的改变对化学平衡移动的影响判断;
(3)计算出平衡时各物质浓度,利用化学平衡常数表达式和CO转化率表达式计算.(1)3min-4min之间,CO和H2O浓度还在变化,未达平衡状态,故答案为:不平衡;
(2)a.增加水蒸气,化学平衡向正反应方向移动,化学反应速率增大;
b.正反应放热,降低温度,化学平衡向右移动,化学反应速率减小;
c.使用催化剂,化学平衡不移动;
d.增加氢气浓度,化学平衡向逆反应方向移动,化学反应速率增大;
根据以上分析可知,平衡向逆方向移动,可采取的措施选择d;反应速率降低,平衡向正方向移动,可采取的措施选择b,
故答案为:d;b;
(3)850℃时,转化的CO为0.12mol/L,则
CO(g)十 H2O(g)⇌CO2(g)十 H2 (g)
初始浓度(mol/L)0.20.30 0
变化浓度(mol/L)0.120.120.120.12
平衡浓度(mol/L)0.080.180.120.12
化学平衡常数K=
c(CO2) •c(H2)
c(CO)• c(H2O) =[0.12 mol/L×0.12 mol/L/0.08 mol/L×0.18 mol/L]=1,CO的转化率为:
0.12mol/L
0.20mol/L×100%=60%,
答:该反应的平衡常数为1,CO的平衡转化率为60%.点评:
本题考点: 物质的量或浓度随时间的变化曲线;化学平衡的影响因素;化学平衡的计算.
考点点评: 本题考查化学平衡常数及影响因素、影响化学平衡的因素、化学平衡图象与计算等,难度中等.1年前查看全部
- 现有反应CO(g)+H2O(g)⇌CO2(g)+H2(g)△H<0,850℃时,平衡常数K=1
现有反应CO(g)+H2O(g)⇌CO2(g)+H2(g)△H<0,850℃时,平衡常数K=1
(1)若升高温度到950℃时,达到平衡时K______1(用“>、=、<”表示).
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0mol CO、3.0molH2O、1.0mol CO2和 x molH2,则:
①当x=5.0时,上述平衡向______(填正反应或逆反应)方向进行.
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是______.
(3)在350℃时,保持温度不变,将1molCO2和3molH2充入一密闭恒容容器中,充分反应生成甲醇蒸汽和水蒸气达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为[2−a/2][2−a/2];若350℃时,保持温度不变,将1molCO2和3molH2充入一密闭恒压容器中,充分反应达到平衡后,若CO2转化率为b,则a______b(用“>、=、<”表示). flower-jason1年前1
flower-jason1年前1 -
 fatfatfat 共回答了14个问题
fatfatfat 共回答了14个问题 |采纳率92.9%解题思路:(1)反应是放热反应升温平衡逆向进行,平衡常数减小;
(2)①依据浓度商计算和平衡常数比较反应进行方向;
②若要使上述反应开始时向正反应方向进行,满足Q<K分析计算;
(3)根据化学平衡的三段法计算平衡时各物质的物质的量,再利用反应前后气体的物质的量之比等于压强之比来计算压强之比;根据压强对平衡移动的影响来确定平衡的移动方向;(1)CO(g)+H2O(g)⇌CO2(g)+H2(g);△H<0,在850℃时,平衡常数K=1,升温到950℃时,平衡常数随温度变化,反应是放热反应,升温平衡逆向进行,平衡常数减小,K<1;
故答案为:<;
(2)①850℃时,若向一容积可变的密闭容器中同时充入 1.0molCO、3.0molH2O、1.0molCO2和 xmolH2,当x=5.0时,反应前后气体体积不变,可以利用物质的量代替平衡浓度计算浓度商,Q=[5.0×1.0/1.0×3.0]=[5/3]>K=1,平衡逆向进行;
故答案为:逆反应;
②若要使上述反应开始时向正反应方向进行,满足Q<K,Q=[x×1.0/1.0×3.0]<1,x<3.0,则x应满足的条件是0<x<3;
故答案为:0<x<3;
(3)由化学平衡的三段模式法计算可知,
CO2 (g)+3H2(g)=CH3OH(g)+H2O(g)
起始1300
变化a3 aaa
平衡 1-a3-3aaa
根据相同条件下气体的压强之比等于物质的量之比,
则容器内的压强与起始压强之比为[1−a+3−3a+a+a/1+3]=[2−a/2],若350℃时,保持温度不变,将1molCO2和3molH2充入一密闭恒压器中,由于反应中气体的物质的量
是减小的,所以恒压相当于在恒容的基础上加大压强,平衡会正向移动,CO2转化率会增大,即a<b.
故答案为:[2−a/2];<;点评:
本题考点: 化学平衡的计算;化学平衡的影响因素.
考点点评: 本题考查了化学平衡影响因素分析,平衡计算应用,主要是条件改变判断移动的理解应用,掌握基础是关键,题目难度中等.1年前查看全部
- 已知反应CO+H2O=CO2+H2,在850℃时的平衡常数K=1.
已知反应CO+H2O=CO2+H2,在850℃时的平衡常数K=1.
已知反应CO+H2O=CO2+H2,在850℃时的平衡常数K=1。850℃时,若向溶积为1L的密闭容器中同时充入1.0molCO,3.0molH2O,1.0molCO2,xmolH2,则(1)当x=5.0时,使计算判断该反应的初始状态是否为化学平衡状态?(2)若要使该反应的初始状态是否为化学平衡状态,求x应满足的条件。 凝露的玫瑰1年前2
凝露的玫瑰1年前2 -
 水果皇后 共回答了23个问题
水果皇后 共回答了23个问题 |采纳率95.7%(1)各物质的浓度为:
C(CO)=1.0mol/1L=1mol/L
C(H2O)=3.0mol/1L=3mol/L
C(CO2)=1.0mol/1L=1mol/L
C(H2)=Xmol/1L=5.0mol/1L=5mol/L
该反应的浓度商Qc=[C(CO2)*C(H2)]/[C(CO)*C(H2O)]=[1mol/L*5mol/L]/[1mol/L*3mol/L]=1.67>1,
反应没有达到平衡状态,反应向逆反应方向进行.
(2)若要使该反应的初始状态为化学平衡状态,
该反应的浓度商Qc=平衡常数K=1
Qc=[C(CO2)*C(H2)]/[C(CO)*C(H2O)]=[1mol/L*Xmol/L]/[1mol/L*3mol/L]=K=1
解得X=3mol/L
3mol/L*1L=3mol
x应满足的条件为3mol1年前查看全部
大家在问
- 1若f(x)=e−x2,则limt→0f(1−2t)−f(1)t=[4/e][4/e].
- 2苯中溶解了少量酒精,怎么除去酒精这个杂质
- 3观察右边两幅图片,回答下列问题。
- 4一报刊销售亭从报社订购某晚报的价格是每份0.7元,销售价是每份1元,卖不掉的报纸还可以以0.2元的价格退还给报社,在一个
- 5Tom together with two of his classmates is tring new tricks
- 6成语玩命猜一个人看着另一个人摔倒
- 7请问play against和play
- 8请问打八十分主一共有多少张?
- 9下列因素中与人种分布最为密切的是( )
- 10水中的硝酸盐含量过高,用于洗漱有什么影响
- 11两个字是近义词的词语,如:咀嚼 两个字是反义词的词语,如:燥湿
- 12(2010•市南区模拟)青岛市某月份连续6天的最高气温依次是:14、13、7、7、12、13(单位:℃),则这组数据的中
- 13有一个两位数十位上和个位上的数的比是3:2个位上的数加上2就和十位上的数同样多
- 14Open the window!(变成否定句) the window!
- 15那长长的柳条,随风飘动.(改为拟人句)



