碳酸锂的化学方程式?为什么不是LIH2CO3呢?H2CO3不是碳酸吗
 二丫blog2022-10-04 11:39:541条回答
二丫blog2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 颀夕 共回答了16个问题
颀夕 共回答了16个问题 |采纳率93.8%- 碳酸锂的化学式是Li2CO3,锂是正1价,碳酸根负二价.
锂和碳酸反应:2Li+H2CO3=Li2CO3+H2↑ - 1年前
相关推荐
- 1千克一氧化二锂,其中锂元素的含量是多少,转化成碳酸锂后,是多少.
1千克一氧化二锂,其中锂元素的含量是多少,转化成碳酸锂后,是多少.
学文科的我被问到这个问题,已经十多年没碰过物理化学了,真是郁闷死我了,
Li2CO3 原子量为114,好像有点不对吧,7*2+12+16*3=74吧 816497071年前1
816497071年前1 -
 detonator 共回答了12个问题
detonator 共回答了12个问题 |采纳率91.7%一氧化二锂 Li2O,Li的原子量为7,O的原子量为16,所以1千克一氧化二锂,LI元素的含量为:
1*7*2/(7*2+16)=14/30=0.46666667KG,
碳酸锂:Li2CO3 原子量为74
转换为碳酸锂后为:0.466666/(14/74)=2.4666667KG
是啊,算错了,改过来了1年前查看全部
- 碳酸锂,碳酸锶和稀盐酸,稀硫酸反应的化学方程式
 霹雳小喇叭1年前1
霹雳小喇叭1年前1 -
 hhyui 共回答了17个问题
hhyui 共回答了17个问题 |采纳率88.2%Li2CO3 + 2 HCl = 2 LiCl + CO2↑ + H2O
SrCO3 + 2 HCl = SrCl2 + CO2↑ + H2O
Li2CO3 + H2SO4 = Li2SO4 + CO2↑ + H2O
SrCO3 + H2SO4 = SrSO4 + CO2↑ + H2O
碳酸盐的通性.1年前查看全部
- 碳酸锂广泛应用于陶瓷和医药等领域.已β-锂辉石(主要成分为Li2O-Al2O3-4SiO2)为原材料制备Li2CO3的工
碳酸锂广泛应用于陶瓷和医药等领域.已β-锂辉石(主要成分为Li2O-Al2O3-4SiO2)为原材料制备Li2CO3的工艺流程如下:

已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4;Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g.
(1)步骤Ⅰ前,B-锂辉石要粉碎成细颗粒的目的是______.
(2)步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li+、SO42-,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需在搅拌下加入______(填“石灰石”、“氯化钙”或“稀硫酸”)以调节溶液的pH到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液.
(3)步骤2中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去的杂质金属离子有______
(4)步骤3中,生成沉淀的离子方程为______
(5)从母液中可回收的主要物质是______. luowei05281年前1
luowei05281年前1 -
 bishuwei 共回答了12个问题
bishuwei 共回答了12个问题 |采纳率83.3%解题思路:(1)从反应速率的角度来分析;
(2)抓住题目中的“酸性溶液”,“调节溶液的pH到6.0~6.5”,从所给试剂中选择符合条件的药品;
(3)H2O2是强氧化剂,可把Fe2+氧化成Fe3+,石灰乳和碳酸钠都是沉淀剂,使溶液中的Fe2+、Mg2+、Ca2+;
(4)分析Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g可知,Li2CO3最易沉淀;
(5)由元素守恒可知,母液中存在较多的Na+、SO42-.(1)固体颗粒越小,化学反应速率越快,同时可使锂元素尽可能多地溶解到酸中,故答案为:(1)增大固液接触面积,加快浸出反应速率,提高浸出率;
(2)所给三种物质中,只有CaCO3能够降低溶液的酸度,提高溶液的pH到6.0~6.5,可除去Fe3+、Al3+.,故答案为:石灰石;
(3)步骤Ⅱ中加入H2O2溶液,可将Fe2+氧化为Fe3+,然后加入石灰乳可除去其中的Fe3+和Mg2+,再加入Na2CO3溶液可除去Ca2+.此时溶液中的离子主要有Li+、Na+、SO42-,
故答案为:Fe2+、Mg2+、Ca2+;
(4)步骤Ⅲ加入饱和Na2CO3溶液后,主要使Li+转化为Li2CO3沉淀,故答案为:2Li++CO32-=Li2CO3↓;
(5)反应后,溶液中的Na2SO4以及加入的过量Na2CO3便留在母液中,可回收的主要物质为Na2SO4,故答案为:Na2SO4.点评:
本题考点: 含硅矿物及材料的应用;物质的分离、提纯和除杂;制备实验方案的设计.
考点点评: 钠、铝、铁、铜及其化合物是日常生活中非常重要的物质,特别是铝、铁在国民经济中占有极其重要的地位.命题的重点将是钠及其化合物(特别是Na2O2、Na2CO3、NaHCO3)的性质、铝及其化合物的两性、Fe2+与Fe3+之间的转化关系、铜的冶炼及Cu(OH)2的性质等.估计以后高考试题将会在选择题中以离子共存、离子方程式、氧化还原反应、物质的鉴别与分离等角度考查金属元素及其化合物的性质,也会在非选择题中以金属元素的性质为载体,通过推断题、实验题,考查考生运用金属元素的有关知识分析解决问题的能力.以实验探究的形式考查元素化合物的性质将成为以后高考命题的新亮点.1年前查看全部
- 四氧化三钴与碳酸锂反应化学方程式
四氧化三钴与碳酸锂反应化学方程式
在Co3O4+Li2CO3+O2→LiCoO2+CO2的反应方程式(本式未配平)中,怎么计算生成1kgLiCoO2所需的理论的Co3O4和Li2CO3的用量? hqbeyond1年前1
hqbeyond1年前1 -
 Foryou023 共回答了13个问题
Foryou023 共回答了13个问题 |采纳率84.6%4Co3O4+6Li2CO3+O2→12LiCoO2+6CO2
M(Co3O4)=240.8g/mol
M(Li2CO3)=73.89g/mol
M(LiCoO2)=97.873g/mol
m(Co3O4)=1000/97.873/3*240.8=820.11g
m(Li2CO3)=1000/97.873/2*73.89=377.48g1年前查看全部
- 若碳酸锂和碳酸钡的混合物与碳酸钙的质量相同,且跟盐酸反应生成二氧化碳量相同,碳酸锂和碳酸钡的质量比为多少?
若碳酸锂和碳酸钡的混合物与碳酸钙的质量相同,且跟盐酸反应生成二氧化碳量相同,碳酸锂和碳酸钡的质量比为多少?
20℃时,碳酸钠和碳酸氢钠的溶解度为21.5g和9.6g,向100g20℃饱和碳酸钠溶液中通入足量的二氧化碳,最多可的晶体多少克?温度(20℃) 好长的烟ss1年前2
好长的烟ss1年前2 -
 zdhzjy 共回答了16个问题
zdhzjy 共回答了16个问题 |采纳率87.5%1.
碳酸钙的原子量为40+12+48=100
所以100g碳酸钙中碳酸根物质的量为1mol
所以100g碳酸锂和碳酸钡的混合物中碳酸根的物质的量也为1mol
设 碳酸锂为Xmol 碳酸钡为Ymol
则有74X+197Y=100 X+Y=1
联立后得 X=97/123 Y=26/123
则X:Y=97:26
2.100g饱和Na2CO3溶液中含Na2CO3为:
100g× ×100%=17.7g
21.5g
100g+21.5g
含水为:82.3g
设通人CO2后消耗H2O和生成的NaHCO3的质量分别为x,y则有:
106 18 2×84
17.7g x=3.0g y=28g
反应后剩余H2O的质量为:82.3g-3.0g=79.3g
最多能溶解NaHCO3的质量为:×79.3g=7.6g
9.6g
100g
最多能析出NaHCO3的质量为28g-7.6g 答:略1年前查看全部
- 碳酸锂 标准熵
 i_iew819ya7ab_21年前1
i_iew819ya7ab_21年前1 -
 灰色秋夜 共回答了17个问题
灰色秋夜 共回答了17个问题 |采纳率100%最后一个字我不认识,我只知道碳酸锂的价格在40元/公斤左右,厂家有很多,但拿少了同样很贵!梓源工贸1年前查看全部
- 1、汞的氯化物有哪些?2、为什么锂盐的性质很特殊?(像晶体构型、碳酸锂溶解度...)
 要命不停1年前2
要命不停1年前2 -
 tom_chan 共回答了24个问题
tom_chan 共回答了24个问题 |采纳率91.7%氯化汞HgCl2
氯化亚汞Hg2Cl2,两个汞形成了一根键
锂离子半径特别小,导致在晶体里锂的配位数通常不能超过4(不然负离子就挤在一起了)
钠离子半径比锂离子大4倍左右.
锂离子和钠离子不同
软硬酸碱理论中,锂离子属于硬酸,钠离子则软得多
酸根离子中氧是硬碱
硬-硬结合稳定
所以碳酸锂溶解度很小,氟化锂难溶,氢氧化锂溶解度也不大
并且锂离子半径小,离子势大,形成晶体的晶格能大
因此它反常地能和氮气常温下反应(氮化锂晶格能特别大)
锂离子很多性质还是相当像碱土金属的.1年前查看全部
- 草酸锂分解生成什么?买了一瓶碳酸锂,本想把它分解得到氧化锂,但要求温度太高,实在做不了,将碳酸锂放入草酸中,得到草酸锂,
草酸锂分解生成什么?
买了一瓶碳酸锂,本想把它分解得到氧化锂,但要求温度太高,实在做不了,将碳酸锂放入草酸中,得到草酸锂,Li2CO3+H2C2O4===Li2C2O4+H2O+CO2↑
分解它温度是够了,但不知道产物是什么,求高人 haai830671年前1
haai830671年前1 -
 移动号码超市 共回答了16个问题
移动号码超市 共回答了16个问题 |采纳率100%应该是生成LiO和CO
草酸锂,色斜方晶体,比重约2.12,490℃以上分解,590℃以上分解完全1年前查看全部
- 在飞船中为了处理人体排出的CO2,飞船上采用了氢氧化锂(LiOH)作为吸收剂,反应生成碳酸锂和水.LiOH中锂元素的化合
在飞船中为了处理人体排出的CO2,飞船上采用了氢氧化锂(LiOH)作为吸收剂,反应生成碳酸锂和水.LiOH中锂元素的化合价是+1+1,飞船上LiOH吸收C02的化学方程式是:CO2+2LiOH=Li2CO少+H2OCO2+2LiOH=Li2CO少+H2O.
 蘩藜11年前1
蘩藜11年前1 -
 daizhi140 共回答了21个问题
daizhi140 共回答了21个问题 |采纳率90.5%LiOH中氢氧根为-1价,为保证不显电性,正负化合价s代数和为0,则Li为+1价;k氧化碳和氢氧化锂反应生成Li4CO3和H4O,根据反应物、生成物、配平可得其化学方程式是 CO4+4LiOH=Li4CO3+H4O.
故答案为:+1、CO4+4LiOH=Li4CO3+H4O1年前查看全部
- β-锂辉石的主要成分是Li2O•Al2O3•4SiO2,还含有FeO、CaO、MgO等.以β-锂辉石为原料制备碳酸锂的一
β-锂辉石的主要成分是Li2O•Al2O3•4SiO2,还含有FeO、CaO、MgO等.以β-锂辉石为原料制备碳酸锂的一种流程如下:

已知:①部分金属氢氧化物开始沉淀和完全沉淀的pH:
②Li2CO3在不同温度的溶解度如下表:氢氧化物 Fe(OH)3 Al(OH)3 Mg(OH)2 开始沉淀pH 2.7 3.7 9.6 完全沉淀pH 3.7 4.7 11
回答下列问题:温度/℃ 0 10 20 50 75 100 Li2CO3的溶解度/g 1.539 1.406 1.329 1.181 0.866 0.728
(1)反应Ⅱ中加碳酸钙的作用是______.
(2)写出反应Ⅲ中生成沉淀A的离子方程式______、______.
(3)写出反应Ⅳ的化学方程式______.洗涤所得Li2CO3沉淀要用热水而非冷水,原因是______. 甘布公主1年前1
甘布公主1年前1 -
 hzw_520 共回答了21个问题
hzw_520 共回答了21个问题 |采纳率95.2%解题思路:(1)碳酸钙可以和硫酸反应,使得溶液的pH升高;
(2)镁离子可以和氢氧根离子反应生成氢氧化镁,钙离子可以和碳酸根离子之间反应生成碳酸钙沉淀;
(3)硫酸锂可以和碳酸钠之间发生反应生成溶解度更小的碳酸锂.(1)反应Ⅱ中加碳酸钙,碳酸钙可以和硫酸反应,使得溶液的pH升高,控制pH,可以使Fe3+和Al3+完全沉淀,故答案为:除去反应Ⅰ中过量的硫酸,控制pH使Fe3+和Al3+完全沉淀;
(2)反应Ⅲ中,加入的氢氧化钙中的氢氧根离子可以和镁离子反应生成氢氧化镁,Mg2++2OH-=Mg(OH)2↓,碳酸钠中的碳酸根离子可以和钙离子之间反应生成碳酸钙沉淀,Ca2++CO32-=CaCO3↓,
故答案为:Mg2++2OH-=Mg(OH)2↓;Ca2++CO32-=CaCO3↓;
(3)硫酸锂可以和碳酸钠之间发生反应生成溶解度更小的碳酸锂,反应的原理方程式为:Li2SO4+Na2CO3=Li2CO3↓+Na2SO4,根据Li2CO3在不同温度的溶解度表,可以知道洗涤所得Li2CO3沉淀要用热水而非冷水,是因为:碳酸锂在较高的温度下溶解度小,用热水洗涤可以减少碳酸锂的损耗,
故答案为:碳酸锂在较高的温度下溶解度小,用热水洗涤可以减少碳酸锂的损耗.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题涉及化学实验基本操作以及物质的分离和提纯等方面的知识,注意知识的迁移和应用是解题的关键,难度不大.1年前查看全部
- 锂常用于航天工业,其中氢氧化锂与二氧化碳反应,生成碳酸锂和水而用于吸收航天员呼出的二氧化碳.写出该反应的文字表达式:
 gesang8881年前1
gesang8881年前1 -
 臭法师 共回答了21个问题
臭法师 共回答了21个问题 |采纳率95.2%氢氧化锂+二氧化碳=碳酸锂+水1年前查看全部
- 【化学——选修2:化学与技术】(15分)碳酸锂用途广泛,可用作陶瓷、药物、催化剂,也是常用的锂离子电池的原料。工业上以锂
【化学——选修2:化学与技术】(15分)碳酸锂用途广泛,可用作陶瓷、药物、催化剂,也是常用的锂离子电池的原料。工业上以锂辉石(Li 2 O·Al 2 O 3 ·4SiO 2 ,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
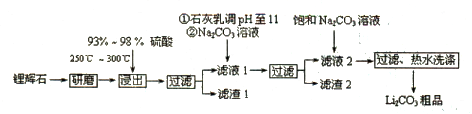
已知:①Li 2 O·Al 2 O 3 ·4SiO 2 +H 2 SO 4 (浓) Li 2 SO 4 +Al 2 O 3 ·H 2 O↓
Li 2 SO 4 +Al 2 O 3 ·H 2 O↓
②某些物质的溶解度(S)如下表所示。
(1)从滤渣1中分离出Al 2 O 3 的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。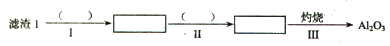
则步骤I中反应的离子方程式是 ,步骤Ⅱ应通入一种气体试剂为 ,步骤II反应完之后需要的操作是 。
(2)已知滤渣2的主要成分有Mg(OH) 2 和CaCO 3 。向滤液l中加入石灰乳的作用是(用离子方程式表示) 。
(3)向滤液2中加入饱和Na 2 CO 3 溶液,过滤后,用“热水洗涤”的原因是 。
(4)工业上,将Li 2 CO 3 粗产品制备成高纯Li 2 CO 3 的部分工艺如下:
a.将Li 2 CO 3 溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入过 量NH 4 HCO 3 溶液,过滤、烘干得高纯Li 2 CO 3 。
①a中,阳极的电极反应式是 。
②b中,生成Li 2 CO 3 反应的化学方程式是 。 我的那些草儿1年前1
我的那些草儿1年前1 -
 fisherfei1982 共回答了15个问题
fisherfei1982 共回答了15个问题 |采纳率80%(1)Al 2 O 3 +6H + = 2Al 3+ +3H 2 O(2分) NH 3 (2分) 过滤(2分)
(2)Ca(OH) 2 + 2H + = Ca 2+ + 2H 2 O(1.5分)Ca(OH) 2 (s) + Mg 2+ Mg(OH) 2 (s) +Ca 2+ (1.5分)
Mg(OH) 2 (s) +Ca 2+ (1.5分)
(3) Li 2 CO 3 的溶解度随温度升高而减小,热水洗涤可减少Li 2 CO 3 的损失(2分)
(4)① 2Cl - ―2e - =Cl 2 ↑(2分)② 2LiOH+2NH 4 HCO 3 =Li 2 CO 3 ↓+(NH 4 ) 2 CO 3 +2H 2 O(2分)
本题考查元素化合物的性质及化学与技术有关知识。(1)用酸将Al 2 O 3 溶液解,再通入氨气转化为Al(OH) 3 沉淀,过滤后灼烧得到Al 2 O 3 ,步骤I中反应的离子方程式是Al 2 O 3 +6H + = 2Al 3+ +3H 2 O,通入的气体物质是NH 3 ,步骤II反应完之后需要的操作是过滤。(2)向滤液l中加入石灰乳的作用是调节溶液的pH值并将Mg 2+ 转化为难溶的Mg(OH) 2 沉淀,反应的离子方程式为Ca(OH) 2 + 2H + = Ca 2+ + 2H 2 O,Ca(OH) 2 (s) + Mg 2+ Mg(OH) 2 (s) +Ca 2+ 。(3)从表中数据可知,Li 2 CO 3 的溶解度随温度升高而减小,故用热水洗涤能减少Li 2 CO 3 的损失,保证更高的产率。(4)①Li 2 CO 3 溶于盐酸,得到LiCl溶液,电解时,阳极Cl - 失电子被子氧化,电极反应式为2Cl - ―2e - =Cl 2 ↑,Li + 通过半透膜进入阴极区,得到LiOH溶液。②电解后得到LiOH溶液,加入NH 4 HCO 3 ,将LiOH转化为Li 2 CO 3 ,反应的化学方程式是2LiOH+2NH 4 HCO 3 =Li 2 CO 3 ↓+(NH 4 ) 2 CO 3 +2H 2 O。
1年前查看全部
Mg(OH) 2 (s) +Ca 2+ 。(3)从表中数据可知,Li 2 CO 3 的溶解度随温度升高而减小,故用热水洗涤能减少Li 2 CO 3 的损失,保证更高的产率。(4)①Li 2 CO 3 溶于盐酸,得到LiCl溶液,电解时,阳极Cl - 失电子被子氧化,电极反应式为2Cl - ―2e - =Cl 2 ↑,Li + 通过半透膜进入阴极区,得到LiOH溶液。②电解后得到LiOH溶液,加入NH 4 HCO 3 ,将LiOH转化为Li 2 CO 3 ,反应的化学方程式是2LiOH+2NH 4 HCO 3 =Li 2 CO 3 ↓+(NH 4 ) 2 CO 3 +2H 2 O。
1年前查看全部
- 碳酸锂的溶解度比碳酸氢锂的溶解度小,为什么?
 cvoe20081年前3
cvoe20081年前3 -
 蓝颜 共回答了20个问题
蓝颜 共回答了20个问题 |采纳率90%对啊.Li2CO3在水中溶解度较小,接近微溶.而LiHCO3易溶.
碳酸盐溶解度小于碳酸氢盐,这是一般规律.不能根据Na2CO3/NaHCO3等反常溶解性能推断锂盐的溶解性,因为锂与其他的碱金属在化学性质上差异很大.1年前查看全部
- 用最小公倍数配平怎么配平?就用氢氧化锂和二氧化碳反应生成碳酸锂和水 这个反应举例子吧
 blms1年前1
blms1年前1 -
 323232hhh 共回答了8个问题
323232hhh 共回答了8个问题 |采纳率87.5%看反应前后化学式中的元素种类谁多,谁最多就以谁的化学式前面的系数为一;
如有元素种类一样多的情况,就看化学式中谁的原子个数最多并以原子个数最多的化学式前面的系数为一,(如下面方反应中的 Li2CO3)定其化学式前计量数为1,然后根据关键化学式去配平其他化学式前的化学计量数.
若出现计量数为分数,再将各计量数同乘以同一整数(一般为分数分母),化分数为整数,这种先定关键化学式计量数为1的配平方法,称为归一法.
以此反应为例 LiOH + CO2 —— Li2CO3 + H2O
反应前后各化学式中元素的种类 3 2 3 2
反应前后各化学式中元素原子个数之和 3 3 6 3
显然关键是 Li2CO3的组成,因而定其计量数为1,这样可得原料中的LiOH 分子个数:2LiOH+CO2=Li2CO3+H2O1年前查看全部
- 碳酸锂广泛应用于陶瓷和医药等领域.已知β锂辉石(主要成分为Li2O•Al2O3•4SiO2)为原材料制备Li2CO3的
碳酸锂广泛应用于陶瓷和医药等领域.已知β锂辉石(主要成分为Li2O•Al2O3•4SiO2)为原材料制备Li2CO3的工艺流程如图:

已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4;步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li+、SO42-,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需在搅拌下加入______(填“石灰石”、“氯化钙”或“稀硫酸”)以调节溶液的pH到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液.
(1)步骤Ⅰ前,β锂辉石要粉碎成细颗粒的目的是______
(2)加入______(填“石灰石”、“氯化钙”或“稀硫酸”)以调节溶液的pH到6.0~6.5,
(3)步骤Ⅱ中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去的杂质金属离子有______.
(4)步骤Ⅲ中,生成沉淀的离子方程式为______.
(5)从母液中可回收的主要物Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g. sindy05951年前1
sindy05951年前1 -
 慧子lily 共回答了12个问题
慧子lily 共回答了12个问题 |采纳率100%解题思路:已知β-锂辉石(主要成分为Li2O•Al2O3•4SiO2)为原材料制备Li2CO3的工艺流程:Li2O•Al2O3•4SiO2加硫酸,浸取,酸浸后得到的酸性溶液中含有Li+、SO42-,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,在在搅拌下加入石灰石调节pH,使Al3+、Fe3+转化为氢氧化物沉淀,过滤,再将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,Fe2+被氧化为Fe3+,然后转化为氢氧化铁沉淀,镁离子转化为氢氧化镁沉淀,钙离子转化为碳酸钙沉淀,过滤的硫酸锂溶液,再加饱和碳酸钠溶液得到碳酸锂沉淀,过滤得到碳酸锂;
(1)从反应速率的角度来分析;
(2)抓住题目中的“酸性溶液”,“调节溶液的pH到6.0~6.5”,从所给试剂中选择符合条件的药品;
(3)H2O2是强氧化剂,可把Fe2+氧化成Fe3+,石灰乳和碳酸钠都是沉淀剂,使溶液中的Fe2+、Mg2+、Ca2+;
(4)步骤Ⅲ加入饱和Na2CO3溶液后,主要使Li+转化为Li2CO3沉淀.已知β-锂辉石(主要成分为Li2O•Al2O3•4SiO2)为原材料制备Li2CO3的工艺流程:Li2O•Al2O3•4SiO2加硫酸,浸取,酸浸后得到的酸性溶液中含有Li+、SO42-,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,在在搅拌下加入石灰石调节pH,使Al3+、Fe3+转化为氢氧化物沉淀,过滤,再将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,Fe2+被氧化为Fe3+,然后转化为氢氧化铁沉淀,镁离子转化为氢氧化镁沉淀,钙离子转化为碳酸钙沉淀,过滤的硫酸锂溶液,再加饱和碳酸钠溶液得到碳酸锂沉淀,过滤得到碳酸锂;
(1)固体颗粒越小,化学反应速率越快,同时可使锂元素尽可能多地溶解到酸中,
故答案为:增大固液接触面积,加快浸出反应速率,提高浸出率;
(2)所给三种物质中,只有CaCO3能够降低溶液的酸度,提高溶液的pH到6.0~6.5,可除去Fe3+、Al3+,
故答案为:石灰石;
(3)步骤Ⅱ中加入H2O2溶液,可将Fe2+氧化为Fe3+,然后加入石灰乳可除去其中的Fe3+和Mg2+,再加入Na2CO3溶液可除去Ca2+.此时溶液中的离子主要有Li+、Na+、SO42-,
故答案为:Fe2+、Mg2+、Ca2+;
(4)步骤Ⅲ加入饱和Na2CO3溶液后,主要使Li+转化为Li2CO3沉淀,反应的离子方程式为:2Li++CO32-=Li2CO3↓;
故答案为:2Li++CO32-=Li2CO3↓.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题以制备Li2CO3的工艺流程为知识背景,考查了影响速率的因素、除杂质、离子方程式等,题目难度中等,侧重于考查学生对题中信息的分析和利用能力.1年前查看全部
- 碳酸锂中锂的化合价是多少
 robertmao1年前1
robertmao1年前1 -
 驾着云彩来看你 共回答了19个问题
驾着云彩来看你 共回答了19个问题 |采纳率89.5%Li2CO3,锂的化合价为正一1年前查看全部
- 已知碳酸锂Ksp=8.64*10^-4,将浓度均为0.2mol/L的硫酸锂和碳酸钠溶液等体积混合,则溶液中残留的Li+浓
已知碳酸锂Ksp=8.64*10^-4,将浓度均为0.2mol/L的硫酸锂和碳酸钠溶液等体积混合,则溶液中残留的Li+浓度为
 榕易1年前1
榕易1年前1 -
 xiaodongplayer 共回答了11个问题
xiaodongplayer 共回答了11个问题 |采纳率90.9%Li2SO4+Na2CO3=Na2SO4+Li2CO3↓
可知在Li2CO3不电离的情况下,溶液中的Li+和CO32-是刚好完全反应的,因此溶液对於Li2CO3来说是饱和溶液
Li2CO3=2Li++CO32-,有[Li+]2*[CO32-]=8.64*10-4
而[CO32-]=1/2[Li+],因此就是1/2[Li+]3=8.64*10-4,[Li+]=自己带数字去算.1年前查看全部
- 现有100克碳酸锂和碳酸钡的混和物,它们和一定浓度的盐酸反应时所消耗盐酸跟100克碳酸钙和该浓度盐酸反应时消耗盐酸量相同
现有100克碳酸锂和碳酸钡的混和物,它们和一定浓度的盐酸反应时所消耗盐酸跟100克碳酸钙和该浓度盐酸反应时消耗盐酸量相同.计算混和物中碳酸锂和碳酸钡的物质的量之比.
 jlccw1年前1
jlccw1年前1 -
 limbo_c 共回答了11个问题
limbo_c 共回答了11个问题 |采纳率100%解题思路:假设碳酸锂、碳酸钡的物质的量分别为xmol、ymol,表示出消耗HCl的物质的量,根据二者质量及消耗盐HCl的物质的量列方程计算解答.100克碳酸锂和碳酸钡的混和物,它们和一定浓度的盐酸反应时所消耗盐酸跟100克碳酸钙和该浓度盐酸反应时消耗盐酸量相同,及混合物消耗HCl为[100g/100g/mol]×2=2mol,
假设碳酸锂、碳酸钡的物质的量分别为xmol、ymol,则:
2x+2y=2
74x+197y=100
整理得x:y=97:26
答:混和物中碳酸锂和碳酸钡的物质的量之比为97:26.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物计算,难度中等,可以计算混合物平均相对分子质量,再利用十字交叉法解答.1年前查看全部
- 碳酸锂怎么分离其中钴镍铜?氢氧化锂也同样?
 condraj1年前1
condraj1年前1 -
 江边鸟飞翔 共回答了15个问题
江边鸟飞翔 共回答了15个问题 |采纳率93.3%用硫酸溶解,长时间电解(惰性电极),在加碳酸钠沉淀出碳酸锂(微溶),过滤后再加熟石灰可得氢氧化锂.1年前查看全部
- 现有100克碳酸锂和碳酸钡的混和物,它们和一定浓度的盐酸反应时所消耗盐酸跟100克碳酸钙和该浓度盐酸反应时消耗盐酸量相同
现有100克碳酸锂和碳酸钡的混和物,它们和一定浓度的盐酸反应时所消耗盐酸跟100克碳酸钙和该浓度盐酸反应时消耗盐酸量相同.计算混和物中碳酸锂和碳酸钡的物质的量之比.
 gchxp1年前2
gchxp1年前2 -
 悠you 共回答了15个问题
悠you 共回答了15个问题 |采纳率93.3%解题思路:假设碳酸锂、碳酸钡的物质的量分别为xmol、ymol,表示出消耗HCl的物质的量,根据二者质量及消耗盐HCl的物质的量列方程计算解答.100克碳酸锂和碳酸钡的混和物,它们和一定浓度的盐酸反应时所消耗盐酸跟100克碳酸钙和该浓度盐酸反应时消耗盐酸量相同,及混合物消耗HCl为[100g/100g/mol]×2=2mol,
假设碳酸锂、碳酸钡的物质的量分别为xmol、ymol,则:
2x+2y=2
74x+197y=100
整理得x:y=97:26
答:混和物中碳酸锂和碳酸钡的物质的量之比为97:26.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物计算,难度中等,可以计算混合物平均相对分子质量,再利用十字交叉法解答.1年前查看全部
大家在问
- 1题干:不久前,你从一家商店买了一台收音机,用了10天后,收音机就出了毛病,写信给哪家商店经理,信件内容包括下列几个方面:
- 2下列句子中有语病的一项是 [ ] A.阅读优秀的文学作品,既能增长知识,
- 3以第三人称把《归园田居》或《使至塞上》改写白话文300字到500字
- 4改为被动语态1.Sometimes they playbasketball after school.2.We must
- 5【高中物理】一个负离子,质量为m,电量大小为q,以速率v垂直于屏S.
- 6求导数题 2*x^3*(y^2+yx)=(5*y^2+1)^(1/2)
- 7物理上v=at是什么时候用的今天做题遇到一个题他做平抛运动,受力分解后,向下用不了h=1/2gt^2因为h没给,后来看答
- 8横竖斜着都能念 3字组成,词没规定 随便填写,要求是从每个角度念着都连贯
- 9各位大侠帮我看看这段英文有木有语法错误
- 10线性代数,高数微积分.两个箭头分别怎么得到的.
- 1147.7除以18减去3.6与5.4的和的差,商是多少?
- 12这篇《凿壁偷光》短文写了匡衡少年时读书的两件事,一件事______________,一件事______________,
- 13play加ing成了playing是什么意思!
- 14How to be pleasurable?the best way is to fake a smile to eve
- 15根据短文内容回答问题,将答案写在答题卡相应题号后的横线上。
