(1)A元素的负二价离子和B元素的正一价离子的电子层结构都与氖相同,A的离子的电子排布式为______;由A、B两元素形
 58fd56safs2022-10-04 11:39:541条回答
58fd56safs2022-10-04 11:39:541条回答(2)D、E、F元素的价电子排布式依次为2s22p2、2s22p3、2s22p4,则三元素的第一电离能由小到大的顺序为______(填元素符号),其原因是______
(3)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,C的元素基态原子的外围电子排布式为______
(4)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有(填元素符号,任写两种)______.

已提交,审核后显示!提交回复
共1条回复
 我是谁的yy 共回答了12个问题
我是谁的yy 共回答了12个问题 |采纳率91.7%- 解题思路:(1)A元素的负二价离子和B元素的正一价离子的电子层结构都与氖相同,则A为氧元素,B为钠元素,据此答题;(2)D、E、F元素的价电子排布式依次为2s22p2、2s22p3、2s22p4,则D为碳元素,E为氮元素,F为氧元素,根据元素周期律判断第一电离能大小;(3)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,则C的核外电子排布式为1s22s22p63s23p63d104s1,据此确定外围电子排布式;(4)根据原子核外电子排布特征和元素所在周期判断;
(1)A元素的负二价离子和B元素的正一价离子的电子层结构都与氖相同,则A为氧元素,B为钠元素,氧离子的电子排布式为1s22s22p6,A、B两元素形成的化合物化学式为Na2O,该化合物中含有离子键,形成离子晶体,故答案为:1s22s22p6;Na2O;离子键;离子;
(2)D、E、F元素的价电子排布式依次为2s22p2、2s22p3、2s22p4,则D为碳元素,E为氮元素,F为氧元素,根据元素周期律,在同周期中,从左向右,元素第一电离能逐渐增大,但由于第ⅤA族最外层电子是半充满状态,是一种稳定结构,所以第一电离能都高于相邻周期的元素,故C、N、O的第一电离能顺序为C<O<N,
故答案为:C<O<N;在同周期中,从左向右,元素第一电离能逐渐增大,但由于第ⅤA族最外层电子是半充满状态,是一种稳定结构,所以第一电离能都高于相邻周期的元素;
(3)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,则C的核外电子排布式为1s22s22p63s23p63d104s1,所以外围电子排布式为3d104s1,故答案为:3d104s1;
(4)根据元素周期表,在第一周期中氢元素未成对电子数是1,第二周期中未成对电子数是2的有碳元素和氧元素,第三周期中未成对电子数是3的有磷元素,故答案为:H、C、O、P;点评:
本题考点: 原子核外电子排布;元素电离能、电负性的含义及应用.
考点点评: 本题主要考查根据原子结构推断元素、进而考查第一电离能、外围电子排布、原子结构等知识,难度不大,注重基础知识的考查. - 1年前
相关推荐
- 有短周期主族元素A、B、C、D、E,A元素是原子半径最大的短周期主族元素,B元素原子的最外层电子数为m,
有短周期主族元素A、B、C、D、E,A元素是原子半径最大的短周期主族元素,B元素原子的最外层电子数为m,
次外层电子数为n,C元素原子的第二层电子数为(m+n),第三层电子数为(m-n),D元素与C元素同主族,E元素原子与B元素原子的核外电子数之比为2:1.
ABCDE各是什么元素? mchgo1年前2
mchgo1年前2 -
 恋上你的钱 共回答了22个问题
恋上你的钱 共回答了22个问题 |采纳率90.9%A:Na
B:O
C:Si
D:C
E:S1年前查看全部
- 已知A B C D E是短周期中的五种非金属元素,它们的原子序数依次增大.A元素原子形成的离子就是一个质子,C D在元素
已知A B C D E是短周期中的五种非金属元素,它们的原子序数依次增大.A元素原子形成的离子就是一个质子,C D在元素周期表中处于相邻的位置,B元素原子的最外层电子数是内层电子数的2倍.E元素与D元素同主族,E的单质为黄色晶体,易溶于二硫化碳.
A B C D E分别是哪些元素? xiaofan_sh1年前1
xiaofan_sh1年前1 -
 吖彬 共回答了19个问题
吖彬 共回答了19个问题 |采纳率84.2%E的单质为黄色晶体,易溶于二硫化碳.E是硫
D只能是氧了
A元素原子形成的离子就是一个质子,A是氢
C是氮,B是碳1年前查看全部
- 某化合物由A、B两种元素组成,其原子个数比为1:3.其中,A元素的质量分数为40%,B元素的相对原子质量为16,则A元素
某化合物由A、B两种元素组成,其原子个数比为1:3.其中,A元素的质量分数为40%,B元素的相对原子质量为16,则A元素的相对原子质量为( )
A. 32
B. 80
C. 40
D. 16 ss我ss去的爱1年前0
ss我ss去的爱1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 已知A元素原子的核电荷数大于B元素原子的核电荷数,但两种元素的原子具有相同数目的电子层,A元素最外层电子数为B元素的2倍
已知A元素原子的核电荷数大于B元素原子的核电荷数,但两种元素的原子具有相同数目的电子层,A元素最外层电子数为B元素的2倍,A元素原子M层电子数为K层电子数的3倍,C元素原子的核电荷数是电子层数的4倍,其质子数为最外层电子数的6倍.
1)A的原子结构示意图 元素名称
2)B的原子结构示意图 元素名称
3)C的离子结构示意图 元素名称 63848651年前1
63848651年前1 -
 原身 共回答了17个问题
原身 共回答了17个问题 |采纳率100%a是氧,b是硼,c是氖1年前查看全部
- A元素所处的周期数,主族序数,原子序数均相等,A元素是什么
 风中畅游1年前1
风中畅游1年前1 -
 ysjwvf 共回答了21个问题
ysjwvf 共回答了21个问题 |采纳率76.2%H1年前查看全部
- 能说明A元素的非金属性比B元素的非金属性强的是?有个选项是:A单质能与B的氢化物水溶液反应吗,生成单质
能说明A元素的非金属性比B元素的非金属性强的是?有个选项是:A单质能与B的氢化物水溶液反应吗,生成单质
答案上此选项错误,请问为什么? r354819671年前2
r354819671年前2 -
 紫暮幽兰 共回答了24个问题
紫暮幽兰 共回答了24个问题 |采纳率95.8%A单质能与B的氢化物水溶液反应,生成单质B,则说明A元素的非金属性比B元素的非金属性强.1年前查看全部
- ABCD是短周期元素 A元素的最高价氧化物的水化物与它的气态氢化物反应的到E
ABCD是短周期元素 A元素的最高价氧化物的水化物与它的气态氢化物反应的到E
1摩尔E含有42摩尔的电子,B原子的最外层电子数是次外层的3倍.CD两原子的最外层电子数分别是内层电子数的一半.c是植物的生长营养元素!求AB元素形成的酸酐的化学式是什么?D元素的单质与水反应的化学方程式是什么?AC元素气态氢化物的稳定性大小?E的水溶液显酸性的离子方程式?急 zhangxw_nb1年前1
zhangxw_nb1年前1 -
 脚丫里的泥 共回答了22个问题
脚丫里的泥 共回答了22个问题 |采纳率72.7%A是S,B是O,C是Si,D是Na
AB元素形成的酸酐的化学式有SO2,SO3
D元素的单质与水反应的化学方程式是2Na+2H2O=2NaOH+H2↑
AC元素气态氢化物的稳定性 H2S>SiH4即A元素气态氢化物的稳定性大于 C元素气态氢化物的稳定性
E的水溶液显酸性的离子方程式:H2SO3=(可逆符号)H+ + HSO3-1年前查看全部
- 已知A元素常见的原子里不含中子;B元素的单质在空气中燃烧产生淡蓝色火焰,其产物在空气中较多时会导
已知A元素常见的原子里不含中子;B元素的单质在空气中燃烧产生淡蓝色火焰,其产物在空气中较多时会导
已知A元素常见的原子里不含中子;B元素的单质在空气中燃烧产生淡蓝色火焰,其产物在空气中较多时会导致酸雨现象;C是氧化物中必含的元素;D是一种金属元素,含D元素的某种盐既为人的生理活动所必需,也是厨房里一种重要的调味品。
(1)由上述某几种元素组成的一种常见的酸叫_____________________________(写名称);一种常见的碱是_________________________________(写化学式)。
(2)上述酸、碱在溶液中反应的化学方程式为_________________________________________________,利用此原理,人们常在酸性土壤中加入_____________________________中和其酸性,以利于作物生长。 小狐狸阿漆1年前5
小狐狸阿漆1年前5 -
 woxinkeai 共回答了16个问题
woxinkeai 共回答了16个问题 |采纳率87.5%A氢,B硫,C氧,D钠
硫酸 NaOH
H2SO4+2NaOH==Na2SO4+2H2O
碱性物质,1年前查看全部
- ABCD四种元素都是短周期元素,A元素的离子有黄色的火焰.B元素的离子结构与NE具有相同的电子层排布.5.8B的氢氧化物
ABCD四种元素都是短周期元素,A元素的离子有黄色的火焰.B元素的离子结构与NE具有相同的电子层排布.5.8B的氢氧化物恰好能与100ML 2 MOLL 盐酸完全反应,B原子核中质子数与中子数相等,H2在C的单质中燃烧产生苍白色的火焰.D元素原子的电子层结构中,最外层电子数是次外层电子数的3倍.ABCD分别是?C在第几周期第几族?它的最高价氧化物的化学式是?AD在燃烧条件下生成化合物是?其中阴离子和阳离子个数比为?在C单质的实验室制法中发生反应的离子方程式?
 twffcu21年前1
twffcu21年前1 -
 小蜜蜂的lovestor 共回答了18个问题
小蜜蜂的lovestor 共回答了18个问题 |采纳率94.4%A :Na B:Mg C:Cl D:O C在第三周期,ⅦA族元素 ;HClO4;Na2O2;1:2;2 MnO4- + 16 H+ + 10 Cl- ==2 Mn2+ + 5 Cl2 ↑+ 8H2O1年前查看全部
- 有A,B,C,D,E五种短周期元素,A,E同周期,A元素的阳离子所带电荷数等于其所在周期数减1,(接下)
有A,B,C,D,E五种短周期元素,A,E同周期,A元素的阳离子所带电荷数等于其所在周期数减1,(接下)
常温常压下,B、C、D、E的单质都为双原子分子,它们之间有如下关系:(1)2A+C2=2AC(2)3A+D2=A3D2(3)A+E2=AE2(4)3B2+D2=2DB3(5)2B2+C2=2B2C
问:A、B、C、D、E五种元素分别是什么 wanglituo0071年前2
wanglituo0071年前2 -
 Hyled 共回答了11个问题
Hyled 共回答了11个问题 |采纳率81.8%我认为A是镁,B是氢,C是O,D是N,E是氯1年前查看全部
- 元素A和元素B的原子的原子序数都小于18.已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层
元素A和元素B的原子的原子序数都小于18.已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层
电子数为(a-b),L层电子数为(a+b),则A B两元素所形成的化合物的性质可能有 A 能与水反应 B 能与硫酸反应 C 能与氢氧化钠反应 D 能与碳酸钠反应 南方文坛001年前4
南方文坛001年前4 -
 yaya200002 共回答了20个问题
yaya200002 共回答了20个问题 |采纳率65%=2.a=6
所以元素A为O(氧气)B为Si1年前查看全部
- A原子(含1个质子和两个中子),A元素为氢,氢原子不是不含中子的吗?
 尚方宝剑5101年前1
尚方宝剑5101年前1 -
 yunxin9032 共回答了17个问题
yunxin9032 共回答了17个问题 |采纳率94.1%H元素共有3种核素:原子核分别是1质子 1中子+1质子 1质子+2中子,后两种是H的同位素.
判断什么元素看的是质子数,质子数是固定的标志.1年前查看全部
- 金属性强弱发生氧化还原反应时,A元素原子失电子比B元素少,能说明A比B金属性强吗? 举个例子...若A元素原子失电子比B
金属性强弱
发生氧化还原反应时,A元素原子失电子比B元素少,能说明A比B金属性强吗? 举个例子...
若A元素原子失电子比B元素多,则能说明吗? 蓝铯枫叶1年前4
蓝铯枫叶1年前4 -
 橙味的 共回答了17个问题
橙味的 共回答了17个问题 |采纳率94.1%不能,A为镁,B为铝.
不能,A为铝,B为锌.1年前查看全部
- 低碳生活的“碳”是什么?A元素B原子C分子D单质
低碳生活的“碳”是什么?A元素B原子C分子D单质
选什么?说出原因
到底是什么 玉雪冰凌1年前9
玉雪冰凌1年前9 -
 一身遥 共回答了19个问题
一身遥 共回答了19个问题 |采纳率100%A
咳咳..
原子是化学变化中的最小粒子(否决 NO)
分子是保持物质性质的最小粒子(同样否决 NONO)
单质是由一种元素组成的纯净物(再次否决 NONONO)
所以 选 A 元素1年前查看全部
- ABCD是短周期元素,A元素的最高价氧化物的水化物与它的气态氢化物反应得到离子化合物,
ABCD是短周期元素,A元素的最高价氧化物的水化物与它的气态氢化物反应得到离子化合物,
1mol该化合物含有42mol电子,B原子的最外层电子排布式为nsn,np2n,C、D两原子的最外层电子数分别是内层电子数的一半.C元素是植物生长的元素之一.
(1)A、B元素形成的酸酐的化学式是
(2)D元素的单质与水反应的化学方程式为
(3)A、C元素气态氢化物的稳定性大小:< (用分子式表示)
(4)A、B、C、D四种元素中电负性最大的是 (用元素符号表示,下同),第一电离能最小的是 板刀面1年前1
板刀面1年前1 -
 kimutaku 共回答了20个问题
kimutaku 共回答了20个问题 |采纳率95%A N
B O
C P
D Li
(1)N2O5 N2O3
(2)2Li+2H2O--->2LiOH+H2
(3)PH31年前查看全部
- AB使位于同一主族的两种短周期元素 由A元素组成的一种单质是重要的半导体材料 A的氧化物甲可用于制造高性能的现代通讯材料
AB使位于同一主族的两种短周期元素 由A元素组成的一种单质是重要的半导体材料 A的氧化物甲可用于制造高性能的现代通讯材料
A是什么 B是什么 甲是什么
下列物质的主要成分不是甲的是 A 水晶 B石英 C黏土 D玛瑙
甲鱼一种酸能发生反应 该反应化学方程式
将甲于纯碱混合 高温熔融时能发生反应生成乙 同时还生成B元素的最高价氧化物
写出化学方程式
B元素的最高价氧化物与足量乙的水溶液发生反应的化学方程式 我是过去时1年前1
我是过去时1年前1 -
 dpssl 共回答了23个问题
dpssl 共回答了23个问题 |采纳率91.3%A Si;B C; 甲:SiO2;
粘土的主要成分是硅酸钠 Na2SiO3
Si+4HF=SiF4+2H2
SiO2+Na2CO3(熔融)=CO2+Na2SiO3
CO2+Na2SiO3+H2O=Na2CO3+H2SiO31年前查看全部
- 两道科学填空题 急用啊1.A元素原子的核电荷数为1,B元素是地壳中含量最多的元素,则A和B两种元素所组成的化合物的化学式
两道科学填空题 急用啊
1.A元素原子的核电荷数为1,B元素是地壳中含量最多的元素,则A和B两种元素所组成的化合物的化学式为( ).
2.一个C-12原子的质量为m千克,某元素一个原子的质量为n千克,则该元素的相对原子质量为( ) andy_guo_cn1年前2
andy_guo_cn1年前2 -
 油炸更健康 共回答了15个问题
油炸更健康 共回答了15个问题 |采纳率100%1.H2O 2.(12n)/m1年前查看全部
- 有A、B、C三种元素,A元素是地壳中含量最多的金属元素,B是空气中含量占第二位的元素,C元素的原子失去二个电子后和氖原子
有A、B、C三种元素,A元素是地壳中含量最多的金属元素,B是空气中含量占第二位的元素,C元素的原子失去二个电子后和氖原子电子层结构相同,则A元素的名称是______,B元素组成的单质的化学式为______,C的离子符号是______.
 ximenpengpeng1年前1
ximenpengpeng1年前1 -
 xixi_62 共回答了17个问题
xixi_62 共回答了17个问题 |采纳率88.2%解题思路:由题干中的条件可知,地壳中含量最多的金属元素是铝,空气中含量占第二位的元素是氧,元素的原子失去两个电子后和氖原子电子层结构相同钠,再依据要求填写即可.依据所学的化学知识可知,地壳中含量最多的金属元素是铝,空气中含量占第二位的元素是氧,元素的原子失去两个电子后和氖原子电子层结构相同钠,则该原子的核外电子数是12,原子中质子数等于核外电子数,故该元素的核电荷数是12,则该元素是镁元素;则A是铝元素,B形成的单质是氧气(O2),C的离子符号是Mg2+;故答案为:铝元素;O2;Mg2+;
点评:
本题考点: 物质的鉴别、推断;化学式的书写及意义.
考点点评: 了解一些常规的化学常识记住一些关于物质的特性;掌握核外电子在化学变化中的作用和得失电子的规律特点是解题的关键.1年前查看全部
- 短周期三种主族元素ABC原子序数依次减小A元素2p能级上有3个未成对电子,B元素原子最外层上的电子数是其电子层数的2倍,
短周期三种主族元素ABC原子序数依次减小A元素2p能级上有3个未成对电子,B元素原子最外层上的电子数是其电子层数的2倍,A、B、C三原子的核外电子层数之和是5(1)三种元素的元素符号(2)A与C形成的化合物分子式,写出该化合物与A的最高价氧化物对应水化物发生的化学方程式
 lknudt1年前1
lknudt1年前1 -
 夏蛰 共回答了19个问题
夏蛰 共回答了19个问题 |采纳率100%NCH,NH3+HNO3=NH4NO31年前查看全部
- 已知A元素是-3价,B元素是+2价,则由A,B两种元素组成的化合物的化学式是什么
 tonysu0071年前5
tonysu0071年前5 -
 Yunamylove 共回答了23个问题
Yunamylove 共回答了23个问题 |采纳率87%B3A2
原则:正负化合价代数和为零.
正价在前,负价在后.1年前查看全部
- 有M 1 、M 2 、M 3 三种含A元素的化合物,已知下列数据(其中A%表示A元素在化合物中的质量分数),则A元素的相
有M 1 、M 2 、M 3 三种含A元素的化合物,已知下列数据(其中A%表示A元素在化合物中的质量分数),则A元素的相对原子质量为( )
化合物 M 1 M 2 M 3 相对分子质量 16 60 180 A% 75% 40% 40% A.36 B.72 C.24 D.12  lee7511年前1
lee7511年前1 -
 虫洞的蚂蚁 共回答了27个问题
虫洞的蚂蚁 共回答了27个问题 |采纳率88.9%设M 1 、M 2 、M 3 的分子中分别含有x、y、z个A原子,A的相对原子质量为a,则
xa
16 ×100%=75%
ya
60 ×100%=40%
za
180 ×100%=40%,所以x:y:z=1:2:6
假设M 1 中有一个A原子,则M 1 中A元素的质量分数为:
a
16 ×100%=75%,a=12;然后M 1 、M 2 、M 3 的分子中A原子的个数比是1:2:6,M 1 中含有一个A原子,则M 2 中含有2个,M 3 中含有6个,故M 3 中A元素的质量分数为
12×6
180 ×100%=40%,
M 2 中A元素的质量分数为
12×2
60 ×100%=40%,都符合要求,
所以A的相对原子质量为12,M 3 中含有一个A原子假设成立,
故答案选D.1年前查看全部
- 0.5摩A元素的原子在反应中失去1摩电子生成简单阳离子,0.4克A单质与足量盐酸反应放出0.02克氢气,A是嘛元
0.5摩A元素的原子在反应中失去1摩电子生成简单阳离子,0.4克A单质与足量盐酸反应放出0.02克氢气,A是嘛元
..答案为钙元素. dali19801年前3
dali19801年前3 -
 vincentqy 共回答了20个问题
vincentqy 共回答了20个问题 |采纳率95%0.5molA失去1mol电子=>1molA失去2mol电子①
生成1gH2(0.5mol)得到1mol电子=>0.02g氢气得到0.02mol电子②
①、②=>0.4gA为0.01mol=>1molA质量为40g=>A为钙元素
一楼答案的扩展版1年前查看全部
- A,B,C,D为短周期元素,原子序数依次增大,A元素构成的单质分子在常见双原子单质分子中含共价键最多.B的最
A,B,C,D为短周期元素,原子序数依次增大,A元素构成的单质分子在常见双原子单质分子中含共价键最多.B的最
外层是此外层电子数的3倍.B,C可组成化合物C2B2,C2B;C,D可组成离子化合物CD.
写出A,B,C,D所代表的元素. uityre1年前3
uityre1年前3 -
 hyflovelynn 共回答了23个问题
hyflovelynn 共回答了23个问题 |采纳率87%A:氮元素N
氮气分子N2中存在氮氮三键
B:氧元素O
最外层第二层电子数6,是次外层第一层电子数2个的三倍
C:钠元素Na
C2B2:Na2O2
C2B:Na2O
D:氯元素Cl
不是氟元素F,因为F比Na原子序数小,不满足ABCD原子序数递增的条件
CD:NaCl1年前查看全部
- 为什么A元素的原子最外层有两个电子,B元素的原子最外层有7个电子.下见详细提问
为什么A元素的原子最外层有两个电子,B元素的原子最外层有7个电子.下见详细提问
为什么A元素的原子最外层有两个电子,B元素的原子最外层有7个电子,则A,B两种元素构成的化合物的化学式可能是AB2(这里的2在B的右下方)? w6099568361年前1
w6099568361年前1 -
 denzixin 共回答了20个问题
denzixin 共回答了20个问题 |采纳率90%A元素的原子最外层有两个电子,说明A原子容易失去两个电子而达到最外层电子稳定结构,B原子最外层7个电子,说明B原子容易得到1个电子从而达到最外层电子稳定结构,所以两者化合后生成化合物化学式可能为AB2,即1个A失去两个电子,这两个电子分给两个B原子.1年前查看全部
- 物质A是由A元素组成的单质,将其在酒精灯火焰上灼烧,火焰 为黄色,B、C、D是含有A元素的三种 不同化合物,A、B、C、
物质A是由A元素组成的单质,将其在酒精灯火焰上灼烧,火焰 为黄色,B、C、D是含有A元素的三种 不同化合物,A、B、C、D按下图所示关系进行转化: 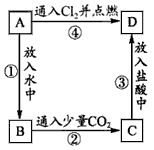
(1)写出下列物质的化学式: A____;B____;C___;D____。
(2)写出①②③的离子方程式及④的化学方程式: ①____, ②___, ③____, ④____。 FiendLee1年前1
FiendLee1年前1 -
 i_rkbf22us45d6 共回答了20个问题
i_rkbf22us45d6 共回答了20个问题 |采纳率95%1年前查看全部
- 含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料——光导纤维,C与烧碱反应
含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料——光导纤维,C与烧碱反应生成含A元素的化合物D。
(1)在元素周期表中,A位于 族,与A同族但相对原子质量比A小的元素B的原子结构示意图为 ,A与B在原子的电子层结构上的相同点是 。
(2)易与C发生化学反应的酸是 ,反应的化学方程式是 。
(3)将C与纯碱混合高温熔融时也发生化学反应生成D,同时还生成B的最高价氧化物E;将全部的E与全部的D在足量的水中混合后,又发生化学反应生成含A的化合物F。
①写出生成D和F的化学反应方程式: 。
②要将纯碱高温熔化,下列坩埚中可选用的是 。
A.普通玻璃坩埚B.石英玻璃坩埚
C.氧化铝坩锅D.铁坩锅
(4)100 g C与石灰石的混合物充分反应后,生成的气体在标准状况下的体积为11.2 L,100 g混合物中石灰石的质量分数是 。 紫菜汤汤1年前1
紫菜汤汤1年前1 -
 织造局 共回答了17个问题
织造局 共回答了17个问题 |采纳率82.4%(1)ⅣA 最外层均有4个电子,最内层均有2个电子
最外层均有4个电子,最内层均有2个电子
(2)氢氟酸 SiO 2 +4HF=SiF 4 ↑+2H 2 O
(3)①SiO 2 +Na 2 CO 3 Na 2 SiO 3 +CO 2 ↑,
Na 2 SiO 3 +CO 2 ↑,
Na 2 SiO 3 +CO 2 +H 2 O=Na 2 CO 3 +H 2 SiO 3 ↓
②D (4)50%
(1)A元素单质可作半导体材料,含A元素的某化合物是制造光导纤维的原料,可知A为硅元素,C为SiO 2 ,D为Na 2 SiO 3 。比硅相对原子质量小的同族元素B为碳。
(2)C为SiO 2 ,能与SiO 2 反应的酸只有氢氟酸。
(3)SiO 2 与Na 2 CO 3 高温下反应生成Na 2 SiO 3 和CO 2 ,含SiO 2 的材料(普通玻璃、石英玻璃)以及Al 2 O 3 等都能与Na 2 CO 3 在高温下反应,故不能用以上材质的坩埚熔融Na 2 CO 3 。
(4)若SiO 2 恰好完全反应或过量,与CaCO 3 反应的化学方程式只有一个,即CaCO 3 +SiO 2 CaSiO 3 +CO 2 ↑。若CaCO 3 过量,除发生上述反应外,还会发生反应:
CaSiO 3 +CO 2 ↑。若CaCO 3 过量,除发生上述反应外,还会发生反应:
CaCO 3 CaO+CO 2 ↑。总之,CaCO 3 的多少决定了CO 2 的产量,可通过以下关系列式求
CaO+CO 2 ↑。总之,CaCO 3 的多少决定了CO 2 的产量,可通过以下关系列式求
CaCO 3 ~ CO 2
100 g 22.4 L
m(CaCO 3 ) 11.2 L
m(CaCO 3 )=50 g
混合物中CaCO 3 的质量分数: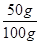 ×100%=50%。
1年前查看全部
×100%=50%。
1年前查看全部
- Ⅰ有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物
 Ⅰ有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的[3/4]倍.A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物.回答下列问题:
Ⅰ有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的[3/4]倍.A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物.回答下列问题:
(1)写出相应元素符合,A______B______C______E______
(2)由A、C、D、E四种元素所组成的一种中学常见的化合物,它既能与盐酸反应,又能与NaOH溶液反应,在这种化合物的水溶液中,滴入紫色石蕊试液出现红色,则溶液中离子浓度由大到小的排列顺序为:______.
(3)将铝片和镁片.插入由A、C、D三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为______.
Ⅱ(5分)已知X是一种盐,H是常见金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有右图所示的关系.
试回答下列问题
(1)G的化学式为:______.
(2)写出下列反应的化学方程式
①______②______. MuMBO1年前1
MuMBO1年前1 -
 叫偶候湘婷 共回答了10个问题
叫偶候湘婷 共回答了10个问题 |采纳率90%解题思路:Ⅰ、A元素的原子是半径最小的原子,应为H元素,B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,则B为N元素,对应的盐为NH4NO3,E元素的最外层电子数是次外层电子数的 [3/4]倍,应为S元素,D与A同族,且与E同周期,应为Na元素,A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物,则C应为O元素;
Ⅱ、由H是一种常见的金属单质,它在B中燃烧后生成一种非金属单质,我们可以推 知这种常见金属单质为金属镁,它在CO2气体中燃烧生成C这种非金属单质.则A为 氧化镁;由X是一种盐,它受热分解可以产生MgO,因此X 可能为碳酸盐,但碳酸镁分解的产物只有氧化镁和二氧化碳,框图中的分解产物有三种,再由题示信息B(CO2)与D反应 可产生非金属单质F,且生成的E物质是工业上重要的碱,则可推断F是O2,D是Na2O2,E是Na2CO3,相应地推断出C是H2O,G是NaOH,那么X是一种碱式碳酸镁.Ⅰ、A元素的原子是半径最小的原子,应为H元素,B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,则B为N元素,对应的盐为NH4NO3,E元素的最外层电子数是次外层电子数的 [3/4]倍,应为S元素,D与A同族,且与E同周期,应为Na元素,A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物,则C应为O元素;
(1)由以上分析可知,A为H,B为N,C为O,E为S,故答案为:H,N,O,S;
(2)由A、C、D、E四种元素所组成的一种中学常见的化合物,它既能与盐酸反应,又能与NaOH溶液反应,
则该盐为NaHSO3,滴入紫色石蕊试液出现红色,说明HSO3-电离程度大于水解程度,则有c(H+)>c(OH-),
溶液中还存在水的电离,则c(H+)>c(SO32-),而HSO3-电离程度较小,则c(HSO3-)>c(H+),
所以有c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),
故答案为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
(3)将铝片和镁片.插入由A、C、D三种元素组成物质为NaOH的稀溶液中构成原电池,铝做负极失电子发生氧化反应,镁做正极,溶液中氢离子得到电子生成氢气,则负极的电极反应式为:2Al-6e-+8OH-=2AlO2-+4H2O;故答案为:2Al-6e-+8OH-=2AlO2-+4H2O;
Ⅱ、由H是一种常见的金属单质,它在B中燃烧后生成一种非金属单质,我们可以推 知这种常见金属单质为金属镁,它在
CO2气体中燃烧生成C这种非金属单质.则A为 氧化镁;由X是一种盐,它受热分解可以产生MgO,因此X 可能为碳酸盐,但碳酸镁分解的产物只有氧化镁和二氧化碳,框图中的分解产物有三种,再由题示信息B(CO2)与D反应 可产生非金属单质F,且生成的E物质是工业上重要的碱,则可推断F是O2,D是Na2O2,E是Na2CO3,相应地推断出C是H2O,G是NaOH,那么X是一种碱式碳酸镁.
(1)由以上分析可知,G的化学式分别为NaOH,故答案为:NaOH;
(2)CO2与Na2O2反应生成2Na2CO3和O2,CO2与Mg反应生成MgO和C,
反应的方程式分别为2Na2O2+2CO2=2Na2CO3+O2和2Mg+CO2
点燃
.
2MgO+C,
故答案为:2Na2O2+2CO2=2Na2CO3+O2; 2Mg+CO2
点燃
.
2MgO+C.点评:
本题考点: 无机物的推断.
考点点评: 本题考查物质的推断,题目难度较大,涉及多个角度的考查,注意把握元素和物质推断的角度.1年前查看全部
- 有A、B、C、D四种元素,已知A元素的原子核外只有1个电子,B是地壳中含量最高的元素,C2-离子核外有18个电子,D是血
有A、B、C、D四种元素,已知A元素的原子核外只有1个电子,B是地壳中含量最高的元素,C2-离子核外有18个电子,D是血红蛋白的组成元素之一,人体缺乏该元素会引起贫血.写出A、B、D三种元素的名称或符号:A______、B______、D______;C2-离子的符号为______;B、C、D三种元素组成化合物的化学式为______.
 susie_520v1年前1
susie_520v1年前1 -
 内农业牧 共回答了20个问题
内农业牧 共回答了20个问题 |采纳率80%解题思路:A元素的原子核外只有一个电子,则A元素为氢元素,B是地壳中含量最高的元素可以知道B为氧元素,而C2-离子核外有18个电子,可以知道C中的电子数为16,而质子数等于电子数等于原子序数,即为第十六号元素,为硫元素,D是血红蛋白的组成元素之一,人体缺乏该元素会引起贫血,可以知道D为铁元素,至此各元素鉴定完毕,可以据此答题.A元素的原子核外只有一个电子,则A元素为氢元素,B是地壳中含量最高的元素可以知道B为氧元素,而C2-离子核外有18个电子,可以知道C中的电子数为16,而原子序数=质子数=电子数,所以C元素为第十六号元素,为硫元素,D是血红蛋白的组成元素之一,人体缺乏该元素会引起贫血,可以知道D为铁元素,所以C2-离子的符号为 S2-;BCD组成的化合物为FeSO4或Fe2(SO4)3.
故答案为:氢(H);氧(O);铁(Fe); S2-; FeSO4或Fe2(SO4)3.点评:
本题考点: 物质的鉴别、推断;元素的符号及其意义;化学式的书写及意义.
考点点评: 元素推断题是化学考查的最基本题型之一,元素的分布、含量、化学性质、题目中所叙述的元素结构特征,是解该类问题的题眼和突破口.1年前查看全部
- 已知A元素的最低化合价为一3价,它的最高价氧化物含氧56.21%,该原子核内的中子数
已知A元素的最低化合价为一3价,它的最高价氧化物含氧56.21%,该原子核内的中子数
比质子数多1,求A是什么元素 M_ren1年前4
M_ren1年前4 -
 8023xx 共回答了20个问题
8023xx 共回答了20个问题 |采纳率95%最低-3,最高+5,所以最高价氧化物分子式为X2O5,设原子量为x
5*16/(2x+5*16)=56.21%
解得x=31
由此可以判断A为P元素1年前查看全部
- 化学:今有A、B、C、D四种元素,其中A元素是1826年法国青年科学家发现的.他在
 36计_假痴不癫1年前3
36计_假痴不癫1年前3 -
 睡在暖房里的猫 共回答了17个问题
睡在暖房里的猫 共回答了17个问题 |采纳率88.2%他在研究海水制盐时,往剩余的副产物苦卤中通入氯气后发现溶液颜色变深,若进一步提取,可得一种红棕色液体,有刺鼻的气味.B、C、D的原子核外电子层均不超过3个.D原子核内的质子数正好等于C原子核内质子数的2倍,而它们最外电子层上的电子数恰好相等.D原子的最内电子层上电子数是B原子核外电子总数的2倍.
则(1)四种元素分别为:A_____,B______,C______,D______.
(2)由上述某元素的单质与另两种元素的化合物反应生成两种酸的化学方程是 .
[分析] 本题主要考查根据原子结构特征推断元素,答题时注意运用分析讨论,并能正确表达化学用语.A的判断应由苦卤与氯气反应得到红棕色液体得出,知其为溴;由“D原子的最内电子层上电子数则是B原子核外电子总数的2倍”,可知B为氢.根据“C、D的原子电子层排布均不超过3个电子层,D原子核内的质子数正好等于C原子核内质子数的2倍,而它们最外电子层上的电子数恰好相等”,可假设D原子的最外电子层的电子数为x,则有下列关系2+8+x=2(2+x),x=6.所以C为氧、D为硫.
[答案] (1)Br H O S (2)Br2+H2O =HBr+HBrO1年前查看全部
- A元素原子m电子层上有六个电子是什么意思?
 uu流浪狗1年前1
uu流浪狗1年前1 -
 逍遥派125 共回答了17个问题
逍遥派125 共回答了17个问题 |采纳率94.1%就是第三层上有6个电子,还有K层2个电子,L层8个电子,一共有16个电子,它是硫.1年前查看全部
- A、B、C、D四种元素,A元素的单质是最清洁的燃料,B元素的单质是空气里最多的气体,C元素是地壳中最多的元素,D 2+
A、B、C、D四种元素,A元素的单质是最清洁的燃料,B元素的单质是空气里最多的气体,C元素是地壳中最多的元素,D 2+ 离子核外有10个电子.回答下列问题:
(1)写出四种元素的名称或符号:A______、B______、C______、D______;
(2)A、B、C三种元素组成的一种碱的化学式为______;
(3)D的单质在C的单质中燃烧的化学方程式为______. haining1111年前1
haining1111年前1 -
 shyshy 共回答了10个问题
shyshy 共回答了10个问题 |采纳率100%(1)根据题意:A元素的单质是最清洁的燃料,可推断A元素为:氢或H;
B元素的单质是空气里最多的气体,可推断B元素为:氮或N;
C元素是地壳中最多的元素为氧,可推断C元素为:氧或O;
D 2+ 离子核外有10个电子,则D元素的质子数为:2+8+2=12,可推知D元素为:或镁Mg;
故答案为:氢或H;氮或N;氧或O;镁或Mg;
(2)根据碱指电离时产生的阴离子全部都是氢氧根离子的化合物;可推断由H,N,O 3种元素组成的碱为:NH 3 ?H 2 O;
故答案为:NH 3 ?H 2 O;
(3)根据书写化学方程式的步骤:写配注等,镁在氧气中燃烧的化学方程式为:2Mg+O 2
点燃
.
2MgO;
故答案为:2Mg+O 2
点燃
.
2MgO.1年前查看全部
- 已知A元素的最低化合价为一3价,它的最高价氧化物含氧56.21%,该原子核内的中子数
 兵乓球1年前6
兵乓球1年前6 -
 主人 共回答了17个问题
主人 共回答了17个问题 |采纳率88.2%最低-3,最高+5,所以最高价氧化物分子式为X2O5,设原子量为x
5*16/(2x+5*16)=56.21%
解得x=31
由此可以判断A为P元素1年前查看全部
- 60.希望有人帮忙)a元素的阴离子,b元素的阴离子,c元素的阳离子
60.希望有人帮忙)a元素的阴离子,b元素的阴离子,c元素的阳离子
a元素的阴离子,b元素的阴离子,c元素的阳离子具有相同的电子层结构,已知a的原子序数大于b的原子序数,则a、b、c三种离子半径大小的顺序是 ()
A.a>b>c
B.b>a>c
C.c>a>b
D.c>b>a
希望有人帮忙,解析.越详细越好. dawei1191年前2
dawei1191年前2 -
 零_ 共回答了14个问题
零_ 共回答了14个问题 |采纳率78.6%由于在有相同电子层结构时 阴离子的半径比阳离子的半径大 所以排除CD
因为a的序数比b大 所以b得的电子多半径就大 所以选B1年前查看全部
- 一道化学题(答好了追分)现有ABCD四种元素:A元素形成的-2价阴离子比氦原子的核外的电子数多8个B元素与A元素形成的一
一道化学题(答好了追分)
现有ABCD四种元素:
A元素形成的-2价阴离子比氦原子的核外的电子数多8个
B元素与A元素形成的一种化合物为淡黄色固体,该固体遇到CO2能生成A的单质;
C为原子核内有12个中子的金属元素,当2.4gC与足量热水反应时,在标准状况下放出气体2.24L.C形成正2价阳离子
D元素原子的M层上有7个电子
1.请写出元素符号A( )C( )
2.指出D在元素周期表的位置:
3.B元素形成的淡黄色固体化合物的电子式为( ),它与CO2反应的化学方程式为( )
4.D的气态氢化物、H2S、HF的热稳定性由上到弱顺序是什么?(用化学式表达)
5.用电子式表示C与D形成化合物的过程
答完了追50分. **fun1年前2
**fun1年前2 -
 永远不断线的风筝 共回答了9个问题
永远不断线的风筝 共回答了9个问题 |采纳率100%1、A(O)、C(Mg) 2、第三周期第7主族 3、Na+[O O]2-Na+(不知道怎么大点),2Na2O2+2CO2==2NaCO3+O2(上箭头) 4、HF>HCl>H2S 5、Cl +Mg2+ +Cl 右箭头 [Cl]-Mg2+[Cl]- (点不知道怎么打出)1年前查看全部
- 求速解已知ABCDE是短周期得五个非金属元素,它们得原子预数依次增大,A元素原子形成得离子核外电子数为零,BCD在元素周
求速解
已知ABCDE是短周期得五个非金属元素,它们得原子预数依次增大,A元素原子形成得离子核外电子数为零,BCD在元素周期表中处于相邻得位置.D元素与E元素同主族.E得单质为黄色固体,易容于二氧化碳.求1、BD得元素符号2、C单质电子式3元素E在周期表中的位置4、由ACD中两种元素组成,且与A2D分子具有相同电子数得两种离子是什么
L层得电子数是K层电子数3倍得元素 sabrina06121年前4
sabrina06121年前4 -
 伊人楼远uu近 共回答了19个问题
伊人楼远uu近 共回答了19个问题 |采纳率94.7%H元素失去一个电子变成H+,核外电子数为零,A是H
E得单质为黄色固体,易容于二硫化碳,E是S
D元素与E元素同主族,D是O
BCD在元素周期表中处于相邻得位置,它们的原子序数依次增大,B是C,C是N
1.B:C,D:O;
·
2:N:;(上面一个一点,两侧分别两点)
3.第三周期,第VIA族
4.A2D即H2O,有10电子,两种离子是NH4+,OH-1年前查看全部
- 1.有A,B,C三种元素,A元素是空气中含量最多的元素,B元素是海水中含量最多的金属元素,C元素的单质可以在氧气中燃烧,
1.有A,B,C三种元素,A元素是空气中含量最多的元素,B元素是海水中含量最多的金属元素,C元素的单质可以在氧气中燃烧,产生蓝紫色火焰,生成有刺激性气味的气体D.试推断:
A的元素符号是_____B和C两种元素形成的化合物的化学式是_____,气体D的化学式是____. 竹韵悠悠1年前2
竹韵悠悠1年前2 -
 永远小zz 共回答了20个问题
永远小zz 共回答了20个问题 |采纳率75%1.有A,B,C三种元素,A元素是空气中含量最多的元素,B元素是海水中含量最多的金属元素,C元素的单质可以在氧气中燃烧,产生蓝紫色火焰,生成有刺激性气味的气体D.试推断:
A的元素符号是__N2___B和C两种元素形成的化合物的化学式是__MG3N2___,气体D的化学式是__SO2__1年前查看全部
- 1. 前4周期中的ABCDE五种主族元素,A元素在其氧化物AO3(3为下脚标哦)中的质量分数为40%,A原子中质
1. 前4周期中的ABCDE五种主族元素,A元素在其氧化物AO3(3为下脚标哦)中的质量分数为40%,A原子中质子数与中子数相等;B是同周期中除稀有气体外原子半径最大的元素;D能形成BD型离子化合物,且B和D的离子的电子层的结构相同;C和D能形成CD3的化合物;C原子比E原子多一个电子;0.9gC与足量的稀硫酸反应,所产生的氢气在标准状况下的体积为1.12L;C原子中质子数比中子数少1;D原子比A原子多1个质子.ABCDE分别是什么元素? 2. ABCDE均是常见的短周期元素,且原子序数依次增大,它们之间可以相互形成A2B,C2B2,CE,DB3(数字为下脚标)等多种化合物B离子与C离子具有相同的电子层结构,D ,E同一个周期.求ABCDE. 3. 现有aA,bB,cC,dD,eE五种短周期元素它们都是生命体不可缺少的重要元素.已知它们的原子序数有如下关系:a+b=c,a+c=d,c+d=e.B,D,E都有多种同素异形体.人类已知的化合物中,有一类化合物的种类已超过三千万种,这类化合物中一般都含有A,B两种元素.求ABCDE 4. 五种短周期元素A B C D E,其原子序数依次增大,A ,E同主族 ,A元素原子半径最小;B元素原子的最外层电子数是内层电子数的两倍;C元素最高价氧化物的水化物X能与其氢化物Y反应生成盐.A,B,C,E四种元素都能与D元素形成原子个数比不相同的常见化合物,求这五种元素.
 漫步云端欧阳雪儿1年前1
漫步云端欧阳雪儿1年前1 -
 恩曦sisi 共回答了19个问题
恩曦sisi 共回答了19个问题 |采纳率84.2%1、
A的最高价氧化物AO3中含A百分之四十设它的分子量为A,A/(A+48)=0.4所以A分子量为32,A原子中质子数等于中子数,所以A是硫
B是第四周期中除稀有气体外原子半径最大的元素,所以B是钾,B,D能形成BD型离子化合物,且B,D两离子的电子层结构相同,所以D是卤族元素,所以D是氯
C为金属元素,与D位于同一周期,且与D能形成CD3型的化合物所以C是铝
E元素的原子比C元素的原子少1个质子,所以E是镁
五种元素分别为S K Al Cl Mg
2、可以组成A2B,C2B2,CE,DB3等化合,并且ABCDE原子序数依次增大
A可能是H,B是O,C可能是Na,D是S,E是Cl
再进行验证.完全符合条件.
ABCDE依次是H,O,Na,S,Cl
3、人类已知的化合物中,有一类化合物的种类已超过三千万种,这类化合物中一般都含有A,B两种元素是有机物,所以应该是C,H,
如果A是H,B是C,
原子序数a+b=c,则C是N,
原子序数a+c=d则D是O
原子序数c+d=e则E是P.
成立.
如果A是C,B是H
原子序数a+b=c则C是N,
原子序数a+c=d则D是Al,
原子序数c+d=e则E是Ca.
因为BDE均有多种同素异形体,故不成立.
综合以上.ABCDE分别是:H,C,N,O,P
4、A元素的原子半径最小.则A为氢元素.
B元素原子的最外层电子数是内层电子数的2倍.则B为碳元素
C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y.则C为氮元素,X为HNO3,Y为
NH4Cl
A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,则E为钠元素.
A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.则D为氧元素
所以ABCDE分别是:H,C,N,O,Na1年前查看全部
- A、B、C、D 都是短周期的元素.A元素的原子核外有2个电子层,最外层已达到饱和.B元素位于A元素的下一周期
A、B、C、D 都是短周期的元素.A元素的原子核外有2个电子层,最外层已达到饱和.B元素位于A元素的下一周期
最外层的电子数是A元素最外层电子数的1/2.C元素的离子带有两个单位正电荷,它的核外电子排布与A原子相同.D元素与C元素属同一周期,D元素原子的最外层电子数比A的最外层电子少1.根据上述事实判断:A B C D 分别是什么
A、B、C、D 都是短周期的元素。A元素的原子核外有2个电子层,最外层已达到饱和。B元素位于A元素的下一周期最外层的电子数是A元素最外层电子数的1/2。C元素的离子带有两个单位正电荷,它的核外电子排布与A原子相同。D元素与C元素属同一周期,D元素原子的最外层电子数比A的最外层电子少1。根据上述事实判断:A B C D 分别是什么 天马行1年前3
天马行1年前3 -
 寻找童话 共回答了19个问题
寻找童话 共回答了19个问题 |采纳率94.7%A:Ne
B:Si
C:Mg
D:F1年前查看全部
- 短周期元素A的原子,其最外层与最内层的电子数之和等于次外层电子数,A的元素符号是( ),A元素与地壳中含量最多的元素B形
短周期元素A的原子,其最外层与最内层的电子数之和等于次外层电子数,A的元素符号是( ),A元素与地壳中含量最多的元素B形成化合物的化学式是( )( ),等质量的这两种化合物的物质的量之比是( ),含B元素的物质的量之比是( ).
 活力瓶111年前5
活力瓶111年前5 -
 欧阳晓彤 共回答了26个问题
欧阳晓彤 共回答了26个问题 |采纳率88.5%A的元素符号是(s ),A元素与地壳中含量最多的元素B形成化合物的化学式是( so2)(so3 ),等质量的这两种化合物的物质的量之比是( 5:4),含B元素的物质的量之比是(5:6 ).1年前查看全部
- 已知A元素原子最外层有6个电子,B元素原子最外层有2个电子,则A、B两种元素构成的化合物的化学式为( )
已知A元素原子最外层有6个电子,B元素原子最外层有2个电子,则A、B两种元素构成的化合物的化学式为( )
A. AB
B. AB2
C. BA3
D. BA snowpatrol001年前3
snowpatrol001年前3 -
 军海 共回答了22个问题
军海 共回答了22个问题 |采纳率95.5%解题思路:最外层电子数多于4个的原子,容易在化学反应中得到电子而形成8电子的相对稳定结构,而最外层电子数少于4个的原子,容易在化学反应中失去电子而形成8电子的相对稳定结构.A元素原子最外层有6个电子,在化学反应中容易得到2个电子,常显-2价;B元素原子最外层有2个电子,在化学反应中容易失去2个电子显+2价;因为化合物对外不显电性,则A、B两种元素构成的化合物的化学式为BA.
故选D.点评:
本题考点: 有关化学式的计算和推断;核外电子在化学反应中的作用;化合价规律和原则.
考点点评: 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.1年前查看全部
- A、B、C三种元素,A元素的单质是最清洁的燃料;B元素的单质能在C元素的单质中剧烈燃烧,火星四射,生成黑色固体;B元素的
A、B、C三种元素,A元素的单质是最清洁的燃料;B元素的单质能在C元素的单质中剧烈燃烧,火星四射,生成黑色固体;B元素的单质是目前世界上年产量最高的金属.
(1)写出下列元素的名称或符号:A______;
(2)写出B、C二种元素组成的一种化合物的名称:______;
(3)写出B元素的单质在C元素的单质中剧烈燃烧的化学方程式3Fe+2O2
Fe3O4点燃 .3Fe+2O2.
Fe3O4点燃 . 渡边一1年前1
渡边一1年前1 -
 y_tina 共回答了18个问题
y_tina 共回答了18个问题 |采纳率94.4%解题思路:本题属于推断题,根据题目给出的信息:A元素的单质是最清洁的燃料,因此A元素的单质是氢气,A元素是氢元素;B元素的单质能在C元素的单质中剧烈燃烧,火星四射,生成黑色固体;铁在氧气中燃烧生成四氧化三铁,铁元素的单质是目前世界上年产量最高的金属,B是铁元素,C是氧元素;B、C二种元素组成的化合物是氧化铁或四氧化三铁.(1)A元素的单质是最清洁的燃料,因此A元素的单质是氢气,A元素是氢元素,故答案为:氢元素或H;
(2)铁在氧气中燃烧生成四氧化三铁,铁元素的单质是目前世界上年产量最高的金属,B是铁元素,C是氧元素,B、C二种元素组成的化合物是氧化铁或四氧化三铁等;故答案为:氧化铁或四氧化三铁等;
(3)铁在氧气中燃烧生成四氧化三铁,配平即可,故答案为:3Fe+2O2
点燃
.
Fe3O4点评:
本题考点: 物质的鉴别、推断;元素的符号及其意义;书写化学方程式、文字表达式、电离方程式.
考点点评: 本考点属于物质的推断题,是通过对实验方法和过程的探究,在比较鉴别的基础上,得出了正确的实验结论.此考点主要出现在填空题和实验题中.1年前查看全部
- A、B、C、D四种元素,A元素的单质是最清洁的燃料,B元素的单质是空气里最多的气体,C元素是地壳中最多的元素,D2+离子
A、B、C、D四种元素,A元素的单质是最清洁的燃料,B元素的单质是空气里最多的气体,C元素是地壳中最多的元素,D2+离子核外有10个电子.回答下列问题:
(1)写出四种元素的名称或符号:A______、B______、C______、D______;
(2)A、B、C三种元素组成的一种碱的化学式为______;
(3)D的单质在C的单质中燃烧的化学方程式为2Mg+O2
2MgO点燃 .2Mg+O2.
2MgO点燃 . 熊猫貔貅1年前1
熊猫貔貅1年前1 -
 zhanglaomi 共回答了17个问题
zhanglaomi 共回答了17个问题 |采纳率94.1%(1)根据题意:A元素的单质是最清洁的燃料,可推断A元素为:氢或H;
B元素的单质是空气里最多的气体,可推断B元素为:氮或N;
C元素是地壳中最多的元素为氧,可推断C元素为:氧或O;
D2+离子核外有10个电子,则D元素的质子数为:2+8+2=12,可推知D元素为:或镁Mg;
故答案为:氢或H;氮或N;氧或O;镁或Mg;
(2)根据碱指电离时产生的阴离子全部都是氢氧根离子的化合物;可推断由H,N,O 3种元素组成的碱为:NH3•H2O;
故答案为:NH3•H2O;
(3)根据书写化学方程式的步骤:写配注等,镁在氧气中燃烧的化学方程式为:2Mg+O2
点燃
.
2MgO;
故答案为:2Mg+O2
点燃
.
2MgO.1年前查看全部
- 与元素有关的化学题A B C D 四种元素,A元素所处的周期数,主族序数.原子序数均相等,B的原子半径是其所在主族中最小
与元素有关的化学题
A B C D 四种元素,A元素所处的周期数,主族序数.原子序数均相等,B的原子半径是其所在主族中最小的,B的最高价氧化物的水化物的化学式是HB03,C 元素原子的最外层电子数比此外层少2个,D的阳离子与C的阴离子具有相同的电子层排布,两元素可形成化合物D2C (1)B元素的名称是?(2)A B 形成的化合物的化学式为?B元素在元素周期表中的位置是?(3) C 元素的符号是?C 的最高价氧化物的化学式是? Google测试员52431年前2
Google测试员52431年前2 -
 青山流云 共回答了23个问题
青山流云 共回答了23个问题 |采纳率95.7%(1)氮 (2)NH3 第二周期第ⅥA族 (3)S H2SO4 补充:上面写错了 (3) S SO31年前查看全部
- 有核电荷数小于18的A、B、C、D四种元素,A元素的原子构成一种单质,可以和黏土混合制成铅笔芯;B单质的体积在空气中占2
有核电荷数小于18的A、B、C、D四种元素,A元素的原子构成一种单质,可以和黏土混合制成铅笔芯;B单质的体积在空气中占21%;C原子有3个电子层,最外层与最内层电子数相同;B原子比D原子少一个电子层,它们可以形成DB2和DB3两种化合物.
(1)写出这四种元素的名称:A ______,B ______,C ______,D ______.
(2)写出A、B形成化合物的化学式 ______.
(3)D单质在B单质中燃烧时的化学方程式 ______,其生成物对环境的破坏是形成 ______.
(4)A、C、D分别与B形成的化合物可以统称为 ______.
(5)B、C和D三种元素形成的化合物的化学式是 ______. 粉色的初恋1年前2
粉色的初恋1年前2 -
 hikaru 共回答了15个问题
hikaru 共回答了15个问题 |采纳率93.3%解题思路:解题时往往需要从题目中挖出一些明显或隐含的条件,抓住突破口(突破口往往是现象特征、反应特征及结构特征),导出结论,最后别忘了把结论代入原题中验证,若“路”走得通则已经成功.
(1)抓住突破口:①“A元素的原子构成一种单质,可以和黏土混合制成铅笔芯”,可以推测出A元素;②“B单质的体积在空气中占21%”,可以推测出B元素;③“C原子有3个电子层,最外层与最内层电子数相同”,又因为核电荷数小于18,可推测出C元素;④“B原子比D原子少一个电子层,它们可以形成DB2和DB3两种化合物”,则可推测D元素;
(2)先推测出A、B为什么元素,再看会形成什么物质;
(3)推测出B、D的元素,再书写其燃烧的化学方程式;根据生成物的性质回答;
(4)先推测出A、C、D、B元素,再看A、C、D分别与B形成的化合物的共同点,找出规律;
(5)先推测出B、C和D三种元素,再书写B、C和D三种元素形成的化合物的化学式.(1)有题意“有核电荷数小于18的A、B、C、D四种元素,A元素的原子构成一种单质,可以和黏土混合制成铅笔芯;B单质的体积在空气中占21%;C原子有3个电子层,最外层与最内层电子数相同;B原子比D原子少一个电子层,它们可以形成DB2和DB3两种化合物.”,可推测:A为碳元素,B为氧元素,C为镁元素,D为硫元素;
(2)因为A为碳元素,B为氧元素,所以会形成一氧化碳、二氧化碳,它们的化学式分别为CO、CO2;
(3)因为B为氧元素、D为硫元素,所以燃烧的化学方程式为S+O2
点燃
.
SO2,其生成物对环境的破坏是形成 酸雨;
(4)因为A为碳元素、C为镁元素、D为硫元素与B为氧元素,反应分别生成二氧化碳、氧化镁、二氧化硫,故都为氧化物;
(5)因为B为氧元素、C为镁元素与D为硫元素三种元素形成的化合物为硫酸镁,其化学式为MgSO4
故答为:(1)A为碳元素,B为氧元素,C为镁元素,D为硫元素;
(2)CO、CO2;
(3)S+O2
点燃
.
SO2,酸雨;
(4)氧化物;
(5)MgSO4点评:
本题考点: 化学式的书写及意义;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号意义的了解,又考查了学生对化学符号的书写;并且要掌握书写化学方程式的方法和技巧.1年前查看全部
- 由A元素组成的一种单质是重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料,C与烧碱反应生成含A元素
由A元素组成的一种单质是重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料,C与烧碱反应生成含A元素的化合物D.
(1)列举化合物D的两种用途:______.
(2)下列物质的主要成分为C的有______(填字母).
a.沙子b.水玻璃c.黏土d.玛瑙
(3)将C与纯碱混合,高温熔融时也能发生反应生成D,同时还生成B元素的最高价氧化物E;将E通入足量D的水溶液中,又发生反应生成含A元素的化合物F.
①C与纯碱混合高温熔融时发生反应的化学方程式为SiO2+Na2CO3
Na2SiO3+CO2↑高温 .SiO2+Na2CO3.
Na2SiO3+CO2↑高温 .
②E与足量D的水溶液反应的离子方程式为______. 秘密tt20061年前1
秘密tt20061年前1 -
 wf1ove 共回答了24个问题
wf1ove 共回答了24个问题 |采纳率91.7%解题思路:含A元素的一种单质是一种重要的半导体材料,则A为Si,含A元素的一种化合物C可用于制造高性能的现代通讯材料--光导纤维,则C为SiO2,C与烧碱反应生成含A元素的化合物D为Na2SiO3.
(1)C为SiO2,D为Na2SiO3,根据Na2SiO3的性质进行解答;
(2)C为SiO2,沙子、玛瑙的主要成分为SiO2,水玻璃、黏土主要成分为硅酸盐;
(3)将SiO2与纯碱混合,高温熔融时生成DNa2SiO3,同时还生成E为CO2;将E物质CO2通入足量DNa2SiO3的水溶液中,碳酸比硅酸强,二氧化碳和硅酸钠反应生成硅酸和碳酸氢钠;生成含A元素的化合物H2SiO3,
①C为SiO2,与纯碱混合高温熔融时生成硅酸钠和二氧化碳;
②E为CO2,通入足量DNa2SiO3的水溶液中,生成硅酸沉淀;含A元素的一种单质是一种重要的半导体材料,则A为Si,含A元素的一种化合物C可用于制造高性能的现代通讯材料:光导纤维,则C为SiO2,C与烧碱反应生成含A元素的化合物D为Na2SiO3,
(1)C为SiO2,与烧碱反应SiO2+2NaOH=Na2SiO3+H2O,生成含A元素的化合物D,D为Na2SiO3,
Na2SiO3(硅酸钠)俗称水玻璃具有广泛的用途,是建筑水泥快干等工业的粘合剂,也是一种溶雪剂的成分之一,也可制备硅胶、木材防火剂,
故答案为:制备硅胶、木材防火剂;
(2)a.沙子主要成分为二氧化硅;b.水玻璃是硅酸钠的水溶液;c.黏土主要成分为硅酸盐;d.玛瑙主要成分为二氧化硅,C为SiO2,所以a、d符合,
故答案为:a、d;
(3)将SiO2与纯碱混合,高温熔融时SiO2+Na2CO3
高温
.
Na2SiO3+CO2↑,生成DNa2SiO3,同时还生成E为CO2;将E物质CO2通入足量DNa2SiO3的水溶液中,碳酸比硅酸强,二氧化碳和硅酸钠反应生成硅酸和碳酸氢钠;反应为:2CO2+Na2SiO3+2H2O═2NaHCO3+H2SiO3↓,生成含A元素的化合物H2SiO3,
①C为SiO2,与纯碱混合高温:SiO2+Na2CO3
高温
.
Na2SiO3+CO2↑,
故答案为:SiO2+Na2CO3
高温
.
Na2SiO3+CO2↑;
②E为CO2,通入足量DNa2SiO3的水溶液中2CO2+Na2SiO3+2H2O═2NaHCO3+H2SiO3↓,离子反应为:2CO2+SiO32-+2H2O═2HCO3-+H2SiO3↓,
故答案为:2CO2+SiO32-+2H2O═2HCO3-+H2SiO3↓;点评:
本题考点: 硅和二氧化硅.
考点点评: 本题考查无机物的推断,题目难度中等,本题中侧重于物质的应用为考查点,注意把握Si的单质及化合物的性质和用途,为高频考点.1年前查看全部
- (5分) A、B、C、D四种元素,A元素的单质是最清洁的燃料,B元素的单质是空气中最多的气体,C是地壳中含量最多的元素,
(5分) A、B、C、D四种元素,A元素的单质是最清洁的燃料,B元素的单质是空气中最多的气体,C是地壳中含量最多的元素,C元素和D元素组成的化合物能使澄清石灰水变浑浊。则元素A为 、元素B的单质为 、元素C为 、元素D为 、C和地壳中含量居的金属元素形成的化合物的化学式是 。(填符号)
 喜欢听故事的人1年前1
喜欢听故事的人1年前1 -
 爱的小虫虫 共回答了18个问题
爱的小虫虫 共回答了18个问题 |采纳率100%H 、 N 2 、O、C、Al 2 O 3 .
由于氢气燃烧后产物是水,不污染环境,燃烧放出的热量多所以最清洁的燃料是氢气,A是氢元素;空气中各成分及体积分数为:氮气:78%、氧气:21%、稀有气体:0.94%、二氧化碳0.03%、水蒸气和杂质:0.03%.所以空气里最多的气体单质是氮气,元素B的单质为 N 2 ;地壳中含量最多的前五种元素有:氧、硅、铝、铁、钙,所以地壳中最多的元素是氧元素,所以C元素是氧元素;使澄清的石灰水变浑浊的气体是二氧化碳,因为C是氧元素,所以D是碳元素;氧元素和地壳中含量最多的金属元素铝形成的化合物的化学式是 Al 2 O 3 .1年前查看全部
- 有A、B、C、D四种元素,由A元素组成的一种单质是自然界里最硬的物质,B元素是人体中含量最多的元素,C元素的原子在化学反
有A、B、C、D四种元素,由A元素组成的一种单质是自然界里最硬的物质,B元素是人体中含量最多的元素,C元素的原子在化学反应中失去一个电子后与氖原子有相同的电子层结构,D元素的原子中无中子.试回答:
(1)A元素形成的这种单质的名称______;B元素的符号______;D离子的______.
(2)由A、B、C三种元素组成化合物的化学式有______. ly19829101年前1
ly19829101年前1 -
 人生美好001 共回答了26个问题
人生美好001 共回答了26个问题 |采纳率96.2%(1)自然界中最硬的单质是金刚石,所以A是碳元素;人体中含量最多的元素是氧,所以B为氧元素,元素符号为O;氖原子的核外电子排布是2、8,电子数为10,则C离子的电子数也是10,它是原子失去一个电子后形成的,所以其原子的核外电子数和质子数都是11,即C为钠元素;D元素的原子中无中子,所以D为氢元素,其离子符号为H + .
(2)A、B、C分别为碳、氧、钠三种元素,三种元素可以组成盐-碳酸钠,则化学式为Na 2 CO 3 .
故答案为:(1)金刚石;O;H + ;(2)Na 2 CO 3 .1年前查看全部
- 我想要知道 A元素比B元素的非金属性弱的时候,AHx BHx(或者是A的化合物与B的化合物?不太会表达)的稳定性,失电子
我想要知道 A元素比B元素的非金属性弱的时候,AHx BHx(或者是A的化合物与B的化合物?不太会表达)的稳定性,失电子能力,酸性,碱性这些的对比 要全部的 A比B非金属性强的时候又咋样 上课没听到课 做题的时候完全不会 只要能背下这些玩意就好办多了
 逍遥蓝麦田SKY1年前4
逍遥蓝麦田SKY1年前4 -
 llittlewolf 共回答了19个问题
llittlewolf 共回答了19个问题 |采纳率84.2%氢化物稳定性B大于A
失电子能力B小于A
氢化物酸性B大于A
氢氧化物碱性B小于A
A比B强时情况正好相反1年前查看全部
大家在问
- 1( They are on the teacher's desk填句子
- 20.09m3=( )dm3=( )cm3
- 3我考虑明天去不去野炊?的英文翻译
- 4I’m glad to have a new classmate.
- 5一个长方形的花池长4米,宽3米,如果在它的底部铺上边长为8平方分米的正方形瓷砖,需要多少块?
- 6仔细观察下面这幅漫画,请用简洁的文字向你的同学介绍这幅漫画。 (1)先为漫画拟定一个标题。(不超过10个字,不能以“无题
- 7英语翻译1.How many people take part in (参加) this survey?2.There
- 8应用题第45道:水果店运来苹果比生梨多850千克,当苹果卖掉一半后就比生梨少75千克.求苹果和生
- 9大家看看这个MATLAB程序哪里错了
- 10有没有可以离开水活的鱼?是不是所有的鱼都离不开水呢?有点不相信.我始终坚信一定有可以离开水活的鱼.
- 11Edison i____the lamp and many other things .解释并说明理由
- 12照样子写3个词语 衣食住行(并列)
- 13很简单就是一个利滚利的公式,比如我从时间A开始存款,月利息是B,每个月除本息之外我还往里面增加钱数额C,N年以后我有多少
- 14英语,会的回答第二节 补全对话(共5小题,根据对话内容,从对话的选项中选出能填入空白处的最佳选项.有两项为多余选项.A:
- 1520分之3公顷怎么化平方米

