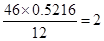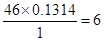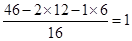未知物A的实验式和分子式都是C 2 H 6 O。A的红外光谱图如图(a),未知物A的核磁共振氢谱有三个峰如图(b),峰面
 Wendy22022-10-04 11:39:541条回答
Wendy22022-10-04 11:39:541条回答| 未知物A的实验式和分子式都是C 2 H 6 O。A的红外光谱图如图(a),未知物A的核磁共振氢谱有三个峰如图(b),峰面积之比是1∶2∶3,未知物A的结构简式为____________。  |

已提交,审核后显示!提交回复
共1条回复
 qxlwlxp 共回答了13个问题
qxlwlxp 共回答了13个问题 |采纳率100%- CH 3 —CH 2 —OH
据题意知:有三种峰,说明氢原子有三种情况,峰面积之比是1∶2∶3,说明这三种氢的个数之比为1∶2∶3。 - 1年前
相关推荐
- 将一定量的乙醇和氧气置于一个完全封闭的容器中引燃,反应生成二氧化碳、水蒸气和一种未知物X.测得反应前后物质的质量如下表:
将一定量的乙醇和氧气置于一个完全封闭的容器中引燃,反应生成二氧化碳、水蒸气和一种未知物X.测得反应前后物质的质量如下表:下列判断不正确的是( )
物质 乙醇 氧气 二氧化碳 水 X 反应前质量g 4.6 8 0 0 0 反应后质量g 0 0 4.4 5.4 m
A. 表中m的值为2.8
B. X可能是该反应的催化剂
C. 增加氧气的量可以减少X的生成
D. 物质X可能含有碳元素 hey-hey1年前1
hey-hey1年前1 -
 uu_xx88 共回答了15个问题
uu_xx88 共回答了15个问题 |采纳率93.3%解题思路:化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和;
化学反应前后,元素的种类不变,原子的种类、总个数不变.4.6g乙醇中碳元素的质量为:4.6g×[24/46]×100%=2.4g,氢元素的质量为:4.6g×[6/46]×100%=0.6g,氧元素的质量为:4.6g×[16/46]×100%=1.6g,
4.4g二氧化碳中碳元素的质量为:4.4g×[12/44]×100%=1.2g,氧元素的质量为:4.4g-1.2g=3.2g;
5.4g水中氢元素的质量为:5.4g×[2/18]×100%=0.6g,氧元素的质量为:5.4g-0.6g=4.8g,
则X中碳元素的质量为:2.4g-1.2g=1.2g,
氢元素的质量为:0.6g-0.6g=0,
氧元素的质量为:1.6g+8g-3.2g-4.8g=1.6g,
设X中碳原子和氧原子的个数比是x:y,则有12x:16y=1.2g:1.6g,x:y=1:1,因此X是一氧化碳.
A、m=4.6+8-4.4-5.4=2.8,该选项判断正确;
B、反应前X的质量是0,反应后质量是2.8g,因此x是生成物,不是催化剂,该选项判断不正确;
C、乙醇完全燃烧生成二氧化碳和水,不完全燃烧时生成二氧化碳、水和一氧化碳,因此增加氧气的量可以减少一氧化碳的生成,该选项判断正确;
D、物质X一定含有碳元素,该选项判断不正确.
故选:BD.点评:
本题考点: 质量守恒定律及其应用;催化剂的特点与催化作用.
考点点评: 化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础.1年前查看全部
- 关于巴斯德肉汤实验该实验中排除的最重要的无关因素是:A.空气B.空气中的未知物C.培养基和一定温度D.瓶子的形状请说明理
关于巴斯德肉汤实验
该实验中排除的最重要的无关因素是:
A.空气
B.空气中的未知物
C.培养基和一定温度
D.瓶子的形状
请说明理由 rose-白1年前1
rose-白1年前1 -
 yiyisc 共回答了18个问题
yiyisc 共回答了18个问题 |采纳率88.9%A
有疑问留言探讨1年前查看全部
- 将一定量的乙醇和氧气置于一个完全封闭的容器中引燃,反应生成二氧化碳、水蒸气和一种未知物X.测得反应前后物质的质量如下表:
将一定量的乙醇和氧气置于一个完全封闭的容器中引燃,反应生成二氧化碳、水蒸气和一种未知物X.测得反应前后物质的质量如下表:下列判断不正确的是( )
物质 乙醇 氧气 二氧化碳 水 X 反应前质量g 4.6 8 0 0 0 反应后质量g 0 0 4.4 5.4 m
A. 表中m的值为2.8
B. X可能是该反应的催化剂
C. 增加氧气的量可以减少X的生成
D. 物质X可能含有碳元素 白翎玄羽1年前1
白翎玄羽1年前1 -
 桔子香水 共回答了22个问题
桔子香水 共回答了22个问题 |采纳率90.9%解题思路:化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和;
化学反应前后,元素的种类不变,原子的种类、总个数不变.4.6g乙醇中碳元素的质量为:4.6g×[24/46]×100%=2.4g,氢元素的质量为:4.6g×[6/46]×100%=0.6g,氧元素的质量为:4.6g×[16/46]×100%=1.6g,
4.4g二氧化碳中碳元素的质量为:4.4g×[12/44]×100%=1.2g,氧元素的质量为:4.4g-1.2g=3.2g;
5.4g水中氢元素的质量为:5.4g×[2/18]×100%=0.6g,氧元素的质量为:5.4g-0.6g=4.8g,
则X中碳元素的质量为:2.4g-1.2g=1.2g,
氢元素的质量为:0.6g-0.6g=0,
氧元素的质量为:1.6g+8g-3.2g-4.8g=1.6g,
设X中碳原子和氧原子的个数比是x:y,则有12x:16y=1.2g:1.6g,x:y=1:1,因此X是一氧化碳.
A、m=4.6+8-4.4-5.4=2.8,该选项判断正确;
B、反应前X的质量是0,反应后质量是2.8g,因此x是生成物,不是催化剂,该选项判断不正确;
C、乙醇完全燃烧生成二氧化碳和水,不完全燃烧时生成二氧化碳、水和一氧化碳,因此增加氧气的量可以减少一氧化碳的生成,该选项判断正确;
D、物质X一定含有碳元素,该选项判断不正确.
故选:BD.点评:
本题考点: 质量守恒定律及其应用;催化剂的特点与催化作用.
考点点评: 化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础.1年前查看全部
- 将一定量的苯(C6H6)和氧气置于一个完全封闭的容器中引燃,反应生成二氧化碳、水和一种未知物X.测得反应前后物质的质量如
将一定量的苯(C6H6)和氧气置于一个完全封闭的容器中引燃,反应生成二氧化碳、水和一种未知物X.测得反应前后物质的质量如下:
物质 苯 氧气 二氧化碳 水 X反应前质量/g 3.9 9.6 0 0 0
反应后质量/g 0 0 6.6 2.7 m
下列判断正确的是()
A、表中m的值为13.5
B、该反应属于分解反应
C、物质X能在氧气中燃烧
D、物质X中一定含有氢元素 苦闷的大龄女11年前1
苦闷的大龄女11年前1 -
 HOHO杰 共回答了19个问题
HOHO杰 共回答了19个问题 |采纳率89.5%A:这种题有个方法,表上层的质量之和=下层质量之和,∴A中13.5不对
B:由反应物的个数与生成物的个数及种类可知,其不为分解反应(至于是啥反应,本初中生暂时没学,反正不符合分解的”一变多“)
C:由其反映的质量与其反应物生成物的相对原子质量可知X质量为4.2相对原子质量为63(X的相对原子质量=【X的质量/X的相对分子质量=水的质量/水的相对分子质量】列出反映的文字表达时即可,要表达式,根据以上所述算出来就行,不一定用水,除了X,用谁都行),由下题可知(即D选项,我先做的D)H完全与O反应生成H2O,由X的相对分子质量及质量与其他物质的质量及相对分子质量可以比出来所有物质的分子个数,方法与一开始的差不多,应该一样,本人实在累了,你自己比吧.逼出来的物质可以燃烧(是一个含碳化合物,本人草稿纸太乱,忘记这物质写哪里了)
D:由其化学方程式(dC6H6+eO2=aco2+bH2O+cX,abcde均为自然数且不为O)可知若完全生成水可生成2.7g,∴由方程式可知:【(6H+3O)的相对分子质量/苯的相对分子质量+(9O2)的相对分子质量】×总质量13.5g可得数2.7g=水的质量,即氢元素完全与氧元素反应生成H2O2.7g,∴D不对
累死我了,我写了半个小时,这一定不是初中的题
最后选c1年前查看全部
- 某含C、H、O三种元素的未知物A,经燃烧分析实验测定该未知物碳的质量分数为52.16%,氢的质量分数为13.14%,该未
某含C、H、O三种元素的未知物A,经燃烧分析实验测定该未知物碳的质量分数为52.16%,氢的质量分数为13.14%,该未知物A的实验式为______.若其摩尔质量为46g/mol,则它的分子式为______.若该未知物A的红外光谱图上发现有O-H键、C-H键和C-O键的振动吸收,该未知物A的结构简式可写为______.
 我向往美好明天1年前1
我向往美好明天1年前1 -
 copydjy 共回答了16个问题
copydjy 共回答了16个问题 |采纳率87.5%解题思路:碳的质量分数是52.16%,氢的质量分数是13.14%,则氧元素质量分数是:1-52.16%-13.14%=34.7%,则该物质中碳、氢、氧原子个数之比=[52.16%/12]:[13.14/1]:[34.7%/16]=4.34%:13,14%:2.17%=2:6:1,据此写出实验式;
根据摩尔质量可知A的相对分子量为46,据此计算出A的分子式;
根据“A的红外吸收光谱表明有C-O键O-H键和C-H键的红外吸收峰”写出A的结构简式.A中含有C、H、O三种元素,碳的质量分数是52.16%,氢的质量分数是13.14%,则氧元素质量分数是:1-52.16%-13.14%=34.7%,则该物质中碳、氢、氧原子个数之比=[52.16%/12]:[13.14/1]:[34.7%/16]=4.34%:13,14%:2.17%=2:6:1,该未知物A的实验式C2H6O;
A的摩尔质量为46g/mol,则A的相对分子质量为46,实验式C2H6O的式量为46,所以A的分子式为:C2H6O,
A的红外吸收光谱表明有C-O键O-H键和C-H键的红外吸收峰,说明A分子中含有羟基:-OH,则A的结构简式为:CH3CH2OH,
故答案为:C2H6O;C2H6O;CH3CH2OH.点评:
本题考点: 有机物实验式和分子式的确定.
考点点评: 本题考查了有机物实验式、分子式、结构简式的计算,题目难度中等,注意掌握有机物分子式、结构简式的确定方法,明确质量守恒在确定有机物分子式、结构简式的应用.1年前查看全部
- 某反应中反应物与生成物有:ASH3,H2SO4,KBRO3,K2SO4,H3ASO4,H2O和一种未知物X已知KBRO3
某反应中反应物与生成物有:ASH3,H2SO4,KBRO3,K2SO4,H3ASO4,H2O和一种未知物X已知KBRO3在反应中得
已知0.2molKBR3在反应中得到1MOL电子生成X,X的化学拭为 求详解
 自在寒武纪11年前1
自在寒武纪11年前1 -
 小搓板 共回答了16个问题
小搓板 共回答了16个问题 |采纳率100%0.2molKBrO3在反应中得到1mol电子,证明1molKBrO3得到5mol电子,也就是降低5价,所以X为0价的Br21年前查看全部
- 某含C、H、O三种元素的未知物A,经燃烧分析实验测定该未知物碳的质量分数为52.16%,氢的质量分数为13.14%,它的
某含C、H、O三种元素的未知物A,经燃烧分析实验测定该未知物碳的质量分数为52.16%,氢的质量分数为13.14%,它的红外吸收光谱表明有C-O键O-H键和C-H键的红外吸收峰,它的相对分子质量为46. 试求:
(1)该未知物A的实验式
(2)该未知物A的分子式
(3)该未知物A的结构式. wangquangter1年前1
wangquangter1年前1 -
 hedayang168 共回答了13个问题
hedayang168 共回答了13个问题 |采纳率84.6%解题思路:(1)碳的质量分数是52.16%,氢的质量分数是13.14%,则氧元素质量分数是:1-52.16%-13.14%=34.7%,则该物质中碳、氢、氧原子个数之比=[52.16%/12]:[13.14%/1]:[34.7%/16]=4.34%:13,14%:2.17%=2:6:1,据此写出实验式;
(2)A的相对分子量为46,据此计算出A的分子式;
(3)根据“A的红外吸收光谱表明有C-O键O-H键和C-H键的红外吸收峰”写出A的结构简式.(1)A中含有C、H、O三种元素,碳的质量分数是52.16%,氢的质量分数是13.14%,则氧元素质量分数是:1-52.16%-13.14%=34.7%,则该物质中碳、氢、氧原子个数之比=[52.16%/12]:[13.14%/1]:[34.7%/16]=4.34%:13,14%:2.17%=2:6:1,则A的实验式为:C2H6O,
答:该未知物A的实验式C2H6O;
(2)A的相对分子质量为46,实验式C2H6O的式量为46,所以A的分子式为:C2H6O,
答:该未知物A的分子式为C2H6O;
(3)A的红外吸收光谱表明有C-O键O-H键和C-H键的红外吸收峰,说明A分子中含有羟基:-OH,则A的结构简式为:CH3CH2OH,结构式为 ,
,
答:该未知物A的结构式为 .
.点评:
本题考点: 有关有机物分子式确定的计算.
考点点评: 本题考查了有机物实验式、分子式、结构简式的计算,题目难度中等,注意掌握有机物分子式、结构简式的确定方法,明确质量守恒在确定有机物分子式、结构简式的应用.1年前查看全部
- 单靠红外吸收光谱,能否判断未知物是何种物质,为什么?
 hzmwhy1年前1
hzmwhy1年前1 -
 遗忘的美丽 共回答了19个问题
遗忘的美丽 共回答了19个问题 |采纳率89.5%根据红外吸收光谱,可以知道未知物中含有什么官能团、基团,但不能确定分子式,不能确定基团的个数,所以不能确定该物质.要结合质谱、核磁共振氢谱等进行判断.1年前查看全部
- 将一定量的苯(C6H6)和氧气置于一个完全封闭的容器中引燃,反应生成二氧化碳、水和 一种未知物 X.
将一定量的苯(C6H6)和氧气置于一个完全封闭的容器中引燃,反应生成二氧化碳、水和 一种未知物 X.
测得反应前后物质的质量如下表
物质苯氧气二氧化碳水X
反应前的质量/克3.99.6000
反应后的质量/克006.62.7M
A.表中m的值为13.5
B.该反应属于分解反应
C.物质X中一定含有氢元素
D物质X的相对分子质量为28
请选择正确的选项,正确的选项也需要解释 dovepizza1年前1
dovepizza1年前1 -
 绿色印象 共回答了11个问题
绿色印象 共回答了11个问题 |采纳率90.9%选D,排除法做.
A.根据质量守恒定律,X的质量m是3.9+9.6-6.6-2.7=4.2,A错误.
B.错误,有两种反应物,不是分解反应.
C水中H元素的质量是2.7*(2/18)=0.3g,苯中中H元素的质量是3.9*(6/78)=0.3g,所以X中没有H元素.
【2/18是H2O中H元素的质量分数,6/78是C6H6中H元素的质量分数】
D.正确,X是CO,苯不完全燃烧可以生成CO,CO的相对分子质量是28.1年前查看全部
- 某含C、H、O三种元素的未知物A,经燃烧分析实验测定该未知物中碳的质量分数为52.16%,氢的质量分数为13.14%
某含C、H、O三种元素的未知物A,经燃烧分析实验测定该未知物中碳的质量分数为52.16%,氢的质量分数为13.14%
C:O:H=(52.16%/12):(34.70%/16):(13.14%/1)这些数求出来怎么化简? 小亭子同学1年前1
小亭子同学1年前1 -
 波的貓er 共回答了18个问题
波的貓er 共回答了18个问题 |采纳率94.4%计算很简单的呀
能用计算器吗?
把百分号去掉 也就是相当于同时x100
52.16/12=4.35
34.7/16=2.17
13.14/1=13.14
同时除以2.17得
4.35/2.17=2
2.17/2.17=1
13.14/2.17=6
C2H6O1年前查看全部
- (2009•黄冈)在一密闭容器内有氧气、二氧化碳、水蒸气和一种未知物W,在一定条件下充分反应,测得反应前后各物质的质量如
(2009•黄冈)在一密闭容器内有氧气、二氧化碳、水蒸气和一种未知物W,在一定条件下充分反应,测得反应前后各物质的质量如下表所示,则下列说法中不正确的是( )
物 质 氧 气 二氧化碳 水蒸气 W 反应前质量/g 50 1 1 23 反应后质量/g 2 45 28 x
A.根据质量守恒定律,x的值应为0
B.反应后的生成物是二氧化碳和水
C.物质W只含碳和氢两种元素
D.物质W一定含碳、氢、氧三种元素 zyhuzeng11年前1
zyhuzeng11年前1 -
 断翅情迷 共回答了21个问题
断翅情迷 共回答了21个问题 |采纳率85.7%由表格信息可知反应后CO2质量增加了44克,是生成物;H2O质量增加了27克,是生成物;生成物共增加质量44g+27g=71g,O2质量减少了48克,是反应物;故W质量应该减少71g-48g=23g,所以反应后物质W的质量x为0,反应物是W和O2,生成物是CO2 和 H2O,根据反应前后元素种类不变,生成物中含有C,H和O三种元素,反应物O2中含有O元素.所以C和H一定来自W,C元素质量为:44克×[12/44]=12克;H元素质量为:27克×[2/18]=3克.12克+3克=15克<23克,所以W中一定含有碳、氢、氧三种元素.
故选C.1年前查看全部
- (2012•昆山市二模)将一定量的乙醇和氧气置于一个完全封闭的容器中引燃,反应生成二氧化碳、水蒸气和一种未知物X.测得反
(2012•昆山市二模)将一定量的乙醇和氧气置于一个完全封闭的容器中引燃,反应生成二氧化碳、水蒸气和一种未知物X.测得反应前后物质的质量如下表:
下列判断正确的是( )物质 乙醇 氧气 二氧化碳 水 X 反应前质量/g 4.6 8 0 0 0 反应后质量/g 0 0 4.4 5.4 m
A.表中m的值无法确定
B.X可能是该反应的催化剂
C.增加氧气的量可以减少X的生成
D.物质X一定含有碳元素,可能含有氢元素 神的预言1年前1
神的预言1年前1 -
 赤尔 共回答了21个问题
赤尔 共回答了21个问题 |采纳率81%解题思路:根据质量守恒定律分析,根据表中的数据确定反应物生成物.反应后质量减少的物质是反应物,质量增加的物质是生成物.通过计算乙醇、氧气、二氧化碳、水中各元素的质量,根据质量守恒定律可以确定X的组成、质量和化学式;经计算知X是一氧化碳,说明乙醇没有充分燃烧,增加氧气的量有助于乙醇的充分燃烧,从而减少一氧化碳的生成.由表中的数据可知:由于乙醇和氧气反应后质量减少,二氧化碳和水反应后质量增加,根据质量守恒定律可知:在该反应中,乙醇和氧气是反应物,二氧化碳和水是生成物.由化合物中某元素的质量=化合物的质量×化合物中该...
点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题的难度不是很大,解答本题要认真分析各物质的质量变化情况,仔细推敲,即可求解.1年前查看全部
- 质谱解析某一未知物的质谱图如图6.12所示,m/z为93,95的谱线强度接近,m/z为79,81峰也类似,而m/z为49
质谱解析
某一未知物的质谱图如图6.12所示,m/z为93,95的谱线强度接近,m/z为79,81峰也类似,而m/z为49,51 的峰强度之比为3∶1.试推测器结构. lifan03261年前1
lifan03261年前1 -
 无人喝采 共回答了13个问题
无人喝采 共回答了13个问题 |采纳率92.3%质谱图没有给出!
是不是有128、130、132的峰?
m/z为93,95的谱线强度接近,应该是CH2Br+.碎片,两个峰的峰强接近于1:1;
m/z为79,81峰也类似,应该是Br+.碎片,两个峰的峰强也接近于1:1;
而m/z为49,51 的峰应该是CH2Cl+.强度之比约为3∶1.
如此推导下来,其结构应该是 CH2ClBr.1年前查看全部
- 分析化学波谱解析某未知物M(107):M+1(108):M+2(109)=100:8.0:0.3.则该未知物分子式为?详
分析化学波谱解析
某未知物M(107):M+1(108):M+2(109)=100:8.0:0.3.则该未知物分子式为?详细解题步骤,并说明为什么谢谢大家了.我会追加分数的.
 lingjiang20081年前1
lingjiang20081年前1 -
 沉醉的醒 共回答了13个问题
沉醉的醒 共回答了13个问题 |采纳率76.9%波谱与光谱分析主要是分析有机物的,包括定量定性分析,有核磁共振,色谱,红外,紫外,可见光等. 个人喜欢环境分析化学其实选择专业还是要看自己喜欢的 ..1年前查看全部
- 将一定量的苯(H6O6)和氧气置于一个完全封闭的容器引燃,反应生成二氧化碳,水和未知物X
将一定量的苯(H6O6)和氧气置于一个完全封闭的容器引燃,反应生成二氧化碳,水和未知物X
若未知物为一氧化碳 写出该反应的化学方程式! zeuspl1年前3
zeuspl1年前3 -
 zhisl99 共回答了16个问题
zhisl99 共回答了16个问题 |采纳率87.5%注意.苯是C6H6
2C6H6 + 14O2==点燃==10CO2 + 2CO + 6H2O
或
2C6H6 + 13O2==点燃==8CO2 + 4CO + 6H2O
或
2C6H6 + 11O2==点燃==4CO2 + 8CO + 6H2O
或
2C6H6 + 10O2==点燃==2CO2 + 10CO + 6H2O
四种可能.
是哪个看看有没有别的条件了.1年前查看全部
- 如果我想确定一有机物(未知物)成分?应该进行哪些测试呢?
如果我想确定一有机物(未知物)成分?应该进行哪些测试呢?
比较复杂的物质,粘度很大的液体 monicaliyuan1年前2
monicaliyuan1年前2 -
 cathy0629 共回答了20个问题
cathy0629 共回答了20个问题 |采纳率85%只是确定成分不要求量哦,
有机物一般都含有C、H、
密封隔绝氧气加热,有水生成就有O元素
有氧高温加热碳化,用酸溶解,再分别鉴定K、Na………………1年前查看全部
- 根据下述反应,判断未知物.(1)A+HCl→B+H2O+CO2↑
根据下述反应,判断未知物.
(1)A+HCl→B+H2O+CO2↑ (2)B+AgNO3→AgCl↓+C
(3)C+CuSO4→BaSO4↓+D (4)D+NaOH→E↓+NaNO3
(5)E
F+H2O加热
已知A是一种盐,则A~F的化学式为:
A、______B、______C、______
D、______E、______F、______. 萧乡夜雨1年前4
萧乡夜雨1年前4 -
 csgogo 共回答了13个问题
csgogo 共回答了13个问题 |采纳率84.6%解题思路:根据复分解反应的原理和化学反应的(3)(4)可知C为硝酸钡,D为硝酸铜,E为氢氧化铜,F为氧化铜,有(1)(2)反应可知A为碳酸钡,B为氯化钡.根据复分解反应的原理和化学反应的(3)C+CuSO4→BaSO4↓+D (4)D+NaOH→E↓+NaNO3可知C为硝酸钡,D为硝酸铜,E为氢氧化铜,
(5)E
加热
F+H2O,氢氧化铜加热生成氧化铜和水;故F为氧化铜,有(1)A+HCl→B+H2O+CO2↑,可知A中含有碳酸根; (2)B+AgNO3→AgCl↓+C;反应可知A为碳酸钡,B为氯化钡.
答案:BaCO3; BaCl2;Ba(NO3)2;Cu(NO3)2; Cu(OH)2; CuO.点评:
本题考点: 物质的鉴别、推断;化学式的书写及意义.
考点点评: 物质推断题最关键是需要突破口,之后围绕突破口展开相关的推断,同时注意审题,注意解答题目的要求和限制,如本题问M的组成元素,而不问是什么名称和化学式,并且要求用元素符号表示而不是元素名称.1年前查看全部
- 某含C.H.O三种元素的未知物A,经燃烧分析实验测定该未知物碳的质量分数为52.16%,氢的质量分数为13.14%,试求
某含C.H.O三种元素的未知物A,经燃烧分析实验测定该未知物碳的质量分数为52.16%,氢的质量分数为13.14%,试求该未知物A的实验式.
 风雪相邻1年前1
风雪相邻1年前1 -
 yiranzai0113 共回答了16个问题
yiranzai0113 共回答了16个问题 |采纳率93.8%解题思路:碳的质量分数是52.16%,氢的质量分数是13.14%,则氧元素质量分数是1-52.16%-13.14%=34.7%,则该物质中碳、氢、氧原子个数之比=[52.16%/12]:[13.14/1]%:[34.7%/16]4.34%:13,14%:2.17%=2:6:1,据此写出实验式.碳的质量分数是52.16%,氢的质量分数是13.14%,氧元素质量分数是1-52.16%-13.14%=34.7%,则该物质中碳、氢、氧原子个数之比=[52.16%/12]:[13.14/1]%:[34.7%/16]4.34%:13,14%:2.17%=2:6:1,所以其实验式为C2H6O,
答:该有机物的实验式为:C2H6O.点评:
本题考点: 有机物实验式和分子式的确定.
考点点评: 本题考查了实验式的计算,较基础.根据元素的质量分数和相对原子质量可计算出原子个数比.1年前查看全部
- 影响Rf值的主要因素有哪些?用Rf值为什么能鉴定未知物?
 jj9914221年前1
jj9914221年前1 -
 猪猪我来了 共回答了20个问题
猪猪我来了 共回答了20个问题 |采纳率100%Rf value 写做Rf值.主要是纸上层析法的用词.源自流速(rate of flow).溶剂从原点渗透到距离a(一般在20—30厘米时测定)的时候,如果位于原点的物质从原点向前移动到b,那么b/a的值(0.0—1.0)就是这种物质的Rf值.例如把葡萄糖和果糖在20℃下于正丁醇-醋酸-水(4∶1∶5)中展开,可分别得到0.18、0.23的Rf值,在醋酸乙酯-吡啶- 水(2∶1∶1)中展开,则分别得到0.28、0.32的Rf值.若滤纸、溶剂温度等保持恒定,则各种物质呈现特定的Rf值,成为鉴定物质的极重要的常数.1年前查看全部
- 关于化学实验式和分子式的计算(要有详细的解题过程) 题1:某含C、H、O三种元素的未知物A,经燃烧分析实验测定该未知物A
关于化学实验式和分子式的计算(要有详细的解题过程) 题1:某含C、H、O三种元素的未知物A,经燃烧分析实验测定该未知物A中碳的质量分数为52.16%,氢的质量分数13.14%.求该未知物A的实验式.题2:某芳香族化合物A由碳、氢、氧三种元素组成,其蒸气密度是相同条件下H2密度的69倍,已知0.1molA在氧气中完全燃烧得30.8gCO2和0.3molH2O,求A的分子式.
 gimix1年前1
gimix1年前1 -
 异常俊美 共回答了13个问题
异常俊美 共回答了13个问题 |采纳率100%碳52.16%,13.14%的氢,氧的质量分数为100%-52.16%-13.14%的质量分数的质量分数= 34.7%
碳氢原子和氧原子比52.16%/ 12:13.14%/ 1:34.7%/ 16 = 3点06分02秒
A的经验分子式为C3H6O2
其蒸气密度是H2密度,在同等条件下的69倍,相对分子质量为69 * 2 = 138中
0.1molA 30.8gCO2即0.7molCO2,0.3molH2O,二氧化碳和水,碳原子和氢原子,只有从A
1molA,碳原子三叔丁基磷,氢中的氧完全燃烧原子6mol
C7H6Ox
12 * 7 +6 +16 = 138,X = 3
的分子式.对于C7H6O31年前查看全部
- 未知物如何通过高分辨相以及XRD来确定其晶胞参数
 suomula1年前1
suomula1年前1 -
 jf9lh 共回答了21个问题
jf9lh 共回答了21个问题 |采纳率76.2%可以通过大功率的XRD扫描精修,得到未知样结构.
如果想通过电镜来做,元素分析的结果也是需要的.1年前查看全部
- 对植物向光性的研究过程丹麦的Jensen已知胚芽鞘的向光性由于尖端能产生某种未知物,受单侧光影响改变其移动的方向而引起.
对植物向光性的研究过程
丹麦的Jensen已知胚芽鞘的向光性由于尖端能产生某种未知物,受单侧光影响改变其移动的方向而引起.他进一步的研究是:用云母片插入胚芽鞘背光一侧的尖端与下部之间,结果向光性消失,而插在向光一侧,向光性仍存在.Jensen的研究使向光性研究有了以下哪一方面的进展
A.未知物在背光一侧不发挥作用 B.未知物在向光一侧不发挥作用
C.未知物是生长促进剂而不是抑制物 D.未知物在尖端产生在下部发挥作用
答案是C 为什么不是D tftrtrreer1年前2
tftrtrreer1年前2 -
 ljy199091 共回答了19个问题
ljy199091 共回答了19个问题 |采纳率84.2%1年前查看全部
- 大学无机化学1、3.6g葡萄糖溶于200g水中,未知物20g溶于500g水中,两溶液同时同温下结冰,求未知物的相对分子量
大学无机化学
1、3.6g葡萄糖溶于200g水中,未知物20g溶于500g水中,两溶液同时同温下结冰,求未知物的相对分子量.已知葡萄糖的式量是180
2、某水溶液的沸点是100.28℃,求(1)该溶液的凝固点;(2)已知25℃时纯水的蒸汽压为3167.73Pa,该温度下溶液的蒸气压;(3)0℃时此溶液的渗透压.已知水的式量为18.02 逆风之伤1年前1
逆风之伤1年前1 -
 阿弥陀佛55725 共回答了29个问题
阿弥陀佛55725 共回答了29个问题 |采纳率89.7%请自己参考课本,有公式,可以自己做.1年前查看全部
- (8分)某含C、H、O三种元素的未知物A,经燃烧分析实验测定该未知物碳的质量分数为52.16%,氢的质量分数为13.14
(8分)某含C、H、O三种元素的未知物A,经燃烧分析实验测定该未知物碳的质量分数为52.16%,氢的质量分数为13.14%,它的红外吸收光谱表明有C—O键O—H键和C—H键的红外吸收峰,它的相对分子质量为46。试求:
(1)该未知物A的实验式(2)该未知物A的分子式(3)该未知物A的结构式 xw791年前1
xw791年前1 -
 我8不yy你8 共回答了20个问题
我8不yy你8 共回答了20个问题 |采纳率100%1年前查看全部
- 某反应中反应物与生成物有:AsH 3 、H 2 SO 4 、KBrO 3 、H 3 AsO 4 、H 2 O和一种未知物
某反应中反应物与生成物有:AsH 3 、H 2 SO 4 、KBrO 3 、H 3 AsO 4 、H 2 O和一种未知物质X.
(1)已知KBrO 3 在反应中得到电子,则该反应的还原剂是______.
(2)已知0.2molKBrO 3 在反应中得到1mol电子生成X,则X的化学式为:______.
(3)根据上述反应可推知______.
a.氧化性:KBrO 3 >H 3 AsO 4 b.氧化性:KBrO 3 >KBrO 3
c.还原性:A S H 3 >Xd.还原性:X>A S H 3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:______.
 飞不出的林子1年前1
飞不出的林子1年前1 -
 jinjfy 共回答了21个问题
jinjfy 共回答了21个问题 |采纳率90.5%(1)KBrO 3 在反应中得到电子,则Br元素的化合价降低,给出的物质中AsH 3 具有还原性,As元素的化合价在反应中升高,故答案为:AsH 3 ;
(2)设X中Br元素化合价为x,由元素化合价的变化可知转移的电子为0.2mol×(5-x)=1mol,解得x=0,则X为Br 2 ,故答案为:Br 2 ;
(3)在反应中,氧化剂为KBrO 3 ,还原剂为AsH 3 ,氧化产物为H 3 AsO 4 ,还原产物为Br 2 ,
由氧化剂的氧化性大于氧化产物的氧化性可知KBrO 3 >H 3 AsO 4 ,由还原剂的还原性大于还原产物的还原性可知A S H 3 >X (Br 2 ),
故答案为:ac;
(4)KBrO 3 在反应中得到电子,AsH 3 具失去电子,转移的电子数为40e - ,则标出电子转移的方向和数目为
,故答案为:
.1年前查看全部
- 在一密闭容器内有氧气、二氧化碳、水蒸气和一种未知物W,在一定条件下充分反应,测得反应前后各物质的质量
在一密闭容器内有氧气、二氧化碳、水蒸气和一种未知物W,在一定条件下充分反应,测得反应前后各物质的质量
物 质 氧 气 二氧化碳 水蒸气 W
反应前质量/g 50 1 1 23
反应后质量/g 2 45 28 x
A.根据质量守恒定律,x的值应为0 B.反应后的生成物是二氧化碳和水
C.物质W只含碳和氢两种元素 D.物质W一定含碳、氢、氧三种元素
请高手分析下,光答案的不需要,谢谢.在线等 jzz526681年前2
jzz526681年前2 -
 泉城隐秘 共回答了18个问题
泉城隐秘 共回答了18个问题 |采纳率88.9%A对.根据质量守恒定律,x的值应为0 50+1+1+23=2+45+28+x x=0
B对.反应后的生成物是二氧化碳和水 质量减少的为反应物,增加的为生成物
C错.物质W只含碳和氢两种元素 (45-1)gCO2含碳44g*12/44=12g (28-1)g水含氢 27g*2/18=3g 所以W含氧 23g-12g-3g=8g
D对.物质W一定含碳、氢、氧三种元素 见C答案1年前查看全部
- (2014•朝阳区二模)将一定量的苯(C6H6)和氧气置于一个完全密闭的容器中引燃,反应后生成二氧化碳、水和一种未知物X
(2014•朝阳区二模)将一定量的苯(C6H6)和氧气置于一个完全密闭的容器中引燃,反应后生成二氧化碳、水和一种未知物X.测得反应前后各物质的质量如表:
下列判断不正确的是( )物质 苯 氧气 二氧化碳 水 X 反应前质量/g 3.9 9.6 0 0 0 反应后质量/g 0 0 6.6 2.7 m
A.表中m的值为4.2
B.物质X由碳、氧元素组成
C.物质X由碳、氢元素组成
D.生产二氧化碳和水的分子个数比为1:1 piglett1年前1
piglett1年前1 -
 日月1188 共回答了16个问题
日月1188 共回答了16个问题 |采纳率81.3%解题思路:化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和.根据质量守恒定律,生成X的质量为:3.9g+9.6g-6.6g-2.7g=4.2g,
3.9g苯中碳元素的质量为:3.9g×[72/78]×100%=3.6g,氢元素质量为:3.9g-3.6g=0.3g,
6.6g二氧化碳中碳元素的质量为:6.6g×[12/44]×100%=1.8g,氧元素的质量为:6.6g-1.8g=4.8g,
2.7g水中氢元素的质量为:2.7g×[2/18]×100%=0.3g,氧元素质量为:2.7g-0.3g=2.4g,
二氧化碳和水的分子个数比为:[6.6g/44]:[2.7g/18]=1:1,
由计算可知,表中m的值为4.2,生成的二氧化碳和水的分子个数比为1:1,物质X由碳、氧元素组成;
因为苯中的氢元素和生成的水中的氢元素质量相等,所以X中不含有氢元素,由分析可知,C选项的判断不正确.
故选:C.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式和进行相关方面计算的基础.1年前查看全部
- 在一密封容器内有氧气、二氧化碳、水蒸气及一种未知物M化学方程式
在一密封容器内有氧气、二氧化碳、水蒸气及一种未知物M化学方程式
反应前 氧气100g 二氧化碳1g 水蒸气1g M46g
反应后 4g 89g 55g x
(1)已知未知物质M的相对分子质量为46,推出其化学式
(2)该反应的化学方程式是什么 拆翼于人间1年前4
拆翼于人间1年前4 -
 好人-好人 共回答了22个问题
好人-好人 共回答了22个问题 |采纳率81.8%(1)反应前O2 100g,CO2 1g,H2O 1g,M 46g,由题可知反应后O2消耗了96g,M全部消耗,CO2增加了88g,H2O增加54g.未产生其他物质.则反应式:
O2+M=CO2+H2O;
他们对应的质量为96,46,88,54.从产生物的成分我们可以断它一定还有C H,O是否含有未知.根据质量守恒,我们来推断下是否还有O.
CO2为88g,分子量44,则其O的重量为64g.H2O为54g,分子量18,其中含有O为48g.反应后的O的总重量为64+48=112g.反应前O的中重量为96,则它还有O.
由题可看出1份的M产生了88/44=2份的C,所以可以推断M的化学式含有C为2
M产生了54/18=3份的H2O,可其化学式含有H为6
反应后的O质量为112g,反应前96g,产生了16g的O,即产生1分O.
所以推导出其化学方程式为C2H6O
(2)反应化学方程式:
C2H6O+3O2=燃烧=2CO2+3H2O1年前查看全部
- 提问[例1]某含C、H、O三种元素的未知物A,经燃烧分析实验测定该未知物中碳的质量分数为52.16%,氢的质量分
提问[例1]某含C、H、O三种元素的未知物A,经燃烧分析实验测定该未知物中碳的质量分数为52.16%,氢的质量分
[例1]某含C、H、O三种元素的未知物A,经燃烧分析实验测定该未知物中碳的质量分数为52.16%,氢的质量分数为13.14%.(P20)
(1)试求该未知物A的实验式(分子中各原子的最简单的整数比). 大泡眼金鱼1年前1
大泡眼金鱼1年前1 -
 agkof 共回答了23个问题
agkof 共回答了23个问题 |采纳率87%先确定该有机物中各组成元素原子的质量分数
由碳,氢的质量分数,则氧的质量分数为34.70%
再求各元素原子的个数比
C:O:H=(52.16/12):(34.70/16):(13.14/1)
化简=2:1:6
则该未知物A的实验式为C2H6O1年前查看全部
- 初中化学如何求未知物的化学式并配方
 心中泪连连1年前1
心中泪连连1年前1 -
 wm287126670 共回答了17个问题
wm287126670 共回答了17个问题 |采纳率82.4%由化学价的升降变化先将变价的价位左右配平在根据物质守衡配平1年前查看全部
- 急救~求未知物的摩尔质量在100g水中溶解未知物10g,测得溶液的疑固点为272.5k,求未知物的摩尔质量.(已知纯水的
急救~求未知物的摩尔质量
在100g水中溶解未知物10g,测得溶液的疑固点为272.5k,求未知物的摩尔质量.(已知纯水的疑固点为273k,水的疑固点降低常数k1=1.86) 找点呀1年前2
找点呀1年前2 -
 hnldx1 共回答了19个问题
hnldx1 共回答了19个问题 |采纳率78.9%纯水的凝固点是273K所以加入这种物质后,凝固点下降=273-272.5=0.5K由公式:△T = K1 * m得:m = 0.5/1.86 = 0.27mol/Kg所以100g水中这种物质的物质的量 = 0.27*100/1000 = 0.027mol所以摩尔质量 = 10/0.027 = 372g/mo...1年前查看全部
- 氯酸钾与浓盐酸在一定温度下反应,生成二氧化氯,氯化钾,氯气和另外一未知物,求反应方程式.
氯酸钾与浓盐酸在一定温度下反应,生成二氧化氯,氯化钾,氯气和另外一未知物,求反应方程式.
二氧化氯具有很强的氧化性,因此常被用作消毒剂,其消毒的效率(以单位质量得到的电子数)表示是氯气的多少倍 狐呶呶小ss1年前4
狐呶呶小ss1年前4 -
 锐锐乖 共回答了19个问题
锐锐乖 共回答了19个问题 |采纳率100%1.
未知产物是水
2kclo3+4hcl=2kcl+cl2+2clo2+2h2o
2.
2.63倍
计算过程
(clo2)=5/2(cl2)(根据得电子数相同时)
质量反比就是消毒效率:
X=(71*5)/(67.5*2)=2.631年前查看全部
大家在问
- 1六年级的课堂作业本中老人与海鸥一课中的最后一题
- 2千日之行的下一句是什么?
- 3Thank you for your continued help,without which,I can't do w
- 4为了防治SO2污染空气,一般通入A盐酸B碱溶液C盐溶液D水
- 5急.求函数y=负二分之一根号下x方+2x+3的单调区间 求函数y=根号下x-1-x分之一的最小值
- 6At seven in the evening ,the shop c______
- 7这个光学透镜成像问题怎么证明?在烛焰与光屏之间移动透镜,能使烛焰的像成在屏上的透镜位置,一般可以有两个,如果这两个位置之
- 8why do you look unhappy because mary asked me to buy the red
- 9将Fe,Cu,Fe2+,Fe3+和Cu2+盛于同一容器中充分反应,如Fe有剩余,则容器中只能有( )
- 10一摞2分米高的打印纸,把它分成同样多的5份,每份打印纸的高大约是多少厘米?
- 11试着写一段对话,运用上不同的提示语。(写少点)很急的。
- 12三大类岩石循环转化示意图,完成下列要求:
- 13,在一个等腰直角三角形中削去一个三角形,剩下一个上底是4厘米,下底是10厘米的等腰梯形
- 14己知:如图1,抛物线我=ax2-2ax+c(a≠0)与我轴交于点C(O,-4),与x轴交于A、B两点,点A的坐标为(4,
- 15诗中的“春” 作文