H2CO3与Ba(NO3)2是否能发生反应?若不能是否是因为碳酸发生了分解?
 cd5102022-10-04 11:39:541条回答
cd5102022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 彼岸风筝 共回答了17个问题
彼岸风筝 共回答了17个问题 |采纳率88.2%- 根据强酸置弱酸的原理这个是不能发生反应的,但是根本上是因为碳酸里面碳酸根离子数目实在太少,根本就不能和钡离子发生可见的反应,LZ可以写一下碳酸的变成碳酸氢根再变成碳酸根的离子方程式就知道了
- 1年前
相关推荐
- 硫酸根检验能用+HCl再+Ba(NO3)2
硫酸根检验能用+HCl再+Ba(NO3)2
如题 孤心随风1年前9
孤心随风1年前9 -
 天亮前想要 共回答了22个问题
天亮前想要 共回答了22个问题 |采纳率90.9%不能
若溶液中含有SO32-,HNO3会把SO32-氧化成SO42-
所以HCl和Ba(NO3)2.不能检验SO42-
只能用盐酸酸化,再加BaCl2来检验.1年前查看全部
- 设NA为阿伏加德罗常数的值.下列关于0.2mol/L Ba(NO3)2溶液不正确的说法是( )
设NA为阿伏加德罗常数的值.下列关于0.2mol/L Ba(NO3)2溶液不正确的说法是( )
A. 2L溶液中有阴、阳离子总数为0.8NA
B. 500mL溶液中NO3-浓度为0.4mol/L
C. 500mL溶液中Ba2+浓度为0.2mol/L
D. 500mL溶液中NO3-总数为0.2NA paulleow1年前4
paulleow1年前4 -
 顾尔谦 共回答了18个问题
顾尔谦 共回答了18个问题 |采纳率94.4%解题思路:A、根据N=化学式中阴阳离子个数×c(Ba(NO3)2)VNA计算;
B、根据溶液中离子的物质的量浓度=化学式中离子个数×溶液的物质的量浓度计算;
C、根据溶液中离子的物质的量浓度=化学式中离子个数×溶液的物质的量浓度计算;
D、根据n(NO3-)=2c(Ba(NO3)2)V计算.A、N(阴阳离子数)=3×c(Ba(NO3)2)V NA=3×0.2mol/L×2L×NA=1.2NA,故A错误;
B、C(NO3-)=2×c(Ba(NO3)2)=2×0.2mol/L=0.4mol/L,故B正确;
C、C(Ba2+)=1×c(Ba(NO3)2)=1×0.2mol/L=0.2mol/L,故C正确;
D、n(NO3-)=2 c(Ba(NO3)2)V=2×0.2mol/L×0.5L=0.2mol,溶液中NO3-总数为0.2NA,故D正确;
故选A.点评:
本题考点: 阿伏加德罗常数;物质的量浓度.
考点点评: 本题考查了有关物质的量浓度的计算,难度不大,明确化学式与离子的关系是解本题的关键.1年前查看全部
- (2002•甘肃)有一包固体混合物,可能含有NaCl、Na2CO3、Ba(NO3)2、MgSO4等物质中的某几种.实验分
(2002•甘肃)有一包固体混合物,可能含有NaCl、Na2CO3、Ba(NO3)2、MgSO4等物质中的某几种.实验分析记录如下:①取少量混合物加足量的水充分搅拌,有白色不溶物生成,过滤;②在滤出的白色不溶物中,加入足量的盐酸,白色不溶物全部溶解;③在步骤②所得的溶液中,加入硝酸银溶液,生成白色沉淀,再加入稀硝酸经振荡沉淀不溶解.请回答:
(1)该固体混合物中,一定含______,一定不含______.
(2)不能断定的物质还需要进一步通过实验验证,如何验证? 爱说梦话的猫1年前1
爱说梦话的猫1年前1 -
 5恶不作10恶不涉 共回答了18个问题
5恶不作10恶不涉 共回答了18个问题 |采纳率88.9%解题思路:NaCl、Ba(NO3)2、MgSO4、Na2CO3四种物质间可以发生的反应有:Ba(NO3)2分别能与MgSO4、Na2CO3生成BaSO4和BaCO3的白色沉淀,白色沉淀BaCO3可以溶于稀硝酸放出气体CO2,白色沉淀BaSO4不能溶解于稀硝酸;根据以上物质间的反应关系,结合实验中的现象,分析、判断固体粉末的组成.NaCl、Ba(NO3)2、MgSO4、Na2CO3四种物质中,Ba(NO3)2分别能与MgSO4、Na2CO3生成BaSO4和BaCO3的白色沉淀;根据实验中固体粉末溶于水生成白色沉淀,而白色沉淀BaCO3可以溶于稀盐酸放出气体CO2、白色沉淀BaSO4不能溶解于稀盐酸,可判断固体粉末中一定含有Ba(NO3)2和Na2CO3、一定不含MgSO4;由于氯化钠不能与另外三种物质发生反应,固体粉末中是否含有NaCl对实验中的现象不产生影响,因此,可判断固体粉末中可能含有NaCl;故:另取少量原混合物溶于水,过滤,在滤液中加入适量的硝酸银溶液,产生白色沉淀,再加稀硝酸,白色沉淀不溶解,则证明原混合物中含氯化钠.
故答案为:(1)Na2CO3、Ba(NO3)2;MgSO4
(2)另取少量原混合物溶于水,过滤,在滤液中加入适量的硝酸银溶液,产生白色沉淀,再加稀硝酸,白色沉淀不溶解,则证明原混合物中含氯化钠.点评:
本题考点: 物质的鉴别、推断;证明盐酸和可溶性盐酸盐;盐的化学性质.
考点点评: 此类问题解决思路一般为:根据物质的性质及物质间可能发生的反应及反应时出现的现象,结合实验中所出现的现象,分析并判断混合物的组成.1年前查看全部
- (2013•梧州一模)有五瓶失去标签的溶液,己知它们是:①Ba(NO3)2溶液,②KCl溶液,③NaOH溶液,④CuSO
(2013•梧州一模)有五瓶失去标签的溶液,己知它们是:①Ba(NO3)2溶液,②KCl溶液,③NaOH溶液,④CuSO4溶液,⑤Na2SO4溶液.
若不用其他任何试剂,用最简便的方法就能将它们一一鉴别.下列鉴别顺序中最合理的是( )
A.④③①⑤②
B.④⑤①②③
C.①⑤③④②
D.③④①⑤② pinping1年前1
pinping1年前1 -
 sniper73 共回答了17个问题
sniper73 共回答了17个问题 |采纳率88.2%解题思路:根据铜离子在溶液中显蓝色,铜离子和氢氧根离子会生成蓝色沉淀,钡离子和硫酸根离子会生成白色沉淀,氯化钾不会出现现象最后鉴别等进行分析;先把带色的离子鉴别出来,在用该离子去鉴别其他的离子,再用鉴别出来的去鉴别后面的离子,依次进行.铜离子在溶液中显蓝色,首先观察溶液的颜色,显蓝色的是硫酸铜;然后将硫酸铜滴入剩余的四种溶液中,一种会出现蓝色沉淀,是氢氧化钠,另一种会出现白色沉淀,是硝酸钡;然后将硝酸钡滴入剩余的两种溶液中出现白色沉淀的是硫酸钠,没有现象的是氯化钾.
故选A.点评:
本题考点: 酸、碱、盐的鉴别.
考点点评: 在解此类题时,先要根据所给的溶液的颜色鉴别出带色的溶液,然后再用该试剂鉴别其他的物质,再用鉴别出来的物质鉴别其他的物质,依此类推.1年前查看全部
- 有一固体粉末,其中可能含有Na2CO3、NaCl、Na2SO4、CuCl2、Ba(NO3)2、K2CO3、K2SO4中的
有一固体粉末,其中可能含有Na2CO3、NaCl、Na2SO4、CuCl2、Ba(NO3)2、K2CO3、K2SO4中的一种或几种,现按下列步骤进行实验.
①将该粉末溶于水得无色溶液和白色沉淀.
②在滤出的沉淀中加入足量稀硝酸,有部分沉淀溶解,同时产生无色气体.
③取滤液做焰色反应,火焰呈黄色,透过蓝色钴玻璃未观察到紫色火焰.
由上述现象推断:
(1)该混合物中一定含有______;一定不含有______;可能含有______.
(2)如要检验其是否存在,将如何操作?______
(3)写出步骤②有关的化学方程式:______. lovewxk31年前1
lovewxk31年前1 -
 ke310 共回答了25个问题
ke310 共回答了25个问题 |采纳率88%解题思路:由①将该粉末溶于水得无色溶液和白色沉淀,可判断一定无CuCl2,一定有Ba(NO3)2,因为只有钡离子才可以形成沉淀,同时可能含碳酸根的化合物或含硫酸根离子的化合物;
由②在滤出的沉淀中加入稀硝酸,有部分沉淀溶解,同时产生无色气体,说明沉淀一定有硫酸钡和碳酸钡,反应为Ba2++SO42-=BaSO4↓,Ba2++CO32-=BaCO3↓,BaCO3+2H+=Ba2++CO2↑+H2O;
由③取滤液做焰色反应,火焰呈黄色,透过蓝色的钴玻璃观察,未见紫色火焰,说明一定有钠离子一定无钾离子,所以原混合物中一定含有Na2CO3和Na2SO4,一定不含有K2CO3和K2SO4;
综上所述:原混合物中一定含有Na2CO3、Na2SO4、Ba(NO3)2;一定不含有CuCl2、K2CO3、K2SO4;可能含有NaCl,以此来解答.由①将该粉末溶于水得无色溶液和白色沉淀,可判断一定无CuCl2,一定有Ba(NO3)2,因为只有钡离子才可以形成沉淀,同时可能含碳酸根的化合物或含硫酸根离子的化合物;
由②在滤出的沉淀中加入稀硝酸,有部分沉淀溶解,同时产生无色气体,说明沉淀一定有硫酸钡和碳酸钡,反应为Ba2++SO42-=BaSO4↓,Ba2++CO32-=BaCO3↓,BaCO3+2H+=Ba2++CO2↑+H2O;
由③取滤液做焰色反应,火焰呈黄色,透过蓝色的钴玻璃观察,未见紫色火焰,说明一定有钠离子一定无钾离子,所以原混合物中一定含有Na2CO3和Na2SO4,一定不含有K2CO3和K2SO4;
(1)由上述分析可知,原混合物中一定含有Na2CO3、Na2SO4、Ba(NO3)2,一定不含有CuCl2、K2CO3、K2SO4,可能含有NaCl,
故答案为:Na2CO3、Na2SO4、Ba(NO3)2;CuCl2、K2CO3、K2SO4;NaCl;
(2)若检验氯化钠的存在,利用银离子与氯离子反应生成白色沉淀,则实验操作为取少量所得滤液于试管,向其中加入几滴AgNO3溶液,再加几滴稀HNO3,产生白色不溶于稀HNO3的沉淀,证明原混合物中有NaCl,否则原混合物中无NaCl,
故答案为:取少量所得滤液于试管,向其中加入几滴AgNO3溶液,再加几滴稀HNO3,产生白色不溶于稀HNO3的沉淀,证明原混合物中有NaCl,否则原混合物中无NaCl;
(3)步骤②有关的化学方程式为BaCO3+2HNO3=Ba(NO3)2+H2O+CO2↑,故答案为:BaCO3+2HNO3=Ba(NO3)2+H2O+CO2↑.点评:
本题考点: 物质的检验和鉴别的实验方案设计.
考点点评: 本题考查物质检验和鉴别,为高频考点,把握物质的性质及实验现象为解答的关键,侧重分析推断能力及知识综合应用能力的考查,注意常见离子的检验方法,题目难度不大.1年前查看全部
- 用2种试剂除去MGSO4,选用BA(NO3)2与KOH对不对
 aiwo99991年前2
aiwo99991年前2 -
 cokifire 共回答了11个问题
cokifire 共回答了11个问题 |采纳率100%不对,
MgSO4+Ba(NO3)2=BaSO4沉淀+Mg(NO3)2
Mg(NO3)2+2KOH=Mg(OH)2沉淀+2KNO3
看最后一样生成物KNO3.带入了新的离子K+和NO3-.如果是除去KNO3里面的MgSO4则这两种试剂就是对的,不然则是错误的.1年前查看全部
- (2013•番禺区一模)三瓶没有标签的白色粉末是Ba(NO3)2、MgCl2和CaO.请设计一个实验方案进行鉴别,并贴上
(2013•番禺区一模)三瓶没有标签的白色粉末是Ba(NO3)2、MgCl2和CaO.请设计一个实验方案进行鉴别,并贴上标签.叙述实验操作、预期现象和结论.
提供的试剂有:蒸馏水提供的仪器有:试管,胶头滴管
实验操作 预期现象与结论  36634991年前1
36634991年前1 -
 qingdaomuye 共回答了20个问题
qingdaomuye 共回答了20个问题 |采纳率85%解题思路:CaO溶于水放出热量,MgCl2溶液能和Ca(OH)2溶液反应产生沉淀,Ba(NO3)2和Ca(OH)2溶液不反应.根据三种物质不同的性质,可以先溶于水,与水反应并放出热量的白色粉末是CaO,然后取少量Ca(OH)2溶液分别滴入另外两种溶液中,能产生沉淀的溶液是MgCl2,无现象的是
Ba(NO3)2.
故答案是:故答案为:
分别取少量三种待鉴别的固体于三支试管中,加入足量水溶解 反应剧烈且伴有大量热量放出的原白色粉末是CaO,固体溶解的原固体是Na2CO3 和KCl
使用胶头滴管取少量Ca(OH)2溶液分别滴入另外两个试管中 有沉淀生成的试管里原固体是MgCl2,无明显现象的试管里原固体是Ba(NO3)2点评:
本题考点: 酸、碱、盐的鉴别.
考点点评: 同时对多种物质进行鉴别时,采取根据物质的性质的异同对物质进行分类的方法,可使复杂的鉴别变得有条理.1年前查看全部
- 除去下列物质中的少量杂质(括号内是杂质),从Ba(NO3)2溶液、Na2CO3溶液、AgNO3溶液、铁粉中选择适当的试剂
除去下列物质中的少量杂质(括号内是杂质),从Ba(NO3)2溶液、Na2CO3溶液、AgNO3溶液、铁粉中选择适当的试剂,将试剂写在横线上:
(1)KNO3(KCl)______(2)HNO3(H2SO4)______
(3)FeCl2(CuCl2)______(4)NaCl(CaCl2)______. 阿波-帅1年前1
阿波-帅1年前1 -
 云惊月 共回答了20个问题
云惊月 共回答了20个问题 |采纳率90%解题思路:根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.(1)要除去KNO3溶液中的KCl,实质就是除去氯离子,可利用KCl溶液与硝酸银反应生成氯化银沉淀和硝酸钾溶液,然后过滤即可,能除去杂质且没有引入新的杂质,符合除杂原则.
(2)要除去HNO3溶液中的H2SO4,实质就是除去硫酸根离子,可利用H2SO4溶液与Ba(NO3)2溶液反应生成硫酸钡沉淀和硝酸,然后过滤即可,能除去杂质且没有引入新的杂质,符合除杂原则.
(3)要除去FeCl2溶液中的CuCl2,实质就是除去铜离子,可利用CuCl2溶液与铁粉反应生成铜和氯化亚铁溶液,然后过滤即可,能除去杂质且没有引入新的杂质,符合除杂原则.
(4)要除去NaCl溶液中的CaCl2,实质就是除去钙离子,可利用CaCl2溶液与Na2CO3溶液反应生成碳酸钙沉淀和氯化钠溶液,然后过滤即可,能除去杂质且没有引入新的杂质,符合除杂原则.
故答案为:(1)AgNO3溶液;(2)Ba(NO3)2溶液;(3)铁粉;(4)Na2CO3溶液.点评:
本题考点: 物质除杂或净化的探究;酸的化学性质;盐的化学性质.
考点点评: 物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.1年前查看全部
- 检硫酸根离子的时候,为什么是“加入硝酸酸化的BA(NO3)2”而不是“先加入硝酸酸化,再加BA(NO3)2”?
 wzd11年前2
wzd11年前2 -
 丢了信仰的猪 共回答了17个问题
丢了信仰的猪 共回答了17个问题 |采纳率100%哇xp呀
先加HNO3可能会把SO3,S等离子氧化成为SO4后沉淀
……
不过可能即使这样还可能会有问题……仿佛是……1年前查看全部
- 若某溶液中,加入Ba(NO3)2溶液有白色沉淀生成若改加NaOH溶液也是有沉淀生成,则该溶液是
 guobinxiao1年前4
guobinxiao1年前4 -
 lowu8 共回答了20个问题
lowu8 共回答了20个问题 |采纳率90%MgSO4溶液最有可能,首先SO42- 可以和Ba2+成白色硫酸钡沉淀,跟OH-成白色沉淀,Mg2+最合适,因此是硫酸镁溶液1年前查看全部
- Ba(NO3)2溶液与NaHSO4反应的化学方程式及其离子方程式.
 红蟑螂1年前3
红蟑螂1年前3 -
 wbh666 共回答了19个问题
wbh666 共回答了19个问题 |采纳率84.2%化学 :Ba(NO3)2 +NaHSO4 ==BaSO4↓ +HNO3 +NaNO3
离子:Ba2+ +SO42- ==BaSO4↓1年前查看全部
- (2010•吉林)某校化学兴趣小组选用H2SO4、Ba(NO3)2、NaOH、K2CO3四种溶液进行“复分解反应条件”的
(2010•吉林)某校化学兴趣小组选用H2SO4、Ba(NO3)2、NaOH、K2CO3四种溶液进行“复分解反应条件”的实验探究.
[实验设计]
将上面四种溶液两两混合分成6组进行实验,请你在下表横线上将组合⑥填写完整.
[实验记录]组合序号 ① ② ③ ④ ⑤ ⑥ 组合物质 H2SO4
Ba(NO3)2H2SO4
NaOHH2SO4 K2CO3 Ba(NO3)2 NaOH Ba(NO3)2 K2CO3 ______
K2CO3
(1)请写出组合③反应的化学方程式:______;
(2)组合①与组合⑤相同的反应现象是______;
(3)需要借助指示剂才可判断反应发生的是______(填组合序号).
[实验结论]
由以上探究实验可得出复分解反应发生的条件:______.
[反思与拓展]
根据你对物质溶解性的了解,请写出一种不能作为反应物发生复分解反应的盐:______. liwei8351年前1
liwei8351年前1 -
 加百列1314 共回答了20个问题
加百列1314 共回答了20个问题 |采纳率80%解题思路:[实验记录]
(1)书写化学方程式时,必须熟悉反应物、生成物和反应条件,必须遵守质量守恒定律,依据客观事实.
(2)根据物质的性质和反应的实验现象进行分析;
(3)根据硫酸和氢氧化钠反应生成硫酸钠和水,反应无明显现象分析;
[实验结论]根据探究实验可得出复分解反应发生的条件;
[反思与拓展]不溶性的盐不能为反应物发生复分解反应.[实验设计]四种溶液两两混合分成6组,除了表中5组外,还差氢氧化钠和碳酸钾,故答案为:
NaOH;
[实验记录](1)碳酸钾和稀硫酸溶液反应生成硫酸钾、水和二氧化碳,该反应的化学方程式为:K2CO3+H2SO4=K2SO4+H2O+CO2↑,故答案为:K2CO3+H2SO4=K2SO4+H2O+CO2↑;
(2)硫酸和硝酸钡反应、硝酸钡和碳酸钾反应都有白色沉淀生成,故答案为:有白色沉淀生成;
(3)硫酸和氢氧化钠反应生成硫酸钠和水,反应无明显现象,需要借助指示剂才可判断反应发生,故答案为:②;
[实验结论]可得出复分解反应发生的条件是两种化合物相互交换成分,有沉淀或气体或水生成,故答案为:两种化合物相互交换成分,有沉淀或气体或水生成;
[反思与拓展]氯化银属于盐,不溶于水,不能作为反应物发生复分解反应,故答案为:氯化银.点评:
本题考点: 复分解反应的条件与实质;书写化学方程式、文字表达式、电离方程式.
考点点评: 要理解和熟记复分解反应的条件与实质,熟记常见酸、碱、盐的溶解性表,并能正确地运用物质的溶解性,方能顺利解题.1年前查看全部
- 设NA表示阿伏加德罗常数的值,下列关于0.2mol/L Ba(NO3)2溶液的叙述不正确的是( )
设NA表示阿伏加德罗常数的值,下列关于0.2mol/L Ba(NO3)2溶液的叙述不正确的是( )
A.2 L溶液中阴阳离子总数为1.2NA
B.500 mL溶液中NO3-浓度为0.2 mol/L
C.500 mL溶液中Ba2+浓度为0.2 mol/L
D.500 mL溶液中NO3-物质的量为0.2 mol tycoms1年前1
tycoms1年前1 -
 zhangq_2005 共回答了15个问题
zhangq_2005 共回答了15个问题 |采纳率93.3%解题思路:A、根据N=化学式中阴阳离子个数×c(Ba(NO3)2)•V•NA计算;
B、根据溶液中离子的物质的量浓度=化学式中离子个数×溶液的物质的量浓度计算;
C、根据溶液中离子的物质的量浓度=化学式中离子个数×溶液的物质的量浓度计算;
D、根据n(NO3-)=2c(Ba(NO3)2)•V计算.A、N(阴阳离子数)=3×c(Ba(NO3)2)2V NA=3×0.2mol/L×2L×NA=1.2NA,故A正确;
B、0.2mol•L-1的Ba(NO3)2溶液中:c(NO3-)=2×c[Ba(NO3)2)]=2×0.2mol/L=0.4mol/L,故B错误;
C、c(Ba2+)=1×c(Ba(NO3)2)=1×0.2mol/L=0.2mol/L,故C正确;
D、n(NO3-)=2 c(Ba(NO3)2)V=2×0.2mol/L×0.5L=0.2mol,NO3-总数为0.2NA,故D正确;
故选B.点评:
本题考点: 物质的量浓度.
考点点评: 本题考查了有关物质的量浓度的计算,题目难度不大,注意掌握物质的量浓度的概念及计算方法,明确化学式与离子的关系是解本题的关键.1年前查看全部
- (2014•许昌二模)A、B、C、D、E、F分别是Na2SO4、Na2CO3、Ba(NO3)2、HNO3、BaCl2、N
(2014•许昌二模)A、B、C、D、E、F分别是Na2SO4、Na2CO3、Ba(NO3)2、HNO3、BaCl2、NaOH六种溶液中的一种,它们具有以下转化关系.则溶液B为______,白色沉淀X的化学式为______C为______.

 0428_hai1年前1
0428_hai1年前1 -
 sherryshow 共回答了18个问题
sherryshow 共回答了18个问题 |采纳率88.9%解题思路:根据图中所给的各种物质都溶于水,硫酸根离子和钡离子会生成白色的硫酸钡沉淀,碳酸根离子和钡离子会生成白色的碳酸钡沉淀,碳酸钡沉淀会溶于硝酸生成二氧化碳气体,二氧化碳和氢氧化钠会生成碳酸钠和水,结合题中的转化关系进行分析.图中所给的各种物质都溶于水,硫酸根离子和钡离子会生成白色的硫酸钡沉淀,碳酸根离子和钡离子会生成白色的碳酸钡沉淀,碳酸钡沉淀会溶于硝酸生成二氧化碳气体,二氧化碳和氢氧化钠会生成碳酸钠和水,白色沉淀X和B反应会生成气体和溶液C,所以气体是二氧化碳,B是硝酸,碳酸钡和硝酸反应生成二氧化碳、水和硝酸钡,所以C是硝酸钡,X是碳酸钡沉淀,二氧化碳和氢氧化钠反应会生成碳酸钠和水,所以F是碳酸钠,E就是氢氧化钠,硝酸钡和硫酸钠反应会生成硫酸钡沉淀和硝酸钠,所以D是硫酸钠,剩下的A是氯化钡,经过验证,推出的各种物质均满足题意,推导合理,所以溶液B为:HNO3,白色沉淀X的化学式为:BaCO3,C为:Ba(NO3)2.
故答案为:HNO3,BaCO3,Ba(NO3)2.点评:
本题考点: 物质的鉴别、推断;酸的化学性质;盐的化学性质.
考点点评: 在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可.1年前查看全部
- 某电镀厂排放的废水中含有大量的有毒重金属盐Ba(NO3)2、Cu(NO3)2、 AgNO3,
某电镀厂排放的废水中含有大量的有毒重金属盐Ba(NO3)2、Cu(NO3)2、 AgNO3,
该厂想用氢氧化钾溶液、盐酸、硫酸三种试剂,将所排废水的重金属离子逐一变成沉淀回收,最后得到只含一种可做化肥的中性溶液.假设每种试剂只用一次,每部恰好完全反应.所加试剂中第二种试剂的阴离子是 硫酸根离子 请问为什么是硫酸根离子呢? 路思思1年前1
路思思1年前1 -
 kelly0213 共回答了21个问题
kelly0213 共回答了21个问题 |采纳率100%首先加入盐酸,除去银离子(银离子与氢氧根离子和硫酸根离子都会形成沉淀)
然后加入硫酸除去钡离子,最后加入氢氧化钾溶液 除去铜离子和前两步反应生成的酸中的氢离子,最后就得到只含一种可做化肥的中性溶液(硝酸钾溶液).1年前查看全部
- 将一定量的SO2通入Ba(NO3)2溶液中,下列离子反应一定不会发生的是( )
将一定量的SO2通入Ba(NO3)2溶液中,下列离子反应一定不会发生的是( )
A.Ba2++SO2+H2O═BaSO3↓+2H+
B.Ba2++SO42-═BaS04↓
C.3SO2+2H2O+2NO3-═3SO42-+4 H++2NO↑
D.4SO2+5H2 O+NO3-═4SO42-+NH4++6 H+ 川流不息啊1年前1
川流不息啊1年前1 -
 草上肥 共回答了25个问题
草上肥 共回答了25个问题 |采纳率88%解题思路:通入水中生成H2SO3,溶液呈酸性,NO3-在酸性条件下具有强氧化性,可与H2SO3发生氧化还原反应生成SO42-,溶液中不可能生成BaSO3.通入水中生成H2SO3,溶液呈酸性,NO3-在酸性条件下具有强氧化性,可与H2SO3发生氧化还原反应生成SO42-,溶液中不可能生成BaSO3,所以A一定错误,如NO3-浓度较低,可被还原生成NO或NH4+.
故选A.点评:
本题考点: 离子方程式的书写.
考点点评: 本题考查离子方程式的判断,题目难度不大,注意NO3-在酸性条件下具有强氧化性以及H2SO3具有还原性的性质.1年前查看全部
- 一包白色粉末、其中可能含有Ba(NO3)2、CaCl2、K2CO3.
一包白色粉末、其中可能含有Ba(NO3)2、CaCl2、K2CO3.
1.将部分粉末加入水中,震荡,生成白沉.
2.向1.的悬浊液中加入过量稀硝酸,白沉消失,并产生气泡.
3.取少量2.的溶液滴入AgNO3溶液、有白沉生成.
根据上述实验现象,判断原白色粉末中肯定存在____,可能含有____,写出1.,2.,3.的离子方程式. 无情-冷血1年前5
无情-冷血1年前5 -
 anshuhua 共回答了19个问题
anshuhua 共回答了19个问题 |采纳率89.5%跟Ag+形成白色沉淀说明肯定有CaCl2,由第一部可知有K2CO3,所以可能有Ba(NO3)2
Ca2++CO32-=CaCO3↓
CaCO3+2H+=CO2↑+H2O+Ca2+
Ag++Cl-=AgCl↓1年前查看全部
- 有失去标签的六瓶溶液:HCl、Na2CO3、Ba(NO3)2、Na2SO4、NaNO3.将其任意编号,进行两两混合,其现
有失去标签的六瓶溶液:HCl、Na2CO3、Ba(NO3)2、Na2SO4、NaNO3.将其任意编号,进行两两混合,其现象如表:
(1)写出各物质的化学式:A、______;B、______;C、______;D、______;E、______.实验 A+D A+B B+C A、B、C、D分别与E 现象 产生气体 产生沉淀 产生沉淀 无现象
(2)写出有关反应的化学方程式A+D______B+C______. 懦弱的勇者1年前1
懦弱的勇者1年前1 -
 酒醉的妖精猪 共回答了11个问题
酒醉的妖精猪 共回答了11个问题 |采纳率81.8%解题思路:根据碳酸钠和盐酸反应会生成二氧化碳气体,碳酸钠、硫酸钠会与硝酸钡生成碳酸钡沉淀、硫酸钡沉淀,所有的硝酸盐、钠盐都溶于水等知识进行分析.(1)碳酸钠和盐酸反应会生成二氧化碳气体,碳酸钠、硫酸钠会与硝酸钡生成碳酸钡沉淀、硫酸钡沉淀,所有的硝酸盐、钠盐都溶于水,通过分析各物质之间的反应现象可知,A、D反应会生成气体,所以A、D是碳酸钠、盐酸中的一种,A、B反应会生成沉淀,所以A、B是碳酸钠、硫酸钠、硝酸钡中的一种,所以A是碳酸钠,D是盐酸,B是硝酸钡,B、C反应会生成沉淀,所以C是硫酸钠,E就是硝酸钠,所以A是Na2CO3,B是Ba(NO3)2,C是Na2SO4,D是HCl,E是NaNO3;
(2)A+D的反应是盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;
B+C的反应是硫酸钠和硝酸钡反应生成硫酸钡沉淀和硝酸钠,化学方程式为:Ba(NO3)2+Na2SO4=BaSO4↓+2NaNO3.
故答案为:(1)Na2CO3,Ba(NO3)2,Na2SO4,HCl,NaNO3;
(2)Na2CO3+2HCl=2NaCl+H2O+CO2↑;Ba(NO3)2+Na2SO4=BaSO4↓+2NaNO3.点评:
本题考点: 酸、碱、盐的鉴别;书写化学方程式、文字表达式、电离方程式.
考点点评: 在解此类题时,首先分析各物质的性质和两两之间的反应,然后结合题中的现象判断出各种物质即可.1年前查看全部
- (2010•青岛模拟)溶于水的钡盐[如Ba(NO3)2、BaCl2等]对人体有毒,但是难溶于水也难溶于酸的BaSO4,不
(2010•青岛模拟)溶于水的钡盐[如Ba(NO3)2、BaCl2等]对人体有毒,但是难溶于水也难溶于酸的BaSO4,不但没有毒,而且还由于它具有不易被X射线透过的特点,在医疗上被用作X射线透视胃肠的内服药剂--“钡餐”.若误食了BaCl2,可用于解毒的药剂是( )
A.糖水
B.食盐水
C.硫酸镁溶液
D.硫酸溶液 面膜公主1年前1
面膜公主1年前1 -
 绿衣烟 共回答了26个问题
绿衣烟 共回答了26个问题 |采纳率88.5%解题思路:误食了BaCl2要解毒,需服用能和氯化钡反应生成硫酸钡的物质,根据复分解反应的条件进行判断.A、糖水不能与氯化钡反应,故A错误;
B、食盐水不能与氯化钡反应,故B错误;
C、硫酸镁能与氯化钡反应生成硫酸钡和氯化镁,故C正确;
D、硫酸具有腐蚀性,不能用于解毒,故D错误;
故选C.点评:
本题考点: 常见中毒途径及预防方法.
考点点评: 不同考查了常见物质间的反应,完成此题,可以依据物质的性质进行.1年前查看全部
- (2010•遵义)某实验室的废液中,可能含有FeCl3、NaCl、Na2SO4、Ba(NO3)2中的一种或多种.某同学取
(2010•遵义)某实验室的废液中,可能含有FeCl3、NaCl、Na2SO4、Ba(NO3)2中的一种或多种.某同学取该废液样品观察为无色溶液,向其中滴加BaCl2溶液产生白色沉淀,继续加稀硝酸无明显现象.根据以上实验现象分析,下列推断正确的是( )
A.可能存在NaCl
B.可能存在Na2SO4
C.一定存在FeCl3
D.一定存在Ba(NO3)2 sanles1年前1
sanles1年前1 -
 范范1314 共回答了14个问题
范范1314 共回答了14个问题 |采纳率92.9%解题思路:根据铁离子在溶液中显黄色及硫酸钡沉淀不溶于稀硝酸和物质间的化学性质进行分析,可能含有的物质是不会影响题中现象的物质.该废液为无色溶液,所以一定没有氯化铁,滴加氯化钡溶液产生沉淀,继续加稀硝酸无明显现象可知废液中一定含有硫酸根离子,即一定含有硫酸钠,而原溶液为无色溶液,无浑浊,所以废液中物质相互间不发生化学反应,故一定无硝酸钡,而氯化钠的存在与否,不影响题中的现象,故可能存在NaCl.
故选A.点评:
本题考点: 物质的鉴别、推断;盐的化学性质.
考点点评: 本题主要考查了物质的化学性质、不溶于硝酸的沉淀及有色溶液,在解题时,可根据题中现象及对应的知识确定存在或不存在的物质,对于对现象没有影响的是可能存在的物质.1年前查看全部
- 有一白色固体,可能含有CaCl2、Ba(NO3)2、Na2SO4和Na2CO3四种物质中的几种,为确定其成分,进行如下实
有一白色固体,可能含有CaCl2、Ba(NO3)2、Na2SO4和Na2CO3四种物质中的几种,为确定其成分,进行如下实验,根据实验现象推断:
(1)将白色固体用足量水充分搅拌,仍有白色不溶物沉淀,这沉淀物M中可能含什么成分,将化学式写在横线上:______.
(2)过滤后得沉淀M和滤液B,向M中加入足量稀盐酸,M全部溶解并放出气体,由此可知沉淀M中一定没有(1)中的______,原混合物中一定有______.
(3)将滤液B分成三份,向第一份中加入BaCl2溶液,无明显现象出现,说明原混合物中一定没有______,向第二份中加入稀H2SO4,有白色沉淀出现,再向第三份中加入AgNO3溶液和稀HNO3,没有白色沉淀出现,可确定原混合物中一定含有______,一定不含有______. zhanjianping1年前1
zhanjianping1年前1 -
 anna蓝 共回答了20个问题
anna蓝 共回答了20个问题 |采纳率90%解题思路:根据物质的性质进行分析,氯化钙能和硝酸钡与碳酸钠反应生成白色碳酸盐沉淀,碳酸盐遇酸化气,硝酸钡能与硫酸钠反应生成不溶于酸的沉淀.(1)将白色固体用足量水充分搅拌,仍有白色不溶物沉淀,这沉淀物M中可能是氯化钙与碳酸钠反应生成的碳酸钙,也可能是硝酸钡与碳酸钠反应生成的碳酸钡,还可能是硝酸钡与硫酸钠反应生成的硫酸钡,故填:CaCO3,BaCO3,BaSO4;
(2)向M中加入足量稀盐酸,M全部溶解并放出气体,则M中不含有硫酸钡,因为硫酸钡是不溶于酸的沉淀,生成的沉淀一定是碳酸盐沉淀,故原混合物只一定含有碳酸钠,故填:BaSO4,Na2CO3;
(3)将滤液B分成三份,向第一份中加入BaCl2溶液,无明显现象出现,说明原混合物中一定没有硫酸钠,向第二份中加入稀H2SO4,有白色沉淀出现,再向第三份中加入AgNO3溶液和稀HNO3,没有白色沉淀出现,说明混合物中不含有氯化钙,一定含有硝酸钡,故填:Na2SO4,Ba(NO3)2,CaCl2.点评:
本题考点: 物质的鉴别、推断;酸的化学性质;盐的化学性质.
考点点评: 本题考查了常见混合物成分的推断,完成此题,可以依据题干提供的信息结合物质的性质进行.1年前查看全部
- 不用其它任何试剂,下列物质①MgSO4 ②NaOH ③CuCl2 ④KCl ⑤Ba(NO3)2被鉴别
不用其它任何试剂,下列物质①MgSO4 ②NaOH ③CuCl2 ④KCl ⑤Ba(NO3)2被鉴别出来的顺序正确的是( )
A. ①②③④⑤
B. ③②①⑤④
C. ③②④⑤①
D. ④③①②⑤ 赵州土1年前1
赵州土1年前1 -
 yorkie 共回答了25个问题
yorkie 共回答了25个问题 |采纳率84%解题思路:进行物质鉴别时,不另加试剂,则首先考虑物质的颜色,然后将溶液两两混合,根据不同的实验现象(生成沉淀、生成气体、变色等)进行鉴别.③氯化铜溶液蓝色,首先鉴别出来,然后将氯化铜与其余溶液混合,出现蓝色沉淀的是②氢氧化钠溶液,故将②鉴别出来,然后将氢氧化钠溶液与剩余的三种溶液混合,生成白色沉淀的是①氢氧化镁,故将①鉴别出来,然后将硫酸镁溶液与剩余的两种溶液混合,有白色沉淀生成的是硝酸钡,将⑤鉴别出来,最后剩下的就是④KCl;观察选项,
答案:B点评:
本题考点: 酸、碱、盐的鉴别.
考点点评: 题考查了常见物质的鉴别,完成此类不加试剂进行物质鉴别的题目,首先考虑物质的颜色,然后将溶液两两混合,根据不同的实验现象进行鉴别,要求同学们熟练掌握常见物质的性质以及相互间反应的实验现象.1年前查看全部
- (2006•海淀区一模)某溶液中含有AgNO3、Cu(NO3)2、Ba(NO3)2三种溶质,用①NaCl ②N
(2006•海淀区一模)某溶液中含有AgNO3、Cu(NO3)2、Ba(NO3)2三种溶质,用①NaCl ②Na2CO3③Na2SO4溶液分别将溶液中的Ag+、Cu2+、Ba2+离子沉淀出来,其加入顺序正确的是( )
A.①②③
B.③②①
C.②③①
D.①③② rp461年前1
rp461年前1 -
 热cc店2 共回答了21个问题
热cc店2 共回答了21个问题 |采纳率85.7%解题思路:要求是分别将三种离子沉淀出来,则第一步不能选择Na2SO4是因为会得到硫酸银(硫酸银微溶于水,微容物溶解度较小也相当于沉淀),硫酸钡两种沉淀;Na2CO3同理,会得到氢氧化铜、碳酸银、碳酸钡三种沉淀(碳酸铜水解生成氢氧化铜).先加入NaCl,它与硝酸银反应,只会生成AgCl沉淀;再加入Na2SO4,它与硝酸钡反应,只会生成硫酸钡沉淀;③最后加入Na2CO3,它与硝酸铜反应只得到氢氧化铜沉淀.
故选D.点评:
本题考点: 离子或物质的共存问题.
考点点评: 本题考查了酸、碱、盐的溶解性,掌握复分解反应的条件与实质,探究分离杂质的操作步骤和方法原则.1年前查看全部
- 根据复分解反应发生的条件,判断NaOH溶液与Ba(NO3)2溶液之间是否能够发生化学反应.
根据复分解反应发生的条件,判断NaOH溶液与Ba(NO3)2溶液之间是否能够发生化学反应.
(1)请你判断NaOH溶液与Ba(NO3)2溶液之间是否能够发生化学反应?______
(2)请设计实验方案,证明你的判断.
实验室提供了蒸馏水、NaOH溶液、Ba(NO3)2溶液、H2SO4溶液、酚酞以及常用的实验仪器.
实验步骤 预期现象与结论 (1)______ ______ (2)______ ______  dodoapei1年前10
dodoapei1年前10 -
 绍兴小潘师爷 共回答了14个问题
绍兴小潘师爷 共回答了14个问题 |采纳率100%解题思路:(1)NaOH为碱,Ba(NO3)2为盐,碱和盐反应生成新碱和新盐,是复分解反应,反应发生的条件是:反应物都可溶,生成物中必须有沉淀.
(2)可以借助指示剂对反应是否发生作出判断.(1)根据溶解性表可知:NaOH、Ba(NO3)2、Ba(OH)2、NaNO3都可溶,反应中没有生成不溶的沉淀,不符合此类复分解反应发生的条件.故答:不能反应,没有气体、沉淀或水生成不符合复分解反应发生的条件;
(2)氢氧化钠能使酚酞变红,滴加硝酸钡只要红色不褪且无其它现象,则反应就未发生.
实验步骤 预期现象与结论
(1)取少量NaOH溶液于试管中,向溶液中滴加几滴酚酞试剂 溶液变红色
判断NaOH溶液显碱性
(2)然后逐滴加入Ba(NO3)2溶液 原溶液中红色没有变化,也无沉淀、气体生成
判断没有发生反应点评:
本题考点: 复分解反应及其发生的条件.
考点点评: 复分解反应是通过化合物相互交换成分而发生的反应,反应必须生成沉淀或气体或水这类难电离的物质才能进行.1年前查看全部
- 有失去标签的A、B、C、D四瓶溶液,它们的成分可能是Na2CO3、K2SO4、Ba(NO3)2、NaHSO4中的某一种,
有失去标签的A、B、C、D四瓶溶液,它们的成分可能是Na2CO3、K2SO4、Ba(NO3)2、NaHSO4中的某一种,进行下列实验:
(1)A+C→溶液①+气体①(2)B+A→溶液②+沉淀①
(3)C+B→溶液③+沉淀②(4)溶液③+沉淀①→溶液④+气体①
根据上述实验结果,写出上述过程的离子方程式:
(1)______.
(2)______.
(3)______.
(4)______. ganghz1年前1
ganghz1年前1 -
 sc2topp 共回答了26个问题
sc2topp 共回答了26个问题 |采纳率96.2%解题思路:Ba(NO3)2与其它三种物质反应均生成沉淀,则B为Ba(NO3)2,碳酸钡能溶于硫酸氢钠溶液,所以沉淀①是碳酸钡,A是Na2CO3,碳酸钠可以和NaHSO4反应生成气体二氧化碳,所以C是NaHSO4,D是K2SO4.
根据物质的性质来书写离子方程式即可.Ba(NO3)2与其它三种物质反应均生成沉淀,则B为Ba(NO3)2,碳酸钡能溶于硫酸氢钠溶液,所以沉淀①是碳酸钡,A是Na2CO3,碳酸钠可以和NaHSO4反应生成气体二氧化碳,所以C是NaHSO4,D是K2SO4.
(1)A是Na2CO3,碳酸钠可以和C:NaHSO4反应生成气体二氧化碳,即2H++CO32-═CO2↑+H2O,故答案为:2H++CO32-═CO2↑+H2O;
(2)A是Na2CO3,B为Ba(NO3)2,二者反应得到碳酸钡沉淀,即CO32-+Ba2+═BaCO3↓,故答案为:CO32-+Ba2+═BaCO3↓;
(3)B是Ba(NO3)2,C是NaHSO4,二者反应可以得到硫酸钡沉淀,即Ba2++SO42-═BaSO4↓,故答案为:Ba2++SO42-═BaSO4↓;
(4)碳酸钡能溶于硝酸溶液,沉淀①是碳酸钡,溶液③中含有硝酸,即BaCO3+2H+═Ba2++CO2↑+H2O,故答案为:BaCO3+2H+═Ba2++CO2↑+H2O.点评:
本题考点: 几组未知物的检验.
考点点评: 本题考查物质的检验和鉴别实验方案的设计,为高频考点,把握物质的性质及反应的现象为解答的关键,注意B为硝酸钡为推断的突破口,题目难度不大.1年前查看全部
- 为了除去氯化钾溶液中少量的氯化镁和硫酸镁,现从①Na2CO3 ②盐酸 ③Ba(NO3)2
为了除去氯化钾溶液中少量的氯化镁和硫酸镁,现从①Na2CO3②盐酸 ③Ba(NO3)2 ④K2CO3 ⑤Ba(OH)2 溶液中选择三种试剂进行实验.使用三种试剂的正确的操作顺序是( )
A.③④②
B.②③④
C.⑤④②
D.⑤②④ lizhengqiqq1年前1
lizhengqiqq1年前1 -
 jhtu5eytresh 共回答了18个问题
jhtu5eytresh 共回答了18个问题 |采纳率94.4%解题思路:根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.除去氯化钾溶液中少量的氯化镁和硫酸镁,实质就是除去镁离子和硫酸根离子,要除掉镁离子,可以选择含氢氧根离子的物质,形成氢氧化镁沉淀;要除掉硫酸根离子,可以选择含钡离子的物质,形成硫酸钡沉淀;所给的物质中若选用Na2CO3或Ba(NO3)2易引入新的杂质离子钠离子和硝酸根离子,故不能选用,应选稀盐酸、碳酸钾、氢氧化钡这三种溶液.
滴加试剂时,先加过量的氢氧化钡,除掉镁离子和硫酸根离子,过滤得到的滤液中含有多余的钡离子和氢氧根离子,再加过量的碳酸钾,即可除掉多余的钡离子;过滤得到的滤液中有多余的碳酸根离子和氢氧根离子,碳酸根离子和氢氧根离子与盐酸中的氢离子反应生成水和二氧化碳、水,故加适量的盐酸就可以除掉.
故正确的操作顺序是⑤④②
故选:C.点评:
本题考点: 物质除杂或净化的探究;盐的化学性质.
考点点评: 物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.1年前查看全部
- 有一固体粉末,其中可能含有Na2CO3、NaCl、Na2SO4、CuCl2、Ba(NO3)2、K2CO3、K2SO4中的
有一固体粉末,其中可能含有Na2CO3、NaCl、Na2SO4、CuCl2、Ba(NO3)2、K2CO3、K2SO4中的一种或几种,现按下列步骤进行实验.
(1)将该粉末溶于水得无色溶液和白色沉淀.
(2)在滤出的沉淀中加入稀硝酸,有部分沉淀溶解,同时产生无色气体.
(3)取滤液做焰色反应,火焰呈黄色,透过蓝色的钴玻璃观察,未见紫色火焰.
由上述现象推断:该混合物中一定含有______;一定不含有______,可能含有______. linhong5211年前1
linhong5211年前1 -
 lili215 共回答了15个问题
lili215 共回答了15个问题 |采纳率80%解题思路:根据物质的性质结合题干中的现象,通过确定存在的物质排除不能共存的物质;
依据(1)可知一定无CuCl2,一定有Ba(NO3)2;可能存在含碳酸根或硫酸根的物质;
依据(2)判断沉淀一定有硫酸钡和碳酸钡;
依据(3)确定有钠元素,一定无钾元素.(1)将该粉末溶于水得无色溶液和白色沉淀,可判断一定无CuCl2,一定有Ba(NO3)2,因为只有钡离子才可以形成沉淀,同时可能含碳酸根的化合物或含硫酸根离子的化合物;
(2)在滤出的沉淀中加入稀硝酸,有部分沉淀溶解,同时产生无色气体,说明沉淀一定有硫酸钡和碳酸钡,反应为Ba2++SO42-=BaSO4↓,Ba2++CO32-=BaCO3↓,BaCO3+2H+=Ba2++CO2↑+H2O;
(3)取滤液做焰色反应,火焰呈黄色,透过蓝色的钴玻璃观察,未见紫色火焰,说明一定有钠离子一定无钾离子,所以原混合物中一定含有Na2CO3和Na2SO4,一定不含有K2CO3和K2SO4;
综上所述:原混合物中一定含有Na2CO3 Na2SO4 Ba(NO3)2;一定不含有CuCl2 K2CO3 K2SO4;可能含有NaCl.
故答案为:Na2CO3、Na2SO4、Ba(NO3)2;CuCl2、K2CO3、K2SO4;NaCl.点评:
本题考点: 几组未知物的检验.
考点点评: 本题考查了物质检验的方法和应用,关键是依据实验现象做出判断,利用存在的物质排除不存在的物质,1年前查看全部
- 按要求写出下列有关的方程式:(1)Ba(NO3)2的电离方程式______.(2)钠和水反应的化学方程式______.(
按要求写出下列有关的方程式:
(1)Ba(NO3)2的电离方程式______.
(2)钠和水反应的化学方程式______.
(3)Al(OH)3溶于NaOH的离子方程式______.
(4)实验室制取氨气的化学方程式2NH4Cl+Ca(OH)2
CaCl2+2H2O+2NH3↑△ .2NH4Cl+Ca(OH)2.
CaCl2+2H2O+2NH3↑△ .
(5)NO2溶于水的离子方程式______. fanchao9905021年前1
fanchao9905021年前1 -
 今生你是我的爱人 共回答了9个问题
今生你是我的爱人 共回答了9个问题 |采纳率100%解题思路:(1)Ba(NO3)2为强电解质,可完全电离;
(2)钠和水反应生成氢氧化钠和氢气;
(3)Al(OH)3为两性氢氧化物,可与氢氧化钠反应生成偏铝酸钠和水;
(4)实验室用氯化铵和氢氧化钙反应制备氨气;
(5)NO2与水反应生成硝酸与NO.(1)Ba(NO3)2为强电解质,电离方程式为Ba(NO3)2=Ba2++2NO3-,故答案为:Ba(NO3)2=Ba2++2NO3-;
(2)钠和水反应生成氢氧化钠和氢气,方程式为2Na+2H2O=2NaOH+H2↑,故答案为:2Na+2H2O=2NaOH+H2↑;
(3)Al(OH)3为两性氢氧化物,可与氢氧化钠反应生成偏铝酸钠和水,反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)实验室用氯化铵和氢氧化钙反应制备氨气,反应的方程式为2NH4Cl+Ca(OH)2
△
.
CaCl2+2H2O+2NH3↑,
故答案为:2NH4Cl+Ca(OH)2
△
.
CaCl2+2H2O+2NH3↑;
(5)NO2与水反应生成硝酸与NO,反应的离子方程式为3NO2+H2O=2H++2NO3-+NO,故答案为:3NO2+H2O=2H++2NO3-+NO.点评:
本题考点: 离子方程式的书写;化学方程式的书写.
考点点评: 本题考查较为综合,涉及电离方程式、化学方程式以及离子方程式的书写,为高考常见题型和高频考点,侧重于学生的分析能力的考查与元素化合物知识的综合运用,注意把握离子的性质以及离子方程式的书写注意事项,为易错点,难度不大.1年前查看全部
- 某实验室的废液中,可能含有FeCl3、NaCl、Na2SO4、Ba(NO3)2中的一种或多种.某同学取该废液样品观察为无
某实验室的废液中,可能含有FeCl3、NaCl、Na2SO4、Ba(NO3)2中的一种或多种.某同学取该废液样品观察为无色溶液,向其中滴加BaCl2溶液产生白色沉淀,继续加稀硝酸无明显现象.根据以上实验现象分析、推断:
(1)根据溶液的物理性质就能判断出废液中一定不存在的物质是______.
(2)滴加BaCl2溶液后产生白色沉淀,写出该反应的化学方程式______.
(3)根据你的推理,可知溶液中可能存在的物质是______. 喜欢小馋猫1年前1
喜欢小馋猫1年前1 -
 fww 共回答了7个问题
fww 共回答了7个问题 |采纳率100%解题思路:(1)根据铁离子在溶液中显黄色进行分析,(2)根据滴加BaCl2溶液产生白色沉淀,继续加稀硝酸无明显现象进行分析,(3)根据(2)中知道存在硫酸钠,就不存在硝酸钡,对于氯化钠不会影响题中的现象进行分析.(1)铁离子在溶液中显黄色,而样品溶于水是无色,所以一定不存在氯化铁,故答案为:FeCl3
(2)氯化钡和硫酸钠反应生成硫酸钡沉淀和氯化钠,故答案为:Na2SO4+BaCl2=BaSO4↓+2NaCl
(3)根据(2)中知道一定存在硫酸钠,存在硫酸钠就不存在硝酸钡,对于氯化钠的存在与否,不影响题中的现象,故答案为:NaCl点评:
本题考点: 酸、碱、盐的鉴别;证明盐酸和可溶性盐酸盐;证明硫酸和可溶性硫酸盐;酸碱盐的溶解性.
考点点评: 在解此类题时,根据题中的现象确定存在或不存在的物质,对于对现象没有影响的是可能存在.1年前查看全部
- 硫酸根离子 鉴定要鉴定硫酸根离子,如果.1加Ba(NO3)2 再加足量稀HNO3 白色沉淀且不溶 那么如果有亚硫酸根或亚
硫酸根离子 鉴定
要鉴定硫酸根离子,如果.1加Ba(NO3)2 再加足量稀HNO3 白色沉淀且不溶 那么如果有亚硫酸根或亚硫酸氢根呢?
盐酸酸化再加氯化钡是不对的,如果有亚硫酸根的话 orangezt1年前1
orangezt1年前1 -
 emilechang 共回答了15个问题
emilechang 共回答了15个问题 |采纳率93.3%先加盐酸酸化然后加氯化钡溶液1年前查看全部
- BaSO3+SO2反应吗?SO2和CO2同时通入Ba(NO3)2为什么有BaSO3沉淀,可以反应消失吗
 lysxm1年前1
lysxm1年前1 -
 wacjy 共回答了16个问题
wacjy 共回答了16个问题 |采纳率100%不会有BaSO3沉淀,但是SO2溶于水生成亚硫酸呈酸性,酸性条件下SO32-会被NO3-氧化成SO42-,所以会有BaSO4沉淀1年前查看全部
- NaHSO3与Ba(NO3)2反应有沉淀吗
NaHSO3与Ba(NO3)2反应有沉淀吗
能给个准确点的答案吗? xihuan_mm1年前1
xihuan_mm1年前1 -
 mmyy369 共回答了10个问题
mmyy369 共回答了10个问题 |采纳率100%有
HSO3可以电离出少量的H+
而NO3-在酸性环境中就相当于存在硝酸,可以表现出强氧化性,从而将SO32-氧化为SO42-
而SO42-与BA2+相遇,就会得到白色沉淀1年前查看全部
- (2005•岳阳)有一包固体粉末可能由Cu(NO3)2、NH4Cl、CaCO3、K2SO4、Ba(NO3)2中的一种或几
(2005•岳阳)有一包固体粉末可能由Cu(NO3)2、NH4Cl、CaCO3、K2SO4、Ba(NO3)2中的一种或几种组成,做实验观察到以下现象:①将此固体粉末加入到足量水中,有白色沉淀出现,上层清液为无色;②过滤,在滤渣中加入稀硝酸,固体全部不溶.回答:从实验①可判断该固体粉末中一定不含______,从实验②可判断该固体粉末中一定含有______,一定不含有______.综合实验①②可知该固体粉末中可能含有______.若要探究该物质是否存在?你的方法是(简述实验操作步骤、现象和结论)______.
 kisser20051年前1
kisser20051年前1 -
 stjcb 共回答了17个问题
stjcb 共回答了17个问题 |采纳率100%解题思路:根据铜离子在溶液中显蓝色,碳酸钙难溶于水,碳酸钙会溶于酸而硫酸钡不溶于酸进行分析.将此固体粉末加入到足量水中,有白色沉淀出现,上层清液为无色,所以一定不存在硝酸铜,沉淀可能是碳酸钙,也可能是硫酸钡,在滤渣中加入稀硝酸,固体全部不溶,所以一定不存在碳酸钙,一定存在硝酸钡和硫酸钾,可能存在氯化铵,故答案为:硝酸铜,硫酸钾、硝酸钡,碳酸钙,氯化铵;
铵根离子会与碱反应放出氨气,故答案为:取样品加入氢氧化钠研磨后,会生成刺激性气味的含有氯化铵,没有刺激性气味的气体发出的不含有氯化铵.点评:
本题考点: 实验探究物质的组成成分以及含量;化学实验方案设计与评价;物质的鉴别、推断.
考点点评: 在解此类题时,首先分析需要鉴别物质的性质,然后根据题中的现象进行分析,对于现象不能确定的,需要再设计实验进行验证.1年前查看全部
- 25、A、B、C、D、E五种溶液,分别是AgNO3、Ba(NO3)2、HCl、CaCl2、Na2CO3、溶液,现分别各取
 25、A、B、C、D、E五种溶液,分别是AgNO3、Ba(NO3)2、HCl、CaCl2、Na2CO3、溶液,现分别各取少许,进行两两混合的实验,结果如下表所示,“↓”表示有沉淀生成,“-”表示无明显现象,空格表示尚未进行实验.
25、A、B、C、D、E五种溶液,分别是AgNO3、Ba(NO3)2、HCl、CaCl2、Na2CO3、溶液,现分别各取少许,进行两两混合的实验,结果如下表所示,“↓”表示有沉淀生成,“-”表示无明显现象,空格表示尚未进行实验.
据右图可推出这五种物质分别是:
A:______;B:______;C:______;D:______;E:______. yefeiyu1年前1
yefeiyu1年前1 -
 fan1976528 共回答了28个问题
fan1976528 共回答了28个问题 |采纳率92.9%解题思路:做推断题时,首先找到解题的突破口,即题眼,然后利用题眼推断出其它物质.本题的题眼是D与三种物质都不反应,所以D为硝酸钡.由图可知,D与三种物质都不反应,分析这五种物质两两混合与其他三种物质不反应的是硝酸钡,所以D为硝酸钡,与硝酸钡反应的物质是碳酸钠,所以A是碳酸钠,碳酸钠还可以与氯化钙反应,所以B为氯化钙,C与氯化钙和硝酸钡都不反应,所以C是稀盐酸,因为氯化钙与硝酸银可反应生成氯化银沉淀,故E是硝酸银;
故答案为:
Na2CO3、CaCl2、HCl、Ba(NO3)2、AgNO3点评:
本题考点: 物质的鉴别、推断.
考点点评: 本题主要考查了学生根据物质的化学性质进行分析解题的能力,关键是找到解题的突破口,然后逐一解答,难度较大.1年前查看全部
- (2011•贵阳)某探究小组的同学用H2SO4、Ba(NO3)2、NaOH、K2CO3四种溶液进行“复分解反应发生条件”
 (2011•贵阳)某探究小组的同学用H2SO4、Ba(NO3)2、NaOH、K2CO3四种溶液进行“复分解反应发生条件”及应用的实验探究.
(2011•贵阳)某探究小组的同学用H2SO4、Ba(NO3)2、NaOH、K2CO3四种溶液进行“复分解反应发生条件”及应用的实验探究.
(1)将四种溶液两两混合,其中用H2SO4与另三种溶液分别混合的现象如下:
①由于有白色沉淀生成,H2SO4与Ba(NO3)2发生了反应,反应的化学方式为______.Ba(NO3)2 NaOH K2CO3 H2SO4 白色沉淀 无明显现象 产生气体
②实验中的H2SO4与NaOH混合“无明显现象”实际上发生了化学反应,其反应过程如图所示,反应的实质是H+和OH-结合生成H2O.同理H2SO4与K2CO3发生反应的实质是______.由此同学们总结得出:复分解反应发生的条件是有沉淀或气体或水生成.
(2)若某复分解反应的生成物中有NaCl,则该反应的反应物是______ (写出两组).
(3)若将原四种溶液混合反应后过滤,其滤液经检验:溶液呈碱性且不含Ba2+、SO42-.滤液中除可以肯定存在的离子外,设计实验证明还可能存在的离子______. shengcong81年前1
shengcong81年前1 -
 geisha1975 共回答了25个问题
geisha1975 共回答了25个问题 |采纳率92%解题思路:(1)①根据书写化学方程式的步骤:写、配、注、等,正确书写化学方程式;
②根据复分解反应的本质是溶液中的离子结合成带电离的物质、难溶的物质或挥发性气体,而使复分解反应趋于完成,进行解答;
(2)根据复分解反应的实质是:反应的两种物质在水溶液中相互交换离子,结合成难电离的物质----沉淀、气体、水,进行解答;
(3)根据碱的性质与碳酸根的检验方法,进行设计检验方法.:(1)
①根据书写化学方程式的步骤:写、配、注、等,反应的化学方式为为:H2SO4+Ba(NO3)2=BaSO4↓+2HNO3 ;
②据复分解反应的本质可知:H2SO4与K2CO3发生反应的实质是,H+和CO32-结合生成H2CO3,H2CO3不稳定分解放出二氧化碳;
(2)根据复分解反应的实质,可得反应的反应物是:NaOH和HCl,Na2CO3和HCl;
(3)根据碱的性质与碳酸根的检验方法:
①取滤液少量,加入BaCl2溶液,无沉淀产生,再滴入几滴酚酞试液,溶液变红色,则证明溶液中还有OH-;
②取滤液少量,加入足量BaCl2溶液,有白色沉淀产生,再取上层清液滴入酚酞试液,若溶液不变色,则证明溶液中还含有CO32-;若溶液变为红色,则证明溶液中同时还有CO32-、OH-;
故答案为:(1)①H2SO4+Ba(NO3)2=BaSO4↓+2HNO3 ;
②H+和CO32-结合生成H2CO3,H2CO3不稳定分解放出二氧化碳;
(2)NaOH和HCl,Na2CO3和HCl
(3)取滤液少量,加入BaCl2溶液,无沉淀产生,再滴入几滴酚酞试液,溶液变红色,则证明溶液中还有OH-.取滤液少量,加入足量BaCl2溶液,有白色沉淀产生,再取上层清液滴入酚酞试液,若溶液不变色,则证明溶液中还含有CO32-.若溶液变为红色,则证明溶液中同时还有CO32-、OH-.点评:
本题考点: 复分解反应的条件与实质;证明碳酸盐;书写化学方程式、文字表达式、电离方程式.
考点点评: 要理解和熟记复分解反应的条件与实质,熟记常见酸、碱、盐的溶解性表,并能正确地运用物质的溶解性,方能顺利解题.1年前查看全部
- 某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或两种.现将6.9g样品溶于足量水中,得到
某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或两种.现将6.9g样品溶于足量水中,得到澄清溶液.若再加入过量的CaCl2溶液,得到4.5g沉淀,对样品所含杂质的正确判断是( )
A.肯定有KNO3和Na2CO3,没有Ba(NO3)2
B.肯定有KNO3,没有Ba(NO3)2,可能有Na2CO3
C.肯定没有Na2CO3和Ba(NO3)2,可能有KNO3
D.无法判断 风轻云淡月1年前2
风轻云淡月1年前2 -
 zjh779 共回答了17个问题
zjh779 共回答了17个问题 |采纳率88.2%将6.9g样品溶于足量水中,得到澄清溶液---肯定没有Ba(NO3)2
再加入过量的CaCl2溶液,得到4.5g沉淀---即CaCO3,
用极端法,CaCO3------K2CO3-------Na2CO3
若都是K2CO3,则需要6.21g
若都是Na2CO3,则需要4.77g
现在,6.9g,即必有KNO3,可能有Na2CO3
即B1年前查看全部
- 答案已经知道了就是想问下步骤1能把bacl2换成ba(no3)2吗,还有步骤3为什么还要加hno3检验?
 veq7a1年前2
veq7a1年前2 -
 rr军勇 共回答了15个问题
rr军勇 共回答了15个问题 |采纳率93.3%步骤1能把bacl2换成ba(no3)2吗,氯气通入B装置,溶液会显酸性,而在酸性环境下的硝酸盐又强氧化性,会把另一部分亚硫酸根也氧化为硫酸根,所以不可以换
还有步骤3为什么还要加hno3检验?硝酸酸化的硝酸银溶液是检验氯离子的固定搭配,中学阶段只要知道是为了排除一些干扰离子iu可以了1年前查看全部
- (2013•保山)有一包白色粉末.可能含有Ba(NO3)2,Na2SO4,Na2CO3,NaNO3中的一种或几种,某同学
(2013•保山)有一包白色粉末.可能含有Ba(NO3)2,Na2SO4,Na2CO3,NaNO3中的一种或几种,某同学分析其成分做了如下实验.该同学分析正确是( )
实验步骤 1 2 实验操作 取样加足量水,充分振荡,静置 过滤后,往滤渣中加过量稀盐酸 实验现象 有白色沉淀产生 沉淀部分溶解
A.该包白色粉末中一定含有Ba(NO3)2、Na2SO4、Na2CO3、NaNO3
B.该包白色粉末中一定含有Ba(NO3)2、Na2CO3可能含有Na2SO4
C.该包白色粉末中一定含有Ba(NO3)2、Na2SO4可能含有NaNO3、Na2CO3
D.该包白色粉末中一定含有Ba(NO3)2、Na2SO4、Na2CO3可能含有NaNO3 cj11221年前1
cj11221年前1 -
 砸oo我也不说 共回答了18个问题
砸oo我也不说 共回答了18个问题 |采纳率94.4%解题思路:Ba(NO3)2,Na2SO4,Na2CO3,NaNO3中混合能够产生沉淀的是Ba(NO3)2和Na2SO4或Na2CO3的反应,且硫酸钡不溶于盐酸碳酸钡能够溶于盐酸据此分析解答;由于Ba(NO3)2,Na2SO4,Na2CO3,NaNO3中混合能够产生沉淀的是Ba(NO3)2和Na2SO4或Na2CO3的反应,且硫酸钡不溶于盐酸碳酸钡能够溶于盐酸,所以由步骤1可知该固体中含有能够生成沉淀的物质,而从步骤2可知生成的白色沉淀有能溶解与盐酸的也有不溶于盐酸的,故可知该固体中一定含有Ba(NO3)2、Na2SO4和Na2CO3,而硝酸钠是否含有无法判断;
故选D点评:
本题考点: 物质的鉴别、推断;盐的化学性质.
考点点评: 此类问题解决思路一般为:根据物质的性质及物质间可能发生的反应及反应时出现的现象,结合实验中所出现的现象,分析并判断混合物的组成.1年前查看全部
- NA表示阿伏加德罗常数的值,下列关于0.2mol•L-1的Ba(NO3)2溶液的说法不正确的是( )
NA表示阿伏加德罗常数的值,下列关于0.2mol•L-1的Ba(NO3)2溶液的说法不正确的是( )
A. 2L溶液中有阴、阳离子总数为1.2NA
B. 500mL溶液中NO3-浓度为0.2mol•L-1
C. 500mL溶液中Ba2+浓度为0.2mol•L-1
D. 500mL溶液中NO3-总数为0.2NA ywzhujianjun1年前1
ywzhujianjun1年前1 -
 cc123 共回答了24个问题
cc123 共回答了24个问题 |采纳率91.7%解题思路:A、根据N=化学式中阴阳离子个数×c(Ba(NO3)2)•V•NA计算;
B、根据溶液中离子的物质的量浓度=化学式中离子个数×溶液的物质的量浓度计算;
C、根据溶液中离子的物质的量浓度=化学式中离子个数×溶液的物质的量浓度计算;
D、根据n(NO3-)=2c(Ba(NO3)2)V计算.A、N(阴阳离子数)=3×c(Ba(NO3)2)2V NA=3×0.2mol/L×2L×NA=1.2NA,故A正确;
B、0.2mol•L-1的Ba(NO3)2溶液中:c(NO3-)=2×c[Ba(NO3)2)]=2×0.2mol/L=0.4mol/L,故B错误;
C、c(Ba2+)=1×c(Ba(NO3)2)=1×0.2mol/L=0.2mol/L,故C正确;
D、n(NO3-)=2 c(Ba(NO3)2)V=2×0.2mol/L×0.5L=0.2mol,NO3-总数为0.2NA,故D正确;
故选B.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查了有关物质的量浓度的计算,题目难度不大,注意掌握物质的量浓度的概念及计算方法,明确化学式与离子的关系是解本题的关键.1年前查看全部
- A、B、C、D分别是Ba(NO3)2、Na2CO3、MgCl2和H2SO4中的各一种溶液.如图标明了它们之间两两相混的现
 A、B、C、D分别是Ba(NO3)2、Na2CO3、MgCl2和H2SO4中的各一种溶液.如图标明了它们之间两两相混的现象,根据以上实验事实可知:
A、B、C、D分别是Ba(NO3)2、Na2CO3、MgCl2和H2SO4中的各一种溶液.如图标明了它们之间两两相混的现象,根据以上实验事实可知:
A为______,B为______,C为______,D为______. sa_gill1年前1
sa_gill1年前1 -
 ycyzl 共回答了27个问题
ycyzl 共回答了27个问题 |采纳率88.9%解题思路:本题属于推断题,根据题中给出的现象和信息可知:B和C反应有气泡产生,可知B、C是碳酸钠和硫酸中的一个,B与A、D都有白色沉淀,可以确定B是碳酸钠,C是硫酸,而硫酸与硝酸钡反应生成白色的硫酸钡沉淀和硝酸,所以A是硝酸钡,剩余的D是氯化镁.B和C反应有气泡产生,可知B、C是碳酸钠和硫酸中的一个,B又会与A、D都有白色沉淀,可以确定B是碳酸钠,所以C就是硫酸,而硫酸与硝酸钡反应生成白色的硫酸钡沉淀和硝酸,所以A是硝酸钡,则D就是氯化镁.
故答案为:Ba(NO3)2;Na2CO3;H2SO4;MgCl2.点评:
本题考点: 物质的鉴别、推断;酸的化学性质;盐的化学性质.
考点点评: 本题主要考查了依据物质之间的反应现象进行物质的推断,只要通过对实验方法和过程的探究,在比较鉴别的基础上,就能得出正确的结论.1年前查看全部
- 有一包白色固体,可能由:CuSO4、Na2SO4、Na2CO3、Ba(NO3)2、NaCl 中的一种或几种组成
有一包白色固体,可能由:CuSO4、Na2SO4、Na2CO3、Ba(NO3)2、NaCl 中的一种或几种组成.为了判断其中的成份,某同学设计了如下实验方案,并进行了实验现象的假设,请你帮助他对这些假设作一些判断:
实验步骤 实验现象 判断 取固体
溶于水①若只得到蓝色溶液 一定没有______. ②若有白色沉淀,静置,上层溶液无色 一定没有______. 取②的混
合物过滤③在沉淀中加入盐酸,沉淀部分溶解;过滤,在滤液中加入AgNO3溶液和稀硝酸,有白色沉淀 一定含有______,
沉淀中加入盐酸的离子方程式:
______.
能否确定原固体中是否含有NaCl,并说明理由
______. dsyyy1年前1
dsyyy1年前1 -
 e119jj 共回答了21个问题
e119jj 共回答了21个问题 |采纳率90.5%解题思路:①若只得到蓝色溶液,说明固体中含有CuSO4,根据离子共存问题分析;
②若有白色沉淀,静置,上层溶液无色,则固体中不含有CuSO4,该白色沉淀可能为BaSO4或BaCO3,
③在沉淀中加入盐酸,沉淀部分溶解则说明固体中含有Na2CO3、Na2SO4和,Ba(NO3)2;
过滤,在滤液中加入AgNO3溶液和稀硝酸,有白色沉淀,该沉淀为AgCl,但不能确定是否含有Cl-,因为前面加入了盐酸引入了Cl-.①若只得到蓝色溶液,说明固体中含有CuSO4,溶液中含有Cu2+、SO42-,则一定不含有Ba(NO3)2、Na2CO3,因与Cu2+、SO42-分别反应生成沉淀;
②若有白色沉淀,静置,上层溶液无色,则固体中不含有CuSO4,该白色沉淀可能为BaSO4或BaCO3;
③在沉淀中加入盐酸,沉淀部分溶解则说明固体中含有Na2CO3、Na2SO4和Ba(NO3)2,生成的BaCO3能溶于盐酸,
反应的离子方程式为BaCO3+2H+=Ba2++CO2↑+H2O,
过滤,在滤液中加入AgNO3溶液和稀硝酸,有白色沉淀,该沉淀为AgCl,
但不能确定是否含有Cl-,因为前面加入了盐酸引入了Cl-.
故答案为:
实验步骤 实验现象 判断
取固体
溶于水 ①若只得到蓝色溶液 一定没有Ba(NO3)2、Na2CO3.
②若有白色沉淀,静置,上层溶液无色 一定没有CuSO4.
取②的混
合物过滤 ③在沉淀中加入盐酸,沉淀部分溶解;过滤,在滤液中加入AgNO3溶液和稀硝酸,有白色沉淀 一定含有Na2CO3、Na2SO4、Ba(NO3)2;
BaCO3+2H+=Ba2++CO2↑+H2O
不能确定,因为前面加入了盐酸引入了Cl-.点评:
本题考点: 常见离子的检验方法.
考点点评: 本题考查离子的检验,题目难度不大,注意通过反应的现象结合离子的性质进行推断,要排除实验操作的干扰.1年前查看全部
- 一未知溶液加入Ba(NO3)2后产生白色沉淀,加入稀HCl后任然有白色沉淀.溶液中可能含有什么离子?
 po09iu091年前1
po09iu091年前1 -
 涛涛套套套 共回答了12个问题
涛涛套套套 共回答了12个问题 |采纳率75%硫酸根离子 或者亚硫酸根离子1年前查看全部
- 关于高中离子反应中的氧化还原我最近发现离子反应的题中关于共存问题很多涉及到氧化还原反应,比如HCL和Ba(NO3)2不能
关于高中离子反应中的氧化还原
我最近发现离子反应的题中关于共存问题很多涉及到氧化还原反应,比如HCL和Ba(NO3)2不能共存因为HNO3会与CL-发生氧化还原,关于这类题目很难想到啊,怎么学呢?有相关总结吗? chastemoon1年前1
chastemoon1年前1 -
 feng51264 共回答了30个问题
feng51264 共回答了30个问题 |采纳率93.3%其实这类题目,楼主能判断出来有离子反应存在的话,建议按离子考虑而不要按照物质化学式考虑题目.遇到化学式,就把它按照溶解后相应的离子来考虑问题,这样条理容易清晰一些.
另外,最好总结一下常见有氧化性离子的氧化能力大小顺序,还原性离子的还原能力大小顺序进行比较,这是这一类题目的不二方法.
当然,有个别有氧化能力出现变化的离子,不过高中的一般只有NO3-,SO42—,这两种受到H+浓度的影响,这一类题目注意就行了.1年前查看全部
- 下述说法中合理的是( )A.SO2通入Ba(NO3)2溶液中得到BaSO3沉淀B.Cl2和SO2等体积充分混合后,通入
下述说法中合理的是( )
A.SO2通入Ba(NO3)2溶液中得到BaSO3沉淀
B.Cl2和SO2等体积充分混合后,通入品红溶液,品红褪色速率更快
C.NO2和SO2都是形成酸雨的气体
D.某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的CO2 影子女人1年前1
影子女人1年前1 -
 九月候鸟 共回答了19个问题
九月候鸟 共回答了19个问题 |采纳率94.7%解题思路:A.SO2通入Ba(NO3)2溶液中发生氧化还原反应;
B.Cl2和SO2等体积充分混合,发生氧化还原反应生成硫酸和HCl;
C.NO2和SO2都与水反应,使雨水酸性增强;
D.水中溶解了较多的CO2,为正常雨水,pH约为5.6.A.SO2通入Ba(NO3)2溶液中发生氧化还原反应,则生成硫酸钡沉淀,故A错误;
B.Cl2和SO2等体积充分混合,发生氧化还原反应生成硫酸和HCl,不具有漂白性,品红溶液不褪色,故B错误;
C.NO2和SO2都与水反应,使雨水酸性增强,则NO2和SO2都是形成酸雨的气体,故C正确;
D.水中溶解了较多的CO2,为正常雨水,pH约为5.6,则雨水样品采集后放置一段时间,pH由4.68变为4.28,可能溶解了二氧化硫或二氧化氮,故D错误;
故选C.点评:
本题考点: 二氧化硫的化学性质;氯气的化学性质;氮的氧化物的性质及其对环境的影响.
考点点评: 本题考查二氧化硫的性质,为高频考点,把握发生的反应及酸雨的形成为解答的关键,注意二氧化硫的还原性、漂白性,选项A为易错点,题目难度中等.1年前查看全部
- 以下六种饱和溶液①Ba(NO3)2②Ca(OH)2③Na2SiO3④NaAlO2⑤Na2CO3⑥NH3和NaCl,分别持
以下六种饱和溶液①Ba(NO3)2②Ca(OH)2③Na2SiO3④NaAlO2⑤Na2CO3⑥NH3和NaCl,分别持续通入CO2,最终得到沉淀或析出晶体的是( )
A.①③④⑥
B.②③④⑥
C.③④⑤⑥
D.②③④⑤ jingjingqian1年前1
jingjingqian1年前1 -
 蔷薇墙头 共回答了25个问题
蔷薇墙头 共回答了25个问题 |采纳率84%解题思路:①碳酸比硝酸弱,与硝酸钡不反应;
②酸性氧化物能与碱反应,过量的CO2与Ca(OH)2 反应:Ca(OH)2+2CO2═Ca(HCO3)2;
③碳酸比硅酸强,过量的CO2与Na2SiO3溶液反应生成硅酸沉淀;
④NaAlO2溶液通入过量的二氧化碳,可生成氢氧化铝沉淀;
⑤过量的CO2通入饱和Na2CO3溶液中发生反应生成碳酸氢钠;
⑥可生成碳酸氢钠和氯化铵,为侯氏制碱法原理.①碳酸比硝酸弱,二氧化碳与Ba(NO3)2溶液不反应,没有沉淀生成,故①错误;
②酸性氧化物能与碱反应,过量的CO2与Ca(OH)2 反应:Ca(OH)2+2CO2═Ca(HCO3)2,无沉淀生成,故②错误;
③碳酸比硅酸强,过量的CO2与Na2SiO3溶液反应:2CO2+Na2SiO3+2H2O═2NaHCO3+H2SiO3↓,产生硅酸沉淀,故③正确;
④NaAlO2溶液通入过量的二氧化碳,由于碳酸酸性比氢氧化铝强,所以生成氢氧化铝白色沉淀和碳酸氢钠,2H2O+NaAlO2+CO2=Al(OH)3↓+NaHCO3,故④正确;
⑤过量的CO2通入饱和Na2CO3溶液中发生反应:Na2CO3+H2O+CO2═2NaHCO3↓,因为碳酸氢钠溶解度比碳酸钠小,所以有NaHCO3晶体析出,故⑤正确;
⑥反应发生NH3+CO2+NaCl+H2O=NaHCO3↓+NH4Cl,所以有NaHCO3晶体析出,故⑥正确.
故选C.点评:
本题考点: 钠的重要化合物;镁、铝的重要化合物.
考点点评: 本题考查了元素及其化合物的性质等,为高考常见题型,侧重于元素化合物知识的综合理解和运用的考查,比较基础,注意基础知识的掌握,难度不大.1年前查看全部
- 某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或两种.现将13.8g样品溶于足量水中,得
某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或两种.现将13.8g样品溶于足量水中,得到澄
清溶液.若再加入过量的CaCl2溶液,得到9g沉淀,对样品所含杂质的正确判断是( )
A.肯定有KNO3 B.肯定Na2CO3 C 可能有Ba(NO3)2 D.可能有Na2CO3,KNO3 d 为什么 我为师狂1年前1
我为师狂1年前1 -
 也轩 共回答了17个问题
也轩 共回答了17个问题 |采纳率82.4%样品溶于足量水中,得到澄清溶液.肯定没有Ba(NO3)2
如果13.8g全部是碳酸钾,加入过量的CaCl2溶液,则可得到10g沉淀,大于9g,所以肯定有KNO3 .也可能有Na2CO3和KNO3 ,因为等质量的碳酸钠与氯化钙反应生成的沉淀更多.1年前查看全部
- 加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸后沉淀不溶解时,可确定有硫酸根存在.为什么不对.
加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸后沉淀不溶解时,可确定有硫酸根存在.为什么不对.
盐酸也会和碳酸钡亚硫酸钡反应的把. 优优天使1年前1
优优天使1年前1 -
 feather3101 共回答了16个问题
feather3101 共回答了16个问题 |采纳率81.3%加盐酸后相当于溶液里有硝酸,硝酸有强氧化性可以把溶液中的亚硫酸根氧化成硫酸很离子,这样沉淀就不会溶解,所以不能确定有硫酸根离子.求给分1年前查看全部
- 有一包白色粉末,其中可能含有Ba(NO3)2、NaCl、K2CO3、Na2SO4.现做以下实验:①将部分粉末加入水中,振
 cinderella951年前1
cinderella951年前1 -
 snowstorm 共回答了18个问题
snowstorm 共回答了18个问题 |采纳率88.9%(1)Ba(NO3)2,NaCl,K2CO3
(2)①BaCO3+2HNO3=Ba(NO3)2+H2O+CO2
③Ba(NO3)2+H2SO4=BaSO4+2HNO3
解析:溶解后有白色沉淀产生,而原粉末中并无不溶物,就是反应生成的沉淀,所给盐中阳离子只有钡离子可以产生沉淀,所以由①可得粉末中一定有Ba(NO)2,加入硝酸沉淀全部溶解并产生气体,所以由②得粉末中一定不含Na2SO4一定含K2CO3,加入硝酸银产生沉淀说明粉末中含氯离子,由③得一定含NaCl.1年前查看全部
- 某化工厂排出的废水中含有AgNO3、Ba(NO3)2、Cu(NO3)2重金属盐,已知白色的Fe(OH)2固体在潮湿的空气
某化工厂排出的废水中含有AgNO3、Ba(NO3)2、Cu(NO3)2重金属盐,已知白色的Fe(OH)2固体在潮湿的空气中的水、氧气反应可生成红褐色的Fe(OH)3,某同学设计了一个除去废水中重金属离子的实验方案如下:
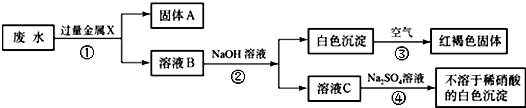
(1)固体A中一定含有的物质为______(写化学式).
(2)B溶液中的溶质一定含有______(写化学式).
(3)请写出③、④的化学方程式:______、______. 水ww泉1年前1
水ww泉1年前1 -
 yetta2008 共回答了25个问题
yetta2008 共回答了25个问题 |采纳率84%解题思路:由题中的框图可知:已知红褐色固体是氢氧化铁,可知X是金属铁,铁把银、铜置换出来,故固体A为Ag、Cu、Fe;又由于加入过量的铁和出现的白色沉淀,所以B溶液中一定有Fe(NO3)2和Ba(NO3)2.书写化学方程式时要注意配平和沉淀符号.(1)由题中的图知:废水加过量固体X,然后向滤液中加氢氧化钠,产生白色沉淀又变成红褐色沉淀,由题中信息知白色沉淀是氢氧化亚铁,红褐色沉淀是氢氧化铁;可知金属X是铁,废水中含有银离子、钡离子和铜离子,铁可将银离子和铜离子置换出来,还有过量的铁,所以固体A中一定含有Fe、Ag和Cu;
(2)溶液中含有没参加反应的硝酸钡和生成的硝酸亚铁,硝酸铜和硝酸银完全被过量的铁置换出来,所以B溶液中的溶质一定含有Fe(NO3)2、Ba(NO3)2;
(3)反应③是白色的Fe(OH)2固体在潮湿的空气中的水、氧气反应可生成红褐色的Fe(OH)3,因此反应的方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
溶液C为Ba(NO3)2,加入硫酸钠发生反应的方程式为:Ba(NO3)2+Na2SO4=BaSO4↓+2NaNO3.
故答案为:(1)Fe、Cu、Ag;(2)Ba(NO3)2、Fe(NO3)2;(3)4Fe(OH)2+O2+2H2O=4Fe(OH)3;Na2SO4+Ba(NO3)2=BaSO4↓+2NaNO3 .点评:
本题考点: 物质的鉴别、推断;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 此题为框图式物质推断题,完成此类题目,关键是找准解题突破口,直接得出结论,然后利用顺向或逆向或两边向中间推,逐一导出其他结论.1年前查看全部
大家在问
- 1孔孟之说 什么意思?
- 2设函数f(x)定义在实数集上,f(2-x)=f(x),且当x大于等于1时,f(x)=lnx,则有
- 3小明和小芳共集邮票576枚邮票,小明的邮票数是小芳的五分之四.他们两人各集邮票多少枚?(列方程解)
- 4the second
- 5看书,第1天看书的九分之二,第2天看书的七分之二,剩下的平均4天看完,平均每天看这本书的几分之几?
- 6计算:12.34+23.45+34.56+45.67+56.78+67.89+78.91+89.12+91.23.
- 7帮忙翻译下我想我有一段时间都不能去你那里了.我没有选择,我得工作.前两次我都想打电话告诉你的.我希望我不是个让你失望的人
- 8帮我选择1 --Have you ever eaten fish ---Yes,we____A.had B.have n
- 9阅读下面的文字,完成1~2题。 玩笑
- 10各种气体中的声速是否相同
- 11(2008•佛山一模)蟑螂喜好在夜间出来活动.科学家把蟑螂放在实验室里,人为地将实验室的白天和黑夜加以颠倒,大约经过一个
- 12英语21.-Will somebody go and get Dr White?
- 13把(m-n)当做一个整体,合并(m-n)的二次方+2(m-n)-三分之一(n-m)的二次方减3m+3n=______
- 14小强,小刚和小明三人读同一篇文章,小强用了2/15小时,小刚用了1/6小时,小明用了0.2小时,﹙﹚的速度最快
- 15非洲最高的山为______,海拔______米.非洲最大的湖泊是______.
