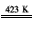晶体硅是不是单质硅?
 zfj252022-10-04 11:39:542条回答
zfj252022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 劳文 共回答了19个问题
劳文 共回答了19个问题 |采纳率84.2%- 是,晶体都是纯净物
- 1年前
 ygp12 共回答了9539个问题
ygp12 共回答了9539个问题 |采纳率0.2%- 单质硅
- 1年前
相关推荐
- 晶体硅太阳电池制备的基本工艺?
 蓝水凌1年前1
蓝水凌1年前1 -
 johson4467 共回答了24个问题
johson4467 共回答了24个问题 |采纳率95.8%太阳能电池片的生产工艺流程分为硅片检测——表面制绒——扩散制结——去磷硅玻璃——等离子刻蚀——镀减反射膜——丝网印刷——快速烧结等.具体介绍如下: 一、硅片检测 硅片是太阳能电池片的载体,硅片质量...1年前查看全部
- 下列物质中NaCl、NaOH、Na2O2、H2O2、(NH4)2S、CO2、CCl4、C2H2、SiO2、SiC、晶体硅
下列物质中NaCl、NaOH、Na2O2、H2O2、(NH4)2S、CO2、CCl4、C2H2、SiO2、SiC、晶体硅、金刚石.
25.下列物质中:NaCl、NaOH、Na2O2、H2O2、(NH4)2S、CO2、CCl4、C2H2、SiO2、SiC、晶体硅、金刚石.
(1)其中只含有离子键的离子化合物是
(2)其中既含有离子键又含有极性共价键的离子晶体是
(3)其中既含有离子键又含有非极性共价键和配位键的离子晶体是
(4)其中既含有离子键又含有非极性共价键的是
(5)其中只含有极性共价键的非极性分子的是
(6)其中含有非极性共价键和极性共价键的非极性分子的是
(7)其中含有非极性共价键和极性共价键的极性分子是 桃子小公主1年前2
桃子小公主1年前2 -
 mmorange 共回答了19个问题
mmorange 共回答了19个问题 |采纳率73.7%1、NaCl
2、NaOH(氢氧键)、(NH4)2S(氮氢键)
3、
4、Na2O2(过氧键)
5、CCl4
6、C2H2
7、H2O21年前查看全部
- 现有九种物质:①干冰;②金刚石;③晶体硫;④晶体硅;⑤过氧化钠;⑥二氧化硅晶体;⑦溴化铵;⑧氖;⑨金属铜 请用
现有九种物质:①干冰;②金刚石;③晶体硫;④晶体硅;⑤过氧化钠;⑥二氧化硅晶体;⑦溴化铵;⑧氖;⑨金属铜 请用编号填写下列空白:
(1)通过非极性键形成原子晶体的是______;熔点最高的晶体是______;属于分子晶体,且分子为直线型的是______;由单原子分子构成的分子晶体的是______;含有非极性键的离子化合物的是______;能导电且为金属晶体的是______.
(2)有下列分子:①CCl4②NO2③SO3④BF3⑤NH3其中属于非极性分子的是______,分子的VSEPR模型为平面三角形的是______,属于分子的立体构型为三角锥形的是______.
(3)在相同条件下,SO2在水中的溶解度和CO2在水中的溶解度相比,SO2的溶解度大,请从分子性质的角度阐述理由______
(4)有下列四种无机含氧酸:①H3PO4②HClO③H3BO3④HNO2根据无机含氧酸的酸性规律,将四种无机含氧酸按酸性相近两两组成一组,它们是______,______. wenchsh1年前1
wenchsh1年前1 -
 皎洁的月 共回答了19个问题
皎洁的月 共回答了19个问题 |采纳率94.7%解题思路:(1)②金刚石和④晶体硅是通过非极性键形成的原子晶体;②金刚石是熔点最高的晶体;①干冰是直线型分子,属于分子晶体;⑧氖是由单原子分子构成的分子晶体;⑤过氧化钠是含有非极性键的离子化合物;⑨金属铜是能导电的金属晶体;
(2)①CCl4③SO3④BF3是非极性分子,③SO3④BF3为平面三角形分子,⑤NH3为三角锥形分子;
(3)根据相似相溶原理进行判断;
(4)①H3PO4 和④HNO2都是中强酸;②HClO和③H3BO3都是弱酸.(1)②金刚石和④晶体硅是通过非极性键形成的原子晶体;②金刚石是熔点最高的晶体;①干冰是直线型分子,属于分子晶体;⑧氖是由单原子分子构成的分子晶体;⑤过氧化钠是含有非极性键的离子化合物;⑨金属铜是能导电的金属晶体;
故答案为:(1)②④,②,①,⑧;⑤,⑨;
(2)①CCl4③SO3④BF3是非极性分子,③SO3④BF3为平面三角形分子,⑤NH3为三角锥形分子;
故答案为:①③④,③④,⑤;
(3)SO2是极性分子,CO2是非极性分子,水是极性分子,根据相似相溶原理,SO2在水中的溶解度比CO2的大,
故答案为:SO2是极性分子,CO2是非极性分子,水是极性分子,根据相似相溶原理,SO2在水中的溶解度比CO2的大;
(4)①H3PO4 和④HNO2都是中强酸;②HClO和③H3BO3都是弱酸,
故答案为:①和④,②和③.点评:
本题考点: 原子晶体;判断简单分子或离子的构型;分子晶体;金属晶体;极性键和非极性键;极性分子和非极性分子.
考点点评: 本题考查晶体类型、空间构型、相似相溶原理以及酸性判断,综合性较强,难度中等.1年前查看全部
- 1摩尔晶体硅什么东西,晶体硅不是原子晶体吗?1摩尔晶体硅有多少个硅原子
 songzhuo4097171年前1
songzhuo4097171年前1 -
 飛沙 共回答了17个问题
飛沙 共回答了17个问题 |采纳率76.5%晶体硅是原子晶体
1摩尔晶体硅就是1摩尔硅原子
n=1*NA=NA(个)
NA是阿夫加德罗常数1年前查看全部
- 晶体硅(Si)是一种重要的半导体材料.冶炼硅时常用碳在高温下还原二氧化硅制得粗硅,反应的化学方程式是:SiO2+2C
晶体硅(Si)是一种重要的半导体材料.冶炼硅时常用碳在高温下还原二氧化硅制得粗硅,反应的化学方程式是:SiO2+2C
Si+2CO↑现要制备含硅21kg的粗硅,理论上需要二氧化硅的质量是多少?高温 . betasun1年前1
betasun1年前1 -
 兼白 共回答了14个问题
兼白 共回答了14个问题 |采纳率92.9%解题思路:由粗硅的质量根据化学方程式可以计算出需要二氧化硅的质量即可;设理论上需要二氧化硅的质量为x.
SiO2+2C
高温
.
Si+2CO↑
6028
x 21 kg
[60/x=
28
21kg]
x=45kg
答:理论上需要二氧化硅的质量为45kg.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题属于根据化学方程式的基本计算,解答时要注意化学方程式的完整性以及计算结果的准确性.1年前查看全部
- ①金刚石 ②NaF ③HCl ④晶体硅 ⑤KF ⑥Hg ⑦KCl ⑧HBr ⑨HI ⑩H2,其熔点由低到高的顺序是
①金刚石 ②NaF ③HCl ④晶体硅 ⑤KF ⑥Hg ⑦KCl ⑧HBr ⑨HI ⑩H2,其熔点由低到高的顺序是
金刚石是原子晶体,熔沸点很高,怎么可能排在第一 jayappli36961年前1
jayappli36961年前1 -
 不解释哈 共回答了20个问题
不解释哈 共回答了20个问题 |采纳率95%10 3 8 9 6 7 5 2 4 11年前查看全部
- 晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:①高温下用过量的碳还原二氧化硅制得粗硅,同时
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:①高温下用过量的碳还原二氧化硅制得粗硅,同时
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用过量的碳还原二氧化硅制得粗硅,同时得到一种可燃性气态;
②粗硅与干燥的HCl气体反应制得SiHCl3(Si+3HCl=SiHCl3+H2)
③SiHCl3与过量的H2在1000℃~1100℃反应制得纯硅,已知SiHCl3能与水强烈反应,在空气中易自燃.请回答:
(1)第一步制取轨的化学方程式______.
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃),提纯SiHCl3可采用______的方法.
(3)实验室用SiHCl3与过量的H2反应制取纯硅装置如图所示(加热和夹持装置略去):
①装置B中的试剂是______,装置C需水浴加热,目的是______.
②反应一段时间后,装置D中可观察到有晶体硅生成,装置D不能采用普通玻璃管的原因是______,D中发生的反应的化学方程式是______.
③为保证实验的成功,操作的关键除题中已告知的之外,你认为最重要的还有:______,______.(答出两点)
 a123lm1年前1
a123lm1年前1 -
 7tcfiws 共回答了21个问题
7tcfiws 共回答了21个问题 |采纳率90.5%(1)高温下,碳做还原剂时,生成CO,即2C+SiO2═2CO+Si.故答案为:2C+SiO2═2CO+Si
(2)利用沸点的不同提纯SiHCl3属于蒸馏,故答案为:蒸馏
(3)浓硫酸是常用的干燥剂,装置C需水浴加热,目的是使SiHCl3气化,与氢气反应;SiHCl3与过量的H2在1000℃~1100℃反应制得纯硅,温度太高,普通玻璃管易熔化;保证实验成功的关键是:装置要严密;控制好温度等;书写化学方程式时,要注意配平.故答案为:①浓硫酸;使SiHCl3气化,与氢气反应;②SiHCl3与过量的H2在1000℃~1100℃反应制得纯硅,温度太高,普通玻璃管易熔化;SiHCl3+H2=Si+3HCl;③装置要严密;控制好温度.1年前查看全部
- 下列有关硅和硅的化合物的用途错误的是( ) A.硅单质作耐火材料 B.晶体硅作半导体材料 C.二氧化硅作光导纤维材料
下列有关硅和硅的化合物的用途错误的是( ) A.硅单质作耐火材料 B.晶体硅作半导体材料 C.二氧化硅作光导纤维材料 D.高纯硅作计算机芯片材料  derek_li1年前1
derek_li1年前1 -
 牛哥下海南 共回答了13个问题
牛哥下海南 共回答了13个问题 |采纳率92.3%A.硅单质在加热条件下能与氧气反应,故A错误;
B.硅单质是半导体材料,故B正确;
C.二氧化硅是光导纤维的原料,故C正确;
D.高纯硅可以作计算机芯片材料,故D正确.
故选A.1年前查看全部
- 晶体硅晶胞中有多少个原子
 仑仑1年前1
仑仑1年前1 -
 m乏味的机会 共回答了16个问题
m乏味的机会 共回答了16个问题 |采纳率87.5%硅晶格常数为5.43095埃(1埃=10-10米).单位晶胞占有的原子数为8个,计算如下:
8X1/8+6x1/2+4=8
立方体的8个顶点,为8个晶胞所共有;6个面心的格点,为两个晶胞所共有.1年前查看全部
- 金刚石,晶体硅,碳化硅熔点的高低
 zhengkui1年前1
zhengkui1年前1 -
 pyght 共回答了19个问题
pyght 共回答了19个问题 |采纳率89.5%都是原子晶体,所以熔沸点高低看键长
键长越短,键能越大,熔沸点越高
金刚石是C-C键,晶体硅是Si-Si键,碳化硅是C-Si键
因为C的原子半径小于Si
所以C-C键键长最短,Si-Si键键长最长,C-Si键键长介于两者之间
那么结论就不难得到了:熔沸点高低:金刚石>碳化硅>晶体硅1年前查看全部
- 晶体硅是带有________光泽的________固体,硬度______,有_______性,是良好的_______材料
晶体硅是带有________光泽的________固体,硬度______,有_______性,是良好的_______材料.
 kylie61年前1
kylie61年前1 -
 dusimon 共回答了24个问题
dusimon 共回答了24个问题 |采纳率91.7%金属,灰黑色,大,脆性,半导体1年前查看全部
- 现有8种物质:①干冰②金刚石③白磷④晶体硅⑤过氧化钠⑥二氧化硅晶体⑦氯化铵⑧氖
现有8种物质:①干冰②金刚石③白磷④晶体硅⑤过氧化钠⑥二氧化硅晶体⑦氯化铵⑧氖
⑴通过非极性键形成的原子晶体是_⑵固态时属于分子晶体的是_⑶有单原子分子构成的分子晶体是_⑷含有非极性键的离子化合物是_ 明月照清秋1年前8
明月照清秋1年前8 -
 若南若北 共回答了20个问题
若南若北 共回答了20个问题 |采纳率95%1 金刚石 晶体硅
2干冰 氖 白磷
3 氖
4过氧化钠1年前查看全部
- 关于硅及其化合物的叙述中,不正确的是( ) A.晶体硅是良好的半导体材料 B.晶体硅与金刚石类似,故其熔、沸点高,硬度
关于硅及其化合物的叙述中,不正确的是( ) A.晶体硅是良好的半导体材料 B.晶体硅与金刚石类似,故其熔、沸点高,硬度大 C.硅酸盐均不溶于水 D.二氧化硅不溶于水,但能溶于强碱溶液  forsterng1年前1
forsterng1年前1 -
 anyplace879 共回答了19个问题
anyplace879 共回答了19个问题 |采纳率94.7%A.晶体硅是优良的半导体材料,故A正确;
B.晶体硅与金刚石都是原子晶体,故其熔、沸点高,硬度大,故B正确;
C.钠盐全部可溶,硅酸钠可溶于水,故C错误;
D.二氧化硅不溶于水,可与强碱反应生成硅酸钠,故D正确.
故选C.1年前查看全部
- 金刚石,晶体硅,Nacl,怎样比较熔点高低?
 acaixiangsi20061年前1
acaixiangsi20061年前1 -
 22394955 共回答了18个问题
22394955 共回答了18个问题 |采纳率77.8%这几种可分两大类,金刚石和晶体硅都是原子晶体,NACL是离子晶体,原子晶体熔点都比离子晶体高,金刚石主要成分是C,原子比SI小,共价键强,熔点高,所以金刚石>晶体硅>NACL1年前查看全部
- 连云港市第一座光伏电站采用晶体硅光伏发电系统,利用太阳能发电,功率为3.2×10 6 W。太阳能是清洁_________
连云港市第一座光伏电站采用晶体硅光伏发电系统,利用太阳能发电,功率为3.2×10 6 W。太阳能是清洁__________(选填“可再生”或“不可再生”)能源。假设一年平均有效发电时间为1200h,则年发电量可达_____________kW·h。
 gaoqingzhu1年前1
gaoqingzhu1年前1 -
 16画 共回答了18个问题
16画 共回答了18个问题 |采纳率83.3%可再生;3.84×10 6 。
太阳能是可再生的;发电量就是功的大小,即W=Pt=3.2×10 6 W×1200h=3.84×10 6 kWh。1年前查看全部
- 1mol碳化硅 晶体硅 和 二氧化硅中 分别含有的 各自的键的数目
1mol碳化硅 晶体硅 和 二氧化硅中 分别含有的 各自的键的数目
碳-硅 硅-硅 氧-硅 键的数目是 为什么
请问下 以后我遇到类似问题如何判断? 小猴子不哭1年前1
小猴子不哭1年前1 -
 rlexzhang 共回答了9个问题
rlexzhang 共回答了9个问题 |采纳率100%碳化硅中每个碳原子与四个硅原子相连,每个硅原子也与四个碳原子相连,因此键的数目应该4mol(以碳为标准,每个碳原子有4个碳硅键)
晶体硅只有2mol.因为1个硅有4个Si-Si键,但是每个Si-Si键归两个Si原子共用,因此还要除以2,这样每个Si原子只能平均到2个Si-Si键,所以是含有2molSi-Si键.
二氧化硅中,每个硅原子与四个氧原子相连,每个氧原子与两个碳原子相连,因此具有4mol.1年前查看全部
- 无机非金属材料的主角--硅是地壳中含量居第二位的元素.信息技术依赖的计算机芯片主要是晶体硅,而光纤材料的主要成分是二氧化
无机非金属材料的主角--硅是地壳中含量居第二位的元素.信息技术依赖的计算机芯片主要是晶体硅,而光纤材料的主要成分是二氧化硅.
(1)在元素周期表中,硅和碳处于同一纵行,它们的最高价氧化物性质迥异.SiO2的熔点高、硬度大,而干冰熔点低硬度小易升华,其原因是______.
(2)写出SiO2与NaOH反应的离子方程式:______.
(3)写出SiO2与Na2CO3高温下反应的化学方程式:Na2CO3+SiO2
Na2SiO3+CO2↑高温 .Na2CO3+SiO2.
Na2SiO3+CO2↑高温 .
(4)H2CO3的酸性强于H2SiO3的酸性.在Na2SiO3溶液中,通入CO2或SO2都可以得到H2SiO3
沉淀,同时生成Na2CO3或Na2SO3.CO2-3的空间构型是______,SO2-3的空间构型是______.
(5)硅酸盐是一些结构复杂的固态物质,通常用氧化物的形式表示其组成.某硅酸盐可表示为:Mga(Si4O10)(OH)b(其中a、b为正整数).
①a能不能等于2?______(填“能”、“不能”或“无法确定”).
②a与b应满足的关系是(写表达式)______.
③a=3时,此硅酸盐的表达式是(以氧化物的形式表示)______. 无花果果果1年前1
无花果果果1年前1 -
 xlhome 共回答了19个问题
xlhome 共回答了19个问题 |采纳率94.7%解题思路:(1)根据原子晶体的熔点高于分子晶体;
(2)根据二氧化硅能与氢氧化钠反应生成硅酸钠和水;
(3)碳酸钠与二氧化硅在高温条件下反应生成硅酸钠和二氧化碳;
(4)根据碳原子和硫原子的杂化方式来分析;
(5)①硅酸盐的化学式可写成氧化物的形式,根据原子守恒从而找出a与b应满足的关系,根据a与b的取值范围判断
②硅酸盐的化学式可写成氧化物的形式,根据原子守恒从而找出a与b应满足的关系
③根据a、b的关系计算b值,从而确定该化学式;(1)SiO2是原子晶体,干冰是分子晶体,而原子晶体的熔点高于分子晶体,故答案为:SiO2是原子晶体,干冰是分子晶体;
(2)二氧化硅能与氢氧化钠反应生成硅酸钠和水,反应的化学方程式为:SiO2+2NaOH═Na2SiO3+H20,离子方程式:SiO2+2OH-=SiO32-+H2O;故答案为:SiO2+2OH-=SiO32-+H2O;
(3)碳酸钠与二氧化硅在高温条件下反应生成硅酸钠和二氧化碳:Na2CO3+SiO2
高温
.
Na2SiO3+CO2↑,故答案为:
Na2CO3+SiO2
高温
.
Na2SiO3+CO2↑;
(4)CO3 2-中碳原子的杂化方式为SP2,离子的空间构型为平面三角形,SO32-中硫原子的杂化方式SP2,离子的空间构型为三角锥形,故答案为:平面三角形、三角锥形;
(5)①硅酸盐Mg a(Si4O10)(OH)b以氧化物的形式表示为aMgO•4SiO2•b/2H2O,根据O原子守恒得:
a+8+b/2=10+b,化简后得2a=b+4,且a、b都大于0,当a=2时,b=0,a能不能等于2,故答案为:不能;
②硅酸盐Mg a(Si4O10)(OH)b以氧化物的形式表示为aMgO•4SiO2•b/2H2O,共用O原子守恒得:
a+8+b/2=10+b,化简后得2a=b+4,故答案为:2a=b+4;
(3)当a=3时,b=2,所以该硅酸盐的化学式为3MgO•4SiO2•H2O,故答案为:3MgO•4SiO2•H2O.点评:
本题考点: 硅和二氧化硅.
考点点评: 本题考查了化学方程式的书写、硅酸盐中硅酸盐与氧化物的相互书写换算,在书写时要注意原子守恒.1年前查看全部
- 晶体硅为什么熔化时会破坏共价键?
晶体硅为什么熔化时会破坏共价键?
离子化合物都很难挥发吗?有没有反例
F2是共价分子吗? tong031年前1
tong031年前1 -
 cpp59 共回答了9个问题
cpp59 共回答了9个问题 |采纳率100%原子直接以共价键构成晶体硅.它熔沸点高,硬度大.
离子化合物熔沸点较高,硬度较大,受热熔化或溶于水时能导电.但是否难挥发就不清楚了.
F2是共价分子.共价分子的定义:分子中原子之间全部是共价键(的分子)叫做共价分子.1年前查看全部
- 按要求填空1水晶2白磷3晶体硅4氢氧化钾5干冰6.硫磺7.金刚石8.过氧化钠9.固体酒精(1)属于离子化合物的是(2)属
按要求填空
1水晶2白磷3晶体硅4氢氧化钾5干冰6.硫磺7.金刚石8.过氧化钠9.固体酒精
(1)属于离子化合物的是
(2)属于分子晶体的单质是;属于分子晶体的化合物是
(3)属于由原子直接构成的分子晶体的是
(4)属于原子晶体的是
2.下列离子化合物中,由与Ne和Ar电子层结构相同的离子组成的是
A LiBr B NaCl C KCl D KBr x30251年前5
x30251年前5 -
 田伯光的梦 共回答了15个问题
田伯光的梦 共回答了15个问题 |采纳率80%1水晶2白磷3晶体硅4氢氧化钾5干冰6.硫磺7.金刚石8.过氧化钠9.固体酒精
(1)属于离子化合物的是48
(2)属于分子晶体的单质是26;属于分子晶体的化合物是59
(3)属于由原子直接构成的分子晶体的是(稀有气体.题目中无)
(4)属于原子晶体的是137
2.下列离子化合物中,由与Ne和Ar电子层结构相同的离子组成的是B
A LiBr B NaCl C KCl D KB1年前查看全部
- 碳化硅(SiC)的一种晶体具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的.在下列三种晶体①金刚石、②晶体硅、③碳
碳化硅(SiC)的一种晶体具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的.在下列三种晶体①金刚石、②晶体硅、③碳化硅中,它们的熔点从高到低的顺序是( )
A. ①③②
B. ②③①
C. ③①②
D. ②①③ ewieoigho1年前2
ewieoigho1年前2 -
 axoot 共回答了22个问题
axoot 共回答了22个问题 |采纳率90.9%解题思路:根据键长对对物质的熔、沸点的影响分析,晶体类型相同的物质,键长越短,键能越大,物质的熔点越高.晶体类型相同的物质,键长越短,键能越大,物质的熔点越高.①金刚石、②晶体硅、③碳化硅着三种物质中键长关系为:C-C<C-Si<Si-Si,所以键能大小为:C-C键能>C-Si键能>Si-Si键能,所以物质的熔点高低为金刚石>碳化硅>晶体硅.
故选A.点评:
本题考点: 晶体的类型与物质熔点、硬度、导电性等的关系.
考点点评: 本题考查了晶体类型相同的物质中,键长对物质熔点的影响,键长越短,键能越大,物质的熔点越高.1年前查看全部
- 硼是属于什么晶体原子晶体,中学阶段只有四个啊 二氧化硅 晶体硅 金刚石 碳化硅
 Jack_huang_nj1年前1
Jack_huang_nj1年前1 -
 始是新承恩 共回答了15个问题
始是新承恩 共回答了15个问题 |采纳率80%汗.大哥你直接说不就得了一堆话也没有说是啥晶体
硬度仅次于金刚石根据以上材料:原子晶体
学习知识不要死板
你可以进行分析啊
硬度仅次于金刚石说明高硬度!
熔点约2300°C,沸点2550°C说明熔沸点很高!
这样的属性分子晶体绝对不具备
离子晶体?他可是单质啊?
混合晶体?高中貌似只有石墨把,况且石墨有高硬度吗?
所以大胆假设吧!1年前查看全部
- 1moL金刚石中所含的共价键?石墨呢?晶体硅呢?
 ddd8006181年前2
ddd8006181年前2 -
 雪山上的瞟客 共回答了24个问题
雪山上的瞟客 共回答了24个问题 |采纳率79.2%1年前查看全部
- 化学在生产和日常生活中有着重要的应用。下列叙述不正确的是 A.晶体硅是光导纤维、芯片的主要成分 B.在海轮外壳上镶嵌锌块
化学在生产和日常生活中有着重要的应用。下列叙述不正确的是
A.晶体硅是光导纤维、芯片的主要成分 B.在海轮外壳上镶嵌锌块,会减缓船体的锈蚀 C.工业上用石灰对煤燃烧后的烟气进行脱硫,并能制取石膏 D.氯气是合成农药、染料和药品的重要原料  b0001931年前1
b0001931年前1 -
 红天使 共回答了22个问题
红天使 共回答了22个问题 |采纳率100%A
1年前查看全部
- 【化学一选修2化学与技术】晶体硅是信息科学和能源科学中的一种重要材料,可用于制芯片和太阳能电池等.以下是工业上制取纯硅的
【化学一选修2化学与技术】
晶体硅是信息科学和能源科学中的一种重要材料,可用于制芯片和太阳能电池等.以下是工业上制取纯硅的一种方法.
请回答下列问题(各元素用相应的元素符号表示):
(1)在上述生产过程中,属于置换反应的有______(填反应代号).
(2)利用反应③能制得纯硅的原因是______.
(3)化合物W的用途很广,通常可用作建筑工业和造纸工业的黏合剂,可作肥皂的填充剂,是天然水的软化剂.将石英砂和纯碱按一定比例混合加热至1373~1623K反应,生成化合物W,其化学方程式是SiO2+Na2CO3
Na2SiO3+CO2↑1373~1623K .SiO2+Na2CO3.
Na2SiO3+CO2↑1373~1623K .
(4)A、B、C三种气体在生产过程中可循环使用的是______(写化学式);在“节能减排”中作为减排目标的一种气体是______(写化学式);分别通入W溶液中能得到白色沉淀的气体是______(写化学式).
(5)工业上合成氨的原料H2是先将焦炭与水蒸气反应生成水煤气,再提纯水煤气得到纯净的H2,提纯水煤气得到纯净的H2的化学方程式为C+H2O(g)
CO+H2高温 .C+H2O(g)、
CO+H2高温 .CO+H2O(g)
CO2+H2催化剂,1073K .CO+H2O(g)、______.
CO2+H2催化剂,1073K .
(6)反应生成的气体只是A而不是B的原因是石英砂原料价格昂贵,焦炭廉价,反应物中焦炭应过量.即使生成二氧化碳,二氧化碳也会在高温下与焦炭反应生成一氧化碳(CO2+C
2CO)高温 .石英砂原料价格昂贵,焦炭廉价,反应物中焦炭应过量.即使生成二氧化碳,二氧化碳也会在高温下与焦炭反应生成一氧化碳(CO2+C.
2CO)高温 . 欲下层楼1年前1
欲下层楼1年前1 -
 l-ye 共回答了16个问题
l-ye 共回答了16个问题 |采纳率87.5%解题思路:(1)置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应;
(2)根据物质的状态;
(3)二氧化硅与碳酸钠高温反应生成硅酸钠;
(4)A、B、C分别为CO、CO2、HCl,化合物W为硅酸钠;
(5)碳和水反应生成一氧化碳和氢气,一氧化碳和水反应生成二氧化碳和氢气,二氧化碳能和氢氧化钙反应生成碳酸钙;
(6)二氧化碳在高温下与焦炭反应生成一氧化碳.(1)置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,①②③属于置换反应,故答案为:①②③;
(2)根据物质的状态在1357 K时除硅外均为气体,故答案为:反应中只有Si是固体,其他物质在1357 K时均为气体且与硅不反应;
(3)二氧化硅与碳酸钠高温反应生成硅酸钠,反应方程式:SiO2+Na2CO3
1373~1623K
.
Na2SiO3+CO2↑,故答案为:SiO2+Na2CO3
1373~1623K
.
Na2SiO3+CO2↑;
(4)A、B、C分别为CO、CO2、HCl;HCl可循环使用;作为减排目标的一种气体是CO2,化合物W为硅酸钠,能与W反应生成沉淀的是CO2和HCl,故答案为:HCl;CO2;CO2和HCl;
(5)碳和水反应生成一氧化碳和氢气:C+H2O(g)
高温
.
CO+H2,一氧化碳和水反应生成二氧化碳和氢气:CO+H2O(g)
催化剂,1073K
.
CO2+H2,二氧化碳能和氢氧化钙反应生成碳酸钙:CO2+Ca(OH)2═CaCO3↓+H2O,
故答案为:C+H2O(g)
高温
.
CO+H2;CO+H2O(g)
催化剂,1073K
.
CO2+H2;CO2+Ca(OH)2═CaCO3↓+H2O;
(6)二氧化碳在高温下与焦炭反应生成一氧化碳,CO2+C
高温
.
2CO,
故答案为:石英砂原料价格昂贵,焦炭廉价,反应物中焦炭应过量.即使生成二氧化碳,二氧化碳也会在高温下与焦炭反应生成一氧化碳(CO2+C
高温
.
2CO).点评:
本题考点: 硅和二氧化硅;无机物的推断.
考点点评: 本题考查无机物的推断,明确各物质的成分是解题的关键,题目难度中等.1年前查看全部
- 晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
 晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅:SiO2+2C
Si+2CO↑.高温 .
②粗硅与干燥的Cl2反应制得SiCl4:Si+2C12
SiCl4.△ .
③SiCl4被过量的H2在1 000~1 100℃时还原制得纯硅:SiCl4+2H2
Si+4HCl.△ .
某同学从资料中查知:SiCl4的熔点为-7O℃,沸点为57.6℃,且在潮湿的空气中能发生水解反应.该同学设计了如下制取纯硅的实验装置(热源及夹持装置已略去).请回答下列问题:
(1)使SiCl4从装置B中逸出与H2充分混合,应采取的措施是______.
(2)装置C不能采用普通玻璃管的原因是______,石英的化学式是______.
(3)如果从装置A中快速向装置B中通入气体,可能观察到的现象是______.
(4)为防止空气污染,含有SiCl4的尾气要通入盛有______溶液的烧杯中,反应的化学方程式为______.
(5)为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度,还应对该装置进行的改进是______. kcl19761年前1
kcl19761年前1 -
 iyzg15 共回答了23个问题
iyzg15 共回答了23个问题 |采纳率91.3%解题思路:(1)根据SiCl4沸点低(57.6),故要使其逸出烧瓶与H2反应,则需对烧瓶B进行水浴加热;
(2)由于H2还原SiCl4的实验是在某些方面1000-1100℃的高温下进行的,在此温度下普通玻璃管会软化,故需用高熔点的石英玻璃管,石英的化学式是SiO2;
(3)由SiCl4易水解生成硅酸和氯化氢来分析现象;
(4)由SiCl4易水解生成硅酸和氯化氢,所以用碱性溶液吸收,结合SiCl4易水解生成硅酸和氯化氢,硅酸和氯化氢都能与碱反应来书写方程式;
(5)H2从A逸出时会带出水蒸气,使B中SiCl4发生水解影响实验;(1)SiCl4沸点低(57.6),故要使其逸出烧瓶与H2反应,则需对烧瓶B进行水浴加热,
故答案为:对装置B水浴加热.
(2)H2还原SiCl4的实验是在某些方面1000-1100℃的高温下进行的,在此温度下普通玻璃管会软化,故需用高熔点的石英玻璃管,石英的化学式是SiO2,
故答案为:在1000-1100℃时普通玻璃管会软化;SiO2
(3)SiCl4易水解生成硅酸和氯化氢,氯化氢遇到空气中的水蒸气,B中液面上方产生少量白雾,液体中有少量白色皎状物硅酸生成,
故答案为:B中液面上方产生少量白雾,液体中有少量白色胶状物生成;
(4)SiCl4易水解生成硅酸和氯化氢,所以用碱性溶液吸收,SiCl4易水解生成硅酸和氯化氢,硅酸和氯化氢都能与碱反应,所以方程式为:SiCl4+6NaOH=Na2SiO3+4NaCl+3H2O,
故答案为:NaOH、SiCl4+6NaOH=Na2SiO3+4NaCl+3H2O;
(5)H2从A逸出时会带出水蒸气,使B中SiCl4发生水解影响实验,所以可以想到应在A、B之间加一个干燥装置故答案为:在装置A与B之间连接一盛有浓硫酸的洗气瓶(或盛有碱石灰的干燥管);点评:
本题考点: 硅和二氧化硅;制备实验方案的设计.
考点点评: 本题主要考查制取纯硅过程中H2还原SiCl4的实验,解题过程中要充分利用题干所给信息,去考虑装置的设计、优化所应采取的措施.1年前查看全部
- 下列各项因果关系中正确的是 [ ] A.金刚石的熔点高于晶体硅,因为两种
下列各项因果关系中正确的是 [ ]A.金刚石的熔点高于晶体硅,因为两种晶体中原子间平均距离前者小于后者
B.水的热稳定性比较高,因为水分子之间存在氢键
C.金属晶体能导电,因为金属晶体中存在金属阳离子
D.离子晶体硬度较大、难于压缩,因为离子晶体中的阴、阳离子排列很有规则 浒关1年前1
浒关1年前1 -
 夙若尘烟 共回答了20个问题
夙若尘烟 共回答了20个问题 |采纳率95%A1年前查看全部
- 晶体硅和非晶硅是同素异形体吗
 xsb321年前1
xsb321年前1 -
 天籁之子SH 共回答了18个问题
天籁之子SH 共回答了18个问题 |采纳率94.4%晶体硅和非晶硅只是结晶状态不一样而已.是同一物质,是同素异形体
同素异形体,是相同元素组成,不同形态的单质.如碳元素就有金钢石、石墨、无定形碳等同素异形体.同素异形体由于结构不同,彼此间物理性质有差异;但由于是同种元素形成的单质,所以化学性质相似.1年前查看全部
- 下列物质:①水晶 ②干冰 ③氨气 ④白磷 ⑤氩 ⑥氯化钠 ⑦铁 ⑧晶体硅 &
下列物质:
①水晶 ②干冰 ③氨气 ④白磷 ⑤氩⑥氯化钠 ⑦铁 ⑧晶体硅⑨过氧化钠 ⑩H2O其中:
(1)将①②④⑥⑧⑩按照熔沸点由高到低的顺序排列______(填序号)
(2)含有极性键的非极性分子的电子式是______.
(3)晶体⑥中1个阳离子周围有______个阴离子;熔化时只破坏共价键的晶体是______(填序号)
(4)1mol金刚石、水晶和白磷中含有共价键的数目之比为______
(5)铁有δ、γ、α三种同素异形体,下图是它们的晶体结构图,三种晶体中铁原子周围距离最近的铁原子个数之比为______.
 liuying12151年前1
liuying12151年前1 -
 方芳13 共回答了21个问题
方芳13 共回答了21个问题 |采纳率100%解题思路:(1)一般熔点为:原子晶体>离子晶体>分子晶体,对于晶体类型相同熔沸点比较:原子晶体键长越短,熔沸点越高;离子晶体离子半径越小,电荷越高,离子键越强熔沸点越高;分子晶体相对分子质量质量越大,分子间作用力越强,熔沸点越高.再结合常温下物质的状态判断;
(2)含有极性键的非极性分子是干冰,分子中碳原子与氧原子之间形成2对共用电子对;
(3)氯化钠晶体中每个Na+周围有6个Cl-,每Cl-离子周围有6个Na+;熔化时只破坏共价键的为原子晶体;
(4)金刚石中每个C原子与周围的4个碳原子形成正四面体结构,每个C-C为C原子提供[1/2]C-C键,水晶是二氧化硅晶体,晶体中每Si原子与周围的4个O原子形成[SiO4]四面体,1mol晶体中含有4molSi-O键,白磷分子是P4,为正四面体结构,分子中为P原子处于正四面体的顶点,分子中含有6个P-P键;
(5)δ-Fe是体心立方结构,以体心的铁原子分析,由晶胞结构可知,与之最近的铁原子位于晶胞立方体的顶点上,故与中心铁原子周围距离最近的铁原子个数为8;γ-Fe是面心立方结构,由晶胞结构可知,以前面的右上角的Fe原子分析,与之最近的铁原子处于该铁原子所在面的面心上,该铁原子为8个晶胞共有,故与之最近的碳原子共有12个;α-Fe是简单立方结构,由晶胞结构可知,以前面的右上角的Fe原子分析,与之最近的铁原子处于该铁原子所在的棱上,该铁原子为8个晶胞共有,故与之最近的碳原子共有6个.(1)①水晶、⑧晶体硅都是原子晶体,熔沸点最高,晶体中键长Si-O<Si-Si,所以熔沸点①水晶>⑧晶体硅;⑥氯化钠是离子晶体,熔沸点比原子晶体低;②干冰④白磷⑩H2O都是分子晶体,其中常温下干冰是气体,白磷是固体,水是液体,晶体熔沸点④白磷>⑩H2O>②干冰,所以熔沸点由高到低的顺序排列①⑧⑥④⑩②,
故答案为:①⑧⑥④⑩②;
(2)含有极性键的非极性分子是干冰,分子中碳原子与氧原子之间形成2对共用电子对,电子式为 ,故答案为:
,故答案为: ;
;
(3)氯化钠晶体中每个Na+周围有6个Cl-,每Cl-离子周围有6个Na+;熔化时只破坏共价键的为原子晶体,①水晶、⑧晶体硅是原子晶体,故答案为:6;①⑧;
(4)金刚石中每个C原子与周围的4个碳原子形成正四面体结构,每个C-C为C原子提供[1/2]C-C键,水晶是二氧化硅晶体,晶体中每Si原子与周围的4个O原子形成[SiO4]四面体,1mol晶体中含有4molSi-O键,白磷分子是P4,为正四面体结构,分子中为P原子处于正四面体的顶点,分子中含有6个P-P键,1mol金刚石、水晶和白磷中含有共价键的数目之比为为4mol×[1/2]:4mol:6mol=1:2:3,故答案为:1:2:3;
(5)δ-Fe是体心立方结构,以体心的铁原子分析,由晶胞结构可知,与之最近的铁原子位于晶胞立方体的顶点上,故与中心铁原子周围距离最近的铁原子个数为8;γ-Fe是面心立方结构,由晶胞结构可知,以前面的右上角的Fe原子分析,与之最近的铁原子处于该铁原子所在面的面心上,该铁原子为8个晶胞共有,故与之最近的碳原子共有12个;α-Fe是简单立方结构,由晶胞结构可知,以前面的右上角的Fe原子分析,与之最近的铁原子处于该铁原子所在的棱上,该铁原子为8个晶胞共有,故与之最近的碳原子共有6个,三种晶体中铁原子周围距离最近的铁原子个数之比为8:12:6=4:6:3,故答案为:4:6:3.点评:
本题考点: 晶胞的计算;晶体的类型与物质熔点、硬度、导电性等的关系.
考点点评: 本题考查晶体类型与熔沸点高低判断、晶体结构、对晶胞的理解与计算等,难度中等,对晶胞的计算注意均摊法的利用,需要学生具备空间想象能力.1年前查看全部
- 现有下列物质:1晶体硅2干冰3冰4氯化钾
现有下列物质:1晶体硅2干冰3冰4氯化钾
求排序及详细分析说明. QQshall1年前4
QQshall1年前4 -
 王业 共回答了22个问题
王业 共回答了22个问题 |采纳率100%第一是si,因为是原子晶体,一般原子晶体的熔沸点较高.
第二是Kcl,是离子晶体.因为离子之间有离子键,较稳定,而熔化要破坏离子键,要较多的能量.所以熔点高.
第三是冰,虽然和CO2 都是分子晶体,但水分子间有氢键,所以比二氧化碳熔点高.
第四是干冰,常温是气态,分子间主要是靠范德华尔兹力作用,作用力较小,熔点低.1年前查看全部
- 下列关于硅材料的叙述正确的是( ) A.玛瑙和水晶的主要成分是晶体硅 B.金刚砂硬度很大,主要成分
下列关于硅材料的叙述正确的是()
A.玛瑙和水晶的主要成分是晶体硅 B.金刚砂硬度很大,主要成分为二氧化硅 C.三峡大坝使用了大量的水泥,水泥是硅酸盐材料 D.太阳能电池可用二氧化硅制作,其应用有利于环保、节能  老母鸡扛枪1年前1
老母鸡扛枪1年前1 -
 靠在墙外等红杏1 共回答了27个问题
靠在墙外等红杏1 共回答了27个问题 |采纳率77.8%C
玛瑙和水晶的主要成分均为二氧化硅;二氧化硅俗称石英砂;而太阳能电池主要材料为硅单质。1年前查看全部
- 晶体硅融化克服什么力?
 球球米球球超1年前1
球球米球球超1年前1 -
 lqph 共回答了24个问题
lqph 共回答了24个问题 |采纳率87.5%分子间作用力1年前查看全部
- (0)现有:①氯化钠晶体;②金刚石;③晶体硅;④干冰;⑤白磷,其熔点由高到低的顺序为______(填序号);
(0)现有:①氯化钠晶体;②金刚石;③晶体硅;④干冰;⑤白磷,其熔点由高到低的顺序为______(填序号);
(2)对硝酸进行九系列的实验,其中部分实验(包括现象)如下:
①浓硝酸中滴入紫色石蕊试液,溶液先呈红色后褪色;
②两根玻璃棒分别蘸有浓硝酸和浓氨水,靠近(不接触)两根玻璃棒出现白烟;
③将铜片投入浓硝酸中,溶液变绿色并产生大量红棕色气体;
④在稀硝酸中逐渐加入铁粉,溶液颜色先变棕黄色后变浅绿色,且开始有气泡出现后来无气泡;
⑤浓硝酸中加入红热的炭,产生大量混合气体
上述实验中,硝酸既表现强氧化性又表现酸性的实验是______(填实验序号,下同),既表现酸性又表现挥发性的是______,只表现强氧化性的是______.
(着)有等体积混合而成的四组气体:①NO2+NO;②NO2+O2;③HC5+N2;④NO+N2,
将其分别通入体积相同的试管,并立即倒立于水槽中,试管内水面上升的高度分别为H0,H2,H着,H0,其中高度关系正确的是______.
A.H2>H着>H0>H0 B.H着>H2>H0>H0C.H0=H2=H着=H0 D.H0>H2>H着>H0. jiangshanlan1年前1
jiangshanlan1年前1 -
 jingle046 共回答了20个问题
jingle046 共回答了20个问题 |采纳率85%解题思路:(1)判断晶体类型,根据晶体类型判断熔点高低;
(2)①浓硝酸具有酸性,可使指示剂变色,浓硝酸具有强氧化性,可以氧化漂白石蕊;
②浓硝酸易挥发,与氨气反应生成硝酸铵,表现了浓硝酸的酸性;
③将铜片投入浓硝酸中,生成硝酸铜并产生大量红棕色气体,表现了浓硝酸的酸性和强氧化性;
④在稀硝酸中逐渐加入铁粉,溶液颜色先变棕黄色,说明生成了硝酸铁,表现了硝酸的硝酸的酸性和强氧化性,后变浅绿色,表现了铁离子的氧化性;
⑤浓硝酸中加入红热的炭,产生大量混合气,不能生成盐,因此只表现了浓硝酸的强氧化性;
(3)NO、N2、O2不溶于水,氯化氢极易溶于水,二氧化氮和水反应方程式为:3NO2+H2O=2HNO3+NO、4NO2+O2+2H2O=4HNO3,气气体减少的体积等于试管内液体体积.(1)①氯化钠晶体是离子晶体②金刚石是原子晶体③晶体硅是原子晶体④干冰分子是晶体⑤白磷是分子晶体,C原子半径如于Si,因此金刚石的熔点大于晶体硅,白磷相对分子质量大于5氧化碳,因此白磷的熔点高于干冰,结合熔点:原子晶体>离子晶体>分子晶体,其熔点由高到低的顺序为:②③①⑤④,
故答案为:②③①⑤④;
(2)①浓硝酸具有酸性,可使指示剂变色,浓硝酸具有强氧化性,可以氧化漂白石蕊,因此表现了硝酸的酸性和强氧化性;
②浓硝酸易挥发,与氨气反应生成硝酸铵,表现了浓硝酸的酸性,因此表现了硝酸的挥发性和酸性;
③将铜片投入浓硝酸中,生成硝酸铜并产生大量红棕色气体,表现了浓硝酸的酸性和强氧化性;
④在稀硝酸中逐渐加入铁粉,溶液颜色先变棕黄色,说明生成了硝酸铁,表现了硝酸的硝酸的酸性和强氧化性,后变浅绿色,表现了铁离子的氧化性;
⑤浓硝酸中加入红热的炭,产生大量混合气,不能生成盐,因此只表现了浓硝酸的强氧化性,
故答案为:①③④;②;⑤;
(右)假设各种气体体积都是a,试管容积为2a,气体减r的体积等于试管内液体体积,
①根据右NO2+上2O=2上NO右+NO知,生成NO的体积为5氧化氮体积的[1/右],所以5氧化氮和水反应生成NO的体积为[1/右],原来还有a,所以NO总的体积为[你a/右],则液面上升高度为试管高度的[1/右];
②根据你NO2+O2+2上2O=你上NO右知,5氧化氮完全反应,剩余气体是氧气,根据氧气和5氧化氮的关系式知,剩余氧气的体积=a-[1/你]×a=[右/你a,则液面高度占试管体积的
5
8];
③氮气和水不反应,氯化氢极易溶于水,所以液面高度等于氯化氢体积,液面高度占试管容积的[a/2a]=[1/2];
④NO、N2都不和水反应,所以水不进入试管,其液面高度为左,
通过以上分析知,液面高度关系为上2>上右>上1>上你,
故答案为:A.点评:
本题考点: 晶体熔沸点的比较;硝酸的化学性质;氮的氧化物的性质及其对环境的影响.
考点点评: 本题考查了晶体的类型、硝酸的性质、根据方程式进行计算,明确晶体的类型和物质的性质是解本题关键,根据试管内液体体积与反应过程中气体减少体积之间的关系来分析解答,题目难度不大.1年前查看全部
- 下列对各组物质性质的比较中,正确的是 A.第一电离能:Na<Mg<Al B.熔点:金刚石>晶体硅>碳化硅 C
下列对各组物质性质的比较中,正确的是
A.第一电离能:Na<Mg<Al B.熔点:金刚石>晶体硅>碳化硅 C.硬度:Li>Na>K D.空间利用率:六方密堆<面心立方<体心立方  junjun0501年前1
junjun0501年前1 -
 xuanwind 共回答了21个问题
xuanwind 共回答了21个问题 |采纳率100%C
1年前查看全部
- 在①金刚石、②晶体硅、③P4、④SiO2、⑤CH4、⑥CH2Cl2、⑦CCl4、⑧NH+4微粒中,分子结构是正四面体的是
在①金刚石、②晶体硅、③P4、④SiO2、⑤CH4、⑥CH2Cl2、⑦CCl4、⑧NH+4微粒中,分子结构是正四面体的是( )
A.①②③⑤⑦
B.①②④
C.③⑤⑦
D.④⑥⑧ mxjy1年前1
mxjy1年前1 -
 ldx429 共回答了11个问题
ldx429 共回答了11个问题 |采纳率90.9%解题思路:分子或离子的结构可以根据价层电子对互斥理论确定;常见的单质可以根据其结构图分析.①金刚石的结构为
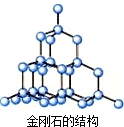 ,为正四面体结构,但是金刚石为原子晶体,不存在分子,故错误;
,为正四面体结构,但是金刚石为原子晶体,不存在分子,故错误;
②晶体硅的空间结构与金刚石的相似,为空间四面体结构,4个共价键完全相同,为正四面体,但是晶体硅为原子晶体,不存在分子,故错误;
③P4 为分子晶体,其分子结构为 ,为正四面体结构,故正确;
,为正四面体结构,故正确;
④SiO2晶体结构 ,二氧化硅晶体中存在四面体结构单元,每个硅原子能构成四个共价键,每个氧原子能形成2个共价键,Si处于中心,O处于4个顶角,但是二氧化硅晶体为原子晶体,不存在分子,故错误;
,二氧化硅晶体中存在四面体结构单元,每个硅原子能构成四个共价键,每个氧原子能形成2个共价键,Si处于中心,O处于4个顶角,但是二氧化硅晶体为原子晶体,不存在分子,故错误;
⑤CH4中中心原子价层电子对个数为4,4个共价键完全相同,则其分子结构为四面体结构,故正确;
⑥CH2Cl2中中心原子价层电子对个数为4,为四面体结构,4个共价键中C-Cl与C-H不同,所以不是正四面体,故错误;
⑦CCl4中中心原子价层电子对个数为4,为四面体结构,4个共价键完全相同,是正四面体,故正确;
⑧NH4+中中心原子价层电子对个数为4,为四面体结构,4个共价键完全相同,为正四面体,NH4+是阳离子不是分子,故错误;
所以正确的③⑤⑦;
故选A.点评:
本题考点: 判断简单分子或离子的构型.
考点点评: 本题考查了分子的空间构型的判断,注意把握价层电子对互斥理论的应用,明确晶体结构是解此题关键,题目难度中等.1年前查看全部
- 晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用过量的碳还原二氧化硅制得粗硅,同时得到一种可燃性气态;
②粗硅与干燥的HCl气体反应制得SiHCl3(Si+3HCl=SiHCl3+H2)
③SiHCl3与过量的H2在1000℃~1100℃反应制得纯硅,已知SiHCl3能与水强烈反应,在空气中易自燃.请回答:
(1)第一步制取轨的化学方程式2C+SiO2
Si+2CO↑高温 .2C+SiO2.
Si+2CO↑高温 .
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃),提纯SiHCl3可采用______的方法.
(3)实验室用SiHCl3与过量的H2反应制取纯硅装置如图所示(加热和夹持装置略去):
①装置B中的试剂是______,装置C需水浴加热,目的是______.
②反应一段时间后,装置D中可观察到有晶体硅生成,装置D不能采用普通玻璃管的原因是______,D中发生的反应的化学方程式是______.
③为保证实验的成功,操作的关键除题中已告知的之外,你认为最重要的还有:______,______.(答出两点) rute1年前1
rute1年前1 -
 gjnc5at 共回答了15个问题
gjnc5at 共回答了15个问题 |采纳率93.3%解题思路:根据题目给出的信息,高温下,碳做还原剂时,碳和二氧化硅生成CO和硅;利用沸点的不同提纯SiHCl3属于蒸馏;浓硫酸是常用的干燥剂,装置C需水浴加热,目的是加快反应的速率;装置D不能采用普通玻璃管的原因是温度太高,普通玻璃管易熔化;保证实验成功的关键是:装置要严密;控制好温度等.(1)高温下,碳做还原剂时,生成CO,即2C+SiO2═2CO+Si.故答案为:2C+SiO2═2CO+Si
(2)利用沸点的不同提纯SiHCl3属于蒸馏,故答案为:蒸馏
(3)浓硫酸是常用的干燥剂,装置C需水浴加热,目的是使SiHCl3气化,与氢气反应;SiHCl3与过量的H2在1000℃~1100℃反应制得纯硅,温度太高,普通玻璃管易熔化;保证实验成功的关键是:装置要严密;控制好温度等;书写化学方程式时,要注意配平.故答案为:①浓硫酸;使SiHCl3气化,与氢气反应;②SiHCl3与过量的H2在1000℃~1100℃反应制得纯硅,温度太高,普通玻璃管易熔化;SiHCl3+H2=Si+3HCl;③装置要严密;控制好温度.点评:
本题考点: 物质的相互转化和制备;气体的干燥(除水);质量守恒定律及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 本考点属于物质的转化和制备题,还考查了化学方程式的书写.本题利用文字描述设计出相应的实验步骤,分步骤进行鉴别,解决本考点需要根据实验现象,综合分析,从而得出正确的结论,要注意知识的整体性.此考点主要出现在实验题中.1年前查看全部
- 下列有关物质用途的说法,错误的是( ) A.二氧化硫常用于漂白纸浆 B.漂粉精可用于游泳池水消毒 C.晶体硅常用于制作
下列有关物质用途的说法,错误的是( )
A.二氧化硫常用于漂白纸浆 B.漂粉精可用于游泳池水消毒 C.晶体硅常用于制作光导纤维 D.氧化铁常用于红色油漆和涂料  kikolan1年前1
kikolan1年前1 -
 传说中的xx人 共回答了19个问题
传说中的xx人 共回答了19个问题 |采纳率89.5%C
制作光导纤维的材料是SiO 2 而不是Si,C项错误。1年前查看全部
- 下列有关物质用途的说法中,不正确的是 A.液氨可用做致冷剂,碱石灰可用于干燥氨气 B.晶体硅常用于制造光导纤维 C.氢氧
下列有关物质用途的说法中,不正确的是
A.液氨可用做致冷剂,碱石灰可用于干燥氨气 B.晶体硅常用于制造光导纤维 C.氢氧化铝可用于治疗胃酸过多 D.金属镁在冶金工业上常用做还原剂和脱氧剂  庭SPL1年前1
庭SPL1年前1 -
 yjl1103 共回答了29个问题
yjl1103 共回答了29个问题 |采纳率93.1%B
1年前查看全部
- 【三选一—选修化学与技术】晶体硅可用作制芯片和太阳能电池等。下列流程图是工业上制取纯硅的一种方法。 请回答下列问题(各元
【三选一—选修化学与技术】
晶体硅可用作制芯片和太阳能电池等。下列流程图是工业上制取纯硅的一种方法。
请回答下列问题(各元素用相应的元素符号表示)。
(1)在上述生产过程中,属于置换反应的有__(填反应的代号“I~Ⅳ”)。
(2)A、B、C三种气体在上述生产过程中可循环利用的是___;在“节能减排”中作为减排目标的一种气体是___。
(3)化合物甲的用途很广,有些已应用于高、精、尖科技领域。通常可作建筑工业和造纸工业上的黏合剂。将石英砂和纯碱按一定比例混合加热至1373~1 623 K反应生成化合物甲,其化学方程式为___。
(4)利用反应Ⅲ能制得纯硅的原因是___。
(5)已知反应Ⅳ中产物的总能量比反应物的总能量低,则在密闭容器内反应Ⅳ达到平衡,改变下列 条件,气体B的物质的量增大的是___。
a.缩小容器的容积
b.降低反应体系的温度
c.加入少量NaOH固体(生成物在此温度下不分解)
d.加入少量催化性能更好的催化剂
(6)金属镍(Ni)与气体A能形成常温下为液态的Ni(A) 4 、利用Ni(A) 4 的生成与分解可以制得纯度很高的纳米镍,写出Ni( A) 4 在423K时分解的化学方程式___。 carpentt61年前1
carpentt61年前1 -
 MUYU77 共回答了22个问题
MUYU77 共回答了22个问题 |采纳率81.8%1年前查看全部
- 为什么晶体硅是由非极性键结合呢`` 所有的非金属单质都是由非极性键结合吗~
 1990bobo1年前1
1990bobo1年前1 -
 小荣哥 共回答了15个问题
小荣哥 共回答了15个问题 |采纳率86.7%晶体硅是硅原子和硅原子之间以共价键结合形成有立体网状结构,又由于形成共价键的都是硅原子,争夺电子能力相同,所以是非极性共价键.
并不是所有的非金属单质都是由非极性键结合的,如惰性气体是单原子分子,就没有非极性键.1年前查看全部
- 立方氮化硼硬度比晶体硅大的原因
 proe200i21年前1
proe200i21年前1 -
 danipp2003 共回答了13个问题
danipp2003 共回答了13个问题 |采纳率100%首先这二者都是原子晶体.原子晶体的硬度、熔沸点都与其共价键键能和键长有关.
其次,氮、硼是第二周期的元素,原子半径都比第三周期元素硅要小,因此形成的共价键键长更短,键能更强,晶体结构更紧密,所以硬度比晶体硅要大.1年前查看全部
- 为什么单质硅亲氧,而晶体硅化学性质不活泼?
 风吹4去1年前1
风吹4去1年前1 -
 liushuiwq 共回答了22个问题
liushuiwq 共回答了22个问题 |采纳率90.9%现实中的纯净物都是不稳定的,话句话说自然界根本不存在真正的纯净物,越是纯净越是容易和其他物质发生反应,而生成稳定的化合物.1年前查看全部
- 有三种晶体:①铝硅合金,②铝晶体,③晶体硅,它们的熔点由低到高的顺序是A.①②③ B.③②① C.①③② D.③①②
 koftony1年前1
koftony1年前1 -
 wsw33 共回答了10个问题
wsw33 共回答了10个问题 |采纳率100%答案A 合金的熔点比它的各成分物质的熔点都低,则铝硅合金的熔点最低,而晶体硅是原子晶体,其熔点比铝晶体高,故三种晶体熔点由低到高的顺序是①②③. 查看原帖1年前查看全部
- 晶体硅燃烧之后是二氧化硅晶体还是分子?
晶体硅燃烧之后是二氧化硅晶体还是分子?
呃……这本是一道计算化学键的题,但是用二氧化硅晶体算的话1mol中有4mol硅氧键;用二氧化硅的话1mol中则有2mol硅氧键.数值上差了2倍,怎么办! 心碎的感觉BOBO1年前1
心碎的感觉BOBO1年前1 -
 alex_天若有情 共回答了24个问题
alex_天若有情 共回答了24个问题 |采纳率95.8%只能是4mol共价键,二氧化硅是原子晶体!1年前查看全部
- 无晶硅是什么啊?无定形硅(a-Si)又称非晶硅,是硅的一种同素异形体.晶体硅通常呈正四面体排列,每一个硅原子位于正四面体
无晶硅是什么啊?
无定形硅(a-Si)又称非晶硅,是硅的一种同素异形体.晶体硅通常呈正四面体排列,每一个硅原子位于正四面体的顶点,并与另外四个硅原子以共价键紧密结合.这种结构可以延展得非常庞大,从而形成稳定的晶格结构.而无定性硅不存在这种延展开的晶格结构,原子间的晶格网络呈无序排列.换言之,并非所有的原子都与其它原子严格地按照正四面体排列.由于这种不稳定性,无定形硅中的部分原子含有悬空键(dangling bond).这些悬空键对硅作为导体的性质有很大的负面影响.然而,这些悬空键可以被氢所填充,经氢化之后,无定形硅的悬空键密度会显著减小,并足以达到半导体材料的标准.但很不如愿的一点是,在光的照射下,氢化无定形硅的导电性能将会显著衰退,这种特性被称为SWE效应(Staebler-Wronski Effect).美国科学家Stanford R.Ovshinsky拥有许多关于无定形硅的专利,包括半导体、太阳能电池等.它们的成本较相应的晶体硅制成品要低很多.此外,无定形硅可用作自计温度计照相机(Thermal Camera)中的微辐射探测仪(microbolometer). sammyfan19841年前1
sammyfan19841年前1 -
 法医鉴定中心 共回答了20个问题
法医鉴定中心 共回答了20个问题 |采纳率95%硅以大量的硅酸盐矿和石英矿存在于自然界中.如果说碳是组成生物界的主要元素,那么,硅就是构成地球上矿物界的主要元素.硅在地壳中的丰度为27.7%,在所有的元素中居第二位,地壳中含量最多的元素氧和硅结合形成的二氧化...1年前查看全部
- 物质结构与性质 下面排序不正确的是A 晶体熔点由高到低 CF4碳化硅>晶体硅D 晶格能由大到小 NaF>NaCl>NaB
物质结构与性质
下面排序不正确的是
A 晶体熔点由高到低 CF4碳化硅>晶体硅
D 晶格能由大到小 NaF>NaCl>NaBr>Nai ynklove1年前2
ynklove1年前2 -
 yangpengliang 共回答了18个问题
yangpengliang 共回答了18个问题 |采纳率100%A正确,B错误,原因相同,具体原因见上一题我的回答
C的三个物质结构相似,为原子晶体,但C原子半径比Si小,C-C键比Si-Si键短,键长越短,键能越大,破坏键要的能量越大,共价键越稳定,所以物质越稳定.所以金刚石硬度,熔点都比单晶硅更大,而C-Si键介于二者之间,所以C正确
D电荷数相同的物质,离子间距大的晶格能小,而离子间距由阴阳离子的半径的平均值决定,I->Br->Cl->F-,晶格能NaF>NaCl>NaBr>NaI
答案D正确1年前查看全部
- 1.金刚石 白磷 晶体硅 水晶 甲烷 四氯化碳 氯仿
1.金刚石 白磷 晶体硅 水晶 甲烷 四氯化碳 氯仿
其中分子具有正四面体结构的是
2.二氟甲烷结构简式有几种
对第一题的补充:123456 123567 256 全部 晓明并优雅的母狗1年前3
晓明并优雅的母狗1年前3 -
 易水冷 共回答了16个问题
易水冷 共回答了16个问题 |采纳率93.8%正四面体的高中只有两种白磷和甲烷,还有甲烷的全卤代物及其他的一些衍生物
就有四氯化碳
二腐甲烷只有一种,甲烷的几个取代都只有一种,他是正四面体
氯仿是正四面体结构?是正三棱锥吧,正三棱锥和正四面体可是不一样的1年前查看全部
- 晶体硅和无定形硅是什么意思,帮忙解释下!
 nura_chen1年前1
nura_chen1年前1 -
 东方的东方 共回答了17个问题
东方的东方 共回答了17个问题 |采纳率82.4%简介 汉语拼音:jing ti gui 英文名称:Crystalline Silicon 性质概括:带有金属光泽的灰黑色固体、熔点高(1410)、硬度大、有脆性、常温下化学性质不活泼. 晶体硅:单质硅是比较活泼的一种非金属元素,它能和96种稳定元素中的64种元素形成化合物.硅的主要用途是取决于它的半导性.硅材料是当前最重要的半导材料.目前世界年产量约为3×106kg.一个直径75mm的硅片,可集成几万至几十万甚至几百万个元件,形成了微电子学,从而出现了微型计算机、微处理机等.由于当前信息工程的发展,硅主要用于微电子技术.以硅晶闸管为主的电力半导体器件,元件越做越大,与硅晶体管相比集成电路正相反,在直径为75mm的硅片上,只做一个能承受几kA电流和几kV电压的元件,这种元件渗透到电子、电力、控制3个领域就形成了一门新学科——电力电子学.为适应大规模集成电路的发展、单晶硅正向大直径、高纯度、高均匀性,无缺陷方向发展.最大硅片直径已达150mm,实验室的高纯硅接近理论极限纯度.目前常用的太阳能电池是硅电池.如果在1平方米面积上铺满硅太阳电池,就可以得到100W电力.单晶硅太阳能电池的性能稳定,转换效率高,体积小,重量轻,很适合作太空航天器上的电源.美国的大型航天器——太空实验室上就安装有4块太阳能电池帆板,它们是由147840块8平方厘米大小的单晶硅太阳能电池排列组成的,发电功率大约为12KW. 编辑本段类别 晶体硅包括单晶硅和多晶硅,晶体硅的制备方法大致是先用碳还原SiO2成为Si,用HCl反应再提纯获得更高纯度多晶硅,单晶硅的制法通常是先制得多晶硅或无定形硅,然后用直拉法或悬浮区熔法从熔体中生长出棒状单晶硅.硅的单晶体.具有基本完整的点阵结构的晶体.不同的方向具有不同的性质,是一种良好的半导材料.纯度要求达到99.9999%,甚至达到99.9999999%以上.用于制造半导体器件、太阳能电池等.用高纯度的多晶硅在单晶炉内拉制而成. 熔融的单质硅在凝固时硅原子以金刚石晶格排列成许多晶核,如果这些晶核长成晶面取向相同的晶粒,则这些晶粒平行结合起来便结晶成单晶硅. 编辑本段化学及物理性质 单晶硅具有准金属的物理性质,有较弱的导电性,其电导率随温度的升高而增加,有显著的半导电性.超纯的单晶硅是本征半导体.在超纯单晶硅中掺入微量的ⅢA族元素,如硼可提高其导电的程度,而形成p型硅半导体;如掺入微量的ⅤA族元素,如磷或砷也可提高导电程度,形成n型硅半导体. 单晶硅的制法通常是先制得多晶硅或无定形硅,然后用直拉法或悬浮区熔法从熔体中生长出棒状单晶硅.单晶硅主要用于制作半导体元件.无定形硅(a-Si)又称非晶硅,是硅的一种同素异形体.晶体硅通常呈正四面体排列,每一个硅原子位于正四面体的顶点,并与另外四个硅原子以共价键紧密结合.这种结构可以延展得非常庞大,从而形成稳定的晶格结构.而无定性硅不存在这种延展开的晶格结构,原子间的晶格网络呈无序排列.换言之,并非所有的原子都与其它原子严格地按照正四面体排列.由于这种不稳定性,无定形硅中的部分原子含有悬空键(dangling bond).这些悬空键对硅作为导体的性质有很大的负面影响.然而,这些悬空键可以被氢所填充,经氢化之后,无定形硅的悬空键密度会显著减小,并足以达到半导体材料的标准.但很不如愿的一点是,在光的照射下,氢化无定形硅的导电性能将会显著衰退,这种特性被称为SWE效应(Staebler-Wronski Effect). 美国科学家Stanford R. Ovshinsky拥有许多关于无定形硅的专利,包括半导体、太阳能电池等.它们的成本较相应的晶体硅制成品要低很多. 此外,无定形硅可用作自计温度计照相机(Thermal Camera)中的微辐射探测仪(microbolometer).1年前查看全部
- 高三化学关于熔沸点高低顺序下列物质熔沸点高低顺序正确的是( )A 金刚石>晶体硅>二氧化硅>碳化硅B Cl2>CBr2>
高三化学关于熔沸点高低顺序
下列物质熔沸点高低顺序正确的是( )
A 金刚石>晶体硅>二氧化硅>碳化硅
B Cl2>CBr2>CCl4>CH4
C MgO>H2O>O2>N2
D 金刚石>生铁>纯铁>钠 zyi801年前1
zyi801年前1 -
 惯性消失 共回答了25个问题
惯性消失 共回答了25个问题 |采纳率96%C.是正确的.
分析:
A.四个都是原子晶体结构,熔沸点就看它们的原子半径的大小,原子半径越小,熔沸点越大,碳的原子半径比氧的小,氧的又比硅的小,所以正确的顺序为:金刚石>碳化硅>二氧化硅>晶体硅.
B.四个都是非极性分子结构,原子半径越小,熔沸点越低,原子半径大小顺序为:H<C<Cl<Br,所以正确的顺序为:CBr4>CCl4>Cl2>CH4.
C.氧化镁是离子晶体结构,水是极性分子结构,氮气和氧气都是非极性分子结构,分子结构的熔沸点要比离子结构的低些,非极性分子的熔沸点比极性分子的要低些,而且氮的原子半径比氧的小,所以正确的顺序就是:MgO>H2O>O2>N.
D.混合物的熔沸点要比对应的纯净物的熔沸点低,因此生铁的熔沸点比纯铁的低,所以正确的顺序为:金刚石>纯铁>生铁>钠.1年前查看全部
- 金刚石和晶体硅谁的熔点高?
 tayshan1年前1
tayshan1年前1 -
 一条肥狗 共回答了16个问题
一条肥狗 共回答了16个问题 |采纳率81.3%金刚石原因它们都是原子晶体,结构相似,成键电子数相等,C原子半径比Si小,C-C键比Si-Si键短,键长越短,键能越大,破坏键要的能量越大,共价键越稳定,所以物质越稳定.所以硬度,熔点都更大.1年前查看全部
大家在问
- 1世在字典里应该查什么部首
- 2世界上所有的物质中有那些是有毒的化学元素
- 3<<饮湖上初晴后雨>>主要描写__表达了诗人__
- 4-0.125除以8/3等于多少
- 5书湖阴先生壁的“两山排闼送青来”使用了什么修辞手法?这样写有什么好处?
- 6题不难,但我有个知识点没懂已知一次函数y=ax+b(a0的解集是()(要过程)已知一次函数y=ax+3与y=x+b的图像
- 7雁门太守行描绘的是什么
- 8给出下列长度的四组线段:一、 1,2,3; 二、 3,4,5; 三、6,7,8; 四、5,
- 9"虚"字在字典里应查哪个偏旁
- 10电车每隔8分发一次车 汽车每隔12分发一次 上午九时 电车 汽车 同时发车 求下次同时发车的时间
- 11直线运动的质点,第一秒内10的速度匀速运动,第二秒内,7的速度运动.第二秒末瞬时速度多少?这三秒内...
- 12单质硅是什么晶体啊?
- 1360个3相乘,积的个位是几.
- 14物体所受合外力不为零时,其速度不可为零 为什么是错误的
- 15某物体作直线运动,其运动规律是s=t^2+3/t,则它在4秒末的瞬时速度是