3.钛酸亚铁(FeTiO3)可用来冶炼金属钛(未来将替代钢铁),其中钛元素的化合价是
 yuyan1102022-10-04 11:39:541条回答
yuyan1102022-10-04 11:39:541条回答是+4,为什么啊

已提交,审核后显示!提交回复
共1条回复
 潜艇潜啊 共回答了16个问题
潜艇潜啊 共回答了16个问题 |采纳率87.5%- 既然是亚铁那么一定是二价的,而氧元素一般都是负二价,所以ti一定是正四价的...
- 1年前
相关推荐
- (2014•梅州二模)金属钛(Ti)硬度大、熔点高、常温时耐酸碱腐蚀,被誉为“未来金属”.以钛铁矿(主要成分为钛酸亚铁:
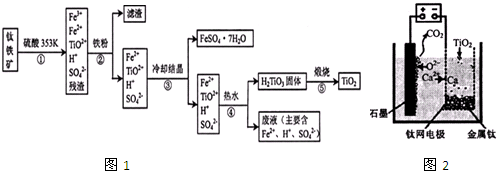
(2014•梅州二模)金属钛(ti)硬度大、熔点高、常温时耐酸碱腐蚀,被誉为“未来金属”.以钛铁矿(主要成分为钛酸亚铁:fetio3)为主要原料冶炼金属钛并获得副产品绿矾(feso4•7h2o)的工业生产流程如下:

请回答下列问题:
(1)钛铁矿和浓硫酸反应的产物之一是tioso4,反应中无气体生成.流程中加入fe屑的目的是______.
(2)过滤需要用到的玻璃仪器有烧杯、______;对过滤后的钛酸沉淀进行洗涤,判断沉淀是否洗涤干净的操作及现象是______.
(3)对溶液Ⅱ进行加热,tio2+发生水解生成钛酸,写出加热过程中发生的离子反应方程式tio2++2h2o
h2tio3↓+2h+△ .tio2++2h2o.
h2tio3↓+2h+△ .
(4)若对溶液i先进行加热后冷却结晶,可能产生的后果是______.
(5)钛***与氯气、焦炭在高温下进行反应,还生成一种可燃性无色气体,写出该反应的化学方程式tio2+2cl2+2c
ticl4+2co高温 .tio2+2cl2+2c,该工艺中,可以循环使用的物质为______(填化学式).
ticl4+2co高温 . hj_finger1年前1
hj_finger1年前1 -
 0100220315 共回答了23个问题
0100220315 共回答了23个问题 |采纳率69.6%解题思路:钛铁矿和浓硫酸反应的产物之一是TiOSO4,加入铁屑,可防止Fe2+氧化,溶液Ⅰ中含有FeSO4和TiOSO4,溶液Ⅱ主要含有TiOSO4,加入水,加热可水解生成H2TiO3,经煅烧可生成TiO2,用氯气、碳反应可生成TiCl4,高温条件下与镁反应可生成Ti,以此解答该题.钛铁矿和浓硫酸反应的产物之一是TiOSO4,加入铁屑,可防止Fe2+氧化,溶液Ⅰ中含有FeSO4和TiOSO4,溶液Ⅱ主要含有TiOSO4,加入水,加热可水解生成H2TiO3,经煅烧可生成TiO2,用氯气、碳反应可生成TiCl4,高温条件下与...
点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查物质的制备实验方案的设计,侧重于学生的分析能力和实验能力的考查,为高考常见题型,难度中等,注意把握实验的基本原理和物质的性质.1年前查看全部
- (2014•甘肃二模)工业上,以钛铁矿为原料制备二氧化钛的工艺流程如下图所示.钛铁矿主要成分为钛酸亚铁(FeTiO3),
(2014•甘肃二模)工业上,以钛铁矿为原料制备二氧化钛的工艺流程如下图所示.钛铁矿主要成分为钛酸亚铁(FeTiO3),其中一部分铁元素在风化过程中会转化为+3价.

已知:TiOSO4遇水会水解.
(1)步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为______.
(2)步骤③中,实现混合物的分离是利用物质的______(填字母序号).
a.熔沸点差异 b.溶解性差异c.氧化性、还原性差异
(3)步骤②、③、④中,均需用到的操作是______(填操作名称).
(4)请结合化学用语用化学平衡理论解释步骤④中将TiO2+转化为H2TiO3的原理:______.
(5)可以利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水),该反应的离子方程式为______.
(6)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如下图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛.
①写出阳极所发生反应的电极反应式:______.
②在制备金属钛前后,CaO的总量不变,其原因是(请结合化学用语解释)制备TiO2时,在电解槽发生如下反应:2CaO═2Ca+O2↑,2Ca+TiO2
Ti+2CaO,由此可见,CaO的量不变;一定条件 .制备TiO2时,在电解槽发生如下反应:2CaO═2Ca+O2↑,2Ca+TiO2.
Ti+2CaO,由此可见,CaO的量不变;一定条件 . yokoo1年前1
yokoo1年前1 -
 lnn1123 共回答了23个问题
lnn1123 共回答了23个问题 |采纳率95.7%解题思路:(1)铁粉将Fe3+转化为Fe2+;
(2)溶液中析出晶体是利用物质溶解度的不同得到;
(3)②③④都是从溶液中得到固体的分离过程,需要用过滤装置;
(4)依据溶液中存在平衡:TiO2++2H2O⇌H2TiO3+2H+,平衡影响因素和平衡移动原理分析判断;
(5)废液主要是亚铁离子、氢离子和二氧化锰反应发生氧化还原反应生成锰离子和铁离子;
(6)①依据装置图分析判断,阳极生成二氧化碳气体,是电解质中的氧离子失电子生成氧气,氧气和阳极石墨反应生成的二氧化碳;
②制备TiO2时,在电解槽发生如下反应:阴极:2Ca2++4e-═2Ca 阳极:2O2--4e-═O2↑,2Ca+TiO2
Ti+2CaO,由此可见,CaO的量不变.一定条件 .(1)故答案为:步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为:2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe═3Fe2+;
(2)步骤③冷却结晶得到硫酸亚铁晶体,利用的是物质溶解度的不同,通过冷却热饱和溶液得到,故答案为:b;
(3)②③④步骤的操作过程中都得到沉淀或晶体,所以需要过滤得到固体和溶液,故答案为:过滤;
(4)④中使用热水的目的是促进TiO2+水解生成H2TiO3,分离出固体加热得到TiO2;溶液中存在平衡:TiO2++2H2O⇌H2TiO3+2H+,当加入热水稀释、升温后,
平衡正向移动,生成H2TiO3;
故答案为:溶液中存在平衡:TiO2++2H2O⇌H2TiO3+2H+,当加入热水稀释、升温后,平衡正向移动,生成H2TiO3.
(5)利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水),利用二氧化锰的氧化性氧化亚铁离子为三价铁离子,反应的离子方程式为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(6)①用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,阳极发生氧化反应,阴极析出钙金属发生还原反应,阳极图示产物可可知,阳极生成二氧化碳气体,是电解质中的氧离子失电子生成氧气,氧气和阳极石墨反应生成的二氧化碳,所以电极反应为:2O2--4e-=O2↑,或C+2O2--4e-=CO2↑;
故答案为:2O2--4e-=O2↑,或C+2O2--4e-=CO2↑;
②制备TiO2时,在电解槽发生如下反应:2CaO═2Ca+O2↑,2Ca+TiO2
一定条件
.
Ti+2CaO,由此可见,CaO的量不变;
或:制备TiO2时,在电解槽发生如下反应:阴极:2Ca2++4e-═2Ca阳极:2O2--4e-═O2↑;2Ca+TiO2
一定条件
.
Ti+2CaO,由此可见,CaO的量不变;
故答案为:制备TiO2时,在电解槽发生如下反应:2CaO═2Ca+O2↑,2Ca+TiO2
一定条件
.
Ti+2CaO,由此可见,CaO的量不变.点评:
本题考点: 制备实验方案的设计;电解原理;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查了物质分离的流程分析判断,物质性质的应用,离子性质的应用,分离操作的方法,氧化还原反应的离子方程式的书写方法,电解池原理的应用,电极反应的书写原则.1年前查看全部
- 具有硬度大、熔点高、耐酸腐蚀而被应用于航空、电子等领域,由钛铁矿(主要成份是FeTiO 3 ,钛酸亚铁)提取金属钛并获得
具有硬度大、熔点高、耐酸腐蚀而被应用于航空、电子等领域,由钛铁矿(主要成份是FeTiO 3 ,钛酸亚铁)提取金属钛并获得副产品FeSO 4 ·7H 2 O的工艺过程如下 
(1)钛铁矿和浓硫酸反应的产物之一是TiOSO 4 ,常温下,该物质易溶于酸性溶液,在pH=0.5时开始转化为钛酸沉淀,
①则物质A是______(填化学式,下同),B是______;
②步骤④生成TiO(OH) 2 (即H 2 TiO 3 )的离子方程式是________________________。
(2)已知FeSO 4 ·7H 2 O的溶解度曲线如下图所示,则步骤③采用的操作是________________________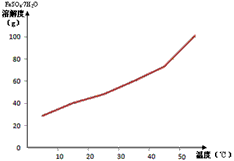
(3)工业上可通过下列反应由TiO 2 制备金属Ti 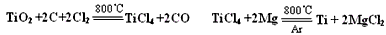
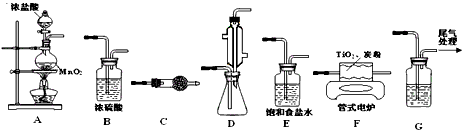
已知:常温下TiCl 4 是一种极易水解的无色液体,沸点为136.4℃。
①从下列供选用的装置中选择合适的装置制备TiCl 4 ,按气流方向连结起来:
A →______→______→ F →______→______→ G
②下列仪器中盛放的药品分别是C__________;G___________
(4)一定条件下,将TiO 2 溶解并还原为Ti 3+ ,再以KSCN作溶液作指示剂,用NH 4 Fe(SO 4 ) 2 标准溶液滴定Ti 3+ 至全部生成Ti 4+ 。称取TiO 2 样品3.0g,消耗0.2mol/L NH 4 Fe(SO 4 ) 2 溶液30mL,则TiO 2 的质量分数是
____________ 1213131年前1
1213131年前1 -
 煽你两巴掌 共回答了17个问题
煽你两巴掌 共回答了17个问题 |采纳率82.4%(1)①Fe;H 2 O;②TiO 2+ +2H 2 O=TiO(OH) 2 +2H +
(2)降温、结晶、过滤
(3)①E、B、D、C;②无水氯化钙;NaOH溶液
(4)80%1年前查看全部
- 以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方
以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方程式为:FeTiO3+2H2SO4═TiOSO4+FeSO4+2H2O

回答下列问题:
(1)钛铁矿和浓硫酸反应属于______(选填“氧化还原反应”或“非氧化还原反应”).
(2)上述生产流程中加入物质A的目的是防止Fe2+被氧化,物质A是______,上述制备TiO2的过程中,所得到的副产物和可回收利用的物质分别是______、______.
(3)反应TiCl4+2Mg═2MgCl2+Ti在Ar气氛中进行的理由是______.
(4)由二氧化钛制取四氯化钛所涉及的反应有:
TiO2(s)+2Cl2(g)+2C(s)═TiCl4(g)+2CO(g)△H1=-72kJ•mol-1
TiO2(s)+2Cl2(g)═TiCl4(g)+O2(g)△H2=+38.8kJ•mol-1
C(s)+CO2(g)═2CO(g)△H3=+282.8kJ•mol-1
反应C(s)+O2(g)═CO2(g)的△H=______. q_linbo1年前1
q_linbo1年前1 -
 rock96 共回答了15个问题
rock96 共回答了15个问题 |采纳率93.3%解题思路:以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,钛铁矿石加入浓硫酸,钛铁矿与浓硫酸发生反应的化学方程式为:FeTiO3+2H2SO4═TiOSO4+FeSO4+2H2O,加入水溶解后加入铁防止亚铁离子被氧化,沉降分离得到溶液Ⅰ,冷却结晶得到硫酸亚铁晶体,过滤得到溶液Ⅱ为TiOSO4,加热过滤得到滤液为硫酸,沉淀为钛酸煅烧得到二氧化钛,加入氯气和焦炭高温反应,由二氧化钛制取四氯化钛,加入镁反应在Ar气氛中进行,发生的反应为;TiCl4+2Mg═2MgCl2+Ti;
(1)根据氧化还原反应中元素的化合价发生变化进行分析判断;
(2)亚铁离子易被氧化为铁离子,加入金属铁可以防护被氧化,根据流程确定所得到的副产物和可回收利用的物质;
(3)Mg和Ti都有较强还原性,在高温下都易被空气中的O2氧化,镁和氮气二氧化碳都反应;
(4)根据盖斯定律来计算化学反应的焓变;(1)钛酸亚铁的化学式为FeTiO3,其中铁元素的化合价为+2价,氧元素的化合价为-2价,钛的化合价为+4价,钛铁矿和浓硫酸反应后,TiOSO4中钛的化合价为+4价,硫为+6价,氧元素的化合价为-2价,FeSO4中铁元素的化合价为+2价,氧元素的化合价为-2价,无化合价的变化,是非氧化还原反应,
故答案为:非氧化还原反应;
(2)亚铁离子易被氧化为铁离子,加入金属铁可以防护被氧化,所以A是金属铁,根据流程,所得到的副产物是绿矾,可回收利用的物质是硫酸;
故答案为:Fe;绿矾和硫酸;
(3)Mg和Ti都有较强还原性,在高温下都易被空气中的O2氧化,镁和二氧化碳反应生成氧化镁和碳,镁和氮气反应生成氮化镁,所以反应TiCl4+2Mg=2MgCl2+Ti需在Ar气氛中进行;
故答案为:防止高温下Mg和Ti与空气中的氧气(或氮气、二氧化碳)作用;
(4)已知反应a、TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g)△H1=-72kJ•mol-1
b、TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)△H2=+38.8kJ•mol-1
c、C(s)+CO2(g)=2CO(g)△H3=+282.8kJ•mol-1
根据盖斯定律,反应C(s)+O2(g)=CO2(g)可以看成是a-b-c获得,所以该化学反应的焓变△H=-72kJ•mol-1-282.8kJ•mol-1-38.8kJ•mol-1=-393.6 kJ/mol,
故答案为:-393.6 kJ/mol;点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;热化学方程式.
考点点评: 本题考查学生化学反应的方向以及元素化合物的性质知识,注意知识的归纳和整理是解题的关键,难度中等.1年前查看全部
- (2010•南通一模)以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与
(2010•南通一模)以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方程式为:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O

回答下列问题:
(1)钛铁矿和浓硫酸反应属于______(选填“氧化还原反应”或“非氧化还原反应”).
(2)上述生产流程中加入物质A的目的是防止Fe2+被氧化,物质A是______,上述制备TiO2的过程中,所得到的副产物和可回收利用的物质分别是______.
(3)反应TiCl4+2Mg=2MgCl2+Ti在Ar气氛中进行的理由是______.
(4)由二氧化钛制取四氯化钛所涉及的反应有:
TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g)△H1=-72kJ•mol-1
TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)△H2=+38.8kJ•mol-1
C(s)+CO2(g)=2CO(g)△H3=+282.8kJ•mol-1
①反应C(s)+CO2(g)=2CO(g)在高温下能够自发进行的原因是______.
②反应C(s)+O2(g)=CO2(g)的△H=______. 释然wei1年前1
释然wei1年前1 -
 零冬 共回答了13个问题
零冬 共回答了13个问题 |采纳率84.6%解题思路:(1)根据氧化还原反应中元素的化合价发生变化进行分析判断;
(2)亚铁离子易被氧化为铁离子,加入金属铁可以防护被氧化,根据流程确定所得到的副产物和可回收利用的物质;
(3)Mg和Ti都有较强还原性,在高温下都易被空气中的O2氧化,镁和氮气二氧化碳都反应;
(4)①根据反应能否自发进行的判据△H-T△S来判断;
②根据盖斯定律来计算化学反应的焓变.(1)钛酸亚铁的化学式为FeTiO3,其中铁元素的化合价为+2价,氧元素的化合价为-2价,钛的化合价为+4价,钛铁矿和浓硫酸反应后,TiOSO4中钛的化合价为+4价,硫为+6价,氧元素的化合价为-2价,FeSO4中铁元素的化合价为+2价,氧元素的化合价为-2价,无化合价的变化,是非氧化还原反应,
故答案为:非氧化还原反应;
(2)亚铁离子易被氧化为铁离子,加入金属铁可以防护被氧化,所以A是金属铁,根据流程,所得到的副产物是绿矾,可回收利用的物质是硫酸,故答案为:Fe;绿矾和硫酸;
(3)Mg和Ti都有较强还原性,在高温下都易被空气中的O2氧化,镁和二氧化碳反应生成氧化镁和碳,镁和氮气反应生成氮化镁,所以反应TiCl4+2Mg=2MgCl2+Ti需在Ar气氛中进行,
故答案为:防止高温下Mg和Ti与空气中的氧气(或氮气、二氧化碳)作用;
(4)①根据反应能否自发进行的判据△H-T△S,△H>0,所以高温下才自发进行,说明该反应的△S>0(或熵增加),故答案为:△S>0(或熵增加);
②已知反应a、TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g)△H1=-72kJ•mol-1
b、TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)△H2=+38.8kJ•mol-1
c、C(s)+CO2(g)=2CO(g)△H3=+282.8kJ•mol-1
根据盖斯定律,反应C(s)+O2(g)=CO2(g)可以看成是a-b-c获得,所以该化学反应的焓变△H=-72kJ•mol-1-282.8kJ•mol-1-38.8kJ•mol-1=-393.6 kJ/mol,
故答案为:-393.6 kJ/mol.点评:
本题考点: 金属冶炼的一般原理;用盖斯定律进行有关反应热的计算;焓变和熵变.
考点点评: 本题考查学生化学反应的方向以及元素化合物的性质知识,注意知识的归纳和整理是解题的关键,难度不大.1年前查看全部
- 第二问怎么看钛酸亚铁拆不拆 还有第三问是怎么做的
 340823231年前1
340823231年前1 -
 机芯 共回答了17个问题
机芯 共回答了17个问题 |采纳率100%第二问:钛酸亚铁不能拆开,因为题目中已经提示(钛酸亚铁,不溶于水),注意不溶于水的提示,难溶物是不可以拆开的.
(2)FeTiO3+4H+=Fe2++TiO2++2H2O
(3)TiO2++(x+1)H2O=TiO2•xH2O+2H+
以下对试题的一些评论希望对你有帮助
(2)考查化学用语的使用技能,将流图中获取的信息以离子方程式的形式予以加工,如果不对流程有整体的认识和分析较难回答.TiO2+离子的信息与酸溶过程之间还有加入铁粉的步骤,基础扎实的学生能够从化合价和氧化还原反应原理排除其干扰.(3)本题学生的思维障碍较多,如不理解“稀释、加热”的目的,对TiO2•xH2O的表示形式感到陌生,某些金属离子(如铁离子、铝离子)易水解的性质不能有效迁移.所以出现了增加反应物O2等错误.从答题情况看相当多学生守恒的方法运用生疏.部分学生错误地将该步骤理解为蒸发溶液得到固体,对第(4)问的解答也有不利影响.实际上该知识和实验方法在人教版选修4的教材中《盐的水解》有一定篇幅的介绍,是水解的重要应用之一,属于基本理论的应用,所以应该作为备考的重要内容对待.1年前查看全部
- 以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方
以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方程式为:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O

回答下列问题:
(1)钛铁矿和浓硫酸反应属于______(选填“氧化还原反应”或“非氧化还原反应”);
(2)反应TiCl4+2Mg=2MgCl2+Ti在Ar气氛中进行的理由是______;
(3)上述生产流程中加入物质A的目的是防止Fe2+被氧化,物质A是______,上述制备TiO2的过程中,所得到的副产物及可回收利用的物质是______.
(4)钛、氯气和过量焦炭在高温下反应的化学方程式2Cl2+TiO2+2C
TiCl4+2CO高温 .2Cl2+TiO2+2C;
TiCl4+2CO高温 .
(5)如果取钛铁矿At,生产出钛Bt(不考虑损耗),则钛铁矿中钛的质量分数[B/A]×100%[B/A]×100%(用A、B字母表示). 52612611年前1
52612611年前1 -
 飞雪夜归人 共回答了13个问题
飞雪夜归人 共回答了13个问题 |采纳率84.6%解题思路:(1)根据氧化还原反应中元素的化合价发生变化进行分析判断;(2)Mg和Ti都有较强还原性,在高温下都易被空气中的O2氧化,镁和氮气二氧化碳都反应;(3)浓硫酸具有强氧化性,与Fe2+反应生成Fe3+,加入铁粉可将Fe3+还原成Fe2+;过滤后滤液中含有FeSO4;由工艺流程图及题中信息可知可回收利用的物质是FeSO4•7H2O、Fe、H2SO4;(4)氯气、二氧化钛和焦炭在高温下反应,由工艺流程图及题中信息可知生成物为四氯化钛和一氧化碳,根据反应前后元素种类不变,即可写出反应的化学方程式;(5)根据钛原子守恒进行解答;(1)钛酸亚铁的化学式为FeTiO3,其中铁元素的化合价为+2价,氧元素的化合价为-2价,钛的化合价为+4价,钛铁矿和浓硫酸反应后,TiOSO4中钛的化合价为+4价,硫为+6价,氧元素的化合价为-2价,FeSO4中铁元素的化合价为+2价,氧元素的化合价为-2价,无化合价的变化,是非氧化还原反应,
故答案为:非氧化还原反应;
(2)Mg和Ti都有较强还原性,在高温下都易被空气中的O2氧化,镁和二氧化碳反应生成氧化镁和碳,镁和氮气反应生成氮化镁,所以反应TiCl4+2Mg=2MgCl2+Ti需在Ar气氛中进行,
故答案为:防止高温下Mg和Ti与空气中的氧气(或氮气、二氧化碳)作用;
(3)浓硫酸具有强氧化性,与Fe2+反应生成Fe3+,加入铁粉可将Fe3+还原成Fe2+,所以物质A是Fe;过滤后滤液中含有FeSO4,结晶后可得到FeSO4•7H2O晶体,由工艺流程图及题中信息可知上述制备TiO2的过程中,所得到的副产物及可回收利用的物FeSO4•7H2O、Fe、H2SO4,
故答案为:Fe;FeSO4•7H2O、Fe、H2SO4;
(4)氯气、二氧化钛和焦炭在高温下反应,氯气具有氧化性,碳具有还原性,由工艺流程图及题中信息可知生成物为四氯化钛和一氧化碳,根据反应前后元素种类不变,反应的化学方程式为:2Cl2+TiO2+2C
高温
.
TiCl4+2CO,
故答案为:2Cl2+TiO2+2C
高温
.
TiCl4+2CO;
(5)如果取钛铁矿At,生产出钛Bt,根据钛没有损耗,所以生产出的钛的质量等于钛铁矿中钛元素的质量,所以钛铁矿中钛的质量分数[B/A]×100%,
故答案为:[B/A]×100%;点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;制备实验方案的设计.
考点点评: 本题考查以钛铁矿为主要原料冶炼金属钛工艺流程,注意分析流程各反应物的转化是解答的关键,题目难度中等.1年前查看全部
- 单质钛的机械强度高,抗腐蚀能力强,有“未来金属”之称.工业上常用硫酸分解钛铁矿(主要成分是钛酸亚铁FeTiO3)的方法来
单质钛的机械强度高,抗腐蚀能力强,有“未来金属”之称.工业上常用硫酸分解钛铁矿(主要成分是钛酸亚铁FeTiO3)的方法来制取TiO2,再由TiO2制金属钛.主要反应有:
①FeTiO3+3H2SO4═Ti(SO4)2+FeSO4+3H2O
②Ti(SO4)2+3H2O═H2TiO3↓+2H2SO4
③H2TiO3
TiO2+H2O△
④TiO2+2C+2Cl2
TiCl4+2CO△
⑤TiCl4+2Mg
2MgCl2+Ti△
下列叙述正确的是( )
A.反应①是氧化还原反应
B.反应②是氧化还原反应
C.反应④中TiO2是氧化剂
D.反应⑤中TiCl4是氧化剂 xaxia1年前1
xaxia1年前1 -
 haha25 共回答了17个问题
haha25 共回答了17个问题 |采纳率94.1%解题思路:A、依据反应前后元素化合价的变化分析判断;
B、依据反应前后元素化合价的变化判断;
C、钛元素化合价未变;
D、钛元素化合价降低作业环境;A、①反应前后无化合价的变化,不是氧化还原反应,故A错误;
B、反应②前后无元素化合价的变化,不是氧化还原反应,故B错误;
C、反应④中 钛元素化合价无变化,故C错误;
D、反应⑤钛元素从+4价变化为0价,做氧化剂,故D正确;
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化反应、化合价、反应类型及原子与离子的关系,考查知识点全面,题目适中.1年前查看全部
- (2013•昆明模拟)工业上,以钛铁矿为原料制备二氧化钛的某工艺流程如图1所示.钛铁矿主要成分为钛酸亚铁( T
(2013•昆明模拟)工业上,以钛铁矿为原料制备二氧化钛的某工艺流程如图1所示.钛铁矿主要成分为钛酸亚铁( TETiO3).其中一部分铁元素在风化过程中会转化为+3价.
完成下列填空:
(1)步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为______.
(2)步骤③中,实现混合物的分离是利用物质的______(填字母序号).
a.熔沸点差异b溶解性差异c氧化性、还原性差异
(3)步骤②、③、④中,均需进行的操作是______(填操作名称).
(4)可利用生产过程中的废液与软锰矿(主要成分MnO2)反应生产硫酸锰,则反应的离子方程式为
(5)利用图2装置,石墨作阳极,钛网作阴极,熔融CaF2-CaO做电解质,可获得金属钙,钙再作为还
原剂,可还原二氧化钛制各金属钛.
①阳极所发生的反应为______.
②在制备金属钛前后,CaO的总量不变,其原因是电解槽中发生反应:2CaO
2Ca+O2↑,钙还原二氧化钛反应方程式为:2Ca+TiO2=Ti+2CaO,在制备金属钛前后,整套装置中CaO的总量不变通电 .电解槽中发生反应:2CaO.
2Ca+O2↑,钙还原二氧化钛反应方程式为:2Ca+TiO2=Ti+2CaO,在制备金属钛前后,整套装置中CaO的总量不变通电 .
(6)T业上用4.0吨钛铁矿制得1 6吨的二氧化钛,则钛铁矿中钛元素的质量分数是______.(假设生产过程中钛没有损失) 我心枯寂1年前1
我心枯寂1年前1 -
 zyfmouse 共回答了16个问题
zyfmouse 共回答了16个问题 |采纳率100%解题思路:(1)金属铁可以和铁离子反应生成亚铁离子,结合电荷守恒、原子守恒配平写出离子方程式;
(2)根据物质溶解度本题分析析出晶体的条件应用;
(3)依据操作过程中形成的物质溶解性和分离目的分析回答;
(4)依据二氧化锰的氧化性氧化亚铁离子分析氧化还原反应生成二价锰的化合物,结合电荷守恒和原子守恒写出;
(5)①依据图示生成物质的分析,阳极生成二氧化碳,阴极析出钙,结合电解池中阳极发生氧化反应,阴极发生还原反应,写出电极反应;
②根据电解槽中发生的反应:2CaO
2Ca+O2↑以及钙还原二氧化钛反应方程式:2Ca+TiO2=Ti+2CaO来回答;通电 .
(6)根据钛原子守恒进行解答.(1)用铁粉将Fe3+转化为Fe2+的反应的离子方程式为:2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+;
(2)步骤③冷却结晶得到硫酸亚铁晶体,利用的是物质溶解度的不同,通过冷却热饱和溶液得到,故答案为:b;
(3)②③④步骤的操作过程中都得到沉淀或晶体,所以需要过滤得到固体和溶液,故答案为:过滤;
(4)利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水),利用二氧化锰的氧化性氧化亚铁离子为三价铁离子,反应的离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(5)①用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,阳极发生氧化反应,阴极析出钙金属发生还原反应,阳极图示产物可可知,阳极生成二氧化碳气体,是电解质中的氧离子失电子生成氧气,氧气和阳极石墨反应生成的二氧化碳,所以电极反应为:2O2--4e-=O2↑,或C+2O2--4e-=CO2↑;
故答案为:2O2--4e-=O2↑,或C+2O2--4e-=CO2↑;
②阴极上电极反应式为:2Ca2++4e-═2Ca,阳极上电极反应为:2O2--4e-=O2↑,电解槽中发生反应:2CaO
通电
.
2Ca+O2↑,钙还原二氧化钛反应方程式为:2Ca+TiO2=Ti+2CaO,在制备金属钛前后,整套装置中CaO的总量不变,故答案为:电解槽中发生反应:2CaO
通电
.
2Ca+O2↑,钙还原二氧化钛反应方程式为:2Ca+TiO2=Ti+2CaO,在制备金属钛前后,整套装置中CaO的总量不变;
(6)如果取钛铁矿4t,生产出16吨的二氧化钛,其中钛元素的质量是16×[48/80]×100%=9.6t,所以钛铁矿中钛的质量分数[9.6/4]×100%=24%,
故答案为:24%.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;电解原理.
考点点评: 本题考查了物质分离的流程分析判断,物质性质的应用,离子性质的应用,分离操作的方法,氧化还原反应的离子方程式的书写方法,电解池原理的应用,电极反应的书写原则.1年前查看全部
- (13分)[探究一]为测定钛铁矿(含FeTiO 3 ,钛酸亚铁)中可提取氧的质量分数,某研究性学习小组设计了以下两套实验
(13分)
[探究一]为测定钛铁矿(含FeTiO 3 ,钛酸亚铁)中可提取氧的质量分数,某研究性学习小组设计了以下两套实验装置:(注:可提取氧指的是可被H 2 、C转化为H 2 O、CO 2 的氧原子)
(1)已知FeTiO 3 被H 2 还原后,生成Fe、TiO 2 和水,学生甲设想用图-1装置(A为电加热装置)从钛铁矿中提取氧。请写出FeTiO 3 在加热时被H 2 还原的化学方程式:
___________________________________________________________________
(2)已知FeTiO 3 被C还原后生成Fe、TiO 2 和CO 2 ,学生乙设想用图-2装置(A为电加热装置)从钛铁矿中提取氧,并且认为该方案的意义在于:反应产生的CO 2 可通过绿色植物的光合作用转化为营养物质,同时产生氧气:
6CO 2 +6H 2 O C 6 H 12 O 6 (葡萄糖)+6O 2 。
C 6 H 12 O 6 (葡萄糖)+6O 2 。
实验过程中,称得反应前装置A中钛铁矿的质量为ag,炭粉的质量为bg,反应后装置B中产生CaCO 3 的质量为cg,则钛铁矿中可提取氧的质量分数的表达式为 。
(3)经专家评审后,认定两个方案都很有意义,但实验设计方面还存在不足之处,例如图-2装置在加热时,生成的CO 2 不可能全部被澄清石灰水吸收,同时钛铁矿和炭粉在加热时还会产生CO,给实验带来误差。
①请对学生乙的设想提出改进措施:改用图-1装置加热钛铁矿和炭粉,并在U型管B之前增加盛有 __________ 的燃烧管,在B之后增加 。
②改进后,实验自始至终需持续向装置A中通入N 2 的目的是 。
[探究二]纳米TiO 2 作为一种光催化剂越来越受到人们的关注,现正广泛开发运用。
(4)某科研小组在不同的载体(钛片、铝片、陶瓷)表面制备二氧化钛薄膜,来考察不同载体TiO 2 薄膜光催化使甲基橙脱色,每次光照20min取一次样,实验结果如图所示,下列说法正确的是 。(双选)
(a)不同载体,无论何种温度一定是钛片最好
(b)约在520℃时,钛片载体的光催化活性最好
(c)无论何种载体,催化活性总是随温度的升高而升高
(d)不同负载TiO 2 薄膜的光催化活性不同 红骆驼5551年前1
红骆驼5551年前1 -
 傻傻乖乖 共回答了20个问题
傻傻乖乖 共回答了20个问题 |采纳率80%1年前查看全部
- (2012•河西区一模)月球表面富含钛铁矿,其主要成分是钛酸亚铁(FeTiO3),其中钛元素的化合价为( )
(2012•河西区一模)月球表面富含钛铁矿,其主要成分是钛酸亚铁(FeTiO3),其中钛元素的化合价为( )
A.+1
B.+2
C.+3
D.+4 疯叻1年前1
疯叻1年前1 -
 381986665 共回答了16个问题
381986665 共回答了16个问题 |采纳率93.8%解题思路:根据在化合物中正负化合价代数和为零,进行解答.根据在化合物中正负化合价代数和为零,可得钛酸亚铁(FeTiO3)中钛元素的化合价为:
(+2)+x+(-2)×3=0,x=+4;故选D.点评:
本题考点: 化学式的书写及意义;常见元素与常见原子团的化合价;化合价规律和原则.
考点点评: 本题考查学生根据在化合物中正负化合价代数和为零计算指定元素化合价的解题能力.1年前查看全部
- 月球表面富含钛铁矿,钛铁矿的主要成分是钛酸亚铁(FeTiO3),其中钛元素的化合价为多少
 啊飞啊1年前3
啊飞啊1年前3 -
 系統默認 共回答了9个问题
系統默認 共回答了9个问题 |采纳率88.9%铁以亚铁形式存在,化合价为+2,氧的化合价是-2,三个氧就是-6,根据化合价守恒,钛的化合价是+41年前查看全部
大家在问
- 1我最喜爱的洋娃娃作文怎么写300字
- 2(2011•普宁市模拟)已知函数f(x)=x2+m,其中m∈R.定义数列{an}如下:a1=0,an+1=f(an),n
- 3请问:把铝放入氨水中会怎样反应?为什么与氢氧化钠反应原理不一样?
- 4有浓度为a的酒精,满瓶共m升,每次倒出n升(n
- 5求英语作文2个 在300字以内就可以 第一个以前同学去美国了,叫王丽,给她写封信,问她生活状况 第二个是寻
- 6最远的距离,是我在你身边却不在你心里 英语长句翻译
- 7已知函数f(x)=(a*2^x+a-2)/(2^x+1)为奇函数.判断函数f(x)的单调性并用定义证明
- 8could you tell me what to do it可以吗?那个it要不要加,
- 9He a___ some words to explain his idea.
- 10下列措施中,属于增大摩擦的是( )
- 11如图,△ABC的周长为18cm,AC,AB边上的中线BE,CF相交于O,且AF=3cm,AE=2cm.求BC的长
- 12很简单的单乘单项式的计算(x-2y)(x+4y) (ab+7)(ab-3) n(n+2)(2n+1) (1-3x)(1+
- 13第14课《学会合作》中的疑问句是哪句?举了哪两个事例(概括),第三自然段用了哪三种表达方法?
- 14Who is she sending it----------?A.from B.
- 15甲地海拔1500米,乙地海拔1000米,甲乙两地相对高度是


