乙二酸(HOOC-COOH)俗名草酸,易溶于水,属于二元中强酸,生产和科学实验中有着广泛的用途.草酸晶体的组成可用H 2
 scllxk2022-10-04 11:39:541条回答
scllxk2022-10-04 11:39:541条回答| 乙二酸(HOOC-COOH)俗名草酸,易溶于水,属于二元中强酸,生产和科学实验中有着广泛的用途.草酸晶体的组成可用H 2 C 2 O 4 -xH 2 O表示,为了测定x值,进行如下实验:称取Wg草酸晶体,配成100.00mL水溶液,量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H 2 SO 4 后,用浓度为amol-L -1 的KMnO 4 溶液滴定, (1)将所发生的反应方程式完成并配平,将完整的化学方程式写在答题卡上. KMnO 4 +H 2 C 2 O 4 +______═K 2 SO 4 +CO 2 ↑+MnSO 4 +______ (2)整个实验过程中不需要的仪器有______(填序号). a.托盘天平(带砝码,镊子)b.酸式滴定管c.烧瓶 d.100mL容量瓶e.烧杯f.漏斗g.锥形瓶 h.玻璃棒i.药匙 (3)实验中,标准KMnO 4 溶液应盛装在______式滴定管中.滴定终点时溶液的颜色变化为______. (4)在滴定过程中若用去amol-L -1 的KMnO 4 溶液VmL,则所配制的草酸溶液的物质的量浓度为______mol-L -1 ,由此可计算x的值是______.(用含W、a、V的代数式表示) (5)该小组同学将0.02mol草酸晶体(H 2 C 2 O 4 -2H 2 O)加入到100mL0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,则该溶液中各离子浓度由大到小的顺序为______. |

已提交,审核后显示!提交回复
共1条回复
 jzdongziyu 共回答了20个问题
jzdongziyu 共回答了20个问题 |采纳率80%- (1)反应中根据氧化剂得失电子守恒可知氧化剂和还原剂物质的量之间的关系为:2MnO 4 - ~5H 2 C 2 O 4 ,在根据电荷守恒和质量守恒可写出反应方程式为:2KMnO 4 +5 H 2 C 2 O 4 +3H 2 SO 4 ═K 2 SO 4 +10CO 2 ↑+2 MnSO 4 +8H 2 O,故答案为:2KMnO 4 +5 H 2 C 2 O 4 +3H 2 SO 4 ═K 2 SO 4 +10CO 2 ↑+2 MnSO 4 +8H 2 O;
(2))①为了配制准确浓度的草酸溶液,所需要的实验仪器主要有天平(含砝码)、烧杯、药匙、100mL容量瓶、胶头滴管、玻璃棒等;②用高锰酸钾溶液进行滴定测草酸的物质的量,所需要的实验仪器主要有烧杯、酸式滴定管、铁架台(带滴定管夹)、锥形瓶等,故答案为:c,f;
(3)KMnO 4 溶液具有强氧化性,可以腐蚀橡皮管,故KMnO 4 溶液应装在酸式滴定管中;滴定时,左手控制滴定管活塞,右手摇动锥形瓶,眼睛注视溶液颜色的变化;KMnO 4 溶液呈紫色,草酸反应完毕,滴入最后一滴KMnO 4 溶液,紫色不褪去,说明滴定到终点,不需要外加指示剂,故答案为:酸;酸溶液由无色变为浅紫色且半分钟不褪色;
(4)2KMnO 4 ~5H 2 C 2 O 4
2mol 5mol
aV×10 -3 mol 0.025×Cmol
2mol
aV×1 0 -3 mol =
5mol
0.025×Cmol
解得:C=0.1aVmol?L -1
H 2 C 2 O 4 ?xH 2 O~H 2 C 2 O 4 ~xH 2 O
1mol 18xg
0.1aV×0.1 w-0.1aV×0.1×90
1mol
0.1aV×0.1 =
18xg
w- 0.1aV×0.1×90
解得X=
50w
9av -5
故答案为:0.1aV;
50w
9av -5;
(5)两者正好1:1反应生成NaHC 2 O 4 ,溶液显酸性说明HC 2 O 4 - 的电离程度大于其水解程度,而溶液中还存在着水的电离,故H + >C 2 O 4 2- ,由于离子的电离程度较小,则有HC 2 O 4 - >H + ,故正确顺序为Na + >HC 2 O 4 - >H + >C 2 O 4 2- >OH - ,故答案为:C(Na + )>c(HC 2 O 4 - )>c(H + )>c(C 2 O 4 2- )>c(OH - ); - 1年前
相关推荐
- 乙二酸乙二酯是什么最简便的流程途径顺序正确的是:1取代反映2加成反应3氧化反应4还原反应5消去反应6酯化反应7中和反应8
乙二酸乙二酯是什么
最简便的流程途径顺序正确的是:1取代反映2加成反应3氧化反应4还原反应5消去反应6酯化反应7中和反应8缩聚反应
a52136b12357c52138d12536
具体和什么东西反应 feiyu52113141年前3
feiyu52113141年前3 -
 wfh168090 共回答了21个问题
wfh168090 共回答了21个问题 |采纳率90.5%O=C - C=O
▏ ▏
OCH2CH2 O
溴代乙烷→消去反应→乙烯+Br2→加成反应→1,2-二溴乙烷+NaOH→取代反应→乙二醇→氧化反应→乙二酸+乙二醇→酯化反应→乙二酸乙二酯
所以是 a 5 2 1 3 61年前查看全部
- 乙二酸乙二酯一定是环状吗
 赖rr兴1年前1
赖rr兴1年前1 -
 悠仰 共回答了19个问题
悠仰 共回答了19个问题 |采纳率84.2%不一定是环状1年前查看全部
- 有机化学反应方程式配平规律有机化学反应方程式怎么配平?例如乙醛和和氢氧化铜反应,乙二酸/乙二酸钠与高锰酸钾进行滴定反应的
有机化学反应方程式配平规律
有机化学反应方程式怎么配平?例如乙醛和和氢氧化铜反应,乙二酸/乙二酸钠与高锰酸钾进行滴定反应的方程式配平.主要是那些反应式中既有有机物也有无机物那种方程式 云游2211年前1
云游2211年前1 -
 fcyj008 共回答了19个问题
fcyj008 共回答了19个问题 |采纳率89.5%化合反应
1、镁在空气中燃烧:2Mg + O2 点燃 2MgO
2、铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O4
3、铝在空气中燃烧:4Al + 3O2 点燃 2Al2O3
4、氢气在空气中燃烧:2H2 + O2 点燃 2H2O
5、红磷在空气中燃烧:4P + 5O2 点燃 2P2O5
6、硫粉在空气中燃烧: S + O2 点燃 SO2
7、碳在氧气中充分燃烧:C + O2 点燃 CO2
8、碳在氧气中不充分燃烧:2C + O2 点燃 2CO
9、二氧化碳通过灼热碳层: C + CO2 高温 2CO
10、一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO2
11、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O === H2CO3
12、生石灰溶于水:CaO + H2O === Ca(OH)2
13、无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4·5H2O
14、钠在氯气中燃烧:2Na + Cl2点燃 2NaCl
分解反应
15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O+ O2↑
16、加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 + O2↑
17、水在直流电的作用下分2H2O 通电 2H2↑+ O2 ↑
18、碳酸不稳定而分H2CO3 === H2O + CO2↑
19、高温煅烧石灰石(二氧化碳工业制法):CaCO3 高温 CaO + CO2↑
置换反应
20、铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu
21、锌和稀硫酸反应(实验室制氢气):Zn + H2SO4 == ZnSO4 + H2↑
22、镁和稀盐酸反应:Mg+ 2HCl === MgCl2 + H2↑
23、氢气还原氧化铜:H2 + CuO 加热 Cu + H2O
24、木炭还原氧化铜:C+ 2CuO 高温 2Cu + CO2↑
25、甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O
26、水蒸气通过灼热碳层:H2O + C 高温 H2 + CO
27、焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe + 3CO2↑
其他
28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH + CuSO4 == Cu(OH)2↓ + Na2SO4
29、甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O
30、酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O
31、一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO2
32、一氧化碳还原氧化铁:3CO+ Fe2O3 高温 2Fe + 3CO2
33、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O
34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH + CO2 ==== Na2CO3 + H2O
35、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
36、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑
一. 物质与氧气的反应:
(1)单质与氧气的反应:
1. 镁在空气中燃烧:2Mg + O2 点燃 2MgO
2. 铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O4
3. 铜在空气中受热:2Cu + O2 加热 2CuO
4. 铝在空气中燃烧:4Al + 3O2 点燃 2Al2O3
5. 氢气中空气中燃烧:2H2 + O2 点燃 2H2O
6. 红磷在空气中燃烧:4P + 5O2 点燃 2P2O5
7. 硫粉在空气中燃烧: S + O2 点燃 SO2
8. 碳在氧气中充分燃烧:C + O2 点燃 CO2
9. 碳在氧气中不充分燃烧:2C + O2 点燃 2CO
(2)化合物与氧气的反应:
10. 一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO2
11. 甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O
12. 酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O
二.几个分解反应:
13. 水在直流电的作用下分2H2O 通电 2H2↑+ O2 ↑
14. 加热碱式碳酸铜:Cu2(OH)2CO3 加热 2CuO + H2O + CO2↑
15. 加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl + 3O2 ↑
16. 加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 + O2↑
17. 碳酸不稳定而分H2CO3 === H2O + CO2↑
18. 高温煅烧石灰石:CaCO3 高温 CaO + CO2↑
三.几个氧化还原反应:
19. 氢气还原氧化铜:H2 + CuO 加热 Cu + H2O
20. 木炭还原氧化铜:C+ 2CuO 高温 2Cu + CO2↑
21. 焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe + 3CO2↑
22. 焦炭还原四氧化三铁:2C+ Fe3O4 高温 3Fe + 2CO2↑
23. 一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO2
24. 一氧化碳还原氧化铁:3CO+ Fe2O3 高温 2Fe + 3CO2
25. 一氧化碳还原四氧化三铁:4CO+ Fe3O4 高温 3Fe + 4CO2
四.单质、氧化物、酸、碱、盐的相互关系
(1)金属单质 + 酸 -------- 盐 + 氢气 (置换反应)
26. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑
27. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑
28. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑
29. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑
30. 锌和稀盐酸Zn + 2HCl === ZnCl2 + H2↑
31. 铁和稀盐酸Fe + 2HCl === FeCl2 + H2↑
32. 镁和稀盐酸Mg+ 2HCl === MgCl2 + H2↑
33. 铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑
(2)金属单质 + 盐(溶液) ------- 另一种金属 + 另一种盐
34. 铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu
35. 锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu
36. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 + Hg
(3)碱性氧化物 +酸 -------- 盐 + 水
37. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O
38. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O
39. 氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O
40. 氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O
41. 氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O
42. 氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O
(4)酸性氧化物 +碱 -------- 盐 + 水
43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O
44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O
45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O
46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O
47. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3 ↓+ H2O
(5)酸 + 碱 -------- 盐 + 水
48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O
49. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O
50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2 + 2H2O
51. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O
52. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ==== FeCl3 + 3H2O
53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O
54.硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O
55.硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 + 2H2O
56.硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ==== CuSO4 + 2H2O
57. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O
58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O
(6)酸 + 盐 -------- 另一种酸 + 另一种盐
59.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
60.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑
61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑
62.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓ + HNO3
63.硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑
64.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4 ↓+ 2HCl
(7)碱 + 盐 -------- 另一种碱 + 另一种盐
65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓ + Na2SO4
66.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓ + 3NaCl
67.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓ + 2NaCl
68. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓ + 2NaCl
69. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH
(8)盐 + 盐 ----- 两种新盐
70.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 ==== AgCl↓ + NaNO3
71.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl
五.其它反应:
72.二氧化碳溶解于水:CO2 + H2O === H2CO3
73.生石灰溶于水:CaO + H2O === Ca(OH)2
74.氧化钠溶于水:Na2O + H2O ==== 2NaOH
75.三氧化硫溶于水:SO3 + H2O ==== H2SO4
76.硫酸铜晶体受热分CuSO4·5H2O 加热 CuSO4 + 5H2O
77.无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4·5H2
化学方程式 反应现象 应用
2Mg+O2点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟 白色信号弹
2Hg+O2点燃或Δ2HgO 银白液体、生成红色固体 拉瓦锡实验
2Cu+O2点燃或Δ2CuO 红色金属变为黑色固体
4Al+3O2点燃或Δ2Al2O3 银白金属变为白色固体
3Fe+2O2点燃Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热 4Fe + 3O2高温2Fe2O3
C+O2 点燃CO2 剧烈燃烧、白光、放热、使石灰水变浑浊
S+O2 点燃SO2 剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰
2H2+O2 点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水) 高能燃料
4P+5O2 点燃2P2O5 剧烈燃烧、大量白烟、放热、生成白色固体 证明空气中氧气含量
CH4+2O2点燃2H2O+CO2 蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水) 甲烷和天然气的燃烧
2C2H2+5O2点燃2H2O+4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水) 氧炔焰、焊接切割金属
2KClO3MnO2 Δ2KCl +3O2↑ 生成使带火星的木条复燃的气体 实验室制备氧气
2KMnO4Δ K2MnO4+MnO2+O2↑ 紫色变为黑色、生成使带火星木条复燃的气体 实验室制备氧气
2HgOΔ2Hg+O2↑ 红色变为银白、生成使带火星木条复燃的气体 拉瓦锡实验
2H2O通电2H2↑+O2↑ 水通电分解为氢气和氧气 电解水
Cu2(OH)2CO3Δ2CuO+H2O+CO2↑ 绿色变黑色、试管壁有液体、使石灰水变浑浊气体 铜绿加热
NH4HCO3ΔNH3↑+ H2O +CO2↑ 白色固体消失、管壁有液体、使石灰水变浑浊气体 碳酸氢铵长期暴露空气中会消失
Zn+H2SO4=ZnSO4+H2↑ 有大量气泡产生、锌粒逐渐溶解 实验室制备氢气
Fe+H2SO4=FeSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解
Mg+H2SO4 =MgSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解
2Al+3H2SO4=Al2(SO4)3+3H2↑ 有大量气泡产生、金属颗粒逐渐溶解
Fe2O3+3H2 Δ 2Fe+3H2O 红色逐渐变为银白色、试管壁有液体 冶炼金属、利用氢气的还原性
Fe3O4+4H2 Δ3Fe+4H2O 黑色逐渐变为银白色、试管壁有液体 冶炼金属、利用氢气的还原性
WO3+3H2Δ W +3H2O 冶炼金属钨、利用氢气的还原性
MoO3+3H2 ΔMo +3H2O 冶炼金属钼、利用氢气的还原性
2Na+Cl2Δ或点燃2NaCl 剧烈燃烧、黄色火焰 离子化合物的形成、
H2+Cl2 点燃或光照 2HCl 点燃苍白色火焰、瓶口白雾 共价化合物的形成、制备盐酸
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 蓝色沉淀生成、上部为澄清溶液 质量守恒定律实验
2C +O2点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因
2C O+O2点燃2CO2 蓝色火焰 煤气燃烧
C + CuO 高温2Cu+ CO2↑ 黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体 冶炼金属
2Fe2O3+3C 高温4Fe+ 3CO2↑ 冶炼金属
Fe3O4+2C高温3Fe + 2CO2↑ 冶炼金属
C + CO2 高温2CO
CO2 + H2O = H2CO3 碳酸使石蕊变红 证明碳酸的酸性
H2CO3 ΔCO2↑+ H2O 石蕊红色褪去
Ca(OH)2+CO2= CaCO3↓+ H2O 澄清石灰水变浑浊 应用CO2检验和石灰浆粉刷墙壁
CaCO3+H2O+CO2 = Ca(HCO3)2 白色沉淀逐渐溶解 溶洞的形成,石头的风化
Ca(HCO3)2Δ CaCO3↓+H2O+CO2↑ 白色沉淀、产生使澄清石灰水变浑浊的气体 水垢形成.钟乳石的形成
2NaHCO3ΔNa2CO3+H2O+CO2↑ 产生使澄清石灰水变浑浊的气体 小苏打蒸馒头
CaCO3 高温 CaO+ CO2↑ 工业制备二氧化碳和生石灰
CaCO3+2HCl=CaCl2+ H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体 实验室制备二氧化碳、除水垢
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体 泡沫灭火器原理
Na2CO3+2HCl=2NaCl+ H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体 泡沫灭火器原理
MgCO3+2HCl=MgCl2+H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体
CuO +COΔ Cu + CO2 黑色逐渐变红色,产生使澄清石灰水变浑浊的气体 冶炼金属
Fe2O3+3CO高温 2Fe+3CO2 冶炼金属原理
Fe3O4+4CO高温 3Fe+4CO2 冶炼金属原理
WO3+3CO高温 W+3CO2 冶炼金属原理
CH3COOH+NaOH=CH3COONa+H2O
2CH3OH+3O2点燃2CO2+4H2O
C2H5OH+3O2点燃2CO2+3H2O 蓝色火焰、产生使石灰水变浑浊的气体、放热 酒精的燃烧
Fe+CuSO4=Cu+FeSO4 银白色金属表面覆盖一层红色物质 湿法炼铜、镀铜
Mg+FeSO4= Fe+ MgSO4 溶液由浅绿色变为无色 Cu+Hg(NO3)2=Hg+ Cu (NO3)2
Cu+2AgNO3=2Ag+ Cu(NO3)2 红色金属表面覆盖一层银白色物质 镀银
Zn+CuSO4= Cu+ZnSO4 青白色金属表面覆盖一层红色物质 镀铜
Fe2O3+6HCl=2FeCl3+3H2O 铁锈溶解、溶液呈黄色 铁器除锈
Al2O3+6HCl=2AlCl3+3H2O 白色固体溶解
Na2O+2HCl=2NaCl+H2O 白色固体溶解
CuO+2HCl=CuCl2+H2O 黑色固体溶解、溶液呈蓝色
ZnO+2HCl=ZnCl2+ H2O 白色固体溶解
MgO+2HCl=MgCl2+ H2O 白色固体溶解
CaO+2HCl=CaCl2+ H2O 白色固体溶解
NaOH+HCl=NaCl+ H2O 白色固体溶解
Cu(OH)2+2HCl=CuCl2+2H2O 蓝色固体溶解
Mg(OH)2+2HCl=MgCl2+2H2O 白色固体溶解
Al(OH)3+3HCl=AlCl3+3H2O 白色固体溶解 胃舒平治疗胃酸过多
Fe(OH)3+3HCl=FeCl3+3H2O 红褐色沉淀溶解、溶液呈黄色
Ca(OH)2+2HCl=CaCl2+2H2O
HCl+AgNO3= AgCl↓+HNO3 生成白色沉淀、不溶解于稀硝酸 检验Cl—的原理
Fe2O3+3H2SO4= Fe2(SO4)3+3H2O 铁锈溶解、溶液呈黄色 铁器除锈
Al2O3+3H2SO4= Al2(SO4)3+3H2O 白色固体溶解
CuO+H2SO4=CuSO4+H2O 黑色固体溶解、溶液呈蓝色
ZnO+H2SO4=ZnSO4+H2O 白色固体溶解
MgO+H2SO4=MgSO4+H2O 白色固体溶解
2NaOH+H2SO4=Na2SO4+2H2O
Cu(OH)2+H2SO4=CuSO4+2H2O 蓝色固体溶解
Ca(OH)2+H2SO4=CaSO4+2H2O
Mg(OH)2+H2SO4=MgSO4+2H2O 白色固体溶解
2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O 白色固体溶解
2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O 红褐色沉淀溶解、溶液呈黄色
Ba(OH)2+ H2SO4=BaSO4↓+2H2O 生成白色沉淀、不溶解于稀硝酸 检验SO42—的原理
BaCl2+ H2SO4=BaSO4↓+2HCl 生成白色沉淀、不溶解于稀硝酸 检验SO42—的原理
Ba(NO3)2+H2SO4=BaSO4↓+2HNO3 生成白色沉淀、不溶解于稀硝酸 检验SO42—的原理
Na2O+2HNO3=2NaNO3+H2O 白色固体溶解
CuO+2HNO3=Cu(NO3)2+H2O 黑色固体溶解、溶液呈蓝色
ZnO+2HNO3=Zn(NO3)2+ H2O 白色固体溶解
MgO+2HNO3=Mg(NO3)2+ H2O 白色固体溶解
CaO+2HNO3=Ca(NO3)2+ H2O 白色固体溶解
NaOH+HNO3=NaNO3+ H2O
Cu(OH)2+2HNO3=Cu(NO3)2+2H2O 蓝色固体溶解
Mg(OH)2+2HNO3=Mg(NO3)2+2H2O 白色固体溶解
Al(OH)3+3HNO3=Al(NO3)3+3H2O 白色固体溶解
Ca(OH)2+2HNO3=Ca(NO3)2+2H2O
Fe(OH)3+3HNO3=Fe(NO3)3+3H2O 红褐色沉淀溶解、溶液呈黄色
3NaOH + H3PO4=3H2O + Na3PO4
3NH3+H3PO4=(NH4)3PO4
2NaOH+CO2=Na2CO3+ H2O 吸收CO、O2、H2中的CO2、
2NaOH+SO2=Na2SO3+ H2O 2NaOH+SO3=Na2SO4+ H2O 处理硫酸工厂的尾气(SO2)
FeCl3+3NaOH=Fe(OH)3↓+3NaCl 溶液黄色褪去、有红褐色沉淀生成
AlCl3+3NaOH=Al(OH)3↓+3NaCl 有白色沉淀生成
MgCl2+2NaOH = Mg(OH)2↓+2NaCl
CuCl2+2NaOH = Cu(OH)2↓+2NaCl 溶液蓝色褪去、有蓝色沉淀生成
CaO+ H2O = Ca(OH)2 白色块状固体变为粉末、 生石灰制备石灰浆
Ca(OH)2+SO2=CaSO3↓+ H2O 有白色沉淀生成 初中一般不用
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 有白色沉淀生成 工业制烧碱、实验室制少量烧碱
Ba(OH)2+Na2CO3=BaCO3↓+2NaOH 有白色沉淀生成
Ca(OH)2+K2CO3=CaCO3↓ +2KOH 有白色沉淀生成
CuSO4+5H2O= CuSO4·H2O 蓝色晶体变为白色粉末
CuSO4·H2OΔ CuSO4+5H2O 白色粉末变为蓝色 检验物质中是否含有水
AgNO3+NaCl = AgCl↓+Na NO3 白色不溶解于稀硝酸的沉淀(其他氯化物类似反应) 应用于检验溶液中的氯离子
BaCl2 + Na2SO4 = BaSO4↓+2NaCl 白色不溶解于稀硝酸的沉淀(其他硫酸盐类似反应) 应用于检验硫酸根离子
CaCl2+Na2CO3= CaCO3↓+2NaCl 有白色沉淀生成
MgCl2+Ba(OH)2=BaCl2+Mg(OH)2↓ 有白色沉淀生成
CaCO3+2HCl=CaCl2+H2O+CO2 ↑
MgCO3+2HCl= MgCl2+H2O+ CO2 ↑
NH4NO3+NaOH=NaNO3+NH3↑+H2O 生成使湿润石蕊试纸变蓝色的气体 应用于检验溶液中的铵根离子
NH4Cl+ KOH= KCl+NH3↑+H2O 生成使湿润石蕊试纸变蓝色的气体1年前查看全部
- 为什么乙二酸的酸性比丙二酸的酸性大
 shann11161年前1
shann11161年前1 -
 laura_ln 共回答了22个问题
laura_ln 共回答了22个问题 |采纳率90.9%乙二酸的羧基离得近,吸电子的诱导效应较强;
乙二酸的两个羧基具有吸电子的共轭效应,而丙二酸有一个亚甲基阻隔,无此作用。
两个原因造成乙二酸负离子的稳定性好得多(负电荷更分散),所以乙二酸酸性较强。1年前查看全部
- 乙二酸和对苯二甲酸缩聚反应化学式
 haiyangzhixin661年前1
haiyangzhixin661年前1 -
 poohyl4 共回答了14个问题
poohyl4 共回答了14个问题 |采纳率85.7%应该是乙二醇吧?
nHO-CH2-CH2-OH + n HOOC-C6H4-COOH---------[—O-CH2-CH2-O-OC-C6H4-CO—]n +2nH2O1年前查看全部
- 由乙醇制备乙二酸乙二酯,最简单的流程途径顺序是
 yy视yy如归1年前1
yy视yy如归1年前1 -
 非特 共回答了16个问题
非特 共回答了16个问题 |采纳率81.3%先消去,变乙烯,再溴加成,变成1,2——二溴乙烷,再和氢氧化钠水溶液反应(取代),变乙二醇,然后取一半乙二醇氧化得乙二酸,和剩下一半乙二醇反应成乙二酸乙二酯,有何不懂可以问.1年前查看全部
- 如何鉴别乙二酸 乙酸 乙醛 甲酸?
 穿着qq好过冬1年前1
穿着qq好过冬1年前1 -
 西牛望月010 共回答了18个问题
西牛望月010 共回答了18个问题 |采纳率83.3%先加 氢氧化钙溶液 有沉淀的是乙二酸.再加足量新制氢氧化铜,溶液只变蓝的是乙酸,溶液中有砖红色沉淀的是乙醛,以上两种现象都有的是甲酸1年前查看全部
- 鉴别甲酸,乙酸,乙二酸
 cookiejing1年前2
cookiejing1年前2 -
 sujinwei 共回答了19个问题
sujinwei 共回答了19个问题 |采纳率94.7%加酸性高锰酸钾溶液 紫色褪去的是乙二酸(乙二酸就是草酸 具有强还原性)而甲酸与乙酸的区别就是甲酸具有醛基 用斐林试剂再水浴加热既可 若有砖红色沉淀则为甲酸 若蓝色消失则为乙酸1年前查看全部
- 乙二酸 与浓高锰酸钾 会不会发生氧化还原反应
 航天科技vv1年前2
航天科技vv1年前2 -
 llljjj123452001 共回答了26个问题
llljjj123452001 共回答了26个问题 |采纳率80.8%会的.
5 H2C2O4 + 2 KMnO4 + 3 H2SO4 = K2SO4 + 2 MnSO4 + 10 CO2↑ + 8 H2O
草酸(乙二酸)有很强的还原性,能被强氧化剂氧化.1年前查看全部
- 共轭二烯烃在酸性高锰酸钾条件下会生成什么,为什么,乙二酸稳定吗
 双子熊熊1年前1
双子熊熊1年前1 -
 怀旧版 共回答了23个问题
怀旧版 共回答了23个问题 |采纳率78.3%就是有乙二酸吧.先氧化成乙二醛(类似臭氧氧化还原水解),再氧化成乙二酸.稳定的,不就是草算嘛1年前查看全部
- 1,有机物要能发生缩聚反应的条件是什么?一定要有两种官能团,共四个官能团才可以吗?如乙二醇和乙二酸
1,有机物要能发生缩聚反应的条件是什么?一定要有两种官能团,共四个官能团才可以吗?如乙二醇和乙二酸
2,所有的酯化反应都是可逆反应吗?发生酯化反应的化学方程式是用→还是可逆号呢?
3,溴乙烷,氯乙烷这些名称是泛指还是专指?是说一溴乙烷还是一或二或三溴乙烷?
4.酚也能和酸反应酯化反应吗?
5,乙烯能和强酸强碱反应吗?
6:卤素单质能和烷烃发生取代反应,那么和醇可以吗?还有,有没有反应物是氧气的取代反应? lanse_jay1年前2
lanse_jay1年前2 -
 4l5iu 共回答了18个问题
4l5iu 共回答了18个问题 |采纳率77.8%有机物要能发生缩聚反应一定要有两种官能团,共四个官能团才可以,如乙二醇和乙二酸.但是有些特殊情况,可以看成是这样,也可以看成不是这样,比如酚醛树脂.
溴乙烷专指一溴乙烷.
酚也能和酸反应酯化
乙烯可被加成,具有还原性.不能和酸碱反应.
可以和唇取代.可以取代氢,也可以取代羟基.
取代反应一般特指有机物,与氧气就燃烧了,1年前查看全部
- 求乙二酸分解方程式,
 eex331年前1
eex331年前1 -
 Missmoney515 共回答了24个问题
Missmoney515 共回答了24个问题 |采纳率95.8%HOOC-COOH->HCOOH+CO21年前查看全部
- 乙二酸和酸性高锰酸钾反应的化学方程式如何配平
 lost1241251年前4
lost1241251年前4 -
 琳崽 共回答了12个问题
琳崽 共回答了12个问题 |采纳率66.7%谁说不会反应
5(COOH)2+2KMnO4+3H2SO4→K2SO4+2MnSO4+10CO2↑+8H2O1年前查看全部
- 乙二酸晶体加热分解生成什么?
 SanDeYaGo1年前1
SanDeYaGo1年前1 -
 lonelydancer 共回答了20个问题
lonelydancer 共回答了20个问题 |采纳率85%应该是产物有CO2和H2O.1年前查看全部
- 乙醇制得乙二酸二乙脂发生的化学方程式,和发生的反应依次是?
 tt10011年前7
tt10011年前7 -
 家有一口田 共回答了19个问题
家有一口田 共回答了19个问题 |采纳率94.7%CH3COOH+C2H5OH---(可逆符号)CH3COOC2H5+H2O
1反应机理:有机酸与醇反应是酸脱羟基醇脱氢
2.反应条件:浓硫酸,加热
3.该反应是可逆反应1年前查看全部
- 写几个方程式乙二醇制乙二醛乙二醛制乙二酸乙二醇制乙二酸
 threestone1年前1
threestone1年前1 -
 cscmkii999 共回答了16个问题
cscmkii999 共回答了16个问题 |采纳率100%基本制备只是官能团的变化.
醇加氧成醛,醛继续加氧成羧酸.用铜作为催化剂同氧气加热即可.1年前查看全部
- 化合物C5H8O(A)可使溴水很快褪色,可与苯肼反应也有银镜反应,A氧化后得一分子丙酮和一分子乙二酸,A结构
 wwdjs1年前1
wwdjs1年前1 -
 笑看风云宇 共回答了15个问题
笑看风云宇 共回答了15个问题 |采纳率100%H3C-C(CH3)=C-CHO1年前查看全部
- 请问甲酸和乙二酸的酸性谁大?顺便问一下有机酸的比较酸性通则?
 xiaoxiao851年前1
xiaoxiao851年前1 -
 zlnoah 共回答了21个问题
zlnoah 共回答了21个问题 |采纳率81%乙二酸强一些
有机酸酸性的比较没什么通则的,有时受到拉电子基团的影响,有时又受到分子内氢键的影响,空间位置有时也起作用,这得具体问题具体分析了1年前查看全部
- 比较醋酸,乙二酸,甲酸的酸性强弱
 happy00011年前1
happy00011年前1 -
 lichuang3636 共回答了15个问题
lichuang3636 共回答了15个问题 |采纳率100%乙二酸强于甲酸强于乙酸1年前查看全部
- 稀盐酸HCl与食品添加剂的反应最好是现象明显的反应,给一些双乙二酸、过氧化钙、溴酸钾或硫(及其化合物)的验证也好如有特别
稀盐酸HCl与食品添加剂的反应
最好是现象明显的反应,
给一些双乙二酸、过氧化钙、溴酸钾或硫(及其化合物)的验证也好
如有特别好的答案, kingkill1年前1
kingkill1年前1 -
 丁香花开了 共回答了24个问题
丁香花开了 共回答了24个问题 |采纳率91.7%盐酸与亚硝酸钠反应,生成黄绿色气体(氯气).1年前查看全部
- 乙酸的酸性乙酸和乙二酸的酸性强吗?这两者哪个强?
 guitarhand1年前2
guitarhand1年前2 -
 xiaomin111 共回答了17个问题
xiaomin111 共回答了17个问题 |采纳率94.1%都属于弱酸,乙二酸酸性强一些.可以这样理解,乙二酸中任何一个羧基都连着一个吸电子的羧基,因而酸性比乙酸强(乙酸中的甲基是给电子的).1年前查看全部
- 乙二酸一类物质的命名.(甲二酸?乙三酸?)
乙二酸一类物质的命名.(甲二酸?乙三酸?)
乙二酸一类物质的命名遵循什么规律?其中“乙”代表什么,“二”代表什么?有没有甲二酸?乙三酸?
没有甲二酸和乙三酸的话其他以此命名的东西是怎样命名的? zhangyp20041年前4
zhangyp20041年前4 -
 程昱 共回答了26个问题
程昱 共回答了26个问题 |采纳率96.2%乙代表两个碳,二代表有两个羧基.没有甲二酸和乙三酸.
通常情况下数字都代表后面跟着的基团的个数,天干数代表碳原子数.
首先用天干数表示碳原子数,然后加汉语数字和这种有机物所包含的官能团名称.数字表示官能团个数.1年前查看全部
- 乙二酸的化学式是?羧酸怎么命名?
 s008java1年前1
s008java1年前1 -
 香之kk师 共回答了20个问题
香之kk师 共回答了20个问题 |采纳率90%化学式是C2H2O4,羧酸的命名和一般脂肪烃的命名相似,有几个碳就是几酸,如果不是一个羧基的话把羧基的数目写在甲乙丙丁的后面就可以了.1年前查看全部
- 求乙二酸与酸性高锰酸钾的反应方程式
 hui1451392jia1年前1
hui1451392jia1年前1 -
 taijimen 共回答了16个问题
taijimen 共回答了16个问题 |采纳率93.8%5H2C2O4+2KMnO4+6(H+)=2(K+)+2(Mn2+)+10CO2+8H2O (注意:CO2后有气体符号,即向上的箭头)1年前查看全部
- 乙二酸和氢氧化钠的反应反应方程式是什么?
 无ID1年前2
无ID1年前2 -
 路_过 共回答了16个问题
路_过 共回答了16个问题 |采纳率87.5%CH3COOH+NaOH=CH3COONa+H2O1年前查看全部
- 乙二酸,丙二酸,丁二酸鉴别最好给说下为什么 XD~~
 yaner嫣儿1年前2
yaner嫣儿1年前2 -
 菲旗 共回答了17个问题
菲旗 共回答了17个问题 |采纳率82.4%加热.
乙二酸(草酸)和丙二酸受热后很容易脱羧.
丁二酸受热后不发生脱羧作用,而发生失水,形成稳定的五元环.1年前查看全部
- 乙二酸为什么能使高锰酸钾褪色?
 nzzzcy1年前1
nzzzcy1年前1 -
 micky_0284swj 共回答了21个问题
micky_0284swj 共回答了21个问题 |采纳率85.7%乙二酸易被温热的高锰酸钾氧化而成二氧化碳,反应式如下:
乙二酸被氧化是因为有两个碳氧双键相连,具有这个结构的物质可以先加水,然后和高锰酸根离子形成环状酯过渡态,再通过分子内消除或双分子亲核取代形成氧化产物.类似结构的物质如丙酮酸也能被高锰酸钾氧化.如果没有水的存在,乙二酸就不能被高锰酸钾氧化.1年前查看全部
- 如何鉴别乙二酸、丁二酸、己二酸
 cestlavieyue1年前1
cestlavieyue1年前1 -
 露露贝贝 共回答了19个问题
露露贝贝 共回答了19个问题 |采纳率100%难1年前查看全部
- 二乙酸酯与乙二酸酯的区别
 李世龙1年前1
李世龙1年前1 -
 san570092 共回答了18个问题
san570092 共回答了18个问题 |采纳率94.4%二乙酸酯
CH3COO(某醇去水)OOC3HC
乙二酸酯
(某醇去水)OOCCOO(某醇去水)1年前查看全部
- 如何鉴别醋酸乙二酸?如题能否使用兰墨水,题目上有这个选项,答案说是的,但没明白为什么?
 bus11年前1
bus11年前1 -
 月满潮生 共回答了20个问题
月满潮生 共回答了20个问题 |采纳率85%加少量CaCO3,仍有沉淀(生成乙二酸钙)的是乙二酸,否则就是醋酸.
或者加醋酸钙溶液,有沉淀生成则原溶液是乙二酸,无明显变化则原溶液是醋酸.
墨水退色是利用乙二酸的还原性.醋酸无此性质.
乙二酸钙不溶于水、醋酸,但溶于HCl溶液,所以 潕敌す←下々 错误.
落叶【逝去】 错误,乙二酸酸性强于醋酸,但也是弱酸.1年前查看全部
- 当量浓度0.005N乙二酸四乙酸二钠是多少摩尔
 掐架专用121年前1
掐架专用121年前1 -
 wxq0004 共回答了15个问题
wxq0004 共回答了15个问题 |采纳率100%对于乙二酸四乙酸二钠溶液而言,其当量浓度与其物质的量浓度数值相等
当量浓度0.005N的EDTA二钠,其物质的量浓度为0.005mol/L1年前查看全部
- 不能使高锰酸钾褪色?A甲酸B乙酸C乙二酸
 helen_pk1年前2
helen_pk1年前2 -
 rhzx 共回答了20个问题
rhzx 共回答了20个问题 |采纳率90%BC
因为A中的甲酸其实还含有一个醛基
醛基可以令KMNO4褪色1年前查看全部
- 做实验时不小心使皮肤上粘了一些高锰酸钾,形成的黑斑很久才能消除,如果用乙二酸的稀溶液洗涤,黑斑可以迅速褪去,其离子方程式
做实验时不小心使皮肤上粘了一些高锰酸钾,形成的黑斑很久才能消除,如果用乙二酸的稀溶液洗涤,黑斑可以迅速褪去,其离子方程式为:MnO
+H2C2O4+H+→CO2↑+Mn2++.下列有关叙述正确的是( )−4
A.发生还原反应的是H2C2O4
B.该离子方程式右侧方框内的产物是OH-
C.10mol CO2生成时,电子转移5mol
D.1mol乙二酸分子中含有7mol σ键 ddadda1年前1
ddadda1年前1 -
 也许我应 共回答了20个问题
也许我应 共回答了20个问题 |采纳率80%解题思路:该反应中Mn元素化合价由+7价变为+2价、C元素化合价由+3价变为+4价,所以高锰酸钾是氧化剂、草酸是还原剂,再结合物质结构、二氧化碳和转移电子之间的关系式计算.A.该反应中Mn元素化合价由+7价变为+2价、C元素化合价由+3价变为+4价,所以高锰酸钾是氧化剂、草酸是还原剂,则发生还原反应的是高锰酸钾,故A错误;
B.该反应是在酸性条件下的反应,所以生成物中应该是水不是氢氧根离子,故B错误;
C.10molCO2生成时,转移电子的物质的量10mol×(4-3)=10mol,故C错误;
D.一个乙二酸分子中含有7个 σ键,所以1mol乙二酸分子中含有7mol σ键,故D正确;
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查了氧化还原反应,根据元素化合价变化结合基本概念来分析解答,知道乙二酸的结构,注意该反应的条件,题目难度不大.1年前查看全部
- 乙二酸乙酯怎么写?还有 乙二酸二乙酯
 rongjih1年前3
rongjih1年前3 -
 mfcf39532 共回答了23个问题
mfcf39532 共回答了23个问题 |采纳率73.9%乙二酸乙酯:HOOC-CO-O-CH2CH3
乙二酸二乙酯:CH3CH2-O-OC-CO-O-CH2CH31年前查看全部
- (2009•海淀区一模)乙二酸通常以二水合物的形式存在,俗称草酸晶体.已知草酸晶体在101℃时熔化并开始升华,157℃时
(2009•海淀区一模)乙二酸通常以二水合物的形式存在,俗称草酸晶体.已知草酸晶体在101℃时熔化并开始升华,157℃时大量升华,继续升温会分解生成CO、CO2和H2O.
(1)下列关于乙二酸的叙述正确的是(填编号)______.
①能和乙二醇发生酯化反应
②能使酸性高锰酸钾溶液褪色
③其溶液能使蓝色石蕊试纸变红
④能和碳酸氢钠溶液反应生成气体
欲验证上述性质,除用到胶头滴管、试管和玻璃导管外,还必需要使用的玻璃仪器有
______、______.
(2)乙二酸的工业生产方法之一是以乙二醇为原料,在一定条件下,用空气氧化得到.写出该反应的化学反应方程式______.
(3)欲检验草酸晶体受热分解的产物中是否有CO2,甲、乙两位同学分别设计了装置1、装置2来完成实验.
(I)简述检验装置1气密性的操作方法______.
(II)B和E两个装置中更合理的是______,理由为______.
(III)请从A~F中选择合适的仪器,组装一套可更好达到实验目的装置,按照气流由左到右的顺序依次为(用字母表示):______. pink77771年前1
pink77771年前1 -
 qepwqzp 共回答了19个问题
qepwqzp 共回答了19个问题 |采纳率100%解题思路:(1)乙二酸分子中含有羧基,有酸性、能发生酯化反应、能被高锰酸钾氧化;根据反应条件选择所需玻璃仪器;
(2)乙二醇含有羟基,在一定条件下能被氧气氧化成乙二酸;
(3)(Ⅰ)利用空气热胀冷缩,手掌体温通过试管壁传导给空气,使其受热膨胀,逸出导管形成气泡来检查装置的气密性;
(Ⅱ)B中的导管过长、过细,冷凝后的乙二酸晶体可能会堵塞导管;E中采用U型管,更有利于乙二酸蒸气的冷凝,防止了乙二酸蒸气干扰CO2的检验;
(Ⅲ)根据反应物草酸的熔点低和验证二氧化碳时杂质的和二氧化碳的性质来组装装置.(1)乙二酸分子中含有羧基,具有酸性,且酸性比碳酸强,能使蓝色石蕊试液变红,能与碳酸氢钠反应生成二氧化碳;能与乙二醇发生发生酯化反应;能被酸性高锰酸钾氧化而使高锰酸钾溶液褪色;验证性质①发生酯化反应条件是在浓硫酸存在并且加热,需要铁架台、酒精灯、试管、玻璃导管;验证性质②需要试管、胶头滴管;验证性质③需要玻璃棒;验证性质④需要胶头滴管和试管,所以除了胶头滴管、试管和玻璃导管外,还必需要使用的玻璃仪器有酒精灯和玻璃棒;
(2)乙二醇中含有羟基,能发生氧化反应,在一定条件下能被氧气氧化生成乙二酸,化学方程式为: ;
;
(3)(І)如图连接好装置,将导管b没入水中,微热(或手捂)试管a,看到导管口处有气泡冒出,撤火(或松手)后,观察到导管内有一段水柱上升,则说明该装置的气密性良好;
(Ⅱ)草酸晶体在101℃时熔化并开始升华,157℃时大量升华,试管中气体中含有草酸,需要除去,以免干扰CO2的检验;B中的导管过长、过细,冷凝后的乙二酸晶体可能会堵塞导管而存在安全隐患;E中采用U型管,与冰水的接触面积更大,更有利于乙二酸蒸气的冷凝,防止了乙二酸蒸气干扰CO2的检验;
(Ⅲ)由于草酸在101℃时熔化,反应装置中试管口应向上倾斜,故选A装置;产生的气体中有草酸、一氧化碳,选择装置E除去草酸,一氧化碳有毒,具有可燃性,可采用点燃的方法除去尾气中的一氧化碳,二氧化碳能使澄清石灰水变浑浊,因此一般用澄清石灰水检验二氧化碳的存在,故选装置F;所有组装一套可更好达到实验目的装置,按照气流由左到右的顺序依次为A、E、F.
故答案为:(1)①②③④;酒精灯,玻璃棒;
(2) ;
;
(3)B中的导管过长、过细,冷凝后的乙二酸晶体可能会堵塞导管而存在安全隐患;E中采用U型管,与冰水的接触面积更大,更有利于乙二酸蒸气的冷凝,防止了乙二酸蒸气干扰CO2的检验
(І)如图连接好装置,将导管b没入水中,微热(或手捂)试管a,看到导管口处有气泡冒出,撤火(或松手)后,观察到导管内有一段水柱上升,则说明该装置的气密性良好;
(Ⅱ)E;
B中的导管过长、过细,冷凝后的乙二酸晶体可能会堵塞导管而存在安全隐患;E中采用U型管,与冰水的接触面积更大,更有利于乙二酸蒸气的冷凝,防止了乙二酸蒸气干扰CO2的检验;
(Ⅲ)A、E、F.点评:
本题考点: 羧酸简介;常见气体的检验;化学实验方案的评价.
考点点评: 本题探讨了乙二酸的性质,本节内容承载的不仅仅是对乙二酸的性质,更重要的是对元素化合物的研究方法,即从三个角度--物质分类角度、氧化-还原角度、特性角度的研究.1年前查看全部
- 菠菜中含草酸(乙二酸),其味苦涩,能溶于水,水溶液呈酸性.过量食用菠菜,容易造成人体缺钙.食用菠菜前一般先将菠菜用热水焯
菠菜中含草酸(乙二酸),其味苦涩,能溶于水,水溶液呈酸性.过量食用菠菜,容易造成人体缺钙.食用菠菜前一般先将菠菜用热水焯一焯,以降低草酸含量,除去菠菜的苦涩味.由此判断下列说法中,不正确的是( )
A.草酸是一种酸
B.加热可以降低草酸在水中的溶解度
C.草酸的水溶液pH<7
D.草酸能与人体中的钙结合生成难溶于水的物质 chdy88981年前1
chdy88981年前1 -
 liushabo 共回答了14个问题
liushabo 共回答了14个问题 |采纳率71.4%解题思路:A、根据草酸属于酸解答;
B、根据草酸的溶解度随着温度的升高而增大解答;
C、根据草酸水溶液呈酸性,草酸的水溶液的pH小于7解答;
D、根据对草酸具体性质的描述可以减小相关方面的判断.A、草酸是一种酸.正确;
B、由食用菠菜前一般先将菠菜用热水焯一焯,以降低草酸含量可知,草酸的溶解度随着温度的升高而增大.正确;
C、草酸属于酸,其水溶的液pH<7.错误;
D、由过量食用菠菜,容易造成人体缺钙可以推知,草酸能与人体中的钙结合生成难溶于水的物质.正确.
答案:C.点评:
本题考点: 酸的化学性质;固体溶解度的影响因素;溶液的酸碱性与pH值的关系.
考点点评: 解答本题要充分理解物质的性质方面的内容,只有这样才能对相关方面的问题做出正确的判断.1年前查看全部
- 一摩有机物燃烧耗氧量最少多少我能想到的就是甲酸和乙二酸是0、5摩,还有更少的吗?
 hello3151年前1
hello3151年前1 -
 你是我永远的网 共回答了22个问题
你是我永远的网 共回答了22个问题 |采纳率81.8%有,氟甲酸燃烧耗氧为0.
FCOOH —点燃→ HF ↑ + CO2↑1年前查看全部
- 乙二酸(C2H2O4),苯乙烯和乙炔三种混合物中含氧的质量分数为X,则其含碳的质量分为
 艾洪泉1年前1
艾洪泉1年前1 -
 这些住 共回答了21个问题
这些住 共回答了21个问题 |采纳率85.7%乙二酸:C2H2O2;
苯乙烯:C8H8;
乙炔:C2H2;
可以看出其中C:H=1:1;
碳元素+氢元素的质量分数=1-X;
碳元素的质量分数=(1×12)/(12×1+1)(1-X)=12/13(1-X);1年前查看全部
- 以乙烯为原料制取聚乙二酸乙二酯.无机试剂任选.全过程方程式.
 清娴如水1年前1
清娴如水1年前1 -
 zz格格 共回答了14个问题
zz格格 共回答了14个问题 |采纳率92.9%CH2=CH2+Br2→CH2BrCH2Br CH2BrCH2Br→(NAOH 加热) HOCH2CH2OH →(过量的氧化铜充分反应) HOOCCOOH +HOCH2CH2OH→乙二酸乙二(醇)酯+2H2O1年前查看全部
- 乙二酸和二乙酸结构式怎样写,他们区别在哪(二乙和乙二)?
 karl1年前2
karl1年前2 -
 north01 共回答了23个问题
north01 共回答了23个问题 |采纳率95.7%乙二酸结构式HOOC-COOH
没有二乙酸这种物质.
二乙酸代表的是两个乙酸分子 ,乙酸结构式CH3COOH1年前查看全部
- 某研究性学习小组通过实验来探究乙二酸(又名草酸)受热分解的产物,他们设计的实验装置如图所示:
某研究性学习小组通过实验来探究乙二酸(又名草酸)受热分解的产物,他们设计的实验装置如图所示: 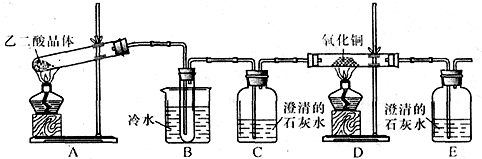
查阅资料可知:乙二酸晶体(H 2 C 2 O 4 •2H 2 O)熔点100.1℃,草酸钙是难溶于水的白色固体;Cu 2 O能溶于稀硫酸,立即发生歧化反应生成Cu 2+ 和Cu.
(1)实验过程中观察到C、E装置中的溶液均变浑浊,且D装置中黑色粉末变为红色,写出A中发生反应的化学方程式:______;
(2)装置B的作用是______;上述装置中有两处需要改进(假设洗气装置每次吸收气体均完全),改进方法是______;______.
(3)实验结束后向装置B的试管中加入NaHCO 3 溶液,产生大量无色气体,由此可以证明两种物质的酸性强弱顺序是______.
(4)有人认为D装置中得到的红色固体可能是Cu,也可能是Cu和Cu 2 O的混合物.实验小组进一步探究:①取少量红色固体加入到盛稀硫酸的试管中,充分振荡,溶液变为蓝色,试管底部仍有红色固体,由此可以得出的结论是______.②取6.8g红色固体与足量的稀硝酸反应,收集到标准状况下的NO气体1.12L.则红色固体中含单质铜的质量分数是______. chenhufen1年前1
chenhufen1年前1 -
 wjhlc 共回答了17个问题
wjhlc 共回答了17个问题 |采纳率82.4%(1)C、E装置中的溶液均变浑浊,且D装置中黑色粉末变为红色,说明乙二酸晶体加热生成一氧化碳、二氧化碳和水,反应的化学方程式:H 2 C 2 O 4 •2H 2 O
△
.
CO↑+CO 2 ↑+3H 2 O;
故答案为:H 2 C 2 O 4 •2H 2 O
△
.
CO↑+CO 2 ↑+3H 2 O;
(2)乙二酸可以和氢氧化钙发生反应,所以防止对检验分解产物CO 2 的干扰,要除去生成物中带出的乙二酸蒸汽,一氧化碳在还原氧化铜之前要将气体干燥,一氧化碳有毒,所以要进行尾气处理,
故答案为:除去生成物中带出的乙二酸蒸汽,防止对检验分解产物CO 2 的干扰;在C与D之间再装配一个盛浓硫酸的洗气瓶(或装有碱石灰的干燥管),将装置E中出来的气体引到酒精灯火焰上让其燃烧(或收集装置E中逸出的尾气);
(3)B的试管中是乙二酸,加入NaHCO 3 溶液,产生大量无色气体应该是二氧化碳,化学反应遵循强酸制弱酸的原理,所以酸性是乙二酸大于碳酸(或H 2 C 2 O 4 >H 2 CO 3 ),故答案为:乙二酸大于碳酸(或H 2 C 2 O 4 >H 2 CO 3 );
(4)①金属铜和硫酸不反应,但是氧化亚铜可以和硫酸反应生成金属铜和硫酸铜,根据实验现象:溶液变为蓝色,则证明红色固体中含有Cu 2 O,故答案为:红色固体中含有Cu 2 O;
②设红色固体中氧化亚铜的物质的量是x,金属铜的物质的量为y,根据质量关系得:144x+64y=6.8,根据电子守恒,得出:2x+2y=
1.12L
22.4L/mol ×(5-2),两式联立解得x=0.025mol,y=0.05mol,所以Cu的质量分数为:
0.05mol×64g/mol
6.8g ×100%=50%,故答案为:50%.1年前查看全部
- 某研究性学习小组通过实验来探究乙二酸(又名草酸)受热分解的产物,他们设计的实验装置如图所示:
某研究性学习小组通过实验来探究乙二酸(又名草酸)受热分解的产物,他们设计的实验装置如图所示:
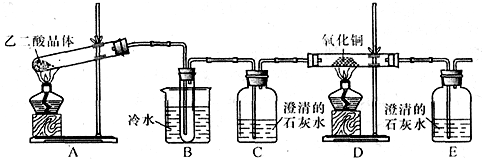
查阅资料可知:乙二酸晶体(H2C2O4•2H2O)熔点100.1℃,草酸钙是难溶于水的白色固体;Cu2O能溶于稀硫酸,立即发生歧化反应生成Cu2+和Cu.
(1)实验过程中观察到C、E装置中的溶液均变浑浊,且D装置中黑色粉末变为红色,写出A中发生反应的化学方程式:H2C2O4•2H2O
CO↑+CO2↑+3H2OH2C2O4•2H2O△ .
CO↑+CO2↑+3H2O;△ .
(2)装置B的作用是除去生成物中带出的乙二酸蒸汽,防止对检验分解产物CO2的干扰除去生成物中带出的乙二酸蒸汽,防止对检验分解产物CO2的干扰;上述装置中有两处需要改进(假设洗气装置每次吸收气体均完全),改进方法是在C与D之间再装配一个盛浓硫酸的洗气瓶(或装有碱石灰的干燥管)在C与D之间再装配一个盛浓硫酸的洗气瓶(或装有碱石灰的干燥管);将装置E中出来的气体引到酒精灯火焰上让其燃烧(或收集装置E中逸出的尾气)将装置E中出来的气体引到酒精灯火焰上让其燃烧(或收集装置E中逸出的尾气).
(3)实验结束后向装置B的试管中加入NaHCO3溶液,产生大量无色气体,由此可以证明两种物质的酸性强弱顺序是乙二酸大于碳酸(或H2C2O4>H2CO3)乙二酸大于碳酸(或H2C2O4>H2CO3).
(4)有人认为D装置中得到的红色固体可能是Cu,也可能是Cu和Cu2O的混合物.实验小组进一步探究:①取少量红色固体加入到盛稀硫酸的试管中,充分振荡,溶液变为蓝色,试管底部仍有红色固体,由此可以得出的结论是红色固体中含有Cu2O红色固体中含有Cu2O.②取6.8g红色固体与足量的稀硝酸反应,收集到标准状况下的NO气体1.12L.则红色固体中含单质铜的质量分数是50%50%. 为了车票的vv1年前1
为了车票的vv1年前1 -
 tctc022 共回答了23个问题
tctc022 共回答了23个问题 |采纳率95.7%(1)C、E装置中的溶液均变浑浊,且D装置中黑色粉末变为红色,说明乙二酸晶体加热生成一氧化碳、二氧化碳和水,反应的化学方程式:H2C2O4•2H2O
△
.
CO↑+CO2↑+3H2O;
故答案为:H2C2O4•2H2O
△
.
CO↑+CO2↑+3H2O;
(2)乙二酸可以和氢氧化钙发生反应,所以防止对检验分解产物CO2的干扰,要除去生成物中带出的乙二酸蒸汽,一氧化碳在还原氧化铜之前要将气体干燥,一氧化碳有毒,所以要进行尾气处理,
故答案为:除去生成物中带出的乙二酸蒸汽,防止对检验分解产物CO2的干扰;在C与D之间再装配一个盛浓硫酸的洗气瓶(或装有碱石灰的干燥管),将装置E中出来的气体引到酒精灯火焰上让其燃烧(或收集装置E中逸出的尾气);
(3)B的试管中是乙二酸,加入NaHCO3溶液,产生大量无色气体应该是二氧化碳,化学反应遵循强酸制弱酸的原理,所以酸性是乙二酸大于碳酸(或H2C2O4>H2CO3),故答案为:乙二酸大于碳酸(或H2C2O4>H2CO3);
(4)①金属铜和硫酸不反应,但是氧化亚铜可以和硫酸反应生成金属铜和硫酸铜,根据实验现象:溶液变为蓝色,则证明红色固体中含有Cu2O,故答案为:红色固体中含有Cu2O;
②设红色固体中氧化亚铜的物质的量是x,金属铜的物质的量为y,根据质量关系得:144x+64y=6.8,根据电子守恒,得出:2x+2y=
1.12L
22.4L/mol×(5-2),两式联立解得x=0.025mol,y=0.05mol,所以Cu的质量分数为:
0.05mol×64g/mol
6.8g×100%=50%,故答案为:50%.1年前查看全部
- 乙二酸与3-羟基丙酸哪个酸性强
 风语者zhai1年前1
风语者zhai1年前1 -
 频烦人 共回答了25个问题
频烦人 共回答了25个问题 |采纳率92%羟基丙酸酸性强,羟基具有供电子作用,离羧基越远供电子诱导效应越弱,酸性越强.1年前查看全部
- (2013•桂林一模)做实验时不小心粘在皮肤上的高锰酸钾会形成黑斑,很久才能消除,若用乙二酸的稀溶液擦洗黑斑,黑斑可以迅
(2013•桂林一模)做实验时不小心粘在皮肤上的高锰酸钾会形成黑斑,很久才能消除,若用乙二酸的稀溶液擦洗黑斑,黑斑可以迅速褪去,其离子反应方程式为MnO
+H2C2O4+H+→CO2↑+Mn2++( )下列有关废反应的叙述正确的是( )−4
A.乙二酸中C显+2价
B.离子反应方程式右侧方框内的产物是OH-
C.氧化剂和还原剂的化学计量数之比是5:2
D.若有6 mol H+参加反应,则转移电子10 mol cbs20061年前1
cbs20061年前1 -
 男子单打右 共回答了20个问题
男子单打右 共回答了20个问题 |采纳率90%解题思路:MnO4-+H2C2O4+H+→CO2↑+Mn2++( ),Mn元素的化合价由+7价降低为+2价,C元素的化合价由+3价升高为+4价,由元素守恒可知,括号内的产物为水,以此来解答.MnO4-+H2C2O4+H+→CO2↑+Mn2++( ),Mn元素的化合价由+7价降低为+2价,C元素化合价由+3价升高为+4价,该反应为2MnO4-+5H2C2O4+6H+═10CO2↑+2Mn2++8H2O,
A.根据化合物中化合价的代数和为0知,碳元素化合价=[4×2−1×2/2]=+3价,故A错误;
B.根据以上分析知,括号内物质是水,故B错误;
C.该反应中高锰酸钾得电子作氧化剂,草酸失电子作还原剂,氧化剂和还原剂的计量数之比是2:5,故C错误;
D.由反应可知,6molH+参加反应时电子转移10mol,故D正确;
故选D.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应,为高考常见题型,明确反应中元素的化合价变化即可解答,注意利用电荷守恒、电子守恒得出反应式为解答的关键,题目难度中等.1年前查看全部
- 跪求硫酸根、亚硫酸根、碳酸根、碳酸氢根、次氯酸根、羧基、苯酚、乙二酸、高氯酸、盐酸、硫酸、硝酸、硅酸、磷酸、偏铝酸的酸性
跪求硫酸根、亚硫酸根、碳酸根、碳酸氢根、次氯酸根、羧基、苯酚、乙二酸、高氯酸、盐酸、硫酸、硝酸、硅酸、磷酸、偏铝酸的酸性大小,
 木卯光军1年前1
木卯光军1年前1 -
 tarcysujill 共回答了16个问题
tarcysujill 共回答了16个问题 |采纳率81.3%你先从化合价下手.1年前查看全部
- 由甲酸、乙酸、乙二酸组成的混合物Xg,经完全燃烧生成标准状况下4.48L CO2气体;完全中和等质量的混合物消
由甲酸、乙酸、乙二酸组成的混合物Xg,经完全燃烧生成标准状况下4.48L CO2气体;完全中和等质量的混合物消耗80ml,2mol/L的NaOH溶液,则X值可能为( )
A. 8.lg
B. 7.85g
C. 15.7g
D. 5.4g xtcai1年前1
xtcai1年前1 -
 青果果冻 共回答了23个问题
青果果冻 共回答了23个问题 |采纳率91.3%解题思路:令甲酸、乙酸、乙二酸的物质的量分别为amol、bmol、cmol,根据碳原子守恒可知a+2b+2c=0.2,根据消耗的氢氧化钠可知a+b+2c=0.16,联立方程可得b=0.04,a+2c=0.12,再根据极限法解答,当为甲酸、乙酸混合时,混合物质量最大,当为乙酸、乙二酸混合时,混合物的质量最小,据此计算解答.令甲酸、乙酸、乙二酸的物质的量分别为amol、bmol、cmol,根据碳原子守恒可知a+2b+2c=0.2,根据消耗的氢氧化钠可知a+b+2c=0.16,联立方程可得b=0.04,a+2c=0.12,
当为甲酸、乙酸混合时,混合物质量最大,则a=0.12,混合物的最大质量=0.04mol×60g/mol+0.12mol×46g/mol=7.92g,
当为乙酸、乙二酸混合时,混合物的质量最小,则c=0.06,混合物的最小质量=0.04mol×60g/mol+0.6mol×90g/mol=7.8g,
由上述分析可知7.8<X<7.92,故选B.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物的有关计算,难度中等,注意利用极限法进行的计算,侧重对学生综合能力的考查.1年前查看全部
- 乙二酸乙二酯 乙二酸二乙酯 二乙酸乙二酯 的结构?有什么不同?是怎样命名的?
 老钻工1年前1
老钻工1年前1 -
 青青菜籽 共回答了17个问题
青青菜籽 共回答了17个问题 |采纳率88.2%乙二酸乙二酯是乙二酸和乙二醇形成的酯
乙二酸二乙酯是乙二酸和两个乙醇形成的酯
二乙酸乙二酯是两个乙酸和乙二醇形成的酯.1年前查看全部
- 乙二酸的加热产物是(分值:2分)
 chedlian1年前1
chedlian1年前1 -
 skyhawk_li 共回答了17个问题
skyhawk_li 共回答了17个问题 |采纳率88.2%一般向草酸(乙二酸)中加入浓硫酸,微热,制取CO
HOOCCOOH→CO2↑+CO↑+H2O1年前查看全部
- 硫化钠的电离硫酸氢钠的电离乙醛与氢气的加成反应乙醛的催化氧化乙醛的银镜反应乙二酸与乙醇的反应乙酸与乙二醇的反应葡萄糖的银
硫化钠的电离
硫酸氢钠的电离
乙醛与氢气的加成反应
乙醛的催化氧化
乙醛的银镜反应
乙二酸与乙醇的反应
乙酸与乙二醇的反应
葡萄糖的银镜反应
葡萄糖与新制氢氧化铜的反应
油酸甘油酯的氢化
油脂的水解反应
乳酸的自身成环反应 jornden1年前2
jornden1年前2 -
 jeaplong 共回答了14个问题
jeaplong 共回答了14个问题 |采纳率92.9%Na2S == 2Na+ + S2- 硫离子的水S2- + H2O == HS- + OH- 水的电离:H2O == H+ + OH-硫离子的水解的 OH- 抑制水的电离所以 c( HS- ) > c( H+ )
CH3CHO+H2=催化剂,加热=CH3CH2OH1年前查看全部
大家在问
- 1can i use it now?后面怎么回答
- 2求小学六年级上册开心每一天的寒假作业~~
- 3若物体在拉力作用下上升0.5m,拉力上升1m.若物体重6N,动滑轮重2N,则拉力F等于4N,机械效率多少?
- 4没有感恩之心的世界,就像没有浪花的大海,广阔而不灵动; 没有感恩之心的民族,就像__________
- 5生活是一把镜子,你对它微笑,他也对你微笑.是一句病句,请问错在哪儿?
- 6锌与流酸的反应是怎样的?会因量的变化而产物不同吗?
- 7,大草地的面积比小草地的面积大一
- 8等于什么?
- 9peaches怎么读是读/pi:t∫is/还是/pi:t∫s/?后面读is还是直接加s?
- 10已知a b互为倒数 c d互为相反数P的平方等于4,试求P+(a+b)2008-cd2009
- 11括号18加9/13括号乘2/3,4/5除以1/9加1/5乘9,括号一减3/16乘8/9括号除以5/12, 11/20乘1
- 12如图为原核生物蛋白质合成示意图,据图推测下列叙述中错误的是( )
- 13甲、乙两数相差30,其中甲数的[3/10]与乙数的[1/3]相等,甲数是___.
- 14如果向水中的白磷处通入氧气(水温80℃),白磷是否会燃烧?
- 15用羡慕、烦躁、粗心大意、灰心丧气、面面相觑、口头禅中的词写一段话
