用氧化法或离子电子法配平下列各方程式: (1)As2O3+HNO3+H2O--H3AsO4+NO
 yoyofish1112022-10-04 11:39:542条回答
yoyofish1112022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 千夕少主 共回答了21个问题
千夕少主 共回答了21个问题 |采纳率95.2%- 3As2O3+4HNO3+7H2O==6H3AsO4+4NO
As由+3——+5,升高2价
N由+5——+2,降低3价
2个As原子(As2O3)就升高4价
4和3最小公倍数是12
所以需要12 / 4=3个As2O3
12 / 3个HNO3
接下来右边是18个H,左边是4个氢,所以要(18-4)/ 2= 7个水
完成 - 1年前
 谦dai 共回答了1个问题
谦dai 共回答了1个问题 |采纳率- 好好学习吧,不要辜负老师和父母对你的期望!相信你行的亲~
- 1年前
相关推荐
- 通过沉淀-氧化法处理含铬废水,减少废液排放对环境的污染,同时回收K2Cr2O7.实验室对含铬废液(含有
通过沉淀-氧化法处理含铬废水,减少废液排放对环境的污染,同时回收k2cr2o7.实验室对含铬废液(含有
cr3+、fe3+、k+、so42-、no3-和少量cr2o72-)回收与再利用工艺如下: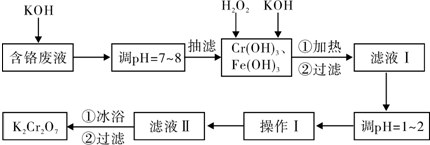
已知:①cr(oh)3+oh-═cro2-+2h2o;②2cro2-+3h2o2+2oh-═2cro42-+4h2o;
③h2o2在酸性条件下具有还原性,能将+6价cr还原为+3价cr.
(1)实验中所用koh浓度为6mol•l-1,现用koh固体配制250ml 6mol•l-1的koh溶液,除烧杯、玻璃棒外,还必需用到的玻璃仪器有______.
(2)抽滤过程中要及时观察吸滤瓶内液面高度,当快达到支管口位置时应进行的操作为______.
(3)滤液Ⅰ酸化前,进行加热的目的是______.冰浴、过滤后,应用少量冷水洗涤k2cr2o7,其目的是______.
(4)下表是相关物质的溶解度数据:
根据溶解度数据,操作Ⅰ具体操作步骤为①______、②______.物质 0℃ 20℃ 40℃ 60℃ 80℃ 100℃ kcl 28.0 34.2 40.1 45.8 51.3 56.3 k2so4 7.4 11.1 14.8 18.2 21.4 24.1 k2cr2o7 4.7 12.3 26.3 45.6 73.0 102.0 kno3 13.9 31.6 61.3 106 167 246.0
(5)称取产品重铬酸钾试样4.000g配成250ml溶液,取出25.00ml于锥形瓶中,加入10ml 2mol•l-1 h2so4和足量碘化钠(铬的还原产物为cr3+),放于暗处5min,然后加入100ml水,加入3ml淀粉指示剂,用0.2400mol•l-1 na2s2o3标准溶液滴定(i2+2s2o32-═2i-+s4o62-).
①若实验***用去na2s2o3标准溶液30.00ml,所得产品的中重铬酸钾的纯度为______(列式计算,设整个过程中其它杂质不参与反应).
②若装na2s2o3标准液的滴定管在滴定前有气泡滴定后没有气泡,测得的重铬酸钾的纯度将:______(填“偏高”、“偏低”、或“不变”). open31年前1
open31年前1 -
 S_L_Zero 共回答了21个问题
S_L_Zero 共回答了21个问题 |采纳率90.5%解题思路:实验室对含铬废液(含有Cr3+、Fe3+、K+、SO42-、NO3-和少量Cr2O72-)回收,先加KOH把Cr3+、Fe3+转化沉淀分离出来,再向沉淀中加双氧水和KOH,把Cr(OH)3转化为CrO42-,酸性条件下CrO42-转化为Cr2O72-,通过蒸发浓缩,过滤得到K2Cr2O7;(1)依据溶液配制的步骤和过程分析所用到的仪器,主要仪器应有配制溶液的容量瓶和定容需要的胶头滴管;配置一定物质的量浓度的溶液所需的玻璃仪器有:烧杯、玻璃棒、吸量管、容量瓶和胶头滴管;(2)实验时,当吸滤瓶中液面高度快达到支管口位置时,为防止液体进入其它装置应该倒出部分液体;(3)H2O2不稳定,受热易分解;K2Cr2O7在冷水中的溶解度较小;(4)根据表中数据可知温度较高时K2Cr2O7的溶解度较大,其它物质的溶解度较小,蒸发浓缩使杂质转化为固体析;,(5)①根据反应:I2+2S2O32-=2I-+S4O62-,碘单质遇到淀粉时,溶液的蓝色消失,据此来回答并计算纯度;②滴定管在滴定前有气泡,会造成V(标准)偏大.(1)配置一定物质的量浓度的溶液所需的玻璃仪器有:烧杯、玻璃棒、吸量管、容量瓶和胶头滴管,
故答案为:250mL容量瓶、胶头滴管;
(2)实验时,当吸滤瓶中液面高度快达到支管口位置时,为防止液体进入其它装置应该倒出部分液体,所以其操作方法是:拔掉吸滤瓶上的橡皮管,从吸滤瓶上口倒出溶液;
故答案为:拔掉吸滤瓶上的橡皮管,从吸滤瓶上口倒出溶液;
(3)H2O2不稳定,受热易分解,所以通过加热来除去H2O2;K2Cr2O7在冷水中的溶解度较小,用少量冷水洗涤K2Cr2O7,能除去晶体表面残留的杂质,还能减小K2Cr2O7的损耗;
故答案为:除去H2O2;除去晶体表面残留的杂质,减小K2Cr2O7的损耗;
(4)根据表中数据可知温度较高时K2Cr2O7的溶解度较大,其它物质的溶解度较小,蒸发浓缩使杂质转化为固体析,温度较高时K2Cr2O7不析出固体,所以要趁热过滤;
故答案为:①蒸发浓缩; ②趁热过滤;
(5)①由反应Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;I2+2S2O32-=2I-+S4O62-可得反应的关系式为Cr2O72-~3I2~6S2O32-,根据关系式计算.
Cr2O72-~3I2~6S2O32-
1mol 3mol 6mol
n 0.2400×30×10-3mol
则250ml含重铬酸钾的物质的量为n=
0.2400×30×10−3mol
6×10,则所得产品中重铬酸钾纯度为
0.2400×30×10−3×10×294
6×4.000×100%=88.2%,
故答案为:88.2%;
②装Na2S2O3标准液的滴定管在滴定前有气泡滴定后没有气泡,会造成V(标准)偏大,则计算出Na2S2O3的物质的量偏大,重铬酸钾的物质的量偏大,则测得的重铬酸钾的纯度将偏高;
故答案为:偏高.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;化学方程式的有关计算.
考点点评: 本题考查较为综合,涉及溶液的配制、氧化还原反应、溶解平衡以及滴定操作等问题,题目难度中等,本题注意从质量守恒的角度利用关系式法计算纯度.1年前查看全部
- 通过氨的催化氧化法制取硝酸,在此全过程中,理论上氨与所耗氧气的物质的量比为__________.
通过氨的催化氧化法制取硝酸,在此全过程中,理论上氨与所耗氧气的物质的量比为__________.
1:要详解. wangdada1年前2
wangdada1年前2 -
 四大纯之抱大腿 共回答了16个问题
四大纯之抱大腿 共回答了16个问题 |采纳率100%首先,氨的催化氧化:
氨:氧=4:5
其次,一氧化氮和氧:
一氧化氮:氧=4:2
再次,二氧化氮溶水:
二氧化氮:氧=4:1
将上述累加,得氨:氧=4:8=1:21年前查看全部
- 在一定条件下用氮气和氢气合成氨,在此过程中有80%的氮气转化为氨气,然后用氨的催化氧化法制取硝酸.
在一定条件下用氮气和氢气合成氨,在此过程中有80%的氮气转化为氨气,然后用氨的催化氧化法制取硝酸.
损失氨气10%,现有180吨的液态氮,可生产68%的硝酸多少吨? lnzxmwxy1231年前1
lnzxmwxy1231年前1 -
 芭娜 共回答了16个问题
芭娜 共回答了16个问题 |采纳率93.8%生成硝酸的步骤:4NH3+5O2=4NO+6H2O 4NO+2O2=4NO24NO2 + O2 + 2H2O = 4HNO3总方程:NH3+2O2=HNO3+H2O由上面化学方程式可知:4NH3~4HNO3 即:1 mol NH3可以生成1 mol HNO3.由题可知,现有180 t液态氨,氮气的利用率为...1年前查看全部
- 工业上目前使用两种方法制取乙醛:(1)乙炔水化法;(2)乙烯氧化法.下列两表提供生产过程中原料、反应条件、原料平衡转化率
工业上目前使用两种方法制取乙醛:(1)乙炔水化法;(2)乙烯氧化法.下列两表提供生产过程中原料、反应条件、原料平衡转化率、产量等有关的信息情况:
表一:原料、反应条件、平衡转化率、日产量
表二:原料来源生产工艺乙炔水化法 乙烯氧化法 原料 乙炔、水 乙烯、空气 反应条件 HgSO4、100~125℃ PdCl2-CuCl2、100~125℃ 平衡转化率 乙炔平衡转化率90%左右 乙烯平衡转化率80%左右 日产量 2.5吨(某设备条件下) 3.6吨(相同设备条件下)
根据上述两表,回答下列问题:原料生产工艺过程 乙炔 CaCO3
CaO①850~1100℃
CaC2②+C、电炉 1100℃
C2H2③饱和食盐水 乙烯 来源于石油裂解气
(1)从两表中分析,现代工业上乙烯氧化法逐步取代乙炔水化法(从环境、原料来源、产率和产量、能耗等角度),分析可能的原因.
从表一看:______
从表二看:______
(2)若乙烯由石油裂化(裂化气混合气体的平均化学式CnHm、m>2n),进一步完全催化裂解而来,得到体积百分含量分别为:甲烷:5%、乙烯:40%、丙烯:10%、其余为丁二烯和氢气(气体体积均在同温同压下测定).若得到40mol乙烯,求:能够得到丁二烯和氢气的物质的量各为多少? 椰子叶子09171年前1
椰子叶子09171年前1 -
 梦醒来时 共回答了19个问题
梦醒来时 共回答了19个问题 |采纳率100%解题思路:(1)结合表格中的数据,结合催化剂有毒、转化率及反应速率、能源消耗等来分析;
(2)石油裂化得到体积百分含量分别为:甲烷:5%、乙烯:40%、丙烯:10%、其余为丁二烯和氢气,利用原子守恒来计算.(1)从表一来看,两者反应条件温度相当,但乙炔水化法制乙醛使用的是汞盐催化剂,毒性大;虽然乙烯氧化法的转化率略小于乙炔水化法,但反应快、日产量比其高得多;
从表二来看,乙炔的制取要经过多步反应制得,且消耗大量的热能、电能,较难获得;乙烯来源于石油裂解气,消耗的总能量比乙炔少,且较容易获得,
故答案为:乙炔水化法制乙醛使用的是汞盐催化剂,毒性大,且日产量高;乙炔的制取要经过多步反应制得,且消耗大量的热能、电能,较难获得;
(2)要得到40molC2H4,则会生成5molCH4、10molC3H6.设生成x mol丁二烯(C4H6)和y molH2,且需要催化裂解a mol的CnHm.
则根据碳原子守恒可知:an=5+30+80+4x=115+4x,
根据氢原子守恒可知:am=20+60+160+6x+2y=240+6x+2y
根据题意:x+y=100-55,
解得:x=
330n−115m
4(m−n)或x=
215n
4(m−n)-28.75,y=
295m−115n
4(m−n)或y=73.75-
215n
4(m−n),
答:丁二烯和氢气的物质的量各为
330n−115m
4(m−n)
215n
4(m−n)-28.75、
295m−115n
4(m−n)或73.75-
215n
4(m−n).点评:
本题考点: 有机物的合成;化学方程式的有关计算.
考点点评: 本题考查有机物的合成及计算,注意表格数据的分析和物质的合成的关系,能利用原子守恒进行有机化学反应的计算,对学生能力的考查较高,题目难度中等.1年前查看全部
- 己二酸制备的问题用高锰酸钾氧化法制备己二酸,在加入环己醇的时候温度过高,导致烧杯中物体立马变褐色,之后继续实验,这样的情
己二酸制备的问题
用高锰酸钾氧化法制备己二酸,在加入环己醇的时候温度过高,导致烧杯中物体立马变褐色,之后继续实验,这样的情况之后会不会没有结晶析出? rb0dbhxj1年前1
rb0dbhxj1年前1 -
 信心是没有用的 共回答了13个问题
信心是没有用的 共回答了13个问题 |采纳率100%不会1年前查看全部
- 芬顿氧化法 废水中有30g/L~20g/L的COD,需要降低到15g/L~10g/L.需要投加多少的双氧水和硫酸亚铁.
芬顿氧化法 废水中有30g/L~20g/L的COD,需要降低到15g/L~10g/L.需要投加多少的双氧水和硫酸亚铁.
废水中有30000mg/L~20000mg/L的COD,需要降低到15000mg/L~10000mg/L.需要投加多少的30%的双氧水和固态的7水合硫酸亚铁. 肥鱼非鱼1年前1
肥鱼非鱼1年前1 -
 yangxuj 共回答了21个问题
yangxuj 共回答了21个问题 |采纳率100%去除率约50%,7水合硫酸亚铁,18g/L;双氧水:45-60ml/200ml,最好坐下试验,1年前查看全部
- 有一种方法叫“烯烃氧化法” 真心不懂 希望能说详细点 最能能举几个例子啦
 ayll1年前1
ayll1年前1 -
 llm805 共回答了26个问题
llm805 共回答了26个问题 |采纳率88.5%比如 R-CH2CH=CH-R
对于这个烯烃来说 烯烃在合适的氧化剂下会发生双键断裂,总的结果就是形象把把双键劈开一边加一个=O
比如我说的这个 就得到
R-CH2CH=O (这里不好话,反正是醛基) 和O=CH-R
1如果双键上直接连的碳原子有H 那么氧化后就得到醛
2 如果没有H那么氧化后得到的是酮.
比如
R-CH2CH=C(CH3)-CH3 氧化后得到 R-CH2CH=O + CH3-CO-CH31年前查看全部
- 处理含淀粉和PVA的废水,臭氧氧化法和芬顿氧化法哪个更好一些?
处理含淀粉和PVA的废水,臭氧氧化法和芬顿氧化法哪个更好一些?
淀粉和PVA更易被臭氧氧化还是fenton氧化?
是淀粉先被氧化还是PVA先被氧化呢? yeswo1年前3
yeswo1年前3 -
 一生无悔0102 共回答了17个问题
一生无悔0102 共回答了17个问题 |采纳率94.1%臭氧应该要好些,当然只靠臭氧来处理是不行的,前面的预处理,或加药剂把臭氧处理的物质沉淀过滤掉更重要,可以去启达臭氧发生器公司的网站看看,上面有关污水处理的介绍1年前查看全部
- 费林试剂氧化法测还原糖,标准溶液的浓度为什么不用物质的量浓度表示?
 80shuijingying1年前1
80shuijingying1年前1 -
 天之冥舞 共回答了18个问题
天之冥舞 共回答了18个问题 |采纳率94.4%可以用物质的量浓度表示的1年前查看全部
- 铬酸氧化法制备环己酮反应结束后,为什么加草酸?
 ep31851年前1
ep31851年前1 -
 愿明天会更好 共回答了16个问题
愿明天会更好 共回答了16个问题 |采纳率100%用于除掉反应中过量的重铬酸盐,避免过量的重铬酸盐继续氧化环己酮,降低产量.1年前查看全部
大家在问
- 1请问:We are playing a great game of "institutional chicken" no
- 2求一篇初一作文!写My day.用过去时态,请不要出现非初一的单词,写成后必悬赏100分!
- 3朋友们!我想让你们出几道数学题.是关于初二的.2道反比例函数,2道勾股定理,2道分式.
- 4He went home by car yesterday同义句 He _____ _____ _____ _____
- 5用英语:哈哈!你还真去翻译了。 怎么说
- 6英语状语从句The roof fell____he had time to dash into the room to
- 7把四分之五M长的丝带剪成同样长的8段,每段长( );把8M长的丝带剪成每段三分之二M长,一共可以剪( )段
- 8求《电子情书》片头曲,开头第一句我听的是dreams are nothing more than wishes……
- 9怎么比较有机物沸点熔点?比如说几个有机物,分别是 3,3-二甲基-戊烷,3-甲基-戊烷,2,3-二甲基戊烷,2,3,3-
- 10知识技能第一题和第三题!
- 11How much are the potatoes in the ___________ market?
- 12一道数学分析题目,希望大家帮帮忙,谢谢!
- 13如图,正方形ABCD和正方形CEFG的位置如图所示,BD与AF相交于点H.
- 14英语翻译1.He is full of good intentions,but can do nothing to he
- 15已知a,b,c满足a-b+c=7,ab+bc+b+c2+16=0,求[b/a]的值.
