热化学△H是什么意思一个化学可逆反应后面写着△H大于或小于0,那么△H是什么意思?
 sukekiyo02022-10-04 11:39:544条回答
sukekiyo02022-10-04 11:39:544条回答
已提交,审核后显示!提交回复
共4条回复
 drivingcrazy 共回答了22个问题
drivingcrazy 共回答了22个问题 |采纳率81.8%- 楼上两家答非所问,△H是化学反应焓变,焓是物体的一个热力学能状态函数,焓变即物体焓的变化量 这个你要上大学才知道
△H=△U+PV 在只做体积功条件下 △H=Q
焓的物理意义可以理解为恒压和只做体积功的特殊条件下,Q=ΔH,即反应的热量变化.因为只有在此条件下,焓才表现出它的特性.例如恒压下对物质加热,则物质吸热后温度升高,ΔH>0,所以物质在高温时的焓大于它在低温时的焓.又如对于恒压下的放热化学反应,ΔH - 1年前
 loseye 共回答了71个问题
loseye 共回答了71个问题 |采纳率- 在发生化学反应时,首先要吸收能量,使反应物的化学键破坏,这一过程需要吸收反应物键能那么多的能量.然后再形成新的化学键,这一过程是释放能量的,释放的能量为生成物的键能.
所以当△H小于0,是一个放热过程,吸收的能量小于释放的能量
反之就是△H大于0,就是吸热过程... - 1年前
 superlc 共回答了4个问题
superlc 共回答了4个问题 |采纳率- 热反应方程式中“反应热”的符号表示!
△H大于0——吸热,△H小于0——放热。 - 1年前
 fyd0207 共回答了95个问题
fyd0207 共回答了95个问题 |采纳率- 三楼的答案是正确的。一楼二楼是高中说法,不尽准确。
- 1年前
相关推荐
- 在热化学反应方程式中,如果都是同一个反应,但是反应物或者生成物的状态不同,热量会如何变化?举例子
 harrisonfo1年前1
harrisonfo1年前1 -
 散落叶 共回答了14个问题
散落叶 共回答了14个问题 |采纳率85.7%比如氢气燃烧的热化学方程式:
生成水蒸气 2H2(g)+O2(g)===2H2O(g);ΔH=-484 kJ·mol-1
生成液态水 2H2(g)+ O2(g)==== H2O(l) ΔH=-571.6 kJmol-1
即等量氢气在相同条件下生成液态水放出更多的热量.1年前查看全部
- 下列关于热化学反应的描述中正确的是 A.已知:H + (aq)+OH - (aq)=H 2 O(l) Δ H =-57.
下列关于热化学反应的描述中正确的是
A.已知:H + (aq)+OH - (aq)=H 2 O(l) Δ H =-57.3kJ/mol,则H 2 SO 4 和Ba(OH) 2 反应:H 2 SO 4 (aq)+Ba(OH) 2 (aq)=BaSO 4 (s)+2H 2 O(l) Δ H =-114.6kJ/mol B.CO(g)的燃烧热是283.0kJ/mol,则:2CO 2 (g)=2CO(g)+O 2 (g) Δ H =2×(-283.0)kJ/mol C.两个体积相同的容器中充入等量的NO 2 发生反应:2NO 2 (g)  N 2 O 4 (g) Δ H <0,绝热容器中气体的颜色比铁制容器中颜色深
N 2 O 4 (g) Δ H <0,绝热容器中气体的颜色比铁制容器中颜色深D.Δ H >0的化学反应一定不能自发进行  娇窕扭拧1年前1
娇窕扭拧1年前1 -
 jstwm 共回答了11个问题
jstwm 共回答了11个问题 |采纳率90.9%C
1年前查看全部
- 从图中表示的各物质能量变化推断下列热化学方程式正确的(a、b均为正数)( )
从图中表示的各物质能量变化推断下列热化学方程式正确的(a、b均为正数)( )
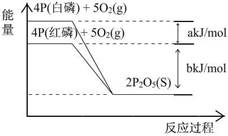
A.4P(白磷) + 5O 2 (g) = 2P 2 O 5 (S) ; △H 1 = +(a+b) kJ/mol B.4P(红磷) + 5O 2 (g) = 2P 2 O 5 (S) ; △H 2 = -(b)kJ/mol C.4P + 5O 2 = 2P 2 O 5 (S) ; △H 3 = +(a+b) kJ/mol D.P(白磷) = P(红磷) ; △H 4 = +(a)kJ/mol  西西兜兜1年前1
西西兜兜1年前1 -
 凯子131 共回答了30个问题
凯子131 共回答了30个问题 |采纳率90%B
A反应为放热反应所以△H 1 = -(a+b) kJ/mol,C中磷和氧气未注明状态,D中△H 4 = +(a/4)kJ/mol。1年前查看全部
- 下列热化学方程式正确的是(△H的绝对值均正确)( )
下列热化学方程式正确的是(△H的绝对值均正确)( )
A.C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=+1367.0 kJ•mol-1(燃烧热)
B.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+57.3 kJ•mol-1(中和热)
C.S(s)+O2(g)═SO2(g)△H=+269.8 kJ•mol-1(反应热)
D.2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1(反应热) 戳戳兵1年前1
戳戳兵1年前1 -
 袖手插言 共回答了18个问题
袖手插言 共回答了18个问题 |采纳率94.4%解题思路:A、依据燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量分析;
B、依据中和热是强酸强碱稀溶液完全反应是1mol水放出的热量分析;
C、硫燃烧反应是放热反应;
D、氢气燃烧生成液态水放热,结合热化学方程式书写方法判断.A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量分析,乙醇燃烧室放热反应,焓变为负值,生成的水是气体,热化学方程式为:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1367.0 kJ•mol-1,故A错误;
B、中和热是强酸强碱稀溶液完全反应是1mol水放出的热量,反应放热,焓变为负值,NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ•mol-1,故B错误;
C、硫燃烧反应是放热反应,S(s)+O2(g)═SO2(g)△H=-269.8 kJ•mol-1,故C错误;
D、氢气燃烧生成液态水放热,结合热化学方程式书写方法可知,2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,书写正确,故D正确;
故选D.点评:
本题考点: 热化学方程式.
考点点评: 本题考查了热化学方程式书写分析判断,主要是燃烧热、中和热概念的理解应用,掌握反应特征和焓变意义是关键,题目较简单.1年前查看全部
- 1、根据热化学反应方程式(标况下):S(S)+O2(g)=SO2(g) △H= -297.23 KJ/mol
1、根据热化学反应方程式(标况下):S(S)+O2(g)=SO2(g) △H= -297.23 KJ/mol
则放出的热量_____(大于/小于/等于)297.23 KJ
2、已知2H2(g)+O2(g)=2H20(l) △H= -569.6 KJ/MOL
2H2O(g)=2H2(g)+O2(g) △H= +482.1 KJ/MOL
现有1G液态H2O,蒸发时吸收的热量为( )
A、2.43KJ
B、4.86KJ
C、43.8KJ
D、87.5KJ 天使魔音1年前3
天使魔音1年前3 -
 niuniubie 共回答了26个问题
niuniubie 共回答了26个问题 |采纳率88.5%1.焓是状态函数,焓的定义可以知道,无论化学反应进行的如何,一旦热化学化学式写定,焓变就是定值.所以选择等于.
2.原理是:Hess(盖斯)定律.化学反应的焓变至于始态和终态有关,而与途径无关.
蒸发即是有液相变为气相,将已知的两个化学方程式结合-(方程式1+方程式2)既得2H2O(g)=2H20(l);△H=87.5KJ/MOL
如按提问者你的问题1G即为1g(克)的话,还应进行换算);△H=(87.5/2)×(1/18)=2.43KJ1年前查看全部
- 英语翻译1.材料科学是研究材料的加工、组织、性能和功能之间的科学.2.高的键强度也使的陶瓷具有热化学堕性,这一性能在发动
英语翻译
1.材料科学是研究材料的加工、组织、性能和功能之间的科学.
2.高的键强度也使的陶瓷具有热化学堕性,这一性能在发动方面有广泛的应用前景,如汽车、航天器和能源装置的发动机.
3 首先,在含碳量不超过1.5%时,含有很少量碳的钢要比高含碳量的钢软一些 uuo4a1年前1
uuo4a1年前1 -
 sz811021 共回答了12个问题
sz811021 共回答了12个问题 |采纳率83.3%1 material science is an ology between process orgaize capability and function.
2 supernal bond strength also made ceramics 热化学惰性 ,which have a prospective of use in motor ,such as auto, areospacecraft and the motor of engine set
3 first ,steel with a fat lot carbon is softer than that with high content in the circumstance that carbon content is less than 1.5%1年前查看全部
- 下列热化学方程式正确的是( )
下列热化学方程式正确的是( )
A.2SO2+O2⇌2SO3;△H=-196.6 kJ•mol-1
B.H2 (g)+[1/2]O2 (g)=H2O(l);△H=-285.8 kJ•mol-1
C.2H2 (g)+O2 (g)=2H2O(l);△H=-571.6 kJ
D.C(s)+O2 (g)=CO2 (g);△H=+393.5 kJ•mol-1 moodee1年前1
moodee1年前1 -
 wdgwdg36 共回答了19个问题
wdgwdg36 共回答了19个问题 |采纳率78.9%解题思路:依据热化学方程式书写方法标注物质聚集状态和对应反应的焓变写出热化学方程式判断.A、没有物质的聚集状态,故A错误;
B、由物质聚集状态和对应反应的焓变,热化学方程式为H2 (g)+[1/2]O2 (g)=H2O(l);△H=-285.8 kJ•mol-1,故B正确;
C、焓变的单位应该为kJ•mol-1,故C错误;
D、C(s)+O2 (g)=CO2 (g),该反应是放热反应焓变为负值,故D错误;
故选B.点评:
本题考点: 热化学方程式.
考点点评: 本题考查了热化学方程式书写方法,注意反应焓变的意义是全部转化放出的热量,题目难度中等.1年前查看全部
- 下列关于热化学反应的描述中正确的是( )
下列关于热化学反应的描述中正确的是( )
A.HCl和NaOH反映的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反映的中和热
△H=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)===2CO(g)+O2(g)反应的△H=2×283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 逍遥笨猪1年前2
逍遥笨猪1年前2 -
 o型水瓶 共回答了14个问题
o型水瓶 共回答了14个问题 |采纳率100%A错,因为中和热定义是“生成1mol水放出的热量”,硫酸和石灰水也是强酸强碱,跟氢氧化钠中和盐酸一样的.B对不解释.C错,比如煤炭的燃烧是放热反应,但是需要加热.D错,燃烧热的定义是1摩尔纯物质在空气中完全燃烧生成稳定氧化物放出的热量,气态水不是稳定氧化物,液态水才是.1年前查看全部
- 什么是热化学反应的中和热、反应热?
 彭_彭1年前1
彭_彭1年前1 -
 6hobff 共回答了30个问题
6hobff 共回答了30个问题 |采纳率90%在稀溶液中,酸跟碱发生中和反应生成1 mol水时的反应热叫做中和热. 1.必须是酸和碱的稀溶液,因为浓酸溶液和浓碱溶液在相互稀释时会放热. 2.强酸和强碱的稀溶液反应才能保证H+(aq)+OH-(aq)====H2O(l)中和热均为57.3 kJ·mol-1,而弱酸或弱碱在中和反应中由于电离吸收热量,其中和热小于57.3 kJ·mol-1; 3.以生成1 mol水为基准. 反应热,通常是指:当一个化学反应在恒压以及不作非膨胀功的情况下发生后,若使生成物的温度回到反应物的起始温度,这时体系所放出或吸收的热量称为反应热.也就是说,反应热通常是指:体系在等温、等压过程中发生物理或化学的变化时所放出或吸收的热量.化学反应热有多种形式,如:生成热、燃烧热、中和热等.化学反应热是重要的热力学数据,它是通过实验测定的,所用的主要仪器称为“量热计”.1年前查看全部
- 高中化学帮我查下这两个热化学反应方程式不用你算.
 wuning8891年前1
wuning8891年前1 -
 zhoumengl 共回答了16个问题
zhoumengl 共回答了16个问题 |采纳率87.5%9.C1年前查看全部
- 热反应方程式已知下列热化学反应方程式Fe2O3+3CO=2Fe+3CO2 △H=-24.8kj/molFe2O3+1/3
热反应方程式
已知下列热化学反应方程式
Fe2O3+3CO=2Fe+3CO2 △H=-24.8kj/mol
Fe2O3+1/3CO=2/3Fe3O4+1/3CO2 △H=-15.73
Fe3O4+CO=3Fe0+CO2 △H=+640.4
则14gCO还原足量Fe0得到Fe固体和CO2时得到对应的△H约为多少
答案我知道,就是不知道过程
这百度也越来越不称职效率也越来越低了,上次一道题发了我三遍,这次希望只要两遍了 花舞怒放1年前1
花舞怒放1年前1 -
 hnxsy777 共回答了20个问题
hnxsy777 共回答了20个问题 |采纳率75%这道题关键是得出:FeO+CO=Fe+CO2 △H=?
Fe2O3+3CO=2Fe+3CO2 △H=-24.8kj/mol ①
Fe2O3+1/3CO=2/3Fe3O4+1/3CO2 △H=-15.73 ②
Fe3O4+CO=3Fe0+CO2 △H=+640.4 ③
由此三个化学反应方程式得:
①-②
2/3Fe3O4+8/3CO=2Fe+8/3CO2 △H=-9.07kJ/mol
Fe3O4+4CO=3Fe+4CO2 △H=-13.605kJ/mol ④
④-③
3FeO+3CO=3Fe+3CO2 △H=-654.005kJ/mol
FeO+CO=Fe+CO2 △H=-218.002kJ/mol
14克CO物质的量是0.5mol
∴对应的△H=0.5mol*(-218.002kJ/mol)=-109kJ1年前查看全部
- 在热化学反应方程式中△H为什么和反应计量数呈对应关系啊.
在热化学反应方程式中△H为什么和反应计量数呈对应关系啊.
知道的说下尽量详细点~△H的单位不是KJ/mol么,随着反应物物质的量的变化所消耗的能量也在变化啊?△H应该是不变的才对啊 一网打尽51881年前1
一网打尽51881年前1 -
 bzlsaly 共回答了22个问题
bzlsaly 共回答了22个问题 |采纳率100%新教材中△H的单位"kJ/mol"中的"mol"是指定反应体系的反应进度的国际单位制(简称SI)单位,而不是物质的量的单位.考虑到中等化学的实际情况,新教材中没有引入“反应进度(符号为ξ)”这个物理量.
由于反应进度ξ的定义与化学反应方程式的写法有关,因此△H也与化学反应方程式的写法有关,即对同一实验数据,由于计算△ξ所依据的化学反应方程式不同,使得△H也不同.所以在使用△H时,必须指明对应的化学反应方程式.例如,
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol ①
H2(g)+1/2O2(g)=H2O(g) △H=-241.8kJ/mol ②
对于反应①来说,2 mol H2(g)和1 mol O2(g) 完全反应生成2 mol H2O(g)表示1 个反应进度的反应,而对于反应②来说,1 mol H2(g)和0.5 mol O2(g)完全反应生成1 mol H2O(g)也表示1个反应进度的反应,前者放热483.6 kJ,后者放热241.8 kJ.因此,两个反应的△H不同,反应① 的△H是反应②的两倍.
对于用不同的化学计量数表示的相同物质的反应,每反应进度的反应所表示的意义是不同的,当然相对应的△H也是不同的.
其实这个问题不必深究,考试时记得△H跟着化学计量数一起成比例的变就行了.1年前查看全部
- 盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学
盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程式:
①CO(g)+[1/2]O2(g)=CO2(g)△H1=-283.0kJ/mol
②H2(g)+[1/2]O2(g)=H2O(l)△H2=-285.8kJ/mol
③C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H3=-1370kJ/mol
计算④2CO(g)+4H2(g)=H2O(l)+C2H5OH(l)的△H. lilielf1年前1
lilielf1年前1 -
 小紅豆 共回答了23个问题
小紅豆 共回答了23个问题 |采纳率87%解题思路:根据盖斯定律,由已知热化学方乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数并进行相应的加减,据此计算.已知:①CO(g)+1/2O2(g)=CO2(g)△H1=-283.0kJ/mol
②H2(g)+[1/2]O2(g)=H2O(l)△H.2=-285.8kJ/mol
③C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H3=-1370kJ/mol
根据盖斯定律,①×2-③+②×4得2CO(g)+4H2(g)=H2O(l)+C2H5OH(l)△H.=2△H1-△H3+4△H2;
故△H.4=2△H1-△H3+4△H2=2×(-283.0kJ/mol)-(-1370kJ/mol)+4×(-285.8kJ/mol)=-339.2kJ/mol
答:2CO(g)+4H2(g)═H2O(l)+C2H5OH(l)的△H=-339.2 kJ/mol.点评:
本题考点: 热化学方程式.
考点点评: 本题考查根据盖斯定律进行的有关反应热的计算,难度中等,注意理解盖斯定律,关键是构造目标热化学方程式.1年前查看全部
- 已知1gHp燃烧生成液态水时放出1下p.99J图热量,以下热化学方程式正确图是( )
已知1gHp燃烧生成液态水时放出1下p.99J图热量,以下热化学方程式正确图是( )
A.2H2(g)+O2(g)=2H2O(l)△H=-142.9kJ•mol-1
B.2H2(g)+O2(g)=2H2O(l)△H=+571.6kJ•mol-1
C.2H2+O2=2H2O△H=-571.6kJ•mol-1
D.H2(g)+[1/2]O2(g)=H2O(l)△H=-285.8kJ•mol-1 赵文辉1年前1
赵文辉1年前1 -
 cwgong 共回答了19个问题
cwgong 共回答了19个问题 |采纳率100%解题思路:根据热化学方程式的书写判断
书写热化学方程式除了要遵循书写化学方程式的要求外,还应注意以下几方面:
(1)必须注明各反应物、生成物的状态(s、l、g、aq),不标“↑”和“↓”符号.
(2)反应热△H与测定条件(温度、压强)有关,若不说明则指常温(25℃)、常压(101kPa)下.
(3)△H只能写在标有反应物或生成物状态的化学方程式的右边,并用“;”隔开.若为吸热反应,△H为“+”;若为放热反应,△H为“-”.△H的单位一般为kJ/mol.
(4)热化学方程式中的化学计量数仅表示该物质的物质的量,不表示物质的分子或原子数,因此可以是整数或分数.
(5)△H与热化学方程式中化学式前面的化学计量数成正比.当反应逆向进行时,其反应热与正反应的反应热数值相等,但符号相反.
(6)书写燃烧热的热化学方程式时,应以燃烧1mol物质为标准来配平其他物质化学式前面的化学计量数.
(7)当两个热化学方程式相加(减)时,反应热同时相加(减),得到一个新的热化学方程式.A、umol氢气燃烧生成液态水,放出的热量为q4u.9kJ×4=57q.6kJ,所以△H=-57q.6kJ•mol-q,故A错误;
B、反应为放热反应,△H为“-”,故B错误;
C、物质的状态影响反应热,未注明物质的聚集状态,故C错误;
k、qgHu燃烧生成液态水时放出q4u.9kJ的热量,△H<0,热化学方程式为Hu(g)+[q/u]Ou(g)=HuO(l)△H=-u85.8kJ•mol-q,故k正确.
故选:k.点评:
本题考点: 热化学方程式.
考点点评: 本题考查热化学方程式,题目难度不大,注意热化学方程式的书写方法.1年前查看全部
- 关于热化学反应的理解如果A - B = 0 热量变化为 a那么A = B 的热量变化是a 还是-a
 wolfzxz1年前1
wolfzxz1年前1 -
 孔子曰子路 共回答了14个问题
孔子曰子路 共回答了14个问题 |采纳率85.7%a 确定无误1年前查看全部
- 盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学
盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
①Fe 2 O 3 (s)+3CO(g)=2Fe(s)+3CO 2 (g)△H=―24.8kJ•mol -1
②3Fe 2 O 3 (s)+CO(g)=2Fe 3 O 4 (s)+CO 2 (g)△H=―47.2kJ•mol -1
③Fe 3 O 4 (s)+CO(g)=3FeO(s)+CO 2 (g)△H=+640.5kJ•mol -1
写出CO气体还原FeO固体得到Fe固体和CO 2 气体的热化学反应方程式:__________________________________________________ yesterday1001年前1
yesterday1001年前1 -
 xx民间xx会 共回答了16个问题
xx民间xx会 共回答了16个问题 |采纳率87.5%CO(g)+FeO(s)=Fe(s)+CO 2 (g)△H=―218.0kJ•mol -1
1年前查看全部
- 1996年,范克(Fwnk.J.E)等人提出用H2O和H2SO4为原料进行热化学循环制氢法:
1996年,范克(Fwnk.J.E)等人提出用H2O和H2SO4为原料进行热化学循环制氢法:
2H2O(l)+SO2(g)+I2(s)═H2SO4(aq)+2HI(g)
H2SO4(aq)═H2O(l)+SO2(g)+[1/2]O2(g)
2HI(g)═H2(g)+I2(g)
从理论上讲,该循环中,1mol原料H2O能制得氢气( )
A.0.25mol
B.0.5mol
C.1mol
D.2mol 舞台冷焰火1年前1
舞台冷焰火1年前1 -
 标枪王 共回答了24个问题
标枪王 共回答了24个问题 |采纳率91.7%已知:①2H2O(l)+SO2(g)+I2(s)═H2SO4(aq)+2HI(g)
②H2SO4(aq)═H2O(l)+SO2(g)+[1/2]O2(g)
③2HI(g)⇌H2(g)+I2(g)
①+②+③可得H2O(l)=H2(g)+[1/2]O2(g),
根据方程式中的循环反应可知,水中氢元素最终完全生成氢气,根据氢原子守恒可知,1mol H2O能制得1mol氢气,
故选C.1年前查看全部
- 下列关于热化学反应的描述中不正确的是( )
下列关于热化学反应的描述中不正确的是( )
A.HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1
B.CO(g)的燃烧热是283.0 kJ•mol-1,则2CO2(g)=2CO(g)+O2(g)反应的△H=2×283.0 kJ•mol-1
C.需要加热才能发生的反应不一定是吸热反应
D.1 mol甲烷燃烧生成液态水和二氧化碳所放出的热量是甲烷燃烧热 dvzn1年前1
dvzn1年前1 -
 asiantour 共回答了16个问题
asiantour 共回答了16个问题 |采纳率87.5%解题思路:A、中和热是指在稀溶液中,强酸和强碱反应生成1mol水时放出的热量;
B、根据燃烧热的概念分析;
C、反应热与反应条件无关;
D、燃烧热是指25℃101KP时,1mol可燃物完全燃烧生成稳定的氧化物时放出的热量.A、中和热是指在稀溶液中,强酸和强碱反应生成1mol水时放出的热量,其衡量标准是生成的水为1mol,故无论稀H2SO4和Ca(OH)2反应生成的水是几摩尔,其中和热恒为57.3KJ/mol,故A错误;
B、CO的燃烧热是指1molCO燃烧生成二氧化碳气体放出的热量,所以2mol二氧化碳分解吸热2×283.0 kJ,故B正确;
C、反应热与反应条件无关,决定于反应物和生成物的能量高低,故C正确;
D、燃烧热是指在25℃101KP时,1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,此时生成的水必须为液态,故D正确;
故选A.点评:
本题考点: 反应热和焓变.
考点点评: 本题考查了燃烧热、中和热以及热化学方程式中计量数的含义,难度不大.1年前查看全部
- 已知如下两个热化学反应方程式:
已知如下两个热化学反应方程式:
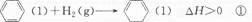
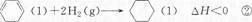
下列说法不正确的是 ()A.反应①、②都属于加成反应 B.在通常条件下,反应①、②都能自发进行 C.反应①吸热、反应②放热的事实说明苯环中含有的并不是碳碳双键 D.反应①、②中的所有有机物均可使溴水褪色,但褪色原理不完全相同  0sunshine01年前1
0sunshine01年前1 -
 麦兜的nn 共回答了12个问题
麦兜的nn 共回答了12个问题 |采纳率83.3%B
1年前查看全部
- 下列热化学方程式正确的是 A.S(s)+O 2 (g)= SO 2 (g);ΔH= -269.8kJ/mol B.NaO
下列热化学方程式正确的是
A.S(s)+O 2 (g)= SO 2 (g);ΔH= -269.8kJ/mol B.NaOH (aq)+HCl(aq)=NaCl(aq)+H 2 O(l);ΔH=+57.3kJ/mol C.表示乙醇的燃烧热:C 2 H 5 OH(l)+3O 2 (g)=2CO 2 (g)+ 3H 2 O(g);ΔH=-1367.0 kJ/mol D.2NO 2 = O 2 +2NO;ΔH= +116.2kJ/mol  梦云崖1年前1
梦云崖1年前1 -
 蹦啊跳啊 共回答了18个问题
蹦啊跳啊 共回答了18个问题 |采纳率88.9%A
1年前查看全部
- 热化学反映的一道选择题 已知答案是C 但不知道为什么D错了 求救 谢谢了啊
热化学反映的一道选择题 已知答案是C 但不知道为什么D错了 求救 谢谢了啊
8.已知氢气的燃烧热为285.8kJ/mol ,CO的燃烧热为282.8kJ/mol ;现有H2和CO组成的混合气体56.0L(标准状况),经充分燃烧后,放出总热量为710.0kJ,并生成液态水.下列说法正确的是
A、CO燃烧的热化学方程式为:
2CO(g) + O2(g) = 2CO2(g);ΔH = +285.8kJ/mol
B、H2燃烧的热化学方程式为:
2H2(g) + O2(g) = 2H2O(g);ΔH = -571.6kJ/mol
C、燃烧前混合气体中H2的体积分数为40%
D、燃烧后的产物全部与足量的过氧化钠作用可产生1.25mol氧气
D选项是错的 求原因 我是问D是如何错的!111 二拳映月1年前1
二拳映月1年前1 -
 掰nn 共回答了18个问题
掰nn 共回答了18个问题 |采纳率88.9%H2+Na2O2---(O2)--->2NaOH
CO+Na2O2---(O2)--->Na2CO3
H2+CO为56L.
所以放出O2为56/2=28L
28/22.4=1.25
D没有错.1年前查看全部
- 下列热化学方程式正确的是( )
下列热化学方程式正确的是( )
A.甲烷的标准燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1
B.稀HNO3溶液与NaOH溶液发生反应生成1 mol H2O时放出57.3 kJ的热量.其热化学方程式为:HNO3(l)+NaOH(l)=NaNO3(l)+H2O(l)△H=-57.3 kJ•mol-1
C.若:2H2S(g)+O2(g)═2S(s)+2H2O(l)△H=-Q kJ•mol-1.则:2H2S(g)+O2(g)═2S(s)+2H2O(g)△H<-Q kJ•mol-1
D.若:2CO(g)+O2(g)═2CO2(g)△H=-566 kJ•mol-1;Na2O2(s)+CO2(g)═Na2CO3(s)+[1/2]O2(g)△H=-266 kJ•mol-1.则CO(g)与Na2O2(s)反应放出549 kJ热量时,转移电子的数目为1.204×1024 很想入眠1年前1
很想入眠1年前1 -
 alander 共回答了14个问题
alander 共回答了14个问题 |采纳率100%解题思路:A、依据燃烧热概念分析,1mol可燃物完全燃烧生成稳定氧化物放出的热量分析;
B、中和热概念分析判断,溶液应用aq表示;
C、液体水变化为气体水吸热,反应是放热反应,焓变为负值;
D、依据热化学方程式和盖斯定律计算得到热化学方程式,结合化学方程式计算多种转移.A、依据燃烧热概念分析,1mol可燃物完全燃烧生成稳定氧化物放出的热量分析,甲烷的标准燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3 kJ•mol-1,故A错误;
B、中和热概念分析判断,溶液应用aq表示,稀HNO3溶液与NaOH溶液发生反应生成1 mol H2O时放出57.3 kJ的热量.其热化学方程式为:HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(l)△H=-57.3 kJ•mol-1,故B错误;
C、液体水变化为气体水吸热,反应是放热反应,焓变为负值,若:2H2S(g)+O2(g)═2S(s)+2H2O(l)△H=-Q kJ•mol-1.则:2H2S(g)+O2(g)═2S(s)+2H2O(g)△H>-Q kJ•mol-1,故C错误;
D、依据热化学方程式和盖斯定律计算得到热化学方程式,结合化学方程式计算电子转移若:
①2CO(g)+O2(g)═2CO2(g)△H=-566 kJ•mol-1;
②Na2O2(s)+CO2(g)═Na2CO3(s)+[1/2]O2(g)△H=-266 kJ•mol-1,依据盖斯定律(①+②×2)×[1/2]得到:
Na2O2(s)+CO(g)=Na2CO3(s)△H=-549KJ/mol
CO(g)与Na2O2(s)反应放出549 kJ热量时,反应一氧化碳1mol,转移电子的数目为1.204×1024,故D正确;
故选D.点评:
本题考点: 热化学方程式.
考点点评: 本题考查了燃烧热、中和热概念分析应用,盖斯定律计算,热化学方程式书写方法是解题关键,掌握基础是关键,题目难度中等.1年前查看全部
- 下列热化学方程式正确的是( )
下列热化学方程式正确的是( )
A.甲烷的燃烧热为-890.3kJ.mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
B.500℃.30 MPa下,将1mol N2和3molH2置于密闭的容器中充分反应生成NH3(g),放热38.6kJ,其热化学方程式为:N2(g)+3H2(g)⇌2NH3(g)△H=-38.6 kJ•mol-1
C.NaOH(s)+[1/2]H2SO4(浓)═[1/2]Na2SO4(aq)+H2O(l)△H=-57.3kJ•mol-1
D.2.0 g C2H2气体完全燃烧生成液态水和二氧化碳气体,放出100 kJ的热量,该反应的热化学方程式为:2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2600 kJ•mol-1 路与途胜1年前1
路与途胜1年前1 -
 denlenwoj 共回答了21个问题
denlenwoj 共回答了21个问题 |采纳率90.5%解题思路:A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;
B、反应是可逆反应,存在化学平衡,不能进行完全;
C、浓硫酸溶解放热;
D、计算26g乙炔完全燃烧生成 液体水和二氧化碳气体放热,标注物质聚集状态和对应焓变写出;A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量,选项中生成的水是气体,不是稳定氧化物,所以甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1,故A错误;
B、将1mol N2和3molH2置于密闭的容器中充分反应生成NH3(g),放热38.6kJ,反应是可逆反应,存在化学平衡,不能进行完全,焓变是制完全转化放出的热量,其热化学方程式为:N2(g)+3H2(g)⇌2NH3(g)△H<-38.6 kJ•mol-1,故B错误;
C、浓硫酸溶解放热,反应放热大于57.3KJ,故C错误;
D、计算26g乙炔完全燃烧生成 液体水和二氧化碳气体放热为2600KJ,标注物质聚集状态和对应焓变写出热化学方程式为:2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2600 kJ•mol-1,故D正确;
故选:D.点评:
本题考点: 热化学方程式.
考点点评: 本题考查了燃烧热,中和热、溶解热概念的分析判断,注意可逆反应不能进行彻底,焓变的含义是物质完全转化放出的热量,题目难度中等.1年前查看全部
- 下列关于热化学反应的描述中正确的是( )
下列关于热化学反应的描述中正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.1mol硫燃烧生成气态三氧化硫所放出的热量是硫磺的燃烧热
C.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4Ca(OH)2反应的中和热为2×(-57.3)kJ/mol
D.CO(g)的燃烧热是283.0kJ/tool,则表示CO燃烧热的热化学方程为CO(g)+[1/2]O2(g)═CO2(g)△H=-283.0kJ/mol 一个快乐的猪1年前1
一个快乐的猪1年前1 -
 cyj0209 共回答了13个问题
cyj0209 共回答了13个问题 |采纳率92.3%解题思路:A、有的放热反应也要加热才发生;
B、燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物所放出的热量;
C、中和热是指强酸和强碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关;
D、燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物所放出的热量.A、有的放热反应也要加热才发生,如碳的燃烧需要点燃,所以需要加热才能发生的反应不一定是吸热反应,故A错误;
B、燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物所放出的热量,硫燃烧生成稳定氧化物是气态二氧化硫,故B错误;
C、中和热是指强酸和强碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关,则H2SO4 Ca(OH)2反应的中和热为-57.3kJ/mol,故C错误;
D、燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物所放出的热量,CO(g)的燃烧热是283.0kJ/mol,则表示CO燃烧热的热化学方程为CO(g)+[1/2]O2(g)═CO2(g)△H=-283.0kJ/mol,故D正确.
故选D.点评:
本题考点: 反应热和焓变.
考点点评: 本题考查了化学反应与能量问题,题目难度不大,注意中和热、燃烧热等概念的理解.1年前查看全部
- 有关热化学反应方程式的问题若1克甲烷燃烧生成气态水,放出X千焦热量,则甲烷燃烧生成气态水的热化学方程式是2CH3OH(L
有关热化学反应方程式的问题
若1克甲烷燃烧生成气态水,放出X千焦热量,则甲烷燃烧生成气态水的热化学方程式是
2CH3OH(L)+3O2(G)===2CO2(G)+4H2O(L);△H=-64XKJ/MOL
为什么是64啊 我算的1MOL的甲烷燃烧不是放出32KJ的热量吗
后面的单位不是每MOL吗 zerowg1年前3
zerowg1年前3 -
 xingyu77222 共回答了21个问题
xingyu77222 共回答了21个问题 |采纳率71.4%大哥,人家KJ/mol中mol^-1是指的反应进行每mol即是每种物质每反应一个计量系数.这个方程式中不是有两个甲烷么?那就是每反应两个甲烷算进行1mol此反应,所以是32的两倍.1年前查看全部
- 盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学
盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程式:
①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-24.8kJ•mol-1
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47.2kJ•mol-1
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+19.42kJ•mol-1
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:______. 郁闷人生-1年前1
郁闷人生-1年前1 -
 philisp109 共回答了23个问题
philisp109 共回答了23个问题 |采纳率95.7%解题思路:根据盖斯定律将三个化学方程式进行处理合并计算得到;Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-24.8kJ/mol ①
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol ②
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+19.42kJ/mol ③
①×3-②-③×2得
6CO(g)+6FeO(s)═6Fe(s)+6CO2(g)△H=(-24.8kJ/mol)×3-(-47.2kJ/mol)-(+19.42kJ/mol)×2=-66kJ/mol,
即 CO(g)+FeO(s)═Fe(s)+CO2(g)△H=-11kJ/mol
故答案为:CO(g)+FeO(s)═Fe(s)+CO2(g)△H=-11kJ/mol;点评:
本题考点: 热化学方程式.
考点点评: 本题考查反应热的计算,题目难度不大,注意盖斯定律的应用.1年前查看全部
- 下列热化学方程式正确的是( 的绝对值均正确) A.C 2 H 5 OH(l)+3O 2 (g)= 2CO 2 (g)+3
下列热化学方程式正确的是(
 的绝对值均正确)
的绝对值均正确)A.C 2 H 5 OH(l)+3O 2 (g)= 2CO 2 (g)+3H 2 O(g);△H=—1367.0 kJ/mol(燃烧热) B.NaOH(aq)+HCl(aq)= NaCl(aq)+H 2 O(l);△H=+57.3kJ/mol(中和热) C.S(s)+O 2 (g)= SO 2 (g);△H=—269.8kJ/mol(反应热) D.2NO 2 = O 2 +2NO;△H=+116.2kJ/mol(反应热)  qazcdetgb1年前1
qazcdetgb1年前1 -
 绷带人 共回答了11个问题
绷带人 共回答了11个问题 |采纳率72.7%C
A错,燃烧热是指在常温常压下,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量;该反应中的产物水为水蒸气,是不稳定的氧化物,应改为液态水;B错,中和反应为放热反应,其△H=—57.3kJ/mol;C正确;D错,未指明反应物和生成物的状态;1年前查看全部
- 按要求写热化学方程式:(1)1.0g甲醇在氧气中完全燃烧放出40kJ热量,写出该反应的燃烧热化学方程式(2已知下列热化学
按要求写热化学方程式:
(1)1.0g甲醇在氧气中完全燃烧放出40kJ热量,写出该反应的燃烧热化学方程式
(2已知下列热化学方程式:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H1=-870.3kJ/mol
②C(s)+O2(g)=CO2(g)△H2=-393.5kJ/mol
③H2(g)+[1/2]O2(g)=H2O(l)△H33=-285.8kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式. gyf20061年前1
gyf20061年前1 -
 xiaohua1984 共回答了16个问题
xiaohua1984 共回答了16个问题 |采纳率87.5%解题思路:(1)热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比;
(2)利用盖斯定律计算反应热,并书写热化学方程式.(1)1g甲醇燃烧生成CO2和液态水时放热40kJ,所以32g甲醇燃烧生成CO2和液态水时放热1280kJ,所以CH3OH(l)+[3/2]O2(g)=CO2(g)+2H2O(l)△H=-1280kJ•mol-1,
答:甲醇燃烧热的热化学方程式为CH3OH(l)+[3/2]O2(g)=CO2(g)+2H2O(l)△H=-1280kJ•mol-1;
(2)已知:①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ/mol
②C(s)+O2(g)═CO2(g)△H2=-393.5kJ/mol
③H2(g)+[1/2]O2(g)═H2O(l )△H3=-285.8kJ/mol
利用盖斯定律将②×2+③×2-①可得:2C(s)+2H2(g)+O2(g)=CH3COOH(l);△H=2×(-393.5kJ/mol)+2×(-285.8kJ/mol)-(-870.3kJ/mol)=-488.3kJ/mol,所以热化学方程式为2C(s)+2H2(g)+O2(g)=CH3COOH(l);△H=-488.3kJ/mol,
答:C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式为:2C(s)+2H2(g)+O2(g)=CH3COOH(l);△H=-488.3kJ/mol.点评:
本题考点: 热化学方程式.
考点点评: 本题考查热化学方程式的书写及利用盖斯定律的计算,题目难度中等.1年前查看全部
- 利用ZnFe2O4/(Fe3O4,Zn)两步热化学循环制氢气系统如图所示,下列说法不正确的是( )
利用ZnFe2O4/(Fe3O4,Zn)两步热化学循环制氢气系统如图所示,下列说法不正确的是( )
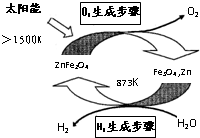
A.图中能量转化方式只有1种
B.两步总反应为:2H2O
2H2↑+O2↑太阳能 .
C.氢能是一种清洁、高效、安全、可持续的新能源
D.H2生产步骤反应为:3Zn+2Fe3O4+4H2O
3ZnFe2O4+4H2↑873K . ecsmkj1年前1
ecsmkj1年前1 -
 1冬之蝉1 共回答了16个问题
1冬之蝉1 共回答了16个问题 |采纳率93.8%解题思路:A、利用ZnFe2O4/(Fe3O4,Zn)两步热化学循环制氢气和氧气,能量转化形式有两种,太阳能转化为化学能,热能转化为化学能;
B、两步分别是ZnFe2O4氧化水和Fe3O4、Zn还原水,ZnFe2O4/(Fe3O4,Zn)可以看成催化剂;
C、氢能源燃烧放热量高、无污染;
D、氢气生成是Fe3O4、Zn还原水制得.A、指氧气是太阳能转化为化学能,制氢气是热能转化为化学能,故A错误;
B、ZnFe2O4/(Fe3O4,Zn)可以看成催化剂,总反应就是分解水,故B正确;
C、氢气燃烧放热量高、无污染、可再生故C正确;
D、氢气生成是Fe3O4、Zn还原水制得,配平方程式可得3Zn+2Fe3O4+4H2O
873K
.
3ZnFe2O4+4H2↑,故D正确;
故选:A.点评:
本题考点: 反应热和焓变;常见的能量转化形式.
考点点评: 本题考查了热化学循环制氢气系统中能量转化形式、氧化还原、可再生能源等等,题目起点高落点低,难度不大.1年前查看全部
- 下列关于热化学反应的描述中正确的是( )
下列关于热化学反应的描述中正确的是( )
A. 已知H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ•mol-1,则H2SO4和Ba(OH)2反应的反应热△H=2×(-57.3)kJ•mol-1
B. 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+[1/2]O2(g)=CO2(g)+2H2(g);△H=-192.9kJ•mol-1,则CH3OH的燃烧热为192.9kJ•mol-1
C. H2(g)的燃烧热是285.8kJ•mol-1,则2H2O(g)=2H2(g)+O2(g);△H=+571.6kJ•mol-1
D. 葡萄糖的燃烧热是2800kJ•mol-1,则[1/2]C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H=-1400kJ•mol-1 城市拖鞋1年前1
城市拖鞋1年前1 -
 xfzhang74 共回答了15个问题
xfzhang74 共回答了15个问题 |采纳率93.3%解题思路:A.根据中和热是指强酸和强碱发生中和反应生成1molH2O所放出的热量来分析;
B.根据燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物所放出的热量,应生成液态水来分析;
C.根据燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物所放出的热量,互为逆反应的反应热的数值相同,符号相反;
D.根据燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物所放出的热量来分析.A.中和热是指稀溶液中,强酸和强碱发生中和反应生成1molH2O所放出的热量,生成2molH2O所放出的热量为2×57.3kJ,但生成硫酸钡沉淀的反应还要放出热量,则H2SO4和Ba(OH)2反应的反应热小于2×(-57.3)kJ•mol-1,故A错误;
B.由燃烧热的概念可知,甲醇燃烧应生成液态水,则CH3OH的燃烧热一定不为192.9kJ•mol-1,故B错误;
C.H2(g)的燃烧热是285.8kJ•mol-1,生成液态水,则2H2O(l)=2H2(g)+O2(g);△H=+571.6kJ•mol-1,故C错误;
D.燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物所放出的热量,葡萄糖的燃烧热是2800kJ•mol-1,则[1/2]C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)△H=-1400kJ•mol-1,故D正确;
故选D.点评:
本题考点: 热化学方程式.
考点点评: 本题主要考查了燃烧热和中和热,明确概念中条件的限制及概念的要点即可解答,题目难度中等,注意中和热的几个关键点:在稀溶液中、强酸强碱反应、生成1molH2O;燃烧热的几个关键点:1molH2O、纯物质、稳定氧化物.1年前查看全部
- 下列关于热化学反应的描述中正确的是 A.已知H + (aq) + OH - (aq) = H 2 O(l)D H =-5
下列关于热化学反应的描述中正确的是
A.已知H + (aq) + OH - (aq) = H 2 O(l)D H =-57.3kJ·mol - 1 ,则H 2 SO 4 和Ba(OH) 2 反应的反应热D H =-114.6kJ·mol - 1 B.密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量,则Fe(s)+S(s)=FeS(s)DH=" +95.6" kJ·mol -1 C.常温时H 2 (g)的燃烧热是285.8 kJ·mol - 1 ,则2H 2 O(g)=2H 2 (g)+O 2 (g) D H =+571.6 kJ·mol - 1 D.常温时葡萄糖的燃烧热是2800 kJ·mol - 1 ,则1/2C 6 H 12 O 6 (s)+3O 2 (g)=3CO 2 (g)+3H 2 O( l ) D H =-1400 kJ·mol - 1  dltv11年前1
dltv11年前1 -
 OliverSegal 共回答了22个问题
OliverSegal 共回答了22个问题 |采纳率90.9%D
A:反应热与反应物质的量有关,况且H 2 SO 4 和Ba(OH) 2 反应时除了有中和热效应的同时,生成沉淀也会产生热效应
B:在热化学方程式中以“—”表示放热,以“+”表示吸热
C:燃烧热是指1mol的可燃物生成稳定的氧化物时所放出的热量,即2H 2 (g)+O 2 (g)=2H 2 O(l) D H =—571.6 kJ·mol - 1 ,也就是2H 2 O(l)=2H 2 (g)+O 2 (g) D H =+571.6 kJ·mol - 1 (本题一定要注意水的状态)
故答案为D1年前查看全部
- 下列热化学方程式正确的是(注:Δ H 的绝对值均正确)( ) A.C 2 H 5 OH(l)+3O 2 (g)===2
下列热化学方程式正确的是(注:Δ H 的绝对值均正确)( )
A.C 2 H 5 OH(l)+3O 2 (g)===2CO 2 (g)+3H 2 O(g) Δ H =-1 367.0 kJ·mol - 1 (燃烧热) B.Ba(OH) 2 (aq)+2HCl(aq)===BaCl 2 (aq)+2H 2 O(l) Δ H =-57.3 kJ·mol - 1 (中和热) C.S(s)+O 2 (g)===SO 2 (g) Δ H =-269.8 kJ·mol - 1 (反应热) D.2NO 2 ===O 2 +2NO Δ H =+116.2 kJ·mol - 1 (反应热)  娟娟秋水1年前1
娟娟秋水1年前1 -
 风云斩 共回答了14个问题
风云斩 共回答了14个问题 |采纳率100%C
燃烧热是指在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的能量,所以乙醇的燃烧产物应该是是液态水,A不正确,C正确。中和热是指在稀溶液中,酸和碱反应生成1mol水时放出的热量,B不正确。D中没有标明物质的状态,不正确。答案选C。1年前查看全部
- 谁能总结一下各类化学方程式的注意事项? 针对考试“判断下列方程式书写是否正确” 热化学?电解?等等
 果冻布丁1年前1
果冻布丁1年前1 -
 goodboynot 共回答了12个问题
goodboynot 共回答了12个问题 |采纳率83.3%书写化学反应方程式的注意事项:
1、要写出正确的化学式.不能杜撰出不符合反应事实的化学式;还要根据化合价来写好化学式,这是最容易犯的错误.
例如:铁燃烧生成四氧化三铁,就不能写成Fe+O2=Fe2O3
2、配平.在化学式前配上一定的化学计量数,使反应前后每种元素的原子个数相等,即要遵守质量守恒定律.
例如:2H2+O2=点燃=2H2O
3、标注“↑”、“↓”和反应条件.当然不要忘了写等号.
例如:2H2O=通电=2H2↑+O2↑(“通电”是该反应的条件,“↑”表示H2和O2都是气体);
其它:
电离的方程式注意 是否完全电离 看看 是用等号 还是 箭头
离子方程式 就是 注意 是否能拆分成离子形式 比如澄清 石灰水 石灰乳 前者可拆 后者不可 注意写 沉淀符号
沉淀 就是 掌握难容物质 根据图表 然后 产生 标号 就行
燃烧热 注意 状态 是不是表况 然后 注意 要求的系数 注意 是否写了状态 是吸热还是 放热 正负号 写没写.1年前查看全部
- 热化学中0=∑BνB什么意思
 liujing886881年前1
liujing886881年前1 -
 terminal 共回答了17个问题
terminal 共回答了17个问题 |采纳率100%第二个B是下标吧,B代表化学反应中的一种物质,ν代表该物质在化学方程式中的计量数,就是系数(∑是求和符号,不用说了吧).在化学反应方程式中吧,左边的物质全部移到右边,并以负号表示.所以左边就是0了,看上去就和方程一样.比如:2H2+O2=2H2O就被转换为0=2H2O-2H2-O2.求给分1年前查看全部
- 下列说法正确的是( )A.反应热指的是反应过程中放出的热量B.热化学方程式的化学计量数可表示分子的个数C.在热化学方程
下列说法正确的是( )
A.反应热指的是反应过程中放出的热量
B.热化学方程式的化学计量数可表示分子的个数
C.在热化学方程式中无论反应物还是生成物都必须标明聚集状态
D.热化学方程式的化学计量数发生改变,反应热不变 cs10221年前1
cs10221年前1 -
 羊羔不吃草 共回答了19个问题
羊羔不吃草 共回答了19个问题 |采纳率84.2%解题思路:A、依据反应热的概念分析判断;
B、热化学方程式表示物质变化和能量变化,化学计量数只表示物质的量;
C、反应热与物质的聚集状态有关;
D、热化学方程式中系数改变,焓变随之变化.A、反应热是一定条件下的化学反应吸收和放出的热量,故A错误;
B、热化学方程式表示物质变化和能量变化,化学计量数只表示物质的量,不表示微粒数,故B错误;
C、反应热与物质的聚集状态有关,反应热与物质的聚集状态有关,故C正确;
D、焓变是对应热化学方程式下的焓变,热化学方程式中系数改变,焓变随之变化,故D错误;
故选:C.点评:
本题考点: 热化学方程式.
考点点评: 本题考查热化学方程式的含义和书写方法应用,焓变的表达意义,注意化学计量数只表示物质的量,不表示微粒数,题目较简单.1年前查看全部
- 下列关于热化学反应的描述中正确的是 [ ] A.HCl和NaOH反应的中
下列关于热化学反应的描述中正确的是 [ ]A.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H 2 SO 4 和Ca(OH) 2 反应的中和热ΔH=2×(-57.3)
kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO 2 (g) =2CO(g)+O 2 (g)反应的ΔH=+2×283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 yayunxuan1年前1
yayunxuan1年前1 -
 ray1949 共回答了20个问题
ray1949 共回答了20个问题 |采纳率85%B1年前查看全部
- 请问大家在热化学反应中,Hcl气体是稳定化合物吗?
 春快乐SO我快乐1年前3
春快乐SO我快乐1年前3 -
 怡然79 共回答了17个问题
怡然79 共回答了17个问题 |采纳率94.1%HCl是稳定化合物.
不过热化学反应与产物稳定不稳定没有关系,只是能量变化不同而已.1年前查看全部
- 下列关于热化学反应的描述中正确的
下列关于热化学反应的描述中正确的
、HCl和NaOH反应的中和热为ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为 学科网
ΔH=2×(-57.3)kJ/mol 学科网
B、CO(g)的燃烧热是283.0kJ/mol,则有2CO2(g) =2CO(g)+O2(g),ΔH=2×283.0 kJ/mol 学科网 wudong2200881年前1
wudong2200881年前1 -
 qwercom 共回答了13个问题
qwercom 共回答了13个问题 |采纳率100%B 吧
A中 H2SO4和Ca(OH)2要生成 微溶的CaSO4 与完全电离的HCl和NaOH反应不同
一般都低于57.3 kJ/mol,也有个别高于57.3 kJ/mol的.这主要取决于弱酸或弱碱电离时吸热还是放热1年前查看全部
- 下列热化学方程式正确的是(注: 的绝对值均正确)( ) A.C 2 H 5 OH(l
下列热化学方程式正确的是(注:
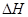 的绝对值均正确)( )
的绝对值均正确)( )A.C 2 H 5 OH(l)+3O 2 (g)==2CO 2 (g) +3H 2 O(g);△H=" —1367.0" kJ/mol(燃烧热) B.NaOH(aq) + HCl(aq) ="=" NaCl(aq) + H 2 O(l);△H= —57.3kJ(中和热) C.S(s) + O 2 (g) ="=" SO 2 (g);△H= —269.8kJ/mol(反应热) D.2NO 2 ==O 2 +2NO;△H= +116.2kJ/mol(反应热)  c52320021年前1
c52320021年前1 -
 奇幻安琪拉 共回答了14个问题
奇幻安琪拉 共回答了14个问题 |采纳率85.7%C
1mol可燃物完全燃烧生成稳定的氧化物放出的热量称为燃烧热,所以H 2 O应该是液态,A错。△H的单位应该为kJ/mol,B错。热化学方程式必须标明物质的聚集状态,故D错。故选C1年前查看全部
- 关于热化学反应方程式△H放热时符号是- 吸热为+
 湖北dd咖啡1年前1
湖北dd咖啡1年前1 -
 傅开虎 共回答了16个问题
傅开虎 共回答了16个问题 |采纳率81.3%当反应为放热反应时,△H为“-” 或△H <0 (表明系统能量减少);当反应为吸热反应时,△H 为“+” 或 △H >0 (表明系统能量增加).1年前查看全部
- 热化学中的焓变的表示的意义我在热化学方程式的书写中高不懂焓变¤h改怎么理解,它的单位是j/mol是怎么推导出来的?表示什
热化学中的焓变的表示的意义
我在热化学方程式的书写中高不懂焓变¤h改怎么理解,它的单位是j/mol是怎么推导出来的?表示什么意义?希望老师们 能据几个例子讲一下,在这先谢了
 静静的雨巷1年前1
静静的雨巷1年前1 -
 ghds0gj6y 共回答了16个问题
ghds0gj6y 共回答了16个问题 |采纳率93.8%焓变表示消耗的反应物和生成的生成物的物质的量等于反应物和生成物前的系数时,反应放出的能量.举个例子,如果反应消耗掉1molH2和1molCl2生成2molHCl放出的能量为Q,则焓变为-QkJ/mol,“-”表示放出能量.注意:焓表示物质具有的能量. 至于单位的推导,说起来比较麻烦,高中一般不要求.如果你还是想要知道的话再继续追问吧!1年前查看全部
- 下列关于热化学反应的描述中正确的是( )
下列关于热化学反应的描述中正确的是( )
A.HCl和NaOH反应的中和热△H=-57.3kJ•mol-1,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1
B.CO(g)的燃烧热是283.0 kJ•mol-1,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0 kJ•mol-1
C.需要加热才能发生的反应一定是吸热反应
D.乙烷的燃烧热就是1mol乙烷燃烧生成气态水和二氧化碳所放出的热量 ydpx1年前1
ydpx1年前1 -
 zz的不甘心 共回答了19个问题
zz的不甘心 共回答了19个问题 |采纳率89.5%解题思路:A.强酸和强碱的稀溶液中和生成1mol水时放出的热量,是中和热,注意只生成水;
B.燃烧热是指可燃物完全燃烧生成稳定化合物时放出的热量,反应热与方程式的计量数成正比放出反写时,反应热的符号相反;
C.反应是吸热还是放热反应与反应条件无关;需要加热才能发生的反应不一定为吸热反应,有些放热反应必须在加热条件下才能进行;
D.燃烧热是指可燃物完全燃烧生成稳定化合物时放出的热量,应生成液态水.A.强酸和强碱的稀溶液中和生成1mol水时放出的热量是中和热,HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,生成沉淀也要放热,则H2SO4和Ba(OH)2的反应放出的热量大于2×57.3kJ,则△H<2×(-57.3)kJ•mol-1,故A错误;
B.CO(g)的燃烧热是283.0 kJ•mol-1,则2CO(g)+O2(g)=2CO2(g)的△H=2×(-283.0)kJ•mol-1,所以2CO2(g)=2CO(g)+O2(g)的△H=2×(+283.0)kJ•mol-1,故B正确;
C.需要加热才能发生的反应不一定为吸热反应,有些放热反应必须在加热条件下才能进行,如铝热反应,故C错误;
D.燃烧热是1mol纯净物完全燃烧生成稳定的氧化物放出的热量,应生成液态水,则1 mol乙烷燃烧生成气态水和二氧化碳所放出的热量不是乙烷的燃烧热,故D错误.
故选B.点评:
本题考点: 反应热和焓变.
考点点评: 本题综合考查了焓变与反应热、中和热、燃烧热等知识,为高频考点,侧重于基本概念的综合理解和运用的考查,题目难度不大,注意相关基础知识的积累.1年前查看全部
- 如何书写热化学反应方程式
 jiekecheng1年前1
jiekecheng1年前1 -
 jm2w 共回答了19个问题
jm2w 共回答了19个问题 |采纳率84.2%1、先书写普通化学反应方程式,
2、在反应物右下角协商反应物状态
3、在方程式后面加上反应的热量变化(吸热反应为正值,即△H>0;放热反应为负值,及△<0)1年前查看全部
- 热化学反应式中 焓变是和 反应系数成正比吗?
 酒城客1年前1
酒城客1年前1 -
 superloverkiki 共回答了16个问题
superloverkiki 共回答了16个问题 |采纳率87.5%是的
如:
H2(g)+1/2 O2(g)=H2O(l) △H=-285.8kJ/mol
2H2(g)+ O2(g)=2H2O(l) △H=-571.6kJ/mol1年前查看全部
- 请问大家在热化学反应中,Hcl气体是稳定化合物吗?我觉得应该Hcl液体才是吧?
 sheoy1年前2
sheoy1年前2 -
 ifreebird 共回答了19个问题
ifreebird 共回答了19个问题 |采纳率89.5%比较一下卤族元素的氢化物,就可以判断Hcl气体是不是稳定化合物了···1年前查看全部
- 在热化学反应中△H比加大小时,若△H为负,那么比较大小是按照放出的热量多少比较还是按照代数值比较?
 onemorenight1年前3
onemorenight1年前3 -
 JACKY2123 共回答了20个问题
JACKY2123 共回答了20个问题 |采纳率85%若都为负值,则比较绝对值,绝对值大的放热多.一正一负则是负值反应放热大.1年前查看全部
- 热化学反应中说化学键断裂要吸收能量,生物学上说是放出能量,怎么回事?
 520徐1年前5
520徐1年前5 -
 不忍看到你流泪 共回答了17个问题
不忍看到你流泪 共回答了17个问题 |采纳率88.2%生物上说的不属于化学键范畴(共价键,离子键,金属键)
比如高能磷酸键,能量就储存在键中.1年前查看全部
- 已知3.6g碳在6.4g氧气中燃烧至反应物耗尽,测得放出热量aKJ,又知道12g碳完全燃烧,放出热量为bKJ.热化学方程
已知3.6g碳在6.4g氧气中燃烧至反应物耗尽,测得放出热量aKJ,又知道12g碳完全燃烧,放出热量为bKJ.热化学方程式 C(s)+1/2O2(g)===CO(g) △H=?
 qqqq_xiaohua1年前1
qqqq_xiaohua1年前1 -
 qq小子儿 共回答了14个问题
qq小子儿 共回答了14个问题 |采纳率92.9%已知3.6g碳在6.4g氧气中燃烧至反应物耗尽,测得放出的热量为aKJ.又知12.0g碳完全燃烧放出的热量为bKJ,则热化学方程式C(s)+1/2O2(g)=CO(g)△H=ω中ω等于( )
(请注明详细过程)
答:C + 0.5O2 = CO (1) ΔrHm1
C + O2 = CO2 (2)ΔrHm2
3.6克碳在在6.4克氧气中燃烧,至反应物耗尽,产物是CO和CO2的混合物,
n(C)=3.6/12=0.3(mol)
n(O2)=6.4/32=0.2(mol),
即碳和氧气以3:2的比例反应,写出反应式:
3C + 2O2 = 2CO + CO2 (3)ΔrHm3
反应式(3)=(1)×2+(2) .
根据盖斯定律,ΔrHm3=2 ΔrHm1+ΔrHm2
由题中已知条件,“12.0g碳完全燃烧,放出热量为bKJ”,12.0g碳刚好是1mol,与反应式(2)书写的计量系数相对应,所以完全燃烧的反应热ΔrHm2=b(kJ).
由“3.6克碳在在6.4克氧气中燃烧,至反应物耗尽,测得放出热量为aKJ”,碳的量为0.3mol,而反应式(3)书写的计量系数是3,
所以ΔrHm3=10a=10a(kJ).
如此可求C + 0.5O2 = CO的反应热ΔrHm1=0.5(10a-b)kJ.1年前查看全部
- 盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学
盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:______. 张纪中先生1年前1
张纪中先生1年前1 -
 米饭女孩 共回答了12个问题
米饭女孩 共回答了12个问题 |采纳率91.7%解题思路:根据盖斯定律将三个化学方程式进行处理.Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol ①
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol②
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ/mol ③
①×3-②-③×2得
6CO(g)+6FeO(s)=6Fe(s)+6CO2(g)△H=(-24.8kJ/mol)×3-(-47.2kJ/mol)-(+640.5kJ/mol)×2=-1308.0kJ/mol,
即 CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol
故答案为:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol.点评:
本题考点: 用盖斯定律进行有关反应热的计算.
考点点评: 本题考查反应热的计算,题目难度不大,注意盖斯定律的应用.1年前查看全部
大家在问
- 1摆动数列 和常数列怎么证明?得出什么关系式就能说明一个数列是摆动数列或常数列?
- 2柳树生长过程柳树和杨树一般什么时候发芽?什么时候长出绿绿的树叶?这两种树有什么不同?
- 3Are quarter OK with you ?什么意思
- 4The hen can swim.变一般疑问句并做否定回答.
- 5图中为第五套人民币上所显示的地理旅游景点,两处景点所在地理区域分别是( )
- 6翻译"the moon is heavy"
- 7两句汉译英不会,直到你告诉我后我才直到他所遭遇的一切对于一周内会有三个星期日的说法,我永远不会信服
- 8请英语达人写一段小短文100单词左右
- 92√27+3√48
- 101+2+3+4+5+6+7+8+9+10+11+12+13+14+15+161+17+18
- 11硫酸镁加氨水 硫酸镁加氨水 石灰乳和碳酸钠
- 12q1,q2,q3按从左到右的顺序分别表示在一条直线上的三个点电荷,已知q1与q2之间的距离为L1,q2和q3之间的距离为
- 13下列说法错误的是( ) A.电磁波的传播过程也是能量传播过程 B.电磁波是一种信息
- 14假如我有一对翅膀 作文
- 15已知三角形三边之比为3:5:7,则该三角形的最大内角为?
