下表是某工业盐的产品质量指标.为了测定该工业盐中氯化钠的质量分数,取100克该工业
 cqwcqw2022-10-04 11:39:541条回答
cqwcqw2022-10-04 11:39:541条回答①测得水的质量分数是3.36%
②用碳酸钠来测定杂质氯化钡的质量时,得到0.985克沉淀.(反应的化学方程式为:
BaCl2+ Na2CO3==== BaCO3(沉淀符号)+ 2NaCL)
求(1)100克该工业盐中含氯化钡的质量.
(2)通过计算,判断此工业盐中氯化钠的质量分数是否符合产品质量标准?
表格:工业盐
氯化钠(%)≥95.5
水分(%)≤3.46
氯化钡(%)≤1.04

已提交,审核后显示!提交回复
共1条回复
 歇斯底里的优雅 共回答了13个问题
歇斯底里的优雅 共回答了13个问题 |采纳率100%- 1)BaCl2+ Na2CO3== BaCO3(沉淀)+ 2NaCL
其中BaCl2分子量为137+35.5*2=208 BaCO3分子量为 137+12+16*3=197
208 /m=197/0.985
则m=1.04g
氯化钡的质量m=1.04g
2)由题得水的质量分数符合表格中的要求,1)问所求出的氯化钡的质量分数为1.04%,也符合要求,所以,次工业盐中氯化钠的质量分数为95.6%,也符合产品质量标准.
望采纳! - 1年前
相关推荐
- 如图,是某工业盐产品质量指标.为了测定该工业盐中氯化钠的质量分数,取100g该工业盐进行实验:①测得水的质量分数为3.3
如图,是某工业盐产品质量指标.为了测定该工业盐中氯化钠的质量分数,取100g该工业盐进行实验:①测得水的质量分数为3.36%;②用碳酸钠来测定杂质氯化钡的质量时,得到0.985g沉淀.(碳酸钠与氯化钡反应的化学方程式:
BaCl 2 +Na 2 CO 3 =BaCO 3 ↓+2NaCl)
求:(1)100g该工业盐中含氯化钡的质量.(工业用盐)
氯化钠(%)≥95.5
水分(%)≤3.46
氯化钡(%)≤1.04
(2)通过计算,判断此工业盐中氯化钠的质量分数是否符合产品质量指标? luizchen1年前1
luizchen1年前1 -
 松本小润 共回答了18个问题
松本小润 共回答了18个问题 |采纳率94.4%(1)设100g该工业用盐中含BaCl 2 的质量为X,
BaCl 2 +Na 2 CO 3 =BaCO 3 ↓+2NaCl
208---------197
X----------0.985g
208:X=197:0.985g,
解之得;X=1.04g;
(2)100g该工业盐中含H 2 O的质量为:100g×3.36%=3.36g;
100g该工业盐中含NaCl的质量为:100g-3.36g-1.04g=95.6g;
该工业盐中含NaCl的质量分数为:
95.6g
100g ×100%=95.6%;
因为95.6%>95.5%,所以该工业盐中氯化钠的质量分数符合产品质量指标.
答:(1)100g该工业盐中含氯化钡的质量为1.04g;
(2)此工业盐中氯化钠的质量分数符合产品质量指标.1年前查看全部
- 右图是某工业盐产品质量指标,(工业盐)氯化钠(%)≥95.5水分(%)≤3.4氯化钙(%)≤1.125.右图是某工业盐产
右图是某工业盐产品质量指标,
(工业盐)
氯化钠(%)≥95.5
水分(%)≤3.4
氯化钙(%)≤1.1
25.右图是某工业盐产品质量指标.为了测定该工业盐中氯化钠的质量分数,取100 g该工业盐进行实验:
①用碳酸钠来测定杂质氯化钙的质量分数,得到 1g 沉淀.
②测得水的质量分数为3.3%;
求:(1)100 g该工业盐中含氯化钙的质量.
(2)通过计算,判断此工业盐中氯化钠的质量分数是否符合产品质量指标? 5267875141年前1
5267875141年前1 -
 泡泡水蜜桃 共回答了18个问题
泡泡水蜜桃 共回答了18个问题 |采纳率83.3%设生成氯化钙的质量是X.
CaCl2+Na2CO3=CaCO3↓ +2NaCl
111 100
X 1g
1.11g
100克样品中的氯化钠的质量:100-100*3.3%-1.11=95.59克
它的质量分数是95.59% 所以它是合格产品.1年前查看全部
- 操场跑道用的化雪的东西是?工业盐的主要成分是什么?
 baby520wm1年前1
baby520wm1年前1 -
 蒲草如丝 共回答了22个问题
蒲草如丝 共回答了22个问题 |采纳率95.5%可以用工业盐、高压水枪.1年前查看全部
- 化学与我们的身体健康息息相关,下列做法,不会危害人体健康的是 A.用工业盐亚硝酸钠腌渍鱼肉 B.焙制面包时加入适量碳酸氢
化学与我们的身体健康息息相关,下列做法,不会危害人体健康的是
A.用工业盐亚硝酸钠腌渍鱼肉 B.焙制面包时加入适量碳酸氢钠 C.生产豆芽时加入高效增白剂 D.用甲醛溶液浸泡海鱼  一群大雁往南飞1年前1
一群大雁往南飞1年前1 -
 idtac 共回答了18个问题
idtac 共回答了18个问题 |采纳率88.9%B
1年前查看全部
- 110-甲基乙烯基-硅橡胶生产时,挥发粉过高会造成什么结果?原材料是BMC的,工业盐:四甲基硅氧烷.
110-甲基乙烯基-硅橡胶生产时,挥发粉过高会造成什么结果?原材料是BMC的,工业盐:四甲基硅氧烷.
本人不懂,请各位高手帮帮忙.最好能说下改良方法.谢谢!
 黑糊糊931年前1
黑糊糊931年前1 -
 CJY卡布基诺 共回答了19个问题
CJY卡布基诺 共回答了19个问题 |采纳率89.5%粘度下降,强度降低.1年前查看全部
- 下图是某工业盐产品质量指标。为了测定该工业盐中氯化钠的质量分数,取100g该工业盐进行实验:
下图是某工业盐产品质量指标。为了测定该工业盐中氯化钠的质量分数,取100g该工业盐进行实验:
①用碳酸钠来测定杂质氯化钙的质量分数,得到0.9g沉淀。
②测得水的质量分数为3.3%。求:
(1)100g该工业盐中含氯化钙的质量分数。
(2)通过计算,判断此工业盐中氯化钠的质量分数是否符合产品质量指标? a831864441年前1
a831864441年前1 -
 ppgg瓶子 共回答了15个问题
ppgg瓶子 共回答了15个问题 |采纳率80%(1)0.999%
(2)含氧化钠95.701%>95.5%,符合指标1年前查看全部
- 如图,是某工业盐产品质量指标.为了测定该工业盐中氯化钠的质量分数,取100g该工业盐进行实验:①测得水的质量分数为3.3
如图,是某工业盐产品质量指标.为了测定该工业盐中氯化钠的质量分数,取100g该工业盐进行实验:①测得水的质量分数为3.36%;②用碳酸钠来测定杂质氯化钡的质量时,得到0.985g沉淀.(碳酸钠与氯化钡反应的化学方程式:BaCl 2 +Na 2 CO 3 ==BaCO 3 ↓+2NaCl) 
求:
(1)100g该工业盐中含氯化钡的质量.
(2)通过计算,判断此工业盐中氯化钠的质量分数是否符合产品质量指标? q4gq1yq1年前1
q4gq1yq1年前1 -
 liuhongmeu 共回答了21个问题
liuhongmeu 共回答了21个问题 |采纳率81%答:(1)100g该工业盐中含氯化钡的质量为1.04g;
(2)此工业盐中氯化钠的质量分数符合产品质量指标.1年前查看全部
- 下列关于生活常识的说法中,正确的是( )A.用含NaNO2的工业盐腌渍食品B.用洗涤剂清洗掉餐具上的油
下列关于生活常识的说法中,正确的是( )A.用含NaNO2的工业盐腌渍食品B.用洗涤剂清洗掉餐具上的油
下列关于生活常识的说法中,正确的是( )
A.用含NaNO2的工业盐腌渍食品
B.用洗涤剂清洗掉餐具上的油污
C.用甲醛水溶液浸泡水产品
D.用纯碱溶液出去水壶上的水垢
 wkq5205181年前1
wkq5205181年前1 -
 teasingwildchild 共回答了19个问题
teasingwildchild 共回答了19个问题 |采纳率78.9%A、亚硝酸钠虽然外观极像食盐,但它有致癌作用,对人体有害,故错误;
B、用洗涤剂清洗掉餐具上的油污是利用乳化作用,正确;
C、甲醛有毒,能破坏蛋白质的结构,不但降低了食品的质量,而且对人体有害,故错误;
D、水壶上的水垢应该用醋酸去掉,错误;
故选B1年前查看全部
- (2014•重庆模拟)亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧
(2014•重庆模拟)亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如图所示(部分夹持装置略).(在木炭和浓硝酸反应之前已排尽装置中的空气)
已知:室温下,①2NO+Na2O2═2NaNO2 ②3NaNO2+3HCl═3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+
(1)写出浓硝酸与木炭反应的化学方程式C+4HNO3(浓)
CO2↑+4NO2↑+2H2O△ .C+4HNO3(浓).
CO2↑+4NO2↑+2H2O△ .
(2)B中观察到的主要现象是______,D装置的作用是______.
(3)检验C中产物有亚硝酸钠的方法是______.
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和______.为避免产生这些副产物,应在B、C装置间增加装置E、F,则B中导管与E、F装置中导管接口的连接顺序是______. 1236893541年前1
1236893541年前1 -
 Ricko_zheng 共回答了9个问题
Ricko_zheng 共回答了9个问题 |采纳率88.9%解题思路:(1)装置A中是浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水,依据氧化还原反应电子守恒和原子守恒配平;
(2)装置B中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,硝酸和铜反应生成硝酸铜,一氧化氮和水;通过装置C中的过氧化钠吸收一氧化氮、二氧化碳,最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气;
(3)依据亚硝酸钠具有氧化性或还原性,选择还原剂或氧化剂发生的反应现象证明产物中是否是亚硝酸钠;
(4)因为一氧化氮中混有二氧化碳和水蒸汽,二氧化碳和过氧化钠发生的反应生成碳酸钠和氧气,水与过氧化钠反应生成氢氧化钠;为避免产生这些副产物,应在B、C装置间增加装置E、F,依次除去二氧化碳和水蒸气.(1)装置A中是浓硝酸和碳加热发反应,反应生成二氧化氮和二氧化碳和水,反应的化学方程式为C+4HNO3(浓)
△
.
CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓)
△
.
CO2↑+4NO2↑+2H2O;
(2)装置B中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,3NO2+H2O=2HNO3+NO,硝酸和铜反应生成硝酸铜,一氧化氮和水,所以反应现象为溶液变蓝,铜片溶解,导管口有无色气体冒出;通过装置C中的过氧化钠吸收一氧化氮、二氧化碳,最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气,
故答案为:铜片溶解,溶液变蓝,导管口有无色气体冒出;除去未反应的NO,防止污染空气;
(3)检验亚硝酸钠的实验设计为:取少量生成物置于试管中,加入稀盐酸,若产生无色气体并在液面上方变为红棕色,则产物是亚硝酸钠.
故答案为:取样,加入稀盐酸,若产生无色气体并在液面上方变为红棕色,则产物是亚硝酸钠;
(4)因为一氧化氮中混有二氧化碳和水蒸汽,二氧化碳和过氧化钠发生的反应生成碳酸钠和氧气,水与过氧化钠反应生成氢氧化钠,故C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物,应在B、C装置间增加装置E、F,依次除去二氧化碳和水蒸气,则B中导管与E、F装置中导管接口的连接顺序是dcba.故答案为:氢氧化钠;dcba.点评:
本题考点: 制备实验方案的设计.
考点点评: 本题考查了物质制备实验方案的设计和信息判断,物质性质的理解应用,注意实验过程中的反应现象分析,掌握基础是关键,题目难度中等.1年前查看全部
- 下图是某工业盐产品质量指标。为了测定工业盐中氯化钠的质量分数,取100g该工业盐进行实验:①测得水的质量分数为3.36%
下图是某工业盐产品质量指标。为了测定工业盐中氯化钠的质量分数,取100g该工业盐进行实验:①测得水的质量分数为3.36%;②用碳酸钠来测定杂质氯化钡的质量时,得到0.985g沉淀。 
求:
(1)100g该工业盐中含氯化钡的质量。
(2)通过计算,判断此工业盐中氯化钠的质量分数是否符合产品质量指标。 龙之升华1年前1
龙之升华1年前1 -
 人uu燕双飞 共回答了15个问题
人uu燕双飞 共回答了15个问题 |采纳率73.3%(1)1.04g
(2)W(NaCl)=95.6% 符合1年前查看全部
- (2013•天桥区二模)碳酸亚铁(FeCO3)是一种重要的工业盐,也是炼铁所用菱铁矿的主要成分,外观为白色固体,难溶于水
(2013•天桥区二模)碳酸亚铁(FeCO3)是一种重要的工业盐,也是炼铁所用菱铁矿的主要成分,外观为白色固体,难溶于水,遇水和氧气会发生反应,化学方程式为4FeCO3+6H2O+O2=4Fe(OH)3+4CO2.
(1)小亮同学提出三种生成碳酸亚铁的情况,其中正确的是(填序号)______
A.+3价铁的盐溶液与可溶性碳酸盐发生复分解反应;B.+2价铁的盐溶液与可溶性碳酸盐作用;C.铁与氧气、水发生复杂的氧化反应
(2)小亮同学取一定量碳酸亚铁固体于烧杯中,加入足量水,将烧杯放置在天平左盘上,向右盘放入砝码至天平平衡.放置较长时间后(不考虑水分蒸发),观察到天平的指针会______(填“偏左”、“偏右”、“不发生偏转”之一);另外,放置过程中还可观察到的一项实验现象为______.
(3)待上述烧杯中物质的质量不发生变化时,向烧杯中加入溶质质量分数为10%的稀盐酸109.5g,恰好完全反应,求反应后所得不饱和溶液中溶质的质量.(计算结果精确到0.01g) tyliuxing1年前1
tyliuxing1年前1 -
 牛儿神话 共回答了15个问题
牛儿神话 共回答了15个问题 |采纳率93.3%解题思路:(1)根据复分解反应前后各元素化合价不变分析;(2)根据碳酸盐铁、水和氧气反应能生成氢氧化铁和二氧化碳分析质量变化,根据生成物叙述实验现象;(3)根据盐酸中氯化氢的质量计算出生成氯化铁的质量.(1)复分解反应前后元素化合价不变,所以+3价铁的盐溶液与可溶性碳酸盐发生复分解反应生成碳酸铁,不是碳酸亚铁,故A错,+2价铁的盐溶液与可溶性碳酸盐作用能生成碳酸亚铁,故B正确;铁与氧气、水发生复杂的氧化反应,是铁生锈生成主要成分是氧化铁的物质,不属于碳酸亚铁,故C错;
(2)烧杯内质量增加了参加反应氧气的质量,反应后减少的质量是生成了二氧化碳,由方程式可知参加反应的氧气的质量小于生成的二氧化碳的质量,所以放置较长时间后,烧杯内质量减少,所以偏向右端;生成的氢氧化铁是红褐色固体,所以现象是白色固体变成红褐色固体;
(3)HCl的质量=109.5g×10%=10.95g
设所得溶液中溶质FeCl3的质量为x
Fe(OH)3+3HCl=FeCl3+3H2O
109.5 162.5
10.95g x
根据:[109.5/162.5=
10.95g
x]解得x=16.25g.
故答案为:(1)B;(2)偏右;白色固体变成红褐色固体(或产生气泡);(3)16.25g.点评:
本题考点: 物质的相互转化和制备;根据化学反应方程式的计算.
考点点评: 本题属于信息探究题,解题的关键是根据题目所给的信息,提取出有用信息,分析出反应进行的情况,从而进行有关的分析与计算.1年前查看全部
- 亚硝酸钠是一种工业盐,它有毒、有咸味,外形与食盐相似.用什么试剂鉴别亚硝酸钠和食盐?怎么操作?
亚硝酸钠是一种工业盐,它有毒、有咸味,外形与食盐相似.用什么试剂鉴别亚硝酸钠和食盐?怎么操作?
RT 秋灵木子1年前1
秋灵木子1年前1 -
 yjj44 共回答了19个问题
yjj44 共回答了19个问题 |采纳率94.7%区别亚硝酸钠和食盐,可以把样品放入碘化钾的硫酸溶液中,再加淀粉.如果显蓝色就证明该样品是亚硝酸钠.1年前查看全部
- 如何测定工业盐中的Nacl、Kcl的含量
如何测定工业盐中的Nacl、Kcl的含量
标准的 能不能速度点 比较急
 爬到闫家了1年前1
爬到闫家了1年前1 -
 nicollhoho 共回答了22个问题
nicollhoho 共回答了22个问题 |采纳率95.5%K元素可以用 四硼酸钠法测定.换算成KCl就行.
Na不知道 .NaK都可以用原子荧光仪试试.多的我也不知道了.1年前查看全部
- 下图是某工业盐产品质量指标。为了测定该工业(工业盐) 盐中氯化钠的质量分数,取100g该工业盐进行实验: ①用碳酸钠来测
下图是某工业盐产品质量指标。为了测定该工业(工业盐) 盐中氯化钠的质量分数,取100g该工业盐进行实验: ①用碳酸钠来测定杂质氯化钙的质量分数,得到1g沉淀。 ②实际测得水的质量分数为3.3%: 
求:(1)100g该工业盐中含氯化钙的质量分数。
(2)通过计算,判断此工业盐中氯化钠的质量分数是否符合产品质量指标? 大汉天子1111年前1
大汉天子1111年前1 -
 林岚 共回答了22个问题
林岚 共回答了22个问题 |采纳率81.8%(1)1.11% (2)95.59%> 95.5% ,合格1年前查看全部
- 据2009.3.15《今日视线》报道:近日,汕头市盐务局对多家餐饮店进行检查,发现不少商户购买私盐和工业盐进行烹饪.工业
据2009.3.15《今日视线》报道:近日,汕头市盐务局对多家餐饮店进行检查,发现不少商户购买私盐和工业盐进行烹饪.工业盐的主要成分是亚硝酸钠(NaNO 2 ),吃了工业盐后会引起中毒.亚硝酸钠(NaNO 2 )中氮元素的化合价为( ) A.+5 B.+3 C.+1 D.0  拍拍新人1年前1
拍拍新人1年前1 -
 626326 共回答了18个问题
626326 共回答了18个问题 |采纳率88.9%根据在化合物中正负化合价代数和为零,可得亚硝酸钠(NaNO 2 )中氮元素的化合价为:(+1)+x+(-2)×2=0,解答x=+3;
故选B.1年前查看全部
- (2012•太原三模)亚硝酸钠是一种工业盐,在生产、生活中应用广泛.现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸
(2012•太原三模)亚硝酸钠是一种工业盐,在生产、生活中应用广泛.现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸的反应及生成气体产物的成分.
已知:
①NO+NO2+2OH-═2NO
+H2O−2
②气体液化的温度:NO2:21℃、NO:-152℃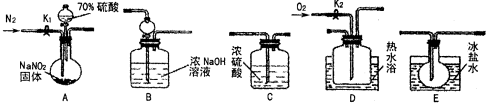
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(按左→右连接):A→C→______→→______→______.
(2)关闭弹簧夹K1,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体.
①确认A中产生的气体含有NO.依据的现象是______.
②装置E的作用是______.
(3)如果向D中通入过量O2,则装置B中发生反应的化学方程式为______.如果没有装置C,对实验结论造成的影响是______.
(4)通过上述实验探究过程,可得出装置A中反应的化学方程式是______.
(5)工业生产中氮氧化物的排放会造成环境污染,可采用如下方法处理氮氧化物:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
则CH4直接将NO2还原为N2的热化学方程式为______. twister11年前1
twister11年前1 -
 sfqrno1 共回答了16个问题
sfqrno1 共回答了16个问题 |采纳率100%解题思路:(1)根据各部分装置的作用进行连接;
(2)根据一氧化氮和氧气反应生成红棕色二氧化氮气体判断,温度低于二氧化氮液化温度时,二氧化氮变成液态;
(3)氧气过量,进入B中可理解为先生成硝酸,硝酸再与氢氧化钠反应生成硝酸钠和水;
(4)根据反应物和生成物写出反应方程式;
(5)根据盖斯定律进行计算.(1)C吸收水蒸气,B尾气处理,防止污染空气,D检验NO,E冷却二氧化氮,利用D检验NO,所以装置的连接为A→C→E→D→B,故答案为:E;D;B;
(2)①D中无色气体变成红色,说明含有NO气体,故答案为:D中出现红棕色气体;
②二氧化氮的液化温度是21℃,低于此温度时,二氧化氮气体变成液态,故答案为:冷凝使NO2完全液化;
(3)如果向D中通入过量O2,则装置B中二氧化氮、氧气和氢氧化钠反应生成硝酸钠和水,其反应方程式为:4NO2+O2+4NaOH=4NaNO3+2H2O,如果没有装置C,二氧化氮和水反应生成一氧化氮,造成干扰,
故答案为:4NO2+O2+4NaOH=4NaNO3+2H2O;水蒸气存在,会与NO2反应产生NO,影响NO的检验;
(4)通过以上分析知,该反应中生成二氧化氮、一氧化氮,同时还有硫酸钠、水生成,所以反应方程式为2NaNO2+H2SO4=Na2SO4+NO2↑+NO↑+H2O,
故答案为:2NaNO2+H2SO4=Na2SO4+NO2↑+NO↑+H2O;
(5)CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1 ①
CH4(g)+4NO(g)═2 N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1 ②
将方程式[①+②/2]得CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-[−574kJ/mol−1160kJ/mol/2]=-867kJ•mol-1 ,
故答案为:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1 .点评:
本题考点: 氮的氧化物的性质及其对环境的影响;用盖斯定律进行有关反应热的计算;探究物质的组成或测量物质的含量.
考点点评: 本题考查了实验方案设计、物质的检验、盖斯定律,明确物质的性质是解本题关键,根据实验现象确定物质的性质,注意仪器的连接顺序,为易错点.1年前查看全部
- 如图,是某工业盐产品质量指标.为了测定该工业盐中氯化钠的质量分数,取100g该工业盐进行实验:①测得水的质量分数为3.3
如图,是某工业盐产品质量指标.为了测定该工业盐中氯化钠的质量分数,取100g该工业盐进行实验:①测得水的质量分数为3.36%;②用碳酸钠来测定杂质氯化钡的质量时,得到0.985g沉淀.(碳酸钠与氯化钡反应的化学方程式:
BaCl2+Na2CO3=BaCO3↓+2NaCl)
求:(1)100g该工业盐中含氯化钡的质量.(工业用盐)
氯化钠(%)≥95.5
水分(%)≤3.46
氯化钡(%)≤1.04
(2)通过计算,判断此工业盐中氯化钠的质量分数是否符合产品质量指标? panmin4106241年前1
panmin4106241年前1 -
 zhanglitai 共回答了14个问题
zhanglitai 共回答了14个问题 |采纳率85.7%解题思路:(1)根据碳酸钠与氯化钡反应的化学方程式和生成沉淀的质量,列出比例式,就可计算出100g该工业盐中含氯化钡的质量;
(2)由标签可知,某工业盐产品主要含有氯化钠、水和氯化钡.根据已知水的质量分数计算出100g该工业盐中含H2O的质量,然后根据“100g-含H2O的质量-含BaCl2的质量=含NaCl的质量”计算出含NaCl的质量,然后根据质量分数公式计算即可.(1)设100g该工业用盐中含BaCl2的质量为X,
BaCl2+Na2CO3=BaCO3↓+2NaCl
208---------197
X----------0.985g
208:X=197:0.985g,
解之得;X=1.04g;
(2)100g该工业盐中含H2O的质量为:100g×3.36%=3.36g;
100g该工业盐中含NaCl的质量为:100g-3.36g-1.04g=95.6g;
该工业盐中含NaCl的质量分数为:[95.6g/100g]×100%=95.6%;
因为95.6%>95.5%,所以该工业盐中氯化钠的质量分数符合产品质量指标.
答:(1)100g该工业盐中含氯化钡的质量为1.04g;
(2)此工业盐中氯化钠的质量分数符合产品质量指标.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题主要考查学生运用化学方程式进行计算的能力.1年前查看全部
- 请问下电解水+工业盐能成84消毒液?
请问下电解水+工业盐能成84消毒液?
我看见别人说电解水加工业盐能成84?如果可以那还需要添加什么?和百斤比列是多少! 弥勒儿1年前1
弥勒儿1年前1 -
 白云深处之风 共回答了8个问题
白云深处之风 共回答了8个问题 |采纳率100%不能、84消毒剂主要成分是次氯酸钠
2NAOH+CL2=NACLO+NACL+H2O1年前查看全部
- (2005•眉山)如图是某工业盐产品质量指标.为了测定该工业盐中氯化钠的质量分数,取100g该工业盐进行实验:
 (2005•眉山)如图是某工业盐产品质量指标.为了测定该工业盐中氯化钠的质量分数,取100g该工业盐进行实验:
(2005•眉山)如图是某工业盐产品质量指标.为了测定该工业盐中氯化钠的质量分数,取100g该工业盐进行实验:
①用碳酸钠来测定杂质氯化钙的质量分数,得到1g沉淀.
②实际测得水的质量分数为3.3%:
求:(1)100g该工业盐中含氯化钙的质量分数.
(2)通过计算,判断此工业盐中氯化钠的质量分数是否符合产品质量指标? lovev21年前1
lovev21年前1 -
 lushiyu1997 共回答了15个问题
lushiyu1997 共回答了15个问题 |采纳率93.3%解题思路:(1)由沉淀质量根据碳酸钠与氯化钙反应的化学方程式可以计算出氯化钙的质量,进而计算出该工业盐中氯化钙的质量分数.
(2)将该工业盐的质量分数看作“1”,去掉氯化钙和所含水的质量分数就是该工业盐中氯化钠的质量分数,然后再与标签上氯化钠的质量分数比较,即可得出本题的答案.(1)设与碳酸钠反应的氯化钙的质量为x.
Na2CO3+CaCl2=CaCO3↓+2NaCl
111 100
x 1g
[111/100]=[x/1g],x=1.11g
该工业盐中氯化钙的质量分数为
[1.11g/100g]×100%=1.11%
(2)该工业盐中氯化钠的质量分数为
1-1.11%-3.3%=95.59%>95.5%
因此该工业盐中氯化钠的质量分数符合产品质量指标.
答:(1)1.11%;
(2)合格.点评:
本题考点: 根据化学反应方程式的计算;标签上标示的物质成分及其含量.
考点点评: 本题主要考查有关化学方程式的计算,难度稍大.1年前查看全部
- 为什么要加亚硝酸盐而不是盐很多卤味或者鸭脖之类的等腌制类食用物都要加一定量的亚硝酸盐(工业盐 ) 那为什么 不单独加盐呢
为什么要加亚硝酸盐而不是盐
很多卤味或者鸭脖之类的等腌制类食用物都要加一定量的亚硝酸盐(工业盐 ) 那为什么 不单独加盐呢?再加盐的同时还要加亚硝酸盐 这是为什么? 飘扬过yy海1年前1
飘扬过yy海1年前1 -
 cnxaini 共回答了22个问题
cnxaini 共回答了22个问题 |采纳率100%亚硝酸盐能防腐.
普通盐防腐要放的计量太大了,不叫卤味,叫腌菜了1年前查看全部
大家在问
- 1看一下该选哪个,也帮我分析下为什么
- 2相信自己我能 作文
- 3this hair clip matches your new hairstyle改为同义句
- 4横遭不幸的“横”怎么读?
- 5英语填空..she don't like p____.beause it's difficultwhere's Seou
- 6他发现学数学很难 用英语怎么说
- 7汽车加速和碰撞时产生的力量,需要一定物理知识,
- 8try to learn something about everything and everything about
- 97倍的x平方-根号6-5=0怎么解
- 10下列反应的离子方程式不正确的是( ) A.锌与硫酸铜溶液反应:Zn+Cu 2+ =Zn 2+ +Cu B.氢氧化钠与盐
- 11There is nothing in the fridge.同义句
- 12为什么log(x) x不能小于0?
- 13play well中well 是什么词性?
- 144m^2+12mn+9n^2分解因式
- 15That is a jacket。
