向Fe(NO3)2、Mg(NO3)2和Cu(NO3)2的混合溶液中加入一定量的锌粉,充分反应后过滤.下列关于得到的溶液或
 binwang33332022-10-04 11:39:541条回答
binwang33332022-10-04 11:39:541条回答A.若滤液中含有Fe2+,则滤渣中一定不含Fe
B.若滤渣中含Cu,则滤液中一定含Fe2+
C.若滤渣中含Zn,则滤液中含2种离子
D.若滤渣中不含Zn,则滤液中至少含3种离子

已提交,审核后显示!提交回复
共1条回复
 duan8952 共回答了17个问题
duan8952 共回答了17个问题 |采纳率94.1%- 解题思路:根据题意“加入一定量的锌粉”,根据金属活动性顺序镁>锌>铁>铜,锌粉不和硝酸镁反应,和硝酸铜、硝酸亚铁发生反应时首先与硝酸铜反应,待硝酸铜完全反应后继续和硝酸亚铁进行反应.
由题义可知:“加入一定量的锌粉”,根据金属活动性顺序镁>锌>铁>铜,锌粉不和硝酸镁反应,和硝酸铜、硝酸亚铁发生反应时首先与硝酸铜反应,待硝酸铜完全反应后继续和硝酸亚铁进行反应.由此可知:
A、如果锌的量不足,可以将溶液中的亚铁离子部分置换出,那么,滤液中含有Fe2+,滤渣中有含Fe,故A错误;
B、滤渣中一定含有Cu,由于锌粉的量不确定,所以,不能确定滤液中含Fe2+的情况,故B错误;
C、若滤渣中含Zn,则滤液中含镁离子,锌离子和硝酸根离子3种离子,故C错误;
D、若滤渣中不含Zn,则滤液中至少含镁离子,锌离子和硝酸根离子3种离子,故D正确.
故选D.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 本题主要考查了学生对金属的活动性顺序表,优先置换原理的应用.要求学生要熟练的掌握金属的活动性顺序表.并灵活的学会分情况讨论问题. - 1年前
相关推荐
- 一个初三置换反应的问题.Zn先和Fe(NO3)2反应还是先和Cu(NO3)2反应?为什么,是不是和金属活动性顺序有关?
 roab1年前1
roab1年前1 -
 我笑你们看不穿 共回答了24个问题
我笑你们看不穿 共回答了24个问题 |采纳率83.3%是的,你想法是正确的
对于置换反应是,离得较远的先反应
所以是锌先与硝酸铜反应,反应完毕后才会与硝酸亚铁反应
可以通过假设的方法来推断,假设锌与硝酸亚铁反应生成了铁,但是铁还会与硝酸铜反应,又生成了亚铁,相当于未反应
所以假设不成立
不懂问1年前查看全部
- 下列说法正确的是( )A.向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体,结论:HNO3分
下列说法正确的是( )
A.向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体,结论:HNO3分解成了NO2
B.实验室检验氨气的方法是将湿润的蓝色石蕊试纸靠近瓶口或管口,观察试纸是否呈红色
C.灼热的铂丝与NH3、O2混合气接触,铂丝继续保持红热,说明氨的氧化反应是放热反应
D.浓硝酸有强氧化性,常温下能与Fe发生剧烈反应 2008见分晓1年前1
2008见分晓1年前1 -
 加菲lqd 共回答了17个问题
加菲lqd 共回答了17个问题 |采纳率88.2%解题思路:A.硝酸根离子在酸性条件具有强氧化性;
B.应该用湿润的红色石蕊试纸检验NH3;
C.铂丝继续保持红热,可说明反应放热;
D.常温下Fe遇浓硝酸发生钝化.A.HNO3与Fe2+反应生成NO,NO与空气接触生成NO2,故A错误;
B.应该用湿润的红色石蕊试纸检验NH3,故B错误;
C.铂丝继续保持红热,可说明反应放热,故C正确;
D.常温下Fe遇浓硝酸发生钝化,在表面生成一层致密的氧化物膜而阻碍反应的继续进行,故D错误.
故选:C.点评:
本题考点: 氨的化学性质;硝酸的化学性质;氮的氧化物的性质及其对环境的影响.
考点点评: 本题考查较为综合,涉及硝酸、氨气的性质以及物质的检验等知识,综合考查学生的分析能力和基础知识的综合应用,为高考高频考点,难度不大,注意相关基础知识的积累.1年前查看全部
- (2010•天津模拟)向含有AgNO3、Fe(NO3)2的混合溶液中加入一定量的锌粉,使其充分反应后,过滤,向滤渣中滴加
(2010•天津模拟)向含有AgNO3、Fe(NO3)2的混合溶液中加入一定量的锌粉,使其充分反应后,过滤,向滤渣中滴加稀盐酸,有气泡产生,则下列结论正确的是( )
A.滤液中一定含Ag+、Zn2+、Fe2+
B.滤液中一定含Zn2+,可能含Ag+
C.滤液中一定含Fe2+,Zn2+,不含Ag+
D.滤液中一定含Zn2+,可能含Fe2+ 瞎起了个名1年前1
瞎起了个名1年前1 -
 韶华已逝 共回答了19个问题
韶华已逝 共回答了19个问题 |采纳率94.7%解题思路:根据金属活动性顺序锌>铁>银,向含有AgNO3、Fe(NO3)2的混合溶液中加入一定量的锌粉,锌粉会首先置换硝酸银中的银,待硝酸银完全反应后继续与硝酸亚铁发生反应;过滤,向滤渣中滴加稀盐酸,有气泡产生,说明滤渣金属是铁或锌与铁的混合物.根据题干信息,滤渣是铁或铁与锌的混合物.滤液中一定没有硝酸银.若只有铁时,滤液中含有硝酸锌,可能有硝酸亚铁;若滤渣为铁与锌的混合物,则滤液中只有硝酸锌.由此分析,D正确.
故选D.点评:
本题考点: 金属的化学性质.
考点点评: 金属放入盐的混合溶液中,首先把活动性最弱的金属置换出来,置换的先后顺序为由弱到强,最强的最后置换出来.1年前查看全部
- 向含有AgNO3、Fe(NO3)2的混合溶液中加入一定量的锌粉,使其充分反应后,过滤,向滤渣中滴加稀盐酸,有气泡产生,则
向含有AgNO3、Fe(NO3)2的混合溶液中加入一定量的锌粉,使其充分反应后,过滤,向滤渣中滴加稀盐酸,有气泡产生,则下列结论正确的是( )
A. 滤液中一定含Ag+、Zn2+、Fe2+
B. 滤液中一定含Zn2+,可能含Ag+
C. 滤液中一定含Fe2+,Zn2+,不含Ag+
D. 滤液中一定含Zn2+,可能含Fe2+ zz迷1年前6
zz迷1年前6 -
 ARKU 共回答了13个问题
ARKU 共回答了13个问题 |采纳率92.3%解题思路:根据金属活动性顺序锌>铁>银,向含有AgNO3、Fe(NO3)2的混合溶液中加入一定量的锌粉,锌粉会首先置换硝酸银中的银,待硝酸银完全反应后继续与硝酸亚铁发生反应;过滤,向滤渣中滴加稀盐酸,有气泡产生,说明滤渣金属是铁或锌与铁的混合物.根据题干信息,滤渣是铁或铁与锌的混合物.滤液中一定没有硝酸银.若只有铁时,滤液中含有硝酸锌,可能有硝酸亚铁;若滤渣为铁与锌的混合物,则滤液中只有硝酸锌.由此分析,D正确.
故选D.点评:
本题考点: 金属的化学性质.
考点点评: 金属放入盐的混合溶液中,首先把活动性最弱的金属置换出来,置换的先后顺序为由弱到强,最强的最后置换出来.1年前查看全部
- 下列说法不正确的是( )①将CO2通入BaCl2溶液中,始终无白色沉淀生成②将盐酸、KSCN溶液和Fe(NO3)2溶液
下列说法不正确的是( )
①将CO2通入BaCl2溶液中,始终无白色沉淀生成
②将盐酸、KSCN溶液和Fe(NO3)2溶液三种溶液混合,混合溶液显红色
③向某溶液中滴入盐酸酸化的BaCl2溶液产生白色沉淀,证明溶液中一定含有SO42-
④将两小块质量相等的金属钠,一块直接投入水中,另一块用铝箔包住,在铝箔上刺些小孔,然后投入水中,两者放出的氢气质量相等
⑤将SO2通入溴水中,证明SO2具有漂白性
⑥在滴有酚酞的Na2CO3溶液中,加入BaC12溶液后红色逐渐褪去,证明Na2CO3溶液中存在水解平衡
⑦因为SiO2能和CaCO3反应生成CO2,所以H2SiO3酸性强于H2CO3.
A.②④⑥⑦
B.①③④⑤
C.③④⑤⑦
D.②③④⑤⑦ 小坷1201年前1
小坷1201年前1 -
 初恋计划传说 共回答了24个问题
初恋计划传说 共回答了24个问题 |采纳率91.7%解题思路:①碳酸的酸性弱于盐酸;
②硝酸根在酸性环境下具有强的氧化性,能够氧化二价铁离子;
③检验硫酸根离子,应先加盐酸,排除其它离子的干扰;
④根据金属钠和水反应以及金属铝和氢氧化钠反应的化学方程式进行计算即可;
⑤二氧化硫通入溴水反应氧化还原反应,溴水被还原而退色;
⑥碳酸钠水解呈碱性,加入BaC12溶液,生成碳酸钡沉淀;
⑦硅酸钠溶液与二氧化碳反应生成硅酸和碳酸钠,依据常温下强酸制弱酸解答.①碳酸的酸性弱于盐酸,将CO2通入BaCl2溶液中,不反应,故①正确;
②硝酸根在酸性环境下具有强的氧化性,能够氧化二价铁离子生成三价铁离子,三价铁离子遇到KSCN溶液显红色,故②正确;
③应先加盐酸,排除其它离子的干扰,所以向某溶液中滴入盐酸酸化的BaCl2溶液产生白色沉淀,证明溶液中可能含有SO42-或Ag+,故③错误;
④金属钠和水反应的原理是:2Na+2H2O=2NaOH+H2,另一块用铝箔包住,在铝箔上刺些小孔,然后按入水中,先发生反应2Na+2H2O=2NaOH+H2,然后金属铝和氢氧化钠反应2Al+2NaOH+6H20=2Na[Al(OH)4]+3H2,等物质的量的金属钠,在两种情况下产生氢气的量不相等,故④错误;
⑤二氧化硫通入溴水反应氧化还原反应,溴水被还原而退色,体现二氧化硫的还原性,故⑤错误;
⑥碳酸钠水解呈碱性,加入BaC12溶液,生成碳酸钡沉淀,平衡向逆方向移动,如溶液褪色,可说明Na2CO3溶液中存在水解平衡,故⑥正确;
⑦向一定浓度的Na2SiO3溶液中通入适量CO2气体,反应生成硅酸沉淀,酸性为碳酸大于硅酸,为强酸制取弱酸的反应,故⑦错误;
所错误的有:③④⑤⑦;
故选:C.点评:
本题考点: 铁盐和亚铁盐的相互转变;盐类水解的应用;二氧化硫的化学性质;硅和二氧化硅;钠的化学性质;常见阴离子的检验.
考点点评: 本题考查了元素化合物知识,题目难度不大,熟悉物质的性质是解题关键,注意硫酸根、三价铁离子的检验,二氧化硫的性质是高考的热点.1年前查看全部
- 向200ML0.1mol/L的Fe(NO3)2溶液中加入适量NaOH溶液,使Fe2+完全转化成沉淀,过滤,洗涤,将所得的
向200ML0.1mol/L的Fe(NO3)2溶液中加入适量NaOH溶液,使Fe2+完全转化成沉淀,过滤,洗涤,将所得的沉淀灼烧质质量不再变化,其质量为多少
 新情61年前3
新情61年前3 -
 瓜子没仁 共回答了16个问题
瓜子没仁 共回答了16个问题 |采纳率81.3%解 Fe离子 有0.02MOL .故氢氧化铁有0.02MOL 4Fe(OH)2+O2+2H2O=4Fe(OH)3【条件为加热]
Fe(OH)3加热 生产Fe2O3 根据 铁守恒 Fe2O3 有0.01MOL
所得的沉淀灼烧质质量不再变化,其质量为 0.01*160=1.6g
祝 楼主新年快乐1年前查看全部
- 一种金属单质与两种酸反应在线等哪种金属先反应比如HCl 与 AgNO3,Fe(NO3)2混合物哪个先反应
 m1db1年前6
m1db1年前6 -
 -提拉米苏 共回答了15个问题
-提拉米苏 共回答了15个问题 |采纳率80%一种金属单质与两种酸反应,如果非氧化性酸没有先后顺序.
例如Mg与HCl和稀硫酸.同时反应,没有先后,主要和H+反应.
如果是氧化性酸,先与氧化性酸反应.
例如Mg与HCl和HNO3,先与HNO3反应.
HCl与AgNO3,Fe(NO3)2混合物.
它与Fe(NO3)2是发生氧化还原反应.
与AgNO3是复分解.同时进行.互不干涉.1年前查看全部
- Fe,FeO和Fe2O3 硝酸不是fe的还原性强 fe和硝酸先反应 怎么会产生光为fe(no3)2的溶液我的意思是fe和
Fe,FeO和Fe2O3 硝酸
不是fe的还原性强 fe和硝酸先反应 怎么会产生光为fe(no3)2的溶液
我的意思是fe和硝酸先反应
只有fe反应完了才和feo fe2o3反应 孤剑风流1年前1
孤剑风流1年前1 -
 zongzi_baby 共回答了14个问题
zongzi_baby 共回答了14个问题 |采纳率92.9%你的问题在http://zhidao.baidu.com/question/45218589.html里有人问过,反应先后的问题,但答案是说关于电极电势的.其实简单地说是可以说明白的.
Fe,FeO和Fe2O3 硝酸一起加入溶液中,铁的确是先反应,但是你想想铁是一开始就失去3个电子还是一个一个电子的失去呢,实际上是一个接着一个地失去电子,因为铁先失去一个电子,就是变成Fe+,Fe+的还原性比FeO中的Fe2+强,接着所以Fe+又失去一个电子,此时就变成了Fe2+,就与FeO中的Fe2+的还原性一样强,但Fe2+又比Fe2O3中的Fe3+还原性强,所以到最后可能就变成只剩下Fe3+ 了.可是这种情况出题者是不会考虑的,在中学中也不会考虑先后问题.
我曾经做过一道类似的题目大概是“向一定量Fe,FeO和Fe2O3的混合物中加入稀硝酸恰好使混合物完全溶解,看到有棕红色气体冒出,再向溶液中加入一定量的Fe,一段时间后Fe完全消失,往所得到的溶液中再加入KSCN溶液,无血红色出现”这可能就是你原题的改版篇,通过后来加入的铁来还原溶液里的3价铁离子.
“往所得到的溶液中再加入KSCN溶液,无血红色出现”这里已经说明溶液中没有3价的铁离子.
楼主问的问题的确会困扰很多人,其实要解答出来很简单,答案就在楼主所问的问题之中,“不是fe的还原性强”这句话就是答案,楼主之所以会困扰是因为先入为主的思想,你只假设了一种情况,而这种情况就是铁小量,首先已经跟硝酸反应完了,硝酸再跟剩下的两种化合物反应.
实际上这个问题又恰恰与楼主先入为主的思想所相反,问题中没有说铁的含量,所以楼主认为只有很少.然而题目没有说明铁的含量正是因为硝酸反应完了,而铁的含量过多,又因为铁有还原性,3价铁离子有氧化性,所以最后过量的铁又与3价铁离子反应,还原成2价的铁离子,最后刚好反应完毕,溶液中只有2价的铁.
当然在现实中不会出现这样完美的结果,但是这是高中的化学题,题目任由出题人发挥.1年前查看全部
- (2013•淮南一模)已知Fe(NO3)2受热分解产物为金属氧化物、NO2和O2,请完成表格内容并回答相关问题:
(2013•淮南一模)已知Fe(NO3)2受热分解产物为金属氧化物、NO2和O2,请完成表格内容并回答相关问题:
(1)对固体产物中Fe化合价的猜想
猜想一:只显+2价;猜想二:只显+3价;猜想三:______
(2)若猜想二成立,题干完成下表加以验证.供选试剂有:0.01mol/L酸性高锰酸钾溶液、0.1mol/LH2SO4溶液、3%H2O2溶液,0.1mol/LKSCN溶液、蒸馏水.(仪器自添)
经验证,猜想二正确,请写出Fe(NO3)2热分解的化学方程式实验操作 现象 目的或结论 步骤1:取适量上述热分解后的固体于试管中,加入0.1mol/L 溶解固体产物 步骤2: 溶液中含有Fe3+ 步骤3: 溶液中不含有Fe 2+ 4Fe(NO3)2
2Fe2O3+8NO2↑+O2↑△ .4Fe(NO3)2;
2Fe2O3+8NO2↑+O2↑△ .
(3)某同学将带火星的木条伸入该分解反应参数的气体中,木条复燃,由此他得出“NO2能支持燃烧的结论”.请你判断该结论是否正确?并说明理由. 遥远的时空1年前1
遥远的时空1年前1 -
 魍魉天使 共回答了24个问题
魍魉天使 共回答了24个问题 |采纳率91.7%解题思路:(1)根据Fe元素有+2价、+3价来分析;
(2)依据三价铁离子遇硫氰酸钾溶液呈红色证明含有铁离子;依据试剂选择高锰酸钾溶液能氧化亚铁离子而褪色证明是否含有亚铁离子;依据实验证明生成金属氧化物为氧化铁,根据生成产物配平写出化学方程式;
(3)依据分解产物物质的量之比结合空气中氧气所占体积分数分析是否能使带火星的木条复燃;(1)Fe元素有+2价、+3价,所以产物可能为Fe2(SO4)3、FeSO4或Fe2(SO4)3和FeSO4的混合物,故答案为:既有+2价又有+3价;
故答案为:既有+2价又有+3价;
(2)已知Fe(NO3)2受热分解产物为金属氧化物、NO2和O2,金属氧化物加入0.1mol/LH2SO4溶液高汤溶解生成铁盐溶液,滴入KSCN溶液,溶液呈血红色证明含有铁离子;向B试管中滴入酸性KMnO4溶液,溶液不褪色证明不含亚铁离子;实验验证含有三价铁,反应反应的化学方程式为:4Fe(NO3)2
△
.
2Fe2O3+8NO2↑+O2↑;
故答案为:
实验操作 现象 目的或结论
步骤2:向A试管中滴入KSCN溶液 溶液呈血红色
步骤3:向B试管中滴入酸性KMnO4溶液 酸性KMnO4溶液不褪色 4Fe(NO3)2
△
.
2Fe2O3+8NO2↑+O2↑
(3)结论正确.Fe(NO3)2分解后的气体产物中,NO2和O2的体积比为8:1,O2的体积分数小于空气中氧气的体积分数21%,若NO2不支持燃烧,则木条不会复燃.
故答案为:结论正确,Fe(NO3)2分解后的气体产物中,NO2和O2的体积比为8:1,O2的体积分数小于空气中氧气的体积分数21%,若NO2不支持燃烧,则木条不会复燃;点评:
本题考点: 性质实验方案的设计.
考点点评: 本题主要考查了物质的化学性质以,在解题时,可根据题中现象及对应的知识确定存在或不存在的物质是解题的关键.1年前查看全部
- (2013•东莞一模)某实验室的废水中含有大量AgNO3、Zn(NO3)2和Fe(NO3)2,课外小组同学欲从该废液中回
(2013•东莞一模)某实验室的废水中含有大量AgNO3、Zn(NO3)2和Fe(NO3)2,课外小组同学欲从该废液中回收银,并得到副产品硫酸亚铁晶体.实验方案如下:

(1)固体甲中含有的物质是(填化学式)______;溶液乙的化学式为______.
(2)写出步骤①的化学方程式:______.
(3)检验步骤①向废水中加入A是否过量的方法是______. 雷雨中的薄荷1年前1
雷雨中的薄荷1年前1 -
 mifomm 共回答了20个问题
mifomm 共回答了20个问题 |采纳率85%解题思路:排在氢前面的金属,才能置换出酸中的氢;排在金属活动性顺序中前面的金属一般能把排在后面的金属从其盐溶液里置换出来;
然后结合实验目的分析实验流程图,并根据对流程图的分析,判断流程中所需加入的物质及发生反应的方程式,设计实验检验反应物是否过量.(1)根据流程可知①中加入的为铁粉,铁能与溶液中的硝酸银反应,得到金属银及过量未完全反应的铁;硝酸银被过量的铁完全反应,锌排在铁的前面,因此溶液中含有不与铁反应的硝酸锌,以及反应后生成和原溶液中就含的硝酸亚铁;
故答案为:Fe、Ag;Zn(NO3)2、Fe(NO3)2;
(2)铁的活动性比银强,加入的铁粉与混合溶液中的硝酸银反应,生成硝酸亚铁和银;
故答案为:Fe+2AgNO3═2Ag+Fe(NO3)2;
(3)加入A过量时,所得固体甲中含有因加入过量而未完全反应的铁,因此可取固体加入稀硫酸或稀盐酸,观察是否有气泡放出,有气泡则固体甲中含铁,加入的铁过量;
故答案为:取少量固体甲于试管中,加入稀硫酸或稀盐酸,有气泡冒出,则加入的铁过量.点评:
本题考点: 金属活动性顺序及其应用;物质的相互转化和制备;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题结合实验主要考查了金属活动性顺序表的应用,能培养学生根据所学知识分析、解决问题的能力.1年前查看全部
- 某实验室的废水中含有大量AgNO3、Zn(NO3)2和Fe(NO3)2,课外小组同学欲从该废液中回收银,并得到副产品硫酸
某实验室的废水中含有大量AgNO3、Zn(NO3)2和Fe(NO3)2,课外小组同学欲从该废液中回收银,并得到副产品硫酸亚铁晶体.实验方案如下:
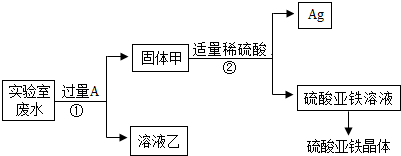
(1)操作①的名称是______,固体甲中含有的物质是(填化学式)______;溶液乙中所含溶质的化学式为______.
(2)写出步骤①的化学方程式:______.
(3)检验步骤①向废水中加入A过量的方法是______. redduke0011年前1
redduke0011年前1 -
 jfdbx 共回答了14个问题
jfdbx 共回答了14个问题 |采纳率92.9%解题思路:结合实验意图分析实验流程图,根据对流程的分析,判断流程中所需要加入的物质及所采取的实验操作,并设计实验检验反应物的过量.(1)把固体与液体分离开的操作为过滤操作;根据流程可得知①中加入的为铁粉,铁能与溶液中的硝酸银反应得到金属银及过量而未完全反应的铁;硝酸银被过量的铁完全反应,因此溶液中含有不与铁反应的硝酸锌和反应后生成及原溶液中就含的硝酸亚铁;
故答案为:过滤(1分),Fe、Ag(2分),Zn(NO3)2、Fe(NO3)2
(2)铁的活动性比银强,加入的铁粉与混合溶液中的硝酸银反应,生成硝酸亚铁和银;
故答案为:Fe+2AgNO3═2Ag+Fe(NO3)2
(3)加入A过量时,所得固体甲中含有因加入过量而未完全反应的铁,因此可取固体加入稀硫酸或稀盐酸,观察是否有气泡放出,有气泡则固体甲中含铁,加入的铁过量;
故答案为:取少量固体甲于试管中,加入稀硫酸,有气泡冒出,则加入的铁过量.点评:
本题考点: 金属活动性顺序及其应用;过滤的原理、方法及其应用;化学式的书写及意义;书写化学方程式、文字表达式、电离方程式.
考点点评: 过滤是分离不溶性固体与液体所形成的混合物的一种最常用的方法.1年前查看全部
- 实验室废水任意排放会造成环境污染.某校实验室中的废水中含有大量的AgNO3、Zn(NO3)2、Fe(NO3)2,该校实验
实验室废水任意排放会造成环境污染.某校实验室中的废水中含有大量的AgNO3、Zn(NO3)2、Fe(NO3)2,该校实验小组设计实验从该废水中回收银,并得到副产品硫酸亚铁晶体.实验方案如下所示(实验过程没
有引入第四种金属元素,废液中只含一种阴离子).回答问题:
(1)实验室常用______的方法分离固体甲和废液,该操作需要使用的仪器有______.
(2)固体甲中含有的物质是(填化学式)______.
(3)步骤①向废水中加入过量的A.检验A是否过量的方法是______.
(4)废液中溶质的化学式为______. T字线1年前1
T字线1年前1 -
 悦梦 共回答了19个问题
悦梦 共回答了19个问题 |采纳率89.5%解题思路:(1)将固体物质与液体物质分开的方法应是过滤,过滤时使用的仪器有烧杯、漏斗、玻璃棒、铁架台(带铁圈).
(2)若想从该废水中回收银,应利用金属活动性顺序,用活泼金属将Ag从AgNO3溶液中置换出来,且实验过程中未引入其它的金属元素,可知,加入的A物质应为Fe或Zn,若加入的是Fe,固体甲中应含有Fe和Ag,则不与FeSO4溶液,不合题意.因此,加入的A物质应为Zn,则固体甲中应含有被Zn置换出来的Fe和Ag,还有剩余的Zn.
(3)检验Zn是否过量的方法,可用继续加入Zn,看Zn粒表面是否有固体析出的方法.
(4)考虑锌与AgNO3、Fe(NO3)2反应的产物.根据转化关系可以看出,由于后期的铁和银都是丙和甲中,所以应该是加入了活泼金属将以上两金属置换为单质,所以加入的A为锌.由于锌是过量的,所以需要将之出去,所以可以加入过量的硫酸亚铁,这样不会引入新的杂质.这样剩余的硫酸亚铁和生成的硫酸锌进入了溶液丁,而固体丙为铁和银的混合物,所以适量硫酸就可以实现铁的转化,且得到纯净的银.
(1)分离固体甲和溶液乙的方法用过滤,过滤时使用的仪器有烧杯、漏斗、玻璃棒、铁架台(带铁圈).
(2)由题意知:加入的A物质应为Zn,则固体甲中应含有被Zn置换出来的Fe和Ag,还有剩余的Zn.
(3)若A不过量,则溶液中可能有未反应的AgNO3或Fe(NO3)2,再加入锌粒应继续反应,锌粒上有固体析出;若A已过量,则溶液中没有AgNO3或Fe(NO3)2,再加入锌粒不能继续反应,锌粒上没有固体析出.
(4)因为锌与AgNO3、Fe(NO3)2反应的产物都为Zn(NO3)2,故废液中溶质的化学式为Zn(NO3)2
故答案为:
(1)过滤;烧杯、漏斗、玻璃棒、铁架台(带铁圈);
(2)Ag、Fe、Zn
(3)取少量上层清液,加入少量锌粒,若锌粒上有固体析出,则A不过量;若锌粒上无固体析出,则A过量.
(4)Zn(NO3)2点评:
本题考点: 金属的化学性质;过滤的原理、方法及其应用.
考点点评: 本题考查了金属活动性顺序与置换反应和过滤的原理及过滤时使用的仪器等,要记住锌、铁、银的活动性,并学会从实验方案图中提炼有用的信息.1年前查看全部
- 一道高三化学题向盛有Fe(NO3)2溶液的试管中加入0.1mol•L-1 H2SO4溶液 试管口出现红棕色气
一道高三化学题
向盛有Fe(NO3)2溶液的试管中加入0.1mol•L-1 H2SO4溶液 试管口出现红棕色气体.则溶液中NO3-被Fe2+还原为NO2,这个描述是错的,然后我想问一下为什么一定生成NO,而不是NO2,跟HNO3浓度有关吗
 o易o1年前2
o易o1年前2 -
 预期轨迹 共回答了19个问题
预期轨迹 共回答了19个问题 |采纳率84.2%0.1mol*L-1的硫酸是稀硫酸。。。所以参照硝酸亚铁跟稀硫酸的反应式1年前查看全部
- 向含有AgNO3、Fe(NO3)2的混合溶液中加入一定量的锌粉,使其充分反应后,过滤,向滤渣中滴加稀盐酸,有气泡产生,则
向含有AgNO3、Fe(NO3)2的混合溶液中加入一定量的锌粉,使其充分反应后,过滤,向滤渣中滴加稀盐酸,有气泡产生,则下列结论正确的是( )
A. 滤液中一定含Ag+、Zn2+、Fe2+
B. 滤液中一定含Zn2+,可能含Ag+
C. 滤液中一定含Fe2+,Zn2+,不含Ag+
D. 滤液中一定含Zn2+,可能含Fe2+ wuyao12341年前1
wuyao12341年前1 -
 庐州刺猬 共回答了18个问题
庐州刺猬 共回答了18个问题 |采纳率94.4%解题思路:根据金属活动性顺序锌>铁>银,向含有AgNO3、Fe(NO3)2的混合溶液中加入一定量的锌粉,锌粉会首先置换硝酸银中的银,待硝酸银完全反应后继续与硝酸亚铁发生反应;过滤,向滤渣中滴加稀盐酸,有气泡产生,说明滤渣金属是铁或锌与铁的混合物.根据题干信息,滤渣是铁或铁与锌的混合物.滤液中一定没有硝酸银.若只有铁时,滤液中含有硝酸锌,可能有硝酸亚铁;若滤渣为铁与锌的混合物,则滤液中只有硝酸锌.由此分析,D正确.
故选D.点评:
本题考点: 金属的化学性质.
考点点评: 金属放入盐的混合溶液中,首先把活动性最弱的金属置换出来,置换的先后顺序为由弱到强,最强的最后置换出来.1年前查看全部
- 一个有关原电池的问题正极为铜,负极为铁,电解质溶液为Fe(NO3)2溶液,能否发生Fe3++Fe=3Fe2+
 chenyuanxin1年前2
chenyuanxin1年前2 -
 东边的西湖 共回答了13个问题
东边的西湖 共回答了13个问题 |采纳率100%不可以.
因为溶液中是Fe2+不是Fe3+,要使得Fe3++Fe=3Fe2+发生,溶液中一定要是Fe3+才行.1年前查看全部
- fe(no3)2受热分解成什么?
 加州雨夜1年前1
加州雨夜1年前1 -
 88920327 共回答了18个问题
88920327 共回答了18个问题 |采纳率77.8%4Fe(NO3)2=2Fe2O3+8NO2+O21年前查看全部
- Fe(NO3)2化学术语怎么说
 两生花1年前7
两生花1年前7 -
 等待阻击 共回答了1个问题
等待阻击 共回答了1个问题 |采纳率100%硝酸亚铁1年前查看全部
- 向稀Fe(NO3)2溶液中加入稀盐酸的离子反应方程式是?
 龙猫王子1年前1
龙猫王子1年前1 -
 flyliudan16 共回答了24个问题
flyliudan16 共回答了24个问题 |采纳率83.3%3Fe2+ + 4H+ + NO3- ==== 3Fe3+ + NO + 2H2O1年前查看全部
- 下列离子方程式正确的是( )A.Fe(NO3)2溶液中滴入一定量盐酸:3Fe2++4H++NO3-=2H2O+NO↑+
下列离子方程式正确的是( )
A.Fe(NO3)2溶液中滴入一定量盐酸:3Fe2++4H++NO3-=2H2O+NO↑+3Fe3+
B.向氯化铵的溶液中加入足量浓NaOH溶液并加热:NH4++OH-
NH3•H2O△ .
C.Ba(OH)2溶液与H2SO4溶液混合产生沉淀:Ba2++SO42-=BaSO4↓
D.往NaOH溶液中通入过量SO2:SO2+2OH-=SO32-+H2O rual19841年前1
rual19841年前1 -
 拉拉了 共回答了13个问题
拉拉了 共回答了13个问题 |采纳率92.3%解题思路:A、酸性条件下,Fe2+与NO3-发生氧化还原反应;
B、加热时,氯化铵溶液与浓NaOH生成氨气;
C、Ba(OH)2溶液与H2SO4溶液混合生成硫酸钡和水;
D、NaOH溶液中通入过量SO2生成亚硫酸氢钠.A、酸性条件下,Fe2+与NO3-发生氧化还原反应,则其反应方程式:3Fe2++4H++NO3-=2H2O+NO↑+3Fe3+,故A正确;
B、加热时,氯化铵溶液与浓NaOH生成氨气,其反应的离子方程式:NH4++OH-
△
.
NH3↑+H2O,故B错误;
C、Ba(OH)2溶液与H2SO4溶液混合生成硫酸钡和水,其反应离子方程式:2OH-+2H++Ba2++SO42-=BaSO4↓+2H2O,故C错误;
D、NaOH溶液中通入过量SO2生成亚硫酸氢钠,其反应离子方程式:SO2+OH-=HSO3-,故D错误;
故选A.点评:
本题考点: 离子方程式的书写.
考点点评: 本题考查了离子方程式的正误判断和书写原则,注意反应物之间量的关系,反应实质理解,题目较简单.1年前查看全部
- 某实验室的废水中含有大量AgNO3、Zn(NO3)2和Fe(NO3)2,课外小组同学欲从该废液中回收银,并得到副产品硫酸
某实验室的废水中含有大量AgNO3、Zn(NO3)2和Fe(NO3)2,课外小组同学欲从该废液中回收银,并得到副产品硫酸亚铁晶体.实验方案如下:
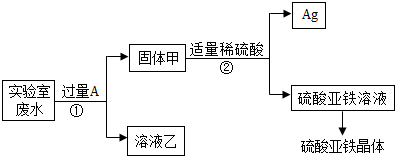
(1)固体甲中含有的物质是(填化学式)______;溶液乙中有颜色的离子符号为______.
(2)写出步骤①的化学方程式:______,反应②的基本类型是______
(3)检验步骤①向废水中加入A是否过量的物理方法是______.
(4)加入过量A 的目的是______. HYVWOOOOO1年前1
HYVWOOOOO1年前1 -
 songyan4917 共回答了18个问题
songyan4917 共回答了18个问题 |采纳率100%解题思路:(1)根据题意,若想从该废水中回收银,并得到副产品硫酸亚铁晶体,应利用金属活动性顺序,用活泼金属将Ag从AgNO3溶液中置换出来,且实验过程中未引入其它的金属元素,可知,加入的A物质应为Fe,据此分析有关的问题;
(2)根据上述分析,写出步骤①的化学方程式并根据反应的特点分析反应的类型;
(3)根据铁能被磁铁吸引分析;
(4)根据实验的目的分析加入过量A 的目的.(1)由题意可知,若想从该废水中回收银,并得到副产品硫酸亚铁晶体,应利用金属活动性顺序,用活泼金属将Ag从AgNO3溶液中置换出来,且实验过程中未引入其它的金属元素,可知,加入的A物质应为Fe,铁能将银从溶液中置换出来不能将锌置换出来,所以,固体甲中含有的物质是Fe和Ag,溶液乙中有颜色的离子符号为亚铁离子,符号为:Fe2+;
(2)在步骤①中铁与硝酸银反应生成了硝酸亚铁和银,反应的化学方程式为:Fe+2AgNO3=Fe(NO3)2+2Ag;该反应由一种单质和化合物反应,生成了领一种单质和化合物,属于置换反应;
(3)由于铁能被磁铁吸引.所以,检验加入A是否过量的物理方法是:对固体甲磁铁吸铁实验;
(4)加入过量A 的目的是将溶液中银全部置换出来,完全回收银.
故答为:(1)铁,Fe2+;(2)Fe+2AgNO3=Fe(NO3)2+2Ag,置换反应;(3)对固体甲磁铁吸铁实验;(4)完全回收银.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 本题考查了金属活动性顺序与置换反应和过滤的原理等知识,要记住锌、铁、银的活动性,并学会从实验方案图中提炼有用的信息.1年前查看全部
- (2005•绵阳)将1.7g AgNO3、1.35gCuCl2和1.8g Fe(NO3)2放入100
(2005•绵阳)将1.7g AgNO3、1.35gCuCl2和1.8g Fe(NO3)2放入100mL蒸馏水中充分溶解,再加入足量的锌粉,发生置换反应.首先析出的固体物质是( )
A.Ag
B.Cu
C.AgCl
D.Fe 永远没有结局1年前1
永远没有结局1年前1 -
 果果鱼 共回答了20个问题
果果鱼 共回答了20个问题 |采纳率95%解题思路:硝酸银溶液能够和氯化铜发生反应,所以解答时应该先判断硝酸银和氯化铜反应的情况,然后再根据金属和盐溶液的反应的特点可以知道,活泼金属和多种盐的混合溶液反应时,总是把最不活泼的金属最先置换出来,可以据此结合金属活动性顺序进行解答.设消耗1.35g氯化铜需要硝酸银的质量为x
CuCl2+2AgNO3═Cu(NO3)2+2AgCl↓
135 340
1.35g x
[135/1.35g=
340
x]
解得:x=3.40g
而题中只给了1.70g硝酸银,所以可以判断加水溶解后,氯化铜有剩余,而硝酸银已被完全反应掉,由于是先溶解后加入锌,所以最先发生的反应为硝酸银和氯化铜的反应,即氯化银最先析出.
故选C.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 解答这类题目时,首先,要熟记和理解金属活动性顺序及其应用,以及与之相关的知识等;然后,根据所给的实验、问题情景结合所学的相关知识细致地阅读、分析题意等按照题目的要求,认真地进行选择或解答即可.1年前查看全部
- (2007•四川)处理胶片的废液中含大量AgNO3、Zn(NO3):和Fe(NO3)2,若随意排放不仅会造成严重的污染,
(2007•四川)处理胶片的废液中含大量AgNO3、Zn(NO3):和Fe(NO3)2,若随意排放不仅会造成严重的污染,而且造成资源浪费.某同学从上述的废液中回收金属银并得到副产品绿矾(FeSO4•7H2O),其回收流程如下:

(1)操作②是______;
(2)固体A中含______,y是______. 狂徒夜磨刀1年前1
狂徒夜磨刀1年前1 -
 我爱安利 共回答了21个问题
我爱安利 共回答了21个问题 |采纳率90.5%解题思路:(1)根据操作②分离出液体和固体进行分析,
(2)根据溶液D中只有一种盐是硫酸亚铁,可以分析出Y是硫酸,B是银,所以固体A就是铁和银,所以X就是铁,将推出的各种物质代入验证即可.(1)过滤操作是将固体从液体中分离的一种操作,经过②后,分离出液体和固体,故答案为:过滤
(2)溶液D中只有一种盐是硫酸亚铁,可以分析出Y是硫酸,B是银,所以固体A就是铁和银,所以X就是铁,过量的铁是为了将硝酸银中的银全部置换出来,过量的硫酸是为了将铁全部反应完,故答案为:银、铁,稀硫酸点评:
本题考点: 物质的鉴别、推断.
考点点评: 该题的难度比较大,阅读量多,在做这类题时,对题意要理解透,找出有用的物质,然后根据问题结合所学的知识进行解答.1年前查看全部
- 硝酸亚铁Fe(NO3)2是一种受热易分解的盐,下列各组对硝酸亚铁受热分解产物的判断,可能符合事实的是( )
硝酸亚铁Fe(NO3)2是一种受热易分解的盐,下列各组对硝酸亚铁受热分解产物的判断,可能符合事实的是( )
A. Fe2O3+N2O5
B. Fe2O3+NO2+O2
C. FeO+NO2
D. Fe2O3+N2O5+O2 路宇光儿1年前3
路宇光儿1年前3 -
 artini 共回答了17个问题
artini 共回答了17个问题 |采纳率82.4%解题思路:氧化还原反应中,存在电子的得失,反应中存在化合价的升降,从化合价的角度分析该题.A.元素化合价不可能都升高,N元素的化合价应降低,故A错误;
B.Fe的化合价升高,N的化合价降低,O元素的化合价升高,符合氧化还原反应规律,故B正确;
C.元素化合价不可能都降低,Fe元素的化合价应升高,故C错误;
D.素化合价不可能都升高,N元素的化合价应降低,故D错误.
故选B.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,题目难度不大,本题注意氧化还原反应中,某种元素的化合价升高,肯定有化合价降低的元素.1年前查看全部
- 将5.6g Fe投入浓硝酸溶液,产生红棕色气体A,把所得溶液减压蒸干,得到20g Fe(NO3)2和
将5.6g Fe投入浓硝酸溶液,产生红棕色气体A,把所得溶液减压蒸干,得到20g Fe(NO3)2和Fe(NO3)3的混合物,将该固体在高温下加热,得到红褐色的Fe2O3和气体B,A、B气体混合通入足量水中,在标准状况下剩余气体的体积为( )
A. 2240mL
B. 4480mL
C. 3360mL
D. 1120mL SunTa0071年前2
SunTa0071年前2 -
 平静的mm 共回答了22个问题
平静的mm 共回答了22个问题 |采纳率77.3%解题思路:根据题意可知,红棕色气体为二氧化氮,即铁与浓硝酸反应时,铁失去电子,氮元素得到电子;在Fe(NO3)2和Fe(NO3)3的混合物,将该固体在高温下加热,得到红褐色的Fe2O3和气体B是亚铁失去电子,氮元素得电子;再A、B气体混合通入足量水中剩余气体一定为NO,则可利用得失电子守恒来计算NO的物质的量.因最后气体为NO,设其物质的量为x,
铁与浓硝酸反应时,铁失去电子,氮元素得到电子,且A为二氧化氮,
在Fe(NO3)2和Fe(NO3)3的混合物,将该固体在高温下加热,得到红褐色的Fe2O3和气体B,是亚铁失去电子,氮元素得电子,且B为氧气,
A、B气体混合通入足量水生成硝酸和NO,
根据守恒思想,计算时抓住反应的始终态即可,反应物可看作Fe、HNO3和水,最终生成物是Fe2O3和剩余气体,A和B混合气体通入水中,剩余气体是NO或O2,根据电子得失守恒可定性判断出剩余气体不可能是O2,则剩余气体只能是NO,设其物质的量为x,则整个过程中由得失电子守恒可知,
[5.6g/56g/mol]×(3-0)=x×(5-2),
解得x=0.1mol,
即标准状况下体积为0.1mol×22.4L/mol=2240mL,
故选A.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题较难,明确发生的化学反应,注意元素化合价的变化,明确最后的物质,利用电子守恒来快速计算是解答的关键,从而可避免中间过程的繁杂计算.1年前查看全部
- 某实验室的废水中含有大量AgNO3、Zn(NO3)2和Fe(NO3)2,课外小组同学欲从该废液中回收银,并得到副产品硫酸
某实验室的废水中含有大量AgNO3、Zn(NO3)2和Fe(NO3)2,课外小组同学欲从该废液中回收银,并得到副产品硫酸亚铁晶体.实验方案如下:

(1)操作①的名称是______,固体甲中含有的物质是(填化学式)______;溶液乙中所含溶质的化学式为______.
(2)写出步骤①的化学方程式:______.
(3)检验步骤①向废水中加入A过量的方法是______. 知愚1年前1
知愚1年前1 -
 5323351 共回答了25个问题
5323351 共回答了25个问题 |采纳率92%解题思路:结合实验意图分析实验流程图,根据对流程的分析,判断流程中所需要加入的物质及所采取的实验操作,并设计实验检验反应物的过量.(1)把固体与液体分离开的操作为过滤操作;根据流程可得知①中加入的为铁粉,铁能与溶液中的硝酸银反应得到金属银及过量而未完全反应的铁;硝酸银被过量的铁完全反应,因此溶液中含有不与铁反应的硝酸锌和反应后生成及原溶液中就含的硝酸亚铁;
故答案为:过滤(1分),Fe、Ag(2分),Zn(NO3)2、Fe(NO3)2
(2)铁的活动性比银强,加入的铁粉与混合溶液中的硝酸银反应,生成硝酸亚铁和银;
故答案为:Fe+2AgNO3═2Ag+Fe(NO3)2
(3)加入A过量时,所得固体甲中含有因加入过量而未完全反应的铁,因此可取固体加入稀硫酸或稀盐酸,观察是否有气泡放出,有气泡则固体甲中含铁,加入的铁过量;
故答案为:取少量固体甲于试管中,加入稀硫酸,有气泡冒出,则加入的铁过量.点评:
本题考点: 金属活动性顺序及其应用;过滤的原理、方法及其应用;化学式的书写及意义;书写化学方程式、文字表达式、电离方程式.
考点点评: 过滤是分离不溶性固体与液体所形成的混合物的一种最常用的方法.1年前查看全部
- 将5.6g Fe投入浓硝酸溶液,产生红棕色气体A,把所得溶液减压蒸干,得到20g Fe(NO3)2和
将5.6g Fe投入浓硝酸溶液,产生红棕色气体A,把所得溶液减压蒸干,得到20g Fe(NO3)2和Fe(NO3)3的混合物,将该固体在高温下加热,得到红褐色的Fe2O3和气体B,A、B气体混合通入足量水中,在标准状况下剩余气体的体积为( )
A. 2240mL
B. 4480mL
C. 3360mL
D. 1120mL 小O树1年前1
小O树1年前1 -
 偌文 共回答了21个问题
偌文 共回答了21个问题 |采纳率90.5%解题思路:根据题意可知,红棕色气体为二氧化氮,即铁与浓硝酸反应时,铁失去电子,氮元素得到电子;在Fe(NO3)2和Fe(NO3)3的混合物,将该固体在高温下加热,得到红褐色的Fe2O3和气体B是亚铁失去电子,氮元素得电子;再A、B气体混合通入足量水中剩余气体一定为NO,则可利用得失电子守恒来计算NO的物质的量.因最后气体为NO,设其物质的量为x,
铁与浓硝酸反应时,铁失去电子,氮元素得到电子,且A为二氧化氮,
在Fe(NO3)2和Fe(NO3)3的混合物,将该固体在高温下加热,得到红褐色的Fe2O3和气体B,是亚铁失去电子,氮元素得电子,且B为氧气,
A、B气体混合通入足量水生成硝酸和NO,
根据守恒思想,计算时抓住反应的始终态即可,反应物可看作Fe、HNO3和水,最终生成物是Fe2O3和剩余气体,A和B混合气体通入水中,剩余气体是NO或O2,根据电子得失守恒可定性判断出剩余气体不可能是O2,则剩余气体只能是NO,设其物质的量为x,则整个过程中由得失电子守恒可知,
[5.6g/56g/mol]×(3-0)=x×(5-2),
解得x=0.1mol,
即标准状况下体积为0.1mol×22.4L/mol=2240mL,
故选A.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题较难,明确发生的化学反应,注意元素化合价的变化,明确最后的物质,利用电子守恒来快速计算是解答的关键,从而可避免中间过程的繁杂计算.1年前查看全部
- 在答案里甲中的物质是 Ag Fe 乙中的物质是Zn(NO3)2 可Fe(NO3)2去哪里啦
 真实姓名哦1年前1
真实姓名哦1年前1 -
 一直等在这里 共回答了20个问题
一直等在这里 共回答了20个问题 |采纳率95%因为过量的Zn,锌的金属活动性比铁和银强,在第①反应中过量锌把废水中的银和铁都置换出来了.(如果废水中首先含有三价铁,也被锌还原成二价铁,最后置换出铁单质),废水中不可能存在硝酸亚铁了,Fe(NO3)2全部被置换成铁单质.1年前查看全部
- Fe(No3)2与稀硫酸反应能否反应,硫酸不是有强氧化性吗,会把Fe(No3)2提升为Fe(No3)3吗,反应方程式
 dazzlingman1年前3
dazzlingman1年前3 -
 ligukgi 共回答了23个问题
ligukgi 共回答了23个问题 |采纳率100%硫酸不是强氧化,是强酸性,但是硝酸根和硫酸的氢离子相当于硝酸,可以氧化2价铁离子1年前查看全部
- (2007•石景山区一模)处理胶片的废液中含有大量AgNO3、Zn(NO3)2和Fe(NO3)2,若随意倾倒会造成严重污
(2007•石景山区一模)处理胶片的废液中含有大量AgNO3、Zn(NO3)2和Fe(NO3)2,若随意倾倒会造成严重污染.某同学想从上述的废液中回收金属银,并得到副产品硫酸亚铁固体,设计了如下图所示的生产流程.

(1)操作②是______.
(2)固体A是______,C中溶质是______,Y是______. yongyuanaiwl1年前1
yongyuanaiwl1年前1 -
 蓝海图腾 共回答了14个问题
蓝海图腾 共回答了14个问题 |采纳率92.9%解题思路:(1)根据操作②分离出液体和固体进行分析;
(2)结合实验意图分析实验流程图,根据对流程的分析,判断流程中所需要加入的物质及所采取的实验操作:根据使用的目的得到硫酸亚铁固体分析溶液D中只有一种盐是硫酸亚铁,可以分析出Y是硫酸,B是银,所以固体A就是铁和银,所以X就是铁,将推出的各种物质代入验证即可.(1)把固体与液体分离开的操作为过滤操作;
(2)溶液D中只有一种盐是硫酸亚铁,可以分析出Y是硫酸,B是银,所以固体A就是铁和银,所以X就是铁,根据流程铁能与溶液中的硝酸银反应得到金属银及过量而未完全反应的铁;硝酸银被过量的铁完全反应,因此溶液中含有不与铁反应的硝酸锌和反应后生成及原溶液中就含的硝酸亚铁;
故答案为:(1)过滤;(2)Ag、Fe; Zn(NO3)2、Fe(NO3)2;H2SO4点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 本题考查了金属活动性顺序和过滤的原理及阅读流程图等,要记住锌、铁、银的活动性,并学会从实验方案图中提炼有用的信息结合金属活动性顺序的意义进行运用.1年前查看全部
大家在问
- 1五天八小时工作制的法律依据是什么呢?请给出具体法规的名称.周六上班算加班么?
- 2重力大小为G的小物块,静止放在半径为R的半球体上,小物块与球心连线与水平地面的夹角为θ,
- 3请问这句话用英语得怎么说?这两个订单请您一并支付,我会提供1米的面料给您,不会将面料裁减成两块0.5米.
- 4用‘’人外有人,天外有天‘’写一句话
- 5(2013•衡水二模)如图是跷跷板示意图,横板AB绕中点O上下转动,立柱OC与地面垂直,设B点
- 6改同义句 英语1)The best way to words is by reading English magazin
- 7在空间四边形ABCD中,各边长均为a,对角线BD=根号2a,AC=a,求异面直线BD与AC的夹角
- 8(2009•宝山区一模)已知△ABC中,AB=4,AC=3,把△ABC绕点A旋转某个角度后,使得点B落在点B1处,点C落
- 9英语翻译
- 10用限制酶切割一个DNA分子,获得一个目的基因,同时有几个个磷酸二酯键被水解?是4个吗?
- 11Na2Co3与NaHCO3在人体中的作用是?NaH2PO4与Na2HPO4呢?
- 12__a zebra? __,__ ____. ___a koala.
- 13将1kg 80℃的热水倒入4kg 20℃的冷水中,若不计热量损失,则混合后水的温度是多少?
- 14英语翻译用现在进行时
- 15氵县 这个字念什么急
