纯度为95%的酒精能用来配助焊剂么?
 红发毛孩2022-10-04 11:39:541条回答
红发毛孩2022-10-04 11:39:541条回答我打算用它溶解松香来配助焊剂,用于做手工电路板焊接,虽然也要焊接贴片元件,但要求不是很高.有谁有过使用经验没有?具体的松香和酒精比例为多少?

已提交,审核后显示!提交回复
共1条回复
 小江豚的瓜皮小猫 共回答了14个问题
小江豚的瓜皮小猫 共回答了14个问题 |采纳率92.9%- 当然可以,具体比例的话,涉及到配方,估计没人会告诉你
- 1年前
相关推荐
- 检验氢气纯度时,将试管口移近火焰,没有爆鸣声,表明氢气纯净 我知道是错的,那么表明什么呢?
 良木缘妞妞1年前2
良木缘妞妞1年前2 -
 大的眼睛 共回答了17个问题
大的眼睛 共回答了17个问题 |采纳率88.2%要听到“卟”的一声,才能表明氢气纯净,
没有声音,有可能在试管内没有氢气或氢气的量很少.1年前查看全部
- 精馏塔分离苯和甲苯,进料50吨/小时,含苯40%,塔顶苯纯度99.5%,求塔顶采出量多少吨/小时
 sepi1年前2
sepi1年前2 -
 van1977 共回答了17个问题
van1977 共回答了17个问题 |采纳率94.1%不是50×40%÷99.5%吨吗?1年前查看全部
- 某化肥如下名称:硫酸甲K2SO4纯度:95%为了确定是否符合标准某人取10g样本,加入适量水溶解后,与组两的BaCl2溶
某化肥如下
名称:硫酸甲
K2SO4
纯度:95%
为了确定是否符合标准
某人取10g样本,加入适量水溶解后,与组两的BaCl2溶液充分反应.
过滤,洗条,哄干沉淀,测得其质量为11.65g.
试通过计算确定该化肥纯度是否符合以上说明
(假设化肥中的杂志不与BaCl2溶液反应) meyukii1年前6
meyukii1年前6 -
 richard_zh 共回答了17个问题
richard_zh 共回答了17个问题 |采纳率70.6%设参加反应的K2SO4质量是x
K2SO4+BaCl2===BaSO4+2KCl
174.233
x.11.65
x/174=11.65/233
x=8.7
那么K2SO4的质量分数是:8.7/10*100%=87%1年前查看全部
- 用含杂质(杂质不与酸反应,也不溶于水)的铁10g和50g稀硫酸完全反应后,滤去杂质,所的液体质量为55.4g,求此铁纯度
用含杂质(杂质不与酸反应,也不溶于水)的铁10g和50g稀硫酸完全反应后,滤去杂质,所的液体质量为55.4g,求此铁纯度?
 冷月无声DYM1年前4
冷月无声DYM1年前4 -
 qq5201120 共回答了18个问题
qq5201120 共回答了18个问题 |采纳率77.8%先由差量法可得:
Fe + H2SO4 ====== FeSO4 + H2↑
56 2
56-2=54(溶液放入铁、逸出氢气后增加的相对质量)
Δm(液)=55.4g-50g=5.4g
m(Fe)=5.6g
Fe%=m(Fe)/m(铁)=56%
纯度为56%1年前查看全部
- PH值是7,是纯水吗高纯度的纯净水,经过空气能加热,热水经过铜管,纯净水的纯度会有变化吗?铜离子会升高吗?热水不超过70
PH值是7,是纯水吗
高纯度的纯净水,经过空气能加热,热水经过铜管,纯净水的纯度会有变化吗?铜离子会升高吗?热水不超过70度,铜管10米左右. 灵欲春宵1年前1
灵欲春宵1年前1 -
 8kxdk 共回答了18个问题
8kxdk 共回答了18个问题 |采纳率100%不一定是啊!PH=7你能显示出这水的酸碱度是中型的啊!并不能显示出水是不含杂质的啊!绝对不溶解的东西是没有啊!铜离子可定会有极少量的溶解到水中啊!79度的温度肯定会加速铜离子溶解到水中啊!1年前查看全部
- 若某氯化铵样品含氮24%,此样品的纯度为多少?取这样的样品14.6克与足量的熟石灰反映,可得到氨气多少升
 牛津里的牛1年前1
牛津里的牛1年前1 -
 冰狐6 共回答了20个问题
冰狐6 共回答了20个问题 |采纳率80%14(14+3+35.5) .24=1年前查看全部
- 收集一试管氢气,检验氢气纯度,没有听到任何声音的原因
收集一试管氢气,检验氢气纯度,没有听到任何声音的原因
用拇指堵住试管口,移近火焰,移开拇指点火,检验氢气纯度,没有听见任何声音. 全都满了1年前1
全都满了1年前1 -
 svw2016 共回答了22个问题
svw2016 共回答了22个问题 |采纳率86.4%可能是氢气含量少或没有氢气,没有发生燃烧,所以没有声音.1年前查看全部
- (2007•武威)石灰石是我市主要矿产之一,小江同学为了寻找纯度超过85%的石灰石,对一样品进行了如下定量实验.
(2007•武威)石灰石是我市主要矿产之一,小江同学为了寻找纯度超过85%的石灰石,对一样品进行了如下定量实验.
试通过分析计算:实验步骤 ①称取烧杯的质量 ②将适量盐酸加入烧杯中并称重 ③称取少量石灰石样品加入烧杯中,使之与过量稀盐酸反应 ④待反应完全后,称重 实验图示 
实验数据 烧杯的质量为50.0g 烧杯和盐酸的质量为100.0g 石灰石样品样品的质量为12.0g 烧杯和其中混合物的质量为107.6g
(1)该实验中生成的二氧化碳的质量是多少克?
(2)该石灰石样品的纯度是否符合要求?(假设石灰石样品中的杂质不与盐酸反应也不溶于水) nn晶231年前1
nn晶231年前1 -
 秋雨冬雪1 共回答了17个问题
秋雨冬雪1 共回答了17个问题 |采纳率88.2%解题思路:(1)石灰石中主要成分碳酸钙可以与盐酸反应生成氯化钙、水和气体二氧化碳;随着反应的发生,二氧化碳不断放出而使烧杯内物质质量减小;完全反应前后烧杯中物质质量差为放出气体二氧化碳的质量;
(2)石灰石样品的纯度=[石灰石样品中碳酸钙的质量/石灰石样品的质量12.0g]×100%,根据反应的化学方程式,可由反应放出二氧化碳的质量计算参加反应的碳酸钙的质量.(1)根据质量守恒定律得:反应放出CO2的质量=(100.0g+12.0g)-107.6g=4.4g;
(2)设12.0g石灰石样品中含CaCO3质量为x
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 44
x 4.4g
[100/x=
44
4.4g]
x=[100×4.4g/44]=10.0g
该石灰石样品的纯度为:[10.0g/12.0g]×100%=83.3%
因83.3%<85%,所以该石灰石样品的纯度不符合要求.
答:(1)该实验中生成的二氧化碳的质量是4.4g;(2)该石灰石样品的纯度不符合要求.点评:
本题考点: 含杂质物质的化学反应的有关计算;质量守恒定律及其应用.
考点点评: 根据质量守恒定律,放出气体的反应,反应前各物质的总质量与反应后剩余物质的质量差即为反应放出气体的质量.1年前查看全部
- 氯化钠的提纯及纯度测定中的结果与讨论是?
 再睡五分钟1年前1
再睡五分钟1年前1 -
 yellowland 共回答了20个问题
yellowland 共回答了20个问题 |采纳率85%1.试剂要加过量.
2.蒸发时要一手搅拌,一手用坩锅钳轻轻夹住蒸发皿.蒸发皿底上无水滴,并用小火加热.
3.在蒸发皿中浓缩至稀浆状,切不可蒸干.
4.溶解粗盐和溶解精盐都用蒸馏水.1年前查看全部
- 已知石灰石所含的杂质不溶于水和盐酸.为测定石灰石的纯度,取4 g样品于烧杯,将50 g稀盐酸分为5次
已知石灰石所含的杂质不溶于水和盐酸.为测定石灰石的纯度,取4 g样品于烧杯,将50 g稀盐酸分为5次依次加入烧杯,每次充分反应后,过滤、干燥、称量剩余固体的质量,再将剩余物放回烧杯,继续进行实验.实验结果如下表(假设过滤、干燥等操作过程,固体质量没有损耗):
请列式计算:(1)该石灰石样品的纯度是多少?实验次数 第1次 第2次 第3次 第4次 第5次 加入稀盐酸的质量 10g 10g 10g 10g 10g 剩余固体的质量 3.0g 2.0g 1.0g 0.4g 0.4g
(2)煅烧该种石灰石100t,得到含杂质的生石灰多少吨? 刘翼6612031年前1
刘翼6612031年前1 -
 suresweet 共回答了11个问题
suresweet 共回答了11个问题 |采纳率90.9%解题思路:根据表中数据可以看出每加10 g酸固体溶解1.0 g,最后不溶固体为0.4 g,从而得到石灰石的纯度,然后利用石灰石高温分解的化学方程式来解答生石灰的质量.(1)因每加10 g酸固体溶解1.0 g,第4次和第5次加酸,固体质量不变,则不溶固体为0.4 g,石灰石样品的纯度为:
(4−0.4)g
4g×100%═90%,
答:石灰石样品的纯度为90%.
(2)该种石灰石100t,其中碳酸钙为100t×90%═90t,杂质为100t-90t═10t,设碳酸钙高温分解生成的生石灰为X,则
CaCO3
高温
.
CaO+CO2↑
100 56
90t X
[100/90t=
56
X],
解得X═50.4t
则得到含杂质的生石灰为50.4t+10t═60.4t
答:得到含杂质的生石灰为60.4t.点评:
本题考点: 含杂质物质的化学反应的有关计算;物质组成的综合计算;质量守恒定律及其应用.
考点点评: 本题考查了学生对表格中数据的分析和应用,准确判断杂质的质量是关键,还要注意计算格式要规范.1年前查看全部
- 鉴定可溶性还原糖的实验前最好检测一下蔗糖溶液和葡萄糖溶液的纯度
鉴定可溶性还原糖的实验前最好检测一下蔗糖溶液和葡萄糖溶液的纯度
这句话为什么是正确的?蔗糖不是还原糖啊 cuttlefish011年前1
cuttlefish011年前1 -
 laohei5 共回答了16个问题
laohei5 共回答了16个问题 |采纳率87.5%对的呀1年前查看全部
- 计算样品纯度和反应转化率,取0.1g氢氧化镁样品加适量盐酸加蒸馏水配成250ml溶液则镁离子的的浓度为0.006897m
计算样品纯度和反应转化率,
取0.1g氢氧化镁样品加适量盐酸加蒸馏水配成250ml溶液则镁离子的的浓度为0.006897mol/L.用移液管移取样品溶液25ml于250ml锥形瓶中,加指示剂然后用EDTA滴定,EDTA消耗6.3ml(EDTA于氢氧化镁1:1反应,EDTA浓度为0.01965mol/L)求氢氧化镁样品纯度和反应转化率 yuchenvv1年前1
yuchenvv1年前1 -
 moye2004 共回答了23个问题
moye2004 共回答了23个问题 |采纳率91.3%笨算也算出来了:Mg :EDTA24.31 1X 0.01965*6.3 X=24.31*0.01965*6.3/100025:X = 250:YY=X*250/25=X/(25/250)Mg :Mg(OH)224.31 58.33Y Z Z=58.33/24.31*Y=X/(25/250)*58.33/24.31=10*58.33/24.31*24.31*0.0196...1年前查看全部
- 急:(按照图中的说明,一袋化肥中含氮元素的质量是多少?该袋化肥的纯度是多少?)
急:(按照图中的说明,一袋化肥中含氮元素的质量是多少?该袋化肥的纯度是多少?)
如题~氮肥
主要成分:硝酸铵(NH4NO3)
净重:50kg
含氮量:30% 逆水激1年前3
逆水激1年前3 -
 杜1 共回答了27个问题
杜1 共回答了27个问题 |采纳率85.2%“_陌丿恋”:
硝酸铵的分子量=(14+1×4+14+16×3)=80
其中氮占(14+14)/80=7/20=35%
50kg化肥应含氮元素50kg×35%=17.5kg
该化肥实际含氮量只有30%
实际含氮元素50kg×30%=15kg
纯度为30÷35≈0.857≈84.7%
答:一袋化肥,应含氮17.5千克,实际只有15千克,纯度为84.7%
祝好,再见.1年前查看全部
- 将6g某铁钉放入足量的硫酸铜溶液中,完全反应后过滤,得固体6.8g,试求该铁钉的纯度.(杂志不反应也不溶解)
 哀悼真善美1年前1
哀悼真善美1年前1 -
 狂小小 共回答了18个问题
狂小小 共回答了18个问题 |采纳率88.9%解 设纯铁的质量为xg
Fe+CuSO4===FeSO4+Cu ⊿ m
56 64-56=8
x 6.8-6=0.8
x=5.6g
铁的纯度:5.6/6×%=93.3%1年前查看全部
- HPLC(离子交换和反相)请问在高效液相色谱中,离子交换高效液相色谱和反相高效液相色谱在测定蛋白质纯度方面有什么区别?十
HPLC(离子交换和反相)
请问在高效液相色谱中,离子交换高效液相色谱和反相高效液相色谱在测定蛋白质纯度方面有什么区别?十分感谢! kmhero1171年前1
kmhero1171年前1 -
 z77c 共回答了20个问题
z77c 共回答了20个问题 |采纳率80%应该是使用的色谱柱不同,分离机制有差异. 分析测试百科网,分析行业的百度知道,有问题可找我,百度上搜下就有.1年前查看全部
- 刘斌同学的姑父准得建一座碳酸钙精粉厂.为检测当地的石灰石中碳酸钙的纯度,他在实验室里用6克石灰石样品与19克稀盐酸混合,
刘斌同学的姑父准得建一座碳酸钙精粉厂.为检测当地的石灰石中碳酸钙的纯度,他在实验室里用6克石灰石样品与19克稀盐酸混合,恰好完全反映,测得残留物质量为22.8克,试计算:依据质量守恒定律生成的二氧化碳为?6克样品中碳酸钙的质量?此石灰石中碳酸钙的纯度?
 灵妙毒性1年前2
灵妙毒性1年前2 -
 shine0325 共回答了20个问题
shine0325 共回答了20个问题 |采纳率95%减少的量全为生成的二氧化碳:6+19-22.8=2.2(克)
根据二氧化碳的量计算纯碳酸钙质量:2.2/44*100=5(克) 44是二氧化碳分子量,100是碳酸钙分子量
碳酸钙纯度为:5/6= %1年前查看全部
- 某地要兴建碳酸钙精粉厂,为了检测当地的碳酸钙纯度,在实验室中用11g石灰石样品与20g稀盐酸恰好反映,
某地要兴建碳酸钙精粉厂,为了检测当地的碳酸钙纯度,在实验室中用11g石灰石样品与20g稀盐酸恰好反映,
测的残留物的质量是26.6g.求:生成的二氧化碳质量是多少?(2)当地石灰石样品的碳酸钙质量分数是多少 刀刀见红1年前1
刀刀见红1年前1 -
 迷悟非两心 共回答了24个问题
迷悟非两心 共回答了24个问题 |采纳率100%由质量守恒定律知M co2=20+11-26.6=4.4g,根据化学反应方程式可得M CaCO3=10g,质量分数为10/11*100%=90.9%1年前查看全部
- PCR扩增过程中,生成的扩增片段大小一样吗?如果不一样,是否影响扩增片段的纯度?
 znwll1年前1
znwll1年前1 -
 paddy_84 共回答了20个问题
paddy_84 共回答了20个问题 |采纳率100%如果引物特异性比较高,模板比较纯的话产物也是一样的,如果担心有其他的片段,可以用第一次PCR产物稀释后作为模板继续PCR,这样就能得道比较纯的产物了.1年前查看全部
- 化学的几道计算题~1.某尿素每千克含N元素0.45千克,则该尿素纯度?2.600千克尿素与多少千克花费硝酸铵肥效相当?
 mazhiwei7771年前1
mazhiwei7771年前1 -
 rsecho 共回答了20个问题
rsecho 共回答了20个问题 |采纳率90%1.尿素的化学式为:CO(NH2)2
其中氮元素的百分含量为:
2×14/(12+16+28+4)=0.46
该尿素每千克含氮元素0.45千克,
则纯度为:0.45/0.46=0.97=97%
2.600kg的尿素含氮的质量为:
600kg×0.46=276kg
硝酸铵NH4NO3中的氮元素百分含量为:
2×14/(2×14+4+3×16)=0.35
要与600kg尿素肥效相同(即含氮量相同),
即需:276kg/0.35=788.57kg1年前查看全部
- 用氢氧化钙和碳酸纳制氢氧化钠,怎样提高氢氧化钠的纯度?
用氢氧化钙和碳酸纳制氢氧化钠,怎样提高氢氧化钠的纯度?
氢氧化钙——建筑用的“精灰”
碳酸钠——食用纯碱 yunxiao001年前2
yunxiao001年前2 -
 寒江821 共回答了16个问题
寒江821 共回答了16个问题 |采纳率100%首先,要提高氢氧化钙溶液和碳酸钠溶液的质量分数,建议在低温下反应,但要增加反应时间.反应后过虑,将剩下的溶液 加热蒸发.补充:建议楼主增大反应剂量,有利于后期的蒸发提纯.蒸发时可用容积较大的容器进行蒸发,此时可用煤气灶代替酒精灯.还有,反应物中应增大碳酸钠的剂量,宁可过量也不能让氢氧化钙过量(钙的化合物多不融于水,会对后期使用造成影响) 重点:反应物溶液的质量分数(低温反应),反应剂量增大,碳酸钠过量.1年前查看全部
- 若炼制1000t百分之93.3纯度的铁,至少需要含氧化铁80百分之的赤铁矿多少吨
 一片风景1年前1
一片风景1年前1 -
 森林里的画展 共回答了19个问题
森林里的画展 共回答了19个问题 |采纳率84.2%FE2O3+3co=3co2+ 2fe
160 112
X=1332.85T 1000T*93.3%=933T
1332.85T/80%=1666.1T1年前查看全部
- 97.5%的铝材是什么铝?纯度这么高的铝什么牌号可以替代或者等同, 见以下图片
97.5%的铝材是什么铝?
纯度这么高的铝什么牌号可以替代或者等同, 见以下图片

 xfimdgn1年前4
xfimdgn1年前4 -
 守侯1 共回答了22个问题
守侯1 共回答了22个问题 |采纳率86.4%牌号 3003
SI 0.6
TE 0.7
CU 0.05
MN 1.0-1.5
ZN 0.1
其它:0.05-0.15
AL-MN 合金.
做什么用啊?
加油啊,哥们.1年前查看全部
- 某同学设计实验方案来测定过氧化钠样品的纯度(杂质不参加反应,条件为标准状况).以下是实验方案的一部分.
某同学设计实验方案来测定过氧化钠样品的纯度(杂质不参加反应,条件为标准状况).以下是实验方案的一部分.
实验原理:2Na2O2 + 2H2O = 4NaOH + O2↑
通过测定生成的氧气的体积,经计算可确定样品中过氧化钠的含量.
①称取过氧化钠样品2.00 g ;
②把这些过氧化钠样品放入气密性良好的气体发生装置中;
③向过氧化钠样品中滴入水,用量筒排水集气,量筒内液面在110 mL处恰与水槽内液面相平;
④ 作为反应器的烧瓶中有54.0 mL液体;
⑤ 将烧瓶内的液体转移到250 mL的容量瓶内,并加水定容.
请回答下列问题:
⑴有1000 mL、 500 mL 、250 mL的量筒备用,则应选用 mL的量筒.
⑵生成气体体积是 mL,为保证生成气体体积的准确性,读取量筒刻度时应注意的问题是
⑶据研究,与上述反应同时发生的反应还有:Na2O2 + 2H2O = 2NaOH + H2O2,H2O2的生成会使测定结果 (填“偏高”、“偏低”或“无影响”).
答案是(1)500ml(2)56ml(3)偏低 未知姓名1年前6
未知姓名1年前6 -
 星巴达 共回答了8个问题
星巴达 共回答了8个问题 |采纳率87.5%⑴ 500 mL
解析:量筒是量度液体体积的仪器.规格以所能量度的最大容量(ml)表示,常用的有10 ml、25ml、50 ml、100 ml、250 ml、500 ml、1000 ml等.外壁刻度都是以 ml为单位,10 ml量简每小格表示0.2 ml,而50 ml量筒每小格表示1ml.可见量筒越大,管径越粗,其精确度越小,由视线的偏差所造成的读数误差也越大.所以,实验中应根据所取溶液的体积,尽量选用能一次量取的最小规格的量筒.分次量取也能引起误差.如量取70ml液体,应选用 100ml量筒.
若2g为纯净Na2O2,则能生成287ml气体
2Na2O2 + 2H2O = 4NaOH + O2↑
那么2gNa2O2最多可以生成的O2体积为
2/78/2*22.4*1000=287.18ml
所以应该选用大于287ml的最小的量筒,也就是500ml的量筒!
⑵ 56 mL
解析:实际上就是110ml-54ml,也就是气体和液体总的体积110ml减去液体的体积54ml,就得到气体的体积!
使量筒内外液面持平;视线平视溶液凹液面底部,与刻度线相切
解析:眼睛是按直线方向看东西的,即读数时的视线方向是:眼睛-量筒刻度-液体凹液面最低处.假设量筒在左边,眼睛在右边,画图,将以上三个地方连成一条线,就可以发现:俯视时,视线是从右上方到左下方的,读出的刻度就比水平位置高;仰视时,视线是从右下方向左上方的,读出的刻度就比水平位置低了
这一题你还是画个图就一目了然了!
⑶ 偏低
解析:显然是偏低,Na2O2 + 2H2O 反应生成了H2O2,双氧水是液体,而不是气体,所以使得生成的O2↑的量减少了,从而测量结果偏低!
第二问补充:
首先你要理解一下为什么量筒内液面在110 mL处恰与水槽内液面相平?
那是因为制取气体前,烧瓶内有很多的空气,而且是大气压.该试验的基本原理是测定气体的增加量作为生成气体的体积.所以要消除原来空气的体积,必须保证空气的体积不变.压强必须调成大气压才行.
这就是量筒内液面在量筒内液面在110 mL处恰与水槽内液面相平量筒内液面在110 mL处恰与水槽内液面相平处恰与水槽内液面相平的原因.
假如量筒内液体高于水槽内,你可以想象外界大气压要比里面高,测量的气体体积就会偏大.同理,假如量筒内液体小于水槽内,外界大气压要比里面低,测量的气体体积就会偏小.
接着再谈为什么气体和液体总的体积是110ml.
这实验中有句话很重要“把这些过氧化钠样品放入气密性良好的气体发生装置中”,气密性良好说明原来烧瓶中的气体压力就是大气压,当加入液体后压力就大于大气压了.而在用排水法时还是要量筒内液面与水槽内液面相平,所以烧瓶内的液体的体积就可以看成是与生成气体体积同样性质的东西.必须用110 mL减掉54ML才能得到生成气体的体积.而得到的56ML是在标准大气压下生成气体的体积.这个问题关键就在一句话“气密性良好”.
这好像是个竞赛题吧!1年前查看全部
- 初三化学计算题一批石灰石原料,其所含的杂质既不溶于水,也不溶于盐酸。高温时也部发生反应。为了测定该石灰石的纯度,某研究所
初三化学计算题
一批石灰石原料,其所含的杂质既不溶于水,也不溶于盐酸。高温时也部发生反应。为了测定该石灰石的纯度,某研究所学习小组取用4g这种石灰石样品。用实验室现有的稀盐酸40g分4次加入。每次充分反应后,经过滤、干燥等操作后称量剩余固体物质的质量。每次稀盐酸的用量见下表。(假如过滤、干燥等操作过程。固体物质不受损耗)
稀盐酸的用量 剩余固体的质量
第一次加入10g 3.0g
第二次加入10g 2.0g
第三次加入10g 1.0g
第四次加入10g 0.4g
1.该石灰石样品的纯度是多少?
2.如果煅烧上述石灰石原料生产出含有杂质的生石灰质量为100t,需要上述石灰石原料多少吨?(精确到0.1)
过程!!1 dushishen1年前3
dushishen1年前3 -
 fccool 共回答了10个问题
fccool 共回答了10个问题 |采纳率70%观察可知 前三次反应 盐酸均消耗完 碳酸钙过量
则最后剩余的不反应的即为杂质 杂质质量 0.4g
1.该石灰石样品的纯度是多少?
(4-0.4)/4*100% = 90%
2.如果煅烧上述石灰石原料生产出含有杂质的生石灰质量为100t,需要上述石灰石原料多少吨?(精确到0.1)
设需要上述石灰石原料质量为x
CaCO3 =高温= CaO + CO...1年前查看全部
- 某同学用溶质的质量分数为16%的硫酸溶液做了一个测定锌片纯度的实验(锌片中的杂质不与硫酸反应).已知硫酸溶液的密度是1.
某同学用溶质的质量分数为16%的硫酸溶液做了一个测定锌片纯度的实验(锌片中的杂质不与硫酸反应).已知硫酸溶液的密度是1.10g/立方厘米.氢气体积在相同条件下测定,氢气的密度为0.085g/L,试求锌片的纯度
编号--锌片质量/g---硫酸溶液体积/mL--生成氢气体积/L
1---------3.3-----------10-----------------0.42
2---------3.3-----------20-----------------0.84
3---------3.3-----------30-----------------1.08
4---------3.3-----------440----------------1.08
[呃..这个是"表格"
"----"只是为了让数都对着- -
具体的计算过程,] lukaijie1年前1
lukaijie1年前1 -
 XIXI777777 共回答了16个问题
XIXI777777 共回答了16个问题 |采纳率87.5%由于产生H2的质量为1.08L×0.085g/L=0.0918g
则Zn~H2
--65---2
--X----0.0918g
X=2.9835g
则其纯度为2.9835g/3.3g=90.41%1年前查看全部
- 某不纯的氯化铵样品,含氮的质量分数是百分之二十,求此氯化铵样品的纯度.
 QQ平步青云1年前1
QQ平步青云1年前1 -
 BTWANG 共回答了25个问题
BTWANG 共回答了25个问题 |采纳率80%随便带个数字进去..
比如说有样品100g
所以有氮元素质量为100*20%=20g
所以有NH4Cl质量为20/(14/53.5)=76.4g
所以样品纯度为76.4g/100g*100%=76.4%1年前查看全部
- (2012•大庆模拟)硝酸铵是农业生产中常用的化学肥料.为测定某含有少量NaNO3的硝酸铵样品中NH4NO3的纯度,取&
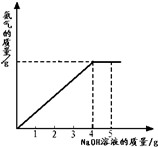 (2012•大庆模拟)硝酸铵是农业生产中常用的化学肥料.为测定某含有少量NaNO3的硝酸铵样品中NH4NO3的纯度,取 2.0g 该硝酸铵样品于容器中,滴入5.0g 20%的NaOH溶液.发生如下反应:NH4NO3+NaOH=NaNO3+NH3↑+H2O.反应过程中放出的氨气质量及加入的NaOH溶液的质量的关系如图所示:完成有关计算:
(2012•大庆模拟)硝酸铵是农业生产中常用的化学肥料.为测定某含有少量NaNO3的硝酸铵样品中NH4NO3的纯度,取 2.0g 该硝酸铵样品于容器中,滴入5.0g 20%的NaOH溶液.发生如下反应:NH4NO3+NaOH=NaNO3+NH3↑+H2O.反应过程中放出的氨气质量及加入的NaOH溶液的质量的关系如图所示:完成有关计算:
(1)样品中硝酸铵的质量分数;
(2)所得溶液中NaNO3的质量分数(保留两位小数). wwID不能取太长1年前1
wwID不能取太长1年前1 -
 纺织工人 共回答了20个问题
纺织工人 共回答了20个问题 |采纳率95%解题思路:(1)从图中可看出氢氧化钠溶液滴加到4克时硝酸铵恰好完全反应,根据参加反应的氢氧化钠的质量求出硝酸铵的质量,即可解答;
(2)根据参加反应的氢氧化钠的质量求出生成的硝酸钠的质量,用生成的硝酸钠的质量+原有的硝酸钠的质量为所得溶液中硝酸钠的质量;用样品的质量+所加氢氧化钠溶液的质量-氨气的质量(氨气的质量可根据氢氧化钠的质量求出)为所得溶液的质量;再根据溶质质量分数计算公式即可求出所得溶液中硝酸钠的质量分数.设2.0g样品中含NH4NO3的质量为ⅹ,反应生成 NaNO3的质量为 y,
反应生成的NH3的质量为z,则
NH4NO3 +NaOH=NaNO3 +NH3↑+H2O
80 40 85 17
ⅹ4g×20% yz
[80/x=
40
4g×20%],[40/4g×20%]=[85/y],[40/4g×20%=
17
z]
ⅹ=1.6g
y=1.7g
z=0.34g
(1)样品中NH4NO3的质量分数为:
1.6g
2g×100%=80%;
(2)反应后所得溶液中NaNO3的质量分数为:
1.7g+(2g−1.6g)
2g+5g−0.34g×100%=31.5%
答:(1)样品中NH4NO3的质量分数为80%;
(2)反应后所得溶液中NaNO3的质量分数为31.5%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 做本道题时要将4克氢氧化钠溶液和5克氢氧化钠溶液区分清,不能乱用,参加反应的氢氧化钠溶液的质量是4克,所加的氢氧化钠溶液的质量是5克.1年前查看全部
- 下列说法正确的是( )A.高纯度的二氧化硅被广泛用于制作计算机芯片B.粗硅可由二氧化硅还原制得C.高纯硅是制造光导纤维
下列说法正确的是( )
A.高纯度的二氧化硅被广泛用于制作计算机芯片
B.粗硅可由二氧化硅还原制得
C.高纯硅是制造光导纤维的原料
D.硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位约占地壳质量的90% 小小彬_1年前1
小小彬_1年前1 -
 木子日一 共回答了12个问题
木子日一 共回答了12个问题 |采纳率91.7%解题思路:A.计算机芯片的成分是硅单质;
B.用碳还原二氧化硅制得粗硅;
C.二氧化硅是光导纤维的成分;
D.硅在地壳中的含量在所有的元素中居第二位.A.计算机芯片的成分是硅单质,不是二氧化硅,故A错误;
B.高温下用碳还原二氧化硅制得粗硅,故B正确;
C.光导纤维成分是二氧化硅,故C错误;
D.硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第二位,故D错误.
故选B.点评:
本题考点: 硅和二氧化硅.
考点点评: 本题考查硅和二氧化硅的性质,难度不大,明确物质的成分是解题的关键.1年前查看全部
- 用含杂质的铁10g与50g稀硫酸完全反应后,滤去杂质,所得液体质量为55.4g,求此铁的纯度.
 我最恨我痴心1年前1
我最恨我痴心1年前1 -
 我爱都的看来过倒 共回答了13个问题
我爱都的看来过倒 共回答了13个问题 |采纳率69.2%分析:Fe+H2SO4=FeSO4+H2↑
56 2
由化学方程式可知,影响溶液质量变化的因素是参加反应的铁和生成的氢气.每有56份质量的铁参加反应“进入”溶液中的同时,则可生成2份质量的氢气从溶液中逸出,故溶液质量增加
56-2=54(份).由题目给的差量 55.4克-50克=5.4克,据此便可列比例求解.
设此铁的纯度为x.
Fe+H2SO4=FeSO4+H2↑
溶液质量增加(差量)
56 2 56-2=54
10x克 55.4克-50克= 5.4克
56∶54=10x克∶5.4克
答:此铁的纯度为56%.
请采纳回答1年前查看全部
- 一瓶久置的氢氧化钠固体已经发生了变质,某研究小组为了探究氢氧化钠的变质纯度,作出如下猜想:猜想一、可能部分变质,固体是N
一瓶久置的氢氧化钠固体已经发生了变质,某研究小组为了探究氢氧化钠的变质纯度,作出如下猜想:猜想一、可能部分变质,固体是NaOH和Na2CO3的混合物;猜想二、可能全部变质,固体是Na2CO3.
(1)首先对固体的成分进行确定.取少量固体于试管中,加水充分溶解,先加入足量的BaCl2溶液,产生白色沉淀,静置后取上层溶液,再加入CuSO4溶液,产生蓝色絮状沉淀.根据实验现象,可判断______是正确的.
(2)称取10.6克该固体样品于锥形瓶中,加入一定质量分数的稀盐酸,直至过量,得到数据如表:
计算该样品中Na2CO3的质量分数.样品质量 反应前总质量 反应后总质量 10.6克 148.5克 146.3克
(3)请你分析,一定质量的NaOH固体,变质前后与足量的稀盐酸反应,变质前生成NaCl的量______(填“大于”、“等于”、或“小于”)变质后生成NaCl的量. 青岛芝麻饼1年前1
青岛芝麻饼1年前1 -
 枝头小麻雀 共回答了17个问题
枝头小麻雀 共回答了17个问题 |采纳率76.5%解题思路:(1)加入足量的BaCl2溶液,产生白色沉淀,该白色沉淀是BaCO3,说明该固体成分中含有CO32-;再加入CuSO4溶液,产生蓝色絮状沉淀,该蓝色絮状沉淀是Cu(OH)2,说明该固体成分中含有OH-;
(2)根据质量守恒定律可以知道反应前后减少的质量为生成的二氧化碳的质量;根据生成的二氧化碳的质量结合反应的化学方程式可以求算出碳酸钠的质量,并求算出碳酸钠的质量分数;
(3)根据化学变化前后元素的质量不变,氢氧化钠变质生成碳酸钠时物质的质量增加,但其中所含钠元素的质量不变,所以一定质量的NaOH固体,变质前后与足量的稀盐酸反应,变质前、后生成NaCl的质量是相等的.(1)根据题意知,该固体溶液中含有CO32-和OH-,所以这瓶久置的氢氧化钠固体是NaOH和Na2CO3的混合物.
故填:猜想一;
(2)根据质量守恒定律可以知道反应前后减少的质量为生成的二氧化碳的质量,其质量为:148.5g-146.3g=2.2g;
B、设样品中碳酸钠的质量为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
10644
x 2.2g
[106/x]=[44/2.2g]
解得:x=5.3g
该样品中Na2CO3的质量分数为[5.3g/10.6g]×100%=50%
答:该样品中Na2CO3的质量分数为50%;
(3)变质前后钠元素质量不变,所以一定质量的NaOH固体,变质前后与足量的稀盐酸反应,变质前生成NaCl的量 等于(填“大于”、“等于”、或“小于”)变质后生成NaCl的量.
故填:等于.点评:
本题考点: 药品是否变质的探究;碱的化学性质;根据化学反应方程式的计算.
考点点评: 要想解答类似于(2)题的题目,首先,要理解和熟记根据化学反应方程式的计算步骤和格式,以及与之相关的知识等.然后,根据所给的问题情景,结合所学的相关知识和技能,细致地分析题意并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.1年前查看全部
- 物质的量浓度问题为测定苛性钾(KOH)的纯度,取样品0.5600 g溶于水配制成1 L溶液,取此溶液25.00mL,用去
物质的量浓度问题
为测定苛性钾(KOH)的纯度,取样品0.5600 g溶于水配制成1 L溶液,取此溶液25.00mL,用去0.0050mol/L H2SO4溶液24.00mL,恰好反应完全,则苛性钾的纯度为(杂质不与酸反应)多少? wywyzx2221年前1
wywyzx2221年前1 -
 qiniade 共回答了19个问题
qiniade 共回答了19个问题 |采纳率89.5%设纯度为X
2KOH + H2SO4 == K2SO4 + 2H2O
112g 1mol
0.56X*25/1000 0.005*0.024
X=0.96=96%1年前查看全部
- 关于钾肥含量的计算钾肥通常用K20的质量分数来表示肥效,某纯度90%的氯化钾肥料相当于含K20____%? (杂质不含钾
关于钾肥含量的计算
钾肥通常用K20的质量分数来表示肥效,某纯度90%的氯化钾肥料相当于含K20____%? (杂质不含钾)
可以有过程也可以没过程要个答案,答案对者秒分
不是31.9% 飘香剑雨1年前2
飘香剑雨1年前2 -
 太阳太阳 共回答了30个问题
太阳太阳 共回答了30个问题 |采纳率86.7%39/(39+35.5)=52.3%
52.3%*90%=47.1%1年前查看全部
- 画色彩时的明暗是通过明度变化还是纯度变化,还是通过色相的变化?
画色彩时的明暗是通过明度变化还是纯度变化,还是通过色相的变化?
在画明暗交界线时是通过加黑色(就是普兰和熟褐)来降低色彩的明度和饱和度还是通过不同颜色的明度来表现?好像都有……怎么控制呢?水粉总是画不好 我爱大飞1年前1
我爱大飞1年前1 -
 迅娇 共回答了19个问题
迅娇 共回答了19个问题 |采纳率89.5%这个要看你整幅画的冷暖和明度来把握,不要刻意去记住这些概念,用心去感受,大胆的用色1年前查看全部
- (2014•巴中模拟)如图是某尿素[CO(NH2)2]肥料包装袋上的说明,此尿素肥料的纯度是( )
(2014•巴中模拟)如图是某尿素[CO(NH2)2]肥料包装袋上的说明,此尿素肥料的纯度是( )

A.≥46.3%
B.≥46.7%
C.≥60%
D.≥99.2% ynmaqiyang1年前1
ynmaqiyang1年前1 -
 zl525525 共回答了17个问题
zl525525 共回答了17个问题 |采纳率94.1%解题思路:尿素中氮元素的质量分数=[氮的相对原子质量×氮原子个数/尿素的相对分子质量]×100%,化肥的纯度可理解为:[化肥中氮元素的质量分数/尿素中氮元素的质量分数]×100%,根据此公式进行分析解答.尿素[CO(NH2)2]的相对质量为:12+16+(14+1×2)×2=60;
尿素中氮元素的质量分数=[14×2/60]×100%≈46.7%;
该化肥的纯度≥[46.3%/46.7%]≈99.2%.
故选:D.点评:
本题考点: 元素的质量分数计算.
考点点评: 本题难度较大,考查同学们结合新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.1年前查看全部
- 甲肝抗体是在人体体液免疫的最后阶段由浆细胞产生的.与常规抗体相比,单克隆抗体有纯度高、特异性强等特点 哪句话有错?
 valen1791年前1
valen1791年前1 -
 douqing 共回答了16个问题
douqing 共回答了16个问题 |采纳率93.8%特异性免疫分感应、反应、效应三个阶段,抗体在反应阶段产生,不是最后阶段.另外不存在特异性强这一说法1年前查看全部
- 欲配制1000毫升3摩尔/升盐酸溶液需纯度为36.5%的浓盐酸多少毫升?
 fzmusic1年前4
fzmusic1年前4 -
 沙滩与大海 共回答了20个问题
沙滩与大海 共回答了20个问题 |采纳率85%3MOL HCL
纯度可换算为1 MOL/(100G)
故需浓盐酸 300G
36.5%的浓盐酸密度为1.19g/ml
故需252.1ml1年前查看全部
- 工业烧碱2克,制成250ml溶液,取50ml可与0.2mol/L硫酸20ml完全中和,求烧碱纯度?
 赵小片1年前1
赵小片1年前1 -
 樱木花道就是我 共回答了16个问题
樱木花道就是我 共回答了16个问题 |采纳率87.5%烧碱纯度=(((0.2*20/1000)*40)/(2*50/250))*100
=80%1年前查看全部
- 有一种石灰石样品,其中含有既不溶于水也不与盐酸反应的杂质二氧化硅.某同学为了测定该样品的纯度,他取了2g石灰石样品,将2
有一种石灰石样品,其中含有既不溶于水也不与盐酸反应的杂质二氧化硅.某同学为了测定该样品的纯度,他取了2g石灰石样品,将20g稀盐酸分四次加入,实验中得到的数据记录如下:
(1)该石灰石样品的纯度为多少?稀盐酸用量 剩余固体质量 第一次加入5g 1.315g 第二次加入5g 0.63g 第三次加入5g 0.3g 第四次加入5g 0.3g
(2)20kg这种石灰石与足量的盐酸反应,可以生产多少千克CO2? 小涟漪1年前1
小涟漪1年前1 -
 jjkan 共回答了29个问题
jjkan 共回答了29个问题 |采纳率86.2%解题思路:(1)由于样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶解于水,因此由表中每次加入5g稀盐酸固体减少的质量关系可判断:每加入5g稀盐酸固体应减少0.685g;据此规律,由第四次加入盐酸后固体质量的减少值小于0.685g可判断此次反应后碳酸钙已完全反应;利用样品杂质的质量,由此求出石灰石样品中碳酸钙的质量分数;
(2)根据化学方程式计算,根据碳酸钙的质量就可求出生成的二氧化碳的质量.(1)根据表中的实验数据可得,每加入5g稀盐酸,固体质量减少0.685g,第三次加入稀盐酸后,固体减少的质量=0.63g-0.3g=0.33g,小于0.685g,即此时碳酸钙已完全反应;所以剩余的0.3g固体即为杂质的质量,石灰石样品中碳酸钙的质量分数=[2g−0.3g/2g]×100%=85%
(2)设20Kg石灰石样品与足量稀盐酸反应生成CO2的质量为x,碳酸钙的质量为20Kg×85%=17Kg
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 44
17Kgx
[100/44=
17Kg
x]
x=7.48Kg
答案:
(1)该石灰石样品的纯度为85%
(2)可以生产7.48千克CO2点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 根据图表中剩余固体的质量,分析每次加入相同稀盐酸所减少的质量即样品中被反应掉碳酸钙的质量,判断出第四次加稀盐酸后碳酸钙完全反应,此为本题的突破口.1年前查看全部
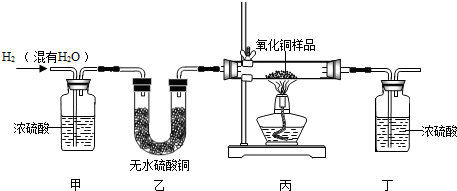
- 用氢气还原氧化铜的方法测定某氧化铜样品的纯度(杂质不与氢气反应),同学们设计了以下实验装置,准确称取15克干燥样品进行实
用氢气还原氧化铜的方法测定某氧化铜样品的纯度(杂质不与氢气反应),同学们设计了以下实验装置,准确称取15克干燥样品进行实验.
【查阅资料】①无水硫酸铜为白色固体,遇水变成蓝色。
②浓硫酸具有吸水性,可做干燥剂。
请根据资料回答:
(1)在实验中,乙装置的作用是 .
(2)准确称取完全反应前后装置丙和丁的质量如表:
小丽想根据装置丁的质量变化进行计算,请帮小丽求出氧化铜样品的纯度(写出计算过程).装置丙 装置丁 反应前 48.8克 161.2克 反应后 46.5克 163.9克
(3)小明根据装置丙的质量变化计算,发现小丽结果偏大。请分析导致这一结果的原因可能是 .
A.装置的气密性不好 B.空气中的水分被丁处浓硫酸吸收
C.通入的氢气量不足 D.氧化铜没有完全被还原 qrambk1年前1
qrambk1年前1 -
 小添2000 共回答了24个问题
小添2000 共回答了24个问题 |采纳率95.8%(1)检验氢气中水分是否全部被吸收 (2)80% (3) B
1年前查看全部
- 为测定石灰石中碳酸钙的纯度,取一定质量的石灰石(杂质不溶于水,也不与酸反应)高温煅烧一段时间后得78g固体向其中加入40
为测定石灰石中碳酸钙的纯度,取一定质量的石灰石(杂质不溶于水,也不与酸反应)高温煅烧一段时间后得78g固体向其中加入400g质量分数为14.6%的稀盐酸充分反应后发现固体质量不再减少,过滤得一定质量的中性溶液和20g不溶物(滤渣),则原石灰石样品中碳酸钙的纯度为( )
A. 50%
B. 75%
C. 80%
D. 90% 闹静静1年前1
闹静静1年前1 -
 生命痕迹 共回答了14个问题
生命痕迹 共回答了14个问题 |采纳率100%解题思路:石灰石高温锻烧,碳酸钙分解生成氧化钙和二氧化碳,锻烧后固体与盐酸反应,碳酸钙与盐酸反应生成氯化钙、水、二氧化碳而氧化钙与盐酸生成氯化钙和水,且反应后溶液呈中性,说明恰好完全反应,因此,反应后所得溶液一定是氯化钙,其中钙元素质量即石灰石中碳酸钙中钙元素的质量、氯元素质量即所加盐酸中氯元素质量;利用氯化钙中氯元素与钙元素质量关系,可由盐酸中所含氯元素质量求得碳酸钙中钙元素质量,进而计算出碳酸钙的质量,最终根据题意完成原石灰石样品中碳酸钙的纯度的计算.400g质量分数为14.6%的稀盐酸中所含氯元素质量=400g×14.6%×[35.5/36.5]×100%=56.8g
氯化钙中钙元素与氯元素质量比=40:(35.5×2)=40:71,则氯化钙中氯元素质量为56.8g时钙元素质量=[56.8g/71×40=32g
石灰石中碳酸钙的质量=32g÷
40
100]×100%=80g
原石灰石样品中碳酸钙的纯度=[80g/80g+20g]×100%=80%
故选C.点评:
本题考点: 根据化学反应方程式的计算;含杂质物质的化学反应的有关计算.
考点点评: 根据化学变化前后元素质量不变,通过氯化钙中氯元素与钙元素质量关系,建立盐酸与碳酸钙的质量关系,这是解答本题的技巧所在.1年前查看全部
- 现有200t含氧化铁80%的赤铁矿,则用这批原料进行炼铁,可以练出纯度为97%的生铁多少
 y2kksam1年前1
y2kksam1年前1 -
 aileen_cn2004 共回答了14个问题
aileen_cn2004 共回答了14个问题 |采纳率92.9%3CO+ Fe2O3 =高温= 2Fe + 3CO2
160 112
200*80% 97%x
160:112=200*80%:97%x
10:7=160:97%x
97%x=112
x=115.51年前查看全部
- 取12.5g含杂质的石灰石,加到100g稀盐酸中恰好完全反应,过滤得滤液105.6g,则该石灰石的纯度为
 天下第一5211年前2
天下第一5211年前2 -
 ze123456 共回答了14个问题
ze123456 共回答了14个问题 |采纳率100%百分之八十
溶液中增加的质量其实是CaO的质量 因为碳酸钙和盐酸反应 二氧化碳挥发 真正留下来的是氧化钙
105.6-100=5.6 也就是说氧化钙5.6g 也就是0.1mol
所以碳酸钙有0.1mol 也就是10g
10/12.5=80%1年前查看全部
- 如何检验氢气的纯度?
 yzg56181年前1
yzg56181年前1 -
 了了L 共回答了22个问题
了了L 共回答了22个问题 |采纳率81.8%用大拇指捂住小试管.
点燃酒精灯,试管移近火焰,试管口对着燃着的酒精灯火焰,移开拇指点火.
如听到尖锐的爆鸣声,说明氢气不纯.
如爆鸣声轻而沉闷,说明试管内收集的氢气纯净.1年前查看全部
- 30克二氧化氯溶解在8千克水中,浓度是多少PPM?二氧化氯纯度在95%左右.
30克二氧化氯溶解在8千克水中,浓度是多少PPM?二氧化氯纯度在95%左右.
30克二氧化氯溶解在8千克水中,浓度是多少PPM? mayufeng91年前2
mayufeng91年前2 -
 小童1960 共回答了15个问题
小童1960 共回答了15个问题 |采纳率86.7%二氧化氯是中性分子,在水中几乎以分子状态存在,水溶液中的亚氯酸和氯酸仅占溶质的2%.如果按此计算,溶质中二氧化氯为:30g*98%=29.4g,则溶液浓度为(29.4g/30g+8000g)*1000000=3661.27ppm.1年前查看全部
- 已知测得50克石灰水样品中含钙元素10克,求石灰水的纯度?
 Jolly1年前3
Jolly1年前3 -
 我爱何剑峰 共回答了14个问题
我爱何剑峰 共回答了14个问题 |采纳率85.7%石灰水的纯度:10*(74/40)/50=0.37=37%1年前查看全部
- 用间接碘量法测定BaCl2的纯度时,先将Ba2+沉淀为Ba(IO3)2,洗涤后溶解并酸化,加入过量的KI,然后用Na2S
用间接碘量法测定BaCl2的纯度时,先将Ba2+沉淀为Ba(IO3)2,洗涤后溶解并酸化,加入过量的KI,然后用Na2S2O3标准溶液滴定,则BaCl2与Na2S2O3的计量关系是( ).
 liouwevj1年前2
liouwevj1年前2 -
 cdsingaler 共回答了20个问题
cdsingaler 共回答了20个问题 |采纳率80%假设酸化用的是H2SO4
Ba(IO3)2+10KI+6H2SO4=BaSO4+6I2+5K2SO4+6H2O
2Na2S2O3+I2=Na2S4O6+2NaI
BaCl2与Na2S2O3的计量关系是
BaCl2---Ba(IO3)2-----6I2-----12Na2S2O31年前查看全部
- %95纯度的乙醇想要调成%75,该怎么调?
%95纯度的乙醇想要调成%75,该怎么调?
想要改变乙醇纯度的公式是什么. why618548211年前1
why618548211年前1 -
 弓虽oo石硬 共回答了20个问题
弓虽oo石硬 共回答了20个问题 |采纳率75%必须先知道95%乙醇质量设为x.设稀释的乙醇质量为y.95%x=75%y.y=95%x除以75%.y-x的得数是稀释乙醇的水的质量.1年前查看全部
- 亲们~走过路过 来瞧瞧~有400t含Fe2O3 80%的赤铁矿石,最多可炼成纯度97%的生铁多少吨?
 小白紫狼1年前3
小白紫狼1年前3 -
 cocogxj 共回答了23个问题
cocogxj 共回答了23个问题 |采纳率95.7%400t*80%=320t
3CO+ Fe2O3 =高温= 2Fe + 3CO2
160 112
320t x*97%
160/320t=112/(x*97%)
x=230.9t
可以炼得纯度97%的生铁230.9吨1年前查看全部
- 紧急,桔水重力纯度呢?
 wohada1年前1
wohada1年前1 -
 骑着月亮去爱你 共回答了18个问题
骑着月亮去爱你 共回答了18个问题 |采纳率83.3%糖液固体含量/锤度;
糖液转光度/锤度.1年前查看全部
大家在问
- 1急需一份一个17岁女孩子以自己介绍为主题的英文文章
- 2我和朋友的故事我的好朋友叫吴左富,是我的至交好友.请大家帮帮忙帮我写一篇作文.最晚不要超过10点
- 3扩句:蜜蜂采蜜.
- 4证明limn趋向于无穷时(sin根号n-sin根号下(n+1) ) =0 求详细步骤
- 5I want to go to the cinema after school.(同义句)
- 6求函数f(x)=lnx+2x-6的零点个数. 直接画图、两个函数求图象交点个数、利用函数单调性判断等三种方法
- 7关于游西湖的英语作文(现在完成时)100词左右
- 8初中数学一道关于销售利润问题的题目,求解答谢谢。
- 9下列说法正确的是( )A.Na和Na+都属于同种元素,所以化学性质相似B.化学式为AB型的离子化合物中,阴阳离子所带电
- 10十进制转八进制的小数问题将十进制数193.12转换成八进制数.整数部分就不需要讲了,我知道了.关键是小数部分我不会.请把
- 11高二中译英4句1他过去沉迷于玩电脑游戏 obsessior2经理尽量做到人尽其才 fit3看电视新闻是了解时事的绝好途径
- 12下列关于电视信号发射的说法中,正确的是( ) A.电视只传递图象信号 B.电视信号靠电磁波传递图象、声音 C.电视信号
- 132013年3月1日13:44柳州市柳南区地震了吗?
- 14设点P是曲线y=2x 2 上的一个动点,曲线y=2x 2 在点P处的切线为l,过点P且与直线l垂直的直线与曲线y=2x
- 15执行总裁应该怎么翻译 CEO 还是 Executive President 两者的区别是什么
